A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
المسلسل كتلة الوجه المسح المجهري الإلكترون (SBEM) لدراسة العمود الفقري Dendritic
In This Article
Summary
يتم تطبيق المجهر الإلكتروني التسلسلي لمسح الوجه الكتلي (SBEM) على صورة وتحليل العمود الفقري التشجر في قرن آمون مورين.
Abstract
المجهر الإلكتروني ثلاثي الأبعاد (3D EM) يعطي إمكانية لتحليل المعلمات المورفولوجية للعمود الفقري التشجر مع دقة النانو. بالإضافة إلى ذلك ، يمكن ملاحظة بعض ميزات العمود الفقري التشجر ، مثل حجم العمود الفقري وكثافة ما بعد متشابك (PSD) (تمثل جزءا ما بعد متشابك من المشبك) ، ووجود محطة presynaptic ، وشبكية endoplasmic السلس أو شكل غير نمطي من PSD (على سبيل المثال ، العمود الفقري متعددة الداخلية) ، إلا مع 3D EM. باستخدام المجهر الإلكتروني التسلسلي لمسح الوجه الكتلي (SBEM) ، من الممكن الحصول على بيانات EM ثلاثية الأبعاد بشكل أسهل وبطريقة أكثر قابلية للاستنساخ مما كانت عليه عند إجراء القسم التسلسلي التقليدي. هنا نعرض كيفية إعداد عينات فرس النهر الماوس لتحليل SBEM وكيف يمكن الجمع بين هذا البروتوكول مع دراسة immunofluorescence من العمود الفقري التشجر. يسمح لنا التشوه التثبيتي المعتدل بإجراء دراسات الفلورة المناعية باستخدام المجهر الخفيف على نصف الدماغ ، في حين تم إعداد النصف الآخر ل SBEM. هذا النهج يقلل من عدد الحيوانات التي ستستخدم للدراسة.
Introduction
وتقع معظم نقاط الاشتباك العصبي مثير في الجهاز العصبي المركزي على العمود الفقري التشجر - نتوءات صغيرة من غشاء الخلايا العصبية. تشكل هذه النتوءات مقصورات بيوكيميائية محصورة تتحكم في نقل الإشارات داخل الخلايا. ترتبط اللدونة الهيكلية للعمود الفقري المتشجر ونقاط الاشتباك العصبي ارتباطا وثيقا بالتغيرات الوظيفية في الفعالية المتشابكة التي تكمن وراء عمليات مهمة مثل التعلم والذاكرة1و2. من المهم ملاحظة أن المجهر الإلكتروني (EM) هو التقنية الوحيدة التي تسمح بتحديد ما إذا كان العمود الفقري التشجر لديه مدخل ما قبل الاشتباك العصبي. هناك حاجة أيضا إلى دقة EM لدراسة التفاصيل الهيكلية الفائقة مثل شكل كثافة ما بعد المتشابك (PSD) ، والتي تمثل جزءا من متشابكة من المشبك ، أو أبعاد العمود الفقري المتشعب ، وكذلك حجم وشكل بوتون أكسنال. بالإضافة إلى ذلك، مع EM فمن الممكن تصور نقاط الاشتباك العصبي والمناطق المحيطة بها.
بفضل التقدم في تقنيات التصوير والحوسبة ، من الممكن إعادة بناء دوائر عصبية بأكملها. تقنيات المجهر الإلكتروني حجم, مثل المقطع التسلسلي انتقال المجهر الإلكتروني (ssTEM), المسلسل كتلة الوجه المسح المجهري الإلكتروني (SBEM), وركزت شعاع أيون المسح المجهري الإلكتروني (FIB-SEM) وتستخدم عادة لإعادة بناء الدائرة العصبية3.
في دراساتنا، يتم استخدام طريقة SBEM بنجاح للتحقيق في اللدونة الهيكلية للعمود الفقري التشجر وPSDs في عينات من قرن آمون الماوس وشرائح الدماغ organotypic 4،5. ويستند SBEM على تركيب ميكروميكروم مصغرة داخل غرفة المجهر الإلكتروني المسحالضوئي 6،7،8،9. يتم تصوير الجزء العلوي من كتلة العينة ، ثم يتم قطع العينة على عمق محدد بواسطة ultramicrotome ، مما يكشف عن وجه كتلة جديد ، والذي يتم تصويره مرة أخرى ثم يتم تكرار العملية8. ونتيجة لذلك، يتم ترك صورة وجه الكتلة فقط بينما يتم فقدان الشريحة التي تم قطعها كحطام. هذا هو السبب في أن SBEM يسمى تقنية مدمرة ، مما يعني أنه من غير الممكن تصوير نفس المكان مرة أخرى. ومع ذلك ، فإن ميزة الأساليب المدمرة على الكتلة هي أنها لا تعاني من مشاكل تزييفها وفقدان القسم الذي يمكن أن يؤثر بشكل كبير على جودة البيانات وتحليل البيانات3. وعلاوة على ذلك، يعطي SBEM إمكانية لتصوير مجال رؤية كبير نسبيا (> 0.5 ملم × 0.5 ملم) بدقة عالية3.
لتوظيف SBEM ، يجب إعداد العينات وفقا لبروتوكول مخصص ومتناقض للغاية بسبب كاشف الإلكترونات المكثرة المستخدمة للحصول على الصور. نعرض هنا كيفية إجراء إعداد العينة وفقا للبروتوكول استنادا إلى إجراء طورته Deerinck10 (المركز الوطني لبحوث المجهر والتصوير (NCMIR) الأسلوب)، وذلك باستخدام انخفاض osmium-thiocarbohydrazide-osmium (rOTO) البقع وضعت في 1980s8،11. بالإضافة إلى ذلك ، نقدم نهج تثبيت من خطوتين ، مع تغلغل تثبيت خفيف يسمح باستخدام نفس الدماغ لكل من دراسات الفلورة المناعية مع المجهر الخفيف وSBEM.
في البروتوكول يتم إصلاح دماغ الفأر في المقام الأول مع تثبيت معتدل ، ثم يقطع إلى نصفين ، ويتم تثبيت نصف الكرة الأرضية واحد وإعداده للفلورة المناعية (IF) ، في حين أن الآخر لدراسات EM(الشكل 1).
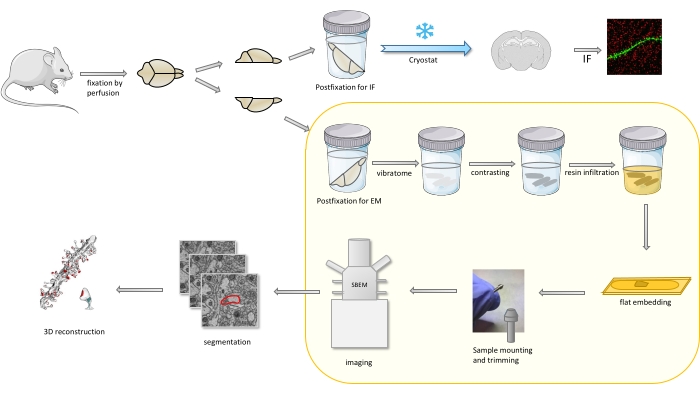
الشكل 1. تمثيل تخطيطي لسير العمل للعمود الفقري dendritic التحضير للتحليل مع SBEM. تم التضحية بالفئران وثقبها مع مثبت أولي خفيف. تم قطع الدماغ إلى أنصاف ، وتم تثبيت نصف الكرة الأرضية مع immunofluorescence (IF) المخصصة المثبتة ، cryoprotected ، شرائح باستخدام cryostat ومعالجتها لدراسات IF ، في حين تم postfixed نصف الكرة الآخر مع مثبت EM ، شرائح مع الهزاز وأعدت لدراسات EM. وتباينت شرائح الدماغ لدراسات SBEM، شقة جزءا لا يتجزأ من الراتنج، ثم تم تركيب منطقة CA1 من قرن آمون إلى دبوس، وصورت مع SBEM (الشكل 1). وظهر الجزء من البروتوكول الذي تم تسليط الضوء عليه في صندوق أصفر في الفيديو. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
تم إجراء البحث وفقا لإرشادات معهد نينكي وإذن اللجنة الأخلاقية المحلية. وقد أجريت الدراسات وفقا لتوجيه مجلس الجماعات الأوروبية الصادر في 24 تشرين الثاني/نوفمبر 1986 (86/609/EEC)، وقانون حماية الحيوان في بولندا، ووافقت عليه أول لجنة محلية للأخلاقيات في وارسو. وبذلت كل الجهود لتقليل عدد الحيوانات المستخدمة ومعاناتها.
تنبيه: يجب تنفيذ جميع الإجراءات الموضحة أدناه في غطاء أبخرة المختبر. نظرا للطبيعة الخطرة للكواشف المستخدمة. مطلوب تدابير السلامة الشخصية مثل القفازات، معطف المختبر، نظارات السلامة وقناع الوجه.
1. إعداد المثبت للتشويش (2٪ wt/vol بارافورمالديهايد (PFA) و0.5٪ فول / فول غلوتارالدهيد (GA) في 0.1 M الفوسفات العازلة (PB)، PH 7.4)
ملاحظة: تحضير الحل المثبت في نفس اليوم كما سيتم استخدامه ولا تخزينه أطول من لمدة 3 ساعات. في حالة نقص الوقت، قم بإعداد 2٪ PFA في 0.1 M PB في اليوم السابق، وتخزينه عند 4 درجة مئوية وإضافة GA جديدة قبل وقت قصير من التشوه.
- خذ 400 مل من الماء المقطر المزدوج المعقم (ddH2O) وسخنيه إلى 60 درجة مئوية باستخدام لوحة ساخنة مثيرة. ثم أضف 20 غرام من PFA. إضافة قطرات من 1 M NaOH حتى يذوب تماما PFA والسماح للخليط لتهدئة.
- أضف 500 مل من 0.2 م PB (pH 7.4).
- تصفية الحل لإزالة أي إيداع وتبريده إلى 4 درجة مئوية.
- قبل التغلغل، أضف 20 مل من 25٪ GA إلى الحل ثم قم بزيادة مستوى الصوت مع ddH2O إلى 1 L.
2. إعداد مثبت ما بعد التخبط لSBEM (2٪ wt/vol PFA و 2.5٪ vol/vol GA في 0.1 M PB، pH 7.4)
- خذ 50 مل من المثبت للتشويش (2٪ PFA و 0.5٪ GA في 0.1 M PB).
- إضافة 5 مل من 25٪ الجمعية العامة.
3. إعداد مثبت ما بعد التخبط لتلطيخ IF (4٪ PFA في المالحة العازلة الفوسفات (PBS))
- حل قرص من 1x PBS (درجة الحموضة 7.4) في المياه النقية والايونات (H2O) وفقا لتعليمات الشركة المصنعة.
- استخدام لوحة ساخنة اثارة لتسخين الحل إلى 60 درجة مئوية وإضافة 40 غرام من PFA.
- إضافة قطرات من 1 M NaOH حتى يذوب تماما PFA والسماح للخليط لتبرد.
- ضبط درجة الحموضة للحل إلى 7.5 مع 1 M HCl ثم أعلى مستوى الصوت مع H2O إلى 1 L.
- تصفية الحل لإزالة أي ودائع.
4. التغلغل عبر القلب من الحيوانات
ملاحظة: يجب جمع جميع نفايات PFA وGA وتخزينها للتخلص منها وفقا للوائح المحلية. يجب أن يتبع التخدير والتشويش اللوائح المحلية. في البروتوكول الموصوف الكبار 3 أشهر من العمر و 20±1 شهرا أنثى Thy1-GFP(M) الفئران (Thy1-GFP +/-)12 التعبير عن البروتين الفلوري الأخضر (GFP) في عدد قليل من الخلايا العصبية glutamatergic استخدمت ولكن أي أخرى يمكن استخدامها أيضا. تم تربية الحيوانات كهيدروزيغوت مع خلفية C57BL/6J في بيت الحيوان في معهد نينكي للبيولوجيا التجريبية.
- قبل التخدير التغلغل الماوس عن طريق إدارة خليط الكيتامين / xylazine (تصل إلى 90 ملغ / كغ من وزن الجسم الكيتامين و 10 ملغ / كجم وزن الجسم xylazine) عن طريق الحقن داخل الصفاق (إبرة قياس 27).
- تقييم ما إذا كان عمق التخدير كافية عن طريق التحقق من رد الفعل على محفزات الألم (معسر) ومنعكس القرنية (التحديق).
- بعد 20 دقيقة إجراء حقن داخل الصفاق (إبرة قياس 27) من بنتوباربيتال الصوديوم (50 ملغ / كجم وزن الجسم).
- Perfuse الماوس وفقا لبروتوكول جراحة التشويش التي وصفها غيج وآخرون13 (انظر النقطة 4; الشكل 5-6- الأرقام 5-6- الأرقام 5-6 باستخدام مضخة perfusion تبدأ مع 0.1 M الفوسفات العازلة، pH 7.4 (30 مل) لمدة 3 دقائق وتستمر مع 2٪ PFA و 0.5٪ الجمعية العامة في 0.1 M PB، PH 7.4 لمدة 6 دقائق (80 مل).
- تشريح بلطف الدماغ من الجمجمة وتقسيمه إلى نصفين (انظر الشكل 9-10 في غيج وآخرون. ضع قطعة واحدة في قارورة تحتوي على مثبت لSBEM والثانية في القارورة مع 4٪ PFA / PBS لتلطيخ IF.
- الحفاظ على نصفي الكرة الأرضية في التثبيت في 4 درجة مئوية بين عشية وضحاها.
5. إعداد شرائح الدماغ للفحص المجهري الإلكتروني
- اختر إعدادات الهزاز (سرعة سفر النصل: 0.075 مم/ثانية، تردد القطع: 80 هرتز).
- ضع غرفة الشريحة في الحامل، وأرفقها بالهزاز وأحاطها بالثلج. ثم ضع شفرة حلاقة في حامل شفرة الهزاز.
- استخدام ملعقة، أو كائن مماثل ووضع الدماغ المبرد (سطح الظهرية حتى) على سطح قطع صعبة (على سبيل المثال، غطاء طبق بيتري الزجاج). لإعداد شريحة تاجية من قرن آمون جعل قطع عمودي بين نصف الكرة الدماغي والمخيخ مع شفرة حلاقة أو مشرط، وبالتالي إزالة المخيخ. ويمكن أيضا إزالة لمبة الشم.
- تطبيق الغراء سيانواكريلات على منصة جافة من الهزاز.
- التقاط الدماغ مع ملقط وتجفيفها بعناية على ورقة التصفية.
- الغراء نصف الكرة الأرضية إلى منصة قريبة من شفرة القطع مع طرف rostral صعودا. إرفاق المنصة إلى حامل وملء فورا مع الجليد الباردة 0.1 M PB، الرقم القياسي 7.4. إذا تم إجراء القطع المتعامد بشكل صحيح ، فإن نصف الكرة الأرضية سيقف مستقيما لتوفير زاوية 90 درجة المطلوبة لإجراء قطع إكليلي متماثل يحتوي على قرن آمون. تأكد من أن الدماغ مغطى ب PB.
- ضع شفرة الهزاز أمام نصف الكرة الأرضية وأخفضها إلى الجانب التاجي من نصف الكرة الأرضية. خفض النصل إلى 400 ميكرومتر أخرى في الاتجاه caudal والبدء في تشريح. استمر في التقطيع حتى يتم فصل أول شريحتين تماما عن كتلة الأنسجة.
- تراجع عن النصل وخفض آخر 100 ميكرومتر، ثم شريحة مرة أخرى.
- عندما يصبح قرن آمون مرئية (استخدام أطلس الدماغ الماوس Paxinos وفرانكلين, 200414) جمع شرائح مع فرشاة الطلاء الصغيرة أو ماصة باستور البلاستيك الموسعة.
- نقل شرائح إلى لوحة 12 جيدا مليئة الباردة 0.1 M PB, pH 7.4.
- تشريح قرن آمون في طبق بيتري الزجاج مليئة 0.1 M PB, pH 7.4 باستخدام شفرة حلاقة أو مشرط, ووضعها في قوارير زجاجية مع نفس العازلة الفوسفات.
ملاحظة: لتخزين طويل الأجل من شرائح تكملة 0.1 M PB مع 0.05٪ azide الصوديوم (NaN3).
6. إعداد عينة الدماغ لاحتواء المناعة
- بعد التثبيت بين عشية وضحاها في 4٪ PFA / PBS الحل في غطاء الدخان، ووضع أنسجة الدماغ في حل التبريد (30٪ السكروز في برنامج تلفزيوني مع 0.05٪ NaN3)والاحتفاظ بها في 4 درجة مئوية لمدة 2 أيام (حتى غرقت).
- إعداد حل مضاد للتجمد (15٪ السكروز / 30٪ جلايكول الإيثيلين/ 0.05٪ NaN3/ PBS).
- تعيين درجة حرارة مجلس الوزراء من cryostat في -19 درجة مئوية وتأكد من أن يتم الوصول إلى درجة الحرارة قبل المضي قدما. أثناء تقسيم، تأكد من أن درجة حرارة مجلس الوزراء لا تزال بين -18 °C و -20 °C.
- استخدام ملعقة، أو كائن مماثل ووضع الدماغ المبرد (سطح الظهرية حتى) على سطح قطع صعبة (على سبيل المثال، غطاء طبق بيتري الزجاج). لإعداد شريحة تاجية من قرن آمون جعل قطع عمودي بين نصف الكرة الدماغي والمخيخ مع شفرة حلاقة أو مشرط، وبالتالي إزالة المخيخ.
- حدد قرص عينة المبردة مسبقا، وتغطيتها مع وسيلة للتجميد على الرف تحرير واستخدام ملقط إصلاح نصف الكرة الأرضية إلى القرص مع طرف وردي صعودا والانتظار حتى يتم تجميد العينة تماما. أدخل قرص العينة في رأس عينة.
- تثبيت شفرة في حامل شفرة داخل غرفة التبريد وقطع شرائح سميكة 40 ميكرومتر.
- نقل شرائح مع فرشاة طلاء صغيرة إلى لوحة 96 جيدا مليئة الباردة المضادة للتجميد الحل وفك بلطف المقاطع (جمع شريحة بعد كل جولة من تشريح لمنعهم من الضياع في غرفة شريحة).
ملاحظة: يمكن تخزين العقول أو المقاطع في محلول مضاد للتجمد عند -20 درجة مئوية لفترة طويلة.
7. الاحتواء المناعي لشرائح الدماغ
ملاحظة: تم تنفيذ جميع خطوات تلطيخ في لوحة 24 جيدا على شاكر منصة.
- غسل شرائح مع برنامج تلفزيوني ثلاث مرات، في كل مرة لمدة 6 دقائق.
- احتضان شرائح في 300 ميكرولتر من حل حجب (5٪ مصل الحمير العادي (NDS)/0.3٪ تريتون X-100) لمدة 1 ساعة مع اهتزاز لطيف على الدوار.
- احتضان شرائح مع الأجسام المضادة الأولية ضد PSD-95 المخفف 1:500 في 5٪ NDS/0.3٪ تريتون X-100/PBS (300 ميكرولتر لكل بئر) بين عشية وضحاها في 4 درجة مئوية. التركيز النهائي للأجسام المضادة الأولية هو 2 ميكروغرام / مل.
- غسل شرائح مع 0.3٪ تريتون X-100/PBS في درجة حرارة الغرفة (RT) ثلاث مرات، في كل مرة لمدة 6 دقائق.
- شرائح الحضانة مع الأجسام المضادة الثانوية المخفف 1:500 في 300 ميكرولتر من 0.3٪ تريتون X-100/PBS لمدة 90 دقيقة. التركيز النهائي للأجسام المضادة الثانوية هو 4 ميكروغرام / مل.
- غسل شرائح مع برنامج تلفزيوني ثلاث مرات، في كل مرة لمدة 6 دقائق.
- قم بتحميل الشرائح على الشرائح باستخدام وسيطة تركيب ثم أغلقها بشريحة غطاء.
- فحص العينات باستخدام المجهر confocal (63 × هدف النفط، NA 1.4، حجم بكسل 0.13 ميكرومتر × 0.13 ميكرومتر).
ملاحظة: للتخزين طويل الأجل: احتفظ بالعينات عند درجة حرارة 4 درجات مئوية، واحمها من الضوء.
8. إعداد عينة SBEM
تنبيه: نظرا للطبيعة الخطرة للكواشف المستخدمة يجب أن تنفذ جميع الإجراءات المذكورة أدناه في غطاء الدخان المختبري. قبل استخدام هذه المواد الكيميائية قراءة بعناية أوراق بيانات سلامة المواد التي تقدمها الشركات المصنعة ونسأل موظف السلامة حول القواعد المحلية لضمان المناولة الآمنة والتخلص من النفايات.
- عينة متناقضة
ملاحظة: يجب إجراء عمليات غسل الشرائح واحتضان درجة حرارة الغرفة مع اهتزاز خفيف (على سبيل المثال ، على منصة شاكر). تم استخدام المياه مزيل الغاز الأوتوكلاف.- غسل شرائح مع الباردة 0.1 M PB, pH 7.4 خمس مرات, في كل مرة لمدة 3 دقائق.
- إعداد خليط 1:1 من 4٪ من تيتروكسيد الأوسميوم المائي و 3٪ فيروكيانيد البوتاسيوم (1:1 بواسطة vol). المنتج النهائي سوف تتحول البني. تزج العينات في هذا الخليط، ووضعها على الجليد، ومن هذه المرحلة فصاعدا من المهم لحمايتهم من الضوء. احتضانهم مع اهتزاز لطيف لمدة ساعة واحدة.
- وفي الوقت نفسه إعداد حل ثيوكاربوهيدرازايد (TCH). مزيج 10 مل من مزدوج المقطر H2O (ddH2O) و 0.1 غرام من TCH ووضعها في فرن تعيين في 60 درجة مئوية لمدة 1 ساعة. من المهم أن تدور الحل من وقت لآخر (على سبيل المثال، كل 10 دقائق). عندما تكون جاهزة، تبريده إلى درجة حرارة الغرفة.
- غسل شرائح مع DDH2O خمس مرات، في كل مرة لمدة 3 دقائق.
- تصفية حل TCH باستخدام مرشح حقنة 0.22 ميكرومتر وتزج العينة في حل تصفيتها. الشرائح ستتحول إلى اللون الأسود. احتضنهم لمدة 20 دقيقة في درجة حرارة الغرفة.
- غسل العينات مع DDH2O خمس مرات، في كل مرة لمدة 3 دقائق.
- احتضان العينات مع محلول مائي 2٪ من OsO4 لمدة 30 دقيقة في درجة حرارة الغرفة.
- غسل العينات مع DDH2O خمس مرات، في كل مرة لمدة 3 دقائق.
- ضع العينات في خلات أورانيل المائة المائة المصفاة واحتضنها عند درجة حرارة 4 درجات مئوية بين عشية وضحاها. استخدام 0.22 ميكرومتر مرشح حقنة للترشيح.
- إعداد محلول حمض الأسبارتيك L عن طريق خلط 0.4 غرام من حمض الأسبارتيك L و 80 مل من ddH2O، وضبط درجة الحموضة إلى 3.8 لتسهيل الذوبان، ومن ثم أعلى مع الماء إلى 100 مل.
- في اليوم التالي، تبدأ مع إعداد والتون الرئيسيaspartate 15. مزيج 0.066 غرام من نترات الرصاص مع 10 مل من محلول حمض الأسبارتيك L (نقطة 8.1.10) مسبقا إلى 60 درجة مئوية وضبط درجة الحموضة إلى 5.5 (تقاس عند 60 درجة مئوية) مع 1 M NaOH. أغلق القارورة مع أسبارتات الرصاص واتركها عند 60 درجة مئوية لمدة 30 دقيقة في حمام مائي. وينبغي أن يكون الحل واضحا. إذا تحول إلى غائم ، يجب التخلص منه ويحتاج إلى إعداد واحد جديد.
- في غضون ذلك، غسل العينات مع ddH degassed2O خمس مرات، في كل مرة لمدة 3 دقائق. ثم الاحتفاظ بها في الفرن تعيين في 60 درجة مئوية لمدة 30 دقيقة.
- تزج العينات في محلول الأسبارتات الرصاص الطازجة واحتضانها في الفرن تعيين في 60 درجة مئوية لمدة 20 دقيقة.
- غسل العينات مع دي دي ه2O degassed خمس مرات، في كل مرة لمدة 3 دقائق.
- التجفاف والتضمين الراتنج
- إعداد راتنج الايبوكسي. وزن المكونات (33.3 غرام من مكون A / M، 33.3 غرام من المكون B، و 1 غرام من المكون D) وخلط الراتنج جيدا (على سبيل المثال، يهز على شاكر دوارة في أنبوب 15 مل) لمدة 30 دقيقة على الأقل قبل إضافة 16 قطرات من المسرع DMP 30. يحرك المزيج مرة أخرى لمدة 10 دقائق أخرى.
ملاحظة: وزن المكونات تحت غطاء الدخان. هذا المبلغ من المكونات يعطي ما يقرب من 60 مل من الراتنج ما يكفي ل15 قنينة مع عينات. يمكنك إعداد أقل أو تخزين بقية الراتنج في حقنة في 4 درجة مئوية والاستفادة منه في اليوم التالي. تذكر أن تغلق طرف الحقنة. - إعداد قوارير مع مخففات متدرج من الإيثانول (30٪، 50٪، 70٪، 90٪، 100٪، 100٪ الإيثانول في الماء و 100٪ المجففة على منخل الجزيئية).
- مزيج الراتنج مع الإيثانول 100٪ في نسبة 1:1 للحصول على 50٪ الراتنج. امزجها جيدا.
- يجفف العينات لمدة 5 دقائق في كل تخفيف للإيثانول بدءا من 30٪ وتنتهي مع الإيثانول اللامائي 100٪ المجففة على الغربال الجزيئي. تذكر، يجب أن العينات لا تجف تماما.
- التسلل العينات الأولى في 50٪ الراتنج لمدة 30 دقيقة، وبعد ذلك في الراتنج 100٪ لمدة ساعة واحدة، ثم مرة أخرى في الراتنج 100٪ بين عشية وضحاها. تنفيذ جميع خطوات التسلل مع اهتزاز بطيء مستمر.
- في اليوم التالي، ضع العينات في راتنج طازج بنسبة 100٪ لمدة ساعة واحدة ثم قم بتضمينها بين أوراق تضمين الفلوروبوليمر. إزالة الشحوم قطعة من ورقة تضمين مع الإيثانول، وشقة تضمين العينات بين طبقتين منه، وذلك باستخدام اثنين من الشرائح الزجاجية كدعم. في محاولة لتجنب فقاعات الهواء في الراتنج على أو على مقربة من العينة.
- علاج العينات في الفرن في 70 درجة مئوية لمدة 48 ساعة على الأقل.
- إعداد راتنج الايبوكسي. وزن المكونات (33.3 غرام من مكون A / M، 33.3 غرام من المكون B، و 1 غرام من المكون D) وخلط الراتنج جيدا (على سبيل المثال، يهز على شاكر دوارة في أنبوب 15 مل) لمدة 30 دقيقة على الأقل قبل إضافة 16 قطرات من المسرع DMP 30. يحرك المزيج مرة أخرى لمدة 10 دقائق أخرى.
- التشذيب والتصاعد
- فصل أوراق تضمين وقطع قطعة من العينة المضمنة (حوالي 1 مم × 1 ملم) مع شفرة حلاقة. نقلها إلى بارا فيلم. وهذا يقلل من خطر فقدان العينة بسبب الكهروستاتيكيات.
- خذ دبوس الألومنيوم الذي تم إزالة الشحوم مع الإيثانول. مزيج الايبوكسي موصل جيدا واستخدام كمية صغيرة منه لتركيب العينة إلى دبوس. علاج الايبوكسي موصل في 70 درجة مئوية لمدة 10 دقائق.
- تقليم كل جانب من كتلة العينة مع سكين الماس ومن ثم تلميع وجه الكتلة حتى يتعرض النسيج.
ملاحظة: في هذه الخطوة، تأكد من وجود منطقة الاهتمام عن طريق جمع بعض المقاطع وأداء الأزرق toluidineتلطيخ 16 أو التحقق تحت المجهر الإلكتروني. - تقليل حجم العينة قدر الإمكان. ثم الأرض العينة إلى دبوس مع الطلاء موصل وعلاجه (لمدة 24 ساعة في درجة حرارة الغرفة أو في الفرن في 65 درجة مئوية لمدة 40 دقيقة).
- لتقليل القطع الأثرية المشحونة، قم بتغليف العينات بطبقة رقيقة من الذهب أو الذهب/البلاديوم.
9. التصوير SBEM
- ضع الدبوس مع عينة في غرفة المجهر الإلكتروني التسلسلي لمسح الوجه الكتلي. محاذاة العينة إلى السكين. أغلق الغرفة وحدد المعلمات.
- جمع كومة من الصور في التكبير المطلوب، وحجم بكسل، سمك شريحة، والجهد المتسارع (EHT)، الفتحة، والضغط، الخ.
ملاحظة: تعتمد المعلمات على العينة والهدف من التجربة. يتم تضمين إعدادات التصوير الأولي المثالي في جدول المواد.
10.3D إعادة الإعمار
ملاحظة: بالنسبة للخطوات المذكورة أدناه نستخدم برامج الوصول المفتوح مثل فيجي17 (ImageJ الإصدار 1.49b) ومتصفح صورة المجهر (MIB)18 وإعادة بناء19 ولكن يمكن استخدام برامج أخرى مختلفة.
- تحويل ملفات micrograph الرقمية (dm) إلى تنسيق TIFF. استيراد أولا تسلسل الصورة (في FijiJ: ملف > استيراد > تسلسل الصورة > اختيار تنسيق بت 8) ثم حفظ ك TIFF (في FijiJ: ملف > حفظ > تسلسل الصور > اختيار Tiff).
- ضبط السطوع والتباين من كومة من الصور (في فيجي: صورة > ضبط > السطوع / التباين)، وإذا لزم الأمر ، denoise عليه (استخدام البرنامج المساعد DenoisEM لفيج20 : الإضافات > DenoiseEM > دنويس).
- محاذاة المكدس (في FijiJ: الإضافات > StagReg أو MIB: مجموعة البيانات > أدوات المحاذاة).
- العمود الفقري الجزء التشجر ونقاط الاشتباك العصبي (في MIB أو إعادة بناء البرمجيات، تتوفر دروس شاملة (انظر جدول المواد للحصول على تفاصيل).
النتائج
باستخدام الطريقة المذكورة أعلاه عالية التباين، يمكن الحصول على صور جيدة القرار من أنسجة الدماغ الماوس. وهناك مجال كبير من الرؤية التي توفرها تقنية SBEM يسهل الاختيار الدقيق للمنطقة ذات الاهتمام. تم التقاط صورة كبيرة لمنطقة CA1 من قرن آمون لقياس طول الطبقة radiatum (ريال) (الشكل 2A
Discussion
هناك العديد من الاختلافات في الطريقة NCMIR الأولية التي وصفها Deerinck في 201010. وتظل المبادئ الأساسية كما هي، ولكن، تبعا لنوع المواد التي تمت دراستها، يتم تنفيذ تغييرات طفيفة. وقد وصف سابقا أن الراتنجات المختلفة يمكن استخدامها لتضمين عينات لSBEM وعلى سبيل المثال في حالة النباتات، Spurr ?...
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
تم إجراء التصوير SBEM والتصوير المجهري الخفيف وإعداد عينة المجهر الإلكتروني باستخدام معدات مختبر الأنسجة التصويرية والوظيفة التي تعمل كمرفق أساسي للتصوير في معهد نينكي للبيولوجيا التجريبية.
لإعداد الشكل 1، تم استخدام صورة فأر (Souris_02)، وقارورة من https://smart.servier.com/.
وقد دعم هذا العمل من قبل المركز الوطني للعلوم (بولندا) منحة أوبوس (UMO-2018/31/B/NZ4/01603) الممنوحة ل KR.
Materials
| Name | Company | Catalog Number | Comments |
| Anesthetic: | |||
| Ketamine/xylazine mixture (Ketamina/Sedazin) | Biowet Pulawy, Pulawy, Poland | ||
| Sodium pentobarbital (Morbital) | Biowet Pulawy, Pulawy, Poland | ||
| Fixatives: | |||
| Glutaraldehyde (GA) | Sigma-Aldrich,St. Louis, MI, USA | G5882 | Grade I, 25% in H2O, specially purified for use as an electron microscopy fixative |
| Hydrochloric acid (HCl) | POCH, Gliwice, Poland | 575283115 | pure p.a. |
| Paraformaldehyde (PFA) | Sigma-Aldrich,St. Louis, MI, USA | 441244 | prilled, 95% |
| Phosphate buffered saline (PBS), pH 7.4 | Sigma-Aldrich,St. Louis, MI, USA | P4417-50TAB | tablets |
| Sodium hydroxide (NaOH) | Sigma-Aldrich,St. Louis, MI, USA | S5881 | reagent grade,  98%, pellets (anhydrous) 98%, pellets (anhydrous) |
| Sodium phosphate dibasic (Na2HPO4) | Sigma-Aldrich,St. Louis, MI, USA | S3264 | |
| Sodium phosphate monobasic (NaH2PO4) | Sigma-Aldrich,St. Louis, MI, USA | S3139 | |
| Perfusion: | |||
| Large blunt/blunt curved scissors (~14.5 cm) | Fine Science Tools, Foster City, CA, USA | 14519-14 | |
| Micro-spatula (double 2" flat ends, one rounded, one tapered to 1/8") | Fine Science Tools, Foster City, CA, USA | 10091-12 | |
| Needle tip, 15 GA, blunt (perfusion needle) | KD Medical GmbH Hospital Products, Berlin, Germany | KD-FINE 900413 | 1.80 x 40 mm |
| Pair of fine (Graefe) tweezers | Fine Science Tools, Foster City, CA, USA | 11050-10 | |
| Perfusion pump | Lead Fluid | BQ80S | |
| Plastic vials | Profilab, Warsaw, Poland | 534.02 | plastic vials with blue cap for tissue storage, 20 ml, 31 x 48 mm |
| Straight iris scissors (~9 cm) | Fine Science Tools, Foster City, CA, USA | 14058-11 | |
| Brain slices preparation for EM: | |||
| 12-well plate | NEST, Rahway, NJ, USA | 712001 | |
| Cyanoacrylic glue | Fenedur, Montevideo, Uruguay | ||
| Glass vials | Electron Microscopy Sciences, Hatfield, PA, USA | 72632 | 20 ml Scintillation Vial, a pack of 100 |
| Pasteur pipette | VWR, Radnor, PA, USA | 612-4545 | LDPE, disposable, 7.5 ml |
| Razor blade | Wilkinson Sword, London, UK | Classic double edge safety razor blades | |
| Scalpel blade | Swann-Morton, Sheffield, UK | No. 20 | |
| Vibratome | Leica Microsystems, Vienna, Austria | Leica VT1000 S | |
| Brain slices preparation for IF: | |||
| 96-well plate | NEST, Rahway, NJ, USA | 701101 | |
| Criostat | Leica Microsystems, Vienna, Austria | Leica CM 1950 | |
| Ethylene glycol | Bioshop, Burlington, Canada | ETH001 | |
| Low-profile disposable blade 819 | Leica Biosystems Inc., USA | 14035838925 | |
| Scalpel blade | Swann-Morton, Sheffield, UK | No. 20 | |
| Sodium azide (NaN3) | POCH, Gliwice, Poland | 792770426 | |
| Sucrose | POCH, Gliwice, Poland | 772090110 | |
| Tissue freezing medium for cryosectioning, OCT-Compound | Leica Biosystems, Switzerland | 14020108926 | |
| Immunostaining: | |||
| 24-well plate | NEST, Rahway, NJ, USA | 702001 | |
| Anti-Post Synaptic Density Protein 95 Antibody | Merck-Millipore, Burlington, MA, USA | MAB1598 | |
| Confocal microscope | Zeiss, Göttingen, Germany | Zeiss Spinning Disc microscope (63 × oil objective, NA 1.4, pixel size 0.13 µm × 0.13 µm) | |
| Cover slide | Menzel Glaser, Braunschweig, Germany | B-1231 | 24 x 60 mm |
| Donkey anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 555 | Invitrogen, Carlsbad, CA, USA | A31570 | |
| Fluoromount-G Mounting Medium, with DAPI | Invitrogen, Carlsbad, CA, USA | 00-4959-52 | |
| Microscope slide | Thermo Scientific, Waltham, MA, USA | AGAA00008 | SuperFrost |
| Normal donkey serum (NDS) | Jackson ImmunoResearch Laboratories, West Grove, PA, USA | 017-000-121 | |
| Shaker | JWElectronic, Warsaw, Poland | KL-942 | |
| TritonT X-100 Reagent Grade | Bioshop, Burlington, Canada | TRX506 | |
| Electron microsocpy sample preparation | |||
| Potassium hexacyanoferrate(II) trihydrate | POCH, Gliwice, Poland | 746980113 | |
| Aclar 33C Film | Electron Microscopy Sciences, Hatfield, PA, USA | 50425 | Fluoropolymer Film embedding sheet |
| DMP-30, 2,4,6-Tris(dimethylaminomethyl)phenol | Sigma-Aldrich,St. Louis, MI, USA | T58203 | Epoxy embedding medium accelerator |
| Durcupan ACM single component A, M | Sigma-Aldrich,St. Louis, MI, USA | 44611 | Durcupan ACM single component A, M epoxy resin |
| Durcupan ACM single component B | Sigma-Aldrich,St. Louis, MI, USA | 44612 | Durcupan ACM single component B, hardener 964 |
| Durcupan ACM single component D | Sigma-Aldrich,St. Louis, MI, USA | 44614 | Durcupan ACM single component D , plasticizer |
| Ethyl alcohol absolute | POCH, Gliwice, Poland | 64-17-5 | Ethyl alcohol absolute 99.8 % pure P.A.-BASIC |
| Genlab laboratory oven | Wolflabs, York, UK | Mino/18/SS | Oven Genlab MINO/18/SS 18l volume, no fan circulation, no digital display, standard temperature gradient, standard recovery rate, no timer, 250°C maximum temperature, 240V electrical supply |
| L-Aspartic acid | Sigma-Aldrich,St. Louis, MI, USA | A-9256 | reagent grade,  98% (HPLC) 98% (HPLC) |
| Lead (II) nitrate | Sigma-Aldrich,St. Louis, MI, USA | 467790 |  99.95% trace metals basis 99.95% trace metals basis |
| Osmium tetroxide | Sigma-Aldrich,St. Louis, MI, USA | 75632 | for electron microscopy, 4% in H2O |
| pH meter | Elmetron, Zabrze, Poland | CP-5-5 | |
| Rotator | BioSan, Józefów, Poland | Multi Bio RS-24 | rotator Multi Bio RS-24 |
| Sodium hydroxide (NaOH) | Sigma-Aldrich,St. Louis, MI, USA | S5881 | reagent grade,  98%, pellets (anhydrous) 98%, pellets (anhydrous) |
| Sunflower mini shaker | Grant bio, Shepreth,UK | PD-3D | |
| Syringe filter | Millipore, Burlington, MA, USA | SLGP033NB | 0,22 µm pore size |
| Thiocarbohydrazide | Sigma-Aldrich,St. Louis, MI, USA | 88535 | purum p.a., for electron microscopy,  99.0% (N) 99.0% (N) |
| Uranyl acetate | Serva, Heidelberg, Germany | 77870 | Uranyl acetate·2H2O, research grade |
| Water bath | WSL, Swietochlowice, Poland | LWT | |
| Specimen mounting for SBEM | |||
| 96-well culture plate | VWR, Radnor, PA, USA | 734-2782 | 96-well plates, round bottom, non treated |
| AM Gatan 3View stub handling tweezers | Micro to Nano, Haarlem, Netherlands Netherlands | 50-001521 | |
| Binocular | OPTA-TECH, Warsaw, Poland | X2000 | |
| Conductive glue | Chemtronics, Georgia, USA | CW2400 | conductive eopxy |
| Gatan 3View sample pin stubs | Micro to Nano, Haarlem, Netherlands Netherlands | 10-006003 | |
| Parafilm | Sigma-Aldrich,St. Louis, MI, USA | P7793 | roll size 20 in. × 50 ft |
| Pelco conductive silver paint | Ted Pella, Redding, CA, USA | 16062-15 | PELCO® Conductive Silver Paint, 15g |
| Razor blades double edge | Electron Microscopy Sciences, Hatfield, PA, USA | 72000 | Stainless Steel "PTFE" coated. PERSONNA brand .004" thick, wrapped individually, 250 blades in a box. |
| Scanning Electron Microscope | Zeiss, Oberkochen, Germany | Sigma VP with Gatan 3View2 chamber, acceleration voltage 2.5 kV, variable pressure 5 Pa, aperture 20 µm, dwell time 6 µs, slice thickness 60 nm, magnification 15 000 x, image resolution 2048 x 2048 pixels, pixel size 7.3 nm | |
| trim 90° diamond knife | Diatome Ltd., Nidau, Switzerland | DTB90 | |
| Ultramicrotome | Leica Microsystems, Vienna, Austria | Leica ultracutR | |
| Software | webpage | tutorials | |
| FijiJ | https://fiji.sc/ | ||
| Microscopy Image Browser | http://mib.helsinki.fi/ | http://mib.helsinki.fi/tutorials.html | |
| Reconstruct | https://synapseweb.clm.utexas.edu/software-0 | https://synapseweb.clm.utexas.edu/software-0) | |
| Animals | |||
| Mice | Adult 3-month old and 20±1 month old female Thy1-GFP(M) mice (Thy1-GFP +/-) (Feng et al.,2000) which express GFP in a sparsely distributed population of glutamatergic neurons. Animals were bred as heterozygotes with the C57BL/6J background in the Animal House of the Nencki Institute of Experimental Biology. |
References
- Bosch, M., Hayashi, Y. Structural plasticity dendritic spines. Current Opinion in Neurobiology. 22 (3), 383-388 (2012).
- Borczyk, M., Radwanska, K., Giese, K. P. The importance of ultrastructural analysis of memory. Brain Research Bulletin. 173, 28-36 (2021).
- Wanner, A. A., Kirschmann, M. A., Genoud, C. Challenges of microtome-based serial block-face scanning electron microscopy in neuroscience: challenges of SBEM in neuroscience. Journal of Microscopy. 259 (2), 137-142 (2015).
- Śliwińska, M. A., et al. Long-term Memory Upscales Volume of Postsynaptic Densities in the Process that Requires Autophosphorylation of αCaMKII. Cerebral Cortex. 30 (4), 2573-2585 (2020).
- Borczyk, M., Śliwińska, M. A., Caly, A., Bernas, T., Radwanska, K. Neuronal plasticity affects correlation between the size of dendritic spine and its postsynaptic density. Scientific Reports. 9 (1), 1693 (2019).
- Leighton, S. B. SEM images of block faces, cut by a miniature microtome within the SEM - a technical note. Scanning Electron Microscopy. , 73-76 (1981).
- Denk, W., Horstmann, H. Serial Block-Face Scanning Electron Microscopy to Reconstruct Three-Dimensional Tissue Nanostructure. PLoS Biology. 2 (11), 329 (2004).
- Smith, D., Starborg, T. Serial block face scanning electron microscopy in cell biology: Applications and technology. Tissue and Cell. 57, 111-122 (2019).
- Titze, B., Genoud, C. Volume scanning electron microscopy for imaging biological ultrastructure: Volume scanning electron microscopy. Biology of the Cell. 108 (11), 307-323 (2016).
- Deerinck, T. J., Bushong, E. A., Thor, A., Ellisman, M. H. . NCMIR methods for 3D EM: A new protocol for preparation of biological specimens for serial block face scanning electron microscopy. , 6-8 (2010).
- Willingham, M. C., Rutherford, A. V. The use of osmium-thiocarbohydrazide-osmium (OTO) and ferrocyanide-reduced osmium methods to enhance membrane contrast and preservation in cultured cells. Journal of Histochemistry & Cytochemistry. 32 (4), 455-460 (1984).
- Feng, G., et al. Imaging Neuronal Subsets in Transgenic Mice Expressing Multiple Spectral Variants of GFP. Neuron. 28 (1), 41-51 (2000).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Paxinos, G., Franklin, K. B. J. . The mouse brain in stereotaxic coordinates. , (2004).
- Walton, J. Lead aspartate, an en bloc contrast stain particularly useful for ultrastructural enzymology. Journal of Histochemistry & Cytochemistry. 27 (10), 1337-1342 (1979).
- Mercer, E. H. a scheme for section staining in electron microscopy. Journal of the Royal Microscopical Society. 81 (3-4), 179-186 (1963).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Belevich, I., Joensuu, M., Kumar, D., Vihinen, H., Jokitalo, E. Microscopy Image Browser: A Platform for Segmentation and Analysis of Multidimensional Datasets. PLOS Biology. 14 (1), 1002340 (2016).
- Fiala, J. C. Reconstruct: a free editor for serial section microscopy. Journal of Microscopy. 218 (1), 52-61 (2005).
- Roels, J., et al. An interactive ImageJ plugin for semi-automated image denoising in electron microscopy. Nature Communications. 11 (1), 771 (2020).
- Radwanska, K., et al. Mechanism for long-term memory formation when synaptic strengthening is impaired. Proceedings of the National Academy of Sciences. 108 (45), 18471-18475 (2011).
- Kittelmann, M., Hawes, C., Hughes, L. Serial block face scanning electron microscopy and the reconstruction of plant cell membrane systems: SBFSEM Methods for Plant Cells. Journal of Microscopy. 263 (2), 200-211 (2016).
- Fendrych, M., et al. Programmed Cell Death Controlled by ANAC033/SOMBRERO Determines Root Cap Organ Size in Arabidopsis. Current Biology. 24 (9), 931-940 (2014).
- Russell, M. R. G., et al. 3D correlative light and electron microscopy of cultured cells using serial blockface scanning electron microscopy. Journal of Cell Science. 130 (1), 278-291 (2017).
- Płachno, B. J., Świątek, P., Jobson, R. W., Małota, K., Brutkowski, W. Serial block face SEM visualization of unusual plant nuclear tubular extensions in a carnivorous plant (Utricularia, Lentibulariaceae). Annals of Botany. 120 (5), 673-680 (2017).
- Genoud, C., Titze, B., Graff-Meyer, A., Friedrich, R. W. Fast Homogeneous En Bloc Staining of Large Tissue Samples for Volume Electron Microscopy. Frontiers in Neuroanatomy. 12, (2018).
- Puhka, M., Joensuu, M., Vihinen, H., Belevich, I., Jokitalo, E. Progressive sheet-to-tubule transformation is a general mechanism for endoplasmic reticulum partitioning in dividing mammalian cells. Molecular Biology of the Cell. 23 (13), 2424-2432 (2012).
- Gluenz, E., Wheeler, R. J., Hughes, L., Vaughan, S. Scanning and three-dimensional electron microscopy methods for the study of Trypanosoma brucei and Leishmania mexicana flagella. Methods in Cell Biology. 127, 509-542 (2015).
- Starborg, T., et al. Using transmission electron microscopy and 3View to determine collagen fibril size and three-dimensional organization. Nature Protocols. 8 (7), 1433-1448 (2013).
- Hughes, L., Borrett, S., Towers, K., Starborg, T., Vaughan, S. Patterns of organelle ontogeny through a cell cycle revealed by whole-cell reconstructions using 3D electron microscopy. Journal of Cell Science. 130 (3), 637-647 (2017).
- Bojko, A., et al. Improved Autophagic Flux in Escapers from Doxorubicin-Induced Senescence/Polyploidy of Breast Cancer Cells. International Journal of Molecular Sciences. 21 (17), 6084 (2020).
- Knott, G. W., Holtmaat, A., Trachtenberg, J. T., Svoboda, K., Welker, E. A protocol for preparing GFP-labeled neurons previously imaged in vivo and in slice preparations for light and electron microscopic analysis. Nature Protocols. 4 (8), 1145-1156 (2009).
- Glauert, A. M., Lewis, P. R. . Biological specimen preparation for transmission electron microscopy. , (2014).
- Genoud, C. Altered Synapse Formation in the Adult Somatosensory Cortex of Brain-Derived Neurotrophic Factor Heterozygote Mice. Journal of Neuroscience. 24 (10), 2394-2400 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved