A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מיקרוסקופיית אלקטרונים סריקה טורית של פרצוף בלוק (SBEM) לחקר קוצים דנדריטים
In This Article
Summary
מיקרוסקופיית אלקטרונים סריקת פרצוף בלוק סדרתית (SBEM) מוחלת על תמונה ולנתח קוצים דנדריטיים בהיפוקמפוס המורין.
Abstract
מיקרוסקופיית אלקטרונים תלת מימדית (3D EM) נותנת אפשרות לנתח פרמטרים מורפולוגיים של קוצים דנדריטיים ברזולוציה ננומטרית. בנוסף, תכונות מסוימות של קוצים דנדריטיים, כגון נפח עמוד השדרה וצפיפות פוסט-סינפטית (PSD) (המייצגת חלק פוסט-סינפטי של הסינפסה), נוכחות של מסוף פרזינפטי, ורטיקולום אנדופלסמי חלק או צורה לא טיפוסית של PSD (למשל, עמוד שדרה מרובה פנימיות), ניתן לראות רק עם 3D EM. על ידי שימוש במיקרוסקופיית אלקטרונים סריקה טורית של פני בלוק (SBEM) ניתן להשיג נתונים אלקטרומגם תלת-ממדיים בקלות ובאופן רב יותר מאשר בעת ביצוע חתך סדרתי מסורתי. כאן אנו מראים כיצד להכין דגימות היפוקמפוס עכבר לניתוח SBEM וכיצד פרוטוקול זה יכול להיות משולב עם מחקר חיסוני של קוצים דנדריטיים. זלוף קיבעון מתון מאפשר לנו לבצע מחקרים אימונופלואורסצנטיים עם מיקרוסקופיה קלה על מחצית אחת של המוח, בעוד החצי השני היה מוכן SBEM. גישה זו מפחיתה את מספר בעלי החיים שישמשו למחקר.
Introduction
רוב הסינפסות המרגשות במערכת העצבים המרכזית ממוקמות על קוצים דנדריטיים - בליטות קטנות של קרום עצבי. בליטות אלה יוצרות תאים ביוכימיים מוגבלים השולטים בהעברת אותות תאיים. פלסטיות מבנית של קוצים וסינפסות דנדריטיים קשורה קשר הדוק לשינויים התפקודיים ביעילות הסינפטית העומדים בבסיס תהליכים חשובים כגון למידה וזיכרון1,2. חשוב לציין כי מיקרוסקופיה אלקטרונים (EM) היא הטכניקה היחידה המאפשרת לקבוע אם עמוד השדרה דנדריטי יש קלט presynaptic. רזולוציית EM נדרשת גם כדי ללמוד פרטים אולטרה-מבניים כגון צורה של צפיפות פוסט-סינפטית (PSD), המייצגת חלק פוסט-סינפטי של סינפסה, או ממדים של עמוד שדרה דנדריטי, כמו גם את הגודל והצורה של בוטון אקסוני. בנוסף, עם EM ניתן לדמיין סינפסות וסביבתם.
הודות להתקדמות בטכנולוגיות הדמיה ומחשוב ניתן לשחזר מעגלים עצביים שלמים. טכניקות מיקרוסקופיה אלקטרונים נפח, כגון מיקרוסקופיית אלקטרונים שידור מקטע סדרתי (ssTEM), מיקרוסקופיית אלקטרונים סריקת פני בלוק סדרתית (SBEM) ומיקרוסקופיית אלקטרונים סריקת קרן יונים ממוקדת (FIB-SEM) משמשות בדרך כלל לשחזורים של מעגלים עצביים3.
במחקרים שלנו, שיטת SBEM משמש בהצלחה כדי לחקור את הפלסטיות המבנית של קוצים דנדריטיים ו- PSD בדגימות של היפוקמפוס העכבר ופרוסות מוח אורגנוטיפיות 4,5. ה- SBEM מבוסס על התקנת אולטרה-מיקרודום מיניאטורי בתוך תא מיקרוסקופ האלקטרונים סורק6,7,8,9. החלק העליון של בלוק המדגם הוא בתמונה, ולאחר מכן המדגם נחתך בעומק שצוין על ידי ultramicrotome, חושף פרצוף בלוק חדש, אשר שוב בתמונה ולאחר מכן התהליך חוזר עלעצמו 8. כתוצאה מכך, רק התמונה של פרצוף בלוק נותרת בעוד הפרוסה שנחתכה אבדה כשרידים. לכן SBEM נקרא טכניקה הרסנית, כלומר לא ניתן לדמיין את אותו המקום שוב. עם זאת, היתרון של שיטות חסימה הרסניות הוא שהם אינם סובלים מבעיות עיוות ואובדן מקטע שיכול להשפיע באופן משמעותי על איכות הנתונים וניתוח הנתונים3. יתר על כן, SBEM נותן את האפשרות לדמיין שדה ראייה גדול יחסית ( > 0.5 מ"מ × 0.5 מ"מ) ברזולוציה גבוהה3.
כדי להעסיק SBEM, דגימות צריכות להיות מוכנות על פי פרוטוקול ייעודי, מנוגד מאוד בשל גלאי אלקטרונים backscattered המשמש לרכישת תמונות. אנו מראים כאן כיצד לבצע הכנת מדגם על פי הפרוטוקול המבוסס על הליך שפותח על ידי Deerinck10 (המרכז הלאומי למיקרוסקופיה ומחקר הדמיה (NCMIR), באמצעות כתמי אוסמיום-thiocarbohydrazide-osmium מופחתים שפותחו בשנות השמונים8,11. בנוסף, אנו מציגים גישת קיבעון דו-שלבית, עם זלוף קיבעון מתון המאפשר להשתמש באותו מוח הן למחקרי אימונופלואורסצנטיות עם מיקרוסקופיה קלה ו- SBEM.
בפרוטוקול מוח עכבר קבוע בעיקר עם קיבעון קל, ולאחר מכן חתוך לחצי, וחצי כדור אחד הוא postfixed ומוכן עבור אימונופלואורסצנטיות (IF), בעוד השני למחקרי EM (איור 1).
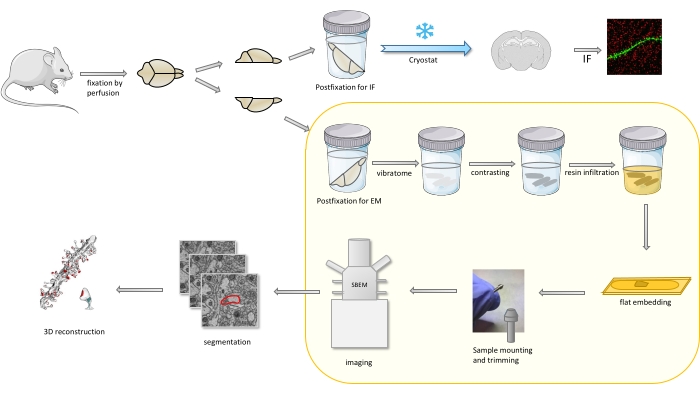
איור 1. ייצוג סכמטי של זרימת העבודה עבור הכנת קוצים דנדריטי לניתוח עם SBEM. עכברים הוקרבו ונושלו עם קיבעון ראשוני מתון. המוח נחתך לחצי, וחצי הכדור השני הוצב עם קיבוע חיסוני (IF) קיבעוני ייעודי, קריו-מוגן, פרוס באמצעות קריוסטט ומעובד למחקרי IF, בעוד חצי הכדור השני היה postfixed עם מתקן EM, פרוס עם הוויברטום והוכן למחקרי EM. פרוסות המוח למחקרי SBEM היו מנוגדות, שטוח מוטבע שרף, אז אזור CA1 של ההיפוקמפוס הותקן על הסיכה, ותמונה עם SBEM (איור 1). החלק בפרוטוקול המודגש בקופסה צהובה הוצג בסרטון. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Protocol
המחקר בוצע בהתאם להנחיות מכון ננקי ואישור ועדת האתיקה המקומית. המחקרים בוצעו בהתאם להנחיית מועצת הקהילות האירופית מ-24 בנובמבר 1986 (86/609/EEC), חוק הגנת בעלי חיים בפולין ואושר על ידי ועדת האתיקה המקומית הראשונה בוורשה. נעשו כל המאמצים לצמצם את מספר בעלי החיים המשמשים ואת סבלם.
זהירות: כל ההליכים המתוארים להלן חייבים להתבצע במכסה אדים במעבדה. בשל האופי המסוכן של ריאגנטים בשימוש. אמצעי בטיחות אישיים כגון כפפות, חלוק מעבדה, משקפי בטיחות ומסכת פנים נדרשים.
1. הכנת הקיבעון עבור זלוף (2% wt / vol paraformaldehyde (PFA) ו 0.5% vol / vol glutaraldehyde (GA) ב 0.1 M חוצץ פוספט (PB), pH 7.4)
הערה: הכן את הפתרון הקיבווני באותו יום שבו ייעשה בו שימוש ואל תאחסן אותו זמן רב יותר מאשר למשך 3 שעות. במקרה של מחסור בזמן, להכין 2% PFA ב 0.1 M PB יום קודם לכן, לאחסן אותו ב 4 °C (75 °F) ולהוסיף GA טרי זמן קצר לפני זלוף.
- קח 400 מ"ל של מים סטריליים מזוקקים כפולים (ddH2O) וחמם אותו ל 60 °C (60 °F) באמצעות צלחת חמה ערבוב. לאחר מכן להוסיף 20 גרם של PFA. מוסיפים טיפות של 1 M NaOH עד PFA מומס לחלוטין ולאפשר את התערובת להתקרר.
- הוסף 500 מ"ל של 0.2 M PB (pH 7.4).
- לסנן את הפתרון כדי להסיר כל פיקדון ולקרר אותו ל 4 °C (70 °F).
- רגע לפני זלוף, להוסיף 20 מ"ל של 25% GA לפתרון ולאחר מכן למלא את הנפח עם ddH2O עד 1 L.
2. הכנת קיבוע פוסטפוזיה עבור SBEM (2% wt/ vol PFA ו- 2.5% vol / vol GA ב- 0.1 M PB, pH 7.4)
- קח 50 מ"ל של הקיבעון עבור זלוף (2% PFA ו 0.5% GA ב 0.1 M PB).
- הוסף 5 מ"ל של 25% GA.
3. הכנת קבוע פוסטפוזיה עבור כתמי IF (4% PFA ב פוספט חוצץ מלוחים (PBS))
- ממיסים טבליה של 1x PBS (pH 7.4) במים מטוהרים ומטוהרים (H2O) בהתאם להוראות היצרן.
- השתמש צלחת חמה ערבוב לחמם את הפתרון ל 60 °C (60 °F) ולהוסיף 40 גרם של PFA.
- מוסיפים טיפות של 1 M NaOH עד PFA מומס לחלוטין ולאפשר את התערובת להתקרר.
- כוונן את רמת ה- pH של הפתרון ל- 7.5 עם 1 M HCl ולאחר מכן למעלה את עוצמת הקול עם H2O עד 1 L.
- סנן את הפתרון כדי להסיר את כל ההפקדות.
4. זלוף עירוי של בעלי חיים
הערה: יש לאסוף ולאחסן את כל פסולת PFA ו- GA לסילוק בהתאם לתקנות המקומיות. הרדמה וזיהוי צריך לעקוב אחר התקנות המקומיות. בפרוטוקול המתואר מבוגר בן 3 חודשים ו 20± נקבה בת 20 חודשים Thy1-GFP(M) עכברים (Thy1-GFP +/-)12 מבטא חלבון פלואורסצנטיות ירוק (GFP) באוכלוסייה מפוזרת בדלילות של נוירונים גלוטמטרגיים שימשו אך ניתן להשתמש בכל אחד אחר גם כן. בעלי חיים גודלו כהטרוזיגוטים עם רקע C57BL/6J בבית החיות של מכון ננקי לביולוגיה ניסויית.
- לפני זלוף מרדים עכבר על ידי מתן תערובת קטמין/ קסילאצין (עד 90 מ"ג / קילוגרם קטמין משקל גוף ו 10 מ"ג / קילוגרם קסילאצין משקל גוף) באמצעות הזרקה תוך-פריציונלית (מחט 27-מד).
- להעריך אם עומק ההרדמה מספיק על ידי בדיקת הרפלקס לגירויים כאב (צביטה) ורפלקס הקרנית (פזילה).
- לאחר 20 דקות לבצע הזרקה תוך-גופית (מחט 27-מד) של נתרן פנטוברביטל (50 מ"ג/ קילוגרם משקל גוף).
- לעיין בעכבר על פי פרוטוקול ניתוח זלוף המתואר על ידי Gage et al.13 (ראה נקודה 4; איור 5.6). באמצעות משאבת זלוף להתחיל עם חיץ פוספט 0.1 M, pH 7.4 (30 מ"ל) במשך 3 דקות ולהמשיך עם 2% PFA ו 0.5% GA ב 0.1 M PB, pH 7.4 במשך 6 דקות (80 מ"ל).
- ניתחו בעדינות את המוח מהגולגולת וחלקו אותו לשניים (ראו איור 9-10 בגייג' ואח', 201213). מניחים חתיכה אחת בחתיכה המכילה קיבעון ל- SBEM ואת השנייה לתוך הבקריאל עם 4% PFA / PBS להכתמת IF.
- שמור את ההמיספרות בקבע ב 4 °C (4 °F) לילה.
5. המוח פורס את ההכנה למיקרוסקופיית אלקטרונים
- בחר את הגדרות הוויברטום (מהירות נסיעה להב: 0.075 מ"מ/s, תדירות חיתוך: 80 הרץ).
- מניחים את תא הפרוסה לתוך המחזיק, מחברים אותו לויברטום ומקיף אותו בקרח. ואז מניחים סכין גילוח לתוך מחזיק להב הוויברטום.
- השתמש בכף, או חפץ דומה ומניחים את המוח המצונן (משטח גב למעלה) על משטח חיתוך קשה (למשל, מכסה צלחת פטרי מזכוכית). כדי להכין פרוסה קורונלית של ההיפוקמפוס לעשות חתך מאונך בין חצי הכדור המוחי ואת המוח הקטן עם סכין גילוח או אזמל, ובכך להסיר את המוח הקטן. ניתן גם להסיר את נורת הריח.
- יש למרוח דבק ציאנואקרילט על הרציף היבש של הוויברטום.
- הרימו את המוח במלקחיים וייבשו אותו בזהירות על נייר סינון.
- הדבק את חצי הכדור לרציף קרוב ללהב החיתוך עם קצה הרוסטריאל כלפי מעלה. חבר את הרציף למחזיק ומיד מלא אותה ב-0.1 M PB קר כקרח, pH 7.4. אם החתך המאונך נעשה כראוי, חצי הכדור יעמוד ישר למעלה ויספק זווית של 90° הנדרשת כדי לבצע חתך קורונלי סימטרי המכיל את ההיפוקמפוס. להבטיח כי המוח מכוסה PB.
- מקם את להב הוויברטום מול חצי הכדור והנמיך אותו לצד ההוסטל של חצי הכדור. הורידו את הלהב ל-400 מיקרומטר נוספים בכיוון הקדאלי והתחילו לכהן. ממשיכים לחתוך עד ששתי הפרוסות הראשונות מופרדות לחלוטין מבלוק הרקמה.
- לסגת הלהב ולהוריד עוד 100 מיקרומטר, ולאחר מכן לפרוס שוב.
- כאשר ההיפוקמפוס הופך גלוי (השתמש אטלס המוח העכבר פקסינוס פרנקלין, 200414) לאסוף את הפרוסות עם מברשת צבע קטנה או פיפטה פסטר פלסטיק רחב.
- מעבירים את הפרוסות לצלחת 12-באר מלאה ב-0.1 M PB קר, pH 7.4.
- לנתח את ההיפוקמפוס בצלחת פטרי מלא 0.1 M PB, pH 7.4 באמצעות סכין גילוח או אזמל, ולשים אותו לתוך בקבוקוני זכוכית עם אותו חוצץ פוספט.
הערה: לאחסון לטווח ארוך של תוספת פרוסות 0.1 M PB עם 0.05% נתרן אזיד (NaN3).
6. הכנת דגימת מוח לחיסון
- לאחר קיבוע בן לילה בתמיסת 4% PFA /PBS במכסה אדים, הכניסו את רקמת המוח לתמיסת ההקפאה (30% סוכרוז ב-PBS עם 0.05% NaN3) ושמרו אותה על 4 מעלות צלזיוס למשך יומיים (עד השקיעה).
- הכן פתרון נגד קפיאה (15% סוכרוז / 30% אתילן גליקול / 0.05% NaN3/PBS).
- הגדר את טמפרטורת הארון של cryostat ב -19 °C (70 °F) ולוודא כי הטמפרטורה היא הגיעה לפני שתמשיך הלאה. במהלך החתך, ודא כי טמפרטורת הארון נשאר בין -18 °C (50 °F) עד -20 °C (50 °F).
- השתמש בכף, או חפץ דומה ומניחים את המוח המצונן (משטח גב למעלה) על משטח חיתוך קשה (למשל, מכסה צלחת פטרי מזכוכית). כדי להכין פרוסה קורונלית של ההיפוקמפוס לעשות חתך מאונך בין חצי הכדור המוחי ואת המוח הקטן עם סכין גילוח או אזמל, ובכך להסיר את המוח הקטן.
- בחר דיסק דגימה מקורר מראש, לכסות אותו במדיום להקפאה על מדף משחרר ושימוש במלקחיים לתקן את חצי הכדור לדיסק עם קצה rostral כלפי מעלה ולחכות עד הדגימה קפואה לחלוטין. הכנס את דיסק הדגימה לראש דגימה.
- התקן להב במחזיק להב בתוך תא ההקפאה וחתוך פרוסות בעובי 40 מיקרומטר.
- מעבירים פרוסות עם מברשת צבע קטנה לצלחת 96-well מלאת תמיסה קרה נגד הקפאה ומפרקים בעדינות את החלקים (אוספים פרוסה לאחר כל סיבוב של חיתוך כדי למנוע מהם ללכת לאיבוד בתא הפרוסה).
הערה: מוח או מקטעים ניתן לאחסן בתמיסה נגד קפיאה ב -20 °C (50 °F) במשך זמן רב.
7. חיסון של פרוסות מוח
הערה: כל שלבי הכתמים בוצעו בצלחת של 24 באר על שייקר פלטפורמה.
- לשטוף את הפרוסות עם PBS שלוש פעמים, בכל פעם במשך 6 דקות.
- דגירה פרוסות 300 μL של פתרון חסימה (5% סרום חמור רגיל (NDS)/0.3% Triton X-100) במשך שעה אחת עם רועד עדין על סיבוב.
- לדגור את הפרוסות עם הנוגדן העיקרי נגד PSD-95 מדולל 1:500 ב 5% NDS / 0.3% טריטון X-100 / PBS (300 μL לבאר) לילה ב 4 °C (5 °F). הריכוז הסופי של הנוגדן העיקרי הוא 2 מיקרוגרם / מ"ל.
- לשטוף את הפרוסות עם 0.3% Triton X-100 / PBS בטמפרטורת החדר (RT) שלוש פעמים, בכל פעם במשך 6 דקות.
- דגירה פרוסות עם הנוגדן המשני מדולל 1:500 ב 300 μL של 0.3% טריטון X-100 / PBS במשך 90 דקות. הריכוז הסופי של הנוגדן המשני הוא 4 מיקרוגרם / מ"ל.
- לשטוף את הפרוסות עם PBS שלוש פעמים, בכל פעם במשך 6 דקות.
- טען את הפרוסות בשקופיות באמצעות מדיום הרכבה ולאחר מכן סגור אותן באמצעות שקופית כיסוי.
- בדוק את הדגימות באמצעות מיקרוסקופ קונפוקלי (63 × מטרת שמן, NA 1.4, גודל פיקסל 0.13 מיקרומטר × 0.13 מיקרומטר).
הערה: לאחסון לטווח ארוך: שמור את הדגימות ב 4 °C (70 °F), להגן עליהם מפני אור.
8. הכנת מדגם SBEM
זהירות: בשל האופי המסוכן של ריאגנטים השתמשו בכל ההליכים המתוארים להלן חייב להתבצע במכסה אדים במעבדה. לפני השימוש בכימיקלים אלה קרא בעיון את גליונות הנתונים לבטיחות החומרים שסופקו על ידי היצרנים ושאל את קצין הבטיחות על הכללים המקומיים כדי להבטיח טיפול בטוח וסילוק פסולת.
- דוגמה מנוגדת
הערה: פרוסות כביסה ודגירה בטמפרטורת החדר צריך להתבצע עם רועד קל (למשל, על שייקר פלטפורמה). נעשה שימוש במים מנוצלים אוטומטיים.- לשטוף את הפרוסות עם קר 0.1 M PB, pH 7.4 חמש פעמים, בכל פעם במשך 3 דקות.
- הכן תערובת 1:1 של 4% אוסמיום טטרידוקסיד מימית ו 3% אשלגן ferrocyanide (1:1 על ידי vol). המוצר הסופי יהפוך לחום. טובלים את הדגימות בתערובת זו, מניחים אותן על קרח, ומשלב זה ואילך חשוב להגן עליהן מפני אור. לדגור אותם עם רועד עדין במשך שעה אחת.
- בינתיים להכין פתרון thiocarbohydrazide (TCH). מערבבים 10 מ"ל של H2O מזוקק כפול (ddH2O) ו 0.1 גרם של TCH ומניחים אותו לתוך תנור להגדיר ב 60 °C (1 שעה. חשוב לסובב את הפתרון מעת לעת (למשל, כל 10 דקות). כאשר מוכן, לקרר אותו לטמפרטורת החדר.
- לשטוף את הפרוסות עם ddH2O חמש פעמים, בכל פעם במשך 3 דקות.
- סנן פתרון TCH באמצעות מסנן מזרק של 0.22 מיקרומטר וטבול את הדוגמה בפתרון מסונן. הפרוסות יהפכו לשחורות. לדגור אותם במשך 20 דקות בטמפרטורת החדר.
- לשטוף את הדגימות עם ddH2O חמש פעמים, בכל פעם במשך 3 דקות.
- לדגור על הדגימות עם פתרון מימי 2% של OsO4 במשך 30 דקות בטמפרטורת החדר.
- לשטוף את הדגימות עם ddH2O חמש פעמים, בכל פעם במשך 3 דקות.
- מניחים את הדגימות מסונן 1% אצטט אורניל מימית ודגור אותם ב 4 °C (50 °F) לילה. השתמש במסנן מזרק 0.22 מיקרומטר לסינון.
- הכן פתרון חומצה אספרטית L על ידי ערבוב 0.4 גרם של חומצה אספרטית L ו 80 מ"ל של ddH2O, להתאים את ה- pH ל 3.8 להמסה קלה יותר, ולאחר מכן למעלה עם מים ל 100 מ"ל.
- למחרת, תתחיל עם ההובלה של וולטון בהכנות15. לערבב 0.066 גרם של עופרת חנקתית עם 10 מ"ל של פתרון חומצה אספרטית L (נקודה 8.1.10) התחמם מראש ל 60 °C (5.5( נמדד ב 60 °C) עם 1 M NaOH. סגור את הקרבון עם אספרטט עופרת ולהשאיר אותו ב 60 °C (30 °F) במשך 30 דקות באמבט מים. הפתרון צריך להיות ברור. אם זה הופך מעונן, זה חייב להיות מושלך ואחד חדש צריך להיות מוכן.
- בינתיים, לשטוף את הדגימות עם ddH degassed2O חמש פעמים, בכל פעם במשך 3 דקות. ואז לשמור אותם בתנור להגדיר ב 60 °C (60 °F) במשך 30 דקות.
- טובלים את הדגימות בתמיסת אספרטט העופרת הטריה ודגר אותם בתנור שנקבע על 60 מעלות צלזיוס במשך 20 דקות.
- לשטוף את הדגימות עם ddH degassed2O חמש פעמים, בכל פעם במשך 3 דקות.
- התייבשות והטבעת שרף
- הכן שרף אפוקסי. שקול את החומרים (33.3 גרם של רכיב A/M, 33.3 גרם של רכיב B, ו 1 גרם של רכיב D) ומערבבים את השרף היטב (למשל, לנער אותו על שייקר סיבובי בצינור 15 מ"ל) במשך 30 דקות לפחות לפני הוספת 16 טיפות של מאיץ DMP 30. מערבבים שוב עוד 10 דקות.
הערה: שקלו את המרכיבים מתחת למכסה המנוע. כמות זו של רכיבים נותן כ 60 מ"ל של שרף מה מספיק עבור 15 בקבוקונים עם דגימות. אתה יכול להכין פחות או לאחסן את שאר השרף במזרק ב 4 °C (55 °F) ולהשתמש בו למחרת. זכור לאטום את קצה המזרק. - הכן בקבוקונים עם דילול מדורג של אתנול (30%, 50%, 70%, 90%, 100%, 100% אתנול במים ו 100% מיובש על מסננת מולקולרית).
- מערבבים את השרף עם 100% אתנול ביחס 1:1 כדי להשיג 50% שרף. מערבבים את זה היטב.
- ייבשו את הדגימות במשך 5 דקות בכל דילול של אתנול החל מ -30% וכלה ב -100% אתנול נטול מים מיובש על מסננת מולקולרית. זכור, אסור שהדגימות יתייבשו לגמרי.
- לחדור את הדגימות תחילה ב 50% שרף במשך 30 דקות, הבא ב 100% שרף במשך שעה אחת, ולאחר מכן שוב ב 100% שרף לילה. בצע את כל שלבי החדירה עם רעד איטי מתמיד.
- למחרת, מניחים את הדגימות בשרף טרי של 100% למשך שעה אחת ואז הטמיעים אותן בין יריעות הטמעה פלואורופולימריות. Degrease חתיכות של גיליון הטבעה עם אתנול, שטוח להטמיע את הדגימות בין שתי שכבות של זה, באמצעות שתי שקופיות זכוכית כתמיכה. נסה להימנע מבועות אוויר שרף על או קרוב לדגימה.
- לרפא את הדגימות בתנור ב 70 °C (70 °F) לפחות 48 שעות.
- הכן שרף אפוקסי. שקול את החומרים (33.3 גרם של רכיב A/M, 33.3 גרם של רכיב B, ו 1 גרם של רכיב D) ומערבבים את השרף היטב (למשל, לנער אותו על שייקר סיבובי בצינור 15 מ"ל) במשך 30 דקות לפחות לפני הוספת 16 טיפות של מאיץ DMP 30. מערבבים שוב עוד 10 דקות.
- חיתוך והרכבה
- הפרד יריעות הטמעה וחתוך חתיכה מהדגימה המוטבעת (כ-1 מ"מ x 1 מ"מ) עם סכין גילוח. תעביר את זה לפרפילם. זה ימזער את הסכנה לאבד את המדגם עקב אלקטרוסטטיק.
- קח סיכת אלומיניום כי כבר degreased עם אתנול. מערבבים היטב אפוקסי מוליך ומשתמשים בכמות קטנה ממנו כדי לעלות על הדגימה על הסיכה. לרפא אפוקסי מוליך ב 70 °C (70 °F) במשך 10 דקות.
- חותכים כל צד של בלוק המדגם עם סכין היהלום ולאחר מכן ללטש את הפנים של הבלוק עד הרקמה נחשפת.
הערה: בשלב זה, לאשר את נוכחותו של אזור עניין על ידי איסוף חלקים מסוימים וביצוע תכתם כחול טולואידין16 או בדיקה תחת מיקרוסקופ אלקטרונים. - להקטין את גודל המדגם ככל האפשר. לאחר מכן לקרקע את המדגם לסיכה עם צבע מוליך לרפא אותו (במשך 24 שעות בטמפרטורת החדר או בתנור ב 65 °C (40 דקות).
- כדי למזער את טעינת חפציו, יש למצפות את הדגימות בשכבה דקה של זהב או זהב/פלדיום.
9. הדמיית SBEM
- הנח את הסיכה עם דגימה לתוך התא של מיקרוסקופ אלקטרונים סורק פני בלוק סדרתי. יישר את הדגימה לסכין. סגור את התא והגדר את הפרמטרים.
- לאסוף ערימה של תמונות בהגדלה הרצויה, גודל פיקסל, עובי פרוסה, מתח מואץ (EHT), צמצם, לחץ, וכו '.
הערה: הפרמטרים תלויים במדגם ובמטרת הניסוי. הגדרות הדמיה ראשוניות למופת כלולות בטבלת החומרים.
10.3D שחזורים
הערה: עבור השלבים המוזכרים להלן אנו משתמשים בתוכנה פתוחה למשל פיג'י17 (ImageJ גירסה 1.49b), דפדפן תמונה מיקרוסקופי (MIB)18 ושחזור19 אך ניתן להשתמש בתוכנות שונות אחרות.
- המר קבצי מיקרוגרף דיגיטלי (dm) לתבנית TIFF. תחילה יבא את רצף התמונה (בפיג'ג': רצף > קבצים ייבוא > תמונה > בחר תבנית 8 סיביות) ולאחר מכן שמור כ- TIFF (בפיג'ג': קובץ > שמור כרצף תמונות > > בחר Tiff).
- כוונן את הבהירות ואת הניגודיות של ערימת התמונות (בפיג'ג': תמונה > כוונן > בהירות/ניגודיות)ובמידת הצורך, תזלזל בה (השתמש בתוסף DenoisEM עבור FijJ20 : תוספים > DenoiseEM > Denoise).
- ישר את המחסנית (בפיג'ג': תוספים > StagReg או MIB: ערכות נתונים > כלי יישור).
- קוצים וסינפסות של מגזרי שוק (בתוכנת MIB או שחזור, ערכות לימוד מקיפות זמינות (ראה טבלת חומרים לקבלת פרטים).
תוצאות
באמצעות השיטה המתוארת מעל ניגודיות גבוהה, תמונות ברזולוציה טובה של רקמת המוח העכבר ניתן להשיג. שדה ראייה גדול המסופק על ידי טכניקת SBEM מאפשר בחירה מדויקת של אזור העניין. התמונה הגדולה של אזור CA1 של ההיפוקמפוס נלקחה כדי למדוד את אורך הרדיאטור (SR)(איור 2A)ולהגדיר את ההדמיה ?...
Discussion
ישנן וריאציות רבות של שיטת NCMIR העיקרית המתוארת על ידי Deerinck בשנת 201010. העקרונות הבסיסיים נשארים זהים, אך בהתאם לסוג החומר הנלמד, מיושמים שינויים קלים. זה תואר בעבר כי שרפים שונים ניתן להשתמש כדי להטמיע דגימות עבור SBEM למשל במקרה של צמחים, Spurr של הוא שרף של בחירה בשל הצמיגות הנמוכה ש...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
הדמיית SBEM, הדמיית מיקרוסקופיה קלה והכנת דגימת מיקרוסקופיה אלקטרונית בוצעו עם שימוש בציוד של המעבדה לרקמת הדמיה ותפקוד המשמשת כמתקן ליבה הדמיה במכון ננקי לביולוגיה ניסויית.
להכנת איור 1 נעשה שימוש בתמונה של עכבר (Souris_02) ובבינה מבית https://smart.servier.com/.
עבודה זו נתמכה על ידי מרכז המדע הלאומי (פולין) גרנט אופוס (UMO-2018/31/B/NZ4/01603) שהוענק ל- KR.
Materials
| Name | Company | Catalog Number | Comments |
| Anesthetic: | |||
| Ketamine/xylazine mixture (Ketamina/Sedazin) | Biowet Pulawy, Pulawy, Poland | ||
| Sodium pentobarbital (Morbital) | Biowet Pulawy, Pulawy, Poland | ||
| Fixatives: | |||
| Glutaraldehyde (GA) | Sigma-Aldrich,St. Louis, MI, USA | G5882 | Grade I, 25% in H2O, specially purified for use as an electron microscopy fixative |
| Hydrochloric acid (HCl) | POCH, Gliwice, Poland | 575283115 | pure p.a. |
| Paraformaldehyde (PFA) | Sigma-Aldrich,St. Louis, MI, USA | 441244 | prilled, 95% |
| Phosphate buffered saline (PBS), pH 7.4 | Sigma-Aldrich,St. Louis, MI, USA | P4417-50TAB | tablets |
| Sodium hydroxide (NaOH) | Sigma-Aldrich,St. Louis, MI, USA | S5881 | reagent grade,  98%, pellets (anhydrous) 98%, pellets (anhydrous) |
| Sodium phosphate dibasic (Na2HPO4) | Sigma-Aldrich,St. Louis, MI, USA | S3264 | |
| Sodium phosphate monobasic (NaH2PO4) | Sigma-Aldrich,St. Louis, MI, USA | S3139 | |
| Perfusion: | |||
| Large blunt/blunt curved scissors (~14.5 cm) | Fine Science Tools, Foster City, CA, USA | 14519-14 | |
| Micro-spatula (double 2" flat ends, one rounded, one tapered to 1/8") | Fine Science Tools, Foster City, CA, USA | 10091-12 | |
| Needle tip, 15 GA, blunt (perfusion needle) | KD Medical GmbH Hospital Products, Berlin, Germany | KD-FINE 900413 | 1.80 x 40 mm |
| Pair of fine (Graefe) tweezers | Fine Science Tools, Foster City, CA, USA | 11050-10 | |
| Perfusion pump | Lead Fluid | BQ80S | |
| Plastic vials | Profilab, Warsaw, Poland | 534.02 | plastic vials with blue cap for tissue storage, 20 ml, 31 x 48 mm |
| Straight iris scissors (~9 cm) | Fine Science Tools, Foster City, CA, USA | 14058-11 | |
| Brain slices preparation for EM: | |||
| 12-well plate | NEST, Rahway, NJ, USA | 712001 | |
| Cyanoacrylic glue | Fenedur, Montevideo, Uruguay | ||
| Glass vials | Electron Microscopy Sciences, Hatfield, PA, USA | 72632 | 20 ml Scintillation Vial, a pack of 100 |
| Pasteur pipette | VWR, Radnor, PA, USA | 612-4545 | LDPE, disposable, 7.5 ml |
| Razor blade | Wilkinson Sword, London, UK | Classic double edge safety razor blades | |
| Scalpel blade | Swann-Morton, Sheffield, UK | No. 20 | |
| Vibratome | Leica Microsystems, Vienna, Austria | Leica VT1000 S | |
| Brain slices preparation for IF: | |||
| 96-well plate | NEST, Rahway, NJ, USA | 701101 | |
| Criostat | Leica Microsystems, Vienna, Austria | Leica CM 1950 | |
| Ethylene glycol | Bioshop, Burlington, Canada | ETH001 | |
| Low-profile disposable blade 819 | Leica Biosystems Inc., USA | 14035838925 | |
| Scalpel blade | Swann-Morton, Sheffield, UK | No. 20 | |
| Sodium azide (NaN3) | POCH, Gliwice, Poland | 792770426 | |
| Sucrose | POCH, Gliwice, Poland | 772090110 | |
| Tissue freezing medium for cryosectioning, OCT-Compound | Leica Biosystems, Switzerland | 14020108926 | |
| Immunostaining: | |||
| 24-well plate | NEST, Rahway, NJ, USA | 702001 | |
| Anti-Post Synaptic Density Protein 95 Antibody | Merck-Millipore, Burlington, MA, USA | MAB1598 | |
| Confocal microscope | Zeiss, Göttingen, Germany | Zeiss Spinning Disc microscope (63 × oil objective, NA 1.4, pixel size 0.13 µm × 0.13 µm) | |
| Cover slide | Menzel Glaser, Braunschweig, Germany | B-1231 | 24 x 60 mm |
| Donkey anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 555 | Invitrogen, Carlsbad, CA, USA | A31570 | |
| Fluoromount-G Mounting Medium, with DAPI | Invitrogen, Carlsbad, CA, USA | 00-4959-52 | |
| Microscope slide | Thermo Scientific, Waltham, MA, USA | AGAA00008 | SuperFrost |
| Normal donkey serum (NDS) | Jackson ImmunoResearch Laboratories, West Grove, PA, USA | 017-000-121 | |
| Shaker | JWElectronic, Warsaw, Poland | KL-942 | |
| TritonT X-100 Reagent Grade | Bioshop, Burlington, Canada | TRX506 | |
| Electron microsocpy sample preparation | |||
| Potassium hexacyanoferrate(II) trihydrate | POCH, Gliwice, Poland | 746980113 | |
| Aclar 33C Film | Electron Microscopy Sciences, Hatfield, PA, USA | 50425 | Fluoropolymer Film embedding sheet |
| DMP-30, 2,4,6-Tris(dimethylaminomethyl)phenol | Sigma-Aldrich,St. Louis, MI, USA | T58203 | Epoxy embedding medium accelerator |
| Durcupan ACM single component A, M | Sigma-Aldrich,St. Louis, MI, USA | 44611 | Durcupan ACM single component A, M epoxy resin |
| Durcupan ACM single component B | Sigma-Aldrich,St. Louis, MI, USA | 44612 | Durcupan ACM single component B, hardener 964 |
| Durcupan ACM single component D | Sigma-Aldrich,St. Louis, MI, USA | 44614 | Durcupan ACM single component D , plasticizer |
| Ethyl alcohol absolute | POCH, Gliwice, Poland | 64-17-5 | Ethyl alcohol absolute 99.8 % pure P.A.-BASIC |
| Genlab laboratory oven | Wolflabs, York, UK | Mino/18/SS | Oven Genlab MINO/18/SS 18l volume, no fan circulation, no digital display, standard temperature gradient, standard recovery rate, no timer, 250°C maximum temperature, 240V electrical supply |
| L-Aspartic acid | Sigma-Aldrich,St. Louis, MI, USA | A-9256 | reagent grade,  98% (HPLC) 98% (HPLC) |
| Lead (II) nitrate | Sigma-Aldrich,St. Louis, MI, USA | 467790 |  99.95% trace metals basis 99.95% trace metals basis |
| Osmium tetroxide | Sigma-Aldrich,St. Louis, MI, USA | 75632 | for electron microscopy, 4% in H2O |
| pH meter | Elmetron, Zabrze, Poland | CP-5-5 | |
| Rotator | BioSan, Józefów, Poland | Multi Bio RS-24 | rotator Multi Bio RS-24 |
| Sodium hydroxide (NaOH) | Sigma-Aldrich,St. Louis, MI, USA | S5881 | reagent grade,  98%, pellets (anhydrous) 98%, pellets (anhydrous) |
| Sunflower mini shaker | Grant bio, Shepreth,UK | PD-3D | |
| Syringe filter | Millipore, Burlington, MA, USA | SLGP033NB | 0,22 µm pore size |
| Thiocarbohydrazide | Sigma-Aldrich,St. Louis, MI, USA | 88535 | purum p.a., for electron microscopy,  99.0% (N) 99.0% (N) |
| Uranyl acetate | Serva, Heidelberg, Germany | 77870 | Uranyl acetate·2H2O, research grade |
| Water bath | WSL, Swietochlowice, Poland | LWT | |
| Specimen mounting for SBEM | |||
| 96-well culture plate | VWR, Radnor, PA, USA | 734-2782 | 96-well plates, round bottom, non treated |
| AM Gatan 3View stub handling tweezers | Micro to Nano, Haarlem, Netherlands Netherlands | 50-001521 | |
| Binocular | OPTA-TECH, Warsaw, Poland | X2000 | |
| Conductive glue | Chemtronics, Georgia, USA | CW2400 | conductive eopxy |
| Gatan 3View sample pin stubs | Micro to Nano, Haarlem, Netherlands Netherlands | 10-006003 | |
| Parafilm | Sigma-Aldrich,St. Louis, MI, USA | P7793 | roll size 20 in. × 50 ft |
| Pelco conductive silver paint | Ted Pella, Redding, CA, USA | 16062-15 | PELCO® Conductive Silver Paint, 15g |
| Razor blades double edge | Electron Microscopy Sciences, Hatfield, PA, USA | 72000 | Stainless Steel "PTFE" coated. PERSONNA brand .004" thick, wrapped individually, 250 blades in a box. |
| Scanning Electron Microscope | Zeiss, Oberkochen, Germany | Sigma VP with Gatan 3View2 chamber, acceleration voltage 2.5 kV, variable pressure 5 Pa, aperture 20 µm, dwell time 6 µs, slice thickness 60 nm, magnification 15 000 x, image resolution 2048 x 2048 pixels, pixel size 7.3 nm | |
| trim 90° diamond knife | Diatome Ltd., Nidau, Switzerland | DTB90 | |
| Ultramicrotome | Leica Microsystems, Vienna, Austria | Leica ultracutR | |
| Software | webpage | tutorials | |
| FijiJ | https://fiji.sc/ | ||
| Microscopy Image Browser | http://mib.helsinki.fi/ | http://mib.helsinki.fi/tutorials.html | |
| Reconstruct | https://synapseweb.clm.utexas.edu/software-0 | https://synapseweb.clm.utexas.edu/software-0) | |
| Animals | |||
| Mice | Adult 3-month old and 20±1 month old female Thy1-GFP(M) mice (Thy1-GFP +/-) (Feng et al.,2000) which express GFP in a sparsely distributed population of glutamatergic neurons. Animals were bred as heterozygotes with the C57BL/6J background in the Animal House of the Nencki Institute of Experimental Biology. |
References
- Bosch, M., Hayashi, Y. Structural plasticity dendritic spines. Current Opinion in Neurobiology. 22 (3), 383-388 (2012).
- Borczyk, M., Radwanska, K., Giese, K. P. The importance of ultrastructural analysis of memory. Brain Research Bulletin. 173, 28-36 (2021).
- Wanner, A. A., Kirschmann, M. A., Genoud, C. Challenges of microtome-based serial block-face scanning electron microscopy in neuroscience: challenges of SBEM in neuroscience. Journal of Microscopy. 259 (2), 137-142 (2015).
- Śliwińska, M. A., et al. Long-term Memory Upscales Volume of Postsynaptic Densities in the Process that Requires Autophosphorylation of αCaMKII. Cerebral Cortex. 30 (4), 2573-2585 (2020).
- Borczyk, M., Śliwińska, M. A., Caly, A., Bernas, T., Radwanska, K. Neuronal plasticity affects correlation between the size of dendritic spine and its postsynaptic density. Scientific Reports. 9 (1), 1693 (2019).
- Leighton, S. B. SEM images of block faces, cut by a miniature microtome within the SEM - a technical note. Scanning Electron Microscopy. , 73-76 (1981).
- Denk, W., Horstmann, H. Serial Block-Face Scanning Electron Microscopy to Reconstruct Three-Dimensional Tissue Nanostructure. PLoS Biology. 2 (11), 329 (2004).
- Smith, D., Starborg, T. Serial block face scanning electron microscopy in cell biology: Applications and technology. Tissue and Cell. 57, 111-122 (2019).
- Titze, B., Genoud, C. Volume scanning electron microscopy for imaging biological ultrastructure: Volume scanning electron microscopy. Biology of the Cell. 108 (11), 307-323 (2016).
- Deerinck, T. J., Bushong, E. A., Thor, A., Ellisman, M. H. . NCMIR methods for 3D EM: A new protocol for preparation of biological specimens for serial block face scanning electron microscopy. , 6-8 (2010).
- Willingham, M. C., Rutherford, A. V. The use of osmium-thiocarbohydrazide-osmium (OTO) and ferrocyanide-reduced osmium methods to enhance membrane contrast and preservation in cultured cells. Journal of Histochemistry & Cytochemistry. 32 (4), 455-460 (1984).
- Feng, G., et al. Imaging Neuronal Subsets in Transgenic Mice Expressing Multiple Spectral Variants of GFP. Neuron. 28 (1), 41-51 (2000).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Paxinos, G., Franklin, K. B. J. . The mouse brain in stereotaxic coordinates. , (2004).
- Walton, J. Lead aspartate, an en bloc contrast stain particularly useful for ultrastructural enzymology. Journal of Histochemistry & Cytochemistry. 27 (10), 1337-1342 (1979).
- Mercer, E. H. a scheme for section staining in electron microscopy. Journal of the Royal Microscopical Society. 81 (3-4), 179-186 (1963).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Belevich, I., Joensuu, M., Kumar, D., Vihinen, H., Jokitalo, E. Microscopy Image Browser: A Platform for Segmentation and Analysis of Multidimensional Datasets. PLOS Biology. 14 (1), 1002340 (2016).
- Fiala, J. C. Reconstruct: a free editor for serial section microscopy. Journal of Microscopy. 218 (1), 52-61 (2005).
- Roels, J., et al. An interactive ImageJ plugin for semi-automated image denoising in electron microscopy. Nature Communications. 11 (1), 771 (2020).
- Radwanska, K., et al. Mechanism for long-term memory formation when synaptic strengthening is impaired. Proceedings of the National Academy of Sciences. 108 (45), 18471-18475 (2011).
- Kittelmann, M., Hawes, C., Hughes, L. Serial block face scanning electron microscopy and the reconstruction of plant cell membrane systems: SBFSEM Methods for Plant Cells. Journal of Microscopy. 263 (2), 200-211 (2016).
- Fendrych, M., et al. Programmed Cell Death Controlled by ANAC033/SOMBRERO Determines Root Cap Organ Size in Arabidopsis. Current Biology. 24 (9), 931-940 (2014).
- Russell, M. R. G., et al. 3D correlative light and electron microscopy of cultured cells using serial blockface scanning electron microscopy. Journal of Cell Science. 130 (1), 278-291 (2017).
- Płachno, B. J., Świątek, P., Jobson, R. W., Małota, K., Brutkowski, W. Serial block face SEM visualization of unusual plant nuclear tubular extensions in a carnivorous plant (Utricularia, Lentibulariaceae). Annals of Botany. 120 (5), 673-680 (2017).
- Genoud, C., Titze, B., Graff-Meyer, A., Friedrich, R. W. Fast Homogeneous En Bloc Staining of Large Tissue Samples for Volume Electron Microscopy. Frontiers in Neuroanatomy. 12, (2018).
- Puhka, M., Joensuu, M., Vihinen, H., Belevich, I., Jokitalo, E. Progressive sheet-to-tubule transformation is a general mechanism for endoplasmic reticulum partitioning in dividing mammalian cells. Molecular Biology of the Cell. 23 (13), 2424-2432 (2012).
- Gluenz, E., Wheeler, R. J., Hughes, L., Vaughan, S. Scanning and three-dimensional electron microscopy methods for the study of Trypanosoma brucei and Leishmania mexicana flagella. Methods in Cell Biology. 127, 509-542 (2015).
- Starborg, T., et al. Using transmission electron microscopy and 3View to determine collagen fibril size and three-dimensional organization. Nature Protocols. 8 (7), 1433-1448 (2013).
- Hughes, L., Borrett, S., Towers, K., Starborg, T., Vaughan, S. Patterns of organelle ontogeny through a cell cycle revealed by whole-cell reconstructions using 3D electron microscopy. Journal of Cell Science. 130 (3), 637-647 (2017).
- Bojko, A., et al. Improved Autophagic Flux in Escapers from Doxorubicin-Induced Senescence/Polyploidy of Breast Cancer Cells. International Journal of Molecular Sciences. 21 (17), 6084 (2020).
- Knott, G. W., Holtmaat, A., Trachtenberg, J. T., Svoboda, K., Welker, E. A protocol for preparing GFP-labeled neurons previously imaged in vivo and in slice preparations for light and electron microscopic analysis. Nature Protocols. 4 (8), 1145-1156 (2009).
- Glauert, A. M., Lewis, P. R. . Biological specimen preparation for transmission electron microscopy. , (2014).
- Genoud, C. Altered Synapse Formation in the Adult Somatosensory Cortex of Brain-Derived Neurotrophic Factor Heterozygote Mice. Journal of Neuroscience. 24 (10), 2394-2400 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved