Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Dendritik Dikenlerin Çalışması için Seri Blok-Yüz Tarama Elektron Mikroskopisi (SBEM)
Bu Makalede
Özet
Murine hipokampustaki dendritik dikenleri görüntülemek ve analiz etmek için Seri Blok-Yüz Tarama Elektron Mikroskopisi (SBEM) uygulanır.
Özet
Üç boyutlu elektron mikroskopisi (3D EM), dendritik dikenlerin morfolojik parametrelerini nano ölçekli çözünürlükle analiz etme imkanı sunar. Ek olarak, dendritik dikenlerin hacmi ve sinaptik yoğunluk sonrası (PSD) (sinapsın post-sinaptik kısmını temsil eden), presynaptik terminalin varlığı ve PSD'nin pürüzsüz endoplazmik retikülum veya atipik formu (örneğin, çok içli omurgalar) gibi bazı özellikleri sadece 3D EM ile gözlemlenebilir. Seri blok yüz taramalı elektron mikroskopisi (SBEM) kullanarak, 3D EM verilerini geleneksel seri kesitleme yaparken olduğundan daha kolay ve tekrarlanabilir bir şekilde elde etmek mümkündür. Burada fare hipokampal örneklerinin SBEM analizi için nasıl hazırlanacağını ve bu protokolün dendritik dikenlerin immünofluoresans çalışması ile nasıl birleştirilebileceğini gösteriyoruz. Hafif fiksasyon perfüzyonu beynin bir yarısına hafif mikroskopi ile immünofluoresans çalışmaları yapmamızı sağlarken, diğer yarısı SBEM için hazırlanmıştır. Bu yaklaşım, çalışma için kullanılacak hayvan sayısını azaltır.
Giriş
Merkezi sinir sistemindeki uyarıcı sinapsların çoğu dendritik dikenler üzerinde bulunur - bir nöronal zarın küçük çıkıntıları. Bu çıkıntılar hücre içi sinyal transdüksiyonu kontrol eden sınırlı biyokimyasal bölmeler oluşturur. Dendritik dikenlerin ve sinapsların yapısal plastisitesi, öğrenme ve hafıza gibi önemli süreçlerin altında yatan sinaptik etkinlikteki fonksiyonel değişikliklerle yakından ilgilidir1,2. Elektron mikroskopisinin (EM) dendritik bir omurganın presynaptik bir girişi olup olmadığını belirlemeye izin veren tek teknik olduğunu belirtmek önemlidir. EM çözünürlüğü, bir sinapsın postynaptik bir kısmını temsil eden postsinaptik yoğunluğun (PSD) şekli veya dendritik bir omurganın boyutlarının yanı sıra bir aksonal boutonun boyutu ve şekli gibi ultrayapısal ayrıntıları incelemek için de gereklidir. Ek olarak, EM ile sinapsları ve çevrelerini görselleştirmek mümkündür.
Görüntüleme ve bilgi işlem teknolojilerindeki gelişmeler sayesinde tüm sinir devrelerini yeniden oluşturmak mümkündür. Nöronal devre rekonstrüksiyonlarında seri kesit iletim elektron mikroskopisi (ssTEM), seri blok yüz taramalı elektron mikroskopisi (SBEM) ve odaklanmış iyon ışını tarama elektron mikroskopisi (FIB-SEM) gibi hacimli elektron mikroskopi teknikleri yaygın olarak kullanılmaktadır3.
Çalışmalarımızda, fare hipokampus ve organotipik beyin dilimleri örneklerinde dendritik dikenlerin ve PSD'lerin yapısal plastisitesini araştırmak için SBEM yöntemibaşarıyla4 ,5. SBEM, taramalı elektron mikroskop odası 6 ,7,8,9'uniçine minyatür bir ultramikrotomkurulumunadayanmaktadır. Örnek bloğun üst kısmı görüntülenir ve daha sonra numune ultramikrotom tarafından belirtilen derinlikte kesilir, tekrar görüntülenen ve daha sonra işlem tekrarlanan yeni bir blok yüzü ortaya çıkar8. Sonuç olarak, kesilen dilim enkaz olarak kaybolurken yalnızca bir blok yüzünün görüntüsü bırakılır. Bu nedenle SBEM yıkıcı bir teknik olarak adlandırılır, yani aynı yeri tekrar imgelemek mümkün değildir. Bununla birlikte, yıkıcı blok üzerindeki yöntemlerin avantajı, veri kalitesini ve veri analizini önemli ölçüde etkileyebilecek çarpıtma sorunlarından ve kesit kaybından muzdarip olmamasıdır3. Ayrıca, SBEM yüksek çözünürlükte nispeten geniş bir görüş alanı (> 0,5 mm × 0,5 mm) görüntüleme imkanı verir3.
SBEM'i çalıştırmak için, numunelerin görüntü almak için kullanılan arkadan saçılmış elektron dedektörü nedeniyle özel, son derece zıt bir protokole göre hazırlanması gerekir. 1980'lerde geliştirilen azaltılmış osmium-tiyokarbohidrazür-osmiyum (rOTO) lekeleri kullanılarak Deerinck 10 (Ulusal Mikroskopi ve Görüntüleme Araştırmaları Merkezi (NCMIR) yöntemi ile geliştirilen bir prosedüre dayanan protokole göre numune hazırlamanın nasıl gerçekleştirildiğini burada gösteriyoruz. Buna ek olarak, hafif fiksasyon perfüzyonu ile hem hafif mikroskopi hem de SBEM ile immünofluoresans çalışmaları için aynı beyni kullanmaya izin veren iki aşamalı bir fiksasyon yaklaşımı sunuyoruz.
Protokolde bir fare beyni öncelikle hafif bir fiksatif ile sabitlenir ve daha sonra yarıya indirilir ve bir yarımküre, em çalışmaları için iken, bir yarımküre postfixed ve immünofluoresans (IF) için hazırlanır (Şekil 1).
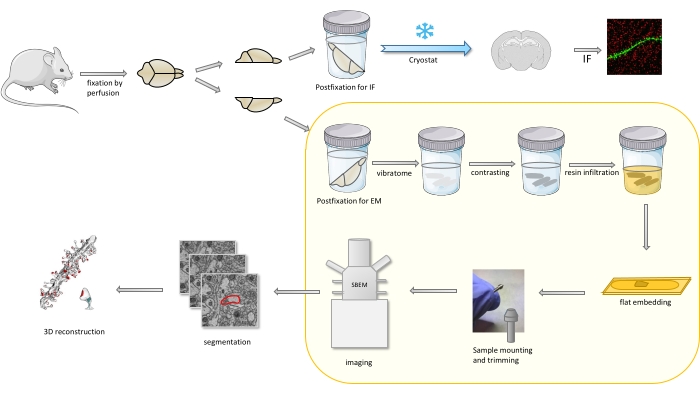
Şekil 1. SBEM ile analiz için dendritik diken hazırlığı için iş akışının şematik gösterimi. Fareler kurban edildi ve hafif bir birincil fiksatif ile perfüzyon yapıldı. Beyin yarıya indirildi ve bir yarımküreye immünofluoresans (IF)- adanmış fiksatif, kriyoproteksk, kriyostat kullanılarak dilimlenmiş ve IF çalışmaları için işlenmiş, diğer yarımküre ise EM fiksatif ile yapıştırılmış, vibratom ile dilimlenmiş ve EM çalışmaları için hazırlanmıştır. SBEM çalışmaları için beyin dilimleri kontrast oluşturmuş, reçineye gömülü düz, daha sonra hipokampüsün bir CA1 bölgesi pime monte edilmiş ve SBEM ile görüntülenmiştir (Şekil 1). Protokolün sarı bir kutuda vurgulanan kısmı videoda yer aldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protokol
Araştırma, Nencki Enstitüsü yönergelerine ve Yerel Etik Komitesi'nin iznine uygun olarak gerçekleştirildi. Çalışmalar, 24 Kasım 1986 (86/609/EEC) avrupa topluluklar konseyi direktifi, Polonya Hayvanları Koruma Yasası uyarınca yürütülmüş ve Varşova'daki ilk Yerel Etik Komitesi tarafından onaylanmıştır. Kullanılan hayvan sayısını ve acılarını en aza indirmek için tüm çabalar sarf edildi.
DİkKAT: Aşağıda açıklanan tüm prosedürler laboratuvar dumanı davlumbazında yapılmalıdır. Kullanılan reaktiflerin tehlikeli doğası nedeniyle. Eldiven, laboratuvar önlüğü, güvenlik gözlüğü ve yüz maskesi gibi kişisel güvenlik önlemleri gereklidir.
1. Perfüzyon için fiksatif hazırlanması (0.1 M fosfat tamponunda (PB), pH 7.4'te perfüzyon (%2 wt/vol paraformaldehit (PFA) ve %0.5 vol/vol glutaraldehit (GA)
NOT: Fiksatif çözeltiyi kullanılacağı gün hazırlayın ve 3 saatten daha uzun süre saklamayın. Zaman sıkıntısı durumunda, bir gün önce 0,1 M PB'de% 2 PFA hazırlayın, 4 ° C'de saklayın ve perfüzyondan kısa bir süre önce taze GA ekleyin.
- 400 mL steril çift damıtılmış su (ddH2O) alın ve karıştırmalı bir sıcak plaka kullanarak 60 °C'ye ısıtın. Ardından 20 g PFA ekleyin. PFA tamamen çözünene kadar 1 M NaOH damlaları ekleyin ve karışımın soğumasını bekleyin.
- 500 mL 0,2 M PB (pH 7,4) ekleyin.
- Herhangi bir tortuyu çıkarmak için çözeltiyi filtreleyin ve 4 °C'ye soğutun.
- Perfüzyondan hemen önce, çözeltiye% 25 GA'nın 20 mL'sini ekleyin ve ardından hacmi ddH 2 O ile1L'ye yükseltin.
2. SBEM için postperfüzyon fiksatifinin hazırlanması (0,1 M PB, pH 7,4'te % 2 wt/vol PFA ve % 2,5 vol/vol GA)
- Perfüzyon için 50 mL fiksatif alın (0,1 M PB'de %2 PFA ve %0,5 GA).
- %25 GA'nın 5 mL'sini ekleyin.
3. IF boyama için postperfüzyon fiksatifinin hazırlanması (fosfat tamponlu salinde (PBS) %4 PFA)
- 1x PBS (pH 7.4) tableti üretici talimatlarına göre arıtılmış ve deiyonize bir suda (H2O) çözün.
- Çözeltiyi 60 °C'ye ısıtmak ve 40 g PFA eklemek için karıştırmalı bir sıcak plaka kullanın.
- PFA tamamen çözünene kadar 1 M NaOH damlaları ekleyin ve karışımın soğumasını bekleyin.
- Çözeltinin pH'ını 1 M HCl ile 7,5'e ayarlayın, ardından H 2 O ile1L'ye kadar ses seviyesini ayarlayın.
- Tortuları kaldırmak için çözeltiyi filtreleyin.
4. Hayvanların transkardiyal perfüzyonu
NOT: Tüm PFA ve GA atıkları yerel yönetmeliklere göre toplanmalı ve bertaraf edilmek üzere saklanmalıdır. Anestezi ve perfüzyon yerel yönetmeliklere uygun olmalıdır. Açıklanan protokolde yetişkin 3 aylık ve 20±1 aylık dişi Thy1-GFP(M) fareler (Thy1-GFP +/-)12 adet seyrek dağılmış glutamaterjik nöron popülasyonunda yeşil floresan proteini (GFP) ifade eden ancak diğerleri de kullanılabilir. Hayvanlar, Nencki Deneysel Biyoloji Enstitüsü Hayvan Evi'nde C57BL/6J arka planına sahip heterozygotlar olarak yetiştirildi.
- Perfüzyondan önce bir fareyi ketamin/ksilazin karışımı (90 mg/kg vücut ağırlığı ketamin ve 10 mg/kg vücut ağırlığı kslazine kadar) intraperitoneal enjeksiyon (27-gauge iğne) ile kullanarak uyuşturun.
- Ağrı uyaranlarına (sıkışma) ve kornea refleksine (şaşılık) karşı refleksi kontrol ederek anestezi derinliğinin yeterli olup olmadığını değerlendirin.
- 20 dakika sonra sodyum pentobarbital (50 mg/kg vücut ağırlığı) intraperitoneal enjeksiyon (27-gauge iğne) yapın.
- Bir fareyi Gage ve ark.13 tarafından açıklanan perfüzyon cerrahisi protokolüne göre perfüzyon edin (bkz. nokta 4; Şekil 5-6). Perfüzyon pompası kullanarak 0,1 M fosfat tamponu, 3 dakika boyunca pH 7,4 (30 mL) ile başlayın ve 0,1 M PB'de %2 PFA ve %0,5 GA ile devam edin, 6 dakika (80 mL) için pH 7,4.
- Beyni kafatasından hafifçe ayırın ve ikiye bölün (bkz. Gage ve ark., 201213).'deŞekil 9-10). Bir parçayı SBEM için fiksatif içeren bir şişeye, ikinci parçayı ise IF boyama için% 4 PFA / PBS ile şişeye yerleştirin.
- Yarımküreleri bir gecede 4 °C'de sabitleyicide tutun.
5. Elektron mikroskopisi için beyin dilimleri hazırlığı
- Vibratom ayarlarını seçin (bıçak hareket hızı: 0,075 mm/s, kesme frekansı: 80 Hz).
- Dilim haznesini tutucuya yerleştirin, vibratoğa takın ve buzla çevreleyin. Daha sonra vibratom bıçağı tutucusuna bir jilet yerleştirin.
- Bir kaşık veya benzer bir nesne kullanın ve soğutulmuş beyni (sırt yüzeyi yukarı) sert bir kesme yüzeyi (örneğin, cam bir Petri kabı kapağı) üzerine yerleştirin. Hipokampüsün koronal bir dilimini hazırlamak için serebral yarımküre ile beyincik arasında jilet veya neşterle dik bir kesim yapın, böylece beyincik çıkarılır. Koku ampulü de çıkarılabilir.
- Vibratomin kuru platformuna siyanoakrilat tutkal uygulayın.
- Beyni toparlayıp filtre kağıdına dikkatlice kurulayın.
- Yarımküreyi, rostral uç yukarı doğru kesme bıçağına yakın platforma yapıştırın. Platformu tutucuya takın ve hemen buz gibi 0,1 M PB, pH 7,4 ile doldurun. Dik kesim düzgün yapılırsa, yarımküre hipokampus içeren simetrik bir koronal kesim yapmak için gereken 90 ° açıyı sağlayarak düz durur. Beynin PB ile kaplı olduğundan emin olun.
- Vibratom bıçağını yarımkürenin önüne yerleştirin ve yarımkürenin koronal tarafına küs. Bıçağı kaudal yönde 400 μm daha aşağı 400 μm'ye küçümseyin ve dilimlemeye başlayın. İlk iki dilim doku bloğundan tamamen ayrılana kadar dilimlenmeye devam edin.
- Bıçağı geri çek ve 100 μm daha indir, sonra tekrar dilimle.
- Hipokampus görünür hale geldiğinde (fare beyin atlası Paxinos ve Franklin, 200414kullanın) dilimleri küçük boya fırçası veya genişlemiş plastik Pasteur pipet ile toplayın.
- Dilimleri soğuk 0,1 M PB, pH 7,4 ile doldurulmuş 12 kuyulu bir tabağa aktarın.
- Hipokampusu jilet veya neşter kullanarak 0,1 M PB, pH 7,4 ile doldurulmuş cam bir Petri kabında parçalara ayırın ve aynı fosfat tamponuna sahip cam şişelere koyun.
NOT: Dilimlerin uzun süreli depolanmasının %0,05 sodyum azit (NaN3)ile 0,1 M PB eklenmiş olması.
6. İmmünasyon için beyin örneği hazırlığı
- Duman kaputunda% 4 PFA / PBS çözeltisinde gece sabitlemeden sonra, beyin dokusunu kriyoprezervasyon çözeltisine koyun (% 0.05 NaN 3 ile PBS'de%30sakkaroz) ve 2 gün boyunca (batana kadar) 4 ° C'de tutun.
- Bir antifriz çözeltisi hazırlayın (%15 sakkaroz/%30 etilen glikol/%0,05 NaN3/PBS).
- Kriyostatın dolap sıcaklığını -19 °C olarak ayarlayın ve daha fazla ilerlemeden önce sıcaklığa ulaşıldığından emin olun. Kesit sırasında, kabin sıcaklığının -18 °C ile -20 °C arasında kaldığından emin olun.
- Bir kaşık veya benzer bir nesne kullanın ve soğutulmuş beyni (sırt yüzeyi yukarı) sert bir kesme yüzeyi (örneğin, cam bir Petri kabı kapağı) üzerine yerleştirin. Hipokampüsün koronal bir dilimini hazırlamak için serebral yarımküre ile beyincik arasında jilet veya neşterle dik bir kesim yapın, böylece beyincik çıkarılır.
- Önceden soğutulmuş bir numune diski seçin, bir serbest rafta donmak için bir ortamla örtün ve forseps kullanarak yarımküreyi diske rostral bir uçla yukarı doğru sabitlayın ve numune tamamen donana kadar bekleyin. Numune diskini bir numune kafasına yerleştirin.
- Kriyo haznesinin içindeki bir bıçak tutucuya bir bıçak takın ve 40 μm kalınlığında dilimler kesin.
- Küçük bir boya fırçası ile dilimleri soğuk anti-freeze çözeltisi ile doldurulmuş 96 kuyu plakasına aktarın ve bölümleri hafifçe açın (dilim odasında kaybolmalarını önlemek için her dilimleme turundan sonra bir dilim toplayın).
NOT: Beyinler veya bölümler -20 °C'de bir antifriz çözeltisinde uzun süre saklanabilir.
7. Beyin dilimlerinin immünostaining
NOT: Tüm boyama adımları bir platform çalkalayıcıda 24 kuyulu bir plakada gerçekleştirildi.
- Dilimleri PBS ile her seferinde 6 dakika boyunca üç kez yıkayın.
- Dilimleri 300 μL blokaj çözeltisinde (%5 normal eşek serumu (NDS)/%0,3 Triton X-100) bir rotatör üzerinde hafifçe sallanarak 1 saat boyunca kuluçkaya yatırın.
- 4 °C'de bir gecede %5 NDS/%0,3 Triton X-100/PBS (kuyu başına 300 μL) ile 1:500 seyreltilmiş PSD-95'e karşı birincil antikor ile dilimleri kuluçkaya yatırın. Birincil antikorun son konsantrasyonu 2 μg/mL'dir.
- Dilimleri oda sıcaklığında (RT) %0,3 Triton X-100/PBS ile her seferinde 6 dakika boyunca üç kez yıkayın.
- İkincil antikor ile dilimleri 90 dakika boyunca % 0,3 Triton X-100 / PBS'nin 300 μL'sinde 1:500 seyreltin. İkincil antikorun son konsantrasyonu 4 μg /mL'dir.
- Dilimleri PBS ile her seferinde 6 dakika boyunca üç kez yıkayın.
- Dilimleri bir montaj ortamı kullanarak slaytlara monte edin ve sonra bir kapak slaydı ile kapatın.
- Konfokal mikroskop kullanarak numuneleri inceleyin (63 × yağ hedefi, NA 1.4, piksel boyutu 0.13 μm × 0.13 μm).
NOT: Uzun süreli depolama için: numuneleri 4 °C'de tutun, ışıktan koruyun.
8. SBEM numune hazırlama
DİkKAT: Kullanılan reaktiflerin tehlikeli yapısı nedeniyle aşağıda açıklanan tüm prosedürler laboratuvar duman kaputunda yapılmalıdır. Bu kimyasalları kullanmadan önce, üreticiler tarafından sağlanan Malzeme Güvenliği Veri Sayfalarını dikkatlice okuyun ve güvenli kullanım ve atık bertarafını sağlamak için güvenlik görevlisine yerel kuralları sorun.
- Örnek karşıtlığı
NOT: Dilim yıkama ve oda sıcaklığı inkübasyonu hafif sallama ile yapılmalıdır (örneğin, bir platform çalkalayıcıda). Otoklav gazdan arındırılmış su kullanılmıştır.- Dilimleri her seferinde 3 dakika boyunca soğuk 0,1 M PB, pH 7,4 ile beş kez yıkayın.
- %4 sulu osmiyum tetroksit ve %3 potasyum ferrosiyanit karışımı hazırlayın (vol tarafından 1:1). Son ürün kahverengiye dönecektir. Örnekleri bu karışıma daldırin, buza yerleştirin ve bu aşamadan itibaren onları ışıktan korumak önemlidir. Onları 1 saat boyunca hafifçe sallayarak kuluçkaya yatırın.
- Bu arada bir tiyokarbohidrazid (TCH) çözeltisi hazırlayın. 10 mL çift damıtılmış H2O (ddH2O) ve 0,1 g TCH karıştırın ve 1 saat boyunca 60 °C'de ayarlanmış bir fırına yerleştirin. Çözeltiyi zaman zaman döndürmek önemlidir (örneğin, her 10 dakikada bir). Hazır olduğunuzda oda sıcaklığına soğutin.
- Dilimleri her seferinde 3 dakika boyunca beş kez ddH2O ile yıkayın.
- TCH çözümünü 0,22 μm şırındıcı filtre kullanarak filtreleyin ve numuneyi filtrelenmiş çözeltiye daldırın. Dilimler siyaha dönecek. Oda sıcaklığında 20 dakika kuluçkaya yatır.
- Numuneleri her seferinde 3 dakika boyunca beş kez ddH2O ile yıkayın.
- Numuneleri oda sıcaklığında 30 dakika boyunca% 2 sulu OsO4 çözeltisi ile kuluçkaya yatırın.
- Numuneleri her seferinde 3 dakika boyunca beş kez ddH2O ile yıkayın.
- Numuneleri filtrelenmiş % 1 sulu uranil asetat içine yerleştirin ve bir gecede 4 ° C'de kuluçkaya bırakın. Filtrasyon için 0,22 μm şırınna filtresi kullanın.
- 0,4 g L-aspartik asit ve 80 mL ddH2O karıştırarak L-aspartik asit çözeltisini hazırlayın, daha kolay çözünmesi için pH'ı 3,8'e ayarlayın ve ardından 100 mL'ye kadar suyla toplayın.
- Ertesi gün, Walton'ın15 hazırlıkla başla. 0.066 g kurşun nitratı 10 mL L-aspartik asit çözeltisi (nokta 8.1.10) ile 60 °C'ye önceden ısıtılmış olarak karıştırın ve pH'ı 1 M NaOH ile 5.5'e (60 °C'de ölçülür) ayarlayın. Şişeyi kurşun aspartat ile kapatın ve bir su banyosunda 30 dakika boyunca 60 °C'de bırakın. Çözüm açık olmalı. Bulutlu hale gelirse, atılmalıdır ve yeni bir tane hazırlanmalıdır.
- Bu arada, numuneleri gazsız ddH ile2O ile her seferinde 3 dakika boyunca beş kez yıkayın. Daha sonra 60 °C'de ayarlanmış fırında 30 dakika bekletin.
- Numuneleri taze hazırlanmış kurşun aspartat çözeltisine daldırin ve 60 °C'de 20 dakika boyunca fırına inkübte edin.
- Numuneleri gazsız ddH ile2O ile her seferinde 3 dakika boyunca beş kez yıkayın.
- Dehidrasyon ve reçine gömme
- Epoksi reçinesi hazırlayın. 16 damla hızlandırıcı DMP 30 eklemeden önce malzemeleri (33,3 g bileşen A/M, 33,3 g bileşen B ve 1 g bileşen D) tartın ve reçineyi iyice karıştırın (örneğin, 15 mL'lik bir tüpte döner çalkalayıcı üzerinde çalkalayın). 10 dakika daha karıştırın.
NOT: Duman kaputunun altındaki malzemeleri tartın. Bu miktarda bileşen, numuneli 15 şişe için yeterli olan yaklaşık 60 mL reçine verir. Reçinenin geri kalanını daha az hazırlayabilir veya 4 °C'de bir şırınnada saklayabilir ve ertesi gün kullanabilirsiniz. Şırındağının ucunu mühürlemeyi unutma. - Etanol dereceli seyreltmeler ile şişeler hazırlayın (%30, %50, %70, %90, %100, suda %100 etanol ve %100 moleküler elek üzerinde kurutulmuş).
- %50 reçine elde etmek için reçineyi 1:1 oranında %100 etanol ile karıştırın. İyice karıştırın.
- Numuneleri% 30'dan başlayarak ve moleküler elek üzerinde kurutulan% 100 susuz etanol ile biten her etanol seyreltmesinde 5 dakika susuz bırakın. Unutmayın, numuneler asla tamamen kurumamalıdır.
- Örneklere ilk olarak 30 dakika boyunca %50 reçine, bir saat boyunca %100 reçine ve bir gecede tekrar %100 reçine ile sızın. Tüm sızma adımlarını sürekli yavaş sallanarak gerçekleştirin.
- Ertesi gün, örnekleri bir saat boyunca taze% 100 reçineye yerleştirin ve daha sonra floropolimer gömme levhaları arasına gömün. Etanol ile gömme levha parçalarını yağdan arındırın ve destek olarak iki cam slayt kullanarak numuneleri iki katmanın arasına düz bir şekilde gömün. Numunenin üzerinde veya yakınında reçinede hava kabarcıklarından kaçınmaya çalışın.
- Numuneleri 70 °C'de fırında en az 48 saat boyunca iyileştirin.
- Epoksi reçinesi hazırlayın. 16 damla hızlandırıcı DMP 30 eklemeden önce malzemeleri (33,3 g bileşen A/M, 33,3 g bileşen B ve 1 g bileşen D) tartın ve reçineyi iyice karıştırın (örneğin, 15 mL'lik bir tüpte döner çalkalayıcı üzerinde çalkalayın). 10 dakika daha karıştırın.
- Kırpma ve montaj
- Gömme levhalarını ayırın ve gömülü numunenin bir parçasını (yaklaşık 1 mm x 1 mm) jiletle kesin. Parafilme aktarın. Bu, elektrostatik nedeniyle numuneyi kaybetme tehlikesini en aza indirecektir.
- Etanol ile yağdan arındırılmış bir alüminyum pim alın. İltifatlı bir epoksiyi iyice karıştırın ve numuneyi pime monte etmek için biraz kullanın. 70 °C'de iletken epoksiyi 10 dakika boyunca tedavi edin.
- Örnek bloğun her iki tarafını elmas bıçakla kesin ve doku açığa olana kadar bloğun yüzünü parlatın.
NOT: Bu adımda, bazı bölümleri toplayarak ve toluidin mavisi boyama16 gerçekleştirerek veya elektron mikroskobu altında kontrol ederek ilgi çekici bir bölgenin varlığını onaylayın. - Numunenin boyutunu mümkün olduğunca azaltın. Daha sonra numuneyi iletken boya ile pime topraklayın ve tedavi etmenin (oda sıcaklığında 24 saat veya 65 °C'de fırında 40 dakika).
- Şarj yapıtlarını en aza indirmek için, numuneleri ince bir altın veya altın/paladyum tabakasıyla kaplayın.
9. SBEM görüntüleme
- Bir örnekle pimi seri blok yüz tarama elektron mikroskobu odasına yerleştirin. Örneği bıçağa hizalayın. Bölmeyi kapatın ve parametreleri ayarlayın.
- İstediğiniz büyütme, piksel boyutu, dilim kalınlığı, hızlandırılmış voltaj (EHT), diyafram, basınç vb.
NOT: Parametreler örneğe ve denemenin amacına bağlıdır. Örnek ilk görüntüleme ayarları malzeme tablosuna dahildir.
10.3D yeniden yapılanmalar
NOT: Aşağıda belirtilen adımlar için FijiJ17 (ImageJ sürüm 1.49b), Mikroskopi Görüntü Tarayıcısı (MIB)18 ve Reconstruct19 gibi açık erişimli yazılımlar kullanıyoruz, ancak çeşitli başka yazılımlar kullanılabilir.
- Dijital mikrograf (dm) dosyalarını TIFF formatına dönüştürün. Önce görüntü sırasını içe aktarın (FijiJ' de: Dosya > > Görüntü sırasını içe aktarın > 8 Bit Biçimi Seçin)ve ardından TIFF olarak kaydedin (FijiJ: Dosya > > Görüntü Sırası Olarak Kaydet > Tiff'i Seçin).
- Görüntü yığınının parlaklığını ve kontrastını ayarlayın (FijiJ: Görüntü > > Parlaklığını / Kontrastını Ayarlayın)ve gerekirse denoise (FijJ20 için DenoisEM eklentisini kullanın: Eklentiler > DenoiseEM > Denoise).
- Yığını hizalayın (FijiJ' de: StagReg veya MIB> eklentiler: Veri Kümesi > Hizalama Araçları).
- Segment dendritik dikenler ve sinapslar (MIB veya Reconstruct yazılımında kapsamlı öğreticiler mevcuttur (ayrıntılar için Malzeme Tablosu'ne bakın).
Sonuçlar
Yüksek kontrastın üzerinde açıklanan yöntem kullanılarak fare beyin dokusunun iyi çözünürlüklü görüntüleri elde edilebilir. SBEM tekniği tarafından sağlanan geniş bir görüş alanı, ilgi çekici bölgenin hassas bir şekilde seçilmesini kolaylaştırır. Hipokampüsün CA1 bölgesinin büyük görüntüsü stratum radiatum (SR) uzunluğunu ölçmek (Şekil 2A) ve görüntülemeyi tam olarak merkezde ayarlamak için alınmıştır (Şekil 2...
Tartışmalar
Deerinck tarafından 2010 yılında açıklanan birincil NCMIR yönteminin birçok varyasyonu vardır10. Temel ilkeler aynı kalır, ancak çalışılan malzemenin türüne bağlı olarak hafif değişiklikler uygulanır. Daha önce, SBEM için numuneleri gömmek için farklı reçinelerin kullanılabileceği ve örneğin bitkiler söz konusu olduğunda, Spurr's hücre duvarlarından daha iyi sızmaya izin veren düşük viskozitesi nedeniyle tercih edilen reçinedir22...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Nencki Deneysel Biyoloji Enstitüsü'nde görüntüleme çekirdeği tesisi olarak hizmet veren Görüntüleme Doku ve fonksiyon laboratuvarının ekipmanlarının kullanımı ile SBEM görüntüleme, ışık mikroskopi görüntüleme ve elektron mikroskopi numunesi hazırlama yapıldı.
Şekil 1'in hazırlanması için bir farenin (Souris_02) görüntüsü ve https://smart.servier.com/ bir şişe kullanılmıştır.
Bu çalışma, KR'ye verilen Ulusal Bilim Merkezi (Polonya) Grant Opus (UMO-2018/31/B/NZ4/01603) tarafından desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Anesthetic: | |||
| Ketamine/xylazine mixture (Ketamina/Sedazin) | Biowet Pulawy, Pulawy, Poland | ||
| Sodium pentobarbital (Morbital) | Biowet Pulawy, Pulawy, Poland | ||
| Fixatives: | |||
| Glutaraldehyde (GA) | Sigma-Aldrich,St. Louis, MI, USA | G5882 | Grade I, 25% in H2O, specially purified for use as an electron microscopy fixative |
| Hydrochloric acid (HCl) | POCH, Gliwice, Poland | 575283115 | pure p.a. |
| Paraformaldehyde (PFA) | Sigma-Aldrich,St. Louis, MI, USA | 441244 | prilled, 95% |
| Phosphate buffered saline (PBS), pH 7.4 | Sigma-Aldrich,St. Louis, MI, USA | P4417-50TAB | tablets |
| Sodium hydroxide (NaOH) | Sigma-Aldrich,St. Louis, MI, USA | S5881 | reagent grade,  98%, pellets (anhydrous) 98%, pellets (anhydrous) |
| Sodium phosphate dibasic (Na2HPO4) | Sigma-Aldrich,St. Louis, MI, USA | S3264 | |
| Sodium phosphate monobasic (NaH2PO4) | Sigma-Aldrich,St. Louis, MI, USA | S3139 | |
| Perfusion: | |||
| Large blunt/blunt curved scissors (~14.5 cm) | Fine Science Tools, Foster City, CA, USA | 14519-14 | |
| Micro-spatula (double 2" flat ends, one rounded, one tapered to 1/8") | Fine Science Tools, Foster City, CA, USA | 10091-12 | |
| Needle tip, 15 GA, blunt (perfusion needle) | KD Medical GmbH Hospital Products, Berlin, Germany | KD-FINE 900413 | 1.80 x 40 mm |
| Pair of fine (Graefe) tweezers | Fine Science Tools, Foster City, CA, USA | 11050-10 | |
| Perfusion pump | Lead Fluid | BQ80S | |
| Plastic vials | Profilab, Warsaw, Poland | 534.02 | plastic vials with blue cap for tissue storage, 20 ml, 31 x 48 mm |
| Straight iris scissors (~9 cm) | Fine Science Tools, Foster City, CA, USA | 14058-11 | |
| Brain slices preparation for EM: | |||
| 12-well plate | NEST, Rahway, NJ, USA | 712001 | |
| Cyanoacrylic glue | Fenedur, Montevideo, Uruguay | ||
| Glass vials | Electron Microscopy Sciences, Hatfield, PA, USA | 72632 | 20 ml Scintillation Vial, a pack of 100 |
| Pasteur pipette | VWR, Radnor, PA, USA | 612-4545 | LDPE, disposable, 7.5 ml |
| Razor blade | Wilkinson Sword, London, UK | Classic double edge safety razor blades | |
| Scalpel blade | Swann-Morton, Sheffield, UK | No. 20 | |
| Vibratome | Leica Microsystems, Vienna, Austria | Leica VT1000 S | |
| Brain slices preparation for IF: | |||
| 96-well plate | NEST, Rahway, NJ, USA | 701101 | |
| Criostat | Leica Microsystems, Vienna, Austria | Leica CM 1950 | |
| Ethylene glycol | Bioshop, Burlington, Canada | ETH001 | |
| Low-profile disposable blade 819 | Leica Biosystems Inc., USA | 14035838925 | |
| Scalpel blade | Swann-Morton, Sheffield, UK | No. 20 | |
| Sodium azide (NaN3) | POCH, Gliwice, Poland | 792770426 | |
| Sucrose | POCH, Gliwice, Poland | 772090110 | |
| Tissue freezing medium for cryosectioning, OCT-Compound | Leica Biosystems, Switzerland | 14020108926 | |
| Immunostaining: | |||
| 24-well plate | NEST, Rahway, NJ, USA | 702001 | |
| Anti-Post Synaptic Density Protein 95 Antibody | Merck-Millipore, Burlington, MA, USA | MAB1598 | |
| Confocal microscope | Zeiss, Göttingen, Germany | Zeiss Spinning Disc microscope (63 × oil objective, NA 1.4, pixel size 0.13 µm × 0.13 µm) | |
| Cover slide | Menzel Glaser, Braunschweig, Germany | B-1231 | 24 x 60 mm |
| Donkey anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 555 | Invitrogen, Carlsbad, CA, USA | A31570 | |
| Fluoromount-G Mounting Medium, with DAPI | Invitrogen, Carlsbad, CA, USA | 00-4959-52 | |
| Microscope slide | Thermo Scientific, Waltham, MA, USA | AGAA00008 | SuperFrost |
| Normal donkey serum (NDS) | Jackson ImmunoResearch Laboratories, West Grove, PA, USA | 017-000-121 | |
| Shaker | JWElectronic, Warsaw, Poland | KL-942 | |
| TritonT X-100 Reagent Grade | Bioshop, Burlington, Canada | TRX506 | |
| Electron microsocpy sample preparation | |||
| Potassium hexacyanoferrate(II) trihydrate | POCH, Gliwice, Poland | 746980113 | |
| Aclar 33C Film | Electron Microscopy Sciences, Hatfield, PA, USA | 50425 | Fluoropolymer Film embedding sheet |
| DMP-30, 2,4,6-Tris(dimethylaminomethyl)phenol | Sigma-Aldrich,St. Louis, MI, USA | T58203 | Epoxy embedding medium accelerator |
| Durcupan ACM single component A, M | Sigma-Aldrich,St. Louis, MI, USA | 44611 | Durcupan ACM single component A, M epoxy resin |
| Durcupan ACM single component B | Sigma-Aldrich,St. Louis, MI, USA | 44612 | Durcupan ACM single component B, hardener 964 |
| Durcupan ACM single component D | Sigma-Aldrich,St. Louis, MI, USA | 44614 | Durcupan ACM single component D , plasticizer |
| Ethyl alcohol absolute | POCH, Gliwice, Poland | 64-17-5 | Ethyl alcohol absolute 99.8 % pure P.A.-BASIC |
| Genlab laboratory oven | Wolflabs, York, UK | Mino/18/SS | Oven Genlab MINO/18/SS 18l volume, no fan circulation, no digital display, standard temperature gradient, standard recovery rate, no timer, 250°C maximum temperature, 240V electrical supply |
| L-Aspartic acid | Sigma-Aldrich,St. Louis, MI, USA | A-9256 | reagent grade,  98% (HPLC) 98% (HPLC) |
| Lead (II) nitrate | Sigma-Aldrich,St. Louis, MI, USA | 467790 |  99.95% trace metals basis 99.95% trace metals basis |
| Osmium tetroxide | Sigma-Aldrich,St. Louis, MI, USA | 75632 | for electron microscopy, 4% in H2O |
| pH meter | Elmetron, Zabrze, Poland | CP-5-5 | |
| Rotator | BioSan, Józefów, Poland | Multi Bio RS-24 | rotator Multi Bio RS-24 |
| Sodium hydroxide (NaOH) | Sigma-Aldrich,St. Louis, MI, USA | S5881 | reagent grade,  98%, pellets (anhydrous) 98%, pellets (anhydrous) |
| Sunflower mini shaker | Grant bio, Shepreth,UK | PD-3D | |
| Syringe filter | Millipore, Burlington, MA, USA | SLGP033NB | 0,22 µm pore size |
| Thiocarbohydrazide | Sigma-Aldrich,St. Louis, MI, USA | 88535 | purum p.a., for electron microscopy,  99.0% (N) 99.0% (N) |
| Uranyl acetate | Serva, Heidelberg, Germany | 77870 | Uranyl acetate·2H2O, research grade |
| Water bath | WSL, Swietochlowice, Poland | LWT | |
| Specimen mounting for SBEM | |||
| 96-well culture plate | VWR, Radnor, PA, USA | 734-2782 | 96-well plates, round bottom, non treated |
| AM Gatan 3View stub handling tweezers | Micro to Nano, Haarlem, Netherlands Netherlands | 50-001521 | |
| Binocular | OPTA-TECH, Warsaw, Poland | X2000 | |
| Conductive glue | Chemtronics, Georgia, USA | CW2400 | conductive eopxy |
| Gatan 3View sample pin stubs | Micro to Nano, Haarlem, Netherlands Netherlands | 10-006003 | |
| Parafilm | Sigma-Aldrich,St. Louis, MI, USA | P7793 | roll size 20 in. × 50 ft |
| Pelco conductive silver paint | Ted Pella, Redding, CA, USA | 16062-15 | PELCO® Conductive Silver Paint, 15g |
| Razor blades double edge | Electron Microscopy Sciences, Hatfield, PA, USA | 72000 | Stainless Steel "PTFE" coated. PERSONNA brand .004" thick, wrapped individually, 250 blades in a box. |
| Scanning Electron Microscope | Zeiss, Oberkochen, Germany | Sigma VP with Gatan 3View2 chamber, acceleration voltage 2.5 kV, variable pressure 5 Pa, aperture 20 µm, dwell time 6 µs, slice thickness 60 nm, magnification 15 000 x, image resolution 2048 x 2048 pixels, pixel size 7.3 nm | |
| trim 90° diamond knife | Diatome Ltd., Nidau, Switzerland | DTB90 | |
| Ultramicrotome | Leica Microsystems, Vienna, Austria | Leica ultracutR | |
| Software | webpage | tutorials | |
| FijiJ | https://fiji.sc/ | ||
| Microscopy Image Browser | http://mib.helsinki.fi/ | http://mib.helsinki.fi/tutorials.html | |
| Reconstruct | https://synapseweb.clm.utexas.edu/software-0 | https://synapseweb.clm.utexas.edu/software-0) | |
| Animals | |||
| Mice | Adult 3-month old and 20±1 month old female Thy1-GFP(M) mice (Thy1-GFP +/-) (Feng et al.,2000) which express GFP in a sparsely distributed population of glutamatergic neurons. Animals were bred as heterozygotes with the C57BL/6J background in the Animal House of the Nencki Institute of Experimental Biology. |
Referanslar
- Bosch, M., Hayashi, Y. Structural plasticity dendritic spines. Current Opinion in Neurobiology. 22 (3), 383-388 (2012).
- Borczyk, M., Radwanska, K., Giese, K. P. The importance of ultrastructural analysis of memory. Brain Research Bulletin. 173, 28-36 (2021).
- Wanner, A. A., Kirschmann, M. A., Genoud, C. Challenges of microtome-based serial block-face scanning electron microscopy in neuroscience: challenges of SBEM in neuroscience. Journal of Microscopy. 259 (2), 137-142 (2015).
- Śliwińska, M. A., et al. Long-term Memory Upscales Volume of Postsynaptic Densities in the Process that Requires Autophosphorylation of αCaMKII. Cerebral Cortex. 30 (4), 2573-2585 (2020).
- Borczyk, M., Śliwińska, M. A., Caly, A., Bernas, T., Radwanska, K. Neuronal plasticity affects correlation between the size of dendritic spine and its postsynaptic density. Scientific Reports. 9 (1), 1693 (2019).
- Leighton, S. B. SEM images of block faces, cut by a miniature microtome within the SEM - a technical note. Scanning Electron Microscopy. , 73-76 (1981).
- Denk, W., Horstmann, H. Serial Block-Face Scanning Electron Microscopy to Reconstruct Three-Dimensional Tissue Nanostructure. PLoS Biology. 2 (11), 329 (2004).
- Smith, D., Starborg, T. Serial block face scanning electron microscopy in cell biology: Applications and technology. Tissue and Cell. 57, 111-122 (2019).
- Titze, B., Genoud, C. Volume scanning electron microscopy for imaging biological ultrastructure: Volume scanning electron microscopy. Biology of the Cell. 108 (11), 307-323 (2016).
- Deerinck, T. J., Bushong, E. A., Thor, A., Ellisman, M. H. . NCMIR methods for 3D EM: A new protocol for preparation of biological specimens for serial block face scanning electron microscopy. , 6-8 (2010).
- Willingham, M. C., Rutherford, A. V. The use of osmium-thiocarbohydrazide-osmium (OTO) and ferrocyanide-reduced osmium methods to enhance membrane contrast and preservation in cultured cells. Journal of Histochemistry & Cytochemistry. 32 (4), 455-460 (1984).
- Feng, G., et al. Imaging Neuronal Subsets in Transgenic Mice Expressing Multiple Spectral Variants of GFP. Neuron. 28 (1), 41-51 (2000).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Paxinos, G., Franklin, K. B. J. . The mouse brain in stereotaxic coordinates. , (2004).
- Walton, J. Lead aspartate, an en bloc contrast stain particularly useful for ultrastructural enzymology. Journal of Histochemistry & Cytochemistry. 27 (10), 1337-1342 (1979).
- Mercer, E. H. a scheme for section staining in electron microscopy. Journal of the Royal Microscopical Society. 81 (3-4), 179-186 (1963).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Belevich, I., Joensuu, M., Kumar, D., Vihinen, H., Jokitalo, E. Microscopy Image Browser: A Platform for Segmentation and Analysis of Multidimensional Datasets. PLOS Biology. 14 (1), 1002340 (2016).
- Fiala, J. C. Reconstruct: a free editor for serial section microscopy. Journal of Microscopy. 218 (1), 52-61 (2005).
- Roels, J., et al. An interactive ImageJ plugin for semi-automated image denoising in electron microscopy. Nature Communications. 11 (1), 771 (2020).
- Radwanska, K., et al. Mechanism for long-term memory formation when synaptic strengthening is impaired. Proceedings of the National Academy of Sciences. 108 (45), 18471-18475 (2011).
- Kittelmann, M., Hawes, C., Hughes, L. Serial block face scanning electron microscopy and the reconstruction of plant cell membrane systems: SBFSEM Methods for Plant Cells. Journal of Microscopy. 263 (2), 200-211 (2016).
- Fendrych, M., et al. Programmed Cell Death Controlled by ANAC033/SOMBRERO Determines Root Cap Organ Size in Arabidopsis. Current Biology. 24 (9), 931-940 (2014).
- Russell, M. R. G., et al. 3D correlative light and electron microscopy of cultured cells using serial blockface scanning electron microscopy. Journal of Cell Science. 130 (1), 278-291 (2017).
- Płachno, B. J., Świątek, P., Jobson, R. W., Małota, K., Brutkowski, W. Serial block face SEM visualization of unusual plant nuclear tubular extensions in a carnivorous plant (Utricularia, Lentibulariaceae). Annals of Botany. 120 (5), 673-680 (2017).
- Genoud, C., Titze, B., Graff-Meyer, A., Friedrich, R. W. Fast Homogeneous En Bloc Staining of Large Tissue Samples for Volume Electron Microscopy. Frontiers in Neuroanatomy. 12, (2018).
- Puhka, M., Joensuu, M., Vihinen, H., Belevich, I., Jokitalo, E. Progressive sheet-to-tubule transformation is a general mechanism for endoplasmic reticulum partitioning in dividing mammalian cells. Molecular Biology of the Cell. 23 (13), 2424-2432 (2012).
- Gluenz, E., Wheeler, R. J., Hughes, L., Vaughan, S. Scanning and three-dimensional electron microscopy methods for the study of Trypanosoma brucei and Leishmania mexicana flagella. Methods in Cell Biology. 127, 509-542 (2015).
- Starborg, T., et al. Using transmission electron microscopy and 3View to determine collagen fibril size and three-dimensional organization. Nature Protocols. 8 (7), 1433-1448 (2013).
- Hughes, L., Borrett, S., Towers, K., Starborg, T., Vaughan, S. Patterns of organelle ontogeny through a cell cycle revealed by whole-cell reconstructions using 3D electron microscopy. Journal of Cell Science. 130 (3), 637-647 (2017).
- Bojko, A., et al. Improved Autophagic Flux in Escapers from Doxorubicin-Induced Senescence/Polyploidy of Breast Cancer Cells. International Journal of Molecular Sciences. 21 (17), 6084 (2020).
- Knott, G. W., Holtmaat, A., Trachtenberg, J. T., Svoboda, K., Welker, E. A protocol for preparing GFP-labeled neurons previously imaged in vivo and in slice preparations for light and electron microscopic analysis. Nature Protocols. 4 (8), 1145-1156 (2009).
- Glauert, A. M., Lewis, P. R. . Biological specimen preparation for transmission electron microscopy. , (2014).
- Genoud, C. Altered Synapse Formation in the Adult Somatosensory Cortex of Brain-Derived Neurotrophic Factor Heterozygote Mice. Journal of Neuroscience. 24 (10), 2394-2400 (2004).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır