このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
樹状脊椎研究のためのシリアルブロック顔走査電子顕微鏡(SBEM)
要約
シリアルブロックフェイススキャン電子顕微鏡(SBEM)は、マウス海馬の樹状脊椎を画像化し、分析するために適用されます。
要約
3次元電子顕微鏡(3D EM)は、ナノスケールの分解能で樹状脊椎の形態学的パラメータを解析する可能性を与えます。また、脊椎の体積やシナプス後密度(PSD)(シナプス後のシナプス部分を表す)、シナプス前末端の存在、PSDの滑らかな内径レチラムまたは非定型形態(例えば、多innervat脊椎)の一部の特徴は、3D EMでのみ観察することができる。シリアルブロック面走査電子顕微鏡(SBEM)を採用することにより、従来のシリアル切り離しを行う場合よりも簡単かつ再現性の高い方法で3D EMデータを取得することが可能です。ここでは、SBEM分析のためにマウス海馬サンプルを調製する方法と、このプロトコルを樹状脊椎の免疫蛍光研究と組み合わせる方法を示す。軽度の固定灌流は、脳の半分に光顕微鏡による免疫蛍光試験を行い、残りの半分はSBEMのために準備された。このアプローチは、研究に使用される動物の数を減らします。
概要
中枢神経系の興奮シナプスのほとんどは樹状脊椎に位置しています - 神経膜の小さな突起。これらの突起は、細胞内シグナル伝達を制御する限定された生化学的コンパートメントを形成する。樹状脊椎およびシナプスの構造的可塑性は、学習および記憶1、2のような重要なプロセスの根源となるシナプス有効性の機能的変化と密接に関連している。電子顕微鏡(EM)は、樹状脊椎にシナプス前入力があるかどうかを判断できる唯一の技術であることに注意することが重要です。EM解像度は、シナプス後の部分(PSD)、シナプス後の部分、樹状脊椎の寸法、軸索の大きさと形状などの超構造的な詳細を研究するためにも必要です。さらに、EMを使用すると、シナプスとその周辺を視覚化することが可能です。
イメージングおよびコンピューティング技術の進歩により、神経回路全体を再構築することが可能です。体積電子顕微鏡法は、例えば、シリアルセクション透過電子顕微鏡(ssTEM)、シリアルブロック面走査電子顕微鏡(SBEM)、および集光イオンビーム走査電子顕微鏡(FIB-SEM)などの神経回路再構成に一般的に用いられている。
我々の研究では、SBEM法は、マウス海馬および組織性脳スライス4,5のサンプルにおける樹状脊椎およびPSDの構造的可塑性を調査するためにうまく採用されている。SBEMは、走査型電子顕微鏡室6、7、8、9の中にミニチュアの超ミクロトームを設置することに基づいています。サンプルブロックの上部が画像化され、その後、サンプルがウルトラミクロトームによって指定された深さで切断され、新しいブロック面が明らかになります。その結果、切断されたスライスが破片として失われている間、ブロック面の画像のみが残されます。SBEMが破壊的な技術と呼ばれる理由は、同じ場所を再びイメージすることはできません。しかし、破壊的なオンブロック法の利点は、データ品質とデータ分析3に大きな影響を与える可能性のある歪み問題やセクション損失に苦しんでいないということです。さらに、SBEMは、比較的大きな視野(>0.5mm×0.5mm)を高解像度3で画像化する可能性を与える。
SBEMを採用するには、画像の取得に使用される反射電子検出器により、サンプルを専用の非常にコントラストの高いプロトコルに従って調製する必要があります。ここでは、1980年代8,11年に開発された還元オスミウムチオカルボヒドラジド(rOTO)染色を用いて、Deerinck10(国立顕微鏡・イメージング研究センター(NCMIR)法)が開発した手順に基づいて、プロトコルに従ってサンプル調製を行う方法を示す。また、軽顕微鏡とSBEMによる免疫蛍光研究に同じ脳を用いることができる軽度の固定灌流を用いて、2段階固定法を導入する。
プロトコルでは、マウスの脳は主に軽度の固定剤で固定され、次いで半分に切断され、一方の半球は後固定され、免疫蛍光(IF)のために準備され、もう1つはEM研究のために(図1)である。
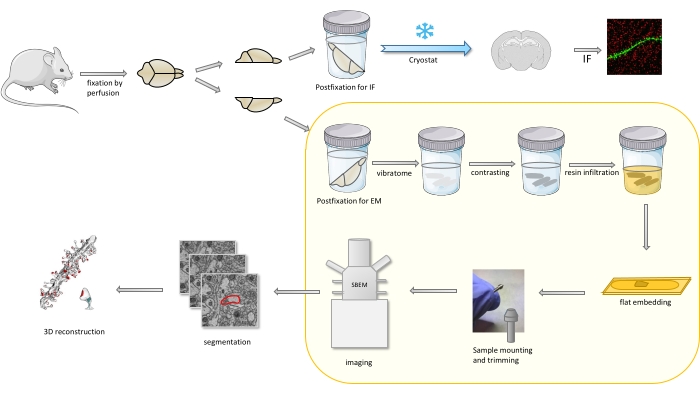
図 1.SBEM を使用した解析のための樹状脊椎の準備のためのワークフローの概略表現。 マウスを屠殺し、軽度の一次固定剤を浸透させた。脳は半分に切断され、1つの半球は免疫蛍光(IF)専用の固定剤(IF)専用の固定剤で後固定され、凍結保護され、凍結スタットを使用してスライスされ、IF研究のために処理され、他の半球はEM固定剤で後付けされ、ビブラートでスライスされ、EM研究のために準備された。SBEM研究のための脳スライスは対照的であり、樹脂に平らに埋め込まれ、次いで海馬のCA1領域をピンに取り付け、SBEMで画像化した(図1)。黄色いボックスで強調表示されたプロトコルの一部は、ビデオで紹介されました。 この図の大きなバージョンを表示するには、ここをクリックしてください。
プロトコル
研究は、ネンキ研究所のガイドラインと地方倫理委員会の許可に従って行われました。研究は、1986年11月24日(86/609/EEC)の欧州共同体理事会指令、ポーランドの動物保護法に従って行われ、ワルシャワで最初の地方倫理委員会によって承認されました。すべての努力は、使用される動物の数とその苦しみを最小限に抑えるために行われました。
注意:以下に説明するすべての手順は、実験室のヒュームフードで行う必要があります。使用される試薬の危険な性質のため。手袋、ラボコート、安全メガネ、フェイスマスクなどの個人の安全対策が必要です。
1. 灌流用固定剤の調製 (2%wt/vol パラホルムアルデヒド (PFA) および 0.5% vol/vol グルタルアルデヒド (GA) 0.1 M リン酸バッファー (PB) pH 7.4)
注: 固定ソリューションは、使用日と同じ日に準備し、3 時間以上保存しないでください。時間不足の場合は、前日に0.1M PBで2%PFAを準備し、4°Cで保存し、灌流の直前に新鮮なGAを追加します。
- 400mLの無菌二重蒸留水(ddH2O)を取り、攪拌ホットプレートを使用して60°Cに加熱します。次に、20 g の PFA を追加します。PFAが完全に溶解するまで1 M NaOHの滴を加え、混合物を冷却させます。
- 0.2 M PB(pH 7.4)の500 mLを加えます。
- 溶液をフィルターしてデポジットを取り除き、4°Cに冷却します。
- 灌流の直前に、溶液に25%GAの20 mLを加え、ddH2Oから1 Lでボリュームを上げる。
SBEM(2%wt/vol PFAおよび0.1 M PBで2.5%の体積/体積GA、pH 7.4)のためのポストパーフュージョン固定剤の調製
- 灌流のための固定剤の50 mLを取る (2% PFA と 0.1 M PB で 0.5% GA).
- 25%GAの5 mLを追加します。
3. IF染色用の過灌流後固定液の調製(リン酸緩衝生理食塩水(PBS)におけるPFA 4%)
- 製造者の指示に従って、1x PBS(pH 7.4)の錠剤を精製および脱イオン水(H2O)に溶解します。
- 攪拌ホットプレートを使用して溶液を60°Cに加熱し、PFAを40g加えます。
- PFAが完全に溶解するまで1M NaOHの滴を加え、混合物を冷却させます。
- 溶液のpHを1 M HClで7.5に調整し、H2O~1 Lで音量を上げ上げ下ろします。
- ソリューションをフィルター処理して、預金を削除します。
4. 動物の心筋灌流
注: PFA および GA の廃棄物はすべて、現地の規制に従って廃棄するために収集および保管する必要があります。麻酔と灌流は、現地の規則に従う必要があります。記載されたプロトコルでは、成人3ヶ月および20±1ヶ月齢の雌の雌のThy1-GFP(M)マウス(thy1-GFP +/-)12は、グルタマ作動性ニューロンのまばらな分布集団中で緑色蛍光タンパク質(GFP)を発現するが 、他の任意のいずれも使用することができる。動物は、実験生物学研究所の動物館でC57BL / 6Jの背景を持つヘテロ接合ゴットとして飼育されました。
- 腹腔内注射(27ゲージ針)を介してケタミン/キシラジン混合物(最大90mg/kg体重ケタミンおよび10mg/kg体重キシラジン)の投与によりマウスを麻酔する前に。
- 痛み覚醒(つまみ)と角膜反射(目を細める)に対する反射をチェックすることによって、麻酔の深さが十分であるかどうかを評価します。
- 20分後ペントバルビタールナトリウム(50mg/kg体重)の腹腔内注射(27ゲージ針)を行う。
- Gageらが記述する灌流手術プロトコルに従ってマウスをパーフューズする( ポイント4を参照;図5-6)。0.1 Mリン酸緩衝液で始まる灌流ポンプを使用して、pH 7.4(30 mL)を3分間、0.1 M PBで2%PFAと0.5%GA、pH 7.4を6分間(80 mL)継続します。
- 脳を頭蓋骨から穏やかに解剖し、半分に分割します(Gageら、201213の図9-10を参照)。SBEM用の固定性を含むバイアルに1個を入れ、2つ目をバイアルに4%PFA/PBSで入れ、IF染色を行います。
- 一晩4 °Cで固定化中の半球を保ちます。
5. 脳は電子顕微鏡の準備をスライスする
- ビブラートの設定(ブレードの移動速度:0.075ミリメートル/s、切断周波数:80 Hz)を選択します。
- スライスチャンバーをホルダーに入れ、ビブラートメに取り付け、氷で囲みます。次に、カミソリの刃をビブラートメのブレードホルダーに入れなさい。
- スプーン、または同様の物体を使用し、冷やした脳(後ろ面を上)を堅い切断面(例えば、ガラスペトリ皿の蓋)に置きます。海馬のコロナスライスを準備するには、大脳半球と小脳の間にカミソリの刃またはメスで垂直に切り取り、小脳を取り除く。嗅球も取り外すことができます。
- ビブラートメのドライプラットフォームにシアノアクリル酸接着剤を塗布します。
- 鉗子で脳を拾い、フィルターペーパーで慎重に乾燥させます。
- 半球を、ブレードの刃に近いプラットフォームに接着し、その先端を上に向けます。ホルダーにプラットフォームを取り付け、すぐに氷冷0.1 M PB、pH 7.4でそれを満たします。垂直カットが適切に行われると、半球は海馬を含む対称コロナカットを行うために必要な90°の角度を提供してまっすぐ立ちます。脳がPBで覆われていることを保証します。
- ビブラートメブレードを半球の前に置き、半球のコロナ側に下げます。ブレードを尾翼方向に400μmまで下げ、スライスを開始します。最初の2つのスライスが組織ブロックから完全に分離されるまでスライスを続けます。
- ブレードを引き込み、さらに100μm下げてから、もう一度スライスします。
- 海馬が見えるようになると(マウスの脳アトラスパキシノスとフランクリン、200414)小さな絵筆や広がったプラスチックパスツールピペットでスライスを収集します。
- 冷たい0.1 M PB、pH 7.4で満たされた12ウェルプレートにスライスを移します。
- 0.1 M PBで満たされたガラスペトリ皿で海馬を解剖し、カミソリの刃またはメスを使用してpH 7.4、同じリン酸バッファーを持つガラスバイアルに入れます。
注:スライスの長期保存のために0.05%アジドナトリウム(NaN3)と0.1 M PBを補います。
6. 免疫染色のための脳サンプル調製
- ヒュームフードに4%PFA/PBS溶液を一晩固定した後、脳組織を凍結保存溶液(PBSでは30%スクロース、0.05%NaN3)に入れ、2日間(沈むまで)4°Cに保ちます。
- 不凍液(15%スクロース/30%エチレングリコール/0.05%NaN3/PBS)を調製してください。
- クライオスタットのキャビネット温度を-19 °Cに設定し、さらに進む前に温度に達していることを確認してください。断結中は、キャビネット温度が-18°C~-20°Cの間に保たれていることを確認してください。
- スプーン、または同様の物体を使用し、冷やした脳(後ろ面を上)を堅い切断面(例えば、ガラスペトリ皿の蓋)に置きます。海馬のコロナスライスを準備するには、大脳半球と小脳の間にカミソリの刃またはメスで垂直に切り取り、小脳を取り除く。
- 事前に冷却された標本ディスクを選択し、フリーシェルフで凍結するための媒体でそれをカバーし、鉗子を使用して、ロザラル先端を上向きにディスクに半球を固定し、標本が完全に凍結するまで待ちます。試料のディスクを試料の頭部に挿入します。
- ブレードホルダーにブレードを取り付け、厚さ40μmのスライスをカットします。
- 冷たい凍結防止液で満たされた96ウェルプレートに小さなペイントブラシでスライスを転送し、セクションを穏やかに展開します(スライスの各ラウンドの後にスライスを収集して、スライスチャンバーで迷子にならないようにします)。
注:脳やセクションは、長い時間のために-20°Cで不凍液に保存することができます。
7. 脳スライスの免疫染色
注:すべての染色手順は、プラットフォームシェーカー上の24ウェルプレートで行われました。
- スライスをPBSで3回、毎回6分間洗います。
- 300 μLのブロッキング溶液(5%正常ロバ血清(NDS)/0.3%トリトンX-100)でスライスを1時間インキュベートし、ローテーターで穏やかな揺れをします。
- PSD-95に対して一次抗体でスライスをインキュベートし、5%NDS/0.3%トリトンX-100/PBS(ウェルあたり300 μL)で1:500を4°Cで一晩培養します。 一次抗体の最終濃度は2μg/mLです。
- 0.3%トリトンX-100/PBSでスライスを室温(RT)で3回、毎回6分間洗います。
- 2次抗体でスライスをインキュベートし、0.3%トリトンX-100/PBSの300 μLで1:500を90分間培養します。二次抗体の最終濃度は4μg/mLである。
- スライスをPBSで3回、毎回6分間洗います。
- 取り付け媒体を使用してスライドにスライスを取り付け、カバースライドで閉じます。
- 共焦点顕微鏡(63×油対、NA 1.4、画素サイズ0.13μm×0.13μm)を使用して検体を調べます。
注:長期保存:4°Cでサンプルを保ち、光から保護してください。
8. SBEM サンプル調製
注意:試薬の危険な性質のために使用し、以下に記載のすべての手順は、実験室のヒュームフードで行う必要があります。これらの化学物質を使用する前に、製造業者が提供する材料安全データシートを注意深く読み、安全管理および廃棄物処理を確実に行うため、現地の規則について安全担当者に依頼してください。
- 対照的なサンプル
注:スライス洗浄と室温インキュベーションは、穏やかな揺れ(例えば、プラットフォームシェーカー上)で行う必要があります。脱気水をオートクレーブが使用した。- スライスを冷たい0.1 M PB、pH 7.4で5回、3分間洗います。
- 4%水酸化オスミウムと3%フェロシアン化カリウム(1:1 vol)の1:1混合物を調製します。最終製品は茶色になります。この混合物にサンプルを浸し、氷の上に置き、この段階以降は光からそれらを保護することが重要です。1時間の穏やかな揺れでそれらをインキュベート。
- 一方チオカルボヒドラジド(TCH)溶液を調製する。2倍蒸留したH2O(ddH2 O)10mLとTCH0.1gを混ぜ、60°Cにセットしたオーブンに1時間置きます。溶液を時々(例えば、10分ごと)旋回することが重要です。準備ができたら、室温まで冷却します。
- スライスをddH2Oで5回、3分間洗います。
- 0.22 μmのシリンジフィルターを使用してTCH溶液をフィルターし、サンプルをフィルター処理された溶液に浸します。スライスが黒く変わります。室温で20分間インキュベートします。
- サンプルをddH2Oで5回、3分間洗浄します。
- OO4 の2%水溶液を室温で30分間インキュベートします。
- サンプルをddH2Oで5回、3分間洗浄します。
- サンプルを濾過した1%の酢酸ウナニル水溶液に入れ、一晩4°Cでインキュベートします。ろ過には0.22 μmのシリンジフィルターを使用してください。
- L-アスパラギン酸0.4gとdDH2Oの80 mLを混合してL-アスパラギン酸溶液を調製し、溶解しやすいようにpHを3.8に調整し、水で100 mLに上げます。
- 翌日、ウォルトンのリードアスパート15 の準備から始めます。硝酸鉛0.066gをL-アスパラギン酸溶液10 mL(点8.1.10)と混合し、pHを5.5(60°Cで測定)に調整し、1 M NaOHで調整します。鉛アスパラギンテでバイアルを閉じ、水浴で30分間60°Cにしておきます。解決策は明確であるべきです。曇った場合は、破棄する必要があり、新しいものを準備する必要があります。
- その間、各回3分間、脱ガスddH2Oでサンプルを5回洗浄します。その後、オーブンに60°Cで30分間置いておきます。
- サンプルを作りたての鉛アスパラギンス溶液に浸し、60°Cのオーブンセットで20分間インキュベートします。
- 各回3分間、脱ガスddH2Oでサンプルを5回洗浄します。
- 脱水・樹脂埋め込み
- エポキシ樹脂を準備します。成分(成分A/Mの33.3g、成分Bの33.3g、および成分Dの1g)の重量を量り、樹脂をよく混ぜ(例えば、15mLチューブのロータリーシェーカーで振る)、加速器DMP 30の16滴を加える前に少なくとも30分間混合します。もう一度10分間かき混ぜます。
注:ヒュームフードの下の成分の重量を量ります。この成分の量は、サンプルと15バイアルのために十分である樹脂の約60 mLを与えます。4°Cで残りの樹脂をシリンジに入れるか、少なくして保管し、翌日に利用することができます。注射器の先端をシールすることを忘れないでください。 - エタノールの等級希釈(30%、50%、70%、90%、100%、水中の100%エタノール、分子ふるいで100%乾燥した)でバイアルを調製します。
- 樹脂を1:1の割合で100%エタノールと混合し、50%の樹脂を得る。よく混ぜます。
- エタノールの希釈ごとに5分間サンプルを脱水し、30%から始まり、100%無水エタノールで終わる。サンプルは完全に乾燥してはならないことを覚えておいてください。
- サンプルを最初に50%樹脂に30分間浸潤し、次に100%樹脂で1時間、次に100%の樹脂で一晩浸潤します。一定の遅い揺れですべての浸潤ステップを実行します。
- 翌日、サンプルを1時間新鮮な100%樹脂に入れ、フッ素樹脂埋め込みシートの間に埋め込みます。埋め込みシートの部分をエタノールで脱脂し、2つのガラススライドを支持として使用して、その2つの層の間にサンプルを平らに埋め込みます。サンプルの上または近くに樹脂の気泡を避けるようにしてください。
- 70°Cでサンプルを48時間以上硬化させます。
- エポキシ樹脂を準備します。成分(成分A/Mの33.3g、成分Bの33.3g、および成分Dの1g)の重量を量り、樹脂をよく混ぜ(例えば、15mLチューブのロータリーシェーカーで振る)、加速器DMP 30の16滴を加える前に少なくとも30分間混合します。もう一度10分間かき混ぜます。
- トリミングと取り付け
- 埋め込みシートを分離し、埋め込みサンプル(約1mm x 1 mm)をカミソリの刃で切ります。パラフィルムに移します。これにより、静電気によるサンプルの損失の危険性を最小限に抑えます。
- エタノールで脱脂したアルミニウムピンを取ります。導電性エポキシをよく混ぜて、少量を使ってサンプルをピンに取り付けます。70°Cで10分間、導電性エポキシを治します。
- サンプルブロックの両側をダイヤモンドナイフでトリミングし、組織が露出するまでブロックの面を磨きます。
注:このステップでは、いくつかのセクションを収集し、トルイジンブルー染色16 または電子顕微鏡の下でチェックを行うことによって、関心のある領域の存在を確認します。 - サンプルのサイズをできるだけ小さくします。その後、導電性塗料でピンにサンプルを接地し、それを治します(室温で24時間、または65°Cのオーブンで40分間)。
- 充電アーティファクトを最小限に抑えるために、スパッタは、金または金/パラジウムの薄い層でサンプルをコーティングします。
9. SBEMイメージング
- サンプルを用いたピンをシリアルブロック面走査型電子顕微鏡のチャンバーに入れます。サンプルをナイフに合わせます。チャンバーを閉じて、パラメータを設定します。
- 所望の倍率、ピクセルサイズ、スライス厚さ、加速電圧(EHT)、絞り、圧力などで画像のスタックを収集します。
注: パラメータは、サンプルと実験の目的によって異なります。例示的な初期イメージング設定は、材料表に含まれています。
10.3D再建
注:以下に記載されている手順については、例えばフィジーJ17(ImageJバージョン1.49b)、顕微鏡画像ブラウザ(MIB)18、再構築19などのオープンアクセスソフトウェアを使用しますが、他の様々なソフトウェアを使用することができます。
- デジタル顕微鏡写真 (dm) ファイルを TIFF 形式に変換します。まずイメージ シーケンスをインポートします (フィジー > ファイル >インポート > イメージ シーケンス > 8 ビット形式を選択する) > [> 8 ビット形式を選択] ) > TIFF として 保存>、イメージ シーケンスとして保存 >> TIFF ファイルとして保存します。
- イメージのスタックの明るさとコントラストを調整します (フィジーJで:画像>>明るさ/コントラストを調整する)、必要に応じてノイズを取り下げてください (FijJ20 :プラグイン> denoiseEM > denoise)。
- スタックを整列します (フィジーJ: StagReg または MIB >プラグイン: アライメント ツール>データセット)。
- セグメント樹状脊椎およびシナプス(MIBまたは再構築ソフトウェアでは、包括的なチュートリアルが利用可能です(詳細については 、資料一覧 を参照)。
結果
上述の高コントラスト法を用いて、マウス脳組織の良好な解像度画像が得られる。SBEM技術によって提供される大きな視野は関心領域の精密な選択を促進する。海馬のCA1領域の大きな画像を撮影し、ラジタム(SR)の長さを測定し、画像を中央に正確に設定した(図2B)。次に、画像のスタックを取得し、対象とするオブジェクト、例えば樹状突起?...
ディスカッション
2010年10年にディアリンクによって記述された主要なNCMIR法の多くのバリエーションがあります。基本的な原理は変わりませんが、研究する材料の種類によっては、わずかな変更が実施されます。SBEM用の試料を埋め込むために異なる樹脂を使用することができること、例えば植物の場合、スパーは細胞壁22,23を通じてより良い浸潤を...
開示事項
著者らは開示するものは何もない。
謝辞
SBEMイメージング、光顕微鏡イメージング、電子顕微鏡サンプル調製は、Nencki実験生物学研究所のイメージングコア施設として機能するイメージング組織機能研究所の機器を使用して行われました。
図1の調製には、マウス(Souris_02)の画像、及び https://smart.servier.com/ からのバイアルを用いた。
この研究は、KRに授与された国立科学センター(ポーランド)グラントオープス(UMO-2018/31/B/NZ4/01603)によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| Anesthetic: | |||
| Ketamine/xylazine mixture (Ketamina/Sedazin) | Biowet Pulawy, Pulawy, Poland | ||
| Sodium pentobarbital (Morbital) | Biowet Pulawy, Pulawy, Poland | ||
| Fixatives: | |||
| Glutaraldehyde (GA) | Sigma-Aldrich,St. Louis, MI, USA | G5882 | Grade I, 25% in H2O, specially purified for use as an electron microscopy fixative |
| Hydrochloric acid (HCl) | POCH, Gliwice, Poland | 575283115 | pure p.a. |
| Paraformaldehyde (PFA) | Sigma-Aldrich,St. Louis, MI, USA | 441244 | prilled, 95% |
| Phosphate buffered saline (PBS), pH 7.4 | Sigma-Aldrich,St. Louis, MI, USA | P4417-50TAB | tablets |
| Sodium hydroxide (NaOH) | Sigma-Aldrich,St. Louis, MI, USA | S5881 | reagent grade,  98%, pellets (anhydrous) 98%, pellets (anhydrous) |
| Sodium phosphate dibasic (Na2HPO4) | Sigma-Aldrich,St. Louis, MI, USA | S3264 | |
| Sodium phosphate monobasic (NaH2PO4) | Sigma-Aldrich,St. Louis, MI, USA | S3139 | |
| Perfusion: | |||
| Large blunt/blunt curved scissors (~14.5 cm) | Fine Science Tools, Foster City, CA, USA | 14519-14 | |
| Micro-spatula (double 2" flat ends, one rounded, one tapered to 1/8") | Fine Science Tools, Foster City, CA, USA | 10091-12 | |
| Needle tip, 15 GA, blunt (perfusion needle) | KD Medical GmbH Hospital Products, Berlin, Germany | KD-FINE 900413 | 1.80 x 40 mm |
| Pair of fine (Graefe) tweezers | Fine Science Tools, Foster City, CA, USA | 11050-10 | |
| Perfusion pump | Lead Fluid | BQ80S | |
| Plastic vials | Profilab, Warsaw, Poland | 534.02 | plastic vials with blue cap for tissue storage, 20 ml, 31 x 48 mm |
| Straight iris scissors (~9 cm) | Fine Science Tools, Foster City, CA, USA | 14058-11 | |
| Brain slices preparation for EM: | |||
| 12-well plate | NEST, Rahway, NJ, USA | 712001 | |
| Cyanoacrylic glue | Fenedur, Montevideo, Uruguay | ||
| Glass vials | Electron Microscopy Sciences, Hatfield, PA, USA | 72632 | 20 ml Scintillation Vial, a pack of 100 |
| Pasteur pipette | VWR, Radnor, PA, USA | 612-4545 | LDPE, disposable, 7.5 ml |
| Razor blade | Wilkinson Sword, London, UK | Classic double edge safety razor blades | |
| Scalpel blade | Swann-Morton, Sheffield, UK | No. 20 | |
| Vibratome | Leica Microsystems, Vienna, Austria | Leica VT1000 S | |
| Brain slices preparation for IF: | |||
| 96-well plate | NEST, Rahway, NJ, USA | 701101 | |
| Criostat | Leica Microsystems, Vienna, Austria | Leica CM 1950 | |
| Ethylene glycol | Bioshop, Burlington, Canada | ETH001 | |
| Low-profile disposable blade 819 | Leica Biosystems Inc., USA | 14035838925 | |
| Scalpel blade | Swann-Morton, Sheffield, UK | No. 20 | |
| Sodium azide (NaN3) | POCH, Gliwice, Poland | 792770426 | |
| Sucrose | POCH, Gliwice, Poland | 772090110 | |
| Tissue freezing medium for cryosectioning, OCT-Compound | Leica Biosystems, Switzerland | 14020108926 | |
| Immunostaining: | |||
| 24-well plate | NEST, Rahway, NJ, USA | 702001 | |
| Anti-Post Synaptic Density Protein 95 Antibody | Merck-Millipore, Burlington, MA, USA | MAB1598 | |
| Confocal microscope | Zeiss, Göttingen, Germany | Zeiss Spinning Disc microscope (63 × oil objective, NA 1.4, pixel size 0.13 µm × 0.13 µm) | |
| Cover slide | Menzel Glaser, Braunschweig, Germany | B-1231 | 24 x 60 mm |
| Donkey anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 555 | Invitrogen, Carlsbad, CA, USA | A31570 | |
| Fluoromount-G Mounting Medium, with DAPI | Invitrogen, Carlsbad, CA, USA | 00-4959-52 | |
| Microscope slide | Thermo Scientific, Waltham, MA, USA | AGAA00008 | SuperFrost |
| Normal donkey serum (NDS) | Jackson ImmunoResearch Laboratories, West Grove, PA, USA | 017-000-121 | |
| Shaker | JWElectronic, Warsaw, Poland | KL-942 | |
| TritonT X-100 Reagent Grade | Bioshop, Burlington, Canada | TRX506 | |
| Electron microsocpy sample preparation | |||
| Potassium hexacyanoferrate(II) trihydrate | POCH, Gliwice, Poland | 746980113 | |
| Aclar 33C Film | Electron Microscopy Sciences, Hatfield, PA, USA | 50425 | Fluoropolymer Film embedding sheet |
| DMP-30, 2,4,6-Tris(dimethylaminomethyl)phenol | Sigma-Aldrich,St. Louis, MI, USA | T58203 | Epoxy embedding medium accelerator |
| Durcupan ACM single component A, M | Sigma-Aldrich,St. Louis, MI, USA | 44611 | Durcupan ACM single component A, M epoxy resin |
| Durcupan ACM single component B | Sigma-Aldrich,St. Louis, MI, USA | 44612 | Durcupan ACM single component B, hardener 964 |
| Durcupan ACM single component D | Sigma-Aldrich,St. Louis, MI, USA | 44614 | Durcupan ACM single component D , plasticizer |
| Ethyl alcohol absolute | POCH, Gliwice, Poland | 64-17-5 | Ethyl alcohol absolute 99.8 % pure P.A.-BASIC |
| Genlab laboratory oven | Wolflabs, York, UK | Mino/18/SS | Oven Genlab MINO/18/SS 18l volume, no fan circulation, no digital display, standard temperature gradient, standard recovery rate, no timer, 250°C maximum temperature, 240V electrical supply |
| L-Aspartic acid | Sigma-Aldrich,St. Louis, MI, USA | A-9256 | reagent grade,  98% (HPLC) 98% (HPLC) |
| Lead (II) nitrate | Sigma-Aldrich,St. Louis, MI, USA | 467790 |  99.95% trace metals basis 99.95% trace metals basis |
| Osmium tetroxide | Sigma-Aldrich,St. Louis, MI, USA | 75632 | for electron microscopy, 4% in H2O |
| pH meter | Elmetron, Zabrze, Poland | CP-5-5 | |
| Rotator | BioSan, Józefów, Poland | Multi Bio RS-24 | rotator Multi Bio RS-24 |
| Sodium hydroxide (NaOH) | Sigma-Aldrich,St. Louis, MI, USA | S5881 | reagent grade,  98%, pellets (anhydrous) 98%, pellets (anhydrous) |
| Sunflower mini shaker | Grant bio, Shepreth,UK | PD-3D | |
| Syringe filter | Millipore, Burlington, MA, USA | SLGP033NB | 0,22 µm pore size |
| Thiocarbohydrazide | Sigma-Aldrich,St. Louis, MI, USA | 88535 | purum p.a., for electron microscopy,  99.0% (N) 99.0% (N) |
| Uranyl acetate | Serva, Heidelberg, Germany | 77870 | Uranyl acetate·2H2O, research grade |
| Water bath | WSL, Swietochlowice, Poland | LWT | |
| Specimen mounting for SBEM | |||
| 96-well culture plate | VWR, Radnor, PA, USA | 734-2782 | 96-well plates, round bottom, non treated |
| AM Gatan 3View stub handling tweezers | Micro to Nano, Haarlem, Netherlands Netherlands | 50-001521 | |
| Binocular | OPTA-TECH, Warsaw, Poland | X2000 | |
| Conductive glue | Chemtronics, Georgia, USA | CW2400 | conductive eopxy |
| Gatan 3View sample pin stubs | Micro to Nano, Haarlem, Netherlands Netherlands | 10-006003 | |
| Parafilm | Sigma-Aldrich,St. Louis, MI, USA | P7793 | roll size 20 in. × 50 ft |
| Pelco conductive silver paint | Ted Pella, Redding, CA, USA | 16062-15 | PELCO® Conductive Silver Paint, 15g |
| Razor blades double edge | Electron Microscopy Sciences, Hatfield, PA, USA | 72000 | Stainless Steel "PTFE" coated. PERSONNA brand .004" thick, wrapped individually, 250 blades in a box. |
| Scanning Electron Microscope | Zeiss, Oberkochen, Germany | Sigma VP with Gatan 3View2 chamber, acceleration voltage 2.5 kV, variable pressure 5 Pa, aperture 20 µm, dwell time 6 µs, slice thickness 60 nm, magnification 15 000 x, image resolution 2048 x 2048 pixels, pixel size 7.3 nm | |
| trim 90° diamond knife | Diatome Ltd., Nidau, Switzerland | DTB90 | |
| Ultramicrotome | Leica Microsystems, Vienna, Austria | Leica ultracutR | |
| Software | webpage | tutorials | |
| FijiJ | https://fiji.sc/ | ||
| Microscopy Image Browser | http://mib.helsinki.fi/ | http://mib.helsinki.fi/tutorials.html | |
| Reconstruct | https://synapseweb.clm.utexas.edu/software-0 | https://synapseweb.clm.utexas.edu/software-0) | |
| Animals | |||
| Mice | Adult 3-month old and 20±1 month old female Thy1-GFP(M) mice (Thy1-GFP +/-) (Feng et al.,2000) which express GFP in a sparsely distributed population of glutamatergic neurons. Animals were bred as heterozygotes with the C57BL/6J background in the Animal House of the Nencki Institute of Experimental Biology. |
参考文献
- Bosch, M., Hayashi, Y. Structural plasticity dendritic spines. Current Opinion in Neurobiology. 22 (3), 383-388 (2012).
- Borczyk, M., Radwanska, K., Giese, K. P. The importance of ultrastructural analysis of memory. Brain Research Bulletin. 173, 28-36 (2021).
- Wanner, A. A., Kirschmann, M. A., Genoud, C. Challenges of microtome-based serial block-face scanning electron microscopy in neuroscience: challenges of SBEM in neuroscience. Journal of Microscopy. 259 (2), 137-142 (2015).
- Śliwińska, M. A., et al. Long-term Memory Upscales Volume of Postsynaptic Densities in the Process that Requires Autophosphorylation of αCaMKII. Cerebral Cortex. 30 (4), 2573-2585 (2020).
- Borczyk, M., Śliwińska, M. A., Caly, A., Bernas, T., Radwanska, K. Neuronal plasticity affects correlation between the size of dendritic spine and its postsynaptic density. Scientific Reports. 9 (1), 1693 (2019).
- Leighton, S. B. SEM images of block faces, cut by a miniature microtome within the SEM - a technical note. Scanning Electron Microscopy. , 73-76 (1981).
- Denk, W., Horstmann, H. Serial Block-Face Scanning Electron Microscopy to Reconstruct Three-Dimensional Tissue Nanostructure. PLoS Biology. 2 (11), 329 (2004).
- Smith, D., Starborg, T. Serial block face scanning electron microscopy in cell biology: Applications and technology. Tissue and Cell. 57, 111-122 (2019).
- Titze, B., Genoud, C. Volume scanning electron microscopy for imaging biological ultrastructure: Volume scanning electron microscopy. Biology of the Cell. 108 (11), 307-323 (2016).
- Deerinck, T. J., Bushong, E. A., Thor, A., Ellisman, M. H. . NCMIR methods for 3D EM: A new protocol for preparation of biological specimens for serial block face scanning electron microscopy. , 6-8 (2010).
- Willingham, M. C., Rutherford, A. V. The use of osmium-thiocarbohydrazide-osmium (OTO) and ferrocyanide-reduced osmium methods to enhance membrane contrast and preservation in cultured cells. Journal of Histochemistry & Cytochemistry. 32 (4), 455-460 (1984).
- Feng, G., et al. Imaging Neuronal Subsets in Transgenic Mice Expressing Multiple Spectral Variants of GFP. Neuron. 28 (1), 41-51 (2000).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Paxinos, G., Franklin, K. B. J. . The mouse brain in stereotaxic coordinates. , (2004).
- Walton, J. Lead aspartate, an en bloc contrast stain particularly useful for ultrastructural enzymology. Journal of Histochemistry & Cytochemistry. 27 (10), 1337-1342 (1979).
- Mercer, E. H. a scheme for section staining in electron microscopy. Journal of the Royal Microscopical Society. 81 (3-4), 179-186 (1963).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Belevich, I., Joensuu, M., Kumar, D., Vihinen, H., Jokitalo, E. Microscopy Image Browser: A Platform for Segmentation and Analysis of Multidimensional Datasets. PLOS Biology. 14 (1), 1002340 (2016).
- Fiala, J. C. Reconstruct: a free editor for serial section microscopy. Journal of Microscopy. 218 (1), 52-61 (2005).
- Roels, J., et al. An interactive ImageJ plugin for semi-automated image denoising in electron microscopy. Nature Communications. 11 (1), 771 (2020).
- Radwanska, K., et al. Mechanism for long-term memory formation when synaptic strengthening is impaired. Proceedings of the National Academy of Sciences. 108 (45), 18471-18475 (2011).
- Kittelmann, M., Hawes, C., Hughes, L. Serial block face scanning electron microscopy and the reconstruction of plant cell membrane systems: SBFSEM Methods for Plant Cells. Journal of Microscopy. 263 (2), 200-211 (2016).
- Fendrych, M., et al. Programmed Cell Death Controlled by ANAC033/SOMBRERO Determines Root Cap Organ Size in Arabidopsis. Current Biology. 24 (9), 931-940 (2014).
- Russell, M. R. G., et al. 3D correlative light and electron microscopy of cultured cells using serial blockface scanning electron microscopy. Journal of Cell Science. 130 (1), 278-291 (2017).
- Płachno, B. J., Świątek, P., Jobson, R. W., Małota, K., Brutkowski, W. Serial block face SEM visualization of unusual plant nuclear tubular extensions in a carnivorous plant (Utricularia, Lentibulariaceae). Annals of Botany. 120 (5), 673-680 (2017).
- Genoud, C., Titze, B., Graff-Meyer, A., Friedrich, R. W. Fast Homogeneous En Bloc Staining of Large Tissue Samples for Volume Electron Microscopy. Frontiers in Neuroanatomy. 12, (2018).
- Puhka, M., Joensuu, M., Vihinen, H., Belevich, I., Jokitalo, E. Progressive sheet-to-tubule transformation is a general mechanism for endoplasmic reticulum partitioning in dividing mammalian cells. Molecular Biology of the Cell. 23 (13), 2424-2432 (2012).
- Gluenz, E., Wheeler, R. J., Hughes, L., Vaughan, S. Scanning and three-dimensional electron microscopy methods for the study of Trypanosoma brucei and Leishmania mexicana flagella. Methods in Cell Biology. 127, 509-542 (2015).
- Starborg, T., et al. Using transmission electron microscopy and 3View to determine collagen fibril size and three-dimensional organization. Nature Protocols. 8 (7), 1433-1448 (2013).
- Hughes, L., Borrett, S., Towers, K., Starborg, T., Vaughan, S. Patterns of organelle ontogeny through a cell cycle revealed by whole-cell reconstructions using 3D electron microscopy. Journal of Cell Science. 130 (3), 637-647 (2017).
- Bojko, A., et al. Improved Autophagic Flux in Escapers from Doxorubicin-Induced Senescence/Polyploidy of Breast Cancer Cells. International Journal of Molecular Sciences. 21 (17), 6084 (2020).
- Knott, G. W., Holtmaat, A., Trachtenberg, J. T., Svoboda, K., Welker, E. A protocol for preparing GFP-labeled neurons previously imaged in vivo and in slice preparations for light and electron microscopic analysis. Nature Protocols. 4 (8), 1145-1156 (2009).
- Glauert, A. M., Lewis, P. R. . Biological specimen preparation for transmission electron microscopy. , (2014).
- Genoud, C. Altered Synapse Formation in the Adult Somatosensory Cortex of Brain-Derived Neurotrophic Factor Heterozygote Mice. Journal of Neuroscience. 24 (10), 2394-2400 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved