Method Article
تحليلات أكتين دايناميكز، اقتران مخلب وقوة الجر للنمو مخروط مقدما
In This Article
Summary
للتقدم، يجب أن تمارس مخاريط النمو قوى جذب ضد البيئة الخارجية. جيل قوى الجر يعتمد على ديناميات أكتين واقتران مخلب. وتصف هذه الدراسة أساليب لتحليل ديناميات أكتين، اقتران مخلب وقوى الجر للتقدم مخروط النمو.
Abstract
لإنشاء شبكات وظيفية، يجب أن تهاجر الخلايا العصبية إلى وجهاتها المناسبة ومن ثم توسيع المحاور نحو الخلايا المستهدفة. هذه العمليات تعتمد على التقدم من المخاريط النمو التي تقع على نصائح من neurites. المخاريط النمو أكسنال توليد القوى الدافعة من خلال استشعار البيئة الدقيقة المحلية وتعديل ديناميات الهيكل الخلوي واقتران أكتين الالتصاق (اقتران مخلب). وقد أدت عقود من البحث إلى تحديد جزيئات التوجيه، ومستقبلاتها، وسلاسل الإشارات المصب لتنظيم هجرة الخلايا العصبية والتوجيه المحوري. ومع ذلك ، فإن الآلات الجزيئية اللازمة لتوليد القوى لدفع النمو مخروط التقدم والملاحة هي مجرد بداية لتوضيح. في الحافة الرائدة من المخاريط نمو الخلايا العصبية, خيوط أكتين الخضوع لتدفق الرجعية, الذي يعمل بالبوليمرة actin وتقلص actomyosin. اقتران مخلب بين تدفق F-actin الرجعية وركيزة لاصقة يولد قوى الجر للتقدم مخروط النمو. وتصف هذه الدراسة بروتوكولا مفصلا لرصد التدفق الرجعي ل F-actin عن طريق التصوير البقعي الواحد. الأهم من ذلك، عندما يقترن F-actin علامة Lifeact، يمكن لهذه التقنية قياس 1) معدل البلمرة F-أكتين و 2) كفاءة اقتران مخلب بين تدفق F-actin الرجعية والركيزة لاصقة. كلاهما متغيرات حاسمة لتوليد القوى لتحقيق تقدم مخروط النمو والملاحة. وبالإضافة إلى ذلك، تصف هذه الدراسة بروتوكولا مفصلا للفحص المجهري لقوة الجر، والذي يمكن أن يحدد 3) قوة الجر الناتجة عن مخاريط النمو. وهكذا، من خلال اقتران تحليلات التصوير بقع واحد والجر قوة المجهر، يمكن للمحققين رصد الميكانيكا الجزيئية الكامنة وراء النمو مخروط مقدما والملاحة.
Introduction
في الدماغ الفقاري النامية، والخلايا العصبية الخضوع لهجرات منظمة بشكل متقن ومشروع محاور عصبية نحو شركاء متشابك المناسبة لإنشاء شبكات الخلايا العصبية وظيفية1،2،3. المخاريط النمو، والتي هي هياكل الحسية والحركية تقع في غيض من neurites، وتحديد سرعة واتجاه هجرة الخلايا العصبية و outgrowthon المحور3،4،5. منذ الخلايا العصبية محاطة ببيئات معبأة بإحكام، يجب أن المخاريط النمو ممارسة القوى ضد بيئتها للمضي قدما6،7. لفهم الآليات الكامنة وراء هجرة الخلايا العصبية والتوجيه المحوري، وتحليلات الميكانيكا الجزيئية للتقدم مخروط النمو ضرورية.
وقد كشفت عقود من التحليل أن قوة الجر لدفع التقدم مخروط النمو يتم إنشاؤها بواسطة آلية "مخلب"; ويعتقد أن هذه الآلية تعمل ليس فقط في مخروط النمو المحوري ولكن أيضا في مخروط نمو العملية الرائدة من الخلايا العصبية المهاجرة8,9,10,11,12. وهي خيوط أكتين (F-actins) في المخاريط النمو بلمرة في الحافة الرائدة وإزالة الطابع المباشر، ودفع من الغشاء الرائدة13،14،15. القوة الناتجة, بالتزامن مع انكماش actomyosin, يحفز حركة الخلفية من F-actins دعا flowins الرجعية7,11,16,17,18,19,20,21. مخلب- وخلايا الالتصاق جزيئات التوسط اقتران الميكانيكية بين تدفق F-actin الرجعية وركيزة لاصقة ونقل قوة تدفق F-actin على الركيزة, وبالتالي توليد قوة الجر للنمو مخروط advance7,8,9,11,12,22 . في الوقت نفسه ، يقلل اقتران actin-substrate من سرعة تدفق F-actin ويحول البلمرة actin إلى القوة لتبرز الغشاء الرائد 9،10.
المخاريط النمو أكسنال الشعور العظة الكيميائية المحلية ونقلها إلى قوة دافعة اتجاهية للملاحة مخروط النمو3,23,24,25. على سبيل المثال، يحفز جزيء توجيه المحور netrin-1 مستقبلاته المحذوفة في سرطان القولون والمستقيم (DCC)، وينشط ثلاثي الفوسفات (GTP) الربط بين البروتينات بروتين التحكم في البروتينات 42 (Cdc42) وركيزة توكسين C3 botulinum ذات الصلة 1 (Rac1)، وكيناز في المصب p21 تنشيط كيناز 1 (Pak1)26. Cdc42 وRac1 تعزيز 1) البلمرة actin، وباك1 الفوسفوريلات جزيء مخلب shootin122،26. يتفاعل Shootin1 مع تدفق F-actin إلى الوراء عبر كورتاكتين بروتين ملزم لل أكتين27. يتفاعل Shootin1 أيضا مع جزيء التصاق الخلية L1 (L1-CAM)20,24. Shootin1 الفوسفور يزيد من تقارب ملزمة للكورتاكتين وL1-CAM, ويعزز shootin1 بوساطة 2) مخلب اقتران24,27. داخل مخروط النمو، التنشيط غير المتماثلة من البلمرة actin واقتران مخلب زيادة 3) قوة الجر على جانب مصدر netrin-1، وبالتالي توليد قوة دافعة اتجاهية لتحويل مخروط النمو (الشكل 1)24. وقد عززت البحوث المكثفة على مدى العقود القليلة الماضية فيما يتعلق هجرة الخلايا العصبية والتوجيه المحور فهم جزيئات التوجيه، ومستقبلاتها، وما يرتبط بها من الشلالات الإشارات المصب2،10،28،29،30. ومع ذلك، فإن الآلات الجزيئية لتوليد قوى من أجل التقدم مخروط النمو بدأت للتو أن تكون أوضح؛ ويمكن أن يعزى ذلك إلى الاستخدام المحدود للبروتوكولات للتحليلات الميكانيكية البيولوجية.
وتصف هذه الدراسة بروتوكولا مفصلا لرصد التدفق الرجعي ل F-actin عن طريق التصوير البقعي الواحد16,18. وقد تم رصد التدفق الرجعي F-actin على نطاق واسع باستخدام المجهر فائقة الدقة، والغزل القرص المجهري confocal والتداخل الكلي انعكاس مضان (TIRF) المجهر25،31،32،33،34،35،36،37،38 . غير أن البروتوكول في هذه الدراسة يستخدم مجهرا قياسيا للفلورة، وبالتالي يمكن اعتماده بسهولة11,16,18,20,22,23,24,27,39,40,41,42. عند دمجها مع وضع العلامات F-actin بواسطة Lifeact43 ، يسمح التصوير البقعي الواحد بالتقييم الكمي لمعدل البلمرة actin وكفاءة اقتران القابض بين التدفق الرجعي F-actin والركيزة اللاصقة3942. وتصف هذه الدراسة كذلك بروتوكولا مفصلا للفحص المجهري لقوة الجر باستخدام هلام البولي أكريلاميد (PAA) المدمج في حبة الفلورسنت 11,22,23,24,27,39,41,42,44. هذه الطريقة بالكشف عن وكميا قوة الجر تحت مخروط النمو من خلال رصد حركات حبة الناجمة عن القوة4445. يتم توفير رمز تحليل قوة الجر مفتوحة المصدر ، ويتم شرح طريقة تحديد قوة الجر أثناء هجرة مخروط النمو بالتفصيل. بمساعدة التصوير بقع واحد والجر قوة المجهر، سيتم تسهيل فهم الميكانيكا الجزيئية الكامنة وراء الهجرة مخروط النمو والملاحة. هذه التقنيات تنطبق أيضا على تحليل الميكانيكا الجزيئية الكامنة وراء تضخم العمود الفقري dendritic، والذي هو معروف أن تكون مهمة في التعلم والذاكرة42.
Protocol
أجريت جميع التجارب باستخدام المختبر مع اللجنة المؤسسية لرعاية الحيوان واستخدامه التابعة لمعهد نارا للعلوم والتكنولوجيا. وينبغي للمحققين اتباع المبادئ التوجيهية المعمول بها من قبل لجانهم التنظيمية المؤسسية والوطنية المعنية بالحيوانات لرعاية واستخدام المختبرات.
1. إعداد الحلول والإعلام
- إعداد الحلول والوسائط الثقافية كما تم تلخيصها في الملف التكميلي 1
2. إعداد بولي مد ليسين (PDL) / الركائز المغلفة باللامينين
- معطف 14 مم قطرها أطباق الزجاج القاع مع 100 ميكروغرام / مل PDL، حل في المالحة العازلة الفوسفات (PBS، درجة الحموضة 7.4)، واحتضان لليلة واحدة في حاضنة رطبة في 37 درجة مئوية.
ملاحظة: لا تجف أسطح الزجاج بعد هذه الخطوة - إزالة الحل PDL وماصة 1 مل من برنامج تلفزيوني على الزجاج لمدة 10 ق ثلاث مرات.
- معطف الأطباق مع 5 ميكروغرام / مل صفح، حل في برنامج تلفزيوني، واحتضان لليلة واحدة في حاضنة رطبة في 37 درجة مئوية.
- إزالة محلول صفح وماصة 1 مل من برنامج تلفزيوني على الزجاج لمدة 10 ق ثلاث مرات.
- إزالة برنامج تلفزيوني ووضع 0.5 مل من المتوسط العصبي على الأسطح الزجاجية. تخزين الأطباق في حاضنة رطبة في 37 درجة مئوية.
ملاحظة: يمكن تخزين الأطباق المغلفة بالطبق PDL/laminin لمدة 2-3 أيام في حاضنة مرطبة عند 37 درجة مئوية.
3. تشريح وتفكك قرن آمون
- قتل الفأر الحامل عن طريق خلع عنق الرحم.
ملاحظة: تستخدم هذه الدراسة الفئران المتاحة تجاريا (انظر جدول المواد). يجب على المحققين استخدام الفئران التي يتم تربيتها وعلاجها إنسانيا في بيئة معقمة. - تشريح الأجنة الجنينية اليوم 16 (E16) أجنة الفئران، ووضعها على الجليد.
- في غطاء تدفق صفح، تشريح العقول مع مقص ووضعها على طبق 10 سم معقمة تحتوي على 10 مل من محلول تشريح الجليد البارد.
- مع المجهر ستيريو تشريح، قشر بعناية بعيدا السحالي من نصفي الكرة الأرضية الدماغية ومن ثم تشريح فرس النهر باستخدام ملقط.
- نقل فرس النهر إلى 5 مل من محلول الهضم الجليد البارد في أنبوب 15 مل. احتضان فرس النهر في حمام مائي لمدة 20 دقيقة في 37 درجة مئوية.
- إزالة محلول الهضم وإضافة 3 مل من محلول تشريح.
- ماصة بلطف فرس النهر أربع مرات مع ماصة باستور.
- احتضان فرس النهر في حمام مائي لمدة 20 دقيقة في 37 درجة مئوية.
- نقل تعليق الخلية إلى أنبوب الطرد المركزي 50 مل. إضافة 3 مل من محلول تشريح جديد للأنسجة غير المرتبطة.
- كرر الخطوات 3.7-3.9 حتى يتم فصل فرس النهر تماما.
- إزالة المجاميع العائمة من الحمض النووي من تعليق الخلية عن طريق الدوران وspirating مع ماصة باستور. الطرد المركزي تعليق الخلية في 180 × ز لمدة 20 دقيقة في 4 درجة مئوية.
ملاحظة: الحمض النووي المستمدة من الخلايا التالفة سوف يزعج عملية الطرد المركزي. إذا بقيت الخلايا العصبية في الفائقة، طرد مركزي تعليق الخلية مرة أخرى بعد إزالة بعناية الحمض النووي. - وسيطة عصبية متساوية الأضلاع تحتوي على مصل بقري جنيني بنسبة 10٪ (FBS) ، وبينسلين (100 U / mL) ، وستريبتومايسين (100 ميكروغرام / مل) في حاضنة مرطبة عند 37 درجة مئوية مع 5٪ من ثاني أكسيد الكربون.
4. العدوى وزراعة الخلايا العصبية
- إزالة supernatant وإضافة 5 مل من الجليد الباردة برنامج تلفزيوني في أنبوب 50 مل. Resuspend بيليه الخلية عن طريق الأنابيب لطيف.
- نقل 10 ميكرولتر من تعليق الخلية في أنبوب الطرد المركزي الدقيق, إضافة 10 ميكرولتر من 0.5٪ الحل الأزرق تريبان, ومن ثم عد عدد الخلايا مع مقياس الدم.
- الطرد المركزي تعليق الخلية في أنبوب 50 مل في 180 × ز لمدة 20 دقيقة في 4 درجة مئوية.
- في غضون ذلك، aliquot لtransfection، 1 ميكروغرام من pFN21A-HaloTag-أكتين و 3 ميكروغرام من pmNeonGreen-N1-Lifeact لكل 1 × 106 خلايا، في أنبوب الطرد المركزي الدقيق.
- بعد الطرد المركزي، قم بإزالة الناطور وأضف 100 ميكرولتر من وسيطة الكهرومporation (التي توفرها عدة العدوى) إلى أنبوب 50 مل. إعادة إنفاق بيليه الخلية عن طريق الأنابيب.
- اخلط تعليق الخلية مع محلول الحمض النووي المقتبس ونقل الخليط إلى كوفيت (مقدم من عدة العدوى).
ملاحظة: نظرا لأن فقاعات الهواء تزعج الكهرومporation، قم بإزالتها من تعليق الخلية. - أدخل الكوفيت في جهاز الكهرومporation (جدول المواد)، وادخل الكهرومporation باستخدام برنامج O-005.
- إضافة فورا 1 مل من المتوسط العصبية قبل الدافئة والمتوازنة التي تحتوي على 10٪ FBS، البنسلين (100 U/mL)، والستريبتوميسين (100 ميكروغرام / مل) إلى cuvette.
- نقل تعليق الخلية إلى أنبوب الطرد المركزي 15 مل باستخدام ماصة بلاستيكية (التي تقدمها عدة transfection).
- نقل 10 ميكرولتر من تعليق الخلية إلى microtube، إضافة 10 ميكرولتر من محلول أزرق 0.5٪ تريبان، ومن ثم عد عدد الخلايا مع مقياس الدم.
- أخرج أطباق PDL/laminin المغلفة بالزجاج السفلي من الحاضنة وأزل الوسط العصبي.
- ماصة 0.5 مل من تعليق الخلية التي تحتوي على 2.0 × 105 خلايا لكل طبق واحتضان في حاضنة مرطبة في 37 درجة مئوية مع 5٪ CO2 لمدة 3 ساعة.
- استبدال المتوسطة مع 0.5 مل من المتوسط العصبي القاعدي تحتوي على 2٪ B-27 الملحق, الجلوتامين (1 mM), البنسلين (100 U/mL), وستريبتومايسين (100 ميكروغرام / مل). زراعة الخلايا العصبية في حاضنة مرطبة لمدة 3 أيام عند 37 درجة مئوية مع 5٪ CO2.
5. التصوير بقعة واحدة في المخاريط نمو الخلايا العصبية
- في اليوم في المختبر (DIV) 3، علاج الخلايا العصبية مع رباعي ميثيل رودامين (TMR) ليغاند في تخفيف 1:2000 في الثقافة المتوسطة. الحفاظ على الخلايا العصبية لمدة 1 ساعة في 37 درجة مئوية مع 5٪ CO2.
- غسل ليغند TMR ثلاث مرات مع برنامج تلفزيوني قبل الحارة.
- إزالة برنامج تلفزيوني وماصة 0.5 مل من المتوسط L-15 ليبوفيتز الدافئة التي تحتوي على 2٪ B-27 الملحق, الجلوتامين (1 mM), البنسلين (100 U/mL), والستريبتوميسين (100 ميكروغرام / مل).
- الحفاظ على الخلايا العصبية لمدة ساعة واحدة عند 37 درجة مئوية.
- بدوره على المجهر epifluorescence وتعيين حاضنة المرحلة الأعلى إلى 37 درجة مئوية.
ملاحظة: يستخدم هذا البروتوكول مجهرا فائق الفلورة مزودا بكاميرا أشباه الموصلات التكميلية لأكسيد المعادن، وعدسة موضوعية للغمر بالزيت 100x/1.40 NA، ومصباح زئبق، وبرنامج الحصول على الصور (انظر جدول المواد). ويمكن أيضا استخدام المجاهر الأخرى ذات المواصفات المكافئة لهذا التحليل. - ضع الخلايا العصبية المعالجة ب TMR ligand في طبق الزجاج السفلي على حاضنة المرحلة العليا الدافئة.
- تعيين معلمات الحصول على الصورة كما يلي: وقت التعرض، 500 مللي ثانية لقنوات الفلورسنت Lifeact و HaloTag-actin؛ binning، 1 × 1 (0.065 ميكرومتر × 0.065 ميكرومتر لكل بكسل)؛ الفاصل الزمني، 3 s؛ المدة، 50 إطار.
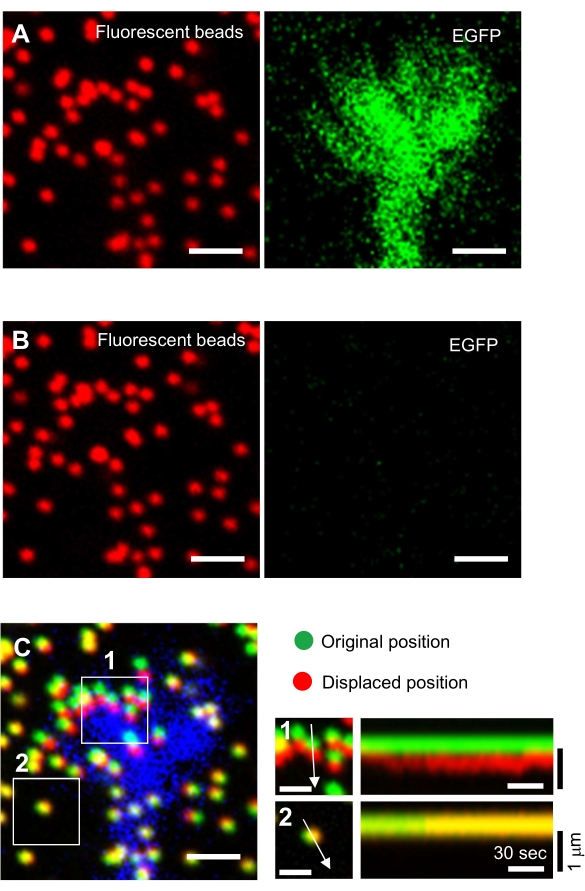
- حدد مخروط النمو الذي يعبر بقوة عن Lifeact ويعبر بشكل ضعيف عن HaloTag-actin.
ملاحظة: يجب أن يكون التعبير Lifeact قوية بما يكفي لتصور مورفولوجيا مخروط النمو. يجب أن يكون تعبير HaloTag-actin ضعيفا بشكل غير كاف ليتم اكتشافه (الشكل 2A). يمكن تعديل مستويات تعبيرات البروتين الفلوري عن طريق تغيير كمية الحمض النووي للإصابة بالعدوى. - أغلق حقل الحجاب الحاجز لإلقاء الضوء على منطقة دنيا تتضمن مخروط النمو (الشكل 2B).
ملاحظة: الإضاءة من منطقة الحد الأدنى يقلل من إشارة الخلفية ويزيد من إشارة مضان إلى نسبة الضوضاء (S / N)، مما يتيح الكشف عن بقع أكتين (الشكل 2B). لزيادة نسبة S/N، يوصى بإضاءة مخروط النمو دون تقليل الضوء بواسطة مرشحات الكثافة المحايدة. - الحصول على صور الفاصل الزمني (الملف التكميلي 2). حفظ كصورة مكدس الزمنية متعددة القنوات (تنسيق tiff).
6. الكميات من F-actin سرعة التدفق ومعدل البلمرة باستخدام برنامج معالجة الصور وتحليل فيجي
ملاحظة: الرجوع إلى الملف التكميلي 3 للحصول على بيانات الممارسة لتحديد سرعة تدفق F-actin ومعدل البلمرة أكتين.
- افتح صورة مكدس الوقت متعدد القنوات على فيجي.
- حدد تحليل > تعيين مقياس وتعيين حجم البكسل للصور.
- العثور على بقعة أكتين التي تتدفق إلى الوراء لمدة لا تقل عن خمسة أطر زمنية داخل حزمة F-actin في filopodia أو lamellipodia.
- حدد image > تحويل > Rotate، وضبط زاوية الصور بحيث تشير حزمة F-actin إلى الأعلى (الشكل 3A).
- انقر على المستطيل على شريط الأدوات، وارسم مربع يتضمن بقع أكتين وطرف حزمة F-actin (الشكل 3B و 1 و 2).
ملاحظة: إشارات بقع HaloTag-actin ضعيفة. بالإضافة إلى ذلك، إشارات Lifeact في نصائح البعيدة من مخروط النمو ضعيفة وخافتة (الشكل 2B) لأن نصائح البعيدة من مخروط النمو رقيقة بالمقارنة مع الجزء القريب. وينبغي للمحققين تعزيز الإشارات لتحسين الكميات من سرعة تدفق F-actin ومعدل البلمرة (الشكل 3B). على الرغم من أن إشارة Lifeact في مخروط النمو القريب تصبح مشبعة ، إلا أن هذا لن يزعج تحديد النهاية البعيدة ل F-actins (الشكل 3E ، الخط الأصفر). - حدد الصورة > تكرار وإدخال الإطارات الزمنية الخمسة (الشكل 3B، 3-5).
- حدد > الصور مكدسات > جعل المونتاج، وإدخال المعلمات: أعمدة، 5؛ صفوف، 1؛ عامل المقياس، 1.
- انقر على موافق. ستظهر الصورة المونتاج على الشاشة.
- حدد > الصور > اللون تقسيم القنوات. وهذا يفصل بين القناتين الفلوريتين.
- القياس الكمي لسرعة تدفق F-actin.
- حدد تحليل > تعيين القياسات، واختر المنطقة والمستطيل المحيط.
- انقر فوق البيضاوي على شريط الأدوات، ورسم دائرة على بقعة أكتين (الشكل 3C، 1 و 2).
- حدد تراكب > الصورة > إضافة التحديد. يتم تراكب الدائرة على المونتاج الصورة (الشكل 3C، 3، و 4).
ملاحظة: يمكن تغيير لون التراكب في تحرير خيارات > > الألوان. - كرر تراكب الدوائر للنقط المتبقية (الشكل 3C، 5).
ملاحظة: لتحديد بدقة مراكز بقع أكتين، يجب على المحققين تراكب الدوائر على البقع. - انقر على مستقيم على شريط الأدوات، ورسم خط يربط بين مراكز الدوائر (الشكل 3D، 1 و 2).
- حدد تحليل مقياس >. ستظهر النتيجة على الشاشة (الشكل 3D، 3).
ملاحظة: الارتفاع المعروض في النتيجة يشير إلى مسافة نقل بقعة أكتين أثناء الملاحظة (الشكل 3D، 3). - حساب سرعة تدفق F-actin بقسمة مسافة النقل على وقت المراقبة.
- التحديد الكمي لمعدل البلمرة F-actin.
- رسم خط يربط بين نصائح حزمة F-actin (الشكل 3E، 1).
- حدد تحليل مقياس >. ستظهر النتيجة على الشاشة (الشكل 3E، 2).
ملاحظة: يشير الارتفاع في النتيجة إلى طول امتداد حزمة F-actin أثناء الملاحظة (الشكل 3E، 2). - حساب معدل تمديد F-actin بقسمة طول التمديد على وقت الملاحظة.
- حساب معدل البلمرة F-actin كمجموع سرعة تدفق F-actin ومعدل التمديد (الشكل 3F).
7. إعداد هلام PAA للجر قوة المجهر والثقافات العصبية
- إعداد المواد الهلامية PAA اللازمة للفحص المجهري قوة الجر (الشكل 4)
- ماصة 0.5 مل من NaOH (100 mM)، مذابة في H2O المقطر، على أطباق ذات قاع زجاجي قطره 27 مم، واحتضان لمدة 15 دقيقة في درجة حرارة الغرفة (RT).
- أضف 50 ميكرولتر من 3-aminopropyltrimethyoxysilane (APTMS) إلى محلول NaOH على الأطباق واخلط الحلول عن طريق الأنابيب اللطيفة ، واحتضن لمدة 15 دقيقة في RT.
- غسل الأطباق الزجاج القاع مع H2O المقطر، والجافة.
- Pipette 0.5 مل من محلول الجلوتارادهيد 0.5٪ ، المذاب في PBS ، على طبق الزجاج السفلي المعالج من APTMS ، واحتضانه لمدة 30 دقيقة في RT.
- غسل الأطباق ذات القاع الزجاجي مع H2O المقطر والجافة.
- إعداد حل يحتوي على محلول H2O المقطر (412 ميكرولتر) و30٪ (ث/v) محلول أكريلاميد (63 ميكرولتر) و2.5٪ (ث/v) محلول بيس أكريلاميد (6 ميكرولتر) وحل ميكروسفير معدل بالكاربوكسيلات (حبة فلورية) (20 ميكرولتر).
ملاحظة: دوامة حل حبة الفلورسنت إلى فصل الخرز المجمعة قبل إضافة إلى الحل أكريلاميد. - ديغا الحل في غرفة فراغ لمدة 30 دقيقة في RT.
- لهذا الحل، إضافة 1 ميكرولتر من 10٪ (ث / v) بيرسولفوات الأمونيوم (APS)، المذاب في H2O المقطر، و 1 ميكرولتر من N، N'، N'tetramethylethylenediamine (TEMED)، ومزيج عن طريق الأنابيب لطيف.
- ضع غطاء زجاجي (قطره 18 مم) على غطاء أنبوب طرد مركزي سعة 15 مل.
- أضف على الفور 25 ميكرولتر من الحل إلى غطاء الغطاء ، ثم ضع بلطف طبق ا مقلوبا من الزجاج السفلي على الغطاء. السماح للأكريلاميد لبوليمرة لمدة 1 ساعة في RT.
- تطبيق H2O المقطر على coverslip وقشر بعيدا عن هلام باستخدام إبرة حقنة مع طرف عازمة.
- إزالة H2O وإضافة sulfo-SANPAH (1 mM)، حل في برنامج تلفزيوني، إلى هلام.
- في ظل ظروف معقمة، يعرض المواد الهلامية للأشعة فوق البنفسجية لمدة 5 دقائق. غسل الجل ثلاث مرات مع برنامج تلفزيوني لمدة 15 دقيقة لكل غسل.
- تحديد صلابة هلام مع طريقة المسافة البادئة ميكروسفير (الشكل 5A)44.
- نقل ميكروسفير الذي تم تحديده القطر وكثافته، إلى هلام ومن ثم وضعه على مرحلة عينة من المجهر confocal المسح بالليزر.
- التركيز على سطح هلام وتسجيل ض الموقف (الشكل 5B).
- وبالمثل، ركز على الجزء السفلي من الغلاف المجهري، وسجل موضع z (الشكل 5C).
- حساب عمق المسافة البادئة كما يحددها الفرق بين المواضع z من سطح هلام وأسفل ميكروسفير.
- حساب معامل يونغ E من هلام من قبل:
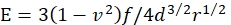
حيث f هو وزن الطفو المصحح للغلاف المجهري ، d هو عمق المسافة البادئة للجل ، r هو نصف قطر الغلاف المجهري ، و v هو نسبة بواسون (التي تبلغ قيمتها 0.3 ، كما تم تحديدها سابقا46).
- معطف المواد الهلامية مع PDL واللحنين كما هو موضح في القسم 2.
- كما هو موضح في القسمين 3 و 4، تشريح أجنة الفئران E16، فرس النهر الفصام، وtransfect مع 5 ميكروغرام من pEGFP-C1 لكل 1.0 × 106 خلايا. البذور 2.0 × 105 خلايا على PDL / هلام مغلفة بالسمينين.
ملاحظة: لتحليل قوة الجر، التصوير المجهري للخلايا ذات العلامات الفلورية ضروري لتحديد منطقة مخروط النمو.
8. الجر قوة المجهر في المخاريط نمو الخلايا العصبية
- على DIV3، استبدل الوسط الثقافي ب 0.5 مل من متوسط L-15 من Leibovitz الدافئ الذي يحتوي على 2٪ ملحق B-27، والغلوتامين (1 mM)، البنسلين (100 U/mL)، والستريبتوميسين (100 ميكروغرام/مل). الحفاظ على الخلايا العصبية لمدة 1 ساعة في 37 درجة مئوية.
- قم بتشغيل مجهر كونفوجكال ليزري وقم بتعيين حاضنة المسرح إلى 37 درجة مئوية.
ملاحظة: تستخدم هذه الدراسة مجهرا ضوئيا ضوئيا بالليزر مجهزا بعدسة موضوعية للغمر بالمياه 63x/1.2 NA وبرنامج الحصول على الصور وتحليلها (انظر جدول المواد). - ضع الخلايا العصبية في طبق الزجاج السفلي على حاضنة المرحلة العليا التي تم تسخينها مسبقا.
- تعيين معلمات الحصول على الصورة كما يلي: حجم المسح الضوئي، 512 × 512 بكسل؛ مسح المنطقة، 1.5-3x التكبير؛ سرعة المسح الضوئي، ~1 s لكل إطار؛ الطول الموجي بالليزر، 561 نانومتر (الطول الموجي للإثارة للخرزات الفلورية) و 488 نانومتر (الطول الموجي للإثارة للبروتين الفلوري الأخضر المعزز (EGFP))؛ الفاصل الزمني، 3 s؛ المدة، 50 إطار.
- لتصور مورفولوجيا مخروط النمو، حدد مخروط النمو الذي يعبر بقوة عن EGFP.
- التركيز على سطح هلام والحصول على الصور الفاصل الزمني (الشكل 6A وملف تكميلي 4).
ملاحظة: لتحليل الجر، استخدم قناتين فلوريتين (للخرزات الفلورية وEGFP) وقناة ذات مجال ساطع (يوصى بالتقاط تباين التداخل التفاضلي (DIC) أو صور تباين الطور). - استخدم برنامج معالجة الصور (مثل فيجي) لإنتاج مداخن صور RGB ذات القناة الواحدة وحفظ هذه الصور كملفات tiff.
ملاحظة: من الضروري أن المحققين أيضا حفظ البيانات الأولية. - تطبيق 100 ميكرولتر من 10٪ (ث / الخامس) كبريتات دودسيل الصوديوم (SDS)، حل في H2O المقطر، إلى طبق الزجاج القاع للاسترخاء الركيزة هلام عن طريق الإفراج عن الخلايا العصبية من الركيزة. احتضان الطبق لمدة 5 دقائق في 37 درجة مئوية لتثبيت درجة الحرارة.
ملاحظة: يتم استخدام صورة الخرز في ركيزة غير مدربين للإشارة إلى مواقع الخرز الأصلية أثناء تحليل قوة الجر (الشكل 6C). تطبيق حل SDS يغير مواقف xyz بسبب التغير الحراري في الحاضنة والاسترخاء من تشوه الناجم عن الخلية. ولذلك، يحتاج المحققون إلى تصحيح المستوى البؤري وموقع x-y. - التركيز على سطح هلام، والحصول على صورة من الخرز في الركيزة غير المدربة (الشكل 6B).
- إنتاج صورة RGB قناة واحدة من الخرز في الركيزة غير المدربة، وحفظ هذه الصورة كملف tiff.
- تصحيح وضع x-y لصورة الخرز في الركيزة غير المدربة باستخدام فيجي
- في فيجي، افتح صورة الخرز في الركيزة غير المدربة وصورة مكدس الفاصل الزمني للخرزات الفلورية.
- حدد > الصور مكدسات > أدوات > سلسلة. سيظهر مربع حوار على الشاشة (الشكل 7A، 1).
- حدد صورة الخرز في الركيزة غير المدربة وصورة المكدس الفاصل الزمني للخرزات الفلورية في Image1 و Image2 على التوالي (الشكل 7A، 2).
- انقر على موافق. تتم إضافة صورة حبة في الركيزة غير المدربة إلى صورة مكدس الفاصل الزمني (الشكل 7A، 3).
- باستخدام شريط التمرير (الشكل 7B، 1، الإطار الأحمر)، عرض الإطار الثاني من صورة المكدس (السهم الأحمر).
- حدد الإضافات > StackReg (الشكل 7B، 2). سيظهر مربع حوار على الشاشة (الشكل 7B، 3).
- حدد Body Rigid من القائمة المنسدلة (الشكل 7B، 3، الإطار الأحمر) وانقر فوق موافق. ثم يبدأ تصحيح موضع x-y.
- استخدم شريط التمرير لعرض الإطار الأول لصورة المكدس المصححة موضع x-y.
- حدد الصورة > مكررة (الشكل 7C، 1). سيظهر مربع حوار على الشاشة (الشكل 7B، 2).
- إدخال 1 في النطاق، إلغاء تحديد المكدس المكرر (الشكل 7C، 2)، وانقر فوق موافق. ستظهر صورة الخرز المصححة للموقف x-y في الركيزة غير المدربة على الشاشة (الشكل 7C، 3). حفظ هذه الصورة كملف tiff.
- التحديد الكمي لقوة الجر
ملاحظة: الطريقة الموضحة هنا لتحليل قوة الجر تستخدم MATLAB واثنين من صناديق أدوات MATLAB، "صندوق أدوات معالجة الصور" و "مربع أدوات الحوسبة المتوازية". وسيحتاج المحققون إلى تركيبها قبل التحليل. تم تطوير رمز تحليل قوة الجر استنادا إلى إصدار MATLAB 2018a. لذلك، يجب استخدام إصدار MATLAB 2018a (أو أحدث) للتحليل. وقد وصفت الخوارزميات المستخدمة لتحليل قوة الجر سابقا22.- تحميل رمز تحليل قوة الجر TFM2021 من الملف التكميلي 5. فتح TFM 2021 في ماتلاب
- فتح الرئيسية.m في TFM2021 وتشغيله. ستظهر واجهة مستخدم رسومية (GUI) على الشاشة (الشكل 8A).
- انقر على تحميل صورة الركيزة غير المدربة وحدد صورة حبة x-y تصحيح الموقف في الركيزة غير المدربة.
- انقر على تحميل صور حبة الفلورسنت وحدد صورة المكدس الفاصل الزمني للخرزات.
- انقر على تحميل الصور ذات المجال الساطع وحدد صورة المكدس الفاصل الزمني للحقل الساطع.
- انقر على تحميل صور GFP وحدد صورة المكدس الفاصل الزمني ل EGFP.
- حدد GFP من القائمة المنسدلة على واجهة المستخدم الرسومية (الشكل 8A، المربع الأحمر).
- انقر على عائد الاستثمار لتحديد منطقة المستطيل ذات الأهمية (ROI)، بما في ذلك مخروط النمو، بالنقر فوق نقطتين على صورة الخلية المعروضة على واجهة المستخدم الرسومية (الشكل 8B).
- انقر على زر حفظ على واجهة المستخدم الرسومية (الشكل 8A، السهم الأحمر). سيتم حفظ صور المكدس المحددة، مع عائد الاستثمار، في ملف .mat (ملف تنسيق MATLAB).
- انقر على اكتشاف بقعة. سيظهر مربع حوار على الشاشة.
- إدخال قيمة (عادة 50-150) على مربع الحوار لتحديد عتبة للكشف عن حبة. يؤدي النقر فوق موافق إلى بدء الحساب.
- بعد الانتهاء من الحساب، انقر على مسار الرسم لتوسيع المنطقة المحددة في الخطوة 8.12.8 وعرض الخرز المكتشف كنقاط بيضاء (الشكل 8C، 1).
ملاحظة: تأكد ما إذا كان الكشف عن حبة (النقاط البيضاء) يتداخل مع حبات الفلورسنت. قد يكشف الكشف عن الخرز أيضا عن ضوضاء الخلفية. لتقليل هذا التداخل الخارجي، قم بتغيير قيمة العتبة في Spot detect. بالإضافة إلى ذلك، حدد النقاط الصحيحة يدويا في الخطوة 8.12.13. - انقر على حدد الخرز، وترسيم منطقة متعددة الأضلاع التي تتضمن النقاط الصحيحة تحت مخروط النمو. اضغط على Enter على لوحة المفاتيح. ستتغير النقاط البيضاء داخل المنطقة المضلعة إلى لون أحمر (الشكل 8C، 2).
- انقر على تقدير القوة على واجهة المستخدم الرسومية. ثم قيم الإدخال للمعلمات التالية: حجم البكسل، μm/pixel؛ معامل يونغ، القيمة المحسوبة في الخطوة 7.2.5؛ نسبة بواسون، 0.3.
- تنفيذ قوة التقدير لبدء الحساب. سيقوم البرنامج بحفظ نتائج الحساب في ملف تنسيق جدول البيانات تلقائيا.
ملاحظة: يعرض جدول البيانات x-component و y-component وقوة الحجم في كل إطار زمني (الشكل 8D). راجع الملف التكميلي 6 للحصول على بيانات الممارسة لتحديد قوة الجر.
النتائج
التصوير بقع واحد لقياس معدل البلمرة actin وكفاءة اقتران مخلب
تعبير Lifeact عالية تسمح F-actin التصور داخل مخروط النمو; تعبير HaloTag-actin منخفض يسمح بمراقبة التدفق الرجعي F-actin (الشكل 3، الملف التكميلي 2). تتبع بقع أكتين يسمح قياس سرعة تدفق F-أكتين (الشكل 3C، D). منذ اقتران الميكانيكية من التدفق الرجعية F-actin وركيزة لاصقة يقلل من سرعة تدفق F-actin، يمكن تقدير كفاءة اقتران مخلب من السرعة. وعلاوة على ذلك، F-أكتين وضع العلامات مع Lifeact يساعد التصور من تمديد F-أكتين ومفيدة لقياس معدل البلمرة أكتين (الشكل 3E، F).
التحليل الكمي لقوة الجر
الالتزام الصارم بالمنهجية المعروضة هنا سوف يكشف عن تحركات الخرز الفلوري تحت مخروط النمو (الشكل 6C، الملف التكميلي 4). F-actin تدفق الرجعية على الركيزة يولد قوة الجر مما تسبب في حبات الفلورسنت للتحرك الخلفي تحت مخروط النمو. تقدر شفرة تحليل قوة الجر قوة الجر من إزاحة حبة الفلورسنت، وتعبر عن قوة الجر المحسوبة كناقل قوة. يتم تحديد اتجاه وحجم قوة الجر من المكونات س ص من ناقلات القوة (الشكل 8C، D). يمثل المربع الأحمر في الشكل 8D المكونات س ص من متجه قوة; يصور الشكل 8C مخروط النمو المقابل. وفيما يتعلق بإحداثيات x-y، يشير المتجه إلى -93.8 درجة مقابل المحور س؛ يتم توجيه هذا الاتجاه نحو الجزء الخلفي من مخروط النمو (الشكل 8C). 22 - حسب حجم قوة الجر واو على النحو التالي:
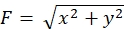
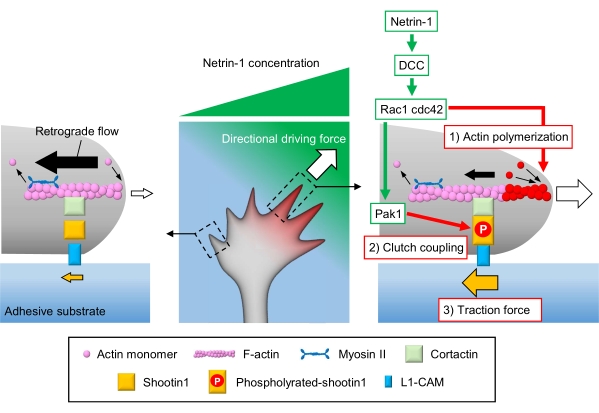
الشكل 1: آلات مخروط النمو لتوليد القوة والملاحة مخروط النمو. التدرج الكيميائي نيترين-1 يحفز التحفيز غير المتماثل لمستقبلاته DCC على مخروط نمو أكسنال. وهذا ينشط Rac1 و Cdc42، وkinase Pak1 المصب. Rac1 وCdc42 تعزيز (1) actin البلمرة، في حين Pak1 الفوسفوريلات shootin1، وتعزيز shootin1 بوساطة (2) اقتران مخلب. التنشيط غير المتماثل لديناميات أكتين واقتران مخلب داخل مخروط النمو يزيد (3) قوة الجر على جانب مصدر netrin-1، وبالتالي توليد قوة دافعة اتجاهية لجذب مخروط النمو. تسمح البروتوكولات المعروضة هنا بالتحديد الكمي للمتغيرات الرئيسية (1) -(3) للملاحة في مخروط النمو. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: صور الفلورية من مخروط نمو الخلايا العصبية تحت الحجاب الحاجز مفتوحة تماما وضيق. مخروط النمو يعبر عن Lifeact وHal أوتاغ أكتين. (أ) تعبير Lifeact عالية تسمح تصور مورفولوجيا مخروط النمو. من ناحية أخرى، مستويات التعبير HaloTag-actin منخفضة جدا، مع إشارات خافتة عندما يتم فتح الحجاب الحاجز بالكامل. (ب) عندما يتم تضييق الحجاب الحاجز بشكل مناسب، تتضاءل إشارات الخلفية، وتظهر بقع أكتين واحدة في مخروط النمو. أشرطة المقياس: 5 ميكرومتر. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: خطوات لقياس سرعة تدفق F-actin ومعدل البلمرة actin باستخدام برنامج معالجة الصور وتحليلها فيجي. (أ) ضبط زاوية الصورة للتحليل. (1) البحث عن وحدد بقعة أكتين (رأس السهم) التي تتدفق في حزمة F-actin. (2) حدد > الصورة تحويل > تدوير. (3) تعيين زاوية بحيث يتم توجيه حزمة F-actin صعودا. (4) سيتم تغيير زاوية الصورة. (ب) ترسيم المنطقة، بما في ذلك بقعة أكتين وحزمة F-actin. (1) انقر على مستطيل على شريط الأدوات. (2) تحديد منطقة على الصورة. يتم زيادة سطوع الصورة وتباينها للسماح بتصور واضح لنقطة actin وطرف حزمة F-actin. (3) حدد الصورة > مكررة. (4) إدخال الأطر الزمنية الخمسة التي تظهر تدفق بقع أكتين في حزمة F-actin. (5) ستظهر صورة المكدس المحددة على الشاشة. (ج) تراكب الدوائر على بقعة أكتين. (1) انقر على البيضاوي على شريط الأدوات. (2) رسم دائرة على بقعة actin. (3) حدد تراكب > الصورة > إضافة التحديد. (4) الدائرة متراكبة. 5) كرر تراكب الدوائر على بقع أكتين المتبقية. (د) قياس مسافة نقل بقع أكتين خلال الأطر الزمنية الخمسة. (1) انقر على مستقيم على شريط الأدوات. (2) رسم خط يربط بين مراكز الدوائر. (3) حدد تحليل قياس >. النتيجة، المشار إليها بواسطة المعلمة الارتفاع (مربع أحمر)، ترحيل مسافة نقل بقعة أكتين. (ه) قياس التغير في طول نتوء F-actin خلال الأطر الزمنية الخمسة. (1) رسم خط يربط بين نصائح من نتوء F-actin. (2) حدد تحليل > القياس. تشير النتيجة (المربع الأحمر)، الارتفاع، إلى طول تمديد حزمة F-actin. (و) يحسب معدل البلمرة actin من مجموع سرعة تدفق F-actin ومعدل التمديد. انظر أيضا الملف التكميلي 2. ويساعد الملف التكميلي 3 المحققين على ممارسة المنهجية المذكورة أعلاه. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
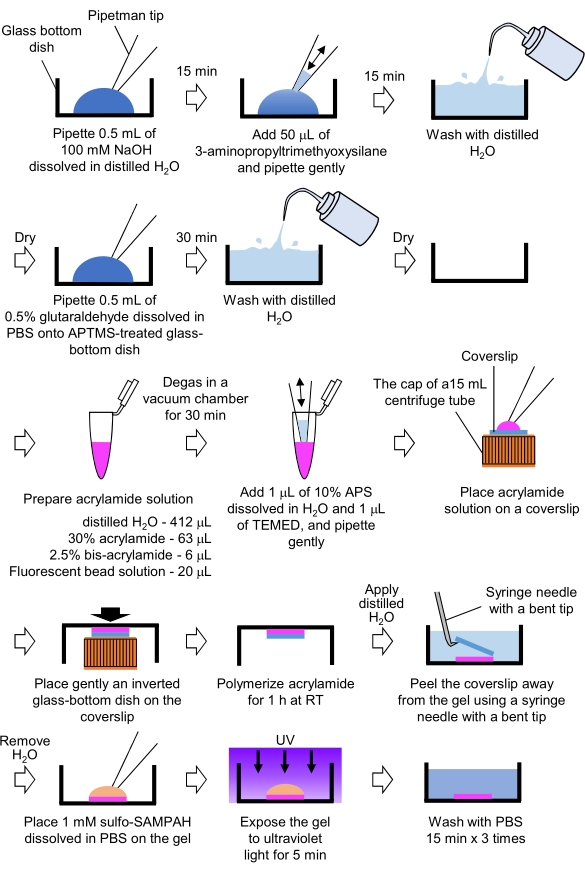
الشكل 4: خطوات لإعداد هلام PAA. يرجى الاطلاع على الخطوة 7.1 للحصول على وصف مفصل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
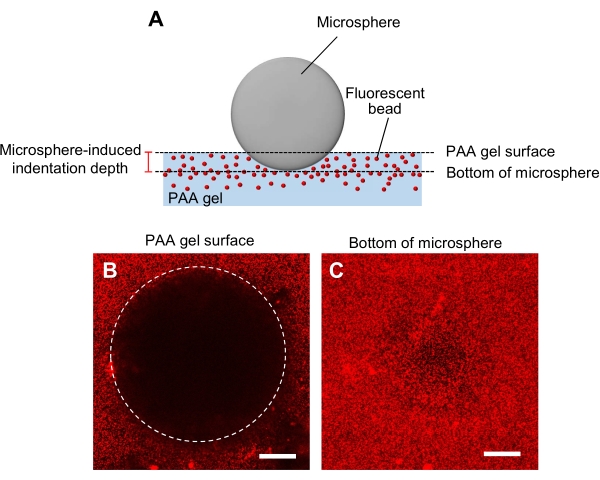
الشكل 5: تحديد صلابة هلام PAA. (أ) طريقة المسافة البادئة للغلاف المجهري. عندما يتم وضع ميكروسفير على هلام PAA حبة الفلورسنت جزءا لا يتجزأ، ووزن الغلاف المجهري يسبب المسافة البادئة في هلام. يتم حساب عمق المسافة البادئة عن طريق طرح المواقع z من سطح هلام PAA من أسفل الغلاف المجهري (B،C) صور الفلورية من هلام PAA المسافة البادئة من قبل ميكروسفير وتحتوي على حبات الفلورسنت. تم استخدام مجهر كونفوجكال ليزر لالتقاط صور لسطح الجل (B) وأسفل الغلاف المجهري (C). إشارات من الخرز الفلوري غير مرئية على سطح الجل في المنطقة البادئة (B، دائرة). ومع ذلك، يمكن ملاحظتها في الجزء السفلي من الغلاف المجهري. أشرطة المقياس: 50 ميكرومتر. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 6: رسم خرائط القوة من مخروط نمو الخلايا العصبية. (A-C) صور مفلورة من الخرز جزءا لا يتجزأ من هلام PAA ومخروط النمو العصبي تصور مع EGFP. بعد الحصول على صور الفاصل الزمني (A) ، تم تحرير الخلايا العصبية من ركيزة الجل عن طريق تطبيق محلول SDS ، وتم التقاط صورة للخرزات في الركيزة غير المدربة (B). (ج) تظهر صورة الخرز في الركيزة غير المدربة الخرز في مواقعها الأصلية (الخضراء) والمشردة (الحمراء). تظهر إشارة EGFP لمخروط النمو باللون الأزرق. تظهر الكيموغرافات (إلى اليمين) حركات الخرز على فترات 3 ق لمدة 147 ثانية، تشير إليها السهام في المنطقتين المعلبة 1 و2. الخرز في المنطقة 2 هو حبة مرجعية. أشرطة المقياس: 2 ميكرومتر ل (A) و (B) و (C، إلى اليسار)، و 1 ميكرومتر ل (C، الأوسط). انظر أيضا الملف التكميلي 4. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
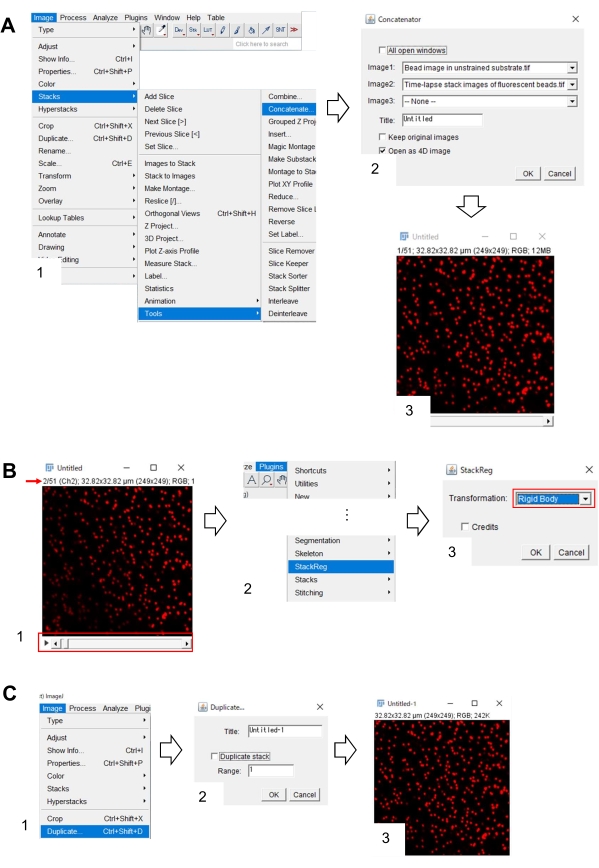
الشكل 7: خطوات لتصحيح موقف س ص من صورة حبة في الركيزة غير المدربة باستخدام فيجي. (أ) تجميع صورة حبة في ركيزة غير مدربين مع صورة المكدس الفاصل الزمني من الخرز الفلوري. (1) حدد > الصور مكدسات > أدوات > سلسلة. (2) حدد صورة الخرز في الركيزة غير المدربة وصورة المكدس الفاصل الزمني للخرزات الفلورية في Image1 و Image2 على التوالي. انقر على موافق. (3) تتم إضافة صورة حبة في الركيزة غير المدربة إلى صورة مكدس الفاصل الزمني. (ب) تصحيح موضع x-y لصورة حبة الفلورسنت. (1) استخدم شريط التمرير (الإطار الأحمر) لتحديد الإطار الثاني (السهم الأحمر) في كومة الصور. (2) حدد الإضافات > StackReg. (3) حدد الجسم جامدة من القائمة المنسدلة (الإطار الأحمر) وانقر على موافق. سيبدأ تصحيح موضع x-y. (C) حفظ صورة حبة موضع ص س تصحيح. بعد تحديد الإطار الأول من صورة المكدس المصححة للموقف x-y، (1) حدد الصورة > مكررة. (2) إدخال 1 في النطاق و إلغاء تحديد المكدس مكررة. ثم انقر على موافق. (3) سوف تظهر صورة حبة س ص تصحيح الموقف في الركيزة غير المدربة على الشاشة. حفظ هذه الصورة كملف tiff. ويساعد الملف التكميلي 6 المحققين على ممارسة المنهجية المذكورة أعلاه. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
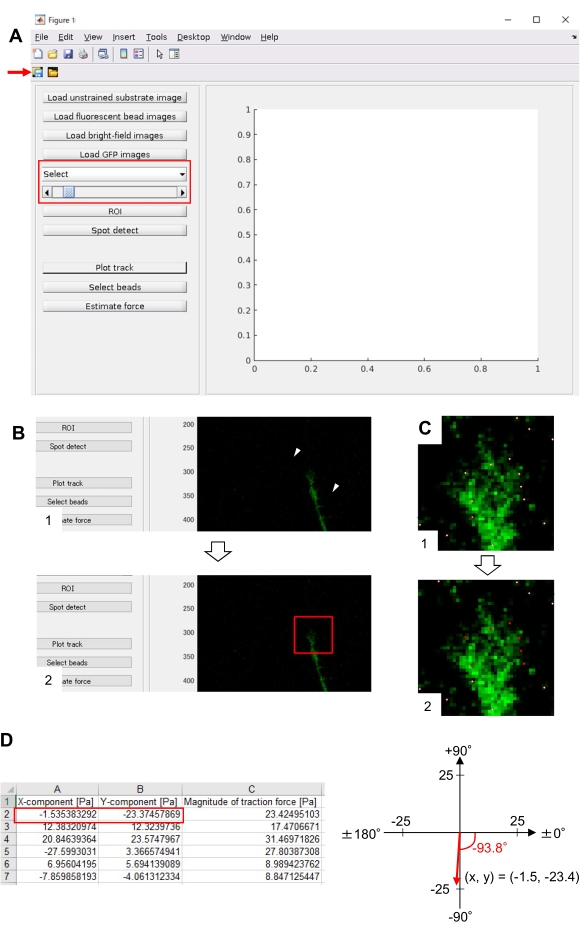
الشكل 8: تحليل قوة الجر تحت مخروط نمو الخلايا العصبية باستخدام رمز تحليل قوة الجر مفتوحة المصدر. (A) واجهة المستخدم الرسومية لتحليل قوة الجر. يمكن تأكيد صور الفاصل الزمني المحددة في واجهة المستخدم الرسومية من القائمة المنسدلة ومع شريط التمرير المشار إليه (المربع الأحمر). (ب) حدد منطقة تتضمن مخروط النمو. (1) انقر على عائد الاستثمار على واجهة المستخدم الرسومية. مع مؤشر الماوس، حدد نقطتين (رؤوس الأسهم) على صورة الخلية. (2) سيظهر مربع أحمر على صورة الخلية. بنقرتين تحديد مواقع ركنين. (ج) حدد الخرز المكتشف (النقاط البيضاء) تحت مخروط النمو. (1) على واجهة المستخدم الرسومية، انقر على حدد الخرز، وترسيم منطقة متعددة الأضلاع التي تشمل مخروط النمو عن طريق النقر. اضغط على مفتاح Enter . (2) النقاط البيضاء داخل المنطقة المضلعة سوف تتغير إلى اللون الأحمر. (د) النتائج المحسوبة لاتجاه قوة الجر وحجمها. يمثل المربع الأحمر في جدول البيانات المكونات س و ص لمتجه القوة، المقدرة بتحليل قوة الجر. على تنسيق س ص في اللوحة اليمنى، يشير متجه القوة الناتج عن مخروط النمو إلى -93.8 درجة مقابل المحور x؛ يتم توجيه هذا التوجه نحو الجزء الخلفي من مخروط النمو في (C). ويساعد الملف التكميلي 6 المحققين على ممارسة المنهجية المذكورة أعلاه. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الملف التكميلي 1: وصفات من الحلول ووسائل الإعلام المستخدمة في هذه الدراسة. راجع النص للحصول على استخدام مفصل. الرجاء الضغط هنا لتحميل هذا الملف.
ملف تكميلي 2: التصوير الفلوري من Lifeact والتصوير بقع الفلورسنت من HaloTag-actin في مخروط نمو الأعصاب. Lifeact (أخضر) وHalaTag-أكتين (أرجواني). تم الحصول على الصور كل 3 ق لمدة إجمالية قدرها 147 s. شريط المقياس: 2 ميكرومتر. انظر أيضا الشكل 3. الرجاء الضغط هنا لتحميل هذا الملف.
الملف التكميلي 3: بيانات الممارسة لتحديد سرعة تدفق F-actin ومعدل البلمرة أكتين. صورة مكدس الزمنية متعددة القنوات Lifeact (أخضر) و HaloTag-actin (أرجواني). انظر أيضا الشكل 3. الرجاء الضغط هنا لتحميل هذا الملف.
ملف تكميلي 4: فيديو رسم خرائط القوة الكشف عن قوة الجر في مخروط نمو الخلايا العصبية. الأصلي (الأخضر) والمشردين (الأحمر) مواقف الخرز. تظهر إشارة EGFP في مخروط النمو باللون الأزرق. تم الحصول على الصور كل 3 ق ل147 ق. شريط المقياس: 2 ميكرومتر. انظر أيضا الشكل 6. الرجاء الضغط هنا لتحميل هذا الملف.
ملف تكميلي 5: رمز تحليل قوة الجر. يرجى الاطلاع على الخطوة 8.12 للحصول على الاستخدام التفصيلي. الرجاء الضغط هنا لتحميل هذا الملف.
الملف التكميلي 6: بيانات الممارسة لتحديد قوة الجر. صورة RGB ذات قناة واحدة للخرزات في ركيزة غير مدربة وصور RGB ذات الفاصل الزمني أحادي القناة للخرزات الفلورية تحت مخروط النمو وEGFP والمجال الساطع. انظر أيضا الشكلين 7 و 8. الرجاء الضغط هنا لتحميل هذا الملف.
Discussion
تستخدم البروتوكولات الموصوفة في هذه الدراسة المواد المتاحة تجاريا ومعدات الفحص المجهري الموجودة بشكل روتيني في جميع المختبرات والمعاهد والجامعات. لذلك ، يمكن للمحققين بسهولة اعتماد التصوير البقعي الوحيد الحالي والفحص المجهري لقوة الجر في دراساتهم.
يمكن للتصوير البقع تحليل البلمرة actin واقتران مخلب. بالإضافة إلى ذلك ، يمكن للتصوير البقعي مراقبة التدفق الرجعي لجزيئات القابض مثل shootin1 والكورتاكتين ، والتي تتفاعل مع تدفق F-actin إلى الوراء. باستخدام مجهر TIRF ، يمكن أيضا رصد التدفق الرجعي لجزيء الالتصاق الخلوي L1-CAM23،41 ؛ يخضع L1-CAM لسلوكيات قبضة وزلة تعكس كفاءة اقتران القابض23,41. على الرغم من أن هذه الدراسة تستخدم نظام TMR-HaloTag للتصوير البقعي، إلا أن البروتينات الفلورية الأخرى، مثل EGFP وبروتين الفلورسنت الأحمر الأحادي، متوفرة أيضا في التحليل16,18,20,23,24,27,39. أساسيات تصور بقع أكتين هي مستوى تعبير منخفض من أكتين الفلورسنت والإضاءة من مساحة الحد الأدنى (الشكل 2). في هذا البروتوكول، يتم الحصول على إشارات Lifeact و HaloTag-actin بشكل تسلسلي. لأن تدفق actin الرجعية بطيئة نسبيا (4.5 ± 0.1 ميكرومتر / دقيقة)24، وتحليل تدفق F-actin الرجعية والبوليمرة أكتين لا تتأثر اقتناء صورة متتابعة من قنوات الفلورسنت المختلفة (~ 1 ق الفاصل الزمني). Lifeact هو علامة F-actin المستخدمة على نطاق واسع، ولكن يمكن أن تتنافس مع البروتينات ملزمة actin47. من أهمية أكبر، Lifeact يمكن أن يغير ديناميات أكتين، مما يؤثر على هياكل F-actin ومورفولوجيا الخلية47،48،49.
يمكن للفحص المجهري قوة الجر الكشف عن القوى لدفع التقدم مخروط النمو. من خلال تركيب الخلايا العصبية داخل مصفوفة خارج الخلية ، يمكن للمحققين أيضا تحليل القوى المتولدة في بيئة شبه ثلاثية الأبعاد11. التصوير عالي التكبير مهم للقياس الكمي الدقيق لقوة الجر لأن مخاريط النمو تولد قوى جذب ضعيفة7. على الرغم من أن أساليب أخرى مع nanopillars أو أجهزة الاستشعار الحيوية الحساسة للإجهاد تستخدم أيضا لقياس قوة الجر50,51, PAA هلام القائم على طريقة قابلة للتكيف للغاية ويسمح لتعديل صلابة الركيزة عن طريق تغيير تركيزات الأكريلاميد وبز-الأكريلاميد41,44,52. في هذا البروتوكول، يتم إعداد هلام PAA بتركيز نهائي من 3.75٪ أكريلاميد و 0.03٪ بيس أكريلاميد. معامل يونغ هو ~ 270 Pa22 وهذا صلابة داخل نطاق أنسجة الدماغ (100-10،000 السلطة الفلسطينية)53،54،55. بسبب سمك هلام PAA (~ 100 ميكرومتر) ، تحد هذه الطريقة من استخدام عدسات عالية التكبير أثناء الفحص المجهري. للحصول على صور عالية التكبير ، يجب على المحققين استخدام وظيفة التكبير في المجهر confocal المسح بالليزر.
وفي الختام، يتيح التصوير البقعي الحالي والفحص المجهري لقوة الجر إجراء تحليلات كمية للأحداث الرئيسية التي تجري على مدى أجيال القوة. وستكون هذه المعلومات قيمة للغاية لتحسين فهم الآليات التي تقوم عليها مخروط النمو والتقدم والملاحة.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
تم دعم هذا البحث جزئيا من قبل AMED تحت رقم المنحة 21gm0810011h0005 (N.I. وY.S.) ، JSPS KAKENHI (JP19H03223 ، N.I.) وJSPS المنح في المعونة للعلماء في وقت مبكر الوظيفي (JP19K16258 ، T .M) ، ومؤسسة أوساكا للبحوث الطبية للأمراض المستعصية (T.M) ، وNAIST الجيل القادم مشروع البحوث متعددة التخصصات (Y.S.).
Materials
| Name | Company | Catalog Number | Comments |
| 0.5% trypan blue stain solution | Nacalai | 29853-34 | |
| 3-aminopropyltrimethyoxysilane | Sigma | 281778-100ML | |
| Acrylamide monomer | Nacalai | 00809-85 | |
| Ammonium persulphate | Cytiva | 17-1311-1 | |
| Axio Observer Z1 | Zeiss | 431007-9902-000 | Epi-fluorescence microscope (single speckle imaging) |
| B-27 supplement (50x) | Thermo Fisher Scientific | 17504-044 | |
| Bovine serum albmine | Sigma | A7906-10G | |
| C-Apochromat 63x/1.2 W Corr | Zeiss | 421787-9970-799 | Objective lens (traction force microscopy) |
| Coverslip (diameter 18 mm) | Matsunami | C018001 | |
| D-glucose | Nacalai | 16806-25 | |
| DNaseI | Sigma | DN25-100MG | |
| Fetal bovine serum | Thermo Fisher Scientific | 10270-106 | |
| Fiji | Open source software package | https://imagej.net/software/fiji/ | |
| FluoSpheres carboxylate-modified 0.2 mm, red (580/605), 2% solid | Thermo Fisher Scientific | F8810 | carboxylate-modified microspheres |
| Glass bottom dish (14 mm diameter) | Matsunami | D1130H | |
| Glass bottom dish (27 mm diameter) | Matsunami | D1140H | |
| Glutaraldehyde solution | Sigma | G5882-10X10ML | |
| HaloTag TMR ligand | Promega | G8251 | |
| HBO103 W/2 | Osram | 4050300382128 | Mercury lamp (single speckle imaging) |
| Image Processing Toolbox | MathWork | https://www.mathworks.com/products/image.html | |
| Laminin solution from mouse EHS tumor | Wako | 120-05751 | |
| Leibovitz’s L-15 medium | Thermo Fisher Scientific | 11415064 | |
| L-glutamine | Nacalai | 16919-42 | |
| LSM710 | Zeiss | N/A | Conforcal laser microscope (traction force microscopy) |
| MATLAB2018a | MathWork | https://www.mathworks.com/products/new_products/release2018a.html | |
| Mouse C57BL/6 | Japan SLC | N/A | |
| Mouse neuron nucleofector kit | Lonza | VPG-1001 | |
| N,N,N’,N’-tetramethylethylenediamine (TEMED) | Nacalai | 33401-72 | |
| N,N’-methylenebisacrylamide | Nacalai | 22402-02 | |
| Neurobasal medium | Thermo Fisher Scientific | 21103-049 | |
| Nucleofector I | Amaxa | AAD-1001 | Electroporation apparatus |
| ORCA Flash 4.0 V2 | Hamamatsu | C11440-22CU | CMOS camera (single speckle imaging) |
| Papain | Nacalai | 26036-34 | |
| Parallel Computing Toolbox | MathWork | https://www.mathworks.com/products/parallel-computing.html | |
| pEGFP-C1 | Clontech | 1528177 | |
| Penicillin-streptomycin (100x) | Nacalai Tesque | 26253-84 | |
| pFN21A-HaloTag-actin | (Minegishi et al., 2018) | N/A | |
| Phosphate buffered saline (PBS) pH 7.4 (10x) | Thermo Fisher Scientific | 70011-044 | |
| Plan-Apochromat 100x/1.4 Oil | Zeiss | 420790-9901-000 | Objective lens (single speckle imaging) |
| pmNeonGreen-N1-Lifeact | (Kastian et al., 2021) | N/A | |
| Poly-D-lysine hydrobromide | Sigma | P6407-5MG | |
| Slulfo-SAMPHA | Thermo Fisher Scientific | 22589 | |
| Sodium dodecyl sulfate | Nacalai | 08933-05 | |
| Sodium hydrate (NaOH) | Nacalai | 31511-05 | |
| Steel ball | Sako tekkou | N/A | Microshpere to determin PAA gel rigidity. 0.6 mm diameter, 7.87 g/cm3. |
| ZEN2009 | Zeiss | https://www.zeiss.com/microscopy/us/products/microscope-software/zen.html#introduction | Image acquisition software (traction force microscopy) |
| ZEN2012 | Zeiss | https://www.zeiss.com/microscopy/us/products/microscope-software/zen.html#introduction | Image acquisition software (single speckle imaging) |
References
- TessierLavigne, M., Goodman, C. S. The molecular biology of axon guidance. Science. 274, 1123-1133 (1996).
- Marin, O., Valiente, M., Ge, X., Tsai, L. H. Guiding neuronal cell migrations. Cold Spring Harbor Perspectives in Biology. 2, 001834 (2010).
- Vitriol, E. A., Zheng, J. Q. Growth cone travel in space and time: the cellular ensemble of cytoskeleton, adhesion, and membrane. Neuron. 73 (6), 1068-1081 (2012).
- Cooper, J. A. Cell biology in neuroscience: mechanisms of cell migration in the nervous system. Journal of Cell Biology. 202, 725-734 (2013).
- Dupraz, S., et al. RhoA controls axon extension independent of specification in the developing brain. Current Biology. 29, 3874-3886 (2019).
- Suter, D. M., Miller, K. E. The emerging role of forces in axonal elongation. Progress in Neurobiology. 94, 91-101 (2011).
- Franze, K. Integrating chemistry and mechanics: the forces driving axon growth. Annual Review of Cell and Developmental Biology. 36, 61-83 (2020).
- Mitchison, T., Kirschner, M. Cytoskeletal dynamics and nerve growth. Neuron. 1, 761-772 (1988).
- Suter, D. M., Forscher, P. Substrate-cytoskeletal coupling as a mechanism for the regulation of growth cone motility and guidance. Journal of Neurobiology. 44, 97-113 (2000).
- Lowery, L. A., Van Vactor, D. The trip of the tip: understanding the growth cone machinery. Nature Reviews Molecular Cell Biology. 10, 332-343 (2009).
- Minegishi, T., et al. Shootin1b mediates a mechanical clutch to produce force for neuronal migration. Cell Reports. 25, 624-639 (2018).
- Minegishi, T., Inagaki, N. Forces to drive neuronal migration steps. Frontiers in Cell and Developmental Biology. 8, 863 (2020).
- Forscher, P., Smith, S. J. Actions of cytochalasins on the organization of actin filaments and microtubules in a neuronal growth cone. Journal of Cell Biology. 107, 1505-1516 (1988).
- Suter, D. M., Forscher, P. An emerging link between cytoskeletal dynamics and cell adhesion molecules in growth cone guidance. Current Opinion in Neurobiology. 8, 106-116 (1998).
- Pollard, T. D., Borisy, G. G. Cellular motility driven by assembly and disassembly of actin filaments. Cell. 112, 453-465 (2003).
- Waterman-Storer, C. M., Desai, A., Bulinski, J. C., Salmon, E. D. Fluorescent speckle microscopy, a method to visualize the dynamics of protein assemblies in living cells. Current Biology. 8, 1227-1230 (1998).
- Katoh, K., Hammar, K., Smith, P. J., Oldenbourg, R. Birefringence imaging directly reveals architectural dynamics of filamentous actin in living growth cones. Molecular Biology of the Cell. 10, 197-210 (1999).
- Watanabe, N., Mitchison, T. J. Single-molecule speckle analysis of actin filament turnover in lamellipodia. Science. 295, 1083-1086 (2002).
- Medeiros, N. A., Burnette, D. T., Forscher, P. Myosin II functions in actin-bundle turnover in neuronal growth cones. Nature Cell Biology. 8, 215-226 (2006).
- Shimada, T., et al. Shootin1 interacts with actin retrograde flow and L1-CAM to promote axon outgrowth. Journal of Cell Biology. 181, 817-829 (2008).
- He, M., Zhang, Z. H., Guan, C. B., Xia, D., Yuan, X. B. Leading tip drives soma translocation via forward F-actin flow during neuronal migration. Jounal of Neuroscience. 30, 10885-10898 (2010).
- Toriyama, M., Kozawa, S., Sakumura, Y., Inagaki, N. Conversion of a signal into forces for axon outgrowth through Pak1-mediated shootin1 phosphorylation. Current Biology. 23, 529-534 (2013).
- Abe, K., et al. Grip and slip of L1-CAM on adhesive substrates direct growth cone haptotaxis. Proceedings of the National Academy of Sciences of the United States of America. 115, 2764-2769 (2018).
- Baba, K., et al. Gradient-reading and mechano-effector machinery for netrin-1-induced axon guidance. Elife. 7, 34593 (2018).
- Nichol, R. I., Hagen, K. M., Lumbard, D. C., Dent, E. W., Gomez, T. M. Guidance of axons by local coupling of retrograde flow to point contact adhesions. Journal of Neuroscience. 36, 2267-2282 (2016).
- Shekarabi, M., et al. Deleted in colorectal cancer binding netrin-1 mediates cell substrate adhesion and recruits Cdc42, Rac1, Pak1, and N-WASP into an intracellular signaling complex that promotes growth cone expansion. Journal of Neuroscience. 25, 3132-3141 (2005).
- Kubo, Y., et al. Shootin1-cortactin interaction mediates signal-force transduction for axon outgrowth. Journal of Cell Biology. 210, 663-676 (2015).
- Huber, A. B., Kolodkin, A. L., Ginty, D. D., Cloutier, J. F. Signaling at the growth cone: ligand-receptor complexes and the control of axon growth and guidance. Annual Review of Neuroscience. 26, 509-563 (2003).
- Kolodkin, A. L., Tessier-Lavigne, M. Mechanisms and molecules of neuronal wiring: a primer. Cold Spring Harbor Perspectives in Biology. 3, 001727 (2011).
- Ayala, R., Shu, T., Tsai, L. H. Trekking across the brain: the journey of neuronal migration. Cell. 128, 29-43 (2007).
- Tatavarty, V., Kim, E. J., Rodionov, V., Yu, J. Investigating sub-spine actin dynamics in rat hippocampal neurons with super-resolution optical imaging. PLoS One. 4, 7724 (2009).
- Frost, N. A., Shroff, H., Kong, H., Betzig, E., Blanpied, T. A. Single-molecule discrimination of discrete perisynaptic and distributed sites of actin filament assembly within dendritic spines. Neuron. 67, 86-99 (2010).
- Chazeau, A., et al. Nanoscale segregation of actin nucleation and elongation factors determines dendritic spine protrusion. EMBO Journal. 33, 2745-2764 (2014).
- Garcia, M., et al. Two-tiered coupling between flowing actin and immobilized N-cadherin/catenin complexes in neuronal growth cones. Proceedings of the National Academy of Sciences of the United States of America. 112, 6997-7002 (2015).
- Swaminathan, V., et al. Actin retrograde flow actively aligns and orients ligand-engaged integrins in focal adhesions. Proceedings of the National Academy of Sciences of the United States of America. 114, 10648-10653 (2017).
- Tsai, T. Y., et al. Efficient front-rear coupling in neutrophil chemotaxis by dynamic myosin II localization. Developmental Cell. 49, 189-205 (2019).
- Zhang, X. F., et al. Regulation of axon growth by myosin II-dependent mechanocatalysis of cofilin activity. Journal of Cell Biology. 218 (7), 2329-2349 (2019).
- Reversat, A., et al. Cellular locomotion using environmental topography. Nature. 582, 582-585 (2020).
- Katsuno, H., et al. Actin migration driven by directional assembly and disassembly of membrane-anchored actin filaments. Cell Reports. 12, 648-660 (2015).
- Urasaki, A., et al. Shootins mediate collective cell migration and organogenesis of the zebrafish posterior lateral line system. Scientific Reports. 9, 12156 (2019).
- Abe, K., et al. Mechanosensitive axon outgrowth mediated by L1-laminin clutch interface. Biophysical Journal. 120, 3566-3576 (2021).
- Kastian, R. F., et al. Shootin1a-mediated actin-adhesion coupling generates force to trigger structural plasticity of dendritic spines. Cell Reports. 35, 109130 (2021).
- Riedl, J., et al. Lifeact: a versatile marker to visualize F-actin. Nature Methods. 5, 605-607 (2008).
- Chan, C. E., Odde, D. J. Traction dynamics of filopodia on compliant substrates. Science. 322, 1687-1691 (2008).
- Wang, Y. L., Pelham, R. J. Preparation of a flexible, porous polyacrylamide substrate for mechanical studies of cultured cells. Methods in Enzymology. 298, 489-496 (1998).
- Li, Y., Hu, Z., Li, C. New method for measuring poisson's ratio in polymer gels. Journal of Applied Polymer Science. 50, 1107-1111 (1993).
- Belyy, A., Merino, F., Sitsel, O., Raunser, S. Structure of the Lifeact-F-actin complex. PLoS Biology. 18, 3000925 (2020).
- Flores, L. R., Keeling, M. C., Zhang, X., Sliogeryte, K., Gavara, N. Lifeact-GFP alters F-actin organization, cellular morphology and biophysical behaviour. Scientific Reports. 9, 3241 (2019).
- Kumari, A., Kesarwani, S., Javoor, M. G., Vinothkumar, K. R., Sirajuddin, M. Structural insights into actin filament recognition by commonly used cellular actin markers. EMBO Journal. 39, 104006 (2020).
- du Roure, O., et al. Force mapping in epithelial cell migration. Proceedings of the National Academy of Sciences of the United States of America. 102, 2390-2395 (2005).
- Grashoff, C., et al. Measuring mechanical tension across vinculin reveals regulation of focal adhesion dynamics. Nature. 466, 263-266 (2010).
- Koch, D., Rosoff, W. J., Jiang, J., Geller, H. M., Urbach, J. S. Strength in the periphery: growth cone biomechanics and substrate rigidity response in peripheral and central nervous system neurons. Biophysical Journal. 102 (3), 452-460 (2012).
- Barnes, J. M., Przybyla, L., Weaver, V. M. Tissue mechanics regulate brain development, homeostasis and disease. Journal of Cell Science. 130, 71-82 (2017).
- Moore, S. W., Roca-Cusachs, P., Sheetz, M. P. Stretchy proteins on stretchy substrates: the important elements of integrin-mediated rigidity sensing. Developmental Cell. 19, 194-206 (2010).
- Tyler, W. J. The mechanobiology of brain function. Nature Reviews Neuroscience. 13, 867-878 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved