Method Article
肌动蛋白动力学、离合器耦合和牵引力分析,促进生长锥体前进
摘要
为了进步,生长锥体必须对外部环境施加牵引力。牵引力的产生取决于肌动蛋白动力学和离合器联轴器。本研究描述了分析肌动蛋白动力学,离合器耦合和生长锥推进牵引力的方法。
摘要
为了建立功能网络,神经元必须迁移到适当的目的地,然后将轴突延伸到它们的靶细胞。这些过程取决于位于神经突起尖端的生长锥的进展。轴突生长锥通过感知其局部微环境并调节细胞骨架动力学和肌动蛋白粘附耦合(离合器耦合)来产生驱动力。数十年的研究已经导致鉴定出引导分子,其受体和下游信号级联,用于调节神经元迁移和轴突引导;然而,产生力以驱动生长锥体前进和导航所需的分子机制才刚刚开始被阐明。在神经元生长锥的前缘,肌动蛋白丝经历逆行流动,其由肌动蛋白聚合和肌动蛋白收缩提供动力。F-肌动蛋白逆行流和粘合基材之间的离合器耦合产生牵引力,用于生长锥体的推进。本研究描述了通过单点斑点成像监测F-肌动蛋白逆行血流的详细方案。重要的是,当与F-肌动蛋白标记物Lifeact结合使用时,该技术可以量化1)F-肌动蛋白聚合速率和2)F-肌动蛋白逆行流和粘合剂基材之间的离合器耦合效率。两者都是产生生长锥前进和导航力的关键变量。此外,本研究描述了牵引力显微镜的详细方案,其可以量化3)生长锥产生的牵引力。因此,通过耦合单斑点成像和牵引力显微镜的分析,研究人员可以监测生长锥前进和导航背后的分子力学。
引言
在发育中的脊椎动物大脑中,神经元经历精心组织的迁移,并将轴突投射到适当的突触伙伴,以建立功能性神经元网络1,2,3。生长锥体是位于神经突尖端的感觉和运动结构,决定了神经元迁移和轴突生长的速度和方向3,4,5。由于神经元被紧密堆积的环境所包围,生长锥体必须对其环境施加力才能向前移动6,7。为了理解神经元迁移和轴突引导背后的机制,分析生长锥体推进的分子力学是必不可少的。
几十年的分析表明,驱动生长锥体前进的牵引力是由"离合器"机构产生的;这种机制被认为不仅在轴突生长锥中起作用,而且在迁移神经元的引导过程生长锥中起作用8,9,10,11,12。也就是说,生长锥中的肌动蛋白细丝(F-肌动蛋白)在前缘聚合并在近端解聚,推出前缘膜13,14,15。由此产生的力与肌动蛋白收缩相结合,诱导称为逆行流的F-肌动蛋白的向后运动7,11,16,17,18,19,20,21。离合器和细胞粘附分子介导F-肌动蛋白逆行流与粘合基底之间的机械耦合,并将F-肌动蛋白流动的力传递到底物上,从而产生生长锥前进的牵引力7,8,9,11,12,22.同时,肌动蛋白-底物偶联降低了F-肌动蛋白流速,并将肌动蛋白聚合转化为突出前缘膜的力9,10。
轴突生长锥感知局部化学线索,并将其转化为生长锥导航的方向驱动力3,23,24,25。例如,轴突引导分子netrin-1刺激其在结直肠癌(DCC)中缺失的受体,并激活三磷酸鸟苷(GTP)结合蛋白细胞分裂控制蛋白42(Cdc42)和Ras相关的C3肉毒杆菌毒素底物1(Rac1),以及它们的下游激酶p21激活的激酶1(Pak1)26。Cdc42和Rac1促进1)肌动蛋白聚合,Pak1磷酸化离合器分子shotin122,26。Shootin1通过肌动蛋白结合蛋白cortactin27与F-肌动蛋白逆行流动相互作用。Shootin1还与L1细胞粘附分子(L1-CAM)20,24相互作用。Shootin1磷酸化增加了皮质蛋白和L1-CAM的结合亲和力,并增强了shootin1介导的2)离合器耦合24,27。在生长锥内,肌动蛋白聚合和离合器耦合的不对称活化增加了3)netrin-1源侧面的牵引力,从而为生长锥体转动产生定向驱动力(图1)24。过去几十年来,关于神经元迁移和轴突引导的深入研究增强了对引导分子,其受体以及相关的下游信号级联的理解2,10,28,29,30。然而,产生生长锥推进力的分子机制才刚刚开始被阐明;这可能归因于用于机械生物学分析的协议的有限使用。
本研究描述了通过单点斑点成像监测F-肌动蛋白逆行流动的详细方案16,18。使用超分辨率显微镜、旋转盘共聚焦显微镜和全干涉反射荧光 (TIRF) 显微镜广泛监测 F-肌动蛋白逆行流25、31、32、33、34、35、36、37、38.然而,本研究中的方案使用标准的落射荧光显微镜,因此易于采用11,16,18,20,22,23,24,27,39,40,41,42。当与Lifeact43的F-肌动蛋白标记结合使用时,单点斑点成像可以量化蜀动蛋白聚合速率和F-肌动蛋白逆行流与粘合剂基材之间的离合器耦合效率39,42。本研究进一步描述了使用荧光珠包埋聚丙烯酰胺(PAA)凝胶11,22,23,24,27,39,41,42,44的牵引力显微镜的详细方案。该方法通过监测力引起的磁珠运动来检测和量化生长锥下的牵引力44,45。本文提供了一种开源的牵引力分析代码,并详细解释了在生长锥迁移过程中量化牵引力的方法。借助单点成像和牵引力显微镜,将促进了解生长锥迁移和导航背后的分子力学。这些技术也适用于分析树突状脊柱肿大背后的分子力学,已知树突状脊柱肿大在学习和记忆中很重要42。
研究方案
所有使用实验动物的实验均由奈良科学技术研究所的机构动物护理和使用委员会进行。研究者应遵循其机构和国家动物监管委员会制定的关于照料和使用实验动物的指南。
1. 溶液和培养基的制备
- 准备补充文件 1 中总结的解决方案和培养基
2. 聚-D-赖氨酸(PDL)/层粘连蛋白包覆基材的制备
- 用100μg/ mL PDL包覆14 mm直径的玻璃底培养皿,溶解在磷酸盐缓冲盐水(PBS,pH 7.4)中,并在37°C的加湿培养箱中孵育过夜。
注意:在此步骤后,请勿使玻璃表面干燥 - 取出PDL溶液,在玻璃杯上移取1 mL PBS三次,持续10秒。
- 用5μg/ mL层粘连蛋白涂覆培养皿,溶解在PBS中,并在37°C的加湿培养箱中孵育过夜。
- 取出层粘连蛋白溶液,在玻璃杯上移液1毫升PBS,持续10秒,每次三次。
- 取出PBS并将0.5 mL神经基质培养基放在玻璃表面上。将培养皿储存在37°C的加湿培养箱中。
注意:PDL / 层粘连蛋白包被的培养皿可以在37°C的加湿培养箱中储存2-3天。
3. 海马体的解剖和解离
- 通过颈椎脱位对怀孕的小鼠实施安乐死。
注:本研究使用市售小鼠( 见材料表)。研究人员应该使用在无菌环境中繁殖和人道处理的小鼠。 - 解剖胚胎16天(E16)小鼠胚胎,并将它们放在冰上。
- 在层流罩中,用剪刀解剖大脑,并将其放在含有10 mL冰冷解剖溶液的无菌10厘米培养皿中。
- 用体视显微镜解剖,小心地剥离大脑半球的脑膜,然后用镊子解剖海马。
- 将海马转移到15 mL管中的5 mL冰冷消化液中。将海马体在37°C的水浴中孵育20分钟。
- 取出消化液并加入3mL解剖溶液。
- 用巴斯德移液器轻轻移液海马体四次。
- 将海马体在37°C的水浴中孵育20分钟。
- 将细胞悬浮液转移到50mL离心管中。向未解离的组织加入3mL新的解剖溶液。
- 重复步骤3.7-3.9,直到海马完全解离。
- 通过旋转并用巴斯德移液管吸气从细胞悬浮液中除去漂浮的DNA聚集体。在4°C下以180× g 离心细胞悬浮液20分钟。
注意:来自受损细胞的DNA会干扰离心过程。如果神经元保留在上清液中,请在小心地除去DNA后再次离心细胞悬浮液。 - 在37°C和5%CO 2的加湿培养箱中平衡含有10%胎牛血清(FBS),青霉素(100U / mL)和链霉素(100μg/ mL)的神经基础培养基。
4. 转染和培养神经元
- 取出上清液,将5 mL冰冷的PBS加入50 mL管中。通过轻柔移液重悬细胞沉淀。
- 将10μL细胞悬浮液转移到微量离心管中,加入10μL0.5%台盼蓝溶液,然后用血细胞计数器计数细胞数。
- 在4°C下以180× g 离心50mL管中的细胞悬浮液20分钟。
- 同时,将转染等分试样,每1×10 6 个细胞1μgpFN21A-HaloTag-actin和3μgpmNeonGreen-N1-Lifeact放入微量离心管中。
- 离心后,除去上清液,将100μL电穿孔培养基(由转染试剂盒提供)加入50mL管中。通过移液重悬细胞沉淀。
- 将细胞悬浮液与等分的DNA溶液混合,并将混合物转移到比色皿(由转染试剂盒提供)。
注意:由于气泡会干扰电穿孔,因此请将其从电池悬浮液中取出。 - 将比色皿插入电穿孔装置(材料表),并使用程序O-005进行电穿孔。
- 立即将1mL含有10%FBS,青霉素(100 U / mL)和链霉素(100μg/ mL)的预热和平衡的神经基础培养基加入比色皿中。
- 使用塑料移液管(由转染试剂盒提供)将细胞悬浮液转移到15 mL离心管中。
- 将10μL细胞悬浮液转移到微量管中,加入10μL0.5%台盼蓝溶液,然后用血细胞计数器计数细胞数量。
- 从培养箱中取出PDL /层粘连蛋白涂层的玻璃底培养皿,并取出神经基底培养基。
- 移液0.5mL细胞悬浮液,每培养皿含有2.0×105 个细胞,并在37°C的加湿培养箱中孵育5%CO 3 小时。
- 用含有2%B-27补充剂,谷氨酰胺(1mM),青霉素(100 U / mL)和链霉素(100μg/ mL)的0.5mL神经基础培养基代替培养基。将神经元在37°C下用5%CO 2在加湿的培养箱中培养3天。
5. 神经元生长锥体的单斑点成像
- 在体外日(DIV)3上,用四甲基罗丹明(TMR)配体在培养基中以1:2000稀释的稀释度处理神经元。将神经元在37°C下用5%CO 2维持1小时。
- 用预热的PBS洗涤TMR配体三次。
- 取出PBS和移液器0.5毫升温热的Leibovitz的L-15培养基,其中含有2%B-27补充剂,谷氨酰胺(1mM),青霉素(100 U / mL)和链霉素(100μg/ mL)。
- 在37°C下维持神经元1小时。
- 打开落射荧光显微镜,将台顶培养箱设置为37°C。
注:本实验方案使用落射荧光显微镜,配备互补金属氧化物半导体相机、100x/1.40 NA油浸物镜、汞灯和图像采集软件(见 材料表)。其他具有相同规格的落射荧光显微镜也可用于此分析。 - 将TMR配体处理的神经元置于加热的舞台顶部培养箱上的玻璃底培养皿中。
- 设置图像采集参数如下:曝光时间,Lifeact和HaloTag-actin荧光通道500 ms;合并,1 x 1(每像素 0.065 μm × 0.065 μm);时间间隔, 3 秒;持续时间,50 帧。
- 选择强烈表达Lifeact并弱表达HaloTag-actin的生长锥体。
注意:Lifeact表达应足够强烈,以可视化生长锥形形态。HaloTag-actin表达应弱,不足以被检测到(图2A)。荧光蛋白表达的水平可以通过改变用于转染的DNA量来调节。 - 关闭隔膜的磁场以照亮包括生长锥在内的最小区域(图2B)。
注:最小区域的照明会降低背景信号并增加荧光信噪比(S/ N),从而能够检测肌动蛋白斑点(图2B)。为了进一步提高信噪比,建议使用中性密度滤光片照亮生长锥而不减少光线。 - 采集延时摄影图像(补充文件 2)。另存为多通道延时堆栈图像(tiff 格式)。
6. 使用斐济图像处理和分析软件定量 F-肌动蛋白流速和聚合速率
注:请参阅 补充文件3 ,了解量化F-肌动蛋白流速和肌动蛋白聚合速率的实践数据。
- 在斐济上打开多通道延时堆栈图像。
- 选择 "分析>设置比例",然后设置图像的像素大小。
- 找到一个在丝状体或薄片状体的F-肌动蛋白束内逆行流动至少五个时间范围内的肌动蛋白斑点。
- 选择" 图像>变换>旋转",然后调整图像的角度,使F-肌动蛋白束指向上方(图3A)。
- 单击工具栏上的 矩形 ,然后绘制一个包含肌动蛋白斑点和F-actin束尖端的框(图3B,1和2)。
注意:HaloTag-actin斑点的信号很弱。此外,生长锥远端的Lifeact信号微弱且微弱(图2B),因为生长锥的远端与近端部分相比很薄。研究人员应增强信号以优化F-肌动蛋白流速和聚合速率的定量(图3B)。虽然近端生长锥体处的Lifeact信号变得饱和,但这不会干扰F-actins远端的测定(图3E,黄线)。 - 选择 "图像>复制 ",然后输入五个时间范围(图 3B,3-5)。
- 选择 图像>堆栈>制作蒙太奇,并输入参数:列,5;行, 1;比例因子, 1.
- 单击 "确定"。图像蒙太奇将出现在屏幕上。
- 选择 "图像>颜色>拆分通道"。这将分隔两个荧光通道。
- F-肌动蛋白流速的定量。
- 选择 分析>设置测量值,然后选择 面积 和 边界矩形。
- 单击工具栏上的 椭圆形 ,然后在肌动蛋白斑点上画一个圆圈(图3C,1和2)。
- 选择" 图像>叠加">添加所选内容。圆圈叠加在图像蒙太奇上(图3C,3和4)。
注:叠加层的颜色可以在 "编辑>选项">颜色"中更改。 - 对剩余的斑点重复圆圈的叠加(图3C,5)。
注意:为了准确确定肌动蛋白斑点的中心,研究人员应在斑点上叠加圆圈。 - 单击工具栏上的" 直线 ",然后绘制一条链接圆圈中心的线(图 3D、1 和 2)。
- 选择" 分析>度量"。结果将出现在屏幕上(图3D,3)。
注:结果中显示 的高度 表示观察期间肌动蛋白斑点的易位距离(图3D,3)。 - 通过将易位距离除以观察时间来计算F-肌动蛋白流速。
- F-肌动蛋白聚合速率的定量。
- 画一条连接F-肌动蛋白束尖端的线(图3E,1)。
- 选择" 分析>度量"。结果将出现在屏幕上(图3E,2)。
注意: 结果中的高度 表示观察期间F-肌动蛋白束的延伸长度(图3E,2)。 - 通过将延伸长度除以观察时间来计算 F-肌动蛋白延伸率。
- 计算F-肌动蛋白聚合速率作为F-肌动蛋白流速和延伸速率之和(图3F)。
7. 用于牵引力显微镜和神经元培养的PAA凝胶的制备
- 制备牵引力显微镜所需的PAA凝胶(图4)
- 移取0.5毫升NaOH(100米M),溶于蒸馏H2 O中,在直径为27毫米的玻璃底培养皿中,在室温(RT)下孵育15分钟。
- 将50μL3-氨基丙基三甲氧基硅烷(APTMS)加入培养皿上的NaOH溶液中,并通过温和移液混合溶液,并在室温下孵育15分钟。
- 用蒸馏的H 2 O清洗玻璃底盘子,然后晾干。
- 移取0.5mL的0.5%戊二醛溶液,溶解在PBS中,在APTMS处理的玻璃底培养皿上,并在室温下孵育30分钟。
- 用蒸馏的H 2 O清洗玻璃底盘子并晾干。
- 制备含有蒸馏H2O(412μL),30%(w / v)丙烯酰胺溶液(63μL),2.5%(w / v)双丙烯酰胺溶液(6μL)和羧酸盐修饰微球(荧光珠)溶液(20μL)的溶液。
注意:在加入丙烯酰胺溶液之前,涡旋荧光珠溶液以解离聚集的珠子。 - 在真空室中在室温下对溶液进行30分钟的脱气。
- 加入1μL溶解在蒸馏H2O中的10%(w / v)过硫酸铵(APS)和1μLN,N,N',N'-四甲基乙二胺(TEMED),并通过轻柔移液混合。
- 将玻璃盖玻片(直径18毫米)放在15 mL离心管的盖子上。
- 立即向盖玻片中加入25μL溶液,然后轻轻地将倒置的玻璃底皿放在盖玻片上。让丙烯酰胺在室温下聚合1小时。
- 将蒸馏的H2 O涂在盖玻片上,并使用带有弯曲尖端的注射器针头将其从凝胶中剥离出来。
- 除去H2 O,将溶解在PBS中的磺基-SANPAH(1mM)加入凝胶中。
- 在无菌条件下,将凝胶暴露在紫外线下5分钟。每次洗涤用PBS洗涤凝胶三次15分钟。
- 用微球压痕法测定凝胶刚度(图5A)44。
- 将直径和密度指定的微球转移到凝胶中,然后将其放置在激光扫描共聚焦显微镜的标本台上。
- 聚焦在凝胶表面并记录z位置(图5B)。
- 同样,聚焦在微球的底部,并记录z位置(图5C)。
- 计算压痕深度,由凝胶表面的z位置与微球底部之间的差值决定。
- 通过以下方式计算凝胶的杨氏模量 E :
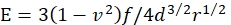
其中 f 是微球的浮力校正重量, d 是凝胶的压痕深度, r 是微球的半径, v 是泊松比(其值为 0.3,如前所述46)。
- 用PDL和层粘连蛋白涂覆凝胶,如第2节所述。
- 如第3节和第4节所述,解剖E16小鼠胚胎,解离海马体,每1.0×106 个细胞用5μgpEGFP-C1转染。在PDL /层粘连蛋白包被的凝胶上接种2.0×105 个细胞。
注意:对于牵引力分析,荧光标记细胞的显微成像对于确定生长锥区域是必要的。
8. 神经元生长锥体牵引力显微镜检查
- 在DIV3上,用0.5mL加热的Leibovitz的L-15培养基替换培养基,其中含有2%B-27补充剂,谷氨酰胺(1mM),青霉素(100 U / mL)和链霉素(100μg/ mL)。将神经元在37°C下维持1小时。
- 打开激光扫描共聚焦显微镜,将台顶培养箱设置为37°C。
注:本研究使用配备63x/1.2 NA水浸物镜和图像采集和分析软件的激光扫描共聚焦显微镜(见 材料表)。 - 将神经元放在预热的舞台顶部培养箱上的玻璃底培养皿中。
- 设置图像采集参数如下:扫描大小,512×512像素;扫描区域,1.5-3倍变焦;扫描速度,每帧~1秒;激光波长,561 nm(荧光珠的激发波长)和488 nm(增强绿色荧光蛋白(EGFP)的激发波长);时间间隔, 3 秒;持续时间,50 帧。
- 要可视化生长锥形态,请选择强烈表达EGFP的生长锥。
- 聚焦在凝胶表面上并获取延时图像(图6A 和 补充文件4)。
注:对于牵引力分析,请使用两个荧光通道(用于荧光珠和EGFP)和一个明场通道(建议捕获微分干涉对比度(DIC)或相衬图像)。 - 使用图像处理软件(例如,斐济)生成单通道延时RGB图像堆栈,并将这些图像另存为tiff文件。
注意:调查人员还必须保存原始数据,这一点至关重要。 - 将100μL溶解在蒸馏H 2 O中的10%(w / v)十二烷基硫酸钠(SDS)施加到玻璃底培养皿中,通过从底物释放神经元来放松凝胶底物。将培养皿在37°C下孵育5分钟以稳定温度。
注:在牵引力分析期间,未受训练基板中的磁珠图像用于参考原始磁珠位置(图6C)。SDS溶液的应用由于培养箱中的热变化和细胞诱导的变形的松弛而改变了xyz位置。因此,研究人员需要校正焦平面和x-y位置。 - 聚焦在凝胶表面上,并获取未受训练的底物中珠子的图像(图6B)。
- 在未受训练的基材中生成磁珠的单通道RGB图像,并将此图像另存为tiff文件。
- 使用斐济校正珠子图像在未受训练基板中的x-y位置
- 在斐济,打开未受训练的基质中的珠子图像和荧光珠的延时堆栈图像。
- 选择 "图像>堆栈>工具>连接"。屏幕上将出现一个对话框(图7A,1)。
- 分别选择未训练基板中的微珠图像和 Image1 和 Image2中荧光珠的延时堆叠图像(图7A,2)。
- 单击 "确定"。将未受约束基板中的磁珠图像添加到延时堆栈图像中(图7A,3)。
- 使用滚动条(图 7B、1、红色框)显示堆栈图像的第二帧(红色箭头)。
- > StackReg 中选择插件(图 7B、2)。屏幕上将出现一个对话框(图7B,3)。
- 从下拉列表中选择 刚体 (图7B,3,红色框),然后单击 确定。然后开始更正 x-y 位置。
- 使用滚动条显示 x-y 位置校正堆栈图像的第一帧。
- 选择 "图像>重复 图像"(图7C,1)。屏幕上将出现一个对话框(图7B,2)。
- 在"范围"中输入 1,取消选择"重复堆栈"(图 7C、2),然后单击"确定"。未受训练基板上的x-y位置校正珠图像将出现在屏幕上(图7C,3)。将此图像另存为 tiff 文件。
- 牵引力的量化
注:此处描述的牵引力分析方法使用 MATLAB 和两个 MATLAB 工具箱,即"图像处理工具箱"和"并行计算工具箱"。调查人员需要在分析之前安装它们。牵引力分析代码是基于 MATLAB 版本 2018a 开发的。因此,必须使用 MATLAB 版本 2018a(或更高版本)进行分析。用于牵引力分析的算法在前面已有描述22。- 从 补充文件 5 下载牵引力分析代码 TFM2021。在 MATLAB 中打开 TFM 2021
- 在 TFM2021 中打开 main.m 并运行它。屏幕上将出现一个图形用户界面(GUI)(图8A)。
- 单击加载 未训练的基板图像 ,然后在未训练的基板中选择 x-y 位置校正的磁珠图像。
- 单击加载 荧光珠图像 ,然后选择磁珠的延时堆栈图像。
- 单击 加载明场图像 ,然后选择明场的延时堆栈图像。
- 单击 加载 GFP 映像 ,然后选择 EGFP 的延时堆栈映像。
- 从 GUI 上的下拉列表中选择 GFP (图 8A,红色框)。
- 单击 ROI 以指定感兴趣的矩形区域 (ROI),包括生长锥,方法是单击 GUI 上显示的单元格图像上的两个点(图 8B)。
- 单击 GUI 上的 保存 按钮(图 8A,红色箭头)。选定的堆栈图像以及 ROI 将保存在 .mat 文件(MATLAB 格式文件)中。
- 单击" 现场检测"。屏幕上将出现一个对话框。
- 在对话框中输入一个值(通常为 50-150)以确定磁珠检测的阈值。单击" 确定" 开始计算。
- 完成计算后,单击 "绘图轨迹 "以放大在步骤8.12.8中选择的区域,并将检测到的珠子显示为白点(图8C,1)。
注:确认磁珠检测(白点)是否与荧光珠重叠。磁珠检测还可以检测背景噪音。要减少这种外部干扰,请更改 Spot 检测处的阈值。此外,在步骤 8.12.13 中手动选择正确的点。 - 单击 "选择珠子",然后划定一个多边形区域,该区域在生长锥下包含正确的点。 按 键盘上的回车键。多边形区域内的白点将变为红色(图8C,2)。
- 单击 GUI 上的 估计力 。然后,输入以下参数的值:像素大小,μm/像素;杨氏模量,在步骤7.2.5处计算的值;泊松比,0.3。
- 执行 估计力 以启动计算。该软件将自动将计算结果保存在电子表格格式文件中。
注:电子表格显示了每个时间帧的 x 分量、y 分量和力大小(图 8D)。请参阅 补充文件 6 ,了解用于量化牵引力的练习数据。
结果
单点斑点成像可量化肌动蛋白聚合速率和离合器耦合效率
高生命力表达允许在生长锥内可视化F-肌动蛋白;低卤代肌动蛋白表达允许监测F-肌动蛋白逆行流(图3, 补充文件2)。追踪肌动蛋白斑点可以测量F-肌动蛋白流速(图3C,D)。由于F-肌动蛋白逆行流和粘合剂基材的机械耦合降低了F-肌动蛋白流速,因此可以从速度估计离合器耦合效率。此外,使用Lifeact标记F-肌动蛋白有助于F-肌动蛋白延伸的可视化,并且有助于量化肌动蛋白聚合速率(图3E,F)。
牵引力的定量分析
严格遵守这里介绍的方法将揭示荧光珠在生长锥下的运动(图6C, 补充文件4)。F-肌动蛋白逆行流向底物产生牵引力,导致荧光珠在生长锥下向后移动。牵引力分析代码估计荧光珠位移的牵引力,并将计算出的牵引力表示为力矢量。牵引力的方向和大小由力矢量的x和y分量确定(图8C,D)。 图8D 中的红色框表示力矢量的x和y分量; 图8C 描绘了相应的生长锥。就x-y坐标而言,矢量指向相对于x轴的-93.8°;该方向朝向生长锥的后部(图8C)。牵引力 F 的大小计算如下:
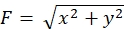
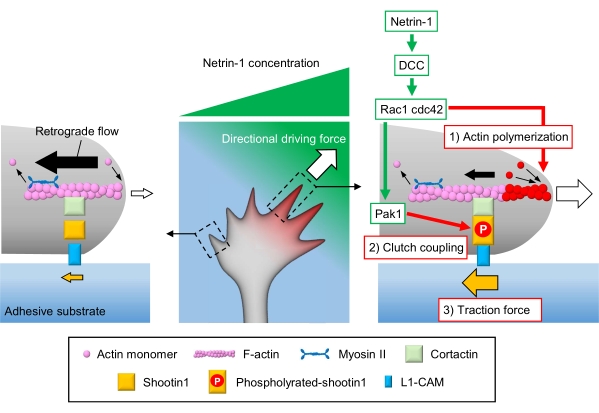
图1:用于力生成和生长锥导航的生长锥机械。 netrin-1化学引诱剂梯度诱导其受体DCC在轴突生长锥体上的不对称刺激。这激活了Rac1和Cdc42,以及它们的下游激酶Pak1。Rac1 和 Cdc42 促进 (1) 肌动蛋白聚合,而 Pak1 磷酸化 shootin1,增强 shootin1 介导的 (2) 离合器耦合。肌动蛋白动力学的不对称激活和生长锥内的离合器耦合增加了(3)netrin-1源侧面的牵引力,从而产生生长锥吸引的方向驱动力。这里介绍的协议允许量化生长锥导航的关键变量(1)-(3)。 请点击此处查看此图的放大版本。

图2:在完全打开和变窄的隔膜下神经元生长锥的荧光图像。生长锥体表达Lifeact和HaloTag-actin。 (A)高生命力表达允许可视化生长锥形形态。另一方面,HaloTag-actin表达水平非常低,当隔膜完全打开时,信号会变暗。(B)当隔膜适当变窄时,背景信号减弱,生长锥中出现单个肌动蛋白斑点。比例尺:5 μm 。请单击此处查看此图的放大版本。

图3:使用图像处理和分析软件斐济量化F-肌动蛋白流速和肌动蛋白聚合速率的步骤。(1)查找并选择在F-肌动蛋白束中流动的肌动蛋白斑点(箭头)。(2)选择 图像 > 变换 > 旋转。(3)设置角度,使F-肌动蛋白束向上定向。(4)图像的角度将被改变。(B)划分区域,包括肌动蛋白斑点和F-肌动蛋白束。(1)单击工具栏上的矩形。(2) 在图像上描绘一个区域。图像的亮度和对比度增加,以允许清晰地可视化肌动蛋白斑点和F-肌动蛋白束的尖端。(3)选择 图像 > 复制。(4)输入显示F-肌动蛋白束中肌动蛋白斑点流动的五个时间范围。(5) 选定的堆栈图像将出现在屏幕上。(C)肌动蛋白斑点上的叠加圆圈。(1)单击工具栏上的椭圆形。(2)在肌动蛋白斑点上画一个圆圈。(3)选择 图像>叠加 > 添加选择。(4) 圆圈被覆盖。5)重复将圆圈叠加在剩余的肌动蛋白斑点上。(D)测量五个时间范围内肌动蛋白斑点的易位距离。(1)单击工具栏上的"直线"。(2)画一条连接圆心的线。(3) 选择分析>度量。结果,由参数高度(红色框)表示,中继肌动蛋白斑点易位距离。(E)测量F-肌动蛋白突起长度在五个时间范围内的变化。(1)画一条连接F-肌动蛋白突起尖端的线。(2) 选择分析>度量。结果(红色框)高度表示F-肌动蛋白束的延伸长度。(F)肌动蛋白聚合速率是根据F-肌动蛋白流速和延伸速率之和计算得出的。另请参见补充文件 2。补充文件3帮助调查人员实践上述方法。请点击此处查看此图的放大版本。
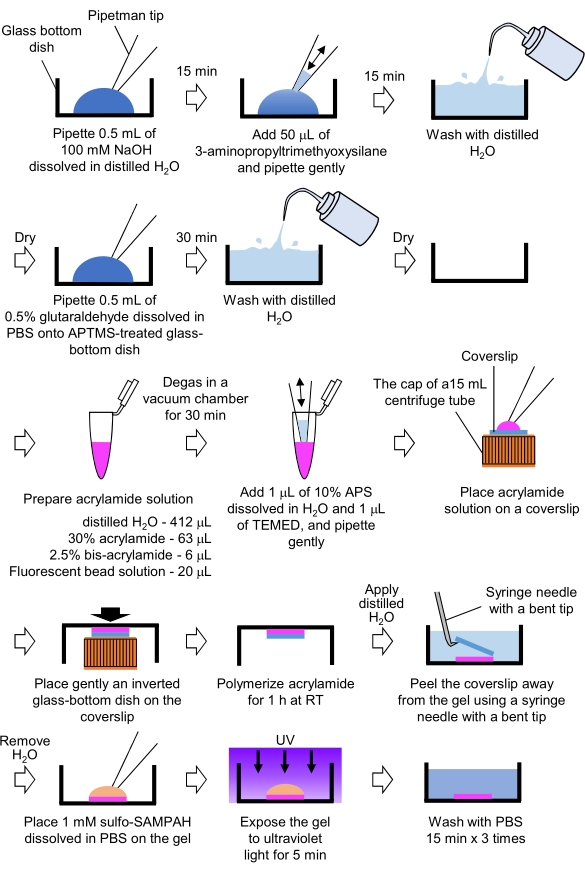
图4:PAA凝胶制备步骤。 有关详细说明,请参阅步骤 7.1。 请点击此处查看此图的放大版本。
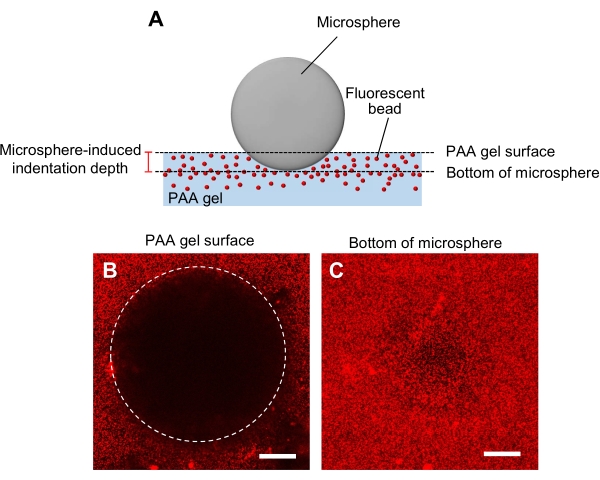
图5:PAA凝胶刚度的测定。(A)一种微球压痕法。当微球被放置在荧光珠包埋的PAA凝胶上时,微球的重量会导致凝胶中的压痕。压痕深度是通过从微球(B,C)微球底部减去PAA凝胶表面的z位置来计算的,PAA凝胶被微球缩进并含有荧光珠的荧光图像。使用激光扫描共聚焦显微镜捕获凝胶表面(B)和微球底部(C)的图像。来自荧光珠的信号在凝胶表面的缩进区域(B,圆形)中不可见。然而,它们可以在微球的底部观察到。比例尺:50 μm 。请单击此处查看此图的放大版本。
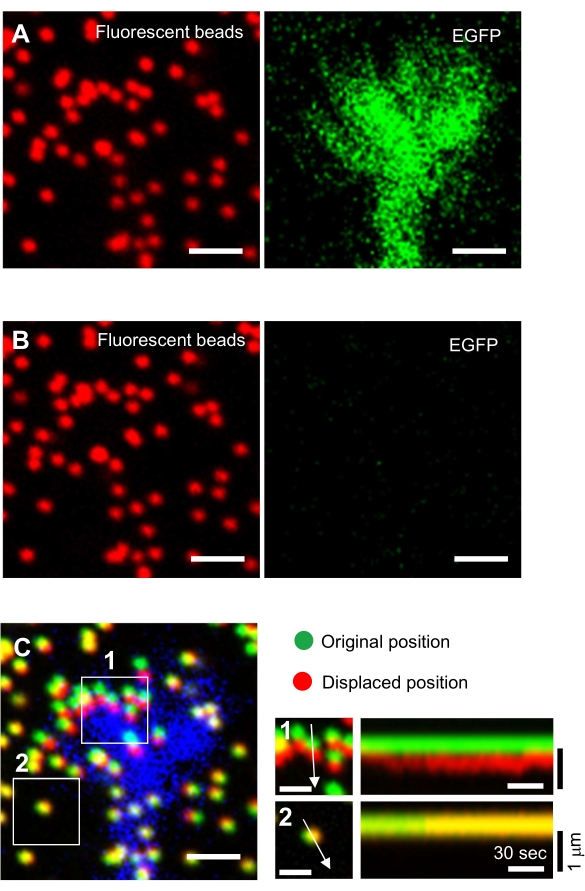
图6:神经元生长锥的力映射。 (A-C)嵌入PAA凝胶中的珠子的荧光图像和用EGFP可视化的神经生长锥。在采集延时图像(A)后,通过应用SDS溶液将神经元从凝胶底物中释放出来,并捕获未训练底物中珠子的图像(B)。(C)未受约束基材中的珠子的图像显示珠子处于其原始(绿色)和位移(红色)位置。生长锥体的EGFP信号以蓝色显示。运动记录仪(右)显示了珠子在147秒的持续时间内以3秒的间隔运动,由盒装区域1和2中的箭头表示。区域2中的珠子是参考珠。比例尺:(A)、(B)和(C,左)为2 μm,(C,中间)为1 μm。另请参见补充文件 4。请点击此处查看此图的放大版本。
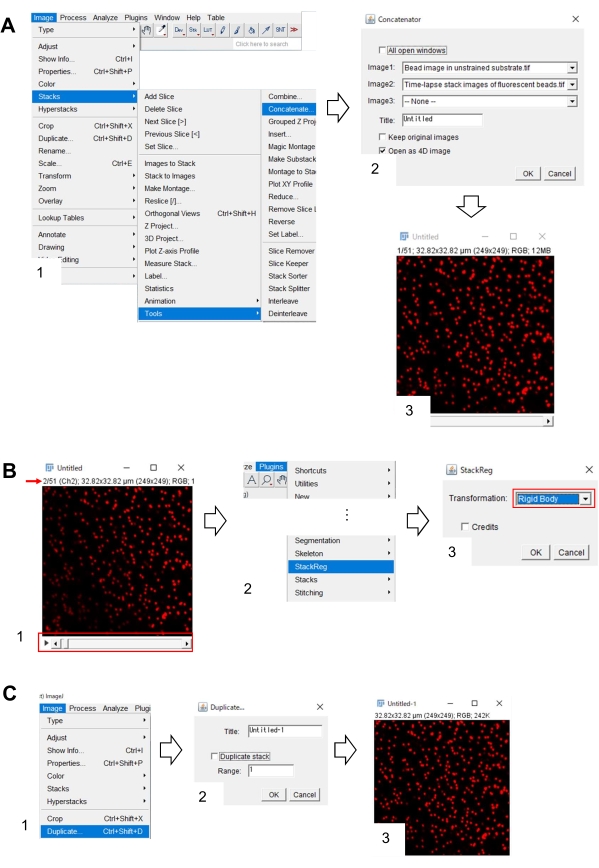
图 7:使用 Fiji 校正未训练基板中磁珠图像 x-y 位置的步骤。(A) 将未训练基板中的磁珠图像与荧光磁珠的延时堆栈图像连接起来。(1) 选择 图像>堆栈 > 工具 > 连接。(2)分别选择未受约束基板中的微珠图像和Image1和Image2中荧光微球的延时堆叠图像。单击"确定"。(3)将未受约束基板中的珠状图像添加到延时堆叠图像中。(B)校正荧光珠图像的x-y位置。(1)使用滚动条(红色框)选择图像堆栈中的第二帧(红色箭头)。(2) 选择插件> StackReg。(3)选择 刚体 从下拉列表(红色框)中,然后单击 OK。将开始更正 x-y 位置。(C) 保存 x-y 位置校正的珠子图像。选择 x-y 位置校正堆栈图像的第一帧后,(1) 选择"图像>复制"。(2) 在"范围"中输入 1,然后取消选择"重复堆栈"。然后单击"确定"。(3)未受约束基材中的x-y位置校正珠子图像将出现在屏幕上。将此图像另存为 tiff 文件。补充文件6帮助调查人员实践上述方法。请点击此处查看此图的放大版本。
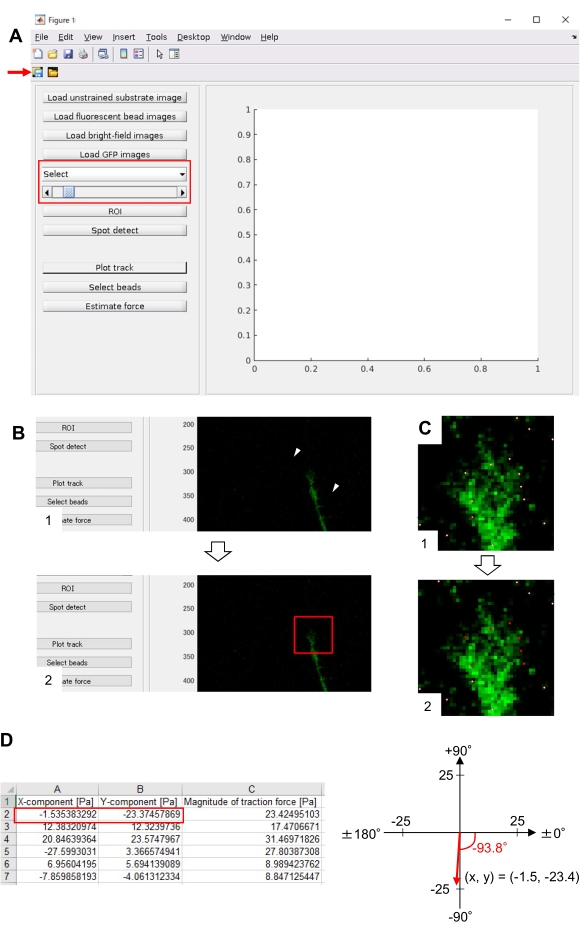
图 8:使用开源牵引力分析代码分析神经元生长锥下的牵引力。GUI上选择的延时图像可以从下拉列表中确认,并指示滑块(红色框)。(B) 选择包含生长锥的区域。(1) 单击 GUI 上的 ROI。使用鼠标光标,在单元格图像上指定两个点(箭头)。(2)单元格图像上将出现一个红色框。单击两下即可确定两个角的位置。(C)选择生长锥下检测到的珠子(白点)。(1) 在 GUI 上,单击"选择珠子",然后单击以划分包含生长锥的多边形区域。按回车键。(2) 多边形区域内的白点将变为红色。(四)牵引力方向和幅度的计算结果。电子表格中的红色框表示力矢量的 x 和 y 分量,通过牵引力分析进行估计。在右侧面板中的x-y坐标上,生长锥产生的力矢量指向相对于x轴的-93.8°;该方向朝向(C)中生长锥体的后部。补充文件6帮助调查人员实践上述方法。请点击此处查看此图的放大版本。
补充文件1:本研究中使用的溶液和培养基的配方。 有关详细用法,请参阅文本。 请点击此处下载此文件。
补充文件2:Lifeact的荧光成像和神经生长锥中HaloTag-actin的荧光斑点成像。 Lifeact(绿色)和HaloTag-actin(洋红色)。每3秒采集一次图像,总持续时间为147秒。比例尺:2 μm。另请参阅图 3。请单击此处下载此文件。
补充文件3:量化F-肌动蛋白流速和肌动蛋白聚合速率的实践数据。 Lifeact(绿色)和HaloTag-actin(洋红色)的多通道延时堆栈图像。另请参见 图 3。 请点击此处下载此文件。
补充文件4:检测神经元生长锥处牵引力的力映射视频。 珠子的原始(绿色)和移位(红色)位置。生长锥中的EGFP信号以蓝色显示。每3秒采集一次图像,持续147秒。比例尺:2 μm。另请参见 图 6。 请点击此处下载此文件。
补充文件5:牵引力分析代码。 有关详细用法,请参阅步骤 8.12。 请点击此处下载此文件。
补充文件6:量化牵引力的实践数据。 未受训练的底物中微珠的单通道RGB图像和生长锥,EGFP和明场下荧光珠的单通道延时堆叠RGB图像。另请参见 图 7 和 图 8。 请点击此处下载此文件。
讨论
本研究中描述的协议使用所有实验室,研究所和大学中常见的商业可用材料和显微镜设备。因此,研究人员可以在他们的研究中轻松采用目前的单斑点成像和牵引力显微镜。
斑点成像可以分析肌动蛋白聚合和离合器耦合。此外,斑点成像可以监测离合器分子(如shootin1和cortactin)的逆行流动,它们与F-肌动蛋白逆行流动相互作用。通过使用TIRF显微镜,还可以监测细胞粘附分子L1-CAM的逆行流动23,41;L1-CAM的抓地力和滑动行为反映了离合器耦合效率23,41。虽然本研究采用TMR-HaloTag系统进行斑点成像,但其他荧光蛋白,如EGFP和单体红色荧光蛋白,也可以在分析中使用16,18,20,23,24,27,39。可视化肌动蛋白斑点的基本要素是荧光肌动蛋白的低表达水平和最小面积的照明(图2)。在该协议中,Lifeact和HaloTag-actin信号依次获得。由于肌动蛋白逆行流相对较慢(4.5 ± 0.1 μm/min)24,因此F-肌动蛋白逆行流和肌动蛋白聚合的分析不受不同荧光通道(~1 s间隔)的顺序图像采集的影响。Lifeact是一种广泛使用的F-肌动蛋白标志物,但可以与肌动蛋白结合蛋白竞争47。更重要的是,Lifeact可以改变肌动蛋白动力学,从而影响F-肌动蛋白结构和细胞形态47,48,49。
牵引力显微镜可以检测驱动生长锥前进的力。通过将神经元安装在细胞外基质中,研究人员还可以分析半3D环境中产生的力11。高倍率成像对于牵引力的准确量化非常重要,因为生长锥会产生微弱的牵引力7。虽然其他具有纳米柱或应力敏感生物传感器的方法也用于测量牵引力50,51,但基于PAA凝胶的方法具有高度的适应性,并且允许通过改变丙烯酰胺和双丙烯酰胺的浓度来调整底物刚度41,44,52。在该协议中,PAA凝胶以终浓度为3.75%丙烯酰胺和0.03%双丙烯酰胺制备;杨氏模量约为270 Pa22 ,该刚度在脑组织(100-10,000 Pa)53,54,55的范围内。由于PAA凝胶的厚度(~100μm),这种方法限制了显微镜下高倍率透镜的使用。为了获得高倍率图像,研究人员应在激光扫描共聚焦显微镜中使用变焦功能。
总之,目前的斑点成像和牵引力显微镜能够对力生成中的关键事件进行定量分析。这些信息对于提高对生长锥推进和导航基础机制的理解将是无价的。
披露声明
作者没有什么可透露的。
致谢
该研究得到了AMED的部分支持,资助号为21gm0810011h0005(N.I.和Y.S.),JSPS KAKENHI(JP19H03223,N.I.)和JSPS Grants-in-Aid for Early-Career Scientists(JP19K16258,T.M.),大阪不治之症医学研究基金会(T.M.)和NAIST下一代跨学科研究项目(Y.S.)。
材料
| Name | Company | Catalog Number | Comments |
| 0.5% trypan blue stain solution | Nacalai | 29853-34 | |
| 3-aminopropyltrimethyoxysilane | Sigma | 281778-100ML | |
| Acrylamide monomer | Nacalai | 00809-85 | |
| Ammonium persulphate | Cytiva | 17-1311-1 | |
| Axio Observer Z1 | Zeiss | 431007-9902-000 | Epi-fluorescence microscope (single speckle imaging) |
| B-27 supplement (50x) | Thermo Fisher Scientific | 17504-044 | |
| Bovine serum albmine | Sigma | A7906-10G | |
| C-Apochromat 63x/1.2 W Corr | Zeiss | 421787-9970-799 | Objective lens (traction force microscopy) |
| Coverslip (diameter 18 mm) | Matsunami | C018001 | |
| D-glucose | Nacalai | 16806-25 | |
| DNaseI | Sigma | DN25-100MG | |
| Fetal bovine serum | Thermo Fisher Scientific | 10270-106 | |
| Fiji | Open source software package | https://imagej.net/software/fiji/ | |
| FluoSpheres carboxylate-modified 0.2 mm, red (580/605), 2% solid | Thermo Fisher Scientific | F8810 | carboxylate-modified microspheres |
| Glass bottom dish (14 mm diameter) | Matsunami | D1130H | |
| Glass bottom dish (27 mm diameter) | Matsunami | D1140H | |
| Glutaraldehyde solution | Sigma | G5882-10X10ML | |
| HaloTag TMR ligand | Promega | G8251 | |
| HBO103 W/2 | Osram | 4050300382128 | Mercury lamp (single speckle imaging) |
| Image Processing Toolbox | MathWork | https://www.mathworks.com/products/image.html | |
| Laminin solution from mouse EHS tumor | Wako | 120-05751 | |
| Leibovitz’s L-15 medium | Thermo Fisher Scientific | 11415064 | |
| L-glutamine | Nacalai | 16919-42 | |
| LSM710 | Zeiss | N/A | Conforcal laser microscope (traction force microscopy) |
| MATLAB2018a | MathWork | https://www.mathworks.com/products/new_products/release2018a.html | |
| Mouse C57BL/6 | Japan SLC | N/A | |
| Mouse neuron nucleofector kit | Lonza | VPG-1001 | |
| N,N,N’,N’-tetramethylethylenediamine (TEMED) | Nacalai | 33401-72 | |
| N,N’-methylenebisacrylamide | Nacalai | 22402-02 | |
| Neurobasal medium | Thermo Fisher Scientific | 21103-049 | |
| Nucleofector I | Amaxa | AAD-1001 | Electroporation apparatus |
| ORCA Flash 4.0 V2 | Hamamatsu | C11440-22CU | CMOS camera (single speckle imaging) |
| Papain | Nacalai | 26036-34 | |
| Parallel Computing Toolbox | MathWork | https://www.mathworks.com/products/parallel-computing.html | |
| pEGFP-C1 | Clontech | 1528177 | |
| Penicillin-streptomycin (100x) | Nacalai Tesque | 26253-84 | |
| pFN21A-HaloTag-actin | (Minegishi et al., 2018) | N/A | |
| Phosphate buffered saline (PBS) pH 7.4 (10x) | Thermo Fisher Scientific | 70011-044 | |
| Plan-Apochromat 100x/1.4 Oil | Zeiss | 420790-9901-000 | Objective lens (single speckle imaging) |
| pmNeonGreen-N1-Lifeact | (Kastian et al., 2021) | N/A | |
| Poly-D-lysine hydrobromide | Sigma | P6407-5MG | |
| Slulfo-SAMPHA | Thermo Fisher Scientific | 22589 | |
| Sodium dodecyl sulfate | Nacalai | 08933-05 | |
| Sodium hydrate (NaOH) | Nacalai | 31511-05 | |
| Steel ball | Sako tekkou | N/A | Microshpere to determin PAA gel rigidity. 0.6 mm diameter, 7.87 g/cm3. |
| ZEN2009 | Zeiss | https://www.zeiss.com/microscopy/us/products/microscope-software/zen.html#introduction | Image acquisition software (traction force microscopy) |
| ZEN2012 | Zeiss | https://www.zeiss.com/microscopy/us/products/microscope-software/zen.html#introduction | Image acquisition software (single speckle imaging) |
参考文献
- TessierLavigne, M., Goodman, C. S. The molecular biology of axon guidance. Science. 274, 1123-1133 (1996).
- Marin, O., Valiente, M., Ge, X., Tsai, L. H. Guiding neuronal cell migrations. Cold Spring Harbor Perspectives in Biology. 2, 001834 (2010).
- Vitriol, E. A., Zheng, J. Q. Growth cone travel in space and time: the cellular ensemble of cytoskeleton, adhesion, and membrane. Neuron. 73 (6), 1068-1081 (2012).
- Cooper, J. A. Cell biology in neuroscience: mechanisms of cell migration in the nervous system. Journal of Cell Biology. 202, 725-734 (2013).
- Dupraz, S., et al. RhoA controls axon extension independent of specification in the developing brain. Current Biology. 29, 3874-3886 (2019).
- Suter, D. M., Miller, K. E. The emerging role of forces in axonal elongation. Progress in Neurobiology. 94, 91-101 (2011).
- Franze, K. Integrating chemistry and mechanics: the forces driving axon growth. Annual Review of Cell and Developmental Biology. 36, 61-83 (2020).
- Mitchison, T., Kirschner, M. Cytoskeletal dynamics and nerve growth. Neuron. 1, 761-772 (1988).
- Suter, D. M., Forscher, P. Substrate-cytoskeletal coupling as a mechanism for the regulation of growth cone motility and guidance. Journal of Neurobiology. 44, 97-113 (2000).
- Lowery, L. A., Van Vactor, D. The trip of the tip: understanding the growth cone machinery. Nature Reviews Molecular Cell Biology. 10, 332-343 (2009).
- Minegishi, T., et al. Shootin1b mediates a mechanical clutch to produce force for neuronal migration. Cell Reports. 25, 624-639 (2018).
- Minegishi, T., Inagaki, N. Forces to drive neuronal migration steps. Frontiers in Cell and Developmental Biology. 8, 863 (2020).
- Forscher, P., Smith, S. J. Actions of cytochalasins on the organization of actin filaments and microtubules in a neuronal growth cone. Journal of Cell Biology. 107, 1505-1516 (1988).
- Suter, D. M., Forscher, P. An emerging link between cytoskeletal dynamics and cell adhesion molecules in growth cone guidance. Current Opinion in Neurobiology. 8, 106-116 (1998).
- Pollard, T. D., Borisy, G. G. Cellular motility driven by assembly and disassembly of actin filaments. Cell. 112, 453-465 (2003).
- Waterman-Storer, C. M., Desai, A., Bulinski, J. C., Salmon, E. D. Fluorescent speckle microscopy, a method to visualize the dynamics of protein assemblies in living cells. Current Biology. 8, 1227-1230 (1998).
- Katoh, K., Hammar, K., Smith, P. J., Oldenbourg, R. Birefringence imaging directly reveals architectural dynamics of filamentous actin in living growth cones. Molecular Biology of the Cell. 10, 197-210 (1999).
- Watanabe, N., Mitchison, T. J. Single-molecule speckle analysis of actin filament turnover in lamellipodia. Science. 295, 1083-1086 (2002).
- Medeiros, N. A., Burnette, D. T., Forscher, P. Myosin II functions in actin-bundle turnover in neuronal growth cones. Nature Cell Biology. 8, 215-226 (2006).
- Shimada, T., et al. Shootin1 interacts with actin retrograde flow and L1-CAM to promote axon outgrowth. Journal of Cell Biology. 181, 817-829 (2008).
- He, M., Zhang, Z. H., Guan, C. B., Xia, D., Yuan, X. B. Leading tip drives soma translocation via forward F-actin flow during neuronal migration. Jounal of Neuroscience. 30, 10885-10898 (2010).
- Toriyama, M., Kozawa, S., Sakumura, Y., Inagaki, N. Conversion of a signal into forces for axon outgrowth through Pak1-mediated shootin1 phosphorylation. Current Biology. 23, 529-534 (2013).
- Abe, K., et al. Grip and slip of L1-CAM on adhesive substrates direct growth cone haptotaxis. Proceedings of the National Academy of Sciences of the United States of America. 115, 2764-2769 (2018).
- Baba, K., et al. Gradient-reading and mechano-effector machinery for netrin-1-induced axon guidance. Elife. 7, 34593 (2018).
- Nichol, R. I., Hagen, K. M., Lumbard, D. C., Dent, E. W., Gomez, T. M. Guidance of axons by local coupling of retrograde flow to point contact adhesions. Journal of Neuroscience. 36, 2267-2282 (2016).
- Shekarabi, M., et al. Deleted in colorectal cancer binding netrin-1 mediates cell substrate adhesion and recruits Cdc42, Rac1, Pak1, and N-WASP into an intracellular signaling complex that promotes growth cone expansion. Journal of Neuroscience. 25, 3132-3141 (2005).
- Kubo, Y., et al. Shootin1-cortactin interaction mediates signal-force transduction for axon outgrowth. Journal of Cell Biology. 210, 663-676 (2015).
- Huber, A. B., Kolodkin, A. L., Ginty, D. D., Cloutier, J. F. Signaling at the growth cone: ligand-receptor complexes and the control of axon growth and guidance. Annual Review of Neuroscience. 26, 509-563 (2003).
- Kolodkin, A. L., Tessier-Lavigne, M. Mechanisms and molecules of neuronal wiring: a primer. Cold Spring Harbor Perspectives in Biology. 3, 001727 (2011).
- Ayala, R., Shu, T., Tsai, L. H. Trekking across the brain: the journey of neuronal migration. Cell. 128, 29-43 (2007).
- Tatavarty, V., Kim, E. J., Rodionov, V., Yu, J. Investigating sub-spine actin dynamics in rat hippocampal neurons with super-resolution optical imaging. PLoS One. 4, 7724 (2009).
- Frost, N. A., Shroff, H., Kong, H., Betzig, E., Blanpied, T. A. Single-molecule discrimination of discrete perisynaptic and distributed sites of actin filament assembly within dendritic spines. Neuron. 67, 86-99 (2010).
- Chazeau, A., et al. Nanoscale segregation of actin nucleation and elongation factors determines dendritic spine protrusion. EMBO Journal. 33, 2745-2764 (2014).
- Garcia, M., et al. Two-tiered coupling between flowing actin and immobilized N-cadherin/catenin complexes in neuronal growth cones. Proceedings of the National Academy of Sciences of the United States of America. 112, 6997-7002 (2015).
- Swaminathan, V., et al. Actin retrograde flow actively aligns and orients ligand-engaged integrins in focal adhesions. Proceedings of the National Academy of Sciences of the United States of America. 114, 10648-10653 (2017).
- Tsai, T. Y., et al. Efficient front-rear coupling in neutrophil chemotaxis by dynamic myosin II localization. Developmental Cell. 49, 189-205 (2019).
- Zhang, X. F., et al. Regulation of axon growth by myosin II-dependent mechanocatalysis of cofilin activity. Journal of Cell Biology. 218 (7), 2329-2349 (2019).
- Reversat, A., et al. Cellular locomotion using environmental topography. Nature. 582, 582-585 (2020).
- Katsuno, H., et al. Actin migration driven by directional assembly and disassembly of membrane-anchored actin filaments. Cell Reports. 12, 648-660 (2015).
- Urasaki, A., et al. Shootins mediate collective cell migration and organogenesis of the zebrafish posterior lateral line system. Scientific Reports. 9, 12156 (2019).
- Abe, K., et al. Mechanosensitive axon outgrowth mediated by L1-laminin clutch interface. Biophysical Journal. 120, 3566-3576 (2021).
- Kastian, R. F., et al. Shootin1a-mediated actin-adhesion coupling generates force to trigger structural plasticity of dendritic spines. Cell Reports. 35, 109130 (2021).
- Riedl, J., et al. Lifeact: a versatile marker to visualize F-actin. Nature Methods. 5, 605-607 (2008).
- Chan, C. E., Odde, D. J. Traction dynamics of filopodia on compliant substrates. Science. 322, 1687-1691 (2008).
- Wang, Y. L., Pelham, R. J. Preparation of a flexible, porous polyacrylamide substrate for mechanical studies of cultured cells. Methods in Enzymology. 298, 489-496 (1998).
- Li, Y., Hu, Z., Li, C. New method for measuring poisson's ratio in polymer gels. Journal of Applied Polymer Science. 50, 1107-1111 (1993).
- Belyy, A., Merino, F., Sitsel, O., Raunser, S. Structure of the Lifeact-F-actin complex. PLoS Biology. 18, 3000925 (2020).
- Flores, L. R., Keeling, M. C., Zhang, X., Sliogeryte, K., Gavara, N. Lifeact-GFP alters F-actin organization, cellular morphology and biophysical behaviour. Scientific Reports. 9, 3241 (2019).
- Kumari, A., Kesarwani, S., Javoor, M. G., Vinothkumar, K. R., Sirajuddin, M. Structural insights into actin filament recognition by commonly used cellular actin markers. EMBO Journal. 39, 104006 (2020).
- du Roure, O., et al. Force mapping in epithelial cell migration. Proceedings of the National Academy of Sciences of the United States of America. 102, 2390-2395 (2005).
- Grashoff, C., et al. Measuring mechanical tension across vinculin reveals regulation of focal adhesion dynamics. Nature. 466, 263-266 (2010).
- Koch, D., Rosoff, W. J., Jiang, J., Geller, H. M., Urbach, J. S. Strength in the periphery: growth cone biomechanics and substrate rigidity response in peripheral and central nervous system neurons. Biophysical Journal. 102 (3), 452-460 (2012).
- Barnes, J. M., Przybyla, L., Weaver, V. M. Tissue mechanics regulate brain development, homeostasis and disease. Journal of Cell Science. 130, 71-82 (2017).
- Moore, S. W., Roca-Cusachs, P., Sheetz, M. P. Stretchy proteins on stretchy substrates: the important elements of integrin-mediated rigidity sensing. Developmental Cell. 19, 194-206 (2010).
- Tyler, W. J. The mechanobiology of brain function. Nature Reviews Neuroscience. 13, 867-878 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。