Method Article
Büyüme Konisi İlerlemesi için Actin Dynamics, Debriyaj Kavrama ve Çekiş Kuvveti Analizleri
Bu Makalede
Özet
İlerlemek için, büyüme konileri dış ortama karşı çekiş kuvvetleri uygulamalıdır. Çekiş kuvvetlerinin üretimi akin dinamiklerine ve debriyaj kavramasına bağlıdır. Bu çalışmada büyüme konisi ilerlemesi için akin dinamiklerini, debriyaj kavramasını ve çekiş kuvvetlerini analiz etme yöntemleri açıklanmaktadır.
Özet
İşlevsel ağlar kurmak için nöronların uygun hedeflerine geçmeleri ve ardından aksonları hedef hücrelerine doğru genişletmeleri gerekir. Bu süreçler, nötroritlerin uçlarında bulunan büyüme konilerinin ilerlemelerine bağlıdır. Aksonal büyüme konileri, yerel mikroçevrimlerini algılayarak ve sitoskeletal dinamikleri ve aktin-yapışma kavramasını (kavrama kavraması) modüle ederek itici güçler üretir. Onlarca yıllık araştırmalar, nöronal göçü ve aksonal rehberliği düzenlemek için kılavuz moleküllerinin, reseptörlerinin ve aşağı akış sinyal basamaklarının tanımlanmasına yol açmıştır; bununla birlikte, büyüme konisi ilerlemesini ve navigasyonu yönlendirmek için kuvvetler üretmek için gereken moleküler makineler yeni yeni aydınlatılmaya başlıyor. Nöronal büyüme konilerinin öncü kenarında, aksin filamentleri, aksin polimerizasyonu ve akromiyosin kasılması ile desteklenen retrograd akışa tabir edilir. F-actin retrograd akışı ile yapışkan substrat arasındaki debriyaj bağlantısı, büyüme konisi ilerlemesi için çekiş kuvvetleri oluşturur. Bu çalışmada F-actin retrograd akışının tek benekli görüntüleme ile izlenmesi için ayrıntılı bir protokol açıklanmaktadır. Daha da önemlisi, bir F-actin işaretleyici Lifeact ile birleştirildiğinde, bu teknik 1) F-actin polimerizasyon oranını ve 2) F-actin retrograd akışı ile yapışkan substrat arasındaki debriyaj kavrama verimliliğini ölçebilir. Her ikisi de büyüme konisi ilerlemesi ve navigasyon için kuvvetler üretmek için kritik değişkenlerdir. Ek olarak, bu çalışma, büyüme konileri tarafından üretilen 3) çekiş kuvvetini ölçebilen ayrıntılı bir çekiş kuvveti mikroskopisi protokolünü açıklar. Böylece, araştırmacılar tek benek görüntüleme ve çekiş kuvveti mikroskopisinin analizlerini bir araya getirebilirler, büyüme konisi ilerlemesini ve navigasyonunu temel alan moleküler mekaniği izleyebilirler.
Giriş
Gelişmekte olan omurgalı beyinde, nöronlar işlevsel nöronal ağlar kurmak için uygun sinaptik ortaklara doğru ayrıntılı olarak organize edilmiş göçlerden geçer ve aksonlar yansıtır1,2,3. Nötrallerin ucunda bulunan duyusal ve hareketli yapılar olan büyüme konileri, nöronal göç ve akson büyümesinin hızını ve yönünü belirler3,4,5. Nöronlar sıkıca paketlenmiş ortamlarla çevrili olduğundan, büyüme konileri ilerlemek için çevrelerine karşı güç uygulamalıdır6,7. Nöronal göçün ve aksonal rehberliğin altında kalan mekanizmaları anlamak için, büyüme konisi ilerlemesi için moleküler mekaniğin analizleri esastır.
Onlarca yıllık analiz, büyüme koni ilerlemesini sağlamak için çekiş kuvvetinin 'debriyaj' mekanizması tarafından üretildiğini ortaya koydu; bu mekanizmanın sadece aksonal büyüme konisinde değil, aynı zamanda göç eden nöronların önde gelen proses büyüme konisinde de işlev göremediği düşünülmektedir8,9,10,11,12. Yani, büyüme konilerindeki aktin filamentler (F-actinler) öndeki kenarda polimerize olur ve proksimal olarak depolimerize olur ve öncü membranı dışarı iterek13,14,15. Elde eden kuvvet, aktomiyosin kasılması ile birlikte, retrograd akış olarak adlandırılan F-aktisinlerin geriye doğru hareketini teşvik eder7,11,16,17,18,19,20,21. Debriyaj ve hücre yapışma molekülleri, F-actin retrograd akışı ile yapışkan substrat arasındaki mekanik bağlantıya aracılık eder ve F-aktiin akışının kuvvetini substrata iletir, böylece büyüme konisi ilerlemesi için çekiş kuvveti üretir7,8,9,11,12,22 . Eşzamanlı olarak, aksin-substrat kavraması F-aktüer akış hızını azaltır ve aksin polimerizasyonunu önde gelen membran9,10'a çıkıntı yapmak için kuvvete dönüştürür.
Aksonal büyüme konileri yerel kimyasal ipuçlarını algılar ve bunları büyüme konisi navigasyonu için yönlü bir itici güce çevirir3,23,24,25. Örneğin, bir akson kılavuz molekülü netrin-1 kolorektal kanserde (DCC) silinen reseptörü uyarır ve Rho guanosine trifosfat (GTP)- bağlayıcı proteinler hücre bölünmesi kontrol proteini 42 (Cdc42) ve Ras ile ilgili C3 botulinum toksin substratı 1 'i (Rac1) ve bunların aşağı akış kinaz p21-aktive kinaz 1'ini (Pak1) aktive eder. Cdc42 ve Rac1 1) aksin polimerizasyonunu teşvik eder ve Pak1 bir debriyaj molekülü çekimini 122,26 fosforilasyon eder. Shootin1, aktiin bağlayıcı protein kortektin27 aracılığıyla F-actin retrograd akışı ile etkileşime girer. Shootin1 ayrıca L1 hücre yapışma molekülü (L1-CAM)20,24 ile etkileşime girer. Shootin1 fosforilasyon, kortaktin ve L1-CAM için bağlayıcı yakınlıkları arttırır ve shootin1 aracılı 2) debriyaj kavramasını geliştirir24,27. Büyüme konisi içinde, akrin polimerizasyonunun asimetrik aktivasyonları ve debriyaj kavraması, netrin-1 kaynağının yan tarafındaki 3) çekiş kuvvetini arttırır, böylece büyüme konisi tornalaması için yönlü itici güç üretir (Şekil 1)24. Nöronal göç ve akson rehberliği ile ilgili son birkaç on yıldaki yoğun araştırmalar, kılavuz moleküllerin, reseptörlerinin ve ilişkili aşağı akış sinyal basamaklarının anlaşılmasını artırmıştır2,10,28,29,30. Bununla birlikte, büyüme konisi ilerlemesi için kuvvetler üretecek moleküler makineler yeni yeni aydınlatılmaya başlıyor; bu, mekanobiyolojik analizler için protokollerin sınırlı kullanımına bağlanabilir.
Bu çalışma, F-actin retrograd akışını tek benek görüntüleme ile izlemek için ayrıntılı bir protokolü açıklar16,18. F-aktipin retrograd akışının izlenmesi, süper çözünürlüklü mikroskopi, iplik disk konfokal mikroskopi ve toplam girişim yansıma floresan (TIRF) mikroskopisi25,31,32,33,34,35,36,37,38 kullanılarak kapsamlı bir şekilde gerçeklendirilmiştir. . Bununla birlikte, bu çalışmadaki protokol standart bir epifluoresans mikroskobu kullanır ve bu nedenle kolayca benimsenebilir11,16,18,20,22,23,24,27,39,40,41,42. Lifeact43 tarafından F-actin etiketleme ile birleştirildiğinde, tek benekli görüntüleme, aktüer polimerizasyon oranının ve F-actin retrograd akışı ile yapışkan substrat39,42 arasındaki debriyaj kavrama verimliliğinin nicelleştirilmesine izin verir. Bu çalışma ayrıca floresan boncuk gömülü poliakrilamid (PAA) jel11,22,23,24,27,39,41,42,44 kullanarak traction kuvveti mikroskopisinin ayrıntılı bir protokolünü açıklamaktadır. Bu yöntem, kuvvet kaynaklı boncuk hareketlerini izleyerek büyüme konisi altındaki çekiş kuvvetini algılar ve ölçer44,45. Açık kaynaklı bir çekiş kuvveti analiz kodu sağlanır ve büyüme konisi göçü sırasında çekiş kuvvetini ölçme yöntemi ayrıntılı olarak açıklanmıştır. Tek benek görüntüleme ve çekiş kuvveti mikroskopisi yardımıyla, büyüme konisi göçü ve navigasyonunun altında kalan moleküler mekaniği anlamak kolaylaştırılacaktır. Bu teknikler, öğrenme ve hafızada önemli olduğu bilinen dendritik omurga genişlemesinin altında kalan moleküler mekaniği analiz etmek için de geçerlidir42.
Protokol
Laboratuvar hayvanları kullanılarak yapılan tüm deneyler Nara Bilim ve Teknoloji Enstitüsü Kurumsal Hayvan Bakım ve Kullanım Komitesi ile gerçekleştirildi. Araştırmacılar, laboratuvar hayvanlarının bakımı ve kullanımı için kurumsal ve ulusal hayvan düzenleme komiteleri tarafından belirlenen yönergelere uymalıdır.
1. Çözümlerin ve medyanın hazırlanması
- Ek Dosya 1'de özetlenen çözümleri ve kültür medyasını hazırlayın
2. Poli-D lizin (PDL)/laminin kaplı substratların hazırlanması
- Fosfat tamponlu salinde (PBS, pH 7.4) çözünmüş 100 μg/mL PDL ile 14 mm çapında cam tabanlı bulaşıkları kaplar ve 37 °C'de nemlendirilmiş bir inkübatörde bir gece kuluçkaya yatırın.
NOT: Bu adımdan sonra cam yüzeyleri kurutmayın - PDL çözeltisini ve pipeti 1 mL PBS'yi cam üzerinde üç kez 10 sn çıkarın.
- Yemekleri PBS'de çözünmüş 5 μg / mL laminin ile kaplayın ve 37 ° C'de nemlendirilmiş bir inkübatörde bir gece kuluçkaya yatın.
- Laminin çözeltisini ve pipeti 1 mL PBS'yi camda üç kez 10 sn çıkarın.
- PBS'yi çıkarın ve nörobakal ortamın 0,5 mL'lik kısmını cam yüzeylere yerleştirin. Bulaşıkları 37 °C'de nemlendirilmiş bir inkübatörde saklayın.
NOT: PDL/laminin kaplı yemekler 37 °C'de nemlendirilmiş bir inkübatörde 2-3 gün saklanabilir.
3. Hipokampüsün diseksiyonu ve ayrışması
- Hamile bir fareyi servikal çıkık ile ötenazi.
NOT: Bu çalışmada piyasada bulunan fareler sunulmuştur (bkz. Malzeme Tablosu). Araştırmacılar sterilize edilmiş bir ortamda yetiştirilen ve insanca tedavi edilen fareleri kullanmalıdır. - Embriyonik gün-16 (E16) fare embriyolarını parçalara ayrıştırıp buza yerleştirin.
- Laminer akış davlumbazında, beyinleri makasla parçalara ayrıştırın ve 10 mL buz gibi diseksiyon çözeltisi içeren steril 10 cm'lik bir kabın üzerine yerleştirin.
- Diseksiyon stereo mikroskobu ile, serebral yarımkürelerin menenjilerini dikkatlice soyun ve ardından hipokampiyi empeps kullanarak parçalara ayrıştırın.
- Hipokampiyi 15 mL'lik bir tüpte 5 mL buz gibi sindirim çözeltisine aktarın. Hipokampiyi 37 °C'de 20 dakika boyunca bir su banyosunda kuluçkaya yatırın.
- Sindirim çözeltisini çıkarın ve 3 mL diseksiyon çözeltisi ekleyin.
- Hipokampiyi pasteur pipetle dört kez hafifçe pipetle.
- Hipokampiyi 37 °C'de 20 dakika boyunca bir su banyosunda kuluçkaya yatırın.
- Hücre süspansiyonu 50 mL santrifüj tüpüne aktarın. Ayrışmayan dokuya 3 mL yeni diseksiyon çözeltisi ekleyin.
- Hipokampi tamamen dağılana kadar 3.7-3.9 arası adımları tekrarlayın.
- Pasteur pipetle dönerek ve aspire ederek hücre süspansiyonundan yüzen DNA agregalarını çıkarın. Hücre süspansiyonu 180 x g'da 4 °C'de 20 dakika santrifüj.
NOT: Hasarlı hücrelerden elde edilen DNA santrifüjleme işlemini bozacaktır. Nöronlar süpernatanta kalırsa, DNA'yı dikkatlice çıkardıktan sonra hücre süspansiyonu tekrar santrifüjleme. - %5 CO2 ile 37 °C'de nemlendirilmiş bir inkübatörde %10 fetal sığır serumu (FBS), penisilin (100 U/mL) ve streptomisin (100 μg/mL) içeren eşkenar nörobakal ortam.
4. Transfeksiyon ve kült nöronlar
- Süpernatant çıkarın ve 50 mL tüp içine 5 mL buz gibi PBS ekleyin. Hücre peletini hafif pipetleme ile yeniden dürt.
- Hücre süspansiyonunun 10 μL'sini bir mikrosantrifüj tüpüne aktarın, % 0,5 trippan mavi çözeltisinin 10 μL'sini ekleyin ve ardından hemositometre ile hücre sayısını sayın.
- Hücre süspansiyonu 50 mL tüpte 180 x g'da 4 °C'de 20 dakika santrifüj.
- Bu arada, transfeksiyon için aliquot, 1 x 106 hücre başına 1 μg pFN21A-HaloTag-actin ve 3 μg pmNeonGreen-N1-Lifeact, bir mikrosantrifüj tüpüne.
- Santrifüjlemeden sonra, süpernatantı çıkarın ve 50 mL'lik boruya 100 μL elektroporasyon ortamı (transfeksiyon kiti tarafından sağlanır) ekleyin. Hücre peletini pipetleme ile yeniden dirildi.
- Hücre süspansiyonunu aliquoted DNA çözeltisi ile karıştırın ve karışımı bir cuvette 'e (transfeksiyon kiti tarafından sağlanır) aktarın.
NOT: Hava kabarcıkları elektroporasyonunu bozduğundan, hücre süspansiyonundan çıkarın. - Cuvette'i elektroporasyon aparatına (Malzeme Tablası) yerleştirin ve O-005 programını kullanarak elektroporasyon gerçekleştirin.
- Cuvette'e hemen %10 FBS, penisilin (100 U/mL) ve streptomisin (100 μg/mL) içeren önceden ısıtılmış ve dengelenmiş nörobakal ortamın 1 mL'sini ekleyin.
- Hücre süspansiyonunu plastik bir pipet kullanarak (transfection kiti tarafından sağlanan) 15 mL santrifüj tüpüne aktarın.
- Hücre süspansiyonunun 10 μL'sini bir mikrotüpe aktarın, % 0,5 trippan mavi çözeltisinin 10 μL'sini ekleyin ve ardından hemositometre ile hücre sayısını sayın.
- PDL/laminin kaplı cam tabanlı tabakları inkübatörden çıkarın ve nörobakal ortamı çıkarın.
- Pipet Çanak başına 2.0 x 105 hücre içeren hücre süspansiyonunun 0.5 mL'si ve 37 °C'de nemlendirilmiş bir inkübatörde 3 saat boyunca% 5 CO2 ile kuluçkaya yaslayın.
- Ortamı %2 B-27 takviyesi, glutamin (1 mM), penisilin (100 U/mL) ve streptomisin (100 μg/mL) içeren 0,5 mL nörobakal ortamla değiştirin. Nöronları% 5 CO2 ile 37 ° C'de 3 gün boyunca nemlendirilmiş bir inkübatörde kültüre edin.
5. Nöronal büyüme konilerde tek benekli görüntüleme
- Gün in vitro (DIV) 3, kültür ortamında 1:2000 seyreltme seyreltme tetrametril-rhodamin (TMR) ligand ile nöronları tedavi. %5 CO2 ile nöronları 37 °C'de 1 saat koruyun.
- TMR ligandını önceden ısıtılmış PBS ile üç kez yıkayın.
- %2 B-27 takviyesi, glutamin (1 mM), penisilin (100 U/mL) ve streptomisin (100 μg/mL) içeren ısıtılmış Leibovitz'in L-15 ortamının PBS ve pipetini 0,5 mL çıkarın.
- Nöronları 37 °C'de 1 saat koruyun.
- Epifluoresans mikroskobu açın ve sahne üstü inkübatörü 37 °C'ye ayarlayın.
NOT: Mevcut protokolde tamamlayıcı metal oksit yarı iletken kamera, 100x/1.40 NA yağ daldırma objektif lens, cıva lambası ve görüntü alma yazılımı ile donatılmış bir epifluoresans mikroskobu sunulmuştur (bkz. Bu analiz için eşdeğer spesifikasyonlara sahip diğer epifluoresans mikroskopları da kullanılabilir. - TMR ligand ile işlenmiş nöronları ısıtılmış sahne üstü inkübatörün üzerine cam tabanlı tabağa yerleştirin.
- Görüntü alma parametrelerini aşağıdaki gibi ayarlayın: pozlama süresi, Lifeact ve HaloTag-actin floresan kanalları için 500 ms; binning, 1 x 1 (0,065 μm × piksel başına 0,065 μm); zaman aralığı, 3 s; süre, 50 kare.
- Lifeact'i güçlü bir şekilde ifade eden ve HaloTag-actin'i zayıf bir şekilde ifade eden bir büyüme konisi seçin.
NOT: Lifeact ifadesi büyüme konisi morfolojisini görselleştirecek kadar güçlü olmalıdır. HaloTag-actin ekspresyonu zayıf ve tespit edilememeli (Şekil 2A). Floresan protein ekspresyonlarının seviyeleri transfeksiyon için DNA miktarı değiştirilerek ayarlanabilir. - Büyüme konisini içeren minimum alanı aydınlatmak için diyafram alanını kapatın (Şekil 2B).
NOT: Minimum alanın aydınlatılması arka plan sinyalini azaltır ve floresan sinyalini gürültüye (S/N) oranına yükselterek akin beneklerinin algılanmasını sağlar (Şekil 2B). S/N oranını daha da artırmak için, ışığı nötr yoğunluk filtreleriyle azaltmadan büyüme konisinin aydınlattırı önerilir. - Zaman atlamalı görüntüler alın (Ek Dosya 2). Çok kanallı zaman atlamalı yığın görüntüsü (tiff biçimi) olarak kaydedin.
6. Bir görüntü işleme ve analiz yazılımı fiji kullanarak F-actin akış hızı ve polimerizasyon oranının nicelleştirilmesi
NOT: F-actin akış hızını ve aktin polimerizasyon oranını ölçmek için uygulama verileri için Ek Dosya 3'e bakın.
- Fiji'de çok kanallı zaman atlamalı yığın görüntüsünü açın.
- Ölçeği > Ayarla'yı seçin ve görüntülerin piksel boyutunu ayarlayın.
- Filopodia veya lamellipodia'daki bir F-actin demetinde en az beş zaman dilimi için geriye doğru akan bir aktivin benek bulun.
- Görüntü > Dönüştür > Döndür'ü seçin ve görüntülerin açısını F-actin demetinin yukarı doğru işaret etmesi için ayarlayın (Şekil 3A).
- Araç çubuğundaki Dikdörtgen'e tıklayın ve aktüer beneklerini ve F-actin paketinin ucunu içeren bir kutu çizin (Şekil 3B, 1 ve 2).
NOT: HaloTag-actin beneklerinin sinyalleri zayıftır. Ek olarak, büyüme konisinin distal uçlarındaki Lifeact sinyalleri zayıf ve soluktur (Şekil 2B), çünkü büyüme konisinin distal uçları proksimal kısma göre incedir. Araştırmacılar, F-aksin akış hızı ve polimerizasyon oranının nicelliklerini optimize etmek için sinyalleri geliştirmelidir (Şekil 3B). Proksimal büyüme konislerindeki Lifeact sinyali doygun hale gelse de, bu F-actinlerin distal ucunun belirlenmesini bozmaz (Şekil 3E, sarı çizgi). - Görüntü > Çoğalt'ı seçin ve beş zaman dilimini girin (Şekil 3B, 3-5).
- Montaj Yapmak > Resim > Yığınları'nı seçin ve parametreleri girin: Sütunlar, 5; Satırlar, 1; Ölçek faktörü, 1.
- Tamam'a tıklayın. Görüntü montajı ekranda görünecektir.
- Görüntü > Renk > Bölünmüş Kanallar'ı seçin. Bu, iki floresan kanalı ayırır.
- F-aktüen akış hızının ölçülmesi.
- Ölçümleri > Ayarla'yı ve Alan ve Sınırlayıcı Dikdörtgen'i seçin.
- Araç çubuğunda Oval'e tıklayın ve bir aksin lekesi üzerine bir daire çizin (Şekil 3C, 1 ve 2).
- Resim > Yer Paylaşımı'> Seçim Ekle'yi seçin. Daire görüntü montajı üzerine bindirilir (Şekil 3C, 3 ve 4).
NOT: Kaplamanın rengi, > Seçenekleri > Renkleri Düzenle'de değiştirilebilir. - Kalan benekler için dairelerin yer paylaşımını tekrarlayın (Şekil 3C, 5).
NOT: Aktüen benek merkezlerini doğru bir şekilde belirlemek için, araştırmacılar benekler üzerindeki daireleri kaplamalıdır. - Araç çubuğunda Düz'e tıklayın ve dairelerin merkezlerini birbirine bağlayan bir çizgi çizin (Şekil 3D, 1 ve 2).
- Ölçü > Çözümle'yi seçin. Sonuç ekranda görünecektir (Şekil 3D, 3).
NOT: Sonuçta görüntülenen yükseklik , gözlem sırasında akin benekinin translokasyon mesafesini gösterir (Şekil 3D, 3). - Translokasyon mesafesini gözlem süresine bölerek F-aktikli akış hızını hesaplayın.
- F-aktüer polimerizasyon oranının nicelemesi.
- F-actin paketinin uçlarını birbirine bağlayan bir çizgi çizin (Şekil 3E, 1).
- Ölçü > Çözümle'yi seçin. Sonuç ekranda görünecektir (Şekil 3E, 2).
NOT: Sonuçtaki yükseklik , gözlem sırasında F-actin demetinin uzatma uzunluğunu gösterir (Şekil 3E, 2). - Uzatma uzunluğunu gözlem süresine bölerek F-actin uzatma oranını hesaplayın.
- F-actin polimerizasyon oranını F-actin akış hızı ve uzatma hızının toplamı olarak hesaplayın (Şekil 3F).
7. Çekiş kuvveti mikroskopisi ve nöron kültürleri için paa jelinin hazırlanması
- Çekiş kuvveti mikroskopisi için gerekli PAA jellerinin hazırlanması (Şekil 4)
- Pipet 0,5 mL NaOH (100 mM), damıtılmış H2O'da, 27 mm çapında cam tabanlı tabaklarda çözülür ve oda sıcaklığında (RT) 15 dakika kuluçkaya yaslanabilir.
- Bulaşıklardaki NaOH çözeltisine 50 μL 3-aminopropyltrimethyoxysilane (APTMS) ekleyin ve çözeltileri hafif pipetleme ile karıştırın ve RT'de 15 dakika kuluçkaya yatırın.
- Cam tabanlı bulaşıkları damıtılmış H2O ile yıkayın ve kurutun.
- Pipet 0.5 mL% 0.5 glutaraldehit çözeltisi, PBS'de çözünmüş, APTMS ile işlenmiş cam tabanlı tabakta ve RT'de 30 dakika kuluçkaya yatır.
- Cam tabanlı bulaşıkları damıtılmış H2O ile yıkayın ve kurutun.
- Damıtılmış H2O (412 μL), %30 (w/v) akrilamid çözeltisi (63 μL), %2,5 (w/v) bis-akrilamid çözeltisi (6 μL) ve karboksilat modifiye mikroküreç (floresan boncuk) çözeltisi (20 μL) içeren bir çözelti hazırlayın.
NOT: Akrilamid çözeltisine eklemeden önce agrega boncuklarını ayrıştırmak için floresan boncuk çözeltisini girdap. - RT'de 30 dakika boyunca çözümü bir vakum odasında gazdan arındırın.
- Bu çözüme, damıtılmış H2O'da çözünmüş% 10 (w/ v) amonyum persülfat (APS) ve 1 μL N,N,N', N'-tetrametilenilenediamin (TEMED) ekleyin ve hafif pipetleme ile karıştırın.
- 15 mL santrifüj tüpünün kapağına bir cam kapak kılıfı (18 mm çapında) yerleştirin.
- Hemen kapak kapağına 25 μL çözelti ekleyin ve ardından kapak kapağına ters cam tabanlı bir kabı hafifçe yerleştirin. Akrilamidin RT'de 1 saat polimerize olmasını izin verin.
- Damıtılmış H2O'yu kapak ucuna uygulayın ve bükülmüş bir uçlu bir şırınga iğnesi kullanarak jelden soyun.
- H2O'yu çıkarın ve PBS'de çözünmüş sülfo-SANPAH'ı (1 mM) jelin içine ekleyin.
- Steril koşullar altında, jelleri 5 dakika boyunca ultraviyole ışığa maruz bırakın. Jeli PBS ile yıkama başına 15 dakika boyunca üç kez yıkayın.
- Mikrokürez girinti yöntemi ile jel sertliğinin belirlenmesi (Şekil 5A)44.
- Çapı ve yoğunluğu için belirtilen bir mikrosferi jelin içine aktarın ve ardından lazer tarama konfokal mikroskobun numune aşamasına yerleştirin.
- Jel yüzeye odaklanın ve z pozisyonunu kaydedin (Şekil 5B).
- Benzer şekilde, mikro kürenin altına odaklanın ve z pozisyonunu kaydedin (Şekil 5C).
- Jel yüzeyinin z-konumları ile mikrosferin tabanı arasındaki farka göre belirlenen girinti derinliğini hesaplayın.
- Young'ın jelin E modüllerini şu şekilde hesaplayın:
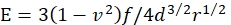
burada f mikro kürenin yüzdürülmüş ağırlığıdır, d jelin girinti derinliğidir, r mikro kürenin yarıçapıdır ve v Poisson'un oranıdır (değeri daha önce belirlendiği gibi 0,3'tür46).
- Jelleri bölüm 2'de açıklandığı gibi PDL ve laminin ile kapla.
- Bölüm 3 ve 4'te açıklandığı gibi, E16 fare embriyolarını parçalara ayırın, hipokampiyi ayırın ve 1.0 x 106 hücre başına 5 μg pEGFP-C1 ile transfect. PDL/laminin kaplı jeller üzerinde tohum 2.0 x 105 hücre.
NOT: Çekiş kuvveti analizi için, büyüme koni alanının belirlenmesi için floresan etiketli hücrelerin mikroskobik görüntülenmesi gereklidir.
8. Nöronal büyüme konilerinde çekiş kuvveti mikroskopisi
- DIV3'te kültür ortamını % 2 B-27 takviyesi, glutamin (1 mM), penisilin (100 U/mL) ve streptomisin (100 μg/mL) içeren 0,5 mL ısıtılmış Leibovitz'in L-15 ortamıyla değiştirin. Nöronları 37 °C'de 1 saat koruyun.
- Lazer tarama konfokal mikroskobu açın ve sahne üstü inkübatörü 37 °C olarak ayarlayın.
NOT: Bu çalışmada 63x/1.2 NA su daldırma objektif lensi ve görüntü alma ve analiz yazılımı ile donatılmış lazer taramalı konfokal mikroskop sunulmuştur (bkz. - Nöronları önceden ısıtılmış sahne üstü inkübatörün üzerine cam tabanlı tabağa yerleştirin.
- Görüntü alma parametrelerini aşağıdaki gibi ayarlayın: tarama boyutu, 512 × 512 piksel; tarama alanı, 1,5-3x yakınlaştırma; tarama hızı, kare başına ~1 s; lazer dalga boyu, 561 nm (floresan boncuklar için ekscitasyon dalga boyu) ve 488 nm (gelişmiş yeşil floresan protein (EGFP) için heyecan dalga boyu); zaman aralığı, 3 s; süre, 50 kare.
- Büyüme konisi morfolojisini görselleştirmek için EGFP'yi güçlü bir şekilde ifade eden bir büyüme konisi seçin.
- Jel yüzeye odaklanın ve hızlandırılmış görüntüler elde edin (Şekil 6A ve Ek Dosya 4).
NOT: Çekiş analizi için iki floresan kanal (floresan boncuklar ve EGFP için) ve parlak alan kanalı (diferansiyel girişim kontrastı (DIC) veya faz kontrastı görüntüleri yakalamanız önerilir) kullanın. - Tek kanallı zaman atlamalı RGB görüntü yığınları oluşturmak ve bu görüntüleri tiff dosyaları olarak kaydetmek için bir görüntü işleme yazılımı (örneğin, Fiji) kullanın.
NOT: Araştırmacıların ham verileri de kaydetmesi önemlidir. - Alt tabakadan nöronları serbest bırakarak jel substratını gevşetmek için cam tabanlı yemeğe, damıtılmış H2O'da çözünmüş% 10 (w/v) sodyum dodecyl sülfat (SDS) 100 μL uygulayın. Sıcaklığı stabilize etmek için kabı 37°C'de 5 dakika kuluçkaya yatırın.
NOT: Boncukların sınırlanmamış bir substrattaki görüntüsü, çekiş kuvveti analizi sırasında orijinal boncuk konumlarına başvurmak için kullanılır (Şekil 6C). SDS çözeltisinin uygulanması, inkübatördeki termal değişim ve hücre kaynaklı deformasyonun gevşemesi nedeniyle ksist konumlarını değiştirir. Bu nedenle, araştırmacıların odak düzlemini ve x-y pozisyonunu düzeltmeleri gerekir. - Jel yüzeyine odaklanın ve sınırlanmamış substrattaki boncukların bir görüntüsünü elde edin (Şekil 6B).
- Sınırlandırılmamış alt tabakadaki boncukların tek kanallı RGB görüntüsünü üretin ve bu görüntüyü bir tiff dosyası olarak kaydedin.
- Fiji kullanılarak sınırlandırılmamış substrattaki boncuk görüntüsünün x-y konumunun düzeltilmesi
- Fiji'de, kısıtlanmamış alt tabakadaki boncuk görüntüsünü ve floresan boncukların zaman atlamalı yığın görüntüsünü açın.
- Birleştirme > Resim > Yığınları > Araçları'nı seçin. Ekranda bir diyalog kutusu görünecektir (Şekil 7A, 1).
- Sırasıyla, sınırlandırılmamış alt tabakadaki boncuk görüntüsünü ve Image1 ve Image2'deki floresan boncukların zaman atlamalı yığın görüntüsünü seçin (Şekil 7A, 2).
- Tamam'a tıklayın. Sınırlandırılmamış alt tabakadaki boncuk görüntüsü zaman atlamalı yığın görüntüsüne eklenir (Şekil 7A, 3).
- Kaydırma çubuğunu (Şekil 7B, 1, kırmızı çerçeve) kullanarak yığın görüntüsünün ikinci karesini (kırmızı ok) görüntüleyin.
- StackReg> Eklentiler'i seçin (Şekil 7B, 2). Ekranda bir diyalog kutusu görünecektir (Şekil 7B, 3).
- Açılan listeden Sert Gövde'yi seçin (Şekil 7B, 3, kırmızı çerçeve) ve Tamam'a tıklayın. X-y konumunun düzeltilmesi daha sonra başlar.
- x-y konum düzeltilmiş yığın görüntüsünün ilk karesini görüntülemek için kaydırma çubuğunu kullanın.
- Resim > Çoğalt'ı seçin (Şekil 7C, 1). Ekranda bir diyalog kutusu görünecektir (Şekil 7B, 2).
- Aralık'a 1 girin, Yinelenen Yığın'ın seçimini kaldırın (Şekil 7C, 2) ve Tamam'ı tıklatın. Kısıtlanılmamış alt tabakadaki x-y konum düzeltilmiş boncuk görüntüsü ekranda görünecektir (Şekil 7C, 3). Bu görüntüyü tiff dosyası olarak kaydedin.
- Çekiş kuvvetinin nicelleştirilmesi
NOT: Çekiş kuvveti analizi için burada açıklanan yöntem MATLAB ve iki MATLAB araç kutusu kullanır, 'Görüntü İşleme Araç Kutusu' ve 'Paralel Bilgi İşlem Araç Kutusu'. Müfettişlerin analizden önce bunları kurmaları gerekecektir. Çekiş kuvveti analiz kodu MATLAB sürüm 2018a'ya dayanarak geliştirilmiştir. Bu nedenle, analiz için MATLAB sürüm 2018a (veya daha yenisi) kullanılmalıdır. Çekiş kuvveti analizi için kullanılan algoritmalar daha önce tanımlanmıştır22.- Ek Dosya 5'ten çekiş kuvveti analiz kodu TFM2021'i indirin. MATLAB'da TFM 2021'i açın
- TFM2021'de ana .m açın ve çalıştırın. Ekranda bir grafik kullanıcı arabirimi (GUI) görünecektir (Şekil 8A).
- Sınırlanmamış substrat görüntüsünü yükle'ye tıklayın ve sınırlandırılmamış alt tabakada x-y konum düzeltilmiş boncuk görüntüsünü seçin.
- Floresan boncuk görüntülerini yükle'ye tıklayın ve boncukların zaman atlamalı yığın görüntüsünü seçin.
- Parlak alan görüntülerini yükle'ye tıklayın ve parlak alanın zaman atlamalı yığın görüntüsünü seçin.
- GFP Görüntülerini Yükle'ye tıklayın ve EGFP'nin zaman atlamalı yığın görüntüsünü seçin.
- GUI'deki açılan listeden GFP'yi seçin (Şekil 8A, kırmızı kutu).
- GUI'de görüntülenen hücre görüntüsünde iki noktayı tıklatarak büyüme konisi de dahil olmak üzere ilgi çekici dikdörtgen bölgeyi (ROI) belirtmek için yatırım getirisine tıklayın (Şekil 8B).
- GUI'deki Kaydet düğmesine tıklayın (Şekil 8A, kırmızı ok). Seçilen yığın görüntüleri, yatırım getirisi ile birlikte bir .mat dosyasına (MATLAB biçimli dosya) kaydedilir.
- Spot algıla'ya tıklayın. Ekranda bir diyalog kutusu görünecektir.
- Boncuk algılama eşiğini belirlemek için diyalog kutusuna bir değer (genellikle 50-150) girin. Tamam'ı tıklatma hesaplamayı başlatır.
- Hesaplamayı bitirdikten sonra, 8.12.8 adımında seçilen bölgeyi büyütmek ve algılanan boncukları beyaz noktalar olarak görüntülemek için Parçayı Çiz'e tıklayın (Şekil 8C, 1).
NOT: Boncuk algılamanın (beyaz noktalar) floresan boncuklarla çakışıp örtüşmediğini onaylayın. Boncuk algılama arka plan gürültüsünü de algılayabilir. Bu dış paraziti azaltmak için Spot algılamada eşik değerini değiştirin. Ayrıca, 8.12.13. - Boncuk seç'e tıklayın ve büyüme konisinin altındaki doğru noktaları içeren çokgen bir bölgeyi sınırlayın. Klavyede Enter tuşuna basın. Çokgen bölgedeki beyaz noktalar kırmızı renge dönüşür (Şekil 8C, 2).
- GUI'de Tahmin kuvveti'ne tıklayın. Ardından, aşağıdaki parametreler için giriş değerleri: piksel boyutu, μm / piksel; Young'ın modülü, Adım 7.2.5'te hesaplanan değer; Poisson'ın oranı 0.3.
- Hesaplamayı başlatmak için Tahmin kuvvetini yürütün. Yazılım, hesaplama sonuçlarını otomatik olarak bir elektronik tablo biçimli dosyaya kaydeder.
NOT: Elektronik tablo her zaman diliminde x bileşenini, y bileşenini ve kuvvet büyüklüğünü gösterir (Şekil 8D). Çekiş kuvveti ölçmek için uygulama verileri için Ek Dosya 6'ya bakın.
Sonuçlar
Aksin polimerizasyon oranını ve debriyaj kavrama verimliliğini ölçmek için tek benekli görüntüleme
Yüksek bir Lifeact ifadesi, büyüme konisi içinde F-actin görselleştirmeye izin veriyor; düşük halotag-actin ifadesi F-actin retrograd akışının izlenmesini sağlar (Şekil 3, Ek Dosya 2). Aktiin beneklerinin izlenmesi F-aktüen akış hızının ölçülmesine izin verir (Şekil 3C, D). F-actin retrograd akışının mekanik bağlantısı ve yapışkan substrat F-actin akış hızını azalttığından, debriyaj kavrama verimliliği hızdan tahmin edilebilir. Ayrıca, Lifeact ile F-actin etiketlemesi F-actin uzantısının görselleştirilmesine yardımcı olur ve akrin polimerizasyon oranını ölçmek için yararlıdır (Şekil 3E, F).
Çekiş kuvvetinin nicel analizi
Burada sunulan metodolojiye sıkı sıkıya bağlı kalmak, floresan boncukların büyüme konisi altındaki hareketlerini ortaya çıkaracaktır (Şekil 6C, Ek Dosya 4). Alt tabakaya F-actin retrograd akışı, floresan boncukların büyüme konisinin altında arkaya doğru hareket etmesine neden olan çekiş kuvveti oluşturur. Çekiş kuvveti analiz kodu, floresan boncuk yerinden deplasmanından gelen çekiş kuvvetini tahmin eder ve hesaplanan çekiş kuvvetini bir kuvvet vektörü olarak ifade eder. Çekiş kuvvetinin yönü ve büyüklüğü kuvvet vektörün x ve y bileşenlerinden belirlenir (Şekil 8C,D). Şekil 8D'deki kırmızı kutu, bir kuvvet vektörün x ve y bileşenlerini temsil eder; Şekil 8C karşılık gelen büyüme konisini tasvir eder. x-y koordinatları açısından, vektör x eksenine karşı -93.8 ° işaret eder; bu yönelim büyüme konisinin arkasına yönlendirilir (Şekil 8C). Çekiş kuvveti F'nin büyüklüğü aşağıdaki gibi hesaplanmıştır:
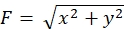
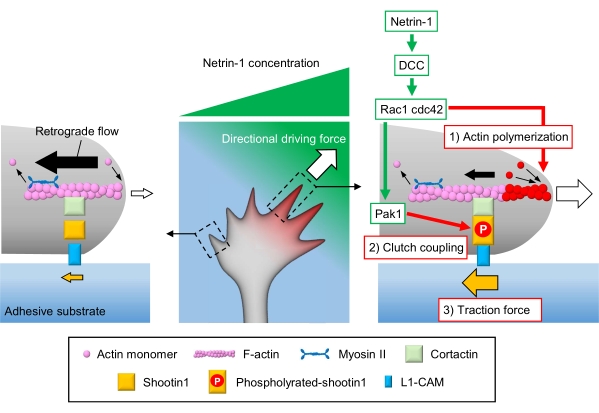
Şekil 1: Kuvvet üretimi ve büyüme konisi navigasyonu için bir büyüme koni makinesi. Netrin-1 kemoattraktant gradyanı, reseptör DCC'sinde aksonal büyüme konisi üzerinde asimetrik stimülasyona neden olur. Bu, Rac1 ve Cdc42'yi ve aşağı akış kinaz Pak1'i etkinleştirir. Rac1 ve Cdc42 (1) aksin polimerizasyonunu teşvik ederken, Pak1 fosforilasyonlar shootin1'i güçlendirerek shootin1 aracılı (2) debriyaj kavramasını geliştirir. Akrin dinamiklerinin asimetrik aktivasyonu ve büyüme konisi içindeki debriyaj bağlantısı, netrin-1 kaynağının yan tarafındaki (3) çekiş kuvvetini arttırır ve böylece büyüme konisi cazibesi için yönlü bir itici güç oluşturur. Burada sunulan protokoller, büyüme konisi navigasyonu için anahtar değişkenlerin (1)-(3) ölçülmesine izin verir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Tamamen açılmış ve daraltılmış bir diyafram altında nöronal büyüme konisinin floresan görüntüleri. Büyüme konisi Lifeact ve HaloTag-actin'i ifade eder. (A) Yüksek bir Lifeact ifadesi büyüme konisi morfolojisinin görselleştirilmesine izin eder. Öte yandan, HaloTag-actin ifade seviyeleri çok düşüktür ve diyafram tamamen açıldığında loş sinyaller verilir. (B) Diyafram uygun şekilde daraltıldığında, arka plan sinyalleri azalır ve büyüme konisinde tek akrin benekleri görülür. Ölçek çubukları: 5 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 3: Bir görüntü işleme ve analiz yazılımı kullanarak F-actin akış hızını ve aksin polimerizasyon hızını ölçme adımları Fiji. (A) Analiz için görüntünün açısını ayarlayın. (1) F-actin demetinde akan bir aktüen benek (ok ucu) bulun ve seçin. (2) Dönüştür > Döndür > Görüntü'yü seçin. (3) Açıyı F-actin demetinin yukarı yönlendirilmesi için ayarlayın. (4) Görüntünün açısı değiştirilecektir. (B) Akin benek ve F-actin demeti de dahil olmak üzere bölgeyi çizin. (1) Araç çubuğundaki Dikdörtgen'e tıklayın. (2) Görüntüdeki bir bölgeyi tanımlama. Görüntünün parlaklığı ve kontrastı, aksin lekesinin ve F-actin demetinin ucunun net bir şekilde görselleştirilmesine izin vermek için artırılmıştır. (3) Resim > Çoğalt'ı seçin. (4) F-actin demetinde aktüen benek akışını gösteren beş zaman dilimini girin. (5) Seçilen yığın görüntüsü ekranda görünecektir. (C) Aktüen benek üzerindeki daireleri kaplar. (1) Araç çubuğunda Oval'e tıklayın. (2) Aktüer benek üzerine daire çizin. (3) Resim > Yer Paylaşımı'> Seçim Ekle'yi seçin. (4) Daire kaplanmıştır. 5) Kalan aktüen beneklerindeki dairelerin üzerine bindirmeyi tekrarlayın. (D) Beş zaman dilimi boyunca aktiin beneklerinin translokasyon mesafesini ölçün. (1) Araç çubuğunda Düz'e tıklayın. (2) Dairelerin merkezlerini birbirine bağlayan bir çizgi çizin. (3) Ölçü > Analiz Et'i seçin. Actin benek translokasyon mesafesini aktaran Yükseklik (kırmızı kutu) parametresi ile gösterilen sonuç. (E) Beş zaman dilimi boyunca F-aktüen çıkıntısının uzunluğundaki değişimi ölçün. (1) F-actin çıkıntısının uçlarını birbirine bağlayan bir çizgi çizin. (2) Ölçü > Analiz Et'i seçin. Sonuç (kırmızı kutu), Yükseklik, F-actin demetinin uzatma uzunluğunu gösterir. (F) Aktisin polimerizasyon oranı, F-aktüer akış hızı ve uzatma oranının toplamından hesaplanır. Ayrıca bkz. Ek Dosya 3, araştırmacıların yukarıda açıklanan metodolojiyi uygulamalarına yardımcı oluyor. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
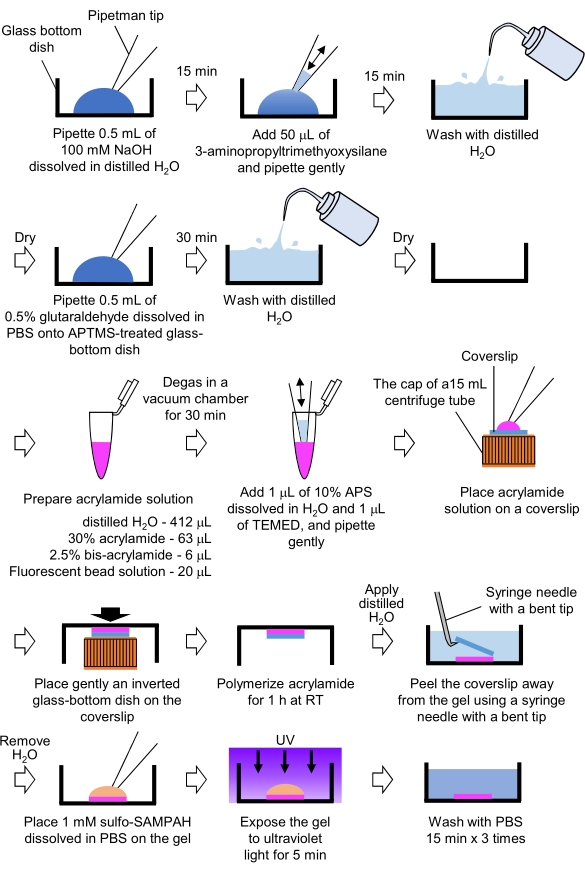
Şekil 4: PAA jel hazırlama adımları. Ayrıntılı bir açıklama için lütfen 7.1 adımına bakın. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
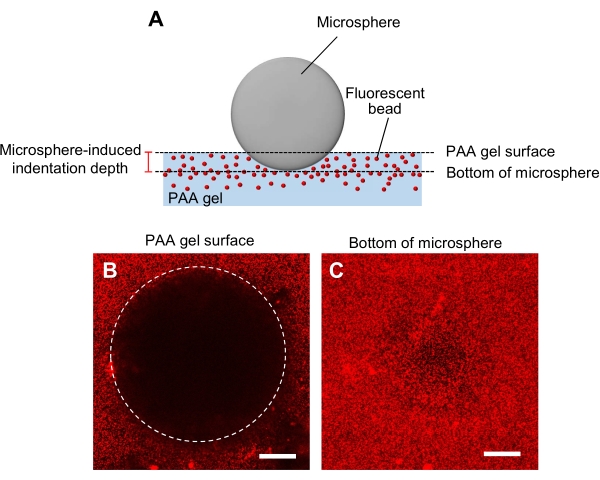
Şekil 5: PAA jel sertliğinin belirlenmesi. (A) Mikroküreden girinti yöntemi. Floresan boncuk gömülü PAA jel üzerine bir mikroküreç yerleştirildiğinde, mikro kürenin ağırlığı jelde girintiye neden olur. Girinti derinliği, PAA jel yüzeyinin z-konumlarının mikrokürenin altından çıkarılarak hesaplanır (B,C) Bir paa jelinin mikroküreç tarafından girintilenmiş ve floresan boncuklar içeren floresan görüntüleri. Jel yüzeyinin (B) ve mikrosferin (C) tabanının görüntülerini yakalamak için lazer taramalı konfokal mikroskop kullanıldı. Floresan boncuklardan gelen sinyaller girintili bölgedeki jel yüzeyinde görünmez (B, daire). Bununla birlikte, mikro kürenin dibinde gözlemlenebilirler. Ölçek çubukları: 50 μm. Bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
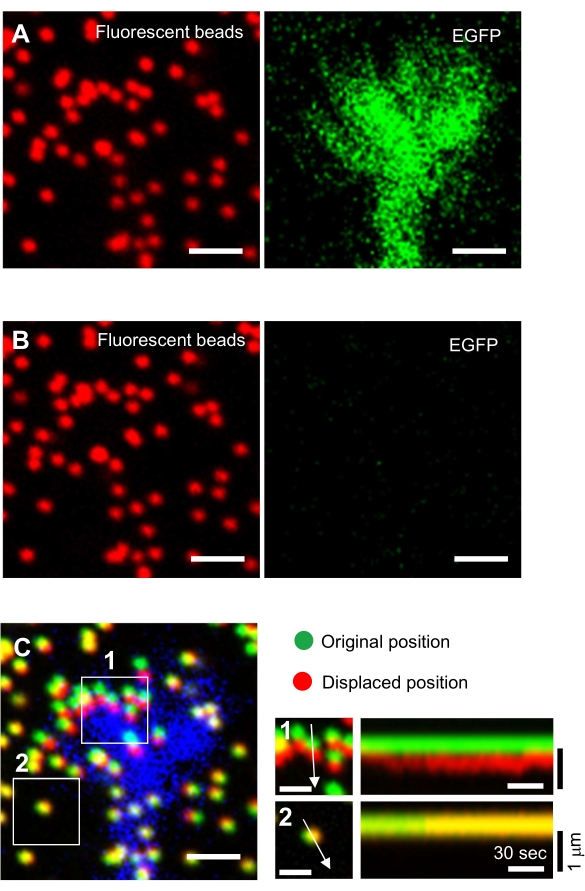
Şekil 6: Nöronal büyüme konisinin zorla haritalandırılması. (A-C) EGFP ile görselleştirilmiş bir PAA jeline ve nöral büyüme konilerine gömülü boncukların floresan görüntüleri. Zaman atlamalı görüntülerin (A) elde edilmesi sonrasında, nöron SDS çözeltisi uygulanarak jel substratından serbest bırakıldı ve kısıtlanmamış substrattaki boncukların bir görüntüsü yakalandı (B). (C) Mezupların sınırlandırılmamış alt tabakadaki görüntüsü, boncukları orijinal (yeşil) ve yer değiştirmiş (kırmızı) konumlarında gösterir. Büyüme konisinin EGFP sinyali mavi renkte gösterilir. Kimograflar (sağda), 1 ve 2' nci kutulu alanlardaki oklarla gösterilen 147 s süre boyunca boncukların hareketlerini 3 s aralıklarla gösterir. Alan 2'deki boncuk bir referans boncuk. Ölçek çubukları: (A), (B) ve (C, sol) için 2 μm ve (C, orta) için 1 μm. Ayrıca bkz. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
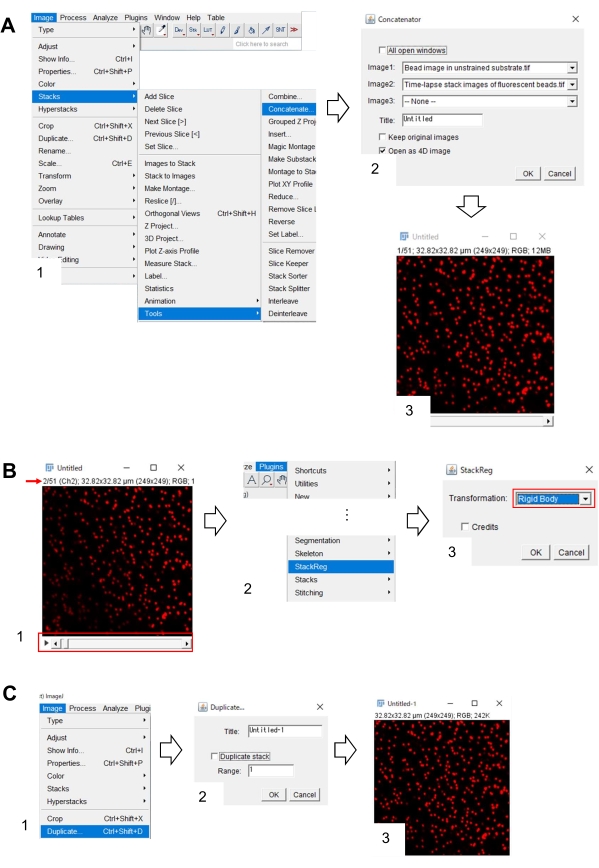
Şekil 7: Boncuk görüntüsünün Fiji kullanarak sınırlandırılmamış substrattaki x-y konumunu düzeltme adımları. (A) Boncuk görüntüsünü, floresan boncukların zaman atlamalı yığın görüntüsüyle sınırlandırılmamış substratta bir araya getirin. (1) Birleştirme > Resim > Yığınları > Araçları'nı seçin. (2) Sırasıyla, kısıtlanmamış substrattaki boncuk görüntüsünü ve Image1 ve Image2'deki floresan boncukların zaman atlamalı yığın görüntüsünü seçin. Tamam'a tıklayın. (3) Sınırlandırılmamış alt tabakadaki boncuk görüntüsü, zaman atlamalı yığın görüntüsüne eklenir. (B) Floresan boncuk görüntüsünün x-y konumunu düzeltin. (1) Görüntü yığınındaki ikinci kareyi (kırmızı ok) seçmek için kaydırma çubuğunu (kırmızı çerçeve) kullanın. (2) StackReg > Eklentileri seçin. (3) Açılan listeden (kırmızı çerçeve) Sert Gövde'yi seçin ve Tamam'a tıklayın. X-y pozisyonunun düzeltilmesine başlanacak. (C) X-y konum düzeltilmiş boncuk görüntüsünü kaydedin. x-y konum düzeltilmiş yığın görüntüsünün ilk karesini seçtikten sonra(1) Görüntü > Çoğalt'ı seçin. (2) Aralığa 1 girin ve Yinelenen yığının seçimini kaldırın. Ardından Tamam'a tıklayın. (3) sınırlandırılmamış alt tabakadaki x-y konum düzeltilmiş boncuk görüntüsü ekranda görünecektir. Bu görüntüyü tiff dosyası olarak kaydedin. Ek Dosya 6, araştırmacıların yukarıda açıklanan metodolojiyi uygulamalarına yardımcı oluyor. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
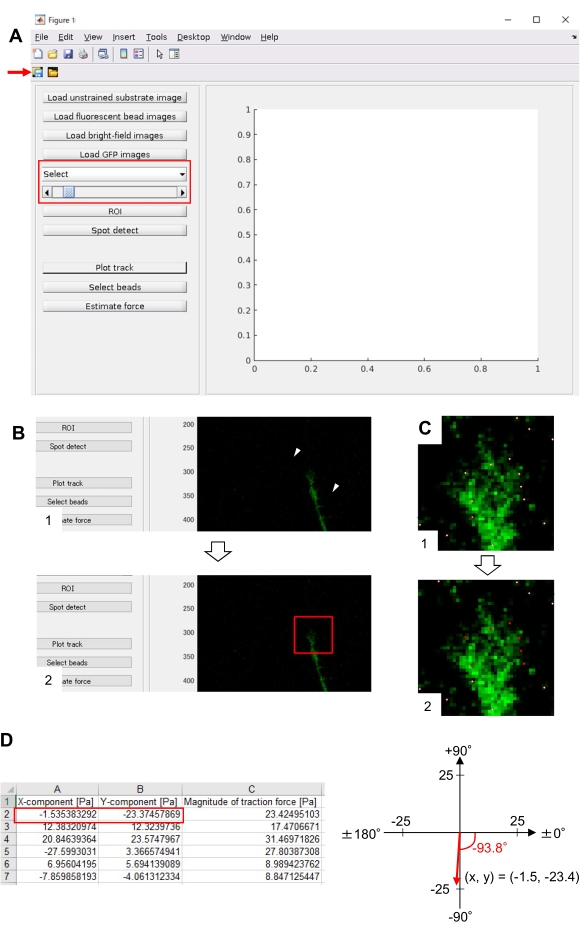
Şekil 8: Açık kaynaklı bir çekiş kuvveti analiz kodu kullanılarak nöronal büyüme konisi altında çekiş kuvvetinin analizi. (A) Çekiş kuvvetini analiz etmek için GUI. GUI'de seçilen hızlandırılmış görüntüler açılan listeden ve kaydırıcı belirtilerek (kırmızı kutu) onaylanabilir. (B) Büyüme konisini içeren bir bölge seçin. (1) GUI'deki yatırım getirisi üzerine tıklayın. Fare imleciyle, hücre görüntüsünde iki nokta (ok uçları) belirtin. (2) Hücre görüntüsünde kırmızı bir kutu görünecektir. İki köşenin konumlarını iki tıklama belirler. (C) Büyüme konisinin altında algılanan boncukları (beyaz noktalar) seçin. (1) GUI'de Boncuk seç'e tıklayın ve tıklayarak büyüme konisini içeren çokgen bir bölgeyi sınırlayın. Enter tuşuna basın. (2) Çokgen bölgedeki beyaz noktalar kırmızı bir renge dönüşecektir. (D) Çekiş kuvvetinin yönünün ve büyüklüğünün hesaplanan sonuçları. Elektronik tablodaki kırmızı kutu, çekiş kuvveti analizi ile tahmin edilen kuvvet vektörün x ve y bileşenlerini temsil eder. Sağ paneldeki x-y koordinatında, büyüme konisi tarafından oluşturulan kuvvet vektörü x eksenine karşı -93,8 ° 'yi gösterir; bu yönelim (C) büyüme konisinin arkasına yönlendirilir. Ek Dosya 6 , araştırmacıların yukarıda açıklanan metodolojiyi uygulamalarına yardımcı oluyor. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Dosya 1: Bu çalışmada kullanılan çözüm ve ortam tarifleri. Ayrıntılı kullanım için metne bakın. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Dosya 2: Sinir büyüme konisinde Lifeact floresan görüntüleme ve HaloTag-actin floresan benek görüntüleme. Lifeact (yeşil) ve HaloTag-actin (macenta). Görüntüler her 3 sn toplam 147 s süreyle elde edildi. Ölçek çubuğu: 2 μm. Ayrıca bkz. Şekil 3. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 3: F-actin akış hızını ve aktin polimerizasyon oranını ölçmek için verileri uygulayın. Lifeact (yeşil) ve HaloTag-actin (macenta) çok kanallı zaman atlamalı yığın görüntüsü. Ayrıca bkz. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Dosya 4: Nöronal büyüme konisinde çekiş kuvveti algılayan bir kuvvet haritalama videosu. Boncukların orijinal (yeşil) ve yer değiştirmiş (kırmızı) konumları. Büyüme konislerindeki EGFP sinyali mavi renkte gösterilir. Görüntüler 147 s için her 3 sn'de bir alındı. Ölçek çubuğu: 2 μm. Ayrıca bkz. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Dosya 5: Çekiş kuvveti analiz kodu. Ayrıntılı kullanım için lütfen Adım 8.12'ye bakın. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Dosya 6: Çekiş kuvveti ölçmek için pratik verileri. Sınırsız substrattaki boncukların tek kanallı RGB görüntüsü ve büyüme konisi, EGFP ve parlak alan altındaki floresan boncukların tek kanallı zaman atlamalı yığın RGB görüntüleri. Ayrıca bkz . Bu Dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
Bu çalışmada açıklanan protokollerde, tüm laboratuvarlarda, enstitülerde ve üniversitelerde rutin olarak bulunan ticari olarak mevcut malzemeler ve mikroskopi ekipmanları sunulmuştur. Bu nedenle, araştırmacılar çalışmalarında mevcut tek benek görüntüleme ve çekiş kuvveti mikroskopisini kolayca benimseyebilirler.
Benek görüntüleme, aksin polimerizasyonunu ve debriyaj kavramasını analiz edebilir. Ek olarak, benek görüntüleme, F-actin retrograd akışı ile etkileşime giren shootin1 ve kortektin gibi debriyaj moleküllerinin retrograd akışını izleyebilir. Bir TIRF mikroskobu kullanılarak, hücre yapışma molekülü L1-CAM'ın retrograd akışı da izlenebilir23,41; L1-CAM, debriyaj kavrama verimliliğini yansıtan kavrama ve kayma davranışlarından geçer23,41. Bu çalışmada benek görüntüleme için TMR-HaloTag sistemi kullanılsa da, EGFP ve monomerik kırmızı floresan protein gibi diğer floresan proteinler de analizde mevcuttur16,18,20,23,24,27,39. Aksin beneklerini görselleştirmek için gerekli olan, floresan akinin düşük ifade seviyesi ve minimum alanın aydınlatılmasıdır (Şekil 2). Bu protokolde, Lifeact ve HaloTag-actin sinyalleri ardışık olarak elde edilir. Aksin retrograd akışı nispeten yavaş olduğundan (4,5 ± 0,1 μm/dk)24, F-actin retrograd akışı ve aksin polimerizasyonunun analizi farklı floresan kanalların (~1 s aralık) sıralı görüntü alımından etkilenmez. Lifeact yaygın olarak kullanılan bir F-actin belirtecidir, ancak akin bağlayıcı proteinlerle rekabet edebilir47. Daha da önemli olan Lifeact, aktüen dinamiklerini değiştirebilir, böylece F-aktüin yapılarını ve hücre morfolojisini 47,48,49 yönden etkileyebilir.
Çekiş kuvveti mikroskopisi, büyüme konisi ilerlemesini sağlamak için kuvvetleri tespit edebilir. Araştırmacılar, nöronları hücre dışı bir matrise monte ederek, yarı 3D bir ortamda üretilen kuvvetleri de analiz edebilir11. Yüksek büyütme görüntüleme, çekiş kuvvetinin doğru ölçülmesi için önemlidir, çünkü büyüme konileri zayıf çekiş kuvvetleri oluşturur7. Her ne kadar nanopillar veya strese duyarlı biyosensörler içeren diğer yöntemler de çekiş kuvvetini ölçmek için kullanılsa da, PAA jel bazlı yöntem son derece uyarlanabilir ve akrilamid ve bis-akrilamid konsantrasyonlarını değiştirerek substrat sertliğinin ayarlanmasına izin verir41,44,52. Bu protokolde, PAA jeli% 3.75 akrilamid ve% 0.03 bis-akrilamid nihai konsantrasyonda hazırlanır; Young'ın modülü ~270 Pa22'dir ve bu sertlik beyin dokusu aralığındadır (100-10.000 Pa)53.54,55. PAA jelinin kalınlığı (~100 μm) nedeniyle, bu yöntem mikroskopi sırasında yüksek büyütme lenslerinin kullanımını sınırlar. Yüksek büyütme görüntüleri elde etmek için, araştırmacılar lazer tarama konfokal mikroskopta yakınlaştırma işlevini kullanmalıdır.
Sonuç olarak, mevcut benek görüntüleme ve çekiş kuvveti mikroskopisi, kuvvet nesillerindeki önemli olayların nicel analizlerini sağlar. Bu bilgiler, büyüme konisinin ilerlemesinin ve navigasyonun altında yatan mekanizmaların anlaşılmasını geliştirmek için paha biçilmez olacaktır.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu araştırma kısmen AMED tarafından 21gm0810011h0005 (N.I. ve Y.S.), JSPS KAKENHI (JP19H03223, N.I.) ve JSPS Erken Kariyer Bilimcileri için Yardım Hibeleri (JP19K16258, T.M.), Osaka Tedavi Edilemez Hastalıklar Tıbbi Araştırma Vakfı (T.M.) ve NAIST Yeni Nesil Disiplinlerarası Araştırma Projesi (Y.S.).
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.5% trypan blue stain solution | Nacalai | 29853-34 | |
| 3-aminopropyltrimethyoxysilane | Sigma | 281778-100ML | |
| Acrylamide monomer | Nacalai | 00809-85 | |
| Ammonium persulphate | Cytiva | 17-1311-1 | |
| Axio Observer Z1 | Zeiss | 431007-9902-000 | Epi-fluorescence microscope (single speckle imaging) |
| B-27 supplement (50x) | Thermo Fisher Scientific | 17504-044 | |
| Bovine serum albmine | Sigma | A7906-10G | |
| C-Apochromat 63x/1.2 W Corr | Zeiss | 421787-9970-799 | Objective lens (traction force microscopy) |
| Coverslip (diameter 18 mm) | Matsunami | C018001 | |
| D-glucose | Nacalai | 16806-25 | |
| DNaseI | Sigma | DN25-100MG | |
| Fetal bovine serum | Thermo Fisher Scientific | 10270-106 | |
| Fiji | Open source software package | https://imagej.net/software/fiji/ | |
| FluoSpheres carboxylate-modified 0.2 mm, red (580/605), 2% solid | Thermo Fisher Scientific | F8810 | carboxylate-modified microspheres |
| Glass bottom dish (14 mm diameter) | Matsunami | D1130H | |
| Glass bottom dish (27 mm diameter) | Matsunami | D1140H | |
| Glutaraldehyde solution | Sigma | G5882-10X10ML | |
| HaloTag TMR ligand | Promega | G8251 | |
| HBO103 W/2 | Osram | 4050300382128 | Mercury lamp (single speckle imaging) |
| Image Processing Toolbox | MathWork | https://www.mathworks.com/products/image.html | |
| Laminin solution from mouse EHS tumor | Wako | 120-05751 | |
| Leibovitz’s L-15 medium | Thermo Fisher Scientific | 11415064 | |
| L-glutamine | Nacalai | 16919-42 | |
| LSM710 | Zeiss | N/A | Conforcal laser microscope (traction force microscopy) |
| MATLAB2018a | MathWork | https://www.mathworks.com/products/new_products/release2018a.html | |
| Mouse C57BL/6 | Japan SLC | N/A | |
| Mouse neuron nucleofector kit | Lonza | VPG-1001 | |
| N,N,N’,N’-tetramethylethylenediamine (TEMED) | Nacalai | 33401-72 | |
| N,N’-methylenebisacrylamide | Nacalai | 22402-02 | |
| Neurobasal medium | Thermo Fisher Scientific | 21103-049 | |
| Nucleofector I | Amaxa | AAD-1001 | Electroporation apparatus |
| ORCA Flash 4.0 V2 | Hamamatsu | C11440-22CU | CMOS camera (single speckle imaging) |
| Papain | Nacalai | 26036-34 | |
| Parallel Computing Toolbox | MathWork | https://www.mathworks.com/products/parallel-computing.html | |
| pEGFP-C1 | Clontech | 1528177 | |
| Penicillin-streptomycin (100x) | Nacalai Tesque | 26253-84 | |
| pFN21A-HaloTag-actin | (Minegishi et al., 2018) | N/A | |
| Phosphate buffered saline (PBS) pH 7.4 (10x) | Thermo Fisher Scientific | 70011-044 | |
| Plan-Apochromat 100x/1.4 Oil | Zeiss | 420790-9901-000 | Objective lens (single speckle imaging) |
| pmNeonGreen-N1-Lifeact | (Kastian et al., 2021) | N/A | |
| Poly-D-lysine hydrobromide | Sigma | P6407-5MG | |
| Slulfo-SAMPHA | Thermo Fisher Scientific | 22589 | |
| Sodium dodecyl sulfate | Nacalai | 08933-05 | |
| Sodium hydrate (NaOH) | Nacalai | 31511-05 | |
| Steel ball | Sako tekkou | N/A | Microshpere to determin PAA gel rigidity. 0.6 mm diameter, 7.87 g/cm3. |
| ZEN2009 | Zeiss | https://www.zeiss.com/microscopy/us/products/microscope-software/zen.html#introduction | Image acquisition software (traction force microscopy) |
| ZEN2012 | Zeiss | https://www.zeiss.com/microscopy/us/products/microscope-software/zen.html#introduction | Image acquisition software (single speckle imaging) |
Referanslar
- TessierLavigne, M., Goodman, C. S. The molecular biology of axon guidance. Science. 274, 1123-1133 (1996).
- Marin, O., Valiente, M., Ge, X., Tsai, L. H. Guiding neuronal cell migrations. Cold Spring Harbor Perspectives in Biology. 2, 001834 (2010).
- Vitriol, E. A., Zheng, J. Q. Growth cone travel in space and time: the cellular ensemble of cytoskeleton, adhesion, and membrane. Neuron. 73 (6), 1068-1081 (2012).
- Cooper, J. A. Cell biology in neuroscience: mechanisms of cell migration in the nervous system. Journal of Cell Biology. 202, 725-734 (2013).
- Dupraz, S., et al. RhoA controls axon extension independent of specification in the developing brain. Current Biology. 29, 3874-3886 (2019).
- Suter, D. M., Miller, K. E. The emerging role of forces in axonal elongation. Progress in Neurobiology. 94, 91-101 (2011).
- Franze, K. Integrating chemistry and mechanics: the forces driving axon growth. Annual Review of Cell and Developmental Biology. 36, 61-83 (2020).
- Mitchison, T., Kirschner, M. Cytoskeletal dynamics and nerve growth. Neuron. 1, 761-772 (1988).
- Suter, D. M., Forscher, P. Substrate-cytoskeletal coupling as a mechanism for the regulation of growth cone motility and guidance. Journal of Neurobiology. 44, 97-113 (2000).
- Lowery, L. A., Van Vactor, D. The trip of the tip: understanding the growth cone machinery. Nature Reviews Molecular Cell Biology. 10, 332-343 (2009).
- Minegishi, T., et al. Shootin1b mediates a mechanical clutch to produce force for neuronal migration. Cell Reports. 25, 624-639 (2018).
- Minegishi, T., Inagaki, N. Forces to drive neuronal migration steps. Frontiers in Cell and Developmental Biology. 8, 863 (2020).
- Forscher, P., Smith, S. J. Actions of cytochalasins on the organization of actin filaments and microtubules in a neuronal growth cone. Journal of Cell Biology. 107, 1505-1516 (1988).
- Suter, D. M., Forscher, P. An emerging link between cytoskeletal dynamics and cell adhesion molecules in growth cone guidance. Current Opinion in Neurobiology. 8, 106-116 (1998).
- Pollard, T. D., Borisy, G. G. Cellular motility driven by assembly and disassembly of actin filaments. Cell. 112, 453-465 (2003).
- Waterman-Storer, C. M., Desai, A., Bulinski, J. C., Salmon, E. D. Fluorescent speckle microscopy, a method to visualize the dynamics of protein assemblies in living cells. Current Biology. 8, 1227-1230 (1998).
- Katoh, K., Hammar, K., Smith, P. J., Oldenbourg, R. Birefringence imaging directly reveals architectural dynamics of filamentous actin in living growth cones. Molecular Biology of the Cell. 10, 197-210 (1999).
- Watanabe, N., Mitchison, T. J. Single-molecule speckle analysis of actin filament turnover in lamellipodia. Science. 295, 1083-1086 (2002).
- Medeiros, N. A., Burnette, D. T., Forscher, P. Myosin II functions in actin-bundle turnover in neuronal growth cones. Nature Cell Biology. 8, 215-226 (2006).
- Shimada, T., et al. Shootin1 interacts with actin retrograde flow and L1-CAM to promote axon outgrowth. Journal of Cell Biology. 181, 817-829 (2008).
- He, M., Zhang, Z. H., Guan, C. B., Xia, D., Yuan, X. B. Leading tip drives soma translocation via forward F-actin flow during neuronal migration. Jounal of Neuroscience. 30, 10885-10898 (2010).
- Toriyama, M., Kozawa, S., Sakumura, Y., Inagaki, N. Conversion of a signal into forces for axon outgrowth through Pak1-mediated shootin1 phosphorylation. Current Biology. 23, 529-534 (2013).
- Abe, K., et al. Grip and slip of L1-CAM on adhesive substrates direct growth cone haptotaxis. Proceedings of the National Academy of Sciences of the United States of America. 115, 2764-2769 (2018).
- Baba, K., et al. Gradient-reading and mechano-effector machinery for netrin-1-induced axon guidance. Elife. 7, 34593 (2018).
- Nichol, R. I., Hagen, K. M., Lumbard, D. C., Dent, E. W., Gomez, T. M. Guidance of axons by local coupling of retrograde flow to point contact adhesions. Journal of Neuroscience. 36, 2267-2282 (2016).
- Shekarabi, M., et al. Deleted in colorectal cancer binding netrin-1 mediates cell substrate adhesion and recruits Cdc42, Rac1, Pak1, and N-WASP into an intracellular signaling complex that promotes growth cone expansion. Journal of Neuroscience. 25, 3132-3141 (2005).
- Kubo, Y., et al. Shootin1-cortactin interaction mediates signal-force transduction for axon outgrowth. Journal of Cell Biology. 210, 663-676 (2015).
- Huber, A. B., Kolodkin, A. L., Ginty, D. D., Cloutier, J. F. Signaling at the growth cone: ligand-receptor complexes and the control of axon growth and guidance. Annual Review of Neuroscience. 26, 509-563 (2003).
- Kolodkin, A. L., Tessier-Lavigne, M. Mechanisms and molecules of neuronal wiring: a primer. Cold Spring Harbor Perspectives in Biology. 3, 001727 (2011).
- Ayala, R., Shu, T., Tsai, L. H. Trekking across the brain: the journey of neuronal migration. Cell. 128, 29-43 (2007).
- Tatavarty, V., Kim, E. J., Rodionov, V., Yu, J. Investigating sub-spine actin dynamics in rat hippocampal neurons with super-resolution optical imaging. PLoS One. 4, 7724 (2009).
- Frost, N. A., Shroff, H., Kong, H., Betzig, E., Blanpied, T. A. Single-molecule discrimination of discrete perisynaptic and distributed sites of actin filament assembly within dendritic spines. Neuron. 67, 86-99 (2010).
- Chazeau, A., et al. Nanoscale segregation of actin nucleation and elongation factors determines dendritic spine protrusion. EMBO Journal. 33, 2745-2764 (2014).
- Garcia, M., et al. Two-tiered coupling between flowing actin and immobilized N-cadherin/catenin complexes in neuronal growth cones. Proceedings of the National Academy of Sciences of the United States of America. 112, 6997-7002 (2015).
- Swaminathan, V., et al. Actin retrograde flow actively aligns and orients ligand-engaged integrins in focal adhesions. Proceedings of the National Academy of Sciences of the United States of America. 114, 10648-10653 (2017).
- Tsai, T. Y., et al. Efficient front-rear coupling in neutrophil chemotaxis by dynamic myosin II localization. Developmental Cell. 49, 189-205 (2019).
- Zhang, X. F., et al. Regulation of axon growth by myosin II-dependent mechanocatalysis of cofilin activity. Journal of Cell Biology. 218 (7), 2329-2349 (2019).
- Reversat, A., et al. Cellular locomotion using environmental topography. Nature. 582, 582-585 (2020).
- Katsuno, H., et al. Actin migration driven by directional assembly and disassembly of membrane-anchored actin filaments. Cell Reports. 12, 648-660 (2015).
- Urasaki, A., et al. Shootins mediate collective cell migration and organogenesis of the zebrafish posterior lateral line system. Scientific Reports. 9, 12156 (2019).
- Abe, K., et al. Mechanosensitive axon outgrowth mediated by L1-laminin clutch interface. Biophysical Journal. 120, 3566-3576 (2021).
- Kastian, R. F., et al. Shootin1a-mediated actin-adhesion coupling generates force to trigger structural plasticity of dendritic spines. Cell Reports. 35, 109130 (2021).
- Riedl, J., et al. Lifeact: a versatile marker to visualize F-actin. Nature Methods. 5, 605-607 (2008).
- Chan, C. E., Odde, D. J. Traction dynamics of filopodia on compliant substrates. Science. 322, 1687-1691 (2008).
- Wang, Y. L., Pelham, R. J. Preparation of a flexible, porous polyacrylamide substrate for mechanical studies of cultured cells. Methods in Enzymology. 298, 489-496 (1998).
- Li, Y., Hu, Z., Li, C. New method for measuring poisson's ratio in polymer gels. Journal of Applied Polymer Science. 50, 1107-1111 (1993).
- Belyy, A., Merino, F., Sitsel, O., Raunser, S. Structure of the Lifeact-F-actin complex. PLoS Biology. 18, 3000925 (2020).
- Flores, L. R., Keeling, M. C., Zhang, X., Sliogeryte, K., Gavara, N. Lifeact-GFP alters F-actin organization, cellular morphology and biophysical behaviour. Scientific Reports. 9, 3241 (2019).
- Kumari, A., Kesarwani, S., Javoor, M. G., Vinothkumar, K. R., Sirajuddin, M. Structural insights into actin filament recognition by commonly used cellular actin markers. EMBO Journal. 39, 104006 (2020).
- du Roure, O., et al. Force mapping in epithelial cell migration. Proceedings of the National Academy of Sciences of the United States of America. 102, 2390-2395 (2005).
- Grashoff, C., et al. Measuring mechanical tension across vinculin reveals regulation of focal adhesion dynamics. Nature. 466, 263-266 (2010).
- Koch, D., Rosoff, W. J., Jiang, J., Geller, H. M., Urbach, J. S. Strength in the periphery: growth cone biomechanics and substrate rigidity response in peripheral and central nervous system neurons. Biophysical Journal. 102 (3), 452-460 (2012).
- Barnes, J. M., Przybyla, L., Weaver, V. M. Tissue mechanics regulate brain development, homeostasis and disease. Journal of Cell Science. 130, 71-82 (2017).
- Moore, S. W., Roca-Cusachs, P., Sheetz, M. P. Stretchy proteins on stretchy substrates: the important elements of integrin-mediated rigidity sensing. Developmental Cell. 19, 194-206 (2010).
- Tyler, W. J. The mechanobiology of brain function. Nature Reviews Neuroscience. 13, 867-878 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır