Method Article
Анализ динамики актина, сцепления сцепления и тяговой силы для продвижения конуса роста
В этой статье
Резюме
Чтобы продвинуться вперед, конусы роста должны оказывать тяговые силы против внешней среды. Генерация тяговых сил зависит от динамики актина и сцепления сцепления. В настоящем исследовании описаны методы анализа динамики актина, сцепления сцепления и тяговых сил для продвижения конуса роста.
Аннотация
Чтобы создать функциональные сети, нейроны должны мигрировать в соответствующие места назначения, а затем расширять аксоны к своим клеткам-мишеням. Эти процессы зависят от продвижения ростовых колбочек, которые расположены на кончиках нейритов. Аксональные конусы роста генерируют движущие силы, ощущая их локальное микроокружение и модулируя динамику цитоскелета и актин-адгезионную связь (сцепление). Десятилетия исследований привели к идентификации направляющих молекул, их рецепторов и нисходящих сигнальных каскадов для регулирования миграции нейронов и аксонального руководства; однако молекулярные механизмы, необходимые для генерации сил для продвижения конуса роста и навигации, только начинают выясняться. На переднем крае колбочек роста нейронов актиновые нити подвергаются ретроградному потоку, который питается полимеризацией актина и сокращением актизина. Муфта сцепления между ретроградным потоком F-актина и адгезивной подложкой создает тяговые силы для продвижения конуса роста. В настоящем исследовании описывается подробный протокол мониторинга ретроградного потока F-актина с помощью однокрапчатой визуализации. Важно отметить, что в сочетании с маркером F-актина Lifeact этот метод может количественно оценить 1) скорость полимеризации F-актина и 2) эффективность связи сцепления между ретроградным потоком F-актина и адгезивной подложкой. Оба являются критическими переменными для создания сил для продвижения конуса роста и навигации. Кроме того, настоящее исследование описывает подробный протокол микроскопии силы тяги, который может количественно оценить 3) тяговую силу, генерируемую конусами роста. Таким образом, объединив анализ односпеклевой визуализации и микроскопии силы тяги, исследователи могут контролировать молекулярную механику, лежащую в основе продвижения конуса роста и навигации.
Введение
В развивающемся мозге позвоночных нейроны подвергаются тщательно организованным миграциям и проецируют аксоны к соответствующим синаптическим партнерам для создания функциональных нейронных сетей1,2,3. Ростовые колбочки, представляющие собой сенсорные и подвижные структуры, расположенные на кончике нейритов, определяют скорость и направление миграции нейронов и роста аксонов3,4,5. Поскольку нейроны окружены плотно упакованными средами, ростовые колбочки должны оказывать силы против окружающей среды, чтобы двигаться вперед6,7. Чтобы понять механизмы, лежащие в основе миграции нейронов и аксонального руководства, необходим анализ молекулярной механики для продвижения конуса роста.
Десятилетия анализа показали, что тяговая сила для стимулирования продвижения конуса роста генерируется механизмом «сцепления»; считается, что этот механизм функционирует не только в аксональном конусе роста, но и в конусе роста ведущего процесса мигрирующих нейронов8,9,10,11,12. А именно, актиновые нити (F-актины) в ростовых шишках полимеризуются на переднем крае и деполимеризуются проксимально, выталкивая переднюю мембрану13,14,15. Результирующая сила в сочетании с сокращением актомиозина индуцирует движение F-актинов назад, называемое ретроградным потоком7,11,16,17,18,19,20,21. Молекулы сцепления и клеточной адгезии опосредуют механическую связь между ретроградным потоком F-актина и адгезивной подложкой и передают силу потока F-актина на подложку, тем самым создавая тяговое усилие для продвижения конуса роста7,8,9,11,12,22 . Одновременно связь актин-подложка снижает скорость потока F-актина и преобразует полимеризацию актина в силу, при которой выступает передняя мембрана9,10.
Аксональные конусы роста воспринимают локальные химические сигналы и преобразуют их в направленную движущую силу для навигации по конусу роста3,23,24,25. Например, аксонная направляющая молекула нетрин-1 стимулирует свой рецептор, удаленный при колоректальном раке (DCC), и активирует Rho guanosine triphosphate (GTP)-связывающие белки клеточного деления белка 42 (Cdc42) и ras-связанного субстрата ботулинического токсина C3 1 (Rac1) и их последующую киназу p21-активированную киназу 1 (Pak1)26. Cdc42 и Rac1 способствуют 1) полимеризации актина, а Pak1 фосфорилирует молекулу сцепления shootin122,26. Shootin1 взаимодействует с ретроградным потоком F-актина через актин-связывающий белок кортактин27. Shootin1 также взаимодействует с молекулой адгезии клеток L1 (L1-CAM)20,24. Фосфорилирование Shootin1 увеличивает сродство связывания кортактина и L1-CAM и усиливает shootin1-опосредованное 2) сцепление 24,27. Внутри конуса роста асимметричные активации полимеризации актина и сцепления увеличивают 3) тяговое усилие на стороне источника нетрина-1, тем самым генерируя направленную движущую силу для поворота конуса роста (рисунок 1)24. Интенсивные исследования за последние несколько десятилетий в отношении миграции нейронов и руководства аксонами улучшили понимание направляющих молекул, их рецепторов и связанных с ними нисходящих сигнальных каскадов2,10,28,29,30. Однако молекулярные механизмы для создания сил для продвижения конуса роста только начинают проясняться; это может быть связано с ограниченным использованием протоколов механобиологического анализа.
В настоящем исследовании описывается подробный протокол мониторинга ретроградного потока F-актина с помощью односпеклической визуализации16,18. Мониторинг ретроградного потока F-актина широко проводился с использованием микроскопии сверхвысокого разрешения, конфокальной микроскопии со спиннинговым диском и флуоресценции полного интерференционного отражения (TIRF)25,31,32,33,34,35,36,37,38 . Протокол в настоящем исследовании, однако, использует стандартный эпифлуоресцентный микроскоп и, таким образом, легко принимается11,16,18,20,22,23,24,27,39,40,41,42. В сочетании с маркировкой F-актина Lifeact43 однокрапчатая визуализация позволяет количественно оценить скорость полимеризации актина и эффективность связи сцепления между ретроградным потоком F-актина и адгезивной подложкой39,42. В настоящем исследовании далее описывается подробный протокол тракционной силовой микроскопии с использованием флуоресцентного полиакриламида (PAA) геля11,22,23,24,27,39,41,42,44. Этот метод обнаруживает и количественно оценивает тяговую силу под конусом роста путем мониторинга движений бусин, вызванных силой44,45. Приведен код анализа тяговой силы с открытым исходным кодом, а также подробно объяснен метод количественной оценки тяговой силы во время миграции конуса роста. С помощью однокрапчатой визуализации и микроскопии силы тяги будет облегчено понимание молекулярной механики, лежащей в основе миграции конуса роста и навигации. Эти методы также применимы для анализа молекулярной механики, лежащей в основе дендритного увеличения позвоночника, что, как известно, важно для обучения и памяти42.
протокол
Все эксперименты с использованием лабораторных животных проводились с Институциональным комитетом по уходу за животными и их использованию Института науки и техники Нара. Исследователи должны следовать установленным руководящим принципам своих институциональных и национальных комитетов по регулированию животных в отношении ухода за лабораторными животными и их использования.
1. Подготовка растворов и сред
- Подготовьте решения и питательные среды, как описано в дополнительном файле 1
2. Получение подложек с поли-D-лизином (PDL)/ламининовым покрытием
- Посуду со стеклянным дном диаметром 14 мм покрыть 100 мкг/мл PDL, растворенную в фосфатно-буферном физиологическом растворе (PBS, pH 7,4), и инкубировать на ночь в увлажненном инкубаторе при 37 °C.
ПРИМЕЧАНИЕ: Не сушите стеклянные поверхности после этого шага - Удалите раствор PDL и пипетку 1 мл PBS на стакане в течение 10 с три раза.
- Посуду покрыть 5 мкг/мл ламинина, растворенного в PBS, и инкубировать на ночь в увлажненном инкубаторе при 37 °C.
- Вынимают раствор ламинина и пипетку по 1 мл ПБС на стакан в течение 10 с три раза.
- Удалите PBS и поместите 0,5 мл нейробазальной среды на стеклянные поверхности. Храните посуду в увлажненном инкубаторе при температуре 37 °C.
ПРИМЕЧАНИЕ: Посуду, покрытую PDL/ламинином, можно хранить в течение 2-3 дней в увлажненном инкубаторе при температуре 37 °C.
3. Рассечение и диссоциация гиппокампа
- Усыпление беременной мыши при вывихе шейки матки.
ПРИМЕЧАНИЕ: В настоящем исследовании используются коммерчески доступные мыши (см. Таблицу материалов). Исследователи должны использовать мышей, которых разводят и гуманно обрабатывают в стерилизованной среде. - Рассекните эмбриональные эмбрионы мышей 16-го дня (Е16) и поместите их на лед.
- В ламинарном проточном капюшоне рассекните мозги ножницами и поместите их на стерильную 10-сантиметровую посуду, содержащую 10 мл ледяного раствора для рассечения.
- С помощью рассеченного стереомикроскопа аккуратно отклейте мозговые оболочки полушарий головного мозга, а затем рассекните гиппокамп с помощью щипцов.
- Переведите гиппокампы в 5 мл ледяного раствора для пищеварения в пробирке объемом 15 мл. Высиживать гиппокампа на водяной бане в течение 20 мин при 37 °C.
- Удалить раствор для пищеварения и добавить 3 мл раствора для расслоения.
- Аккуратно нарисуйте гиппокамп четыре раза пипеткой Пастера.
- Высиживать гиппокампа на водяной бане в течение 20 мин при 37 °C.
- Перенесите клеточную суспензию в центрифужную трубку объемом 50 мл. Добавьте 3 мл нового раствора для рассечения в недиссоциированную ткань.
- Повторяйте шаги 3.7-3.9 до тех пор, пока гиппокамп не будет полностью диссоциирован.
- Удалите плавающие агрегаты ДНК из клеточной суспензии путем закручивания и аспирации пипеткой Пастера. Центрифугируют клеточную суспензию при 180 х г в течение 20 мин при 4 °С.
ПРИМЕЧАНИЕ: ДНК, полученная из поврежденных клеток, нарушит процесс центрифугирования. Если нейроны остаются в супернатанте, центрифугируйте клеточную суспензию снова после тщательного удаления ДНК. - Уравновешивайте нейробазальную среду, содержащую 10% фетальной бычьей сыворотки (FBS), пенициллин (100 Ед/мл) и стрептомицин (100 мкг/мл) в увлажненном инкубаторе при 37 °C с 5% CO2.
4. Трансфекция и культивирование нейронов
- Удалите супернатант и добавьте 5 мл ледяного PBS в пробирку объемом 50 мл. Повторное суспендирование гранулы ячейки путем бережной пипетки.
- Переложите 10 мкл клеточной суспензии в микроцентрифужную трубку, добавьте 10 мкл 0,5% раствора трипана синего цвета, а затем подсчитайте количество клеток с помощью гемоцитометра.
- Центрифугировать клеточную суспензию в пробирке 50 мл при 180 х г в течение 20 мин при 4 °С.
- В то же время, аликвота для трансфекции, 1 мкг pFN21A-HaloTag-актина и 3 мкг pmNeonGreen-N1-Lifeact на 1 х 106 клеток, в микроцентрифужную трубку.
- После центрифугирования удалите супернатант и добавьте 100 мкл электропорационной среды (поставляемой трансфекционным комплектом) в трубку объемом 50 мл. Повторное суспендирование гранул ячейки путем пипетки.
- Смешайте клеточную суспензию с аликвотированным раствором ДНК и перенесите смесь в кювету (предусмотренную трансфекционным набором).
ПРИМЕЧАНИЕ: Поскольку пузырьки воздуха нарушают электропорацию, удалите их из клеточной суспензии. - Вставьте кювету в электропорационный аппарат (Таблица материалов) и выполните электропорацию с помощью программы О-005.
- Немедленно добавьте в кювету 1 мл предварительно подогретой и уравновешенной нейробазальной среды, содержащей 10% FBS, пенициллин (100 Ед/мл) и стрептомицин (100 мкг/мл).
- Перенесите клеточную суспензию в центрифужную трубку объемом 15 мл с помощью пластиковой пипетки (поставляемой комплектом для трансфекции).
- Переложить 10 мкл клеточной суспензии в микропробирку, добавить 10 мкл 0,5% раствора трипана синего цвета, а затем подсчитать количество клеток гемоцитометром.
- Выньте из инкубатора посуду со стеклянным дном, покрытую PDL/ламинином, и удалите нейробазальную среду.
- Пипетку 0,5 мл клеточной суспензии, содержащей 2,0 х 105 клеток на чашку и инкубировать в увлажненном инкубаторе при 37 °С с 5% CO2 в течение 3 ч.
- Замените среду 0,5 мл нейробазальной среды, содержащей 2% добавки B-27, глутамин (1 мМ), пенициллин (100 Ед/мл) и стрептомицин (100 мкг/мл). Культивируйте нейроны в увлажненном инкубаторе в течение 3 дней при 37 °C с 5% CO2.
5. Однокрапчатая визуализация на конусах роста нейронов
- На день in vitro (DIV) 3 обрабатывают нейроны тетраметил-родаминовым (TMR) лигандом в разведении 1:2000 в питательной среде. Поддерживать нейроны в течение 1 ч при 37 °C с 5% CO2.
- Промыть лиганд TMR три раза предварительно подогретым PBS.
- Удалите PBS и пипетку 0,5 мл подогретой среды L-15 Лейбовица, содержащей 2% добавки B-27, глютамин (1 мМ), пенициллин (100 Ед / мл) и стрептомицин (100 мкг / мл).
- Поддерживать нейроны в течение 1 ч при 37 °C.
- Включите эпифлуоресцентный микроскоп и установите температуру инкубатора на 37 °C.
ПРИМЕЧАНИЕ: В настоящем протоколе используется эпифлуоресцентный микроскоп, оснащенный дополнительной металлооксидной полупроводниковой камерой, масляным объективом с погружением 100x/1.40 NA, ртутной лампой и программным обеспечением для получения изображений (см. Таблицу материалов). Другие эпифлуоресцентные микроскопы с эквивалентными спецификациями также могут быть использованы для этого анализа. - Поместите обработанные лигандами нейроны TMR в стеклянную нижнюю чашку на подогретом инкубаторе.
- Задайте параметры получения изображения следующим образом: время экспозиции, 500 мс для флуоресцентных каналов Lifeact и HaloTag-actin; биннинг, 1 x 1 (0,065 мкм × 0,065 мкм на пиксель); временной интервал, 3 с; длительность, 50 кадров.
- Выберите ростовой конус, который сильно выражает Lifeact и слабо экспрессирует HaloTag-актин.
ПРИМЕЧАНИЕ: Экспрессия Lifeact должна быть достаточно сильной, чтобы визуализировать морфологию конуса роста. Экспрессия HaloTag-актина должна быть слабой, недостаточной для обнаружения (рисунок 2A). Уровни флуоресцентных белковых экспрессий могут быть скорректированы путем изменения количества ДНК для трансфекции. - Закройте поле диафрагмы, чтобы осветить минимальную площадь, включающую конус роста (рисунок 2B).
ПРИМЕЧАНИЕ: Освещенность минимальной площади уменьшает фоновый сигнал и увеличивает отношение флуоресцентного сигнала к шуму (S/N), что позволяет обнаруживать актиновые спекли (рисунок 2B). Для дальнейшего увеличения соотношения сигнал/шум рекомендуется освещение конуса роста без уменьшения света фильтрами нейтральной плотности. - Получение покадровых изображений (Дополнительный файл 2). Сохранение в виде многоканального покадрового стекового изображения (формат tiff).
6. Количественная оценка скорости потока F-актина и скорости полимеризации с использованием программного обеспечения для обработки и анализа изображений Fiji
ПРИМЕЧАНИЕ: Обратитесь к Дополнительному файлу 3 для получения практических данных для количественной оценки скорости потока F-актина и скорости полимеризации актина.
- Откройте многоканальное покадровое стековое изображение на Фиджи.
- Выберите «Анализировать > «Задать масштаб» и задайте размер изображений в пикселях.
- Найдите актиновое пятнышко, которое течет ретроградно в течение как минимум пяти временных интервалов в пучке F-актина в филоподиях или ламеллиподиях.
- Выберите Image > Transform > Rotate и отрегулируйте угол изображения так, чтобы расслоение F-актина указывало вверх (рисунок 3A).
- Нажмите на Прямоугольник на панели инструментов и нарисуйте поле, включающее в себя актиновые пятнышки и кончик пучка F-актина (рисунок 3B, 1 и 2).
ПРИМЕЧАНИЕ: Сигналы ГалоТаг-актиновых пятен слабые. Кроме того, сигналы Lifeact на дистальных кончиках конуса роста слабы и слабы (рисунок 2B), потому что дистальные кончики конуса роста тонкие по сравнению с проксимальной частью. Исследователи должны усилить сигналы для оптимизации количественной оценки скорости потока F-актина и скорости полимеризации (рисунок 3B). Хотя сигнал Lifeact на проксимальном конусе роста становится насыщенным, это не нарушит определение дистального конца F-актинов (рисунок 3E, желтая линия). - Выберите Image > Duplicate (Дублировать ) и введите пять таймфреймов (рисунок 3B, 3-5).
- Выберите Стеки изображений > > Сделать монтаж и введите параметры: Столбцы, 5; Ряды, 1; Коэффициент масштабирования, 1.
- Нажмите OK. Монтаж изображения появится на экране.
- Выберите «Изображение > «Цвет» > «Разделенные каналы». Это разделяет два флуоресцентных канала.
- Количественная оценка скорости потока F-актина.
- Выберите «Анализировать > «Задать измерения» и выберите «Область и ограничивающий прямоугольник».
- Нажмите на Овал на панели инструментов и нарисуйте круг на актиновом пятнышке (рисунок 3C, 1 и 2).
- Выберите «Наложение > изображений» > «Добавить выделенную область». Круг накладывается на монтаж изображения (рисунок 3C, 3 и 4).
ПРИМЕЧАНИЕ: Цвет наложения можно изменить в разделе Параметры редактирования > > Цвета. - Повторите наложение окружностей на оставшиеся пятнышки (рис. 3С, 5).
ПРИМЕЧАНИЕ: Чтобы точно определить центры актинового пятнышка, исследователи должны наложить круги на пятнышки. - Нажмите прямо на панели инструментов и нарисуйте линию, которая связывает центры кругов (рисунок 3D, 1 и 2).
- Выберите Анализировать > меру. Результат появится на экране (рисунок 3D, 3).
ПРИМЕЧАНИЕ: Высота, отображаемая в результате, указывает на расстояние транслокации актинового пятнышка во время наблюдения (рисунок 3D, 3). - Рассчитайте скорость потока F-актина, разделив расстояние транслокации на время наблюдения.
- Количественная оценка скорости полимеризации F-актина.
- Нарисуйте линию, которая связывает кончики пучка F-актина (рисунок 3E, 1).
- Выберите Анализировать > меру. Результат появится на экране (рисунок 3E, 2).
ПРИМЕЧАНИЕ: Высота в результате указывает на длину расширения пучка F-актина во время наблюдения (рис. 3E, 2). - Рассчитайте скорость расширения F-актина, разделив длину расширения на время наблюдения.
- Рассчитайте скорость полимеризации F-актина как сумму скорости потока F-актина и скорости расширения (рисунок 3F).
7. Приготовление геля PAA для тракционной силовой микроскопии и культур нейронов
- Получение гелей PAA, необходимых для микроскопии силы тяги (рисунок 4)
- Пипетка 0,5 мл NaOH (100 мМ), растворенная в дистиллированном H2O, на стеклянной посуде диаметром 27 мм и инкубированная в течение 15 мин при комнатной температуре (RT).
- Добавьте 50 мкл 3-аминопропилтриметиоксисилана (APTMS) в раствор NaOH на посуде и перемешайте растворы путем щадящей пипетки и инкубируйте в течение 15 мин при RT.
- Посуду со стеклянным дном вымыть дистиллированным H2O и высушить.
- Пипетка 0,5 мл 0,5% раствора глутаральдегида, растворенная в PBS, на обработанной APTMS стеклянной посуде, и инкубировать в течение 30 мин при RT.
- Посуду со стеклянным дном вымыть дистиллированным H2O и высушить.
- Готовят раствор, содержащий дистиллированный H2O (412 мкл), 30% (мас./об.) раствор акриламида (63 мкл), 2,5% (мас./об.) раствор бис-акриламида (6 мкл) и карбоксилат-модифицированный микросферный (флуоресцентный шарик) раствор (20 мкл).
ПРИМЕЧАНИЕ: Вихрь флуоресцентного бусинного раствора для диссоциации агрегированных шариков перед добавлением в раствор акриламида. - Дегазировать раствор в вакуумной камере в течение 30 мин при РТ.
- К этому раствору добавляют 1 мкл 10% (мас./об.) персульфата аммония (APS), растворенного в дистиллированном H2O, и 1 мкл N,N,N',N'-тетраметилэтилендиамина (TEMED), и смешивают путем щадящего пипетирования.
- Поместите стеклянную крышку (диаметром 18 мм) на крышку трубки центрифуги объемом 15 мл.
- Сразу же добавьте 25 мкл раствора в крышку, а затем аккуратно поместите перевернутую стеклянную посуду на крышку. Дайте акриламиду полимеризоваться в течение 1 ч при РТ.
- Нанесите дистиллированный H2O на крышку и отклейте его от геля с помощью шприцевой иглы с изогнутым наконечником.
- Удалите H2O и добавьте в гель сульфо-SANPAH (1 мМ), растворенное в PBS.
- В стерильных условиях подвергайте гели воздействию ультрафиолета в течение 5 мин. Вымойте гель три раза PBS в течение 15 минут на одну стирку.
- Определение жесткости геля методом углубления микросферы (рисунок 5А)44.
- Перенесите микросферу, которая указана для диаметра и плотности, в гель, а затем поместите ее на стадию образца лазерного сканирующего конфокального микроскопа.
- Сосредоточьтесь на поверхности геля и запишите z-положение (рисунок 5B).
- Аналогично сосредоточьтесь на дне микросферы и запишите z-положение (рисунок 5C).
- Рассчитайте глубину отступа, определяемую разницей между z-положениями поверхности геля и дном микросферы.
- Рассчитайте модуль Юнга E геля следующим образом:
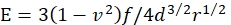
где f — скорректированный на плавучесть вес микросферы, d — глубина углубления геля, r — радиус микросферы, а v — отношение Пуассона (значение которого равно 0,3, как определено ранее46).
- Покройте гели PDL и ламинином, как описано в разделе 2.
- Как описано в разделах 3 и 4, рассечение эмбрионов мыши E16, диссоциация гиппокампа и трансфектирование с 5 мкг pEGFP-C1 на 1,0 x 106 клеток. Семена 2,0 x 105 клеток на PDL/гелях, покрытых ламинином.
ПРИМЕЧАНИЕ: Для анализа силы тяги необходима микроскопическая визуализация флуоресцентно меченых клеток для определения области конуса роста.
8. Тракционная микроскопия на колбочках роста нейронов
- На DIV3 замените культуральную среду 0,5 мл нагретой среды L-15 Лейбовица, содержащей 2% добавки B-27, глутамин (1 мМ), пенициллин (100 Ед/мл) и стрептомицин (100 мкг/мл). Поддерживайте нейроны в течение 1 ч при 37 °C.
- Включите лазерный сканирующий конфокальный микроскоп и установите на сценическом инкубаторе температуру 37 °C.
ПРИМЕЧАНИЕ: В настоящем исследовании используется лазерный сканирующий конфокальный микроскоп, оснащенный объективом с погружением в воду 63x/1.2 NA и программным обеспечением для сбора и анализа изображений (см. Таблицу материалов). - Поместите нейроны в стеклянную нижнюю чашку на предварительно разогретом инкубаторе.
- Задайте параметры получения изображения следующим образом: размер сканирования, 512 × 512 пикселей; область сканирования, 1,5-3-кратный зум; скорость сканирования, ~1 с на кадр; длина волны лазера, 561 нм (длина волны возбуждения для флуоресцентных шариков) и 488 нм (длина волны возбуждения для усиленного зеленого флуоресцентного белка (EGFP)); временной интервал, 3 с; длительность, 50 кадров.
- Чтобы визуализировать морфологию конуса роста, выберите конус роста, который сильно выражает EGFP.
- Сосредоточьтесь на поверхности геля и получите покадровые изображения (рисунок 6A и дополнительный файл 4).
ПРИМЕЧАНИЕ: Для анализа тяги используйте два флуоресцентных канала (для флуоресцентных шариков и EGFP) и канал яркого поля (рекомендуется захват дифференциального интерференционного контраста (DIC) или фазово-контрастных изображений). - Используйте программное обеспечение для обработки изображений (например, Fiji) для создания одноканальных покадровых стеков изображений RGB и сохранения этих изображений в виде файлов tiff.
ПРИМЕЧАНИЕ: Крайне важно, чтобы исследователи также сохраняли необработанные данные. - Нанесите 100 мкл 10% (мас./об.) додецилсульфата натрия (SDS), растворенного в дистиллированном H2O, на стеклянную нижнюю посуду, чтобы расслабить гель-субстрат, высвобождая нейроны из субстрата. Инкубировать блюдо в течение 5 мин при 37°C для стабилизации температуры.
ПРИМЕЧАНИЕ: Изображение бусин в ненапряженной подложке используется для ссылки на исходные положения шариков во время анализа силы тяги (рисунок 6C). Применение раствора SDS изменяет xyz-положения из-за теплового изменения в инкубаторе и расслабления клеточной деформации. Поэтому следователям необходимо скорректировать фокальную плоскость и положение x-y. - Сосредоточьтесь на поверхности геля и получите изображение бусин в ненапряженной подложке (рисунок 6B).
- Создайте одноканальное RGB-изображение бусин в неустановленной подложке и сохраните это изображение в виде файла tiff.
- Коррекция x-y положения изображения бусины в ненапряженной подложке с использованием Фиджи
- На Фиджи откройте изображение бусины в ненапряженной подложке и покадровое изображение флуоресцентных бусин.
- Выберите «Стеки изображений >» > «Инструменты» > «Объединить». На экране появится диалоговое окно (рисунок 7A, 1).
- Выберите изображение бусины в ненапряженной подложке и покадровое стековое изображение флуоресцентных бусин в Image1 и Image2 соответственно (рисунок 7A, 2).
- Нажмите OK. Изображение бусины в ненатянутой подложке добавляется к покадровому стековому изображению (рисунок 7A, 3).
- Используя полосу прокрутки (рисунок 7B, 1, красная рамка), отобразите второй кадр изображения стека (красная стрелка).
- Выберите плагины > StackReg (рисунок 7B, 2). На экране появится диалоговое окно (рисунок 7B, 3).
- Выберите Твердое тело из выпадающего списка (рисунок 7B, 3, красная рамка) и нажмите OK. Затем начинается коррекция положения x-y.
- Используйте полосу прокрутки для отображения первого кадра изображения стека с исправлением положения x-y.
- Выберите Изображение > Дубликат (рисунок 7C, 1). На экране появится диалоговое окно (рисунок 7B, 2).
- Введите 1 в диапазон, снимите флажок Duplicate Stack (рисунок 7C, 2) и нажмите OK. На экране появится изображение бусины с коррекцией положения x-y в ненапряженной подложке (рисунок 7C, 3). Сохраните это изображение в виде файла tiff.
- Количественная оценка тяговой силы
ПРИМЕЧАНИЕ: Метод, описанный здесь для анализа тяговой силы, использует MATLAB и два набора инструментов MATLAB, «Инструментарий обработки изображений» и «Инструментарий параллельных вычислений». Следователи должны будут установить их до анализа. Код анализа тягового усилия был разработан на основе MATLAB версии 2018a. Поэтому для анализа необходимо использовать MATLAB версии 2018a (или более поздней). Алгоритмы, используемые для анализа тяговой силы, были описаны ранее22.- Загрузите код анализа тягового усилия TFM2021 из дополнительного файла 5. Открыть TFM 2021 в MATLAB
- Откройте main.m в TFM2021 и запустите его. На экране появится графический интерфейс пользователя (GUI) (рисунок 8A).
- Нажмите « Загрузить ненапряженное изображение подложки» и выберите изображение бусины с коррекцией положения x-y в ненапряженной подложке.
- Нажмите «Загрузить флуоресцентные изображения бусин» и выберите покадровое изображение бусин.
- Нажмите на Загрузить изображения яркого поля и выберите покадровое стековое изображение яркого поля.
- Нажмите «Загрузить изображения GFP» и выберите покадровое стековое изображение EGFP.
- Выберите GFP из раскрывающегося списка на графическом интерфейсе (рисунок 8A, красное поле).
- Щелкните ROI , чтобы указать интересующую область прямоугольника (ROI), включая конус роста, щелкнув две точки на изображении ячейки, отображаемом на графическом интерфейсе (рисунок 8B).
- Нажмите на кнопку Сохранить на графическом интерфейсе (рисунок 8A, красная стрелка). Выбранные изображения стека вместе с ROI будут сохранены в файле .mat (файл формата MATLAB).
- Нажмите на Spot detect. На экране появится диалоговое окно.
- Введите значение (обычно 50-150) в диалоговом окне, чтобы определить пороговое значение для обнаружения шариков. При нажатии кнопки ОК начинается вычисление.
- После завершения расчета нажмите на Дорожку графика , чтобы увеличить область, выбранную на шаге 8.12.8, и отобразить обнаруженные бусины в виде белых точек (рисунок 8C, 1).
ПРИМЕЧАНИЕ: Подтвердите, что обнаружение бусин (белые точки) перекрывается с флуоресцентными шариками. Обнаружение бусин также может обнаруживать фоновый шум. Чтобы уменьшить это внешнее вмешательство, измените пороговое значение в Spot detect. Кроме того, вручную выберите правильные точки на шаге 8.12.13. - Нажмите выбрать бусины и разграничите полигональную область, которая включает правильные точки под конусом роста. Нажмите Клавишу ВВОД на клавиатуре. Белые точки в полигональной области превратятся в красный цвет (рисунок 8C, 2).
- Щелкните Оценка силы на графическом интерфейсе. Затем введите значения для следующих параметров: размер пикселя, мкм/пиксель; модуль Юнга, значение, рассчитанное на шаге 7.2.5; Коэффициент Пуассона, 0,3.
- Выполните оценку силой, чтобы начать вычисление. Программа автоматически сохранит результаты расчета в файл формата электронной таблицы.
ПРИМЕЧАНИЕ: Электронная таблица показывает x-компонент, y-компонент и величину силы на каждом таймфрейме (рисунок 8D). Обратитесь к дополнительному файлу 6 для получения практических данных для количественной оценки тяговой силы.
Результаты
Однокрапчатая визуализация для количественной оценки скорости полимеризации актина и эффективности соединения сцепления
Экспрессия с высоким содержанием Lifeact позволяет визуализировать F-актин в конусе роста; низкая экспрессия HaloTag-актина позволяет контролировать ретроградный поток F-актина (рисунок 3, дополнительный файл 2). Трассировка актиновых пятен позволяет измерить скорость потока F-актина (рисунок 3C,D). Поскольку механическая связь ретроградного потока F-актина и адгезивной подложки снижает скорость потока F-актина, эффективность сцепления сцепления может быть оценена по скорости. Кроме того, маркировка F-актина с помощью Lifeact облегчает визуализацию расширения F-актина и полезна для количественной оценки скорости полимеризации актина (рисунок 3E, F).
Количественный анализ тяговой силы
Строгое соблюдение представленной здесь методики позволит выявить движения флуоресцентных шариков под конусом роста (рисунок 6С, дополнительный файл 4). Ретроградный поток F-актина на подложку генерирует тяговую силу, заставляя флуоресцентные шарики двигаться назад под конусом роста. Код анализа тяговой силы оценивает тяговую силу от флуоресцентного смещения шарика и выражает рассчитанную тяговую силу как вектор силы. Направление и величина силы тяги определяются из x- и y-компонентов вектора силы (рис. 8C,D). Красное поле на рисунке 8D представляет x- и y-компоненты вектора силы; На рисунке 8C изображен соответствующий конус роста. В терминах координат x-y вектор указывает на -93,8° против оси x; эта ориентация направлена к задней части конуса роста (рисунок 8C). Величина тягового усилия F была рассчитана следующим образом:
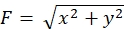
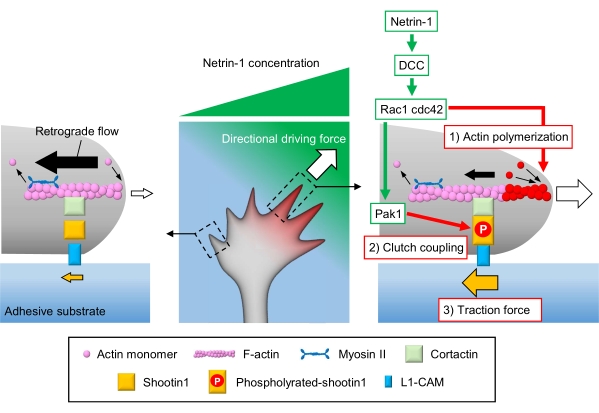
Рисунок 1: Механизм конуса роста для генерации силы и навигации по конусу роста. Градиент хемоаттрантата нетрина-1 индуцирует асимметричную стимуляцию его рецептора DCC на конусе роста аксонала. Это активирует Rac1 и Cdc42, а также их нисходящую киназу Pak1. Rac1 и Cdc42 способствуют (1) полимеризации актина, тогда как Pak1 фосфорилатирует shootin1, усиливая shootin1-опосредованную (2) муфту сцепления. Асимметричная активация динамики актина и сцепления сцепления внутри конуса роста увеличивает (3) тяговое усилие на стороне источника нетрина-1, тем самым генерируя направленную движущую силу для притяжения конуса роста. Представленные здесь протоколы позволяют количественно оценить ключевые переменные (1)-(3) для навигации по конусу роста. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Флуоресцентные изображения конуса роста нейронов под полностью открытой и суженной диафрагмой. Ростовый конус экспрессирует Lifeact и HaloTag-актин. (A) Экспрессия high Lifeact позволяет визуализировать морфологию конуса роста. С другой стороны, уровни экспрессии HaloTag-актина очень низкие, с тусклыми сигналами, когда диафрагма полностью открыта. (B) Когда диафрагма соответствующим образом сужена, фоновые сигналы уменьшаются, и в конусе роста появляются одиночные актиновые пятнышки. Шкала: 5 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Этапы количественной оценки скорости потока F-актина и скорости полимеризации актина с использованием программного обеспечения для обработки и анализа изображений Fiji. (A) Отрегулируйте угол изображения для анализа. (1) Найдите и выберите актиновое пятнышко (наконечник стрелки), которое течет в пучке F-актина. (2) Выберите Изображение > Преобразовать > Повернуть. (3) Установите угол так, чтобы пучок F-актина был направлен вверх. (4) Угол изображения будет изменен. (B) Разграничить область, включая актиновое пятнышко и F-актиновый пучок. (1) Нажмите на Прямоугольник на панели инструментов. (2) Очертите область на изображении. Яркость и контрастность изображения увеличены, чтобы обеспечить четкую визуализацию актинового пятнышка и кончика пучка F-актина. (3) Выберите Изображение > Дубликат. (4) Введите пять таймфреймов, которые показывают поток актиновых пятен в пучке F-актина. (5) Выбранное изображение стека появится на экране. (C) Наложенные круги на актиновое пятнышко. (1) Нажмите на Овал на панели инструментов. (2) Нарисуйте круг на актиновом пятнышке. (3) Выберите наложение > изображений > добавить выделение. (4) Круг накладывается. 5) Повторите наложение кругов на оставшиеся актиновые пятнышки. (D) Измерение расстояния транслокации актиновых пятен в течение пяти временных интервалов. (1) Нажмите прямо на панели инструментов. (2) Проведите линию, которая связывает центры кругов. (3) Выберите «Анализировать > меру». Результат, обозначаемый параметром Height (красный прямоугольник), ретранслирует расстояние транслокации актиновых пятен. (E) Измерить изменение длины протрузии F-актина в течение пяти временных интервалов. (1) Проведите линию, которая связывает кончики F-актинового выступа. (2) Выберите Анализировать > меру. Результат (красное поле), Высота, указывает длину расширения пучка F-актина. (F) Скорость полимеризации актина рассчитывается из суммы скорости потока F-актина и скорости расширения. См. также Дополнительный файл 2. Дополнительный файл 3 помогает исследователям практиковать методологию, описанную выше. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
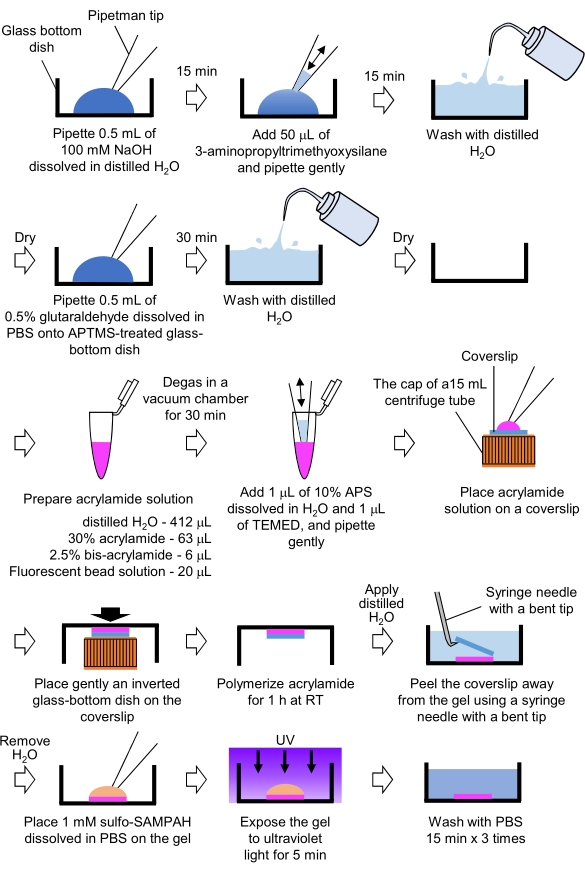
Рисунок 4: Этапы приготовления геля PAA. Подробное описание см. в шаге 7.1. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
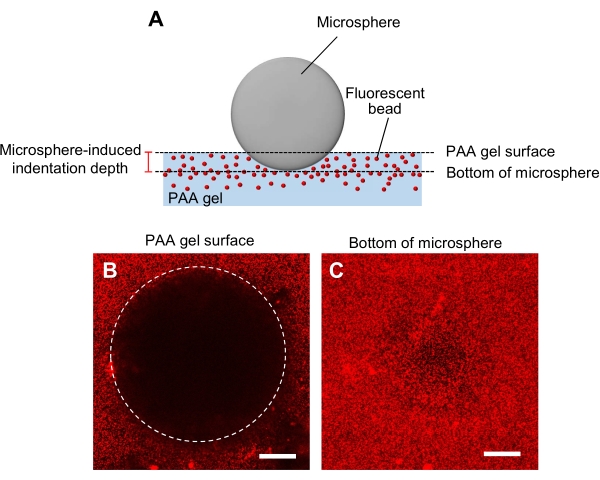
Рисунок 5: Определение жесткости геля PAA. (A) Метод углубления микросферы. Когда микросфера помещается на флуоресцентный гель PAA, встроенный в шарики, вес микросферы вызывает углубление в геле. Глубина отступа рассчитывается путем вычитания z-положений поверхности геля PAA со дна микросферы (B,C) Флуоресцентные изображения геля PAA, вдавленного микросферой и содержащего флуоресцентные шарики. Лазерный сканирующий конфокальный микроскоп использовался для захвата изображений поверхности геля (B) и дна микросферы (C). Сигналы от флуоресцентных шариков не видны на поверхности геля в области отступа (В, круг). Однако их можно наблюдать на дне микросферы. Шкала: 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
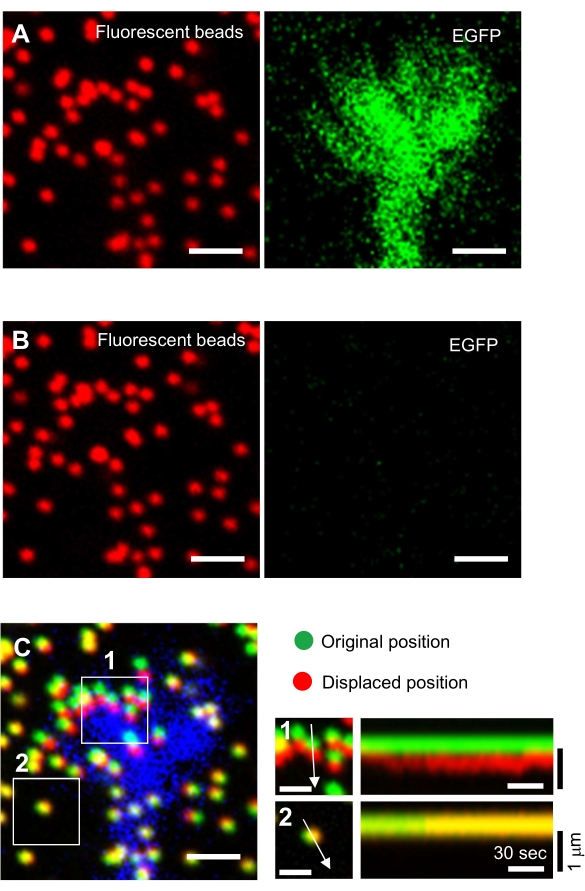
Рисунок 6: Силовое картирование конуса роста нейронов. (А-С) Флуоресцентные изображения бусин, встроенных в гель PAA и нейронный конус роста, визуализированный с помощью EGFP. После получения покадровых изображений (A) нейрон освобождали из гелевой подложки путем нанесения раствора SDS, и было получено изображение шариков в ненапряженной подложке (B). (C) На изображении бусин в ненапряженной подложке видны бусины в их первоначальном (зеленом) и смещенном (красном) положениях. Сигнал EGFP конуса роста показан синим цветом. Кимографы (справа) показывают движения бусин с интервалом 3 с в течение 147 с, обозначенные стрелками в коробочных областях 1 и 2. Бусина в области 2 является эталонной бусиной. Шкала: 2 мкм для (A), (B) и (C, слева) и 1 мкм для (C, середина). См. также Дополнительный файл 4. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
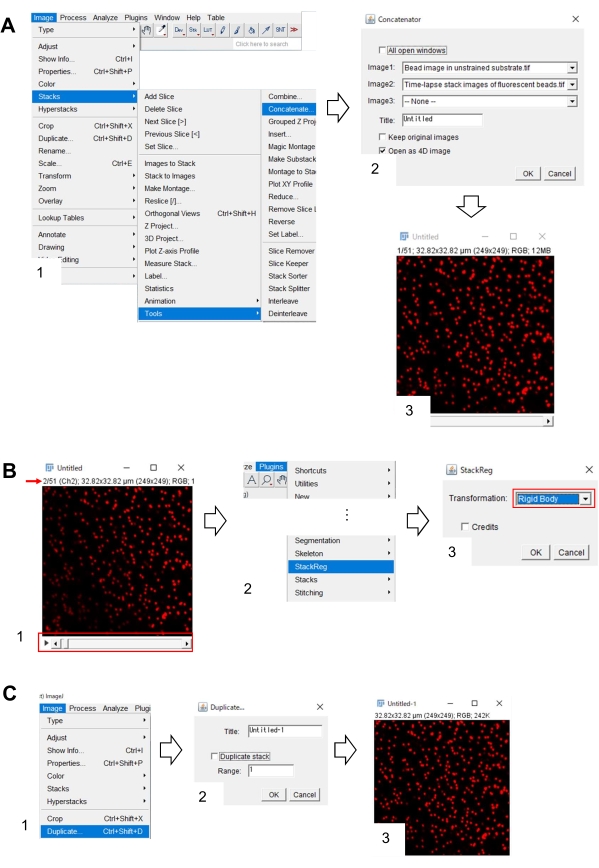
Рисунок 7: Этапы коррекции положения бусины x-y в ненапряженной подложке с использованием Фиджи. (A) Сцепите изображение бусины в ненапряженной подложке с покадровым изображением флуоресцентных бусин. (1) Выберите Стеки > изображений > Инструменты > Объединить. (2) Выберите изображение бусин в ненапряженной подложке и покадровое стековое изображение флуоресцентных бусин в Image1 и Image2 соответственно. Нажмите OK. (3) Изображение бусины в ненатянутой подложке добавляется к покадровому стековому изображению. (B) Коррекция положения x-y флуоресцентного изображения шарика. (1) Используйте полосу прокрутки (красная рамка) для выбора второго фрейма (красная стрелка) в стеке изображений. (2) Выберите Плагины > StackReg. (3) Выберите Твердое тело из выпадающего списка (красная рамка) и нажмите OK. Начнется коррекция положения x-y. (C) Сохраните изображение бусины с коррекцией положения x-y. После выбора первого кадра изображения стека с коррекцией положения x-y (1) выберите «Изображение > дублировать». (2) введите 1 в диапазон и снимите флажок Дублировать стек. Затем нажмите OK. (3) на экране появится изображение бусины с коррекцией положения x-y в ненапряженной подложке. Сохраните это изображение в виде файла tiff. Дополнительный файл 6 помогает исследователям практиковать методологию, описанную выше. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
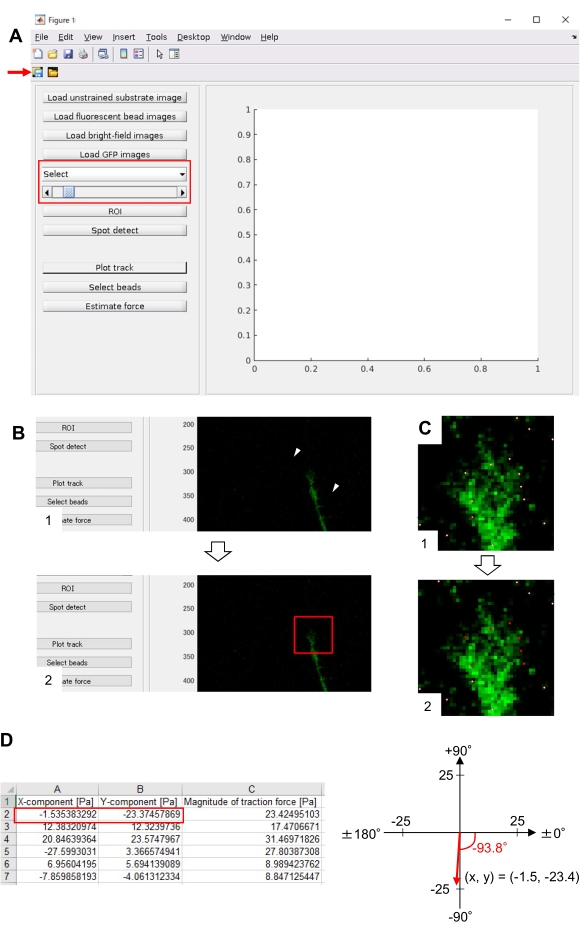
Рисунок 8: Анализ силы тяги под конусом роста нейронов с использованием кода анализа тяговой силы с открытым исходным кодом. (A) GUI для анализа силы тяги. Покадровые изображения, выбранные в графическом интерфейсе, могут быть подтверждены из выпадающего списка и с помощью указанного ползунка (красное поле). (B) Выберите регион, включающий конус роста. (1) Нажмите на ROI на графическом интерфейсе. Курсором мыши укажите две точки (наконечники стрелок) на изображении ячейки. (2) На изображении ячейки появится красное поле. Два клика определяют расположение двух углов. (C) Выберите обнаруженные бусины (белые точки) под конусом роста. (1) На графическом интерфейсе нажмите выбрать бусины и разграничите полигональную область, которая включает в себя конус роста, щелкнув мышью. Нажмите клавишу Enter . (2) Белые точки в полигональной области превратятся в красный цвет. D) Рассчитанные результаты направления и величины тяговой силы. Красное поле в электронной таблице представляет x- и y-компоненты вектора силы, оцененные с помощью анализа тяговой силы. На координате x-y в правой панели вектор силы, генерируемый конусом роста, указывает на -93,8° против оси x; эта ориентация направлена к задней части конуса роста в (C). Дополнительный файл 6 помогает исследователям практиковать методологию, описанную выше. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный файл 1: Рецепты растворов и сред, используемых в этом исследовании. Подробное использование см. в тексте. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 2: Флуоресцентная визуализация Lifeact и флуоресцентная спекл-визуализация HaloTag-актина в конусе роста нерва. Лайфакт (зеленый) и ГалоТаг-актин (пурпурный). Изображения были получены каждые 3 с в течение общей продолжительности 147 с. Шкала: 2 мкм. Смотрите также рисунок 3. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 3: Практические данные для количественной оценки скорости потока F-актина и скорости полимеризации актина. Многоканальное покадровое стековое изображение Lifeact (зеленый) и HaloTag-actin (пурпурный). См. также рисунок 3. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 4: Видео с отображением силы, определяющее тяговую силу на конусе роста нейронов. Исходное (зеленое) и смещенное (красное) положение бусин. Сигнал EGFP в конусе роста показан синим цветом. Изображения приобретались каждые 3 с в течение 147 с. Шкала: 2 мкм. См. также рисунок 6. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 5: Код анализа тягового усилия. Пожалуйста, смотрите Шаг 8.12 для подробного использования. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 6: Практические данные для количественной оценки тяговой силы. Одноканальное RGB-изображение бусин в ненапряженной подложке и одноканальное покадровое стековое RGB-изображения флуоресцентных бусин под конусом роста, EGFP и ярким полем. см. также рисунки 7 и 8. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Протоколы, описанные в этом исследовании, используют коммерчески доступные материалы и оборудование для микроскопии, обычно встречающееся во всех лабораториях, институтах и университетах. Таким образом, исследователи могут легко принять нынешнюю однопятнистую визуализацию и микроскопию силы тяги в своих исследованиях.
Спекл-визуализация может анализировать полимеризацию актина и муфту сцепления. Кроме того, спекл-визуализация может контролировать ретроградный поток молекул сцепления, таких как shootin1 и кортактин, которые взаимодействуют с ретроградным потоком F-актина. С помощью микроскопа TIRF можно также контролировать ретроградный поток молекулы клеточной адгезии L1-CAM23,41; L1-CAM подвергается сцеплению и скольжению, которое отражает эффективность сцепления сцепления23,41. Хотя в настоящем исследовании используется система TMR-HaloTag для спекл-визуализации, другие флуоресцентные белки, такие как EGFP и мономерный красный флуоресцентный белок, также доступны в анализе16,18,20,23,24,27,39. Основными условиями для визуализации актиновых пятен являются низкий уровень экспрессии флуоресцентного актина и освещенность минимальной площади (рисунок 2). В этом протоколе последовательно приобретаются сигналы Lifeact и HaloTag-actin. Поскольку ретроградный поток актина относительно медленный (4,5 ± 0,1 мкм/мин)24, анализ ретроградного потока F-актина и полимеризации актина не зависит от последовательного получения изображения различных флуоресцентных каналов (интервал ~ 1 с). Lifeact является широко используемым маркером F-актина, но может конкурировать с актин-связывающими белками47. Кроме того, Lifeact может изменять динамику актина, тем самым влияя на структуры F-актина и морфологию клеток47,48,49.
Микроскопия тяговой силы может обнаруживать силы, стимулирующие продвижение конуса роста. Устанавливая нейроны во внеклеточном матриксе, исследователи также могут анализировать силы, генерируемые в полу-3D-среде11. Визуализация с высоким увеличением важна для точной количественной оценки силы тяги, поскольку конусы роста генерируют слабые тяговые силы7. Хотя другие методы с нанопилларами или стресс-чувствительными биосенсорами также используются для измерения силы тяги50,51, метод на основе геля PAA обладает высокой степенью адаптации и позволяет регулировать жесткость подложки путем изменения концентраций акриламида и бис-акриламида41,44,52. В этом протоколе гель PAA готовят в конечной концентрации 3,75% акриламида и 0,03% бис-акриламида; Модуль Юнга составляет ~ 270 Pa22, и эта жесткость находится в диапазоне мозговой ткани (100-10 000 Па) 53,54,55. Из-за толщины геля PAA (~ 100 мкм) этот метод ограничивает использование линз с высоким увеличением во время микроскопии. Чтобы получить изображения с высоким увеличением, исследователи должны использовать функцию масштабирования в лазерном сканирующем конфокальном микроскопе.
В заключение, существующая спекл-визуализация и микроскопия силы тяги позволяют проводить количественный анализ ключевых событий в силовых поколениях. Эта информация будет иметь неоценимое значение для улучшения понимания механизмов, лежащих в основе продвижения конуса роста и навигации.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Это исследование было частично поддержано AMED под номером гранта 21gm0810011h0005 (N.I. и Y.S.), JSPS KAKENHI (JP19H03223, N.I.) и JSPS Grants-in-Aid for Early-Career Scientists (JP19K16258, T.M.), Osaka Medical Research Foundation for Inzable Diseases (T.M.) и NAIST Next Generation Interdisciplinary Research Project (Y.S.).
Материалы
| Name | Company | Catalog Number | Comments |
| 0.5% trypan blue stain solution | Nacalai | 29853-34 | |
| 3-aminopropyltrimethyoxysilane | Sigma | 281778-100ML | |
| Acrylamide monomer | Nacalai | 00809-85 | |
| Ammonium persulphate | Cytiva | 17-1311-1 | |
| Axio Observer Z1 | Zeiss | 431007-9902-000 | Epi-fluorescence microscope (single speckle imaging) |
| B-27 supplement (50x) | Thermo Fisher Scientific | 17504-044 | |
| Bovine serum albmine | Sigma | A7906-10G | |
| C-Apochromat 63x/1.2 W Corr | Zeiss | 421787-9970-799 | Objective lens (traction force microscopy) |
| Coverslip (diameter 18 mm) | Matsunami | C018001 | |
| D-glucose | Nacalai | 16806-25 | |
| DNaseI | Sigma | DN25-100MG | |
| Fetal bovine serum | Thermo Fisher Scientific | 10270-106 | |
| Fiji | Open source software package | https://imagej.net/software/fiji/ | |
| FluoSpheres carboxylate-modified 0.2 mm, red (580/605), 2% solid | Thermo Fisher Scientific | F8810 | carboxylate-modified microspheres |
| Glass bottom dish (14 mm diameter) | Matsunami | D1130H | |
| Glass bottom dish (27 mm diameter) | Matsunami | D1140H | |
| Glutaraldehyde solution | Sigma | G5882-10X10ML | |
| HaloTag TMR ligand | Promega | G8251 | |
| HBO103 W/2 | Osram | 4050300382128 | Mercury lamp (single speckle imaging) |
| Image Processing Toolbox | MathWork | https://www.mathworks.com/products/image.html | |
| Laminin solution from mouse EHS tumor | Wako | 120-05751 | |
| Leibovitz’s L-15 medium | Thermo Fisher Scientific | 11415064 | |
| L-glutamine | Nacalai | 16919-42 | |
| LSM710 | Zeiss | N/A | Conforcal laser microscope (traction force microscopy) |
| MATLAB2018a | MathWork | https://www.mathworks.com/products/new_products/release2018a.html | |
| Mouse C57BL/6 | Japan SLC | N/A | |
| Mouse neuron nucleofector kit | Lonza | VPG-1001 | |
| N,N,N’,N’-tetramethylethylenediamine (TEMED) | Nacalai | 33401-72 | |
| N,N’-methylenebisacrylamide | Nacalai | 22402-02 | |
| Neurobasal medium | Thermo Fisher Scientific | 21103-049 | |
| Nucleofector I | Amaxa | AAD-1001 | Electroporation apparatus |
| ORCA Flash 4.0 V2 | Hamamatsu | C11440-22CU | CMOS camera (single speckle imaging) |
| Papain | Nacalai | 26036-34 | |
| Parallel Computing Toolbox | MathWork | https://www.mathworks.com/products/parallel-computing.html | |
| pEGFP-C1 | Clontech | 1528177 | |
| Penicillin-streptomycin (100x) | Nacalai Tesque | 26253-84 | |
| pFN21A-HaloTag-actin | (Minegishi et al., 2018) | N/A | |
| Phosphate buffered saline (PBS) pH 7.4 (10x) | Thermo Fisher Scientific | 70011-044 | |
| Plan-Apochromat 100x/1.4 Oil | Zeiss | 420790-9901-000 | Objective lens (single speckle imaging) |
| pmNeonGreen-N1-Lifeact | (Kastian et al., 2021) | N/A | |
| Poly-D-lysine hydrobromide | Sigma | P6407-5MG | |
| Slulfo-SAMPHA | Thermo Fisher Scientific | 22589 | |
| Sodium dodecyl sulfate | Nacalai | 08933-05 | |
| Sodium hydrate (NaOH) | Nacalai | 31511-05 | |
| Steel ball | Sako tekkou | N/A | Microshpere to determin PAA gel rigidity. 0.6 mm diameter, 7.87 g/cm3. |
| ZEN2009 | Zeiss | https://www.zeiss.com/microscopy/us/products/microscope-software/zen.html#introduction | Image acquisition software (traction force microscopy) |
| ZEN2012 | Zeiss | https://www.zeiss.com/microscopy/us/products/microscope-software/zen.html#introduction | Image acquisition software (single speckle imaging) |
Ссылки
- TessierLavigne, M., Goodman, C. S. The molecular biology of axon guidance. Science. 274, 1123-1133 (1996).
- Marin, O., Valiente, M., Ge, X., Tsai, L. H. Guiding neuronal cell migrations. Cold Spring Harbor Perspectives in Biology. 2, 001834 (2010).
- Vitriol, E. A., Zheng, J. Q. Growth cone travel in space and time: the cellular ensemble of cytoskeleton, adhesion, and membrane. Neuron. 73 (6), 1068-1081 (2012).
- Cooper, J. A. Cell biology in neuroscience: mechanisms of cell migration in the nervous system. Journal of Cell Biology. 202, 725-734 (2013).
- Dupraz, S., et al. RhoA controls axon extension independent of specification in the developing brain. Current Biology. 29, 3874-3886 (2019).
- Suter, D. M., Miller, K. E. The emerging role of forces in axonal elongation. Progress in Neurobiology. 94, 91-101 (2011).
- Franze, K. Integrating chemistry and mechanics: the forces driving axon growth. Annual Review of Cell and Developmental Biology. 36, 61-83 (2020).
- Mitchison, T., Kirschner, M. Cytoskeletal dynamics and nerve growth. Neuron. 1, 761-772 (1988).
- Suter, D. M., Forscher, P. Substrate-cytoskeletal coupling as a mechanism for the regulation of growth cone motility and guidance. Journal of Neurobiology. 44, 97-113 (2000).
- Lowery, L. A., Van Vactor, D. The trip of the tip: understanding the growth cone machinery. Nature Reviews Molecular Cell Biology. 10, 332-343 (2009).
- Minegishi, T., et al. Shootin1b mediates a mechanical clutch to produce force for neuronal migration. Cell Reports. 25, 624-639 (2018).
- Minegishi, T., Inagaki, N. Forces to drive neuronal migration steps. Frontiers in Cell and Developmental Biology. 8, 863 (2020).
- Forscher, P., Smith, S. J. Actions of cytochalasins on the organization of actin filaments and microtubules in a neuronal growth cone. Journal of Cell Biology. 107, 1505-1516 (1988).
- Suter, D. M., Forscher, P. An emerging link between cytoskeletal dynamics and cell adhesion molecules in growth cone guidance. Current Opinion in Neurobiology. 8, 106-116 (1998).
- Pollard, T. D., Borisy, G. G. Cellular motility driven by assembly and disassembly of actin filaments. Cell. 112, 453-465 (2003).
- Waterman-Storer, C. M., Desai, A., Bulinski, J. C., Salmon, E. D. Fluorescent speckle microscopy, a method to visualize the dynamics of protein assemblies in living cells. Current Biology. 8, 1227-1230 (1998).
- Katoh, K., Hammar, K., Smith, P. J., Oldenbourg, R. Birefringence imaging directly reveals architectural dynamics of filamentous actin in living growth cones. Molecular Biology of the Cell. 10, 197-210 (1999).
- Watanabe, N., Mitchison, T. J. Single-molecule speckle analysis of actin filament turnover in lamellipodia. Science. 295, 1083-1086 (2002).
- Medeiros, N. A., Burnette, D. T., Forscher, P. Myosin II functions in actin-bundle turnover in neuronal growth cones. Nature Cell Biology. 8, 215-226 (2006).
- Shimada, T., et al. Shootin1 interacts with actin retrograde flow and L1-CAM to promote axon outgrowth. Journal of Cell Biology. 181, 817-829 (2008).
- He, M., Zhang, Z. H., Guan, C. B., Xia, D., Yuan, X. B. Leading tip drives soma translocation via forward F-actin flow during neuronal migration. Jounal of Neuroscience. 30, 10885-10898 (2010).
- Toriyama, M., Kozawa, S., Sakumura, Y., Inagaki, N. Conversion of a signal into forces for axon outgrowth through Pak1-mediated shootin1 phosphorylation. Current Biology. 23, 529-534 (2013).
- Abe, K., et al. Grip and slip of L1-CAM on adhesive substrates direct growth cone haptotaxis. Proceedings of the National Academy of Sciences of the United States of America. 115, 2764-2769 (2018).
- Baba, K., et al. Gradient-reading and mechano-effector machinery for netrin-1-induced axon guidance. Elife. 7, 34593 (2018).
- Nichol, R. I., Hagen, K. M., Lumbard, D. C., Dent, E. W., Gomez, T. M. Guidance of axons by local coupling of retrograde flow to point contact adhesions. Journal of Neuroscience. 36, 2267-2282 (2016).
- Shekarabi, M., et al. Deleted in colorectal cancer binding netrin-1 mediates cell substrate adhesion and recruits Cdc42, Rac1, Pak1, and N-WASP into an intracellular signaling complex that promotes growth cone expansion. Journal of Neuroscience. 25, 3132-3141 (2005).
- Kubo, Y., et al. Shootin1-cortactin interaction mediates signal-force transduction for axon outgrowth. Journal of Cell Biology. 210, 663-676 (2015).
- Huber, A. B., Kolodkin, A. L., Ginty, D. D., Cloutier, J. F. Signaling at the growth cone: ligand-receptor complexes and the control of axon growth and guidance. Annual Review of Neuroscience. 26, 509-563 (2003).
- Kolodkin, A. L., Tessier-Lavigne, M. Mechanisms and molecules of neuronal wiring: a primer. Cold Spring Harbor Perspectives in Biology. 3, 001727 (2011).
- Ayala, R., Shu, T., Tsai, L. H. Trekking across the brain: the journey of neuronal migration. Cell. 128, 29-43 (2007).
- Tatavarty, V., Kim, E. J., Rodionov, V., Yu, J. Investigating sub-spine actin dynamics in rat hippocampal neurons with super-resolution optical imaging. PLoS One. 4, 7724 (2009).
- Frost, N. A., Shroff, H., Kong, H., Betzig, E., Blanpied, T. A. Single-molecule discrimination of discrete perisynaptic and distributed sites of actin filament assembly within dendritic spines. Neuron. 67, 86-99 (2010).
- Chazeau, A., et al. Nanoscale segregation of actin nucleation and elongation factors determines dendritic spine protrusion. EMBO Journal. 33, 2745-2764 (2014).
- Garcia, M., et al. Two-tiered coupling between flowing actin and immobilized N-cadherin/catenin complexes in neuronal growth cones. Proceedings of the National Academy of Sciences of the United States of America. 112, 6997-7002 (2015).
- Swaminathan, V., et al. Actin retrograde flow actively aligns and orients ligand-engaged integrins in focal adhesions. Proceedings of the National Academy of Sciences of the United States of America. 114, 10648-10653 (2017).
- Tsai, T. Y., et al. Efficient front-rear coupling in neutrophil chemotaxis by dynamic myosin II localization. Developmental Cell. 49, 189-205 (2019).
- Zhang, X. F., et al. Regulation of axon growth by myosin II-dependent mechanocatalysis of cofilin activity. Journal of Cell Biology. 218 (7), 2329-2349 (2019).
- Reversat, A., et al. Cellular locomotion using environmental topography. Nature. 582, 582-585 (2020).
- Katsuno, H., et al. Actin migration driven by directional assembly and disassembly of membrane-anchored actin filaments. Cell Reports. 12, 648-660 (2015).
- Urasaki, A., et al. Shootins mediate collective cell migration and organogenesis of the zebrafish posterior lateral line system. Scientific Reports. 9, 12156 (2019).
- Abe, K., et al. Mechanosensitive axon outgrowth mediated by L1-laminin clutch interface. Biophysical Journal. 120, 3566-3576 (2021).
- Kastian, R. F., et al. Shootin1a-mediated actin-adhesion coupling generates force to trigger structural plasticity of dendritic spines. Cell Reports. 35, 109130 (2021).
- Riedl, J., et al. Lifeact: a versatile marker to visualize F-actin. Nature Methods. 5, 605-607 (2008).
- Chan, C. E., Odde, D. J. Traction dynamics of filopodia on compliant substrates. Science. 322, 1687-1691 (2008).
- Wang, Y. L., Pelham, R. J. Preparation of a flexible, porous polyacrylamide substrate for mechanical studies of cultured cells. Methods in Enzymology. 298, 489-496 (1998).
- Li, Y., Hu, Z., Li, C. New method for measuring poisson's ratio in polymer gels. Journal of Applied Polymer Science. 50, 1107-1111 (1993).
- Belyy, A., Merino, F., Sitsel, O., Raunser, S. Structure of the Lifeact-F-actin complex. PLoS Biology. 18, 3000925 (2020).
- Flores, L. R., Keeling, M. C., Zhang, X., Sliogeryte, K., Gavara, N. Lifeact-GFP alters F-actin organization, cellular morphology and biophysical behaviour. Scientific Reports. 9, 3241 (2019).
- Kumari, A., Kesarwani, S., Javoor, M. G., Vinothkumar, K. R., Sirajuddin, M. Structural insights into actin filament recognition by commonly used cellular actin markers. EMBO Journal. 39, 104006 (2020).
- du Roure, O., et al. Force mapping in epithelial cell migration. Proceedings of the National Academy of Sciences of the United States of America. 102, 2390-2395 (2005).
- Grashoff, C., et al. Measuring mechanical tension across vinculin reveals regulation of focal adhesion dynamics. Nature. 466, 263-266 (2010).
- Koch, D., Rosoff, W. J., Jiang, J., Geller, H. M., Urbach, J. S. Strength in the periphery: growth cone biomechanics and substrate rigidity response in peripheral and central nervous system neurons. Biophysical Journal. 102 (3), 452-460 (2012).
- Barnes, J. M., Przybyla, L., Weaver, V. M. Tissue mechanics regulate brain development, homeostasis and disease. Journal of Cell Science. 130, 71-82 (2017).
- Moore, S. W., Roca-Cusachs, P., Sheetz, M. P. Stretchy proteins on stretchy substrates: the important elements of integrin-mediated rigidity sensing. Developmental Cell. 19, 194-206 (2010).
- Tyler, W. J. The mechanobiology of brain function. Nature Reviews Neuroscience. 13, 867-878 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены