Method Article
액틴 다이내믹스, 클러치 커플링, 성장 콘 발전을 위한 견인력 분석
요약
진급하려면 성장 콘이 외부 환경에 대한 견인력을 발휘해야 합니다. 견인력의 생성은 액틴 역학 및 클러치 커플링에 의존합니다. 본 연구는 성장 콘 발전을 위한 액틴 역학, 클러치 커플링 및 견인력을 분석하는 방법을 설명합니다.
초록
기능 성 네트워크를 설정하려면 뉴런이 적절한 대상으로 마이그레이션한 다음 축축을 대상 셀쪽으로 확장해야 합니다. 이러한 프로세스는 중성염의 끝에 위치한 성장 콘의 발전에 따라 달라집니다. 축 사 성장 콘 그들의 로컬 미세 환경을 감지 하 고 사이토스켈레탈 역학 및 액틴 접착 커플링 (클러치 커플링)을 변조 하 여 원동력을 생성 합니다. 연구의 수십 년 지침 분자의 식별으로 이어졌다, 그들의 수용 체, 그리고 하류 신호 폭포 신경 이동 및 축 하 지침을 조절하기 위한 폭포; 그러나, 성장 원뿔 사전및 탐색을 구동하는 힘을 생성하는 데 필요한 분자 기계는 단지 해명되기 시작했다. 뉴런 성장 콘의 선두 가장자리에서 액틴 필라멘트는 역행 흐름을 거치며, 이는 액틴 중합화 및 actomyosin 수축에 의해 구동됩니다. F-액틴 역행 흐름과 접착제 기판 사이의 클러치 결합은 성장 원뿔 발전을 위한 견인력을 생성합니다. 본 연구는 단일 반점 이미징에 의한 F-액틴 역행 흐름을 모니터링하기 위한 상세한 프로토콜을 설명합니다. 중요한 것은, F-actin 마커 Lifeact와 결합될 때, 이 기술은 F-actin 중합률 및 2) F-액틴 역행 흐름과 접착제 기판 사이의 클러치 커플링 효율을 정량화할 수 있다. 둘 다 성장 원뿔 사전 및 탐색을 위한 힘을 생성하는 데 중요한 변수입니다. 또한, 본 연구는 성장 콘에 의해 생성된 3) 견인력을 정량화할 수 있는 견인력 현미경 검사법의 상세한 프로토콜을 기술한다. 따라서, 단일 반점 이미징 및 견인력 현미경 검사법의 분석을 결합함으로써, 조사자들은 성장 콘 의 전진 및 탐색의 근간분자 역학을 모니터링할 수 있다.
서문
개발 척추 동물 뇌에서, 뉴런은 정교하게 조직 된 마이그레이션을 겪고 기능적 신경 네트워크를 확립하기 위해 적절한 시냅스 파트너를 향해 축축을 투영1,2,3. 중성염 의 끝에 위치한 감각 및 운동 구조인 성장 콘은 뉴런 마이그레이션과 축삭의 속도와 방향을 결정3,4,5. 뉴런은 단단히 포장 된 환경에 둘러싸여 있기 때문에 성장 콘은 앞으로 이동하기 위해 자신의 환경에 대한 힘을 발휘해야합니다6,7. 뉴런 마이그레이션 및 축 하 지침의 기본 메커니즘을 이해 하려면, 성장 콘 사전에 대 한 분자 역학의 분석 필수적이다.
수십 년간의 분석에 따르면 성장 콘 발전을 촉진하는 견인력이 '클러치' 메커니즘에 의해 생성되는 것으로 나타났습니다. 이 메커니즘은 축 성장 콘뿐만 아니라 뉴런마이그레이션의 선도적 인 과정 성장 원뿔에서뿐만 아니라 기능하는 것으로 생각된다8,9,10,11,12. 즉, 성장 콘의 액틴 필라멘트(F-actins)는 최첨단에서 중합하고 근교로 비합합하여 최첨단 멤브레인13,14,15를 밀어냅니다. 그 결과, actomyosin 수축과 함께, 역행 흐름7,11,16,17,18,19,20,21이라고 불리는 F-액틴의 후방 이동을 유도한다. 클러치 및 세포 접착 분자는 F-actin 역행 흐름과 접착 기판 사이의 기계적 결합을 중재하고 F-액틴 흐름의 힘을 기판에 전달하여 성장 콘 어드밴스7,8,9,11,12,22를 위한 견인력을 생성합니다. . 동시에, 액틴 기판 커플링은 F-액틴 유량 속도를 감소시키고 액틴 중합화를 힘으로 변환하여 최첨단 멤브레인9,10을 돌출한다.
축 축 성장 콘 은 로컬 화학 단서를 감지 하 고 성장 콘 탐색에 대 한 방향 원동력으로 변환 3,23,24,25. 예를 들어, 축삭 유도 분자 넷린-1은 대장암(DCC)에서 삭제된 수용체를 자극하고, 로 구아노신 삼위산염(GTP)-결합 단백질 세포 분열 대조단백질 42(Cdc42) 및 Ras 관련 C3 보툴리눔 독소 기판 1(Rac1) 및 이들의 하류 박시(21)를 활성화한다. Cdc42 및 Rac1은 1) 액틴 중합화를 촉진하고, Pak1은 클러치 분자 촬영122,26을 인광한다. Shootin1은 액틴 결합 단백질 cortactin27을 통해 F-액틴 역행 흐름과 상호 작용합니다. Shootin1은 또한 L1 세포 접착 분자 (L1-CAM)20,24와 상호 작용합니다. Shootin1 인산화는 코락틴과 L1-CAM의 결합 친화성을 증가시키고, shootin1-매개 2) 클러치 커플링24,27을 향상시킵니다. 성장 콘 내에서, 액틴 중합 및 클러치 커플링의 비대칭 활성화는 넷린-1 소스의 측면에 대한 견인력 증가 3) 성장 콘 선삭에 대한 방향 구동력을 생성한다(도 1)24. 신경 이동 및 축 하 지침에 관하여 지난 수십 년 동안 집중적인 연구는 지도 분자의 이해를 향상 시켰다, 그들의 수용 체, 그리고 관련 다운 스트림 신호 폭포2,10,28,29,30. 그러나, 성장 콘 어드밴스에 대한 힘을 생성하는 분자 기계는 단지 해명되기 시작했다; 이는 메카노생물학적 분석을 위한 프로토콜의 제한된 사용에 기인할 수 있다.
본 연구는 단일 반점 화상 진찰16,18에 의하여 F-actin 역행 흐름을 감시하기 위한 상세한 프로토콜을 기술합니다. F-actin 역행 흐름의 모니터링은 초해상도 현미경 검사법, 방적 디스크 공초점 현미경 및 총 간섭 반사 형광(TIRF) 현미경 검사25,31,32,32,34,35,36,37,37,38을 사용하여 광범위하게 수행되었습니다. . 그러나 본 연구에서 프로토콜은 표준 형광 현미경을 사용하므로 쉽게 채택할 수 11,16,18,20,22,22,23,27,27,39,40,41,42. Lifeact43에 의한 F-액틴 라벨링과 결합하면, 단일 반점 이미징은 액틴 중합률과 F-액틴 역행 흐름과 접착제 기판 사이의 클러치 커플링 효율의 정량화를 허용한다39,42. 본 연구는 형광 비드 에 내장 된 폴리 아크릴아미드 (PAA) gel11,22,23,27,27,39,41,42,44를 사용하여 견인력 현미경 검사법의 상세한 프로토콜을 더 설명합니다. 이 방법은 힘 유도 비드 움직임을 모니터링하여 성장 콘 하에서 견인력을 감지하고 정량화합니다44,45. 오픈 소스 견인력 분석 코드가 제공되며 성장 콘 마이그레이션 중에 견인력을 정량화하는 방법을 자세히 설명합니다. 단일 반점 이미징 및 견인력 현미경 검사법의 도움으로 성장 원뿔 이동 및 탐색의 근간이되는 분자 역학을 이해하는 것이 촉진될 것입니다. 이러한 기술은 또한 학습 및 메모리42에서 중요한 것으로 알려져 있는 수지상 척추 확대의 근본적인 분자 역학을 분석하기 위해 적용됩니다.
프로토콜
실험실 동물을 이용한 모든 실험은 나라 과학기술연구소의 기관 동물관리 및 사용위원회와 함께 수행되었습니다. 조사관은 실험실 동물의 치료 및 사용에 대한 기관 및 국가 동물 규제 위원회의 확립 된 지침을 따라야합니다.
1. 솔루션 및 미디어 준비
- 보충 파일 1에 요약된 솔루션 및 문화 미디어 준비
2. 폴리 D-리신 (PDL)/라미닌 코팅 기판의 준비
- 100 μg/mL PDL로 14mm 직경의 유리 바닥 접시를 코팅하고 인산염 완충식식(PBS, pH 7.4)에 용해되고 37°C의 가습된 인큐베이터에서 하룻밤 동안 배양합니다.
참고: 이 단계 후 유리 표면을 건조시키지 마십시오. - 10s 3회 유리에 있는 PBS의 PDL 용액 및 파이펫 1 mL을 제거합니다.
- PBS에 용해된 5 μg/mL 라미닌으로 접시를 코팅하고 37°C의 가습 인큐베이터에서 하룻밤 동안 배양합니다.
- 유리에 있는 PBS의 라미닌 용액 과 파이펫 1 mL을 10 s 3회 제거합니다.
- PBS를 제거하고 유리 표면에 신경 물질 배지의 0.5 mL을 배치합니다. 37°C에서 가습된 인큐베이터에 요리를 보관하십시오.
참고: PDL/라미닌 코팅 요리는 37°C의 가습인 인큐베이터에서 2-3일 동안 보관할 수 있습니다.
3. 해마의 해부 및 해리
- 자궁 경부 탈구에 의해 임신 한 마우스를 안락사.
참고: 본 연구는 시판되는 마우스를 사용합니다( 재료표 참조). 연구원은 살균된 환경에서 사육되고 인간적으로 취급되는 마우스를 이용해야 합니다. - 배아 일-16 (E16) 마우스 배아를 해부하고 얼음 위에 놓습니다.
- 라미나르 플로우 후드에 가위로 뇌를 해부하고 10mL의 얼음 차가운 해부 용액이 들어 있는 멸균 10cm 접시에 놓습니다.
- 해부 스테레오 현미경으로 대뇌 반구의 수막을 조심스럽게 벗겨낸 다음 집게를 사용하여 해마를 해부하십시오.
- 해마를 15mL 튜브에 얼음-차가운 소화 용액 5mL로 옮춥니까. 37°C에서 20분 동안 수조에서 해마를 배양합니다.
- 소화 용액을 제거하고 3mL의 해부 용액을 추가합니다.
- 파스퇴르 파이펫으로 해마를 네 번 부드럽게 피펫.
- 37°C에서 20분 동안 수조에서 해마를 배양합니다.
- 세포 현탁액을 50mL 원심분리기 튜브로 옮기다. 불굴의 조직에 3mL의 새로운 해부 용액을 추가합니다.
- 해마가 완전히 해리될 때까지 3.7-3.9 단계를 반복하십시오.
- 파스퇴르 파이펫으로 소용돌이치며 흡입하여 세포 현탁액에서 DNA의 부동 응지를 제거합니다. 4°C에서 20분 동안 180 x g 의 세포 현탁액을 원심분리합니다.
참고: 손상된 세포에서 파생된 DNA는 원심 분리 과정을 방해합니다. 뉴런이 상체에 남아 있으면 DNA를 조심스럽게 제거 한 후 세포 현탁액을 원심 분리하십시오. - 10% 태아 소 혈청(FBS), 페니실린(100 U/mL), 및 37°C의 가습인 인큐베이터에서 연쇄상 구균(100 μg/mL)을 포함하는 신경물질 배지를 5%CO2로 상화한다.
4. 트랜스페션 및 배양 뉴런
- 상체를 제거하고 50mL 튜브에 얼음 차가운 PBS 5mL을 추가합니다. 부드러운 파이펫팅으로 셀 펠릿을 다시 중단합니다.
- 세포 현탁액의 10 μL을 마이크로센심분리기 튜브로 옮기고, 0.5% 트라이판 블루 용액의 10 μL을 추가한 다음 혈종계를 가진 세포의 수를 계산합니다.
- 원심분리기는 50mL 튜브에서 세포 현탁액을 4°C에서 20분 동안 180 x g 로 한다.
- 한편, 트랜스펙트용 알리쿼트, pFN21A-HaloTag-actin 의 1 μg, 1 x 106 세포당 pmNeonGreen-N1-Lifeact 의 3 μg, 마이크로센트리분리기 튜브로.
- 원심분리에 따라, 상체를 제거하고 50mL 튜브에 전기 기공 배지(경화 키트제공)의 100 μL을 추가한다. 파이펫팅으로 셀 펠릿을 다시 중단합니다.
- 셀 현탁액을 알리인용 DNA 용액과 혼합하고 혼합물을 큐벳으로 옮김(경질 키트에 의해 제공)한다.
참고: 기포가 전기포공을 방해하기 때문에 셀 서스펜션에서 제거하십시오. - 큐벳을 전기기 장치(재료 표)에 삽입하고 프로그램 O-005를 사용하여 전기 포공을 수행합니다.
- 즉시 10% FBS, 페니실린(100 U/mL), 연쇄상 구균(100 μg/mL)을 함유한 미리 따뜻하고 평형화된 신경물질 배지1mL을 큐벳에 즉시 추가합니다.
- 플라스틱 파이펫을 사용하여 셀 서스펜션을 15mL 원심분리기 튜브로 이송합니다(경질 키트에서 제공).
- 세포 현탁액의 10 μL을 마이크로튜브로 옮기고, 0.5% 트라이팬 블루 용액의 10 μL을 추가한 다음 혈종계를 가진 세포의 수를 계산합니다.
- 인큐베이터에서 PDL/라미닌 코팅 유리 바닥 접시를 꺼내 신경 물질 매체를 제거하십시오.
- 파이펫 0.5 mL의 세포 현탁액은 접시 당 2.0 x 105 세포를 함유하고 37 °C에서 가습 된 인큐베이터에서 3 시간 동안 5 % CO2 로 배양한다.
- 배지를 2% B-27 보충제, 글루타민(1mMM), 페니실린(100 U/mL), 연쇄절제술(100 μg/mL)을 함유한 신경분단 배지0.5mL로 교체한다. 37°C에서 3일간 가습된 인큐베이터에서 5%의 CO2를 사용하여 뉴런을 배양한다.
5. 뉴런 성장 콘에서 단일 반점 이미징
- 시험 관 내 (DIV) 3일, 배양 배지에서 1:2000 희석시 테트라메틸 로다민(TMR) 리간드로 뉴런을 치료한다. 5% CO2로 37°C에서 1시간 동안 뉴런을 유지한다.
- TMR 리간드를 미리 데워진 PBS로 세 번 씻으시다.
- 2% B-27 보충제, 글루타민(1mM), 페니실린(100 U/mL), 연쇄상 절제술(100 μg/mL)을 함유한 따뜻한 라이보비츠L-15 배지의 PBS 및 파이펫 0.5mL를 제거하십시오.
- 37°C에서 1h의 뉴런을 유지합니다.
- 상피 성피 현미경을 켜고 스테이지 탑 인큐베이터를 37 °C로 설정합니다.
참고: 본 프로토콜은 보완금속-옥사이드 반도체 카메라, 100x/1.40 NA 오일 침지 목적 렌즈, 수은 램프 및 이미지 수집 소프트웨어가 장착된 에피플루오렌스 현미경을 사용합니다( 재료표 참조). 동등한 사양을 가진 그밖 epifluorescence 현미경은 또한 이 분석을 위해 이용될 수 있습니다. - TMR 리간드 처리 된 뉴런을 유리 바닥 접시에 따뜻하게 된 스테이지 탑 인큐베이터에 놓습니다.
- 다음과 같이 이미지 수집 매개 변수를 설정 : 노출 시간, Lifeact 및 HaloTag 액틴 형광 채널에 대한 500 ms; 비닝, 1 x 1 (픽셀 당 0.065 μm ×); 시간 간격, 3 s; 지속 시간, 50 프레임.
- Lifeact을 강하게 표현하고 HaloTag-actin을 약하게 표현하는 성장 콘을 선택합니다.
참고: Lifeact 표현은 성장 원뿔 형태를 시각화할 수 있을 만큼 강력해야 합니다. HaloTag-actin 발현은 감지하기에 충분하지 않아야 합니다(그림 2A). 형광 단백질 발현의 수준은 형질 전환에 대한 DNA의 양을 변화시킴으로써 조절될 수 있다. - 다이어프램 필드를 닫아 성장 콘을 포함하는 최소 영역을 비춥니다(그림 2B).
참고: 최소 영역의 조명은 배경 신호를 줄이고 형광 신호를 노이즈(S/N) 비율로 증가시켜 액틴 반점(도 2B)을 감지할 수 있게 합니다. S/N 비율을 더욱 높이기 위해 중성 밀도 필터에 의한 빛을 줄이지 않고 성장 콘을 비추는 것이 좋습니다. - 시간 경과 이미지 획득(추가 파일 2). 멀티채널 타임랩스 스택 이미지(티프 형식)로 저장합니다.
6. 이미지 처리 및 분석 소프트웨어 피지를 사용하여 F 액틴 유량 속도 및 중합 속도의 정량화
참고: F-액틴 흐름 속도 및 액틴 중합 속도를 정량화하기 위한 실습 데이터를 위한 보충 파일 3 을 참조하십시오.
- 피지에서 멀티 채널 타임 랩스 스택 이미지를 엽니 다.
- > 설정 배율 분석을 선택하고 이미지의 픽셀 크기를 설정합니다.
- filopodia 또는 lamellipodia에서 F 액틴 번들 내에서 최소 5 시간 프레임에 대한 역행하는 액틴 얼룩을 찾을 수 있습니다.
- 이미지 > 변환 > 회전을 선택하고 F-액틴 번들(그림 3A)이 위쪽으로 점등되도록 이미지의 각도를 조정합니다.
- 도구 모음의 사각형 을 클릭하고 액틴 반점과 F 액틴 번들의 끝(그림 3B, 1 및 2)이 포함된 상자를 그립니다.
참고: 할로태그 액틴 반점의 신호는 약합니다. 또한, 성장 콘의 말단 팁에서 Lifeact 신호는 성장 콘의 말단 팁이 근위 부에 비해 얇기 때문에 약하고 희미합니다(도 2B). 조사관은 F-액틴 유량 속도 및 중합 속도(도 3B)의 정량화를 최적화하기 위해 신호를 강화해야 한다. 근위 성장 원뿔의 Lifeact 신호가 포화되지만, 이것은 F-액틴의 단부 종말의 결정을 방해하지 않습니다 (그림 3E, 노란색 선). - 이미지 > 중복을 선택하고 5개의 시간 프레임을 입력합니다(그림 3B, 3-5).
- 몽타주를 만들기 > 이미지 > 스택을 선택하고 매개 변수를 입력합니다: 열, 5; 행, 1; 스케일 팩터, 1.
- 확인을 클릭 합니다. 이미지 몽타주가 화면에 나타납니다.
- 분할 채널에 이미지 > 색상 > 선택합니다. 이것은 두 개의 형광 채널을 분리합니다.
- F-액틴 유량 속도의 정량화.
- > 측정 설정 분석을 선택하고 영역 및 경계 사각형을 선택합니다.
- 도구 모음에서 타원형 을 클릭하고 액틴 반점에 원을 그립니다(그림 3C, 1 및 2).
- 이미지 > 오버레이를 선택> 선택 추가 선택. 원은 이미지 몽타주에 겹쳐져 있습니다(그림 3C, 3 및 4).
참고: > 옵션 > 색상 편집에서 오버레이 색상을 변경할 수 있습니다. - 나머지 반점에 대한 원의 오버레이를 반복합니다(그림 3C, 5).
참고: 액틴 반점의 중심을 정확하게 결정하려면 조사관은 반점에 원을 오버레이해야 합니다. - 도구 모음을 똑바로 클릭하고 원의 중심을 연결하는 선을 그립니다(그림 3D, 1 및 2).
- 측정 > 분석을 선택합니다. 결과는 화면에 나타납니다 (그림 3D, 3).
참고: 결과에 표시된 높이는 관측 중에 액틴 반점의 전좌 거리를 나타냅니다(그림 3D, 3). - 전좌 거리를 관측 시간으로 나누어 F-액틴 유량 속도를 계산합니다.
- F-액틴 중합률의 정량화.
- F액틴 번들의 끝을 연결하는 선을 그립니다(그림 3E, 1).
- > 측정 분석을 선택합니다. 결과는 화면에 나타납니다 (그림 3E, 2).
참고: 결과의 높이는 관측 중에 F-액틴 번들의 확장 길이를 나타냅니다(그림 3E, 2). - 확장 길이를 관측 시간으로 나누어 F-액틴 연장 속도를 계산합니다.
- F-액틴 중합속도를 F-액틴 유량 속도 및 연장속도의 합으로 계산한다(도 3F).
7. 견인력 현미경 검사법과 뉴런 배양을 위한 PAA 젤 준비
- 견인력 현미경 검사법에 필요한 PAA 젤 의 준비 (그림 4)
- 27mm 직경의 유리 바닥 접시에 증류 된 H2O에 용해 된 NaOH (100 mMM)의 파이펫 0.5 mL, 실온 (RT)에서 15 분 동안 배양하십시오.
- 3-aminopropyltrimethyoxysilane (APTMS)의 50 μL을 요리에 NaOH 솔루션에 추가하고 부드러운 파이펫팅으로 솔루션을 혼합하고 RT에서 15 분 동안 배양하십시오.
- 증류된 H2O로 유리 바닥 요리를 씻고 건조시다.
- 파이펫 0.5 mL 0.5% 글루타랄데히드 용액, PBS에 용해, APTMS 처리 유리 바닥 접시에, RT에서 30 분 동안 배양.
- 증류된 H2O로 유리 바닥 요리를 씻고 건조시키십시오.
- 증류H2O(412 μL), 30% (w/v) 아크릴아미드 용액(63 μL), 2.5% (w/v) 비스 아크릴아미드 용액(6μL) 및 카박스실레이트 변형 마이크로스피어(형광비드) 용액(20 μL)을 포함하는 솔루션을 준비한다.
참고: 아크릴아미드 용액에 추가하기 전에 응집구비를 분리하기 위해 형광 비드 용액을 소용돌이시합니다. - RT에서 30분 동안 진공 챔버에서 용액을 탈가스로 드게합니다.
- 이 솔루션에 1μL(w/v) 아황산염(APS), 증류H2O에 용해된 1μL, N,N',N',N'tetramelethyleniamine(TEMED)의 1μL을 추가하고 부드러운 파이펫팅으로 혼합합니다.
- 15mL 원심분리기 튜브의 캡에 유리 커버슬립(직경 18mm)을 놓습니다.
- 즉시 25 μL의 용액을 커버슬립에 넣은 다음, 커버슬립에 반전유리 바닥 접시를 부드럽게 놓습니다. 아크릴아미드가 RT에서 1시간 동안 중합하도록 허용한다.
- 증류된 H2O를 커버슬립에 바르고 구부러진 팁이 있는 주사기 바늘을 사용하여 젤에서 벗겨냅니다.
- H2O를 제거하고 PBS에 용해된 설포-SANPAH(1mM)를 젤에 첨가한다.
- 멸균 조건하에서 젤을 자외선에 5분 동안 노출시하십시오. PBS로 젤을 세 번 씻고 세척당 15분 동안 세척합니다.
- 마이크로스피어 들여쓰기 방법을 이용한 겔 강성의 판정(도 5A)44.
- 직경 및 밀도에 대해 지정된 현미경을 겔로 옮은 다음 레이저 스캐닝 공초점 현미경의 시편 단계에 놓습니다.
- 젤 표면에 초점을 맞추고 z 위치를 기록하십시오(그림 5B).
- 마찬가지로, 마이크로스피어의 맨 아래에 초점을 맞추고 z-위치(그림 5C)를 기록한다.
- 젤 표면의 z 위치와 마이크로스피어의 바닥 사이의 차이에 의해 결정된 들여쓰기 깊이를 계산합니다.
- 젤의 영의 계수 E 를 계산합니다.
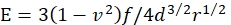
여기서 f 는 마이크로스피어의 부력 보정 중량이고, d 는 겔의 들여쓰기 깊이이고, r 은 마이크로스피어의 반지름이며, v 는 푸아송의 비율(값이 0.3이며, 이전에 결정된 바와 같이)이다.
- 제2항에 설명된 바와 같이 PDL 및 라미닌으로 젤을 코팅합니다.
- 섹션 3 및 4에 설명된 바와 같이, 1.0 x 106 세포당 pEGFP-C1의 5 μg로 E16 마우스 배아, 해리시전 해마 및 트랜스펙트밖으로 해부한다. PDL/라미닌 코팅 젤에 2.0 x 105 셀을 시드하십시오.
참고: 견인력 분석을 위해, 형광 표지 세포의 현미경 화상 진찰은 성장 콘 영역을 결정하기 위해 필요합니다.
8. 신경 성장 콘에서 견인 력 현미경 검사
- DIV3에서는 배양 배지를 0.5mL의 따뜻한 라이보비츠 L-15 배지로 교체하여 2% B-27 보충제, 글루타민(1mM), 페니실린(100 U/mL), 연쇄상 구균(100 μg/mL)을 함유한다. 37°C에서 1h의 뉴런을 유지합니다.
- 레이저 스캐닝 공초점 현미경을 켜고 스테이지 탑 인큐베이터를 37°C로 설정합니다.
참고: 본 연구는 63x/1.2 NA 수분 침수 목표 렌즈와 이미지 수집 및 분석 소프트웨어가 장착된 레이저 스캐닝 공초점 현미경을 사용합니다( 재료표 참조). - 미리 데워진 스테이지 탑 인큐베이터에 뉴런을 유리 바닥 접시에 놓습니다.
- 검색 크기, 512 × 512 픽셀: 다음과 같이 이미지 수집 매개 변수를 설정합니다. 스캔 영역, 1.5-3배 줌; 스캔 속도, 프레임 당 ~ 1 s; 레이저 파장, 561 nm (형광 구슬에 대한 여기 파장) 및 488 nm (향상된 녹색 형광 단백질 (EGFP)을위한 흥분 파장); 시간 간격, 3 s; 지속 시간, 50 프레임.
- 성장 원뿔 형태학을 시각화하려면 EGFP를 강력하게 표현하는 성장 콘을 선택합니다.
- 젤 표면에 초점을 맞추고 시간 경과 이미지를 수집합니다(그림 6A 및 보충 파일 4).
참고: 견인력 분석을 위해 두 개의 형광 채널(형광 구슬 및 EGFP용)과 밝은 필드 채널(차동 간섭 콘트라스트(DIC) 또는 위상 대비 이미지를 캡처하는 것이 좋습니다. - 이미지 처리 소프트웨어(예: 피지)를 사용하여 단일 채널 시간 경과 RGB 이미지 스택을 생성하고 이러한 이미지를 티프 파일로 저장합니다.
참고: 조사관도 원시 데이터를 저장하는 것이 중요합니다. - 증류된 H2O에 용해된 도데실 황산나트륨(SDS)의 100μL을 100μL에 적용하여 기판에서 뉴런을 방출하여 젤 기판을 이완시한다. 온도를 안정시키기 위해 37°C에서 5분 동안 접시를 배양합니다.
참고: 훈련되지 않은 기판에서 구슬의 이미지는 견인력 분석 중에 원래 비드 위치를 참조하는 데 사용됩니다(그림 6C). SDS 용액의 적용은 인큐베이터의 열 변화 및 세포 유발 변형의 이완으로 인해 xyz 위치를 변경합니다. 따라서 조사관은 초점 평면과 x-y 위치를 수정해야 합니다. - 젤 표면에 초점을 맞추고, 훈련되지 않은 기판에서 구슬의 이미지를 습득한다(도 6B).
- 훈련되지 않은 기판에서 구슬의 단일 채널 RGB 이미지를 생성하고 이 이미지를 티프 파일로 저장합니다.
- 피지를 사용하여 훈련되지 않은 기판에서 비드 이미지의 x-y 위치 수정
- 피지에서, 훈련되지 않은 기판과 형광 구슬의 시간 경과 스택 이미지에서 비드 이미지를 엽니 다.
- 이미지 > 스택 을 선택 > 도구 > 연결합니다. 대화 상자가 화면에 나타납니다(그림 7A, 1).
- Image1 및 Image2에서 훈련되지 않은 기판과 형광 구슬의 타임랩스 스택 이미지에서 비드 이미지를 각각 선택합니다(그림 7A, 2).
- 확인을 클릭 합니다. 훈련되지 않은 기판의 비드 이미지가 타임랩스 스택 이미지에 추가됩니다(그림 7A, 3).
- 스크롤 막대(그림 7B, 1, 빨간색 프레임)를 사용하여 스택 이미지(빨간색 화살표)의 두 번째 프레임을 표시합니다.
- 스택레그(그림 7B, 2)> 플러그인을 선택합니다. 대화 상자가 화면에 나타납니다(그림 7B, 3).
- 드롭다운 목록(그림 7B, 3, 빨간색 프레임)에서 강체 본체를 선택하고 확인을 클릭합니다. 그런 다음 x-y 위치의 보정이 시작됩니다.
- 스크롤 막대를 사용하여 x-y 위치 보정 스택 이미지의 첫 번째 프레임을 표시합니다.
- 이미지 > 중복을 선택합니다(그림 7C, 1). 대화 상자가 화면에 나타납니다(그림 7B, 2).
- 범위에서 입력 1을 입력하면 중복 스택(그림 7C, 2)을 선택 해제하고 확인을 클릭합니다. 훈련되지 않은 기판의 x-y 위치 보정 비드 이미지가 화면에 나타납니다(그림 7C, 3). 이 이미지를 티프 파일로 저장합니다.
- 견인력의 정량화
참고: 견인력 분석을 위해 여기에 설명된 방법은 MATLAB과 두 개의 MATLAB 툴박스인 '이미지 처리 툴박스'와 '병렬 컴퓨팅 툴박스'를 사용합니다. 조사관은 분석 전에 설치해야 합니다. 견인력 분석 코드는 MATLAB 버전 2018a를 기반으로 개발되었습니다. 따라서 MATLAB 버전 2018a(또는 그 이후)는 분석에 사용해야 합니다. 견인력 해석에 사용되는 알고리즘은 이전에 설명되었다222.- 보충 파일 5에서 견인력 분석 코드 TFM2021을 다운로드합니다. MATLAB에서 오픈 TFM 2021
- TFM2021에서 메인 .m 열고 실행합니다. 그래픽 사용자 인터페이스(GUI)가 화면에 나타납니다(그림 8A).
- 훈련되지 않은 기판 이미지 로드를 클릭하고 훈련되지 않은 기판에서 x-y 위치 보정 비드 이미지를 선택합니다.
- 형광 비드 로드를 클릭하고 구슬의 시간 경과 스택 이미지를 선택합니다.
- 밝은 필드 이미지 로드를 클릭하고 밝은 필드의 시간 경과 스택 이미지를 선택합니다.
- GFP 이미지 로드를 클릭하고 EGFP의 시간 경과 스택 이미지를 선택합니다.
- GUI의 드롭다운 목록에서 GFP 를 선택합니다(그림 8A, 빨간색 상자).
- ROI를 클릭하여 성장 콘을 포함한 관심 있는 직사각형 영역(ROI)을 GUI에 표시된 셀 이미지의 두 점을 클릭하여 지정합니다(그림 8B).
- GUI의 저장 버튼을 클릭합니다(그림 8A, 빨간색 화살표). 선택한 스택 이미지와 ROI는 .mat FILE(MATLAB 형식 파일)에 저장됩니다.
- 스팟 감지를 클릭합니다. 대화 상자가 화면에 나타납니다.
- 대화 상자에 값(일반적으로 50-150)을 입력하여 비드 감지임계값을 결정합니다. 확인을 클릭하면 계산이 시작됩니다.
- 계산을 마친 후 플롯 트랙을 클릭하여 8.12.8 단계에서 선택한 영역을 확대하고 감지된 구슬을 흰색 점으로 표시합니다(그림 8C, 1).
참고: 비드 검출(흰색 점)이 형광 구슬과 겹치는지 확인합니다. 비드 감지는 배경 소음을 감지할 수도 있습니다. 이러한 외부 간섭을 줄이려면 스팟 감지에서 임계값값을 변경합니다. 또한 8.12.13 단계에서 올바른 점을 수동으로 선택합니다. - 구슬 선택(Select beads)을 클릭하고 성장 콘 아래에 올바른 점을 포함하는 다각형 영역을 구분합니다. 키보드에 입력을 누릅니다. 다각형 영역 내의 흰색 점은 빨간색으로 변경됩니다(그림 8C, 2).
- GUI의 예상 힘을 클릭합니다. 그런 다음 다음 매개 변수에 대한 입력 값: 픽셀 크기, μm/픽셀; 영의 계수, 7.2.5 단계에서 계산된 값; 푸아송의 비율, 0.3.
- 견적 힘을 실행하여 계산을 시작합니다. 소프트웨어는 계산 결과를 스프레드시트 형식 파일에 자동으로 저장합니다.
참고: 스프레드시트는 모든 시간 프레임에서 x 구성 요소, y 구성 요소 및 힘 크기를 표시합니다(그림 8D). 견인력 정량화를 위한 연습 데이터를 위한 보충 파일 6 을 참조하십시오.
결과
액틴 중합률 및 클러치 커플링 효율을 정량화하는 단일 반점 이미징
높은 Lifeact 발현은 성장 콘 내에서 F-액틴 시각화를 허용합니다. 낮은 HaloTag-actin 표현은 F-액틴 역행 흐름의 모니터링을 허용합니다(그림 3, 보충 파일 2). 액틴 반점 추적을 통해 F-액틴 유량 속도를 측정할 수 있습니다(그림 3C,D). F-액틴 역행 흐름과 접착제 기판의 기계적 결합은 F-액틴 유량 속도를 감소시키기 때문에, 클러치 커플링 효율은 속도에서 추정될 수 있다. 더욱이, 라이프액트를 부착한 F-액틴 라벨링은 F-액틴 확장의 시각화를 지원하며 액틴 중합률(도 3E, F)을 정량화하는 데 유용하다.
견인력의 정량적 분석
여기에 제시된 방법론에 대한 엄격한 준수는 성장 콘 아래형구슬의 움직임을 드러낼 것이다(도 6C, 보충 파일 4). 기판에 F-actin 역행 흐름은 형광 구슬이 성장 콘 아래 후방으로 이동하는 원인이 되는 견인력을 생성한다. 견인력 분석 코드는 형광 비드 변위로부터의 견인력을 추정하고 계산된 견인력을 힘 벡터로 표현합니다. 견인력의 방향과 크기는 힘 벡터의 x 및 y-구성 요소로부터 결정된다(도 8C,D). 도 8D의 빨간색 상자는 힘 벡터의 x 및 y 구성 요소를 나타냅니다. 도 8C는 해당 성장 콘을 묘사합니다. x-y 좌표의 관점에서 벡터는 x축에 대해 -93.8°로 가리킵니다. 이 방향은 성장 원뿔의 후면을 향합니다(그림 8C). 견인력 F의 크기는 다음과 같이 계산되었습니다.
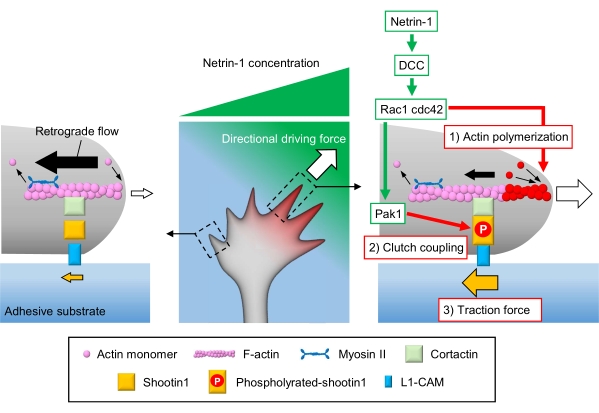
그림 1: 힘 생성 및 성장 콘 탐색을 위한 성장 콘 기계. netrin-1 화학 요법 그라데이션은 축 상 성장 콘에 그것의 수용체 DCC의 비대칭 자극을 유도합니다. 이것은 Rac1및 Cdc42및 다운스트림 키나아제 Pak1을 활성화합니다. Rac1 및 Cdc42는 (1) 액틴 중합화를 촉진하는 반면, Pak1 인산염 은 1을 촬영하여 shootin1 매개 (2) 클러치 커플링을 향상시킵니다. 상기 액틴 역학및 클러치 결합의 비대칭 활성화는 넷린-1 소스의 측면에 있는 (3) 견인력을 증가시켜, 따라서 성장 콘 어트랙션을 위한 방향 동력을 생성한다. 여기에 제시된 프로토콜은 성장 원뿔 탐색을 위한 주요 변수(1)-(3)의 정량화를 허용한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 완전히 열리고 좁은 다이어프램 아래 뉴런 성장 콘의 형광 이미지. 성장 콘은 Lifeact와 HaloTag-actin을 표현합니다. (A) 높은 Lifeact 발현은 성장 원뿔 형태의 시각화를 허용합니다. 반면에 HaloTag-actin 발현 수준은 매우 낮으며 다이어프램이 완전히 열릴 때 희미한 신호가 있습니다. (B) 다이어프램이 적절하게 좁아지면 배경 신호가 감소하고 단일 액틴 반점이 성장 콘에 나타납니다. 스케일 바: 5 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 3: 영상 처리 및 분석 소프트웨어 피지를 이용하여 F-액틴 유량 속도 및 액틴 중합속도를 정량화하기 위한 단계.(A) 분석을 위한 이미지의 각도를 조정한다. (1) F-액틴 번들에서 흐르는 액틴 얼룩(화살표헤드)을 찾아 선택한다. (2) > 회전을 변환하기 > 이미지를 선택합니다. (3) F-액틴 번들이 위쪽으로 향하도록 각도를 설정합니다. (4) 이미지의 각도가 변경됩니다. (B) 액틴 얼룩과 F-액틴 번들을 포함한 지역을 해동한다. (1) 도구 모음의 사각형을 클릭합니다. (2) 이미지의 영역을 설명합니다. 액틴 얼룩과 F액틴 번들의 끝을 명확하게 시각화할 수 있도록 이미지의 밝기와 대비가 증가합니다. (3) 중복되는 이미지 > 선택합니다. (4) F-액틴 번들에서 액틴 반점 흐름을 보여주는 5개의 시간 프레임을 입력합니다. (5) 선택한 스택 이미지가 화면에 나타납니다. (C) 액틴 반점에 오버레이 원. (1) 도구 모음에서 타원형을 클릭합니다. (2) 액틴 반점에 원을 그립니다. (3) 이미지 > 오버레이를 선택> 선택 추가 선택합니다. (4) 원이 겹쳐져 있습니다. 5) 나머지 액틴 반점에 원을 오버레이 반복합니다. (D) 5시간 동안 액틴 반점의 전좌 거리를 측정합니다. (1) 도구 모음에서 직선을 클릭합니다. (2) 원의 중심을 연결하는 선을 그립니다. (3) 측정 > 분석선택합니다. 결과, 매개 변수 높이(빨간색 상자)로 표시되어 액틴 반점 전좌 거리를 중계합니다. (E) 5개의 시간 프레임 동안 F-액틴 돌출 길이의 변화를 측정합니다. (1) F-액틴 돌출의 끝을 연결하는 선을 그립니다. (2) 측정 > 분석 선택합니다. 결과(빨간색 상자) 높이는 F-액틴 번들의 확장 길이를 나타냅니다. (F) 액틴 중합속도는 F-액틴 유량 속도 및 연장속도의 합으로부터 계산된다. 보충 파일 2도 참조하십시오. 보충 파일 3은 조사관이 위에서 설명한 방법론을 연습하도록 지원합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
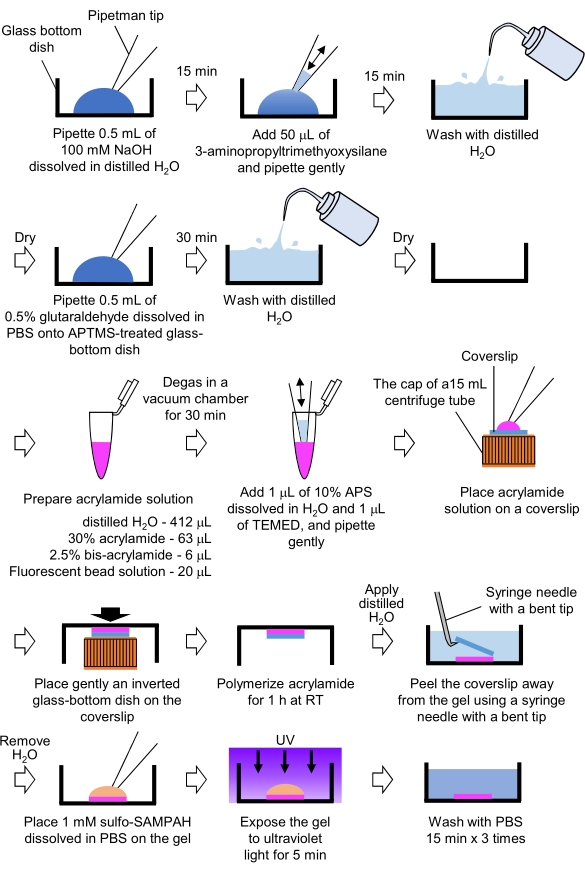
그림 4: PAA 젤 준비를 위한 단계. 자세한 설명은 7.1단계를 참조하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
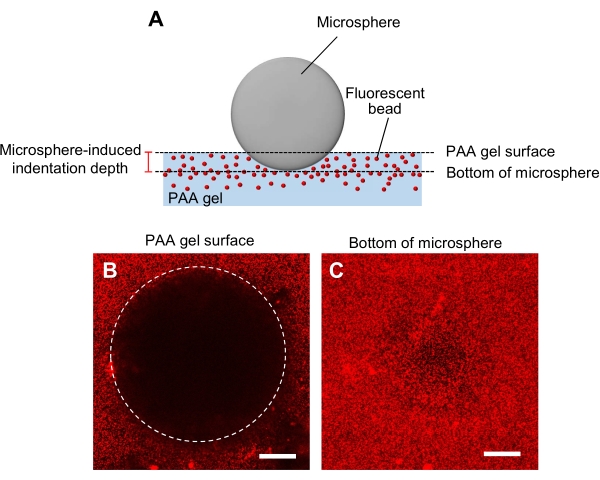
그림 5: PAA 젤 강성의 결정. (A) 마이크로스피어 들여쓰기 방법. 형광 비드 임베디드 PAA 젤에 마이크로스피어를 배치하면 마이크로스피어의 무게가 겔내 들여쓰기를 유발합니다. 들여쓰기 깊이는 마이크로스피어에 의해 들여진 PAA 겔의 마이크로스피어(B,C) 형광 이미지의 바닥에서 PAA 젤 표면의 z-위치를 빼고 형광구를 함유하여 계산된다. 레이저 스캐닝 공초점 현미경은 젤 표면(B)과 마이크로스피어(C)의 바닥의 이미지를 캡처하는 데 사용되었다. 형광 구슬로부터의 신호는 들여쓰기 부위(B, 원)의 겔 표면에서 볼 수 없다. 그러나 마이크로스피어의 맨 아래에서 관찰할 수 있습니다. 스케일 바: 50 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
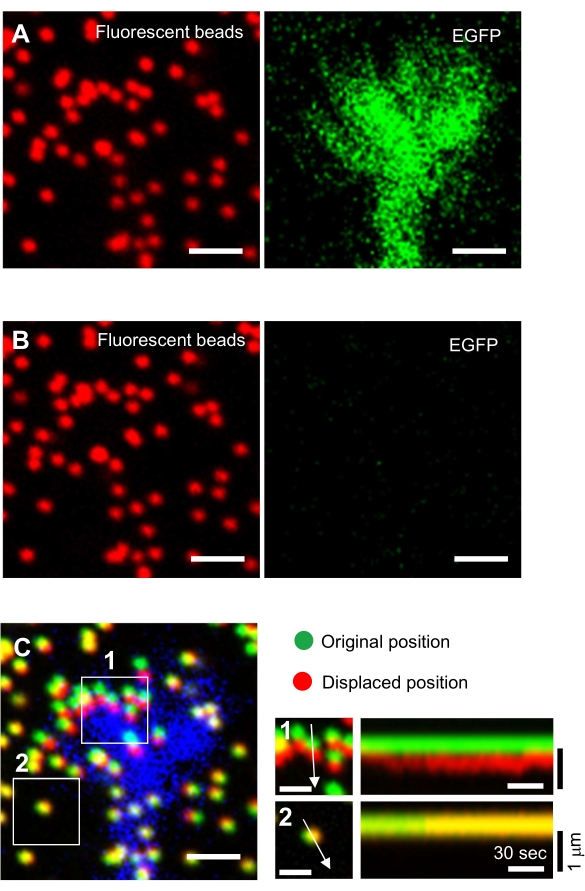
그림 6: 신경 성장 원뿔의 힘 매핑. (A-C) PAA 젤에 내장된 구슬의 형광 이미지와 EGFP로 시각화된 신경 성장 원뿔. 타임랩스 이미지(A)를 인수한 후, 뉴런은 SDS 용액을 적용하여 겔 기판으로부터 방출되었고, 훈련되지 않은 기판에서 구슬의 이미지가 포착되었다(B). (C) 훈련되지 않은 기판의 구슬 이미지는 원래(녹색) 및 변위(빨간색) 위치에 구슬을 표시합니다. 성장 콘의 EGFP 신호는 파란색으로 표시됩니다. Kymographs(오른쪽)는 147s의 지속 시간 동안 3s 간격으로 구슬의 움직임을 표시하며, 박스인 영역 1과 2의 화살표로 표시됩니다. 영역 2의 비드는 참조 구비드입니다. 스케일 바: (A), (B) 및 (C, 왼쪽) 및 1 μm (C, 중간)에 대한 2 μm. 보충 파일 4도 참조하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
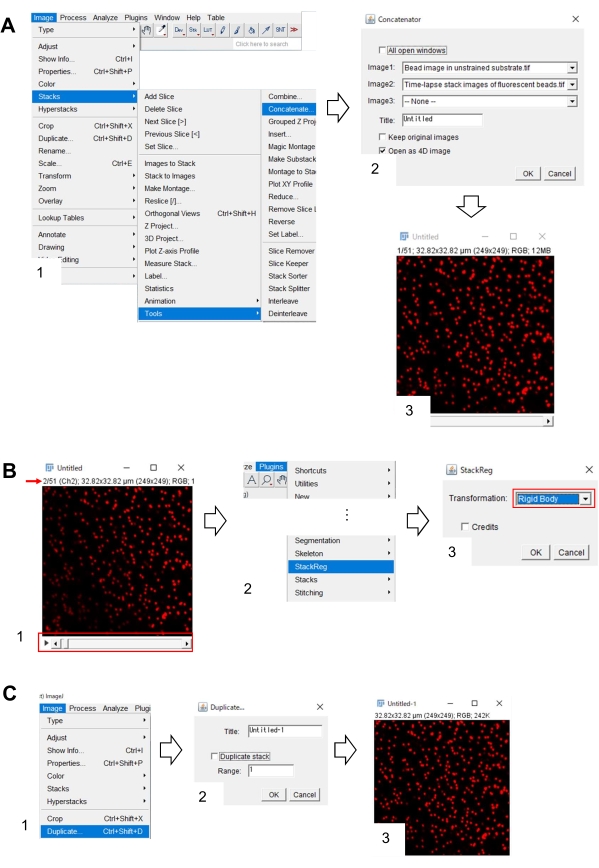
도 7: 피지를 이용한 훈련되지 않은 기판에서 비드 이미지의 x-y 위치를 보정하는 단계. (A) 형광 구슬의 타임랩스 스택 이미지와 함께 훈련되지 않은 기판으로 비드 이미지를 결합한다. (1) 이미지 > > 도구 > 연결된 이미지를 선택합니다. (2) Image1 및 Image2에서 비훈련된 기판및 형광구슬의 타임랩스 스택 이미지를 각각 선택한다. 확인을 클릭합니다. (3) 훈련되지 않은 기판의 비드 이미지가 타임랩스 스택 이미지에 추가된다. (B) 형광 비드 이미지의 x-y 위치를 수정합니다. (1) 스크롤 막대(빨간색 프레임)를 사용하여 이미지 스택에서 두 번째 프레임(빨간색 화살표)을 선택합니다. (2) 스택레그와 > 플러그인을 선택합니다. (3) 드롭다운 목록(빨간색 프레임)에서 강체를 선택하고 확인을 클릭합니다. x-y 위치의 수정이 시작됩니다. (C) x-y 위치 보정 비드 이미지를 저장합니다. x-y 위치 보정 스택 이미지의 첫 번째 프레임을 선택한 후 (1) 이미지 > 중복을 선택합니다. (2) 범위에 1을 입력하고 중복 스택을 선택 해제합니다. 그런 다음 확인을 클릭합니다. (3) 훈련되지 않은 기판의 x-y 위치 보정 비드 이미지가 화면에 나타납니다. 이 이미지를 티프 파일로 저장합니다. 보충 파일 6은 조사관이 위에서 설명한 방법론을 연습하도록 지원합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
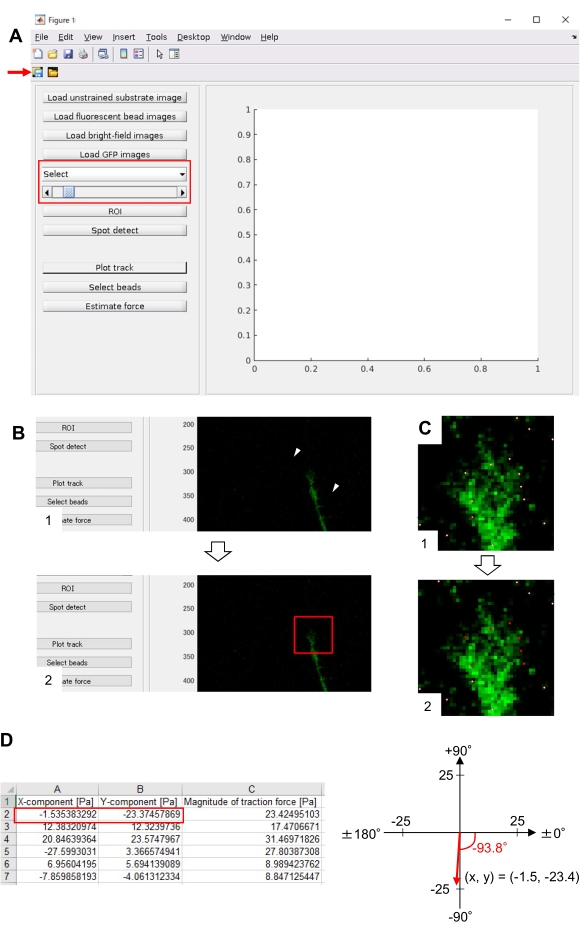
그림 8: 오픈 소스 견인력 분석 코드를 사용하여 뉴런 성장 콘 하에서 견인력분석. GUI에서 선택한 시간 경과 이미지는 드롭다운 목록에서 확인할 수 있으며 슬라이더가 표시된(빨간색 상자)에서 확인할 수 있습니다. (B) 성장 콘을 포함하는 영역을 선택합니다. (1) GUI에서 ROI를 클릭합니다. 마우스 커서를 사용하면 셀 이미지에 두 점(화살표 헤드)을 지정합니다. (2) 셀 이미지에 빨간색 상자가 나타납니다. 두 번의 클릭으로 두 모서리의 위치를 결정합니다. (C) 성장 콘 아래에 검출된 구슬(흰색 점)을 선택합니다. (1) GUI에서 구슬 선택(Select beads)을 클릭하고 클릭하여 성장 콘을 포함하는 다각형 영역을 구분합니다. Enter 키를 누릅니다. (2) 다각형 영역 내의 흰색 점이 빨간색으로 변경됩니다. (D) 견인력의 방향과 크기의 계산된 결과. 스프레드시트의 빨간색 상자는 견인력 해석에 의해 추정되는 힘 벡터의 x 및 y 구성 요소를 나타냅니다. 오른쪽 패널의 x-y 좌표에서, 성장 콘에 의해 생성된 힘 벡터는 x축에 대해 -93.8°로 가리킵니다. 이 방향은 (C)에서 성장 콘의 후면을 향한다. 보충 파일 6은 조사관이 위에서 설명한 방법론을 연습하도록 지원합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 파일 1: 이 연구에 사용되는 솔루션 및 미디어의 조리법. 자세한 내용은 텍스트를 참조하십시오. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 2: 신경 성장 콘에 HaloTag-actin의 Lifeact 및 형광 반점 화상 진찰의 형광 화상 진찰. 라이프액트(녹색) 및 할로태그 액틴(마젠타). 이미지는 총 147s의 기간 동안 3 s마다 획득되었습니다. 스케일 바: 2 μm. 그림 3. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 3: F-액틴 흐름 속도와 액틴 중합 속도를 정량화하기 위한 실습 데이터. Lifeact (녹색) 및 HaloTag 액틴 (마젠타)의 멀티 채널 타임 랩스 스택 이미지. 그림 3도 참조하세요. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 4: 신경 성장 콘에서 견인력을 감지 하는 힘 매핑 비디오. 구슬의 원래(녹색) 및 변위(빨간색) 위치입니다. 성장 콘의 EGFP 신호는 파란색으로 표시됩니다. 이미지는 147 s에 대한 3 s마다 획득했다. 스케일 바: 2 μm. 그림 6도 참조하세요. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 5: 견인력 분석 코드입니다. 자세한 내용은 8.12 단계를 참조하십시오. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 6: 견인력을 정량화하기 위한 연습 데이터. 훈련되지 않은 기판및 단일 채널 타임랩스 스택 RGB 이미지의 단일 채널 RGB 이미지는 성장 콘, EGFP 및 밝은 필드 아래에서 형광 구슬의 RGB 이미지를 스택합니다. 그림 7 과 8도 참조하십시오. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
이 연구에서 설명된 프로토콜은 모든 실험실, 기관 및 대학에서 일상적으로 발견되는 시판되는 재료와 현미경 장비를 사용합니다. 따라서, 조사원은 그들의 연구 결과에서 현재단 단 하나 반점 화상 진찰 및 견인력 현미경 검사를 쉽게 채택할 수 있습니다.
반점 이미징은 액틴 중합및 클러치 커플링을 분석할 수 있습니다. 또한, 반점 이미징은 F-액틴 역행 흐름과 상호 작용하는 shootin1 및 cortactin과 같은 클러치 분자의 역행 흐름을 모니터링할 수 있습니다. TIRF 현미경을 이용하여, 세포 접착 분자 L1-CAM의 역행 흐름도 모니터링될 수 있다23,41; L1-CAM은 클러치 커플링 효율을 반영하는 그립 및 슬립 동작을 겪습니다23,41. 본 연구는 반점 이미징을 위한 TMR-HaloTag 시스템을 채택하지만 EGFP 및 단황 적색 형광 단백질과 같은 다른 형광 단백질도 분석16,18,20,23,24,27,39에서 사용할 수 있습니다. 액틴 반점 시각화를 위한 필수 사항은 형광 액틴의 낮은 발현 수준과 최소 영역의 조명(그림 2)입니다. 이 프로토콜에서는 Lifeact 및 HaloTag 액틴 신호가 순차적으로 획득됩니다. 액틴 역행 흐름이 상대적으로 느리기 때문에(4.5± 0.1 μm/min)24, F-액틴 역행 흐름 및 액틴 중합화 분석은 다른 형광 채널(~1s 간격)의 순차적 이미지 수집에 영향을 받지 않습니다. Lifeact는 널리 사용되는 F-액틴 마커이지만 액틴 결합 단백질47과 경쟁할 수 있습니다. 더 중요한 것은 Lifeact가 액틴 역학을 변화시켜 F-액틴 구조와 세포 형태에 영향을 미칠 수 있습니다47,48,49.
견인력 현미경 검사법은 성장 콘 발전을 유도하는 힘을 감지할 수 있습니다. 세포 외 매트릭스 내에 뉴런을 장착함으로써, 조사관은 또한 반 3D 환경에서 생성 된 힘을 분석 할 수있다11. 고배율 이미징은 성장 원뿔이 약한 견인력을 생성하기 때문에 견인력의 정확한 정량화에 중요합니다7. 나노기둥 또는 스트레스에 민감한 바이오 센서를 이용한 다른 방법도 견인력을 측정하는 데 사용되지만, PAA 겔 계법은 적응력이 뛰어나고 아크릴아미드및 비스 아크릴라미드의 농도를 변화시킴으로써 기판 강성을 조정할 수 있다41,44,52. 본 프로토콜에서 PAA 젤은 아크릴아미드 3.75% 및 0.03% 비스 아크릴아미드의 최종 농도로 제조된다; 영의 계수는 ~270 Pa22이며 이 강성은 뇌 조직의 범위 내에 있습니다 (100-10,000 Pa)53,54,55. PAA 젤 (~100 μm)의 두께로 인해 이 방법은 현미경 검사중에 고배율 렌즈의 사용을 제한합니다. 높은 배율 이미지를 얻으려면, 조사관은 레이저 스캐닝 공초점 현미경에서 줌 기능을 사용해야 합니다.
결론적으로, 현재반점 이미징 및 견인력 현미경 검사는 힘 세대의 주요 사건의 정량적 분석을 가능하게 한다. 이 정보는 성장 콘 발전과 탐색의 기초가 되는 메커니즘에 대한 이해를 향상시키는 데 매우 중요합니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 연구는 보조금 번호 21gm081001h00005 (N.I.I.에서 AMED에 의해 부분적으로 지원되었습니다. JSPS KAKENHI (JP19H03223, N.I.) 및 JSPS 그랜트 -에 이-초기 경력 과학자에 대 한 원조 (JP19K16258, T.M.), 불치성 질환에 대 한 오사카 의학 연구 재단 (T.M.), 그리고 NAIST 차세대 학제 간 연구 프로젝트 (Y.S.).
자료
| Name | Company | Catalog Number | Comments |
| 0.5% trypan blue stain solution | Nacalai | 29853-34 | |
| 3-aminopropyltrimethyoxysilane | Sigma | 281778-100ML | |
| Acrylamide monomer | Nacalai | 00809-85 | |
| Ammonium persulphate | Cytiva | 17-1311-1 | |
| Axio Observer Z1 | Zeiss | 431007-9902-000 | Epi-fluorescence microscope (single speckle imaging) |
| B-27 supplement (50x) | Thermo Fisher Scientific | 17504-044 | |
| Bovine serum albmine | Sigma | A7906-10G | |
| C-Apochromat 63x/1.2 W Corr | Zeiss | 421787-9970-799 | Objective lens (traction force microscopy) |
| Coverslip (diameter 18 mm) | Matsunami | C018001 | |
| D-glucose | Nacalai | 16806-25 | |
| DNaseI | Sigma | DN25-100MG | |
| Fetal bovine serum | Thermo Fisher Scientific | 10270-106 | |
| Fiji | Open source software package | https://imagej.net/software/fiji/ | |
| FluoSpheres carboxylate-modified 0.2 mm, red (580/605), 2% solid | Thermo Fisher Scientific | F8810 | carboxylate-modified microspheres |
| Glass bottom dish (14 mm diameter) | Matsunami | D1130H | |
| Glass bottom dish (27 mm diameter) | Matsunami | D1140H | |
| Glutaraldehyde solution | Sigma | G5882-10X10ML | |
| HaloTag TMR ligand | Promega | G8251 | |
| HBO103 W/2 | Osram | 4050300382128 | Mercury lamp (single speckle imaging) |
| Image Processing Toolbox | MathWork | https://www.mathworks.com/products/image.html | |
| Laminin solution from mouse EHS tumor | Wako | 120-05751 | |
| Leibovitz’s L-15 medium | Thermo Fisher Scientific | 11415064 | |
| L-glutamine | Nacalai | 16919-42 | |
| LSM710 | Zeiss | N/A | Conforcal laser microscope (traction force microscopy) |
| MATLAB2018a | MathWork | https://www.mathworks.com/products/new_products/release2018a.html | |
| Mouse C57BL/6 | Japan SLC | N/A | |
| Mouse neuron nucleofector kit | Lonza | VPG-1001 | |
| N,N,N’,N’-tetramethylethylenediamine (TEMED) | Nacalai | 33401-72 | |
| N,N’-methylenebisacrylamide | Nacalai | 22402-02 | |
| Neurobasal medium | Thermo Fisher Scientific | 21103-049 | |
| Nucleofector I | Amaxa | AAD-1001 | Electroporation apparatus |
| ORCA Flash 4.0 V2 | Hamamatsu | C11440-22CU | CMOS camera (single speckle imaging) |
| Papain | Nacalai | 26036-34 | |
| Parallel Computing Toolbox | MathWork | https://www.mathworks.com/products/parallel-computing.html | |
| pEGFP-C1 | Clontech | 1528177 | |
| Penicillin-streptomycin (100x) | Nacalai Tesque | 26253-84 | |
| pFN21A-HaloTag-actin | (Minegishi et al., 2018) | N/A | |
| Phosphate buffered saline (PBS) pH 7.4 (10x) | Thermo Fisher Scientific | 70011-044 | |
| Plan-Apochromat 100x/1.4 Oil | Zeiss | 420790-9901-000 | Objective lens (single speckle imaging) |
| pmNeonGreen-N1-Lifeact | (Kastian et al., 2021) | N/A | |
| Poly-D-lysine hydrobromide | Sigma | P6407-5MG | |
| Slulfo-SAMPHA | Thermo Fisher Scientific | 22589 | |
| Sodium dodecyl sulfate | Nacalai | 08933-05 | |
| Sodium hydrate (NaOH) | Nacalai | 31511-05 | |
| Steel ball | Sako tekkou | N/A | Microshpere to determin PAA gel rigidity. 0.6 mm diameter, 7.87 g/cm3. |
| ZEN2009 | Zeiss | https://www.zeiss.com/microscopy/us/products/microscope-software/zen.html#introduction | Image acquisition software (traction force microscopy) |
| ZEN2012 | Zeiss | https://www.zeiss.com/microscopy/us/products/microscope-software/zen.html#introduction | Image acquisition software (single speckle imaging) |
참고문헌
- TessierLavigne, M., Goodman, C. S. The molecular biology of axon guidance. Science. 274, 1123-1133 (1996).
- Marin, O., Valiente, M., Ge, X., Tsai, L. H. Guiding neuronal cell migrations. Cold Spring Harbor Perspectives in Biology. 2, 001834 (2010).
- Vitriol, E. A., Zheng, J. Q. Growth cone travel in space and time: the cellular ensemble of cytoskeleton, adhesion, and membrane. Neuron. 73 (6), 1068-1081 (2012).
- Cooper, J. A. Cell biology in neuroscience: mechanisms of cell migration in the nervous system. Journal of Cell Biology. 202, 725-734 (2013).
- Dupraz, S., et al. RhoA controls axon extension independent of specification in the developing brain. Current Biology. 29, 3874-3886 (2019).
- Suter, D. M., Miller, K. E. The emerging role of forces in axonal elongation. Progress in Neurobiology. 94, 91-101 (2011).
- Franze, K. Integrating chemistry and mechanics: the forces driving axon growth. Annual Review of Cell and Developmental Biology. 36, 61-83 (2020).
- Mitchison, T., Kirschner, M. Cytoskeletal dynamics and nerve growth. Neuron. 1, 761-772 (1988).
- Suter, D. M., Forscher, P. Substrate-cytoskeletal coupling as a mechanism for the regulation of growth cone motility and guidance. Journal of Neurobiology. 44, 97-113 (2000).
- Lowery, L. A., Van Vactor, D. The trip of the tip: understanding the growth cone machinery. Nature Reviews Molecular Cell Biology. 10, 332-343 (2009).
- Minegishi, T., et al. Shootin1b mediates a mechanical clutch to produce force for neuronal migration. Cell Reports. 25, 624-639 (2018).
- Minegishi, T., Inagaki, N. Forces to drive neuronal migration steps. Frontiers in Cell and Developmental Biology. 8, 863 (2020).
- Forscher, P., Smith, S. J. Actions of cytochalasins on the organization of actin filaments and microtubules in a neuronal growth cone. Journal of Cell Biology. 107, 1505-1516 (1988).
- Suter, D. M., Forscher, P. An emerging link between cytoskeletal dynamics and cell adhesion molecules in growth cone guidance. Current Opinion in Neurobiology. 8, 106-116 (1998).
- Pollard, T. D., Borisy, G. G. Cellular motility driven by assembly and disassembly of actin filaments. Cell. 112, 453-465 (2003).
- Waterman-Storer, C. M., Desai, A., Bulinski, J. C., Salmon, E. D. Fluorescent speckle microscopy, a method to visualize the dynamics of protein assemblies in living cells. Current Biology. 8, 1227-1230 (1998).
- Katoh, K., Hammar, K., Smith, P. J., Oldenbourg, R. Birefringence imaging directly reveals architectural dynamics of filamentous actin in living growth cones. Molecular Biology of the Cell. 10, 197-210 (1999).
- Watanabe, N., Mitchison, T. J. Single-molecule speckle analysis of actin filament turnover in lamellipodia. Science. 295, 1083-1086 (2002).
- Medeiros, N. A., Burnette, D. T., Forscher, P. Myosin II functions in actin-bundle turnover in neuronal growth cones. Nature Cell Biology. 8, 215-226 (2006).
- Shimada, T., et al. Shootin1 interacts with actin retrograde flow and L1-CAM to promote axon outgrowth. Journal of Cell Biology. 181, 817-829 (2008).
- He, M., Zhang, Z. H., Guan, C. B., Xia, D., Yuan, X. B. Leading tip drives soma translocation via forward F-actin flow during neuronal migration. Jounal of Neuroscience. 30, 10885-10898 (2010).
- Toriyama, M., Kozawa, S., Sakumura, Y., Inagaki, N. Conversion of a signal into forces for axon outgrowth through Pak1-mediated shootin1 phosphorylation. Current Biology. 23, 529-534 (2013).
- Abe, K., et al. Grip and slip of L1-CAM on adhesive substrates direct growth cone haptotaxis. Proceedings of the National Academy of Sciences of the United States of America. 115, 2764-2769 (2018).
- Baba, K., et al. Gradient-reading and mechano-effector machinery for netrin-1-induced axon guidance. Elife. 7, 34593 (2018).
- Nichol, R. I., Hagen, K. M., Lumbard, D. C., Dent, E. W., Gomez, T. M. Guidance of axons by local coupling of retrograde flow to point contact adhesions. Journal of Neuroscience. 36, 2267-2282 (2016).
- Shekarabi, M., et al. Deleted in colorectal cancer binding netrin-1 mediates cell substrate adhesion and recruits Cdc42, Rac1, Pak1, and N-WASP into an intracellular signaling complex that promotes growth cone expansion. Journal of Neuroscience. 25, 3132-3141 (2005).
- Kubo, Y., et al. Shootin1-cortactin interaction mediates signal-force transduction for axon outgrowth. Journal of Cell Biology. 210, 663-676 (2015).
- Huber, A. B., Kolodkin, A. L., Ginty, D. D., Cloutier, J. F. Signaling at the growth cone: ligand-receptor complexes and the control of axon growth and guidance. Annual Review of Neuroscience. 26, 509-563 (2003).
- Kolodkin, A. L., Tessier-Lavigne, M. Mechanisms and molecules of neuronal wiring: a primer. Cold Spring Harbor Perspectives in Biology. 3, 001727 (2011).
- Ayala, R., Shu, T., Tsai, L. H. Trekking across the brain: the journey of neuronal migration. Cell. 128, 29-43 (2007).
- Tatavarty, V., Kim, E. J., Rodionov, V., Yu, J. Investigating sub-spine actin dynamics in rat hippocampal neurons with super-resolution optical imaging. PLoS One. 4, 7724 (2009).
- Frost, N. A., Shroff, H., Kong, H., Betzig, E., Blanpied, T. A. Single-molecule discrimination of discrete perisynaptic and distributed sites of actin filament assembly within dendritic spines. Neuron. 67, 86-99 (2010).
- Chazeau, A., et al. Nanoscale segregation of actin nucleation and elongation factors determines dendritic spine protrusion. EMBO Journal. 33, 2745-2764 (2014).
- Garcia, M., et al. Two-tiered coupling between flowing actin and immobilized N-cadherin/catenin complexes in neuronal growth cones. Proceedings of the National Academy of Sciences of the United States of America. 112, 6997-7002 (2015).
- Swaminathan, V., et al. Actin retrograde flow actively aligns and orients ligand-engaged integrins in focal adhesions. Proceedings of the National Academy of Sciences of the United States of America. 114, 10648-10653 (2017).
- Tsai, T. Y., et al. Efficient front-rear coupling in neutrophil chemotaxis by dynamic myosin II localization. Developmental Cell. 49, 189-205 (2019).
- Zhang, X. F., et al. Regulation of axon growth by myosin II-dependent mechanocatalysis of cofilin activity. Journal of Cell Biology. 218 (7), 2329-2349 (2019).
- Reversat, A., et al. Cellular locomotion using environmental topography. Nature. 582, 582-585 (2020).
- Katsuno, H., et al. Actin migration driven by directional assembly and disassembly of membrane-anchored actin filaments. Cell Reports. 12, 648-660 (2015).
- Urasaki, A., et al. Shootins mediate collective cell migration and organogenesis of the zebrafish posterior lateral line system. Scientific Reports. 9, 12156 (2019).
- Abe, K., et al. Mechanosensitive axon outgrowth mediated by L1-laminin clutch interface. Biophysical Journal. 120, 3566-3576 (2021).
- Kastian, R. F., et al. Shootin1a-mediated actin-adhesion coupling generates force to trigger structural plasticity of dendritic spines. Cell Reports. 35, 109130 (2021).
- Riedl, J., et al. Lifeact: a versatile marker to visualize F-actin. Nature Methods. 5, 605-607 (2008).
- Chan, C. E., Odde, D. J. Traction dynamics of filopodia on compliant substrates. Science. 322, 1687-1691 (2008).
- Wang, Y. L., Pelham, R. J. Preparation of a flexible, porous polyacrylamide substrate for mechanical studies of cultured cells. Methods in Enzymology. 298, 489-496 (1998).
- Li, Y., Hu, Z., Li, C. New method for measuring poisson's ratio in polymer gels. Journal of Applied Polymer Science. 50, 1107-1111 (1993).
- Belyy, A., Merino, F., Sitsel, O., Raunser, S. Structure of the Lifeact-F-actin complex. PLoS Biology. 18, 3000925 (2020).
- Flores, L. R., Keeling, M. C., Zhang, X., Sliogeryte, K., Gavara, N. Lifeact-GFP alters F-actin organization, cellular morphology and biophysical behaviour. Scientific Reports. 9, 3241 (2019).
- Kumari, A., Kesarwani, S., Javoor, M. G., Vinothkumar, K. R., Sirajuddin, M. Structural insights into actin filament recognition by commonly used cellular actin markers. EMBO Journal. 39, 104006 (2020).
- du Roure, O., et al. Force mapping in epithelial cell migration. Proceedings of the National Academy of Sciences of the United States of America. 102, 2390-2395 (2005).
- Grashoff, C., et al. Measuring mechanical tension across vinculin reveals regulation of focal adhesion dynamics. Nature. 466, 263-266 (2010).
- Koch, D., Rosoff, W. J., Jiang, J., Geller, H. M., Urbach, J. S. Strength in the periphery: growth cone biomechanics and substrate rigidity response in peripheral and central nervous system neurons. Biophysical Journal. 102 (3), 452-460 (2012).
- Barnes, J. M., Przybyla, L., Weaver, V. M. Tissue mechanics regulate brain development, homeostasis and disease. Journal of Cell Science. 130, 71-82 (2017).
- Moore, S. W., Roca-Cusachs, P., Sheetz, M. P. Stretchy proteins on stretchy substrates: the important elements of integrin-mediated rigidity sensing. Developmental Cell. 19, 194-206 (2010).
- Tyler, W. J. The mechanobiology of brain function. Nature Reviews Neuroscience. 13, 867-878 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유