Method Article
ניתוחים של אקטין דינמיקה, מצמד צימוד וכוח המתיחה לקידום קונוס צמיחה
In This Article
Summary
כדי להתקדם, קונוסים צמיחה חייבים להפעיל כוחות משיכה נגד הסביבה החיצונית. דור כוחות המתיחה תלוי בדינמיקת אקטין ובצימוד מצמד. המחקר הנוכחי מתאר שיטות לניתוח דינמיקת אקטין, צימוד מצמד וכוחות משיכה להתקדמות חרוט הצמיחה.
Abstract
כדי ליצור רשתות פונקציונליות, נוירונים חייבים לעבור ליעדים המתאימים שלהם ולאחר מכן להרחיב אקסונים לכיוון תאי היעד שלהם. תהליכים אלה תלויים בהתקדמות של קונוסים צמיחה הממוקמים בקצות הנוריטים. קונוסים לצמיחה אקסונית מייצרים כוחות מניעים על ידי חישת המיקרו-סביבה המקומית שלהם ואפנת הדינמיקה של הציטוסד וצימוך הידבקות אקטין (צימוד מצמד). עשרות שנים של מחקר הובילו לזיהוי מולקולות הדרכה, הקולטנים שלהן, ומפלי איתות במורד הזרם לוויסות הגירה עצבית והדרכה אקסונית; עם זאת, המכונות המולקולריות הנדרשות ליצירת כוחות כדי להניע התקדמות חרוט צמיחה וניווט רק מתחילים להיות מנוכרים. בקצה המוביל של קונוסים צמיחה עצביים, חוטי actin לעבור זרימה מדרדרת, אשר מופעל על ידי אקטין פילמור והתכווצות actomyosin. צימוד מצמד בין זרימת F-actin מדרדרת ומצע דבק מייצר כוחות אחיזה להתקדמות חרוט צמיחה. המחקר הנוכחי מתאר פרוטוקול מפורט לניטור זרימת F-actin מדרדרת על ידי הדמיית כתמים יחיד. חשוב לציין, בשילוב עם סמן F-actin Lifeact, טכניקה זו יכולה לכמת 1) את קצב פילמור F-actin ו 2) את יעילות צימוד המצמד בין זרימת F-actin מדרדרת ואת המצע דבק. שניהם משתנים קריטיים ליצירת כוחות להתקדמות ולניווט חרוט הצמיחה. בנוסף, המחקר הנוכחי מתאר פרוטוקול מפורט של מיקרוסקופיית כוח המתיחה, אשר יכול לכמת 3) כוח המתיחה שנוצר על ידי קונוסים צמיחה. לכן, על ידי צימוד הניתוחים של הדמיה כתמים יחיד מיקרוסקופיה כוח המתיחה, החוקרים יכולים לפקח על המכניקה המולקולרית שבביס קונוס הצמיחה מראש וניווט.
Introduction
במוח החולייתי המתפתח, נוירונים עוברים נדידות מאורגנות בקפידה ומקרין אקסונים לעבר שותפים סינפטיים מתאימים כדי להקים רשתות עצביות פונקציונליות1,2,3. קונוסים צמיחה, שהם מבנים חושיים ורגשיים הממוקמים בקצה הנוריטים, קובעים את המהירות והכיוון של הגירה עצבית וצמיחת האקסון 3,4,5. מאחר שתנורות עצב מוקפים בסביבות צפופות, קונוסים לצמיחה חייבים להפעיל כוחות נגד סביבתם כדי להתקדם 6,7. כדי להבין את המנגנונים שבבית הגירה עצבית והדרכה אקסונית, ניתוחים של המכניקה המולקולרית לקידום חרוט צמיחה הם חיוניים.
עשרות שנים של ניתוח גילו כי כוח המתיחה כדי להניע התקדמות חרוט צמיחה נוצר על ידי מנגנון "מצמד"; מנגנון זה נחשב לתפקד לא רק חרוט הצמיחה האקסוני אלא גם קונוס הצמיחה המוביל של נוירונים נודדים8,9,10,11,12. כלומר, חוטי actin (F-actins) בקונוסים צמיחה פילמור בקצה המוביל depolymerize בקרבת מקום, דוחף את הממברנה המובילה13,14,15. הכוח שנוצר, בשילוב עם התכווצות actomyosin, גורמת לתנועה אחורית של F-actins הנקרא זרימה מדרדרת7,11,16,17,18,19,20,21. מולקולות הדבקת מצמד ותאים מתייכות צימוד מכני בין זרימת F-actin מדרדרת לבין המצע הדביק ומעבירות את כוח זרימת F-actin אל המצע, ובכך יוצרות כוח משיכה לקידום חרוט הצמיחה7,8,9,11,12,22 . במקביל, צימוד המצע המעשי מפחית את מהירות זרימת ה-F-actin וממיר פילמור אקטין לכוח כדי לבלוט את הממברנה המובילה9,10.
קונוסים לצמיחה אקסונית חשים רמזים כימיים מקומיים ומעבירים אותם לכוח מניע כיווני לניווט חרוט צמיחה3,23,24,25. לדוגמה, מולקולת הנחיית אקסון netrin-1 מגרה את הקולטן שלה נמחק בסרטן המעי הגס (DCC), ומפעילה את טריפוספט הרו גואנוסין טריפוספט (GTP) מחייב חלבונים חלוקת תאים לשלוט חלבון 42 (Cdc42) וראס הקשורים C3 botulinum רעלן מצע 1 (Rac1), ואת קינאז p21-מופעל במורד הזרם שלהם 1 (Pak1)26. CDC42 ו Rac1 לקדם 1) פילמור אקטין, ו Pak1 זרחן יורה מולקולת מצמד shootin122,26. Shootin1 אינטראקציה עם זרימת מדרדר F-actin באמצעות קורטקטין חלבון מחייב אקטין27. Shootin1 גם אינטראקציה עם מולקולת הידבקות תא L1 (L1-CAM)20,24. זרחן Shootin1 מגביר את הזיקה המחייבת לקורטקטין ו- L1-CAM, ומשפר צימוד מצמד 24,27 בתיווך shootin124,27. בתוך חרוט הצמיחה, הפעלות אסימטריות של פילמור אקטין וצימוד מצמד מגדילות 3) כוח משיכה בצד המקור של netrin-1, ובכך יוצרות כוח מניע כיווני עבור סיבוב חרוט צמיחה (איור 1)24. מחקר אינטנסיבי בעשורים האחרונים בכל הנוגע להנחיית הגירה עצבית ואקסון שיפר את ההבנה של מולקולות הנחיה, הקולטנים שלהן, ומפל איתות במורד הזרם2,10,28,29,30. עם זאת, המכונות המולקולריות כדי ליצור כוחות להתקדמות חרוט צמיחה רק מתחילים להיות מנוכרים; ניתן לייחס זאת לשימוש המוגבל בפרוטוקולים עבור ניתוחים מכנוביולוגיים.
המחקר הנוכחי מתאר פרוטוקול מפורט לניטור זרימת F-actin מדרדרת על ידי הדמיית כתמים יחיד16,18. ניטור זרימת F-actin מדרדרת בוצע בהרחבה באמצעות מיקרוסקופיה ברזולוציה סופר, מיקרוסקופיה קונפוקלית של דיסק מסתובב ומיקרוסקופיה פלואורסצנטית של הפרעות סה"כ (TIRF)25,31,32,33,34,35,36,37,38 . הפרוטוקול במחקר הנוכחי, לעומת זאת, משתמש במיקרוסקופ אפיפלואורסצנטי סטנדרטי ולכן ניתן לאימוץ בקלות11,16,18,20,22,23,24,27,39,40,41,42. בשילוב עם תיוג F-actin על ידי Lifeact43, הדמיית כתמים יחיד מאפשר כימות של קצב פילמור actin ואת יעילות צימוד מצמד בין זרימת F-actin מדרדר ואת מצע דבק39,42. המחקר הנוכחי מתאר עוד פרוטוקול מפורט של מיקרוסקופיה כוח המתיחה באמצעות ג'ל פוליאקרילמיד מוטבע חרוזים פלואורסצנטי (PAA)11,22,23,24,27,39,41,42,44. שיטה זו מזהה וממתמת כוח משיכה מתחת לקונוס הצמיחה על ידי ניטור תנועות חרוזים הנגרמות בכוח44,45. קוד ניתוח כוח המתיחה בקוד פתוח מסופק, והשיטה לכימות כוח המתיחה במהלך נדידת חרוט הצמיחה מוסברת בפירוט. בעזרת הדמיית כתמים יחיד ומיקרוסקופיית כוח המתיחה, הבנת המכניקה המולקולרית שבבית נדידת חרוט הצמיחה וניווט תקל. טכניקות אלה ישימות גם לניתוח המכניקה המולקולרית שבבקע הגדלת עמוד השדרה הדנדריטי, הידועה כחשובה בלמידה ובזיכרון42.
Protocol
כל הניסויים באמצעות חיות מעבדה בוצעו עם הוועדה המוסדית לטיפול בבעלי חיים ושימוש במכון נארה למדע וטכנולוגיה. על החוקרים לפעול על פי הנחיות שנקבעו על ידי הוועדות המוסדיות והלאומיות שלהם לפיקוח על בעלי חיים לטיפול ושימוש בחיות מעבדה.
1. הכנת פתרונות ומדיה
- הכנת הפתרונות ומדיית התרבות כפי שמסוכמים בקובץ 1 המשלים
2. הכנת מצעים מצופים פולי-די-ליסין (PDL)/למינין
- יש מעיל במנות תחתית זכוכית בקוטר 14 מ"מ עם PDL בקוטר 100 מיקרוגרם/מ"ל, מומסות מלוחות פוספט (PBS, pH 7.4), ודגרה למשך הלילה באינקובטור לח ב-37 מעלות צלזיוס.
הערה: אין לייבש את משטחי הזכוכית לאחר שלב זה - הסר את פתרון PDL ואת פיפטה 1 מ"ל של PBS על הזכוכית עבור 10 s שלוש פעמים.
- מצפים את הכלים עם למינין 5 מיקרוגרם / mL, מומס PBS, ודגרה ללילה באינקובטור לח ב 37 °C (5 °F).
- הסר את פתרון למינין ו pipette 1 מ"ל של PBS על הזכוכית עבור 10 s שלוש פעמים.
- הסר את PBS ומניחים 0.5 מ"ל של מדיום neurobasal על משטחי הזכוכית. לאחסן את הכלים בחממה לחה ב 37 °C (50 °F).
הערה: ניתן לאחסן כלים מצופים PDL/למינין למשך 2-3 ימים בחממה לחה ב-37 מעלות צלזיוס.
3. ניתוח וניתוק של ההיפוקמפוס
- המתת חסד עכבר בהריון על ידי נקע צוואר הרחם.
הערה: המחקר הנוכחי משתמש בעכברים הזמינים מסחרית (ראה טבלת חומרים). חוקרים צריכים להשתמש בעכברים שגודלו ומטופלים בצורה הומאנית בסביבה מעוקרת. - לנתח עוברי עכבר יום-16 (E16) עוברי יום,ולהניח אותם על קרח.
- במכסה המנוע של זרימה למינארית, מנתחים את המוח עם מספריים ומניחים אותם על צלחת סטרילית של 10 ס"מ המכילה 10 מ"ל של תמיסת ניתוח קרה כקרח.
- בעזרת מיקרוסקופ סטריאו ניתוח, לקלף בזהירות את קרום המוח של האונה המוחית ולאחר מכן לנתח את ההיפוקמפי באמצעות מלקחיים.
- העבר את ההיפוקמפי לתוך 5 מ"ל של פתרון עיכול קר כקרח בצינור 15 מ"ל. לדגור על ההיפוקמפי באמבט מים במשך 20 דקות ב 37 °C (50 °F).
- הסר את פתרון העיכול ולהוסיף 3 מ"ל של פתרון ביתור.
- בעדינות pipette ההיפוקמפי ארבע פעמים עם פיפטה פסטר.
- לדגור על ההיפוקמפי באמבט מים במשך 20 דקות ב 37 °C (50 °F).
- העבר את ההשעיה התאית לתוך צינור צנטריפוגה 50 מ"ל. הוסף 3 מ"ל של פתרון ניתוח חדש לרקמה הלא ממושמעת.
- חזור על שלבים 3.7-3.9 עד ההיפוקמפי מנותק לחלוטין.
- הסר את האגרגטים הצפים של DNA מן השעיית התא על ידי הסתחררות ושאיפה עם פיפטה פסטר. צנטריפוגה השעיית התא ב 180 x g במשך 20 דקות ב 4 °C (70 °F).
הערה: DNA הנגזר מתאים פגומים יפריע לתהליך צנטריפוגה. אם נוירונים נשארים בסופרננט, צנטריפוגה השעיית התא שוב לאחר הסרת ה- DNA בזהירות. - מדיום עצבי שיווי משקל המכיל 10% סרום בקר עוברי (FBS), פניצילין (100 U/mL) וסטרפטומיצין (100 מיקרוגרם/מ"ל) באינקובטור לח ב-37 °C עם 5% CO2.
4. נוירונים טרנספקטיים ופולחנים
- הסר את supernatant ולהוסיף 5 מ"ל של PBS קר כקרח לתוך צינור 50 mL. resuspend גלולה התא על ידי pipetting עדין.
- העבר 10 μL של השעיית התא לתוך צינור microcentrifuge, להוסיף 10 μL של פתרון כחול טריפן 0.5%, ולאחר מכן לספור את מספר התאים עם hemocytometer.
- צנטריפוגה השעיית התא בצינור 50 מ"ל ב 180 x g במשך 20 דקות ב 4 °C (5 °F).
- בינתיים, aliquot עבור transfection, 1 מיקרוגרם של pFN21A-HaloTag-actin ו 3 מיקרוגרם של pmNeonGreen-N1-Lifeact לכל 1 x 106 תאים, לתוך צינור microcentrifuge.
- לאחר צנטריפוגה, להסיר את supernatant ולהוסיף 100 μL של אלקטרופורציה מדיום (מסופק על ידי ערכת transfection) לתוך צינור 50 מ"ל. resuspend גלולה התא על ידי pipetting.
- מערבבים את מתלה התא עם תמיסת ה- DNA aliquoted ומעבירים את התערובת לקובט (המסופק על ידי ערכת transfection).
הערה: מכיוון שבועות אוויר מפריעות לאלקטרופורציה, הסר אותן מההשעיה של התא. - הכנס את cuvette לתוך מנגנון אלקטרופורציה (טבלה של חומרים), ולבצע אלקטרופורציה באמצעות תוכנית O-005.
- מיד להוסיף 1 מ"ל של מדיום neurobasal התחמם מראש מכויל המכיל 10% FBS, פניצילין (100 U / ML), וסטרפטומיצין (100 מיקרוגרם / מ"ל) ל cuvette.
- העבר את מתלה התא לצינור צנטריפוגה 15 מ"ל באמצעות pipette פלסטיק (מסופק על ידי ערכת עירוי).
- העבר 10 μL של השעיית התא לתוך microtube, להוסיף 10 μL של 0.5% פתרון כחול טריפן, ולאחר מכן לספור את מספר התאים עם hemocytometer.
- מוציאים את מנות התחתית מצופות PDL/למינין מהאינקובטור ומסירים את המדיום העצבי-באלי.
- Pipette 0.5 מ"ל של השעיית התא המכיל 2.0 x 105 תאים לצלחת ודגרה באינקובטור לח ב 37 °C (5% CO2 עבור 3 שעות.
- החלף את המדיום עם 0.5 מ"ל של בינוני neurobasal המכיל 2% B-27 תוספת, גלוטמין (1 מ"מ), פניצילין (100 U / ML), וסטרפטומיצין (100 מיקרוגרם / מ"ל). תרבות הנוירונים באינקובטור לח במשך 3 ימים ב 37 °C (5% CO2.
5. הדמיית כתמים יחיד בקונוסים צמיחה עצביים
- ביום במבחנה (DIV) 3, לטפל הנוירונים עם ליגנד tetramethyl-רודמין (TMR) בדילול של 1:2000 דילול במדיום תרבות. לשמור על הנוירונים במשך 1 שעות ב 37 °C (5% CO2.
- לשטוף את ליגנד TMR שלוש פעמים עם PBS מחומם מראש.
- הסר PBS ופיפטה 0.5 מ"ל של מדיום L-15 מחומם של ליבוביץ המכיל 2% B-27 תוספת, גלוטמין (1 מ"מ), פניצילין (100 U/mL) וסטרפטומיצין (100 מיקרוגרם / מ"ל).
- לשמור על נוירונים במשך 1 שעות ב 37 °C (50 °F).
- הפעל מיקרוסקופ אפיפלואורסצנטיות והגדר את החממה העליונה ל-37 מעלות צלזיוס.
הערה: הפרוטוקול הנוכחי משתמש במיקרוסקופ אפיפלואורסצנטי המצויד במצלמת מוליך למחצה משלימה של תחמוצת מתכת, עדשה אובייקטיבית לטבילת שמן 100x/1.40 NA, מנורת כספית ותוכנה לרכישת תמונות (ראה טבלה של חומרים). מיקרוסקופים אפיפלואורסצנטיים אחרים עם מפרטים שווים עשויים לשמש גם לניתוח זה. - הניחו את הנוירונים שטופלו בליגנד TMR בצלחת התחתונה של הכוס על החממה המחמם.
- הגדר את הפרמטרים לרכישת תמונה כדלקמן: זמן חשיפה, 500 ms עבור Lifeact ו- HaloTag-actin ערוצי פלואורסצנטי; binning, 1 x 1 (0.065 מיקרומטר × 0.065 מיקרומטר לפיקסל); מרווח זמן, 3 שניות; משך זמן, 50 פריימים.
- בחר קונוס צמיחה שמבטא בחוזקה את Lifeact ומבטא חלש את HaloTag-actin.
הערה: ביטוי Lifeact צריך להיות חזק מספיק כדי לדמיין מורפולוגיה קונוס צמיחה. ביטוי HaloTag-actin צריך להיות חלש מספיק כדי להיות מזוהה (איור 2A). ניתן להתאים את רמות ביטויי החלבון הפלואורסצנטיים על ידי שינוי כמות הדנ"א לטרנספקטיון. - סגור את שדה הסרעפת כדי להאיר שטח מינימלי הכולל את חרוט הצמיחה (איור 2B).
הערה: התאורה של אזור מינימלי מפחיתה את אות הרקע ומגבירה את אות הפלואורסצנטיות לרעש (S/N), ומאפשרת זיהוי כתמי אקטין (איור 2B). כדי להגדיל עוד יותר את יחס ה- S/N, מומלץ להאיר את חרוט הצמיחה מבלי להפחית את האור על ידי מסנני צפיפות ניטרליים. - השג תמונות בזמן לשגות (קובץ משלים 2). שמור כתמונת מחסנית זמן רב-ערוצית (תבנית tiff).
6. כימות של מהירות זרימת F-actin וקצב פילמור באמצעות תוכנת עיבוד וניתוח תמונה פיג'י
הערה: עיין בקובץ 3 משלים לקבלת נתוני תרגול לכימות מהירות זרימת F-actin וקצב פילמור אקטין.
- פתח את תמונת מחסנית הזמן הרב-ערוצית בפיג'י.
- בחרו 'נתח > קבעו קנה מידה' והגדירו את גודל הפיקסלים של התמונות.
- מצא כתם אקטין שזורם בנסיגה למינימום של חמש מסגרות זמן בתוך חבילת F-actin בפילופודיה או lamellipodia.
- בחרו 'תמונה > שינוי צורה > סיבוב' והתאמו את זווית התמונות כך שחבילה F-actin תצביע כלפי מעלה (איור 3A).
- לחצו על 'מלבן ' בסרגל הכלים, ושרטטו תיבה הכוללת כתמי אקטין ואת קצה חבילת ה-F-actin (איור 3B, 1 ו-2).
הערה: האותות של כתמי HaloTag-actin חלשים. בנוסף, אותות Lifeact בקצה הדיסטלי של חרוט הצמיחה חלשים וקלושים (איור 2B) מכיוון שהקצוות הדיסטליים של חרוט הצמיחה דקים בהשוואה לחלק הפרוקסימלי. החוקרים צריכים לשפר את האותות כדי לייעל את הכימותים של מהירות זרימת F-actin וקצב פילמור (איור 3B). למרות שהאות Lifeact בקונוס הצמיחה הפרוקסימלי הופך לרווי, הדבר לא יפריע לקביעת הסוף הדיסטלי של F-actins (איור 3E, קו צהוב). - בחרו 'תמונה > שכפלו' והכניסו את חמש מסגרות הזמן (איור 3B, 3.5).
- בחר תמונה > ערימות > הפוך מונטאז', והזן את הפרמטרים: עמודות, 5; שורות, 1; גורם קנה מידה, 1.
- לחץ על אישור. מונטאז' התמונה יופיע על המסך.
- בחרו 'תמונה > צבע > ערוצים מפוצלים'. זה מפריד בין שני ערוצי הפלואורסצנטיים.
- כימות של מהירות זרימת F-actin.
- בחרו 'נתח >'קבעו מדידות' ובחרו 'אזור' ו'מלבן תוחם'.
- לחצו על אליפסה בסרגל הכלים וציירו עיגול על כתם אקטין (איור 3C, 1 ו-2).
- בחרו 'כיסוי תמונה >' > להוסיף בחירה. העיגול מכוסה במונטאז' התמונה (איור 3C, 3 ו-4).
הערה: ניתן לשנות את צבע שכבת העל ב'עריכת אפשרויות > > צבעים'. - חזור על כיסוי העיגולים עבור הכתמים הנותרים (איור 3C, 5).
הערה: כדי לקבוע במדויק את מרכזי הכתם של אקטין, החוקרים צריכים לכסות עיגולים על כתמים. - לחצו על 'ישר ' בסרגל הכלים ושרטטו קו המקשר בין מרכזי העיגולים (איור 3D, 1 ו-2).
- בחר ניתוח > מידה. התוצאה תופיע על המסך (איור 3D, 3).
הערה: הגובה המוצג בתוצאה מציין את מרחק ההקצאה של כתמי האקטין במהלך התצפית (איור 3D, 3). - חשב את מהירות זרימת ה-F-actin על-ידי חלוקת מרחק ההקצאה לפי זמן התצפית.
- כימות של שיעור פילמור F-actin.
- צייר קו המקשר בין קצות חבילת F-actin (איור 3E, 1).
- בחר ניתוח > מידה. התוצאה תופיע על המסך (איור 3E, 2).
הערה: הגובה בתוצאה מציין את אורך ההרחבה של חבילת F-actin במהלך התצפית (איור 3E, 2). - חשב את קצב ההרחבה F-actin על-ידי חלוקת אורך ההרחבה לפי זמן התצפית.
- חשב את קצב פילמור ה-F-actin כסכום מהירות זרימת ה-F-actin וקצב ההרחבה (איור 3F).
7. הכנת ג'ל PAA למיקרוסקופיה כוח המתיחה ותרביות נוירונים
- הכנת ג'לים PAA הנדרשים למיקרוסקופיה של כוח המתיחה (איור 4)
- פיפטה 0.5 מ"ל של NaOH (100 מ"מ), מומסת ב- H2O מזוקק, על מנות בתחתית זכוכית בקוטר 27 מ"מ, ודגרה במשך 15 דקות בטמפרטורת החדר (RT).
- הוסיפו 50 μL של 3-אמינופרופילטרימתיוקסילאן (APTMS) לתמיסת NaOH על הכלים וערבבו את הפתרונות על ידי צנרת עדינה, ודגרה במשך 15 דקות ב- RT.
- לשטוף את הכלים בתחתית זכוכית עם H2O מזוקק, ויבש.
- פיפטה 0.5 מ"ל של תמיסת גלוטרלדהיד 0.5%, מומסת ב-PBS, בצלחת התחתית של הכוס שטופלה ב-APTMS, ודגרה במשך 30 דקות ב-RT.
- לשטוף את הכלים בתחתית זכוכית עם H2O מזוקק ויבש.
- הכן פתרון המכיל H2O מזוקק (412 μL), 30% (w/v) פתרון אקרילאמיד (63 μL), 2.5% (w/v) פתרון ביס-אקרילאמיד (6 μL) ומיקרוספירה מותאמת קרבוקסילאט (חרוזים פלואורסצנטיים) פתרון (20 μL).
הערה: מערבולת פתרון חרוזים פלואורסצנטי לנתק חרוזים מצטברים לפני הוספת פתרון אקרילאמיד. - Degas הפתרון בתא ואקום במשך 30 דקות ב RT.
- לפתרון זה, להוסיף 1 μL של 10% (w / v) אמוניום פרסולפט (APS), מומס H2O מזוקק, ו 1 μL של N,N,N,N', N'-tetramethyl אתילנדיאמין (TEMED), ומערבבים על ידי pipetting עדין.
- מניחים כיסוי זכוכית (קוטר 18 מ"מ) על מכסה צינור צנטריפוגה 15 מ"ל.
- מיד להוסיף 25 μL של הפתרון כדי כיסוי, ולאחר מכן בעדינות למקם צלחת זכוכית הפוכה בתחתית על כיסוי. אפשר אקרילאמיד פולימר במשך 1 שעה ב RT.
- יש למרוח H2O מזוקק על כיסוי ולקלף אותו מהג'ל באמצעות מחט מזרק עם קצה כפוף.
- הסר H2O ולהוסיף סולפו-SANPAH (1 מ"מ), מומס PBS, לג'ל.
- בתנאים סטריליים, לחשוף את הג'לים לאור אולטרה סגול במשך 5 דקות. לשטוף את הג'ל שלוש פעמים עם PBS במשך 15 דקות לכביסה.
- קביעת קשיחות ג'ל בשיטת כניסה מיקרוספירית (איור 5A)44.
- מעבירים מיקרוספירה שצוינה לקוטר ולצפיפות, לג'ל ולאחר מכן מניחים אותה על שלב הדגימה של מיקרוסקופ קונפוקלי סורק לייזר.
- התמקדו במשטח הג'ל ורשמו את מיקום ה-z (איור 5B).
- באופן דומה, התמקדו בתחתית המיקרוספירה ורשמו את מיקום ה-z (איור 5C).
- חשב את עומק הכניסה כפי שנקבע על-ידי ההבדל בין מיקומי z של משטח הג'ל לתחתית המיקרוספירה.
- חשב מודולוס E של יאנג של הג'ל על ידי:
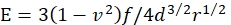
כאשר f הוא המשקל המתוקן של המיקרוספירה, d הוא עומק הכניסה של הג'ל, r הוא הרדיוס של המיקרוספירה, ו - v הוא היחס של פואסון (שערכו הוא 0.3, כפי שנקבע קודם לכן46).
- מצפים את הג'לים ב-PDL ולמינין כמתואר בסעיף 2.
- כפי שתואר בסעיפים 3 ו-4, ניתחו עוברי עכבר E16, ניתחו היפוקמפי ועבירו 5 מיקרוגרם של pEGFP-C1 לכל 1.0 x 106 תאים. זרע 2.0 x 105 תאים על ג'לים מצופים PDL/למינין.
הערה: לניתוח כוח המתיחה, הדמיה מיקרוסקופית של תאים בעלי תווית פלואורסצנטית נחוצה לקביעת אזור חרוט הצמיחה.
8. מיקרוסקופיה כוח המתיחה בקונוסים גדילה עצביים
- ב- DIV3, החליפו את מדיום התרבות ב-0.5 מ"ל של מדיום L-15 מחומם של ליבוביץ המכיל 2% תוספת B-27, גלוטמין (1 מ"מ), פניצילין (100 U/mL) וסטרפטומיצין (100 מיקרוגרם/מ"ל). לשמור על הנוירונים במשך 1 שעות ב 37 °C (50 °F).
- הפעל מיקרוסקופ קונפוקלי סריקת לייזר והגדר את החממה העליונה על הבמה ל 37 °C (7 °F).
הערה: המחקר הנוכחי משתמש במיקרוסקופ קונפוקל סריקת לייזר המצויד בעדשה אובייקטיבית טבילת מים 63x/1.2 NA ותוכנה לרכישת תמונה וניתוח (ראה טבלה של חומרים). - מניחים את הנוירונים בצלחת התחתונה של הכוס על החממה המחמם מראש.
- הגדר את הפרמטרים של רכישת תמונה באופן הבא: גודל סריקה, 512 × 512 פיקסלים; אזור סריקה, זום 1.5-3x; מהירות סריקה, ~1 s לכל מסגרת; אורך גל לייזר, 561 ננומטר (אורך גל העירור עבור החרוזים הפלואורסצנטיים) ו-488 ננומטר (אורך גל העירור לחלבון פלואורסצנטי ירוק משופר (EGFP)); מרווח זמן, 3 שניות; משך זמן, 50 פריימים.
- כדי לדמיין את מורפולוגיית קונוס הצמיחה, בחר קונוס צמיחה המבטא מאוד EGFP.
- התמקדו במשטח הג'ל ורכשו תמונות של זמן לשגות (איור 6A וקובץ משלים 4).
הערה: לניתוח המתיחה, מומלץ להשתמש בשני ערוצים פלואורסצנטיים (עבור חרוזים פלואורסצנטיים ו- EGFP) וערוץ שדה בהיר (לכידת ניגודיות הפרעה דיפרנציאלית (DIC) או תמונות חדות פאזה מומלץ). - השתמש בתוכנת עיבוד תמונה (למשל, פיג'י) כדי להפיק ערימות תמונת RGB חד-ערוציות ושמור תמונות אלה כקבצי תיפוך.
הערה: זה קריטי כי החוקרים גם לשמור את הנתונים הגולמיים. - יש למרוח 100 מיקרו-אל של 10% (w/v) נתרן דודסיל סולפט (SDS), המומס ב-H2O מזוקק, על מנת התחתונה של הכוס כדי להרפות את מצע הג'ל על ידי שחרור תאי עצב מהמצע. לדגור על המנה במשך 5 דקות ב 37°C כדי לייצב את הטמפרטורה.
הערה: התמונה של החרוזים במצע לא מאומן משמשת להפניה לעמדות החרוזים המקוריות במהלך ניתוח כוח המתיחה (איור 6C). יישום של פתרון SDS משנה את עמדות xyz עקב שינוי תרמי באינקובטור והרפיה של עיוות המושרה בתא. החוקרים, אם כן, צריכים לתקן את המישור מוקד ואת מיקום x-y. - התמקדו במשטח הג'ל, ורכשו תמונה של החרוזים במצע הלא מאומן (איור 6B).
- הפק תמונת RGB של ערוץ יחיד של החרוזים במצע הלא מאומן ושמור תמונה זו כקובץ tiff.
- תיקון מיקום ה- x-y של תמונת החרוזים במצע הלא מאומן באמצעות פיג'י
- בפיג'י, פתחו את תמונת החרוזים במצע הלא מאומן ואת תמונת הערימה של חרוזים פלואורסצנטיים.
- בחר > כלים > > של > תמונה. על המסך תופיע תיבת דו-שיח (איור 7A, 1).
- בחרו בתמונת החרוזים במצע הלא מאומן ובתמונת הערימה של חרוזי הפלורסצנט ב-Image1 וב-Image2, בהתאמה (איור 7A, 2).
- לחץ על אישור. תמונת החרוזים במצע הלא מאומן מתווספת לתמונת הערימה של זמן ההפסקה (איור 7A, 3).
- באמצעות פס הגלילה (איור 7B, 1, מסגרת אדומה), הצג את המסגרת השנייה של תמונת הערימה (חץ אדום).
- בחר תוספים > StackReg (איור 7B, 2). על המסך תופיע תיבת דו-שיח (איור 7B, 3).
- בחרו ' גוף קשיח' מהרשימה הנפתחת (איור 7B, 3, מסגרת אדומה) ולחצו על 'אישור'. לאחר מכן מתחיל התיקון של מיקום ה- x-y.
- השתמש בפס הגלילה כדי להציג את המסגרת הראשונה של תמונת הערימה המתוקנת על-ידי מיקום x-y.
- בחר תמונה > כפול (איור 7C, 1). על המסך תופיע תיבת דו-שיח (איור 7B, 2).
- קלט 1 בטווח, בטל את הבחירה באפשרות 'מחסנית כפולה' (איור 7C, 2) ולחץ על הלחצן 'אשר'. תמונת החרוזים המתוקנת במיקום x-y במצע הלא מאומן תופיע על המסך (איור 7C, 3). שמור תמונה זו כקובץ tiff.
- כימות כוח המתיחה
הערה: השיטה המתוארת כאן לניתוח כוח המתיחה משתמשת ב- MATLAB ובשני ארגזי כלים של MATLAB, 'ארגז כלים לעיבוד תמונה' ו'ארגז כלים למחשוב מקביל '. החוקרים יצטרכו להתקין אותם לפני הניתוח. קוד ניתוח כוח המתיחה פותח על בסיס גרסת MATLAB 2018a. לכן, יש להשתמש בגירסת MATLAB 2018a (או גירסה מתקדמת יותר) עבור הניתוח. האלגוריתמים ששימשו לניתוח כוח משיכה תוארו בעבר22.- הורד את כוח המתיחה ניתוח קוד TFM2021 מקובץ משלים 5. פתח את TFM 2021 במטלב
- פתח ראשי.m ב- TFM2021 והפעל אותו. ממשק משתמש גרפי (GUI) יופיע על המסך (איור 8A).
- לחצו על 'טען תמונת מצע לא מאומנת' ובחרו בתמונת החרוזים המתוקנת במיקום x-y במצע לא מאומן.
- לחץ על טען תמונות חרוזים פלואורסצנטי ובחר את תמונת הערימה של חרוזים.
- לחץ על טען תמונות של שדות בהירים ובחר את תמונת הערימה של שדה בהיר.
- לחץ על טען תמונות GFP ובחר את תמונת מחסנית זמן לשגות של EGFP.
- בחר GFP מהרשימה הנפתחת בתיבה הנפתחת GUI (איור 8A, תיבה אדומה).
- לחץ על החזר על החזר על ההשערה כדי לציין את אזור המלבן של עניין (ROI), כולל חרוט הצמיחה, על ידי לחיצה על שתי נקודות בתמונת התא המוצגת ב- GUI (איור 8B).
- לחץ על לחצן שמור ב- GUI (איור 8A, חץ אדום). תמונות המחסנית שנבחרו, יחד עם ה- ROI, יישמרו בקובץ .mat (קובץ תבנית MATLAB).
- לחץ על זיהוי ספוט. על המסך תופיע תיבת דו-שיח.
- הזן ערך (בדרך כלל 50-150) בתיבת הדו-שיח כדי לקבוע סף לזיהוי חרוזים. לחיצה על אישור מתחילה את החישוב.
- לאחר סיום החישוב, לחץ על רצועת התוויה כדי להגדיל את האזור שנבחר בשלב 8.12.8 ולהציג את החרוזים שזוהו כנקודות לבנות (איור 8C, 1).
הערה: אשר אם זיהוי חרוזים (נקודות לבנות) חופף לחרוזים הפלואורסצנטיים. זיהוי חרוזים עשוי גם לזהות רעשי רקע. כדי להפחית הפרעה חיצונית זו, שנה את ערך הסף ב-Spot detect. בנוסף, בחר באופן ידני את הנקודות הנכונות בשלב 8.12.13. - לחץ על בחר חרוזים, ותיחום אזור מצולע הכולל את הנקודות הנכונות מתחת לקונוס הצמיחה. הקש Enter בלוח המקשים. הנקודות הלבנות בתוך אזור המצולעים ישתנו לצבע אדום (איור 8C, 2).
- לחץ על כוח הערכה ב- GUI. לאחר מכן, ערכי קלט עבור הפרמטרים הבאים: גודל פיקסל, μm /פיקסל; מודולוס של יאנג, הערך המחושב בשלב 7.2.5; היחס של פואסון, 0.3.
- בצע כוח הערכה כדי לאתחל את החישוב. התוכנה תשמור את תוצאות החישוב בקובץ תבנית גיליון אלקטרוני באופן אוטומטי.
הערה: הגיליון האלקטרוני מציג את רכיב ה-x, רכיב ה- y וגודל הכוח בכל מסגרת זמן (איור 8D). עיין בקובץ 6 המשלים לקבלת נתוני תרגול לכימות כוח המתיחה.
תוצאות
הדמיית כתמים יחיד לכימות קצב פילמור אקטין ויעילות צימוד מצמד
ביטוי Lifeact גבוה מאפשר הדמיה F-actin בתוך חרוט הצמיחה; ביטוי HaloTag-actin נמוך מאפשר ניטור של זרימת F-actin מדרדרת (איור 3, קובץ משלים 2). מעקב אחר כתמי האקטין מאפשר מדידה של מהירות זרימת F-actin (איור 3C,D). מכיוון שהצימוד המכני של זרימת F-actin מדרדרת והמצע הדבק מפחית את מהירות זרימת F-actin, ניתן להעריך את יעילות צימוד המצמד מהמהירות. יתר על כן, תיוג F-actin עם Lifeact מסייע להדמיה של הרחבת F-actin והוא שימושי לכימות קצב פילמור אקטין (איור 3E,F).
ניתוח כמותי של כוח המתיחה
הקפדה על המתודולוגיה המוצגת כאן תחשוף את תנועותיהם של חרוזי פלואורסצנטיות מתחת לקונוס הצמיחה (איור 6C, קובץ משלים 4). זרימת מדרדר F-actin על המצע מייצר כוח משיכה גורם חרוזים פלואורסצנטי לנוע לאחור תחת חרוט הצמיחה. קוד ניתוח כוח המתיחה מעריך כוח משיכה מפני תזוזת חרוזים פלואורסצנטית, ומבטא את כוח המתיחה המחושב כווקטור כוח. הכיוון והגודל של כוח המתיחה נקבעים מרכיבי x ו- y של וקטור הכוח (איור 8C, D). התיבה האדומה באיור 8D מייצגת את רכיבי ה- x וה- y של וקטור כוח; איור 8C מתאר את חרוט הצמיחה המתאים. במונחים של קואורדינטות x-y, הווקטור מצביע על -93.8° מול ציר ה- x; אוריינטציה זו מכוונת לחלקו האחורי של חרוט הצמיחה (איור 8C). גודל כוח המתיחה F חושב באופן הבא:
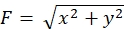
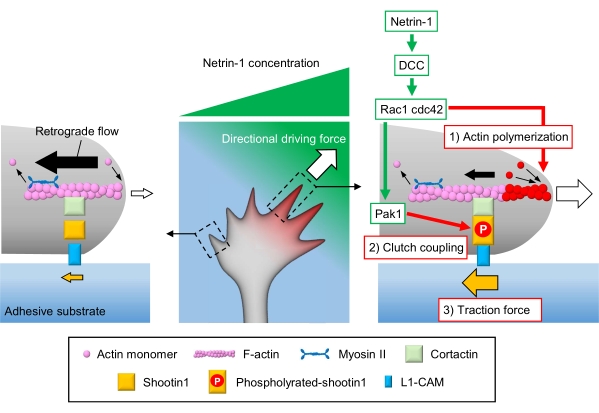
איור 1: מכונות קונוס צמיחה ליצירת כוח וניווט חרוט צמיחה. שיפוע כימותרפי netrin-1 מעורר גירוי אסימטרי של הקולטן שלו DCC על חרוט גדילה אקסוני. זה מפעיל Rac1 ו- CDC42, ואת קינאז Pak1 במורד הזרם שלהם. Rac1 ו- Cdc42 מקדמים (1) פילמור אקטין, בעוד Pak1 זרחן shootin1, שיפור צימוד מצמד 1-בתיווך shootin1(2). ההפעלה האסימטרית של דינמיקת actin ואת צימוד המצמד בתוך חרוט הצמיחה מגביר (3) כוח המתיחה בצד של המקור netrin-1, ובכך יוצר כוח מניע כיווני למשיכה קונוס צמיחה. הפרוטוקולים המוצגים כאן מאפשרים כימות של משתני המפתח (1)-(3) לניווט חרוט צמיחה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: תמונות פלואורסצנטיות של חרוט גדילה עצבי תחת דיאפרגמה פתוחה וצרה לחלוטין. קונוס הצמיחה מבטא את Lifeact ו- HaloTag-actin. (א) ביטוי Lifeact גבוה מאפשר הדמיה של מורפולוגיה קונוס צמיחה. מצד שני, רמות הביטוי HaloTag-actin נמוכות מאוד, עם אותות עמומים כאשר הסרעפת נפתחת במלואה. (B) כאשר הסרעפת מצטמצמת כראוי, אותות הרקע פוחתים, ונוהמי אקטין בודדים מופיעים בקונוס הצמיחה. סרגלי קנה מידה: 5 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: שלבים לכימות מהירות זרימת F-actin וקצב פילמור אקטין באמצעות תוכנת עיבוד וניתוח תמונה פיג'י. (A) התאם את זווית התמונה לניתוח. (1) חפש ובחר כתם אקטן (ראש חץ) הזורם בחבילת F-actin. (2) בחר תמונה > שינוי צורה > סיבוב. (3) הגדר את הזווית כך שחבילה F-actin תכוון כלפי מעלה. (4) זווית התמונה תשתנה. (ב) לתאר את האזור, כולל כתם אקטין ואת חבילת F-actin. (1) לחץ על מלבן בסרגל הכלים. (2) תיווג אזור בתמונה. הבהירות והחדות של התמונה גדלות כדי לאפשר הדמיה ברורה של כתמי actin ואת קצה חבילת F-actin. (3) בחר תמונה > כפול. (4) הזן את חמש מסגרות הזמן המציגות זרימת כתמי אקטין בחבילת F-actin. (5) תמונת המחסנית שנבחרה תופיע על המסך. (ג) עיגולי כיסוי על כתם המעשה. (1) לחץ על אליפסה בסרגל הכלים. (2) צייר עיגול על כתם אקטין. (3) בחר שכבת-על > תמונה > הוסף בחירה. (4) העיגול מכוסה. 5) חזור על הנחת העיגולים על כתמי המעשה הנותרים. (ד) למדוד את מרחק ההקצאה של כתמי אקטין במהלך חמש מסגרות הזמן. (1) לחץ על ישר בסרגל הכלים. (2) צייר קו המקשר בין מרכזי העיגולים. (3) בחר ניתוח > מידה. התוצאה, המצוינת על-ידי הפרמטר Height (תיבה אדומה), מעבירה את מרחק ההקצאה של כתמי actin. (ה) למדוד את השינוי באורך בליטת F-actin במהלך חמש מסגרות הזמן. (1) צייר קו המקשר בין קצות בליטות F-actin. (2) בחר ניתוח > מידה. התוצאה (תיבה אדומה), גובה, מציינת את אורך ההרחבה של חבילת F-actin. (ו) קצב פילמור actin מחושב מסכום מהירות זרימת F-actin וקצב ההרחבה. ראה גם קובץ משלים 2. קובץ משלים 3 מסייע לחוקרים לתרגל את המתודולוגיה המתוארת לעיל. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
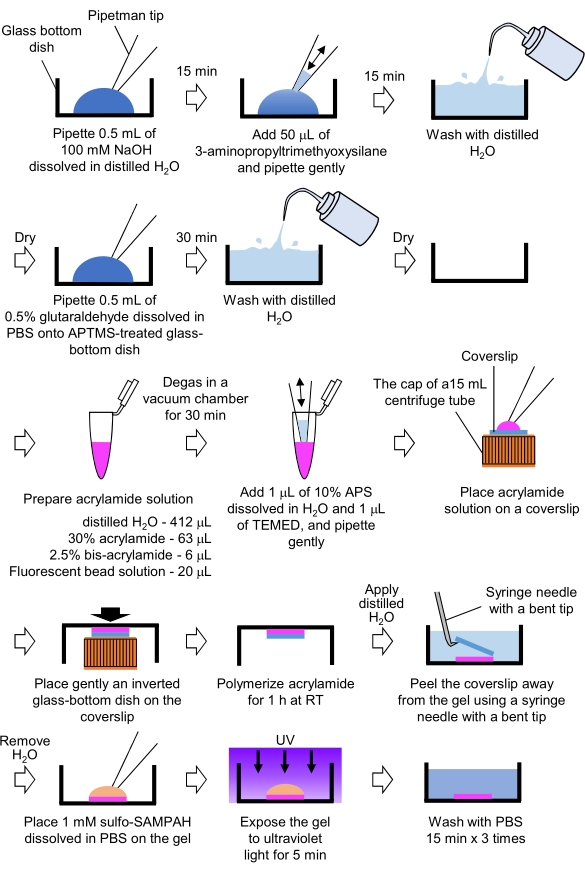
איור 4: צעדים להכנת ג'ל PAA. אנא עיון בשלב 7.1 לקבלת תיאור מפורט. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
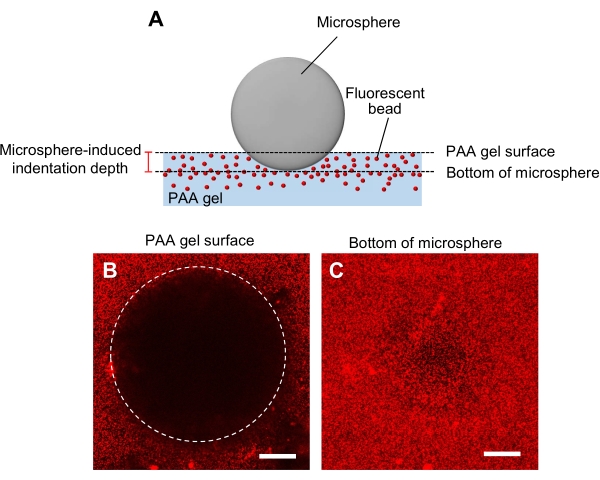
איור 5: קביעת קשיחות ג'ל PAA. (A) שיטת כניסה מיקרוספירית. כאשר מיקרוספירה ממוקמת על ג'ל PAA מוטבע חרוזים פלואורסצנטי, המשקל של המיקרוספירה גורם כניסה בג'ל. עומק הכניסה מחושב על ידי חיסור מיקומי z של משטח ג'ל PAA מתחתית תמונות הפלואורסצנטיות של מיקרוספירה (B,C) פלואורסצנטיות של ג'ל PAA המוכנס פנימה על ידי מיקרוספירה ומכיל חרוזים פלואורסצנטיים. מיקרוסקופ קונפוקלי סריקת לייזר שימש ללכידת תמונות של משטח הג'ל (B) ותחתון המיקרוספירה (C). אותות מהחרוזים הפלואורסצנטיים אינם נראים במשטח הג'ל באזור הכניסה (B, circle). הם יכולים, עם זאת, להיות נצפו בתחתית המיקרוספירה. סרגלי קנה מידה: 50 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
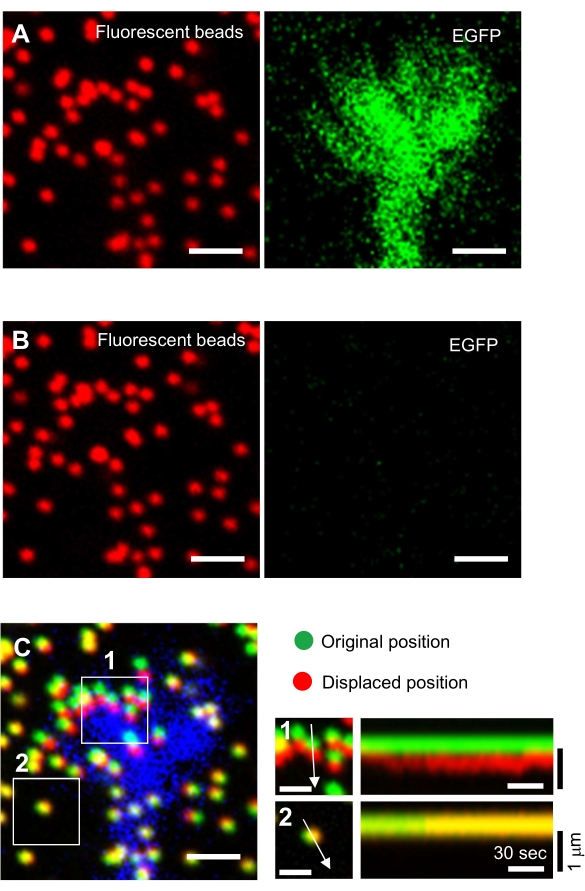
איור 6: מיפוי כוח של חרוט גדילה עצבי. (א-ג) תמונות פלואורסצנטיות של חרוזים המוטמעים בג'ל PAA וקונוס צמיחה עצבי המודגם עם EGFP. לאחר רכישת תמונות זמן לשגות (A), הנוירון שוחרר ממצע הג'ל על ידי החלת פתרון SDS, ותמונה של החרוזים במצע לא מאומן נלכדה (B). (ג) תמונת החרוזים במצע הלא מאומן מראה את החרוזים בתנוחותיהם המקוריות (הירוקות) והעקורות (האדומות). אות EGFP של חרוט הצמיחה מוצג בכחול. קימאוגרפיות (מימין) מציגות את תנועות החרוזים במרווחי זמן של 3 שניות למשך 147 שניות, המצוינות על ידי החצים באזורים בקופסה 1 ו- 2. החרוז באזור 2 הוא חרוז התייחסות. סרגלי קנה מידה: 2 מיקרומטר עבור (A), (B) ו-(C, משמאל) ו- 1 מיקרומטר עבור (C, אמצע). ראה גם קובץ משלים 4. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
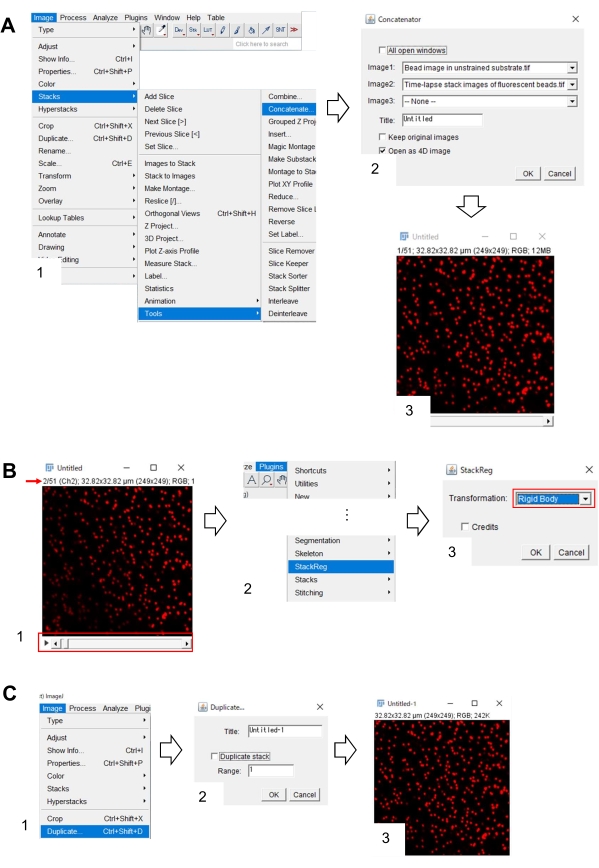
איור 7: שלבים לתיקון מיקום x-y של תמונת החרוזים במצע לא מאומן באמצעות פיג'י. (A) משרשרים את תמונת החרוזים במצע לא מאומן עם תמונת הערימה של חרוזי הפלורסצנט. (1) בחר > תמונות ערימות > כלים > מכנסים. (2) בחר את תמונת החרוזים במצע לא מאומן ואת תמונת הערימה של חרוזים פלואורסצנטיים ב- Image1 ו- Image2, בהתאמה. לחץ על אישור. (3) תמונת החרוזים במצע הלא מאומן מתווספת לתמונת הערימה של זמן-זמן. (B) תקן את מיקום ה- x-y של תמונת החרוזים הפלואורסצנטית. (1) השתמש בפס הגלילה (מסגרת אדומה) כדי לבחור את המסגרת השניה (חץ אדום) בערימת התמונות. (2) בחר תוספים > StackReg. (3) בחר גוף קשיח מהרשימה הנפתחת (מסגרת אדומה) ולחץ על אישור. התיקון של מיקום x-y יתחיל. (ג) שמור את תמונת החרוזים המתוקנת במיקום x-y. לאחר בחירת המסגרת הראשונה של תמונת המחסנית המתוקנת במיקום x-y, (1) בחר תמונה > שכפל. (2) הזן 1 לטווח וביטול הבחירה בערימה כפולה. לאחר מכן לחץ על אישור. (3) תמונת החרוזים המתוקנת במיקום x-y במצע הלא מאומן תופיע על המסך. שמור תמונה זו כקובץ tiff. קובץ משלים 6 מסייע לחוקרים לתרגל את המתודולוגיה המתוארת לעיל. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
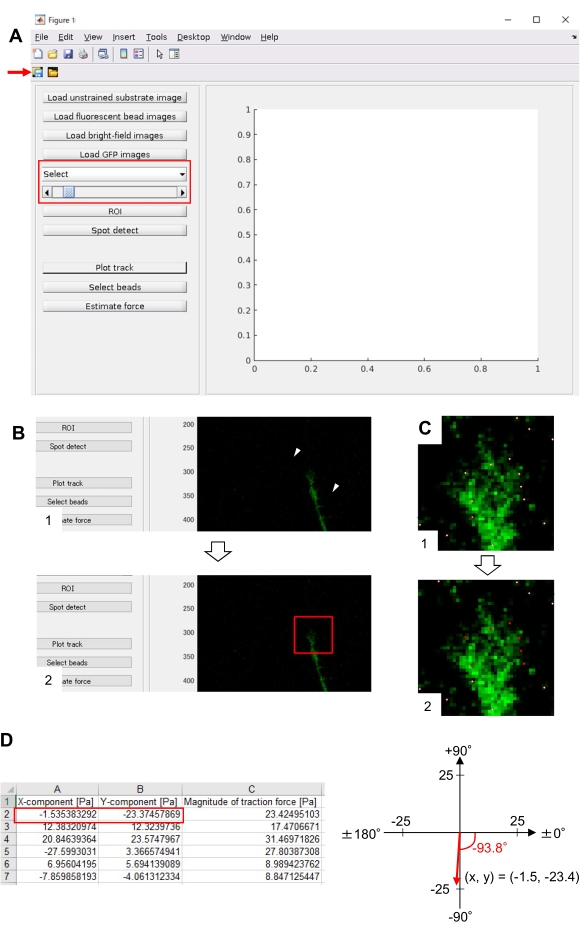
איור 8: ניתוח כוח המתיחה מתחת לקונוס גדילה עצבי באמצעות קוד ניתוח כוח המתיחה בקוד פתוח. (A) GUI לניתוח כוח המתיחה. ניתן לאשר תמונות של זמן לשגות ב- GUI מהרשימה הנפתחת ועם המחוון המצוין (תיבה אדומה). (B) בחר אזור הכולל את חרוט הצמיחה. (1) לחץ על ROI על GUI. באמצעות סמן העכבר, ציין שתי נקודות (ראשי חץ) בתמונת התא. (2) תיבה אדומה תופיע בתמונת התא. שתי לחיצות קובעות את מיקומן של שתי פינות. (ג) בחר את החרוזים שזוהו (נקודות לבנות) מתחת לקונוס הצמיחה. (1) ב- GUI, לחץ על בחר חרוזים ותיחום אזור מצולע הכולל את חרוט הצמיחה על-ידי לחיצה. הקש על מקש Enter . (2) הנקודות הלבנות בתוך אזור המצולעים ישתנו לצבע אדום. (ד) תוצאות מחושבות של הכיוון והגודל של כוח המתיחה. התיבה האדומה בגיליון האלקטרוני מייצגת את רכיבי ה- x וה- y של וקטור הכוח, המוערך על-ידי ניתוח כוח המתיחה. בקואורדינטת x-y בחלונית הימנית, וקטור הכוח שנוצר על-ידי חרוט הצמיחה מצביע על -93.8° מול ציר ה-x; אוריינטציה זו מכוונת לחלקו האחורי של חרוט הצמיחה (C). קובץ משלים 6 מסייע לחוקרים לתרגל את המתודולוגיה המתוארת לעיל. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
קובץ משלים 1: מתכונים של פתרונות ומדיה המשמשים במחקר זה. עיין בטקסט לשימוש מפורט. נא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 2: הדמיית פלואורסצנטיות של Lifeact והדמיה כתמים פלואורסצנטיים של HaloTag-actin בקונוס צמיחה עצבי. Lifeact (ירוק) ו HaloTag-actin (מגנטה). התמונות נרכשו כל 3 שניות למשך כולל של 147 שניות. סרגל קנה מידה: 2 מיקרומטר. ראה גם איור 3. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 3: נתוני תרגול לכימות מהירות זרימת F-actin וקצב פילמור actin. תמונת ערימה רב-ערוצית של Lifeact (ירוק) ו-HaloTag-actin (מגנטה). ראו גם איור 3. נא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 4: וידאו מיפוי כוח זיהוי כוח המתיחה בקונוס גדילה עצבי. העמדות המקוריות (הירוקות) והעקורות (האדומות) של החרוזים. אות EGFP בקונוס הצמיחה מוצג בכחול. התמונות נרכשו כל 3 s עבור 147 s. סרגל קנה מידה: 2 מיקרומטר. ראו גם איור 6. נא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 5: קוד ניתוח כוח המתיחה. אנא עיון בשלב 8.12 לשימוש מפורט. נא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 6: תרגול נתונים לכימות כוח המתיחה. תמונת RGB חד-ערוצית של החרוזים במצע לא מאומן ותמונות RGB של חרוזים פלואורסצנטיים בעלי ערוץ יחיד תחת חרוט גדילה, EGFP ושדה בהיר. ראו גם איורים 7 ו-8. נא לחץ כאן כדי להוריד קובץ זה.
Discussion
הפרוטוקולים המתוארים במחקר זה משתמשים בחומרים זמינים מסחרית ובציוד מיקרוסקופי שנמצאים באופן שגרתי בכל המעבדות, המכונים והאוניברסיטאות. לכן, חוקרים יכולים לאמץ בקלות את הדמיית כתמים יחיד הנוכחי מיקרוסקופיה כוח המתיחה במחקרים שלהם.
הדמיית כתמים יכולה לנתח פילמור אקטין צימוד מצמד. בנוסף, הדמיית כתמים יכולה לפקח על הזרימה המדרדרת של מולקולות מצמד כגון shootin1 וקורטקטין, אשר אינטראקציה עם זרימת F-actin מדרדרת. באמצעות מיקרוסקופ TIRF, הזרימה המדרדרת של מולקולת הידבקות התא L1-CAM ניתן גם לפקח23,41; L1-CAM עובר התנהגויות אחיזה והחלקת המשקפות את יעילות צימוד המצמד23,41. למרות שהמחקר הנוכחי משתמש במערכת TMR-HaloTag להדמיית כתמים, חלבונים פלואורסצנטיים אחרים, כגון EGFP וחלבון פלואורסצנטי אדום מונומרי, זמינים גם בניתוח16,18,20,23,24,27,39. היסודות להדמיית כתמי אקטין הם רמת ביטוי נמוכה של אקטין פלואורסצנטי והארה של אזור מינימלי (איור 2). בפרוטוקול זה, אותות Lifeact ו- HaloTag-actin נרכשים ברצף. מכיוון שזרימת הנסיגה של actin איטית יחסית (4.5 ± 0.1 מיקרומטר/דקה)24, ניתוח זרימת F-actin מדרדרת ופימור אקטין אינם מושפעים מרכישת תמונה רציפה של ערוצי פלואורסצנטיים שונים (~ מרווח זמן של ~ 1). Lifeact הוא סמן F-actin בשימוש נרחב, אבל יכול להתחרות עם חלבונים מחייבים actin47. בעל חשיבות נוספת, Lifeact יכול לשנות את הדינמיקה actin, ובכך להשפיע על מבני F-actin ואת מורפולוגיה התא47,48,49.
מיקרוסקופיה כוח המתיחה יכול לזהות כוחות כדי להניע התקדמות חרוט צמיחה. על ידי הרכבת הנוירונים בתוך מטריצה חוץ-תאית, החוקרים יכולים גם לנתח כוחות שנוצרו בסביבה תלת-ממדית למחצה11. הדמיה בהגדלה גבוהה חשובה לכימות מדויק של כוח המתיחה מכיוון שקונוסים צמיחה יוצרים כוחות אחיזה חלשים7. למרות שיטות אחרות עם nanopillars או biosensors רגישים ללחץ משמשים גם כדי למדוד כוח המתיחה50,51, שיטה מבוססת ג'ל PAA הוא מותאם מאוד ומאפשר התאמה של קשיחות מצע על ידי שינוי הריכוזים של אקרילאמיד וביס-acrylamide41,44,52. בפרוטוקול זה, ג'ל PAA מוכן בריכוז סופי של 3.75% אקרילאמיד ו 0.03% ביס-אקרילאמיד; מודולוס של יאנג הוא ~ 270 Pa22 ונוקשות זו נמצאת בטווח של רקמת המוח (100-10,000 Pa)53,54,55. בשל עובי ג'ל PAA (~ 100 מיקרומטר), שיטה זו מגבילה את השימוש בעדשות הגדלה גבוהה במהלך מיקרוסקופיה. כדי להשיג תמונות בהגדלה גבוהה, החוקרים צריכים להשתמש בפונקציית הזום במיקרוסקופ קונפוקלי סורק לייזר.
לסיכום, הדמיית כתמים הנוכחית ומיקרוסקופיית כוח המתיחה מאפשרת ניתוחים כמותיים של האירועים המרכזיים בדורות הכוח. מידע זה יהיה יקר ערך לשיפור ההבנה של המנגנונים העומדים בבסיס התקדמות וניווט קונוס הצמיחה.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
מחקר זה נתמך בחלקו על ידי AMED תחת מענק מספר 21gm0810011h0005 (N.I. ו- Y.S.), JSPS KAKENHI (JP19H03223, N.I.) ו- JSPS מענקים בסיוע למדענים בתחילת הקריירה (JP19K16258, T.M.), קרן המחקר הרפואי של אוסקה למחלות חשוכות מרפא (T.M.), ופרויקט המחקר הבין-תחומי של הדור הבא של NAIST (י.ש).
Materials
| Name | Company | Catalog Number | Comments |
| 0.5% trypan blue stain solution | Nacalai | 29853-34 | |
| 3-aminopropyltrimethyoxysilane | Sigma | 281778-100ML | |
| Acrylamide monomer | Nacalai | 00809-85 | |
| Ammonium persulphate | Cytiva | 17-1311-1 | |
| Axio Observer Z1 | Zeiss | 431007-9902-000 | Epi-fluorescence microscope (single speckle imaging) |
| B-27 supplement (50x) | Thermo Fisher Scientific | 17504-044 | |
| Bovine serum albmine | Sigma | A7906-10G | |
| C-Apochromat 63x/1.2 W Corr | Zeiss | 421787-9970-799 | Objective lens (traction force microscopy) |
| Coverslip (diameter 18 mm) | Matsunami | C018001 | |
| D-glucose | Nacalai | 16806-25 | |
| DNaseI | Sigma | DN25-100MG | |
| Fetal bovine serum | Thermo Fisher Scientific | 10270-106 | |
| Fiji | Open source software package | https://imagej.net/software/fiji/ | |
| FluoSpheres carboxylate-modified 0.2 mm, red (580/605), 2% solid | Thermo Fisher Scientific | F8810 | carboxylate-modified microspheres |
| Glass bottom dish (14 mm diameter) | Matsunami | D1130H | |
| Glass bottom dish (27 mm diameter) | Matsunami | D1140H | |
| Glutaraldehyde solution | Sigma | G5882-10X10ML | |
| HaloTag TMR ligand | Promega | G8251 | |
| HBO103 W/2 | Osram | 4050300382128 | Mercury lamp (single speckle imaging) |
| Image Processing Toolbox | MathWork | https://www.mathworks.com/products/image.html | |
| Laminin solution from mouse EHS tumor | Wako | 120-05751 | |
| Leibovitz’s L-15 medium | Thermo Fisher Scientific | 11415064 | |
| L-glutamine | Nacalai | 16919-42 | |
| LSM710 | Zeiss | N/A | Conforcal laser microscope (traction force microscopy) |
| MATLAB2018a | MathWork | https://www.mathworks.com/products/new_products/release2018a.html | |
| Mouse C57BL/6 | Japan SLC | N/A | |
| Mouse neuron nucleofector kit | Lonza | VPG-1001 | |
| N,N,N’,N’-tetramethylethylenediamine (TEMED) | Nacalai | 33401-72 | |
| N,N’-methylenebisacrylamide | Nacalai | 22402-02 | |
| Neurobasal medium | Thermo Fisher Scientific | 21103-049 | |
| Nucleofector I | Amaxa | AAD-1001 | Electroporation apparatus |
| ORCA Flash 4.0 V2 | Hamamatsu | C11440-22CU | CMOS camera (single speckle imaging) |
| Papain | Nacalai | 26036-34 | |
| Parallel Computing Toolbox | MathWork | https://www.mathworks.com/products/parallel-computing.html | |
| pEGFP-C1 | Clontech | 1528177 | |
| Penicillin-streptomycin (100x) | Nacalai Tesque | 26253-84 | |
| pFN21A-HaloTag-actin | (Minegishi et al., 2018) | N/A | |
| Phosphate buffered saline (PBS) pH 7.4 (10x) | Thermo Fisher Scientific | 70011-044 | |
| Plan-Apochromat 100x/1.4 Oil | Zeiss | 420790-9901-000 | Objective lens (single speckle imaging) |
| pmNeonGreen-N1-Lifeact | (Kastian et al., 2021) | N/A | |
| Poly-D-lysine hydrobromide | Sigma | P6407-5MG | |
| Slulfo-SAMPHA | Thermo Fisher Scientific | 22589 | |
| Sodium dodecyl sulfate | Nacalai | 08933-05 | |
| Sodium hydrate (NaOH) | Nacalai | 31511-05 | |
| Steel ball | Sako tekkou | N/A | Microshpere to determin PAA gel rigidity. 0.6 mm diameter, 7.87 g/cm3. |
| ZEN2009 | Zeiss | https://www.zeiss.com/microscopy/us/products/microscope-software/zen.html#introduction | Image acquisition software (traction force microscopy) |
| ZEN2012 | Zeiss | https://www.zeiss.com/microscopy/us/products/microscope-software/zen.html#introduction | Image acquisition software (single speckle imaging) |
References
- TessierLavigne, M., Goodman, C. S. The molecular biology of axon guidance. Science. 274, 1123-1133 (1996).
- Marin, O., Valiente, M., Ge, X., Tsai, L. H. Guiding neuronal cell migrations. Cold Spring Harbor Perspectives in Biology. 2, 001834 (2010).
- Vitriol, E. A., Zheng, J. Q. Growth cone travel in space and time: the cellular ensemble of cytoskeleton, adhesion, and membrane. Neuron. 73 (6), 1068-1081 (2012).
- Cooper, J. A. Cell biology in neuroscience: mechanisms of cell migration in the nervous system. Journal of Cell Biology. 202, 725-734 (2013).
- Dupraz, S., et al. RhoA controls axon extension independent of specification in the developing brain. Current Biology. 29, 3874-3886 (2019).
- Suter, D. M., Miller, K. E. The emerging role of forces in axonal elongation. Progress in Neurobiology. 94, 91-101 (2011).
- Franze, K. Integrating chemistry and mechanics: the forces driving axon growth. Annual Review of Cell and Developmental Biology. 36, 61-83 (2020).
- Mitchison, T., Kirschner, M. Cytoskeletal dynamics and nerve growth. Neuron. 1, 761-772 (1988).
- Suter, D. M., Forscher, P. Substrate-cytoskeletal coupling as a mechanism for the regulation of growth cone motility and guidance. Journal of Neurobiology. 44, 97-113 (2000).
- Lowery, L. A., Van Vactor, D. The trip of the tip: understanding the growth cone machinery. Nature Reviews Molecular Cell Biology. 10, 332-343 (2009).
- Minegishi, T., et al. Shootin1b mediates a mechanical clutch to produce force for neuronal migration. Cell Reports. 25, 624-639 (2018).
- Minegishi, T., Inagaki, N. Forces to drive neuronal migration steps. Frontiers in Cell and Developmental Biology. 8, 863 (2020).
- Forscher, P., Smith, S. J. Actions of cytochalasins on the organization of actin filaments and microtubules in a neuronal growth cone. Journal of Cell Biology. 107, 1505-1516 (1988).
- Suter, D. M., Forscher, P. An emerging link between cytoskeletal dynamics and cell adhesion molecules in growth cone guidance. Current Opinion in Neurobiology. 8, 106-116 (1998).
- Pollard, T. D., Borisy, G. G. Cellular motility driven by assembly and disassembly of actin filaments. Cell. 112, 453-465 (2003).
- Waterman-Storer, C. M., Desai, A., Bulinski, J. C., Salmon, E. D. Fluorescent speckle microscopy, a method to visualize the dynamics of protein assemblies in living cells. Current Biology. 8, 1227-1230 (1998).
- Katoh, K., Hammar, K., Smith, P. J., Oldenbourg, R. Birefringence imaging directly reveals architectural dynamics of filamentous actin in living growth cones. Molecular Biology of the Cell. 10, 197-210 (1999).
- Watanabe, N., Mitchison, T. J. Single-molecule speckle analysis of actin filament turnover in lamellipodia. Science. 295, 1083-1086 (2002).
- Medeiros, N. A., Burnette, D. T., Forscher, P. Myosin II functions in actin-bundle turnover in neuronal growth cones. Nature Cell Biology. 8, 215-226 (2006).
- Shimada, T., et al. Shootin1 interacts with actin retrograde flow and L1-CAM to promote axon outgrowth. Journal of Cell Biology. 181, 817-829 (2008).
- He, M., Zhang, Z. H., Guan, C. B., Xia, D., Yuan, X. B. Leading tip drives soma translocation via forward F-actin flow during neuronal migration. Jounal of Neuroscience. 30, 10885-10898 (2010).
- Toriyama, M., Kozawa, S., Sakumura, Y., Inagaki, N. Conversion of a signal into forces for axon outgrowth through Pak1-mediated shootin1 phosphorylation. Current Biology. 23, 529-534 (2013).
- Abe, K., et al. Grip and slip of L1-CAM on adhesive substrates direct growth cone haptotaxis. Proceedings of the National Academy of Sciences of the United States of America. 115, 2764-2769 (2018).
- Baba, K., et al. Gradient-reading and mechano-effector machinery for netrin-1-induced axon guidance. Elife. 7, 34593 (2018).
- Nichol, R. I., Hagen, K. M., Lumbard, D. C., Dent, E. W., Gomez, T. M. Guidance of axons by local coupling of retrograde flow to point contact adhesions. Journal of Neuroscience. 36, 2267-2282 (2016).
- Shekarabi, M., et al. Deleted in colorectal cancer binding netrin-1 mediates cell substrate adhesion and recruits Cdc42, Rac1, Pak1, and N-WASP into an intracellular signaling complex that promotes growth cone expansion. Journal of Neuroscience. 25, 3132-3141 (2005).
- Kubo, Y., et al. Shootin1-cortactin interaction mediates signal-force transduction for axon outgrowth. Journal of Cell Biology. 210, 663-676 (2015).
- Huber, A. B., Kolodkin, A. L., Ginty, D. D., Cloutier, J. F. Signaling at the growth cone: ligand-receptor complexes and the control of axon growth and guidance. Annual Review of Neuroscience. 26, 509-563 (2003).
- Kolodkin, A. L., Tessier-Lavigne, M. Mechanisms and molecules of neuronal wiring: a primer. Cold Spring Harbor Perspectives in Biology. 3, 001727 (2011).
- Ayala, R., Shu, T., Tsai, L. H. Trekking across the brain: the journey of neuronal migration. Cell. 128, 29-43 (2007).
- Tatavarty, V., Kim, E. J., Rodionov, V., Yu, J. Investigating sub-spine actin dynamics in rat hippocampal neurons with super-resolution optical imaging. PLoS One. 4, 7724 (2009).
- Frost, N. A., Shroff, H., Kong, H., Betzig, E., Blanpied, T. A. Single-molecule discrimination of discrete perisynaptic and distributed sites of actin filament assembly within dendritic spines. Neuron. 67, 86-99 (2010).
- Chazeau, A., et al. Nanoscale segregation of actin nucleation and elongation factors determines dendritic spine protrusion. EMBO Journal. 33, 2745-2764 (2014).
- Garcia, M., et al. Two-tiered coupling between flowing actin and immobilized N-cadherin/catenin complexes in neuronal growth cones. Proceedings of the National Academy of Sciences of the United States of America. 112, 6997-7002 (2015).
- Swaminathan, V., et al. Actin retrograde flow actively aligns and orients ligand-engaged integrins in focal adhesions. Proceedings of the National Academy of Sciences of the United States of America. 114, 10648-10653 (2017).
- Tsai, T. Y., et al. Efficient front-rear coupling in neutrophil chemotaxis by dynamic myosin II localization. Developmental Cell. 49, 189-205 (2019).
- Zhang, X. F., et al. Regulation of axon growth by myosin II-dependent mechanocatalysis of cofilin activity. Journal of Cell Biology. 218 (7), 2329-2349 (2019).
- Reversat, A., et al. Cellular locomotion using environmental topography. Nature. 582, 582-585 (2020).
- Katsuno, H., et al. Actin migration driven by directional assembly and disassembly of membrane-anchored actin filaments. Cell Reports. 12, 648-660 (2015).
- Urasaki, A., et al. Shootins mediate collective cell migration and organogenesis of the zebrafish posterior lateral line system. Scientific Reports. 9, 12156 (2019).
- Abe, K., et al. Mechanosensitive axon outgrowth mediated by L1-laminin clutch interface. Biophysical Journal. 120, 3566-3576 (2021).
- Kastian, R. F., et al. Shootin1a-mediated actin-adhesion coupling generates force to trigger structural plasticity of dendritic spines. Cell Reports. 35, 109130 (2021).
- Riedl, J., et al. Lifeact: a versatile marker to visualize F-actin. Nature Methods. 5, 605-607 (2008).
- Chan, C. E., Odde, D. J. Traction dynamics of filopodia on compliant substrates. Science. 322, 1687-1691 (2008).
- Wang, Y. L., Pelham, R. J. Preparation of a flexible, porous polyacrylamide substrate for mechanical studies of cultured cells. Methods in Enzymology. 298, 489-496 (1998).
- Li, Y., Hu, Z., Li, C. New method for measuring poisson's ratio in polymer gels. Journal of Applied Polymer Science. 50, 1107-1111 (1993).
- Belyy, A., Merino, F., Sitsel, O., Raunser, S. Structure of the Lifeact-F-actin complex. PLoS Biology. 18, 3000925 (2020).
- Flores, L. R., Keeling, M. C., Zhang, X., Sliogeryte, K., Gavara, N. Lifeact-GFP alters F-actin organization, cellular morphology and biophysical behaviour. Scientific Reports. 9, 3241 (2019).
- Kumari, A., Kesarwani, S., Javoor, M. G., Vinothkumar, K. R., Sirajuddin, M. Structural insights into actin filament recognition by commonly used cellular actin markers. EMBO Journal. 39, 104006 (2020).
- du Roure, O., et al. Force mapping in epithelial cell migration. Proceedings of the National Academy of Sciences of the United States of America. 102, 2390-2395 (2005).
- Grashoff, C., et al. Measuring mechanical tension across vinculin reveals regulation of focal adhesion dynamics. Nature. 466, 263-266 (2010).
- Koch, D., Rosoff, W. J., Jiang, J., Geller, H. M., Urbach, J. S. Strength in the periphery: growth cone biomechanics and substrate rigidity response in peripheral and central nervous system neurons. Biophysical Journal. 102 (3), 452-460 (2012).
- Barnes, J. M., Przybyla, L., Weaver, V. M. Tissue mechanics regulate brain development, homeostasis and disease. Journal of Cell Science. 130, 71-82 (2017).
- Moore, S. W., Roca-Cusachs, P., Sheetz, M. P. Stretchy proteins on stretchy substrates: the important elements of integrin-mediated rigidity sensing. Developmental Cell. 19, 194-206 (2010).
- Tyler, W. J. The mechanobiology of brain function. Nature Reviews Neuroscience. 13, 867-878 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved