A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
زرع الخلايا العضلية القلبية المشتقة من الخلايا الجذعية المستحثة بالموجات فوق الصوتية في الفئران المحتشدة بعضلة القلب
In This Article
Summary
يعد توصيل الخلايا الموجهة بالموجات فوق الصوتية حول موقع احتشاء عضلة القلب في الفئران طريقة آمنة وفعالة ومريحة لزراعة الخلايا.
Abstract
الهدف الرئيسي من العلاج الخلوي بعد احتشاء عضلة القلب (MI) هو تعزيز معدل تطعيم الخلايا بشكل فعال ، وخلايا عضلة القلب المشتقة من الخلايا الجذعية البشرية (hiPSC-CMs) هي مصدر خلايا واعد لإصلاح القلب بعد التلف الإقفاري. ومع ذلك ، فإن معدل التطعيم المنخفض يمثل عقبة كبيرة أمام التجديد الفعال لأنسجة القلب بعد الزرع. يوضح هذا البروتوكول أن الحقن عن طريق الجلد المتعددة الموجهة بالموجات فوق الصوتية hiPSC-CM في منطقة MI تزيد بشكل فعال من معدلات زرع الخلايا. تصف الدراسة أيضا عملية زراعة hiPSC-CM بأكملها ، والمعالجة المسبقة ، وطرق التوصيل عن طريق الجلد الموجهة بالموجات فوق الصوتية. بالإضافة إلى ذلك ، يساعد استخدام الحمض النووي للميتوكوندريا البشرية في اكتشاف عدم وجود hiPSC-CMs في أعضاء الفئران الأخرى. أخيرا ، تصف هذه الورقة التغيرات في وظائف القلب ، وتكوين الأوعية الدموية ، وحجم الخلية ، وموت الخلايا المبرمج في المنطقة الحدودية المحتشدة في الفئران بعد 4 أسابيع من ولادة الخلايا. يمكن أن نستنتج أن الحقن عن طريق الجلد الموجه بتخطيط صدى القلب لعضلة القلب البطين الأيسر هو علاج خلوي مجدي وغازي نسبيا ومرض وقابل للتكرار وفعال.
Introduction
عندما يحدث MI الحاد ، تموت خلايا عضلة القلب في المنطقة المحتشدة بسرعة بسبب نقص التروية ونقص الأكسجة. يتم إطلاق العديد من العوامل الالتهابية بعد موت الخلايا وتمزق ، بينما تتسلل الخلايا الالتهابية إلى الموقع المحتشاء لتسبب الالتهاب1. بشكل ملحوظ ، تحل الخلايا الليفية والكولاجين ، سواء بدون انقباض أو توصيل كهربائي ، محل خلايا عضلة القلب في الموقع المحتشد لتشكيل نسيج ندبي. نظرا لقدرة التجديد المحدودة للخلايا العضلية القلبية في الثدييات البالغة ، فإن الأنسجة القابلة للحياة التي تشكلت بعد مساحة كبيرة من الاحتشاء عادة ما تكون غير كافية للحفاظ على النتاج القلبي الكافي2. يسبب MI قصور القلب ، وفي الحالات الشديدة من قصور القلب ، يمكن للمرضى الاعتماد فقط على عمليات زرع القلب أو أجهزة مساعدة البطين للحفاظ على وظائف القلب الطبيعية 3,4.
بعد MI ، تتمثل استراتيجية العلاج المثالية في استبدال خلايا عضلة القلب الميتة بخلايا عضلية قلبية مشكلة حديثا ، وتشكيل اقتران كهروميكانيكي مع الأنسجة السليمة. ومع ذلك ، فقد اعتمدت خيارات العلاج عادة إنقاذ عضلة القلب بدلا من استبدالها. حاليا ، تعد العلاجات القائمة على الخلايا الجذعية والخلايا السلفية من بين أكثر الاستراتيجيات الواعدة لتعزيز إصلاح عضلة القلب بعد MI5. ومع ذلك ، فإن زرع هذه الخلايا له العديد من المشكلات ، في المقام الأول عدم قدرة الخلايا الجذعية البالغة على التمايز إلى خلايا عضلية قلبية وعمرها القصير6.
يمكن التحايل على القضايا الأخلاقية المتعلقة باستخدام الخلايا الجذعية الجنينية (ES) بواسطة iPSCs ، والتي تعد مصدرا واعدا للخلايا. بالإضافة إلى ذلك ، تمتلك iPSCs قدرات قوية على التجديد الذاتي ويمكن أن تتمايز إلى خلايا عضليةقلبية 7. أظهرت الدراسات أن hiPSC-CMs المزروعة في موقع MI يمكنها البقاء على قيد الحياة وتشكيل تقاطعات فجوة مع الخلايا المضيفة 8,9. ومع ذلك ، نظرا لأن هذه الخلايا المزروعة تقع في البيئة المكروية لنقص التروية والالتهابات ، فإن معدل بقائها على قيد الحياة منخفض للغاية10,11.
تم إنشاء عدة طرق لتحسين معدل بقاء الخلايا المزروعة ، مثل نقص الأكسجة والمعالجة المسبقة للصدمة الحرارية للخلايا المزروعة12,13 ، والتعديل الوراثي 14,15 ، والزرع المتزامن للخلايا والشعيرات الدموية 16. لسوء الحظ ، فإن معظم الطرق محدودة بالتعقيد والتكلفة العالية. ومن ثم ، تقترح الدراسة الحالية طريقة توصيل hiPSC-CM قابلة للتكرار ومريحة وغازية نسبيا وفعالة.
يمكن إجراء حقن خلايا داخل عضلة القلب الموجهة بالموجات فوق الصوتية باستخدام جهاز الموجات فوق الصوتية البيطرية الصغيرة عالية الدقة وحاقن دقيق ، بغض النظر عن الموقع. تحت توجيه الموجات فوق الصوتية ، يعد توصيل الخلايا مباشرة تحت عملية الخنجري من التامور إلى عضلة القلب في الفئران بروتوكولا آمنا يتجنب تلف الكبد والرئة. يمكن دمج هذه الطريقة في وقت واحد مع تقنيات أخرى لتحسين معدل بقاء الخلايا المزروعة بشكل كبير.
Protocol
تمت مراجعة جميع التجارب على الحيوانات في هذه الدراسة والموافقة عليها من قبل لجنة الأخلاقيات في مستشفى Xiangya الثاني بجامعة سنترال ساوث. انظر جدول المواد للحصول على تفاصيل بشأن جميع المواد والمعدات المستخدمة في هذا البروتوكول. الجداول الزمنية لحقن الخلايا والتصوير والقتل الرحيم هي كما يلي: t0- الاحتشاء المستحث ، T1 أسبوع - صورة وزرع الخلايا ، T2 أسابيع- صور وزرع الخلايا ، T4 أسابيع - التصوير النهائي ، القتل الرحيم وجمع الأنسجة.
1. ثقافة hiPSC ، تمايز خلايا عضلة القلب ، وتنقية الخلايا
- امزج DMEM / F12 ومحلول مصفوفة الغشاء القاعدي مع الثلج عند 4 درجات مئوية بنسبة 1.5: 1 ، القسمة ، وقم بتخزين الخليط الناتج (مخفف المصفوفة) عند -20 درجة مئوية. امزج 25 مل من وسط الاستزراع DMEM / F12 عند 4 درجات مئوية و 1 مل من مخفف المصفوفة جيدا مع الثلج ، وانشر 1 مل / بئر في طبق من 6 آبار. احتفظ باللوحة في وضع مستقيم لمدة 1 ساعة في حاضنة عند 37 درجة مئوية ، واستنشق طاف DMEM / F12 من الآبار. لا تلمس الجزء السفلي من لوحة 6 آبار عند تنفيذ الإجراء.
- قم بإزالة أنبوب الحفظ بالتبريد الذي يحتوي على hiPSCs من النيتروجين السائل وقم بإذابتها بسرعة في حمام مائي بدرجة حرارة 37 درجة مئوية. قم بتعقيم السطح الخارجي لأنبوب الحفظ بالتبريد بنسبة 75٪ كحول ، وامسح الكحول ، وانقل الأنبوب إلى طاولة معقمة فائقة التنظيف.
- استخدم ماصة لنقل محلول الحفظ بالتبريد الذي يحتوي على hiPSCs برفق إلى أنبوب طرد مركزي سعة 15 مل ، وأضف 5 مل من وسط ES الخالي من وحدة التغذية ، وطرد مركزي التعليق عند 300 × جم لمدة 3 دقائق في درجة حرارة الغرفة. تخلص من المادة الطافية وأعد تعليق الخلايا برفق في 6 مل من وسط ES الخالي من وحدة التغذية. عد الخلايا واضبط تركيز الخلية على 5 × 105 خلايا / مل باستخدام وسط الاستزراع.
- أضف مثبط ROCK (Y27632) إلى hiPSCs إلى تركيز نهائي يبلغ 5 ميكرومتر. انقل hiPSCs مع Y27632 إلى لوحة 6 آبار معالجة مسبقا بمصفوفة غشاء القاع ، وقم بتدوير اللوحة المكونة من 6 آبار برفق ، مع تتبع شكل الرقم "8" لتوزيع hiPSCs بالتساوي. ضع hiPSCs في حاضنة رطبة 37 درجة مئوية مع 5٪ CO2 في وضع رأسي لمدة 24 ساعة. استبدل المادة الطافية بوسيط ES الخالي من وحدة التغذية بدون Y27632.
- عندما تصل hiPSCs إلى درجة التقاء 80٪ ، قم باستنشاق طاف المستزرع ، واغسل الخلايا مرتين بمحلول ملحي مخزن بالفوسفات (PBS) ، وأضف RPMI1640 + B27 الخالي من الأنسولين الذي يحتوي على 10 ميكرومتر CHIR99021 (مثبط GSK3-β) ، وضع hiPSCs في حاضنة CO2 رطبة عند 37 درجة مئوية لمدة 24 ساعة.
- استبدل نصف المادة الطافية بوسط RPMI1640 + B27 بدون أنسولين واحتضان الخلايا لمدة 24 ساعة أخرى.
- استبدل وسط الثقافة تماما ب RPMI1640 + B27 (بدون الأنسولين). ضع الألواح في حاضنة رطبة عند 37 درجة مئوية مع 5٪ CO2 في وضع رأسي لمدة 24 ساعة.
- استبدل وسط الاستزراع تماما بعد 3 أيام ب RPMI1640 + B27 + 5 μM IWR1 (مثبط مسار إشارات Wnt) وضع الألواح في حاضنة رطبة عند 37 درجة مئوية مع 5٪ CO2 لمدة 48 ساعة.
- استبدل وسط الاستزراع بعد 5 أيام ب RPMI1640 + B27 بدون أنسولين واستمر في الحضانة لمدة 48 ساعة في حاضنة CO2 رطبة عند 37 درجة مئوية.
- استبدل وسط الاستزراع بوسط RPMI + B27 (بما في ذلك الأنسولين) بعد 7 أيام وضع الألواح في حاضنة CO2 رطبة لمدة 3 أيام عند 37 درجة مئوية. استبدل الوسيط بوسيط RPMI + B27 كل 3 أيام. ابحث عن الضرب التلقائي للخلايا في 9-12 يوما من التمايز.
- بعد مراقبة الخلايا النابضة ، استبدل وسط RPMI + B27 بوسط RPMI 1640 الخالي من الجلوكوز الذي يحتوي على حمض اللاكتيك (1 مل من حمض اللاكتيك يضاف إلى 500 مل من وسط RPMI 1640 الخالي من الجلوكوز). احتضان الخلايا لمدة 72 ساعة في حاضنة رطبة عند 37 درجة مئوية مع 5٪ CO2.
- بعد 72 ساعة ، استبدل المادة الطافية بوسط RPMI + B27 واحتضانها لمدة 48 ساعة في حاضنة رطبة عند 37 درجة مئوية مع 5٪ CO2.
- نضح طاف الثقافة تحت ضغط سلبي وغسل الخلايا 3x مع PBS لإزالة آثار وسط الثقافة. استخدم خليط إنزيم انفصال الخلايا لفصل hiPSC-CMs إلى خلايا فردية عند 37 درجة مئوية. اجمع الخلايا التي تم الحصول عليها في أنبوب طرد مركزي سعة 15 مل يحتوي على 3 مل من محلول دعم عضلة القلب ، وأجهزة طرد مركزي عند 300 × جم لمدة 2 دقيقة في درجة حرارة الغرفة ، وتخلص من المادة الطافية.
- أعد تعليق الخلايا بوسط RPMI + B27 ، وقم بزرعها على ألواح 6 آبار مغلفة بمصفوفة الغشاء القاعدي ، واحتضانها لمدة 48 ساعة في حاضنة رطبة عند 37 درجة مئوية مع 5٪ CO2.
- استبدل طاف الاستزراع للتنقية بوسط RPMI 1640 الخالي من الجلوكوز الذي يحتوي على حمض اللاكتيك واحتضانه لمدة 72 ساعة في حاضنة رطبة عند 37 درجة مئوية مع 5٪ CO2.
- استبدل طاف الثقافة بوسيط RPMI + B27 وقم بتغيير الوسيط كل 3 أيام.
- استمر في العملية المذكورة أعلاه لمدة 30 يوما ، مع استبدال طاف الثقافة بوسط خال من الجلوكوز يحتوي على حمض اللبنيك لمزيد من التنقية. احتضان الخلايا لمدة 3 أيام باستخدام هذا الوسيط واستبدل المادة الطافية ب RPMI + B27. استزرع الخلايا بشكل مستمر لمدة 30 يوما حتى ينبض hiPSC-CMs بثبات ، واستخدم هذه الخلايا لحقن عضلة القلب في الفئران.
2. إعداد hiPSC-CMs وإنشاء نموذج احتشاء عضلة القلب الحاد للفأر
- قم بشفط طاف المزرعة من hiPSC-CMs المستزرعة لمدة 60 يوما ، واغسل الخلايا 3x باستخدام PBS ، وافصل hiPSC-CMs إلى خلايا فردية عند 37 درجة مئوية باستخدام خليط إنزيم انفصال الخلية (~ 3-5 دقائق). اجمع الخلايا في أنبوب طرد مركزي سعة 15 مل يحتوي على 5 مل من وسط RPMI + B27 واخلطه جيدا قبل عد الخلايا لحساب العدد الإجمالي للخلايا. أجهزة الطرد المركزي تعليق الخلية في 300 × غرام لمدة 2 دقيقة في درجة حرارة الغرفة. تخلص من المادة الطافية وأضف وسط دعم عضلة القلب لإعادة تعليقه إلى تركيز 0.6 × 105 خلايا / ميكرولتر.
- احتفظ بأنبوب الطرد المركزي الذي يحتوي على hiPSC-CMs المعاد تعليقه جاهزا عند 37 درجة مئوية للحقن14،17،18،19،20.
- ضع الفئران في صندوق تخدير متصل بالإيزوفلوران للحث على استنشاق التخدير متبوعا باستخدام مرهم بيطري على العينين لمنع الجفاف أثناء التخدير.
ملاحظة: كان تركيز الأيزوفلوران 5٪. انتبه إلى تهوية المختبر أثناء التجربة. - ابحث عن فقدان ردود الفعل في منطقة القدمين والذيل بعد القرص عند وضع الماوس بشكل مسطح على طاولة العمليات ، مما يشير إلى التخدير الكافي. تطبيق البوبرينورفين (0.1 ملغ/ كغ) داخل الصفاق.
- تشويه الشعر على منتصف الرقبة والصدر الأيسر للفئران مع كريم مزيل الشعر ، ومسح كريم تطبيق والشعر مع الشاش بعد 5 دقائق.
- إصلاح الأطراف وذيل الماوس مع الشريط. إصلاح قواطع الماوس مع خيط الحرير 2-0 والشريط. تعقيم المنطقة الجراحية (متوسط الرقبة والصدر الأيسر) بثلاث جولات متناوبة من البيتادين متبوعة بالكحول.
- ضع ستارة جراحية حول المنطقة الجراحية المعقمة. بعد ذلك ، قم بعمل شق متوسط في الرقبة باستخدام مقص تشريحي دقيق وملقط تشريح دقيق لكشف القصبة الهوائية بالكامل. إذا لزم الأمر ، قم بقطع بعض عضلات عنق الرحم الأمامية لتحقيق الاستقرار.
ملاحظة: تم تعمية المشغلين عن مجموعات الحيوانات. - أدخل أنبوب القصبة الهوائية (إبرة ثقب القسطرة 20 جم) عبر الفم.
- قم بتوصيل أنبوب القصبة الهوائية بجهاز التنفس الصناعي وتحقق من الحركة الصدرية للتأكد من أن كلتا الرئتين جيدة التهوية.
- ضبط معلمات التنفس (معدل التنفس: 100-150 نبضة في الدقيقة ، حجم المد والجزر 250-300 ميكرولتر). بعد ذلك ، أعد تثبيت الطرف الخلفي الأيسر إلى الجانب الأيمن السفلي ، وقم بفك الشريط حول الطرف العلوي الأيسر ، وقم بإجراء بضع الصدر في المساحة الوربية للصدر الأيسر 3-4 باستخدام مقص تشريح دقيق وملقط لأقصى قدر من التعرض للقلب.
- باستخدام الملقط، انزع التأمور تحت المجهر لتصوير الشريان التاجي الأمامي الأيسر النازل (LAD) عند الحافة السفلية للزائدة الأذينية اليسرى.
- استخدم خيطا حريريا 6-0 لربط الطرف القريب من LAD. بعد التأكد من إنشاء نموذج MI الحاد بشكل كاف (عندما يتغير LAD البعيد في موقع الربط من الأحمر إلى الأبيض) ، أغلق طبقة الصدر بطبقة وخيط الجلد ب 4-0 غرز متقطعة ملولبة. إجراء جميع العمليات الجراحية المذكورة أعلاه لتحريض MI لمجموعة وهمية من الحيوانات باستثناء الربط.
- قم بإيقاف تشغيل التخدير الاستنشاقي ، وإزالة القنية بعد أن يستأنف الماوس التنفس التلقائي ، وإعادته إلى قفصه. راقب الحيوان حتى يستعيد وعيه الكافي للحفاظ على الاستلقاء القصي. لا تعيده إلى شركة الحيوانات الأخرى حتى يتعافى تماما. يجب تطبيق الحقن داخل الصفاق للبوبرينورفين (0.1 ملغ/ كغ × 3 أيام) وكاربروفين (5 ملغ/ كغ × يوم واحد) كل 12 ساعة بعد العملية.
- حقن السيكلوسبورين A (10 ملغ · كجم -1 · يوم -1) في التجويف داخل الصفاق للفئران قبل 3 أيام من إعطاء hiPSC-CMs لمنع رفض الخلايا المزروعة. حقن السيكلوسبورين A بشكل مستمر لمدة 1 شهر بعد الزرع.
3. حقن hiPSC-CM تحت توجيه الموجات فوق الصوتية
- بعد إعداد نموذج MI ، قم بتعيين الفئران النموذجية MI (الفئران C57BL / 6 البالغة من العمر 12 أسبوعا ؛ 22 جم إلى 24 جم في الوزن ، 50٪ ذكر و 50٪ إناث) إلى جرعة واحدة (SD ، n = 8 في هذه الدراسة) ومجموعات متعددة الجرعات (MD ، n = 8 في هذه الدراسة) في أول يوم بعد MI ووضعها في الأسبوعين الأول والثاني بعد MI في صندوق تخدير متصل ب 5٪ إيزوفلوران لتحريض التخدير بالاستنشاق متبوعا ب التنبيب الرغامي.
- تشويه الشعر على الصدر والجزء العلوي من البطن من الفئران مع كريم مزيل الشعر ومسح كريم قبالة مع الشاش بعد 5 دقائق. مراقبة معدل ضربات القلب للماوس على لوحة العمليات وإدارة استنشاق إيزوفلوران حتى يتم الحفاظ على معدل ضربات القلب في 400-500 نبضة في الدقيقة.
- ثبت أطراف الماوس والذيل بشريط لاصق على وحدة التحكم في الكشف واضبط درجة حرارة المنصة على 37 درجة مئوية.
- ضع جيلي خاص بالموجات فوق الصوتية على الجزء العلوي من البطن واستخدم مسبارا بيطريا أصغر بالموجات فوق الصوتية عالي الدقة للحصول على صور كبد الفأر.
- خفض معدل التنفس الصناعي إلى 50 نبضة في الدقيقة. استخدم حقنة مجهرية سعة 5 ميكرولتر لرسم ~ 3 × 105 خلايا (من الخطوة 2.1). أمسك المحقنة بمناور دقيق ، أدخل إبرة 3 مم في عملية شبه الخنجري اليسرى (الشكل 1 أ). اتبع الحافة العلوية للحجاب الحاجز تحت توجيه الموجات فوق الصوتية (الشكل 1 ب) ، وراقب إيقاع الجهاز التنفسي ونطاقه (الشكل 1 ج ، د) ، وأدخل التامور في نهاية دورة الزفير لتجنب تلف الكبد والرئة (الشكل 1 د).
- بعد دخول إبرة الحاقن الدقيق إلى تجويف التامور ، اضبط معدل التنفس على المعلمة الأصلية (150 نبضة في الدقيقة). احصل على صورة المحور الطويل لقلب الفأر بواسطة تخطيط صدى القلب M-mold وفقا لتعليمات الشركة الصانعة17 (الشكل 1E). تحت التوجيه بالموجات فوق الصوتية ، حقن 3 × 10 5 خلايا (الشكل 1F) في ثلاث مناطق هامشية (1 × 105 خلايا لكل موقع حقن) من موقع الاحتشاء.
- إزالة مسبار الموجات فوق الصوتية الخاص وشطف الهلام. فطم الفأر عن التخدير الاستنشاقي ، وأعده إلى قفصه بعد وعيه الكامل.
- كرر إجراءات حقن الخلايا الموجهة بالموجات فوق الصوتية المذكورة أعلاه بعد 1 و 2 أسابيع من إنشاء MI لمجموعة الفئران MD.
4. تقييم وظائف القلب ، ووضع العلامات الفلورية ، وعدد الخلايا المزروعة ، ومنطقة احتشاء عضلة القلب ، واكتشاف الميتوكوندريا البشرية في الفئران بعد 30 يوما من ربط الفرع الأمامي الهابط الأيسر
- تقييم وظائف القلب
- ضع الماوس في صندوق تخدير متصل بالإيزوفلوران للتخدير التعريفي والاستنشاق متبوعا باستخدام مرهم بيطري على العينين لمنع الجفاف أثناء التخدير. إزالة الشعر على الصدر الأيسر من الماوس مع كريم مزيل الشعر. ضع الماوس على لوحة التشغيل لمراقبة معدل ضربات القلب وضبط استنشاق الأيزوفلوران. الحفاظ على معدل ضربات قلب الماوس في 400-500 نبضة في الدقيقة. نقطة النهاية التجريبية هي اليوم 30 (بعد تحريض MI).
- ثبت أطراف الماوس والذيل بشريط لاصق على وحدة التحكم في الكشف واضبط درجة حرارة المنصة على 37 درجة مئوية.
- بعد تطبيق هلام الموجات فوق الصوتية الخاص على منطقة القلب الأمامية ، استخدم مسبار الموجات فوق الصوتية القلبية عالي الدقة (البيطري) للحصول على صور المحور الطويل ثنائي الأبعاد والمحور القصير ثنائي الأبعاد تحت تخطيط صدى القلب من M-mold و B-mold وفقا لتعليمات الشركة الصانعة17.
- بعد اكتمال الكشف بالموجات فوق الصوتية ، شطف هلام الموجات فوق الصوتية الخاص ، وإيقاف التخدير استنشاق ، وإعادة الماوس إلى قفصه بشكل منفصل بعد الوعي الكامل.
- تحليل البيانات التي تم الحصول عليها وحساب الكسر القذفي البطين الأيسر (EF) والتقصير الجزئي (FS) باستخدام برنامج التحليل. تأكد من أن المشغل أعمى عن المجموعات التجريبية17.
- وضع العلامات الفلورية للأقسام
- اغسل القلب المعزول باستخدام برنامج تلفزيوني ، واغمره في 4٪ بارافورمالدهيد عند 4 درجات مئوية لمدة 12 ساعة. أخرج القلب واغمره في 30٪ سكروز لمدة 24 ساعة حتى يجف.
- قم بتضمين القلب المجفف بمركب درجة حرارة القطع المثلى (OCT) على الثلج الجاف. قم بتقطيع القلب من الأسفل إلى القمة بسمك 10 ميكرومتر وضع الأقسام على الشرائح وقم بتخزين الشرائح عند -20 درجة مئوية.
- اغسل الشرائح بأنسجة القلب باستخدام برنامج تلفزيوني لمدة 3 دقائق.
- تخلل الأنسجة على الشرائح بنسبة 0.5٪ Triton X-100 في درجة حرارة الغرفة لمدة 8 دقائق واغسلها 3x باستخدام PBS لمدة 5 دقائق لكل غسلة.
- بعد تغطية الأنسجة بمصل حمار 10٪ و 90٪ PBS (محلول مانع) ، قم بسد الأقسام لمدة 1 ساعة في درجة حرارة الغرفة.
- بعد إزالة محلول الحجب ، احتضان الأقسام بالجسم المضاد الأساسي (مخفف إلى 1: 100 بمحلول الحظر) طوال الليل عند 4 درجات مئوية. اغسلها 3 مرات باستخدام برنامج تلفزيوني لمدة 5 دقائق لكل غسلة.
- احتضان الأنسجة على الشرائح مع الأجسام المضادة الثانوية المترافقة الفلورية (المخففة إلى 1: 100 مع محلول الحظر) لمدة 1 ساعة في درجة حرارة الغرفة.
ملاحظة: تجنب تعريض الأنسجة بالجسم المضاد الثانوي المترافق بالفلوروفور للضوء من هذه النقطة فصاعدا. - اغسل الشرائح 3x باستخدام PBS لمدة 5 دقائق لكل غسلة.
- قم بتركيب الشرائح باستخدام وسيط تركيب يحتوي على 4 '، 6-diamidino-2-phenylindole (DAPI) وصورة تحت مجهر مضان17.
- عدد hiPSC-CMs المزروعة17
- إجراء تلطيخ الأنسجة المناعية على الأجزاء المجمدة من القلب للتروبونين T الخاص بالمشاة (hcTnT) ، والمستضد النووي البشري (HNA) ، و Sarcomeric Alpha Actinin غير المحدد.
- بعد تقسيم القلب كله بشكل متسلسل ، خذ قسما واحدا لكل 50 قسما لوضع العلامات الفلورية.
- التقط عشوائيا خمس صور عالية التكبير لكل شريحة. احسب عدد حقول الرؤية المطعمة ، واحسب متوسط عدد الخلايا المطعمة لكل وحدة مساحة ، وقم بتعيينها على أنها A1 / μm2. احسب إجمالي المساحة المطعمة للشريحة باستخدام ImageJ (https://imagej.nih.gov/ij/) وقم بتعيينها ك B1μm2 بحيث يكون الرقم المطعمة في هذه الشريحة = A1 × B121,22.
- احسب العدد الإجمالي للخلايا المطعمة لكل قلب فأر باستخدام Eq (1) والنسبة المئوية لمعدل النقش باستخدام Eq (2) ، بالنظر إلى أنه تم اختيار قسم واحد من كل 50 قسما21,22.
- إجمالي عدد الخلايا المطعمة لكل قلب فأر = (A1 × B1 + A2 × B2 +...+ × مليار) × 50 (1)
معدل النقش =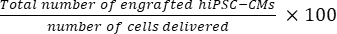 (2)
(2)
ملاحظة: كان عدد الولادات 3 × 10 5 لمجموعة SD و 3 × 3 × 105 لمجموعة MD.
- تقييم منطقة احتشاء عضلة القلب
- قطع قسم مجمد مستعرض (محور قصير) من القلب المعزول ، من القمة إلى قاعدة القلب بسمك 10 ميكرومتر.
- بعد تقسيم القلب بالكامل بشكل متسلسل ، خذ شريحة قسم واحد لكل 30 قسما وقم بتثبيتها في محلول Bouin المسخن مسبقا عند 58 درجة مئوية. قم بتلطيخ القسم ببقع كولاجين حمراء مباشرة بنسبة 0.04٪ و 0.1٪ من الكولاجين الأخضر السريع (مخففة في برنامج تلفزيوني) وفقا لتعليمات الشركة الصانعة17.
- استخدم برنامجا (على سبيل المثال ، ImageJ) لتحليل الصور بعد التصوير المقطعي لكامل الجسم للقلب تحت المجهر باستخدام Eq (3): 14،17
مساحة الاحتشاء٪ =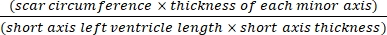 × 100٪ (3)
× 100٪ (3)
- الكشف عن الحمض النووي للميتوكوندريا البشرية في مختلف الأعضاء
- تخدير الفئران بنسبة 5٪ إيزوفلوران والتضحية بها عن طريق خلع عنق الرحم الخلفي. تشريح الفئران بعد 4 أسابيع من زرع الخلايا. حصاد الأعضاء (الكبد والرئة والدماغ والكلى والطحال) وجزء من عضلة القلب (ن = 3 في هذا القسم).
- قم بطحن كل نسيج عضو في النيتروجين السائل واستخراج الحمض النووي من الأنسجة باستخدام المجموعة المشار إليها (انظر جدول المواد) وفقا لتعليمات الشركة المصنعة.
- اتبع تعليمات الشركة المصنعة لاستخدام المجموعة والبادئات المشار إليها (انظر جدول المواد) للكشف عن الحمض النووي للميتوكوندريا البشرية في الأنسجة المذكورة أعلاه (من الخطوة 4.5.1).
النتائج
كشف تخطيط صدى القلب لتقييم وظيفة البطين الأيسر للفئران في كل مجموعة أن إصابات MI قد انعكست بشكل فعال في مجموعة MD (الشكل 2 أ). بالمقارنة مع مجموعة MI ، أظهرت مجموعة SD زيادة في الكسر القذفي (EF) (من 30٪ إلى 35٪ ؛ الشكل 2 ب) وتقصير الكسور (FS) (من 18٪ إلى 22٪ ؛ الشك?...
Discussion
تشمل الخطوات الحاسمة لهذه الدراسة ثقافة hiPSC ، وتمايز خلايا عضلة القلب ، وتنقية hiPSC-CM ، وزرع hiPSC-CM في موقع احتشاء عضلة القلب الفأر. المفتاح هو استخدام الموجات فوق الصوتية للقلب لتوجيه العلاج عبر الجلد نحو موقع الاحتشاء على حافة الاحتشاء حيث تم حقن hiPSC-CMs في المنطقة.
مع إطالة وقت ...
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم دعم هذا العمل من خلال خطة البحث الرئيسية للمؤسسة الوطنية للعلوم الطبيعية في الصين (رقم 91539111 إلى JY) ، والمشروع الرئيسي للعلوم والتكنولوجيا في مقاطعة هونان (رقم 2020SK53420 إلى JY) وبرنامج الابتكار العلمي والتكنولوجي لمقاطعة هونان (2021RC2106 إلى CF).
Materials
| Name | Company | Catalog Number | Comments |
| Antibody | |||
| Cardiac troponin T | Abcam | ab8295 | |
| Donkey Anti-Mouse IgG H&L (Alexa Fluor 488) | Abcam | ab150105 | |
| Donkey Anti-Mouse IgG H&L (Alexa Fluor 555) | Abcam | ab150110 | |
| Donkey Anti-Rabbit IgG H&L (Alexa Fluor 488) | Abcam | ab150073 | |
| Donkey Anti-Rabbit IgG H&L (Alexa Fluor 555) | Abcam | ab150062 | |
| Human cardiac troponin T | Abcam | ab91605 | |
| Isolectin B4 | Vector | FL-1201 | |
| Sarcomeric alpha actinin | Abcam | ab9465 | |
| Wheat germ agglutinin | Thermo Fisher Scientific | W11261 | |
| Reagent | |||
| Accutase | Thermo Fisher Scientific | 00-4555-56 | |
| B27 Supplement(minus insulin) | Thermo Fisher Scientific | A1895601 | |
| B27 Supplement(serum free) | Thermo Fisher Scientific | 17–504-044 | |
| Bouin's solution | Thermo Fisher Scientific | SDHT10132 | |
| CHIR99021 | Selleck | CT99021 | |
| cyclosporin A | Medchemexpress | HY-B0579 | |
| DIRECT RED | Sigma-Aldrich | 365548-25G | |
| DMEM/F12 | Thermo Fisher Scientific | 11320033 | |
| DNeasy Blood & Tissue Kit | Qiagen | 69504 | |
| FAST GREEN FCF | Sigma-Aldrich | F7252-5G | |
| Glucose-free RPMI 1640 | Thermo Fisher Scientific | 11879020 | |
| IWR1 | Selleck | S7086 | |
| lactic acid | Sigma-Aldrich | L6661 | |
| Matrigel | BD Biosciences | BD356234 | |
| mTeSR1 | Stem Cell Technologies | 72562 | |
| O.C.T. Compound | SAKURA | 4583 | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| PowerUP SYBR Green MasterMix kit | Thermo Fisher Scientific | A25742 | |
| RPMI1640 | Thermo Fisher Scientific | 11875119 | |
| STEMdif Cardiomyocyte Freezing Medium/STEMdiff | Stem Cell Technologies | 5030 | |
| STEMdiff Cardiomyocyte Support Medium | Stem Cell Technologies | 5027 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| ultrasound coupling agent | CARENT | 22396269389 | |
| Y-27632 | Selleck | S6390 | |
| Equipment and Supplies | |||
| Applied Biosystems | Thermo Fisher Scientific | 7500 Real-Time PCR | |
| cryostat | Leica | CM1950 | |
| fluoresence microscope | Olympus | IX83 | |
| fine anatomical scissors | Fine Science Tools | 15000-08 | |
| fine dissecting forceps | Fine Science Tools | 11255-20 | |
| Micro syringe | Hamilton | 7633 | |
| Small animal anesthesia machine | MATRX | VMR | |
| Ultra-high resolution small animal ultrasound imaging system | VisualSonics | Vevo 2100 | |
| Software | |||
| Statistical Product and Service Solutions | IBM | 21 | |
| Image J | NIH | 1.48 | |
| Human mitochondrial DNA primers | |||
| the forward primer sequence | CCGCTACCATAATCATCGCTAT | ||
| the reverse primer sequence | TGCTAATACAATGCCAGTCAGG |
References
- Leuschner, F., et al. Rapid monocyte kinetics in acute myocardial infarction are sustained by extramedullary monocytopoiesis. The Journal of Experimental Medicine. 209 (1), 123-137 (2012).
- Lázár, E., et al. Cardiomyocyte renewal in the human heart: insights from the fall-out. European Heart Journal. 38 (30), 2333-2342 (2017).
- Davis, M. K., et al. State of the art: cardiac transplantation. Trends in Cardiovascular Medicine. 24 (8), 341-349 (2014).
- Mancini, D., Colombo, P. C. Left ventricular assist devices: A rapidly evolving alternative to transplant. Journal of the American College of Cardiology. 65 (23), 2542-2555 (2015).
- Zimmermann, W. H. Translating myocardial remuscularization. Circulation Research. 120 (2), 278-281 (2017).
- Hu, X., et al. A large-scale investigation of hypoxia-preconditioned allogeneic mesenchymal stem cells for myocardial repair in nonhuman primates: Paracrine activity without remuscularization. Circulation Research. 118 (6), 970-983 (2016).
- Kempf, H., et al. Cardiac differentiation of human pluripotent stem cells in scalable suspension culture. Nature Protocols. 10 (9), 1345-1361 (2015).
- Chong, J. J., et al. Human embryonic-stem-cell-derived cardiomyocytes regenerate non-human primate hearts. Nature. 510 (7504), 273-277 (2014).
- Shiba, Y., et al. Allogeneic transplantation of iPS cell-derived cardiomyocytes regenerates primate hearts. Nature. 538 (7625), 388-391 (2016).
- Nguyen, P. K., et al. Potential strategies to address the major clinical barriers facing stem cell regenerative therapy for cardiovascular disease: A review. JAMA Cardiology. 1 (8), 953-962 (2016).
- Zimmermann, W. H. Remuscularization of the failing heart. The Journal of Physiology. 595 (12), 3685-3690 (2017).
- Hu, X., et al. Transplantation of hypoxia-preconditioned mesenchymal stem cells improves infarcted heart function via enhanced survival of implanted cells and angiogenesis. The Journal of Thoracic and Cardiovascular Surgery. 135 (4), 799-808 (2008).
- Feng, Y., et al. Heat shock improves Sca-1+ stem cell survival and directs ischemic cardiomyocytes toward a prosurvival phenotype via exosomal transfer: a critical role for HSF1/miR-34a/HSP70 pathway. Stem Cells. 32 (2), 462-472 (2014).
- Fan, C., et al. Cardiomyocytes from CCND2-overexpressing human induced-pluripotent stem cells repopulate the myocardial scar in mice: A 6-month study. Journal of Molecular and Cellular Cardiology. 137, 25-33 (2019).
- Lou, X., et al. N-cadherin overexpression enhances the reparative potency of human-induced pluripotent stem cell-derived cardiac myocytes in infarcted mouse hearts. Cardiovascular Research. 116 (3), 671-685 (2020).
- Sun, X., et al. Transplanted microvessels improve pluripotent stem cell-derived cardiomyocyte engraftment and cardiac function after infarction in rats. Science Translational Medicine. 12 (562), (2020).
- Wu, X., et al. Cardiac repair with echocardiography-guided multiple percutaneous left ventricular intramyocardial injection of hiPSC-CMs after myocardial infarction. Frontiers in Cardiovascular Medicine. 8, 768873 (2021).
- Kannappan, R., et al. Functionally competent DNA damage-free induced pluripotent stem cell-derived cardiomyocytes for myocardial repair. Circulation. 140 (6), 520-522 (2019).
- Lou, X., et al. N-cadherin overexpression enhances the reparative potency of human-induced pluripotent stem cell-derived cardiac myocytes in infarcted mouse hearts. Cardiovascular Research. 116 (3), 671-685 (2020).
- Zhao, M., et al. Y-27632 preconditioning enhances transplantation of human-induced pluripotent stem cell-derived cardiomyocytes in myocardial infarction mice. Cardiovascular Research. 115 (2), 343-356 (2019).
- Zhao, M., et al. Enhancing the engraftment of human induced pluripotent stem cell-derived cardiomyocytes via a transient inhibition of rho kinase activity. Journal of Visualized Experiments: JoVE. (149), e59452 (2019).
- O'Brien, J., Hayder, H., Peng, C. Automated quantification and analysis of cell counting procedures using ImageJ plugins. Journal of Visualized Experiments: JoVE. (117), e54719 (2016).
- Kain, V., Prabhu, S. D., Halade, G. V. Inflammation revisited: inflammation versus resolution of inflammation following myocardial infarction. Basic Research in Cardiology. 109 (6), 444 (2014).
- Rainer, P. P., et al. Cardiomyocyte-specific transforming growth factor β suppression blocks neutrophil infiltration, augments multiple cytoprotective cascades, and reduces early mortality after myocardial infarction. Circulation Research. 114 (8), 1246-1257 (2014).
- Yu, Y., et al. Human embryonic stem cell-derived cardiomyocyte therapy in mouse permanent ischemia and ischemia-reperfusion models. Stem Cell Research & Therapy. 10 (1), 167 (2019).
- Iwanaga, K., et al. Effects of G-CSF on cardiac remodeling after acute myocardial infarction in swine. Biochemical and Biophysical Research Communications. 325 (4), 1353-1359 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved