É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Implante de Cardiomiócitos Derivados de Células-Tronco Pluripotentes Induzidos por Ultrassom em Camundongos Infartados do Miocárdio
Neste Artigo
Resumo
A entrega celular guiada por ultrassom ao redor do local do infarto do miocárdio em camundongos é uma maneira segura, eficaz e conveniente de transplante de células.
Resumo
O principal objetivo da terapia celular após o infarto do miocárdio (IM) é aumentar efetivamente a taxa de enxertos celulares, e os cardiomiócitos derivados de células-tronco pluripotentes induzidos por humanos (hiPSC-CMs) são uma fonte promissora de células para reparo cardíaco após dano isquêmico. No entanto, uma baixa taxa de enxertos é um obstáculo significativo para a regeneração efetiva do tecido cardíaco após o transplante. Esse protocolo mostra que múltiplas injeções percutâneas guiadas por ultrassom hiPSC-CM em uma área de IM efetivamente aumentam as taxas de transplante celular. O estudo também descreve todo o processo de cultura de hiPSC-CM, pré-tratamento e métodos de parto percutâneo guiados por ultrassom. Além disso, o uso de DNA mitocondrial humano ajuda a detectar a ausência de hiPSC-CMs em outros órgãos de camundongos. Finalmente, este trabalho descreve as alterações na função cardíaca, angiogênese, tamanho celular e apoptose na zona borda infartada em camundongos 4 semanas após a entrega celular. Pode-se concluir que a injeção percutânea do miocárdio ventricular esquerdo guiada por ecocardiografia é uma terapia celular factível, relativamente invasiva, satisfatória, repetível e eficaz.
Introdução
Quando ocorre IAM agudo, as células miocárdicas na área infartada morrem rapidamente devido à isquemia e hipóxia. Vários fatores inflamatórios são liberados após a morte e ruptura celular, enquanto as células inflamatórias infiltram o local do infarto para causar inflamação1. Significativamente, fibroblastos e colágeno, ambos sem contratilidade e condutividade elétrica, substituem as células miocárdicas no local infartado para formar tecido cicatricial. Devido à limitada capacidade de regeneração dos cardiomiócitos em mamíferos adultos, o tecido viável formado após uma grande área de infarto geralmente não é adequado para manter débito cardíaco suficiente2. O IM causa insuficiência cardíaca e, em casos graves de insuficiência cardíaca, os pacientes só podem contar com transplantes cardíacos ou dispositivos de assistência ventricular para manter as funções cardíacas normais 3,4.
Após o IM, a estratégia ideal de tratamento é substituir os cardiomiócitos mortos por cardiomiócitos neoformados, formando acoplamento eletromecânico com tecidos normais. No entanto, as opções de tratamento têm tipicamente adotado o salvamento miocárdico em vez da reposição. Atualmente, as terapias baseadas em células-tronco e células progenitoras estão entre as estratégias mais promissoras para promover o reparo miocárdico após oIM5. Entretanto, o transplante dessas células apresenta vários problemas, principalmente a incapacidade das células-tronco adultas de se diferenciarem em cardiomiócitos e seu curto tempo de vida6.
As questões éticas relacionadas ao uso de células-tronco embrionárias (ES) podem ser contornadas pelas iPSCs, que são uma fonte promissora de células. Além disso, as iPSCs possuem forte capacidade de autorrenovação e podem se diferenciar em cardiomiócitos7. Estudos têm demonstrado que os MC-hiPSC transplantados para o sítio do IM podem sobreviver e formar junções comunicantes com as células do hospedeiro 8,9. Entretanto, como essas células transplantadas estão localizadas no microambiente de isquemia e inflamação, sua taxa de sobrevida é extremamentebaixa10,11.
Vários métodos têm sido estabelecidos para melhorar a sobrevida das células transplantadas, como o pré-tratamento com hipóxia e choque térmico das células transplantadas12,13, a modificação genética 14,15 e o transplante simultâneo de células e capilares 16. Infelizmente, a maioria dos métodos é limitada pela complexidade e alto custo. Assim, o presente estudo propõe um método de administração de hiPSC-CM reprodutível, conveniente, relativamente invasivo e eficaz.
A injeção intramiocárdica de células intramiocárdicas guiada por ultrassom pode ser realizada apenas com um pequeno aparelho de ultrassom veterinário de alta resolução e um microinjetor, independentemente do local. Sob orientação ultrassonográfica, a entrega direta de células sob o processo xifoide do pericárdio para o miocárdio em camundongos é um protocolo seguro que evita danos hepáticos e pulmonares. Este método pode ser combinado simultaneamente com outras tecnologias para melhorar significativamente a taxa de sobrevivência das células transplantadas.
Protocolo
Todos os experimentos com animais neste estudo foram revisados e aprovados pelo comitê de ética do Segundo Hospital Xiangya da Universidade Central Sul. Consulte a Tabela de Materiais para obter detalhes sobre todos os materiais e equipamentos utilizados neste protocolo. Os prazos para injeção celular, imagem e eutanásia são os seguintes: t0- induzir infarto, t1 semana- imagem e implante de células, t2 semanas- imagem e implante de células, t4 semanas- imagem final, eutanásia e coleta de tecido.
1. cultura de hiPSC, diferenciação de cardiomiócitos e purificação celular
- Misturar DMEM/F12 e solução-mãe de matriz de membrana basal com gelo a 4 °C numa proporção de 1,5:1, alíquota, e armazenar a mistura resultante (diluente de matriz) a -20 °C. Misturar 25 mL de meio de cultura DMEM/F12 a 4 °C e 1 mL de diluente de matriz completamente com gelo e espalhar 1 mL/poço em uma placa de 6 poços. Manter a placa na posição vertical por 1 h em estufa a 37 °C e aspirar o sobrenadante DMEM/F12 dos poços. Não toque no fundo da placa de 6 poços ao realizar o procedimento.
- Remover o tubo de criopreservação que contém as hiPSC do azoto líquido e descongelá-las rapidamente num banho-maria a 37 °C. Esterilize a superfície externa do tubo de criopreservação com álcool 75%, limpe o álcool e transfira o tubo para uma mesa estéril ultralimpa.
- Use uma pipeta para transferir suavemente a solução de criopreservação contendo hiPSCs para um tubo de centrífuga de 15 mL, adicionar 5 mL de meio ES sem alimentador e centrifugar a suspensão a 300 × g por 3 min à temperatura ambiente. Descarte o sobrenadante e ressuspenda suavemente as células em 6 mL do meio ES livre do alimentador. Contar as células e ajustar a concentração celular para 5 × 105 células/mL com o meio de cultura.
- Adicione o inibidor de ROCK (Y27632) às hiPSCs até uma concentração final de 5 μM. Transfira as hiPSCs com Y27632 para a placa de 6 poços pré-tratada com matriz de membrana basal e gire suavemente a placa de 6 poços, traçando a forma do número "8" para distribuir uniformemente as hiPSCs. Colocar as hiPSCs em estufa úmida a 37 °C com 5% de CO2 na posição vertical por 24 horas. Substitua o sobrenadante pelo meio ES sem alimentador sem o Y27632.
- Quando as hiPSCs atingirem 80% de confluência, aspirar o sobrenadante da cultura, lavar as células duas vezes com solução salina tamponada com fosfato (PBS), adicionar RPMI1640 + B27 sem insulina contendo 10 μM CHIR99021 (inibidor da GSK3-β) e colocar as hiPSCs em uma incubadora úmida de CO2 a 37 °C por 24 h.
- Substitua metade do sobrenadante pelo meio RPMI1640 + B27 sem insulina e incube as células por mais 24 h.
- Substitua completamente o meio de cultura por RPMI1640 + B27 (sem insulina). Colocar as placas numa estufa húmida a 37 °C com 5% de CO2 na posição vertical durante 24 horas.
- Substituir completamente o meio de cultura após 3 dias por RPMI1640 + B27 + 5 μM IWR1 (inibidor da via de sinalização Wnt) e colocar as placas em estufa úmida a 37 °C com 5% de CO2 por 48 h.
- Substitua o meio de cultura após 5 dias por RPMI1640 + B27 sem insulina e continue incubando por 48 h em estufa úmida de CO2 a 37 °C.
- Substitua o meio de cultura pelo meio RPMI + B27 (incluindo insulina) após 7 dias e coloque as placas em uma incubadora de CO2 umidificada por 3 dias a 37 °C. Substitua o meio pelo meio RPMI + B27 a cada 3 dias. Procure o batimento espontâneo das células aos 9-12 dias de diferenciação.
- Após a observação das células pulsáteis, substituir o meio RPMI + B27 por meio RPMI 1640 livre de glicose contendo ácido lático (1 mL de ácido láctico adicionado a 500 mL de meio RPMI 1640 livre de glicose). Incubar as células durante 72 h numa estufa húmida a 37 °C com 5% de CO2.
- Após 72 h, substituir o sobrenadante por meio RPMI + B27 e incubar por 48 h em estufa úmida a 37 °C com 5% de CO2.
- Aspirar o sobrenadante da cultura sob pressão negativa e lavar as células 3x com PBS para remover vestígios do meio de cultura. Use a mistura de enzimas de desprendimento celular para dissociar os hiPSC-CMs em células individuais a 37 °C. Coletar as células obtidas em um tubo de centrífuga de 15 mL contendo 3 mL de solução suporte de cardiomiócitos, centrifugar a 300 × g por 2 min à temperatura ambiente e descartar o sobrenadante.
- Ressuspender as células com meio RPMI + B27, semeá-las em placas de 6 poços revestidas com matriz de membrana basal e incubá-las por 48 h em estufa úmida a 37 °C com 5% de CO2.
- Substitua o sobrenadante da cultura para purificação por meio RPMI 1640 livre de glicose contendo ácido lático e incube por 72 h em estufa úmida a 37 °C com 5% de CO2.
- Substitua o sobrenadante da cultura pelo meio RPMI + B27 e troque o meio a cada 3 dias.
- Continuar o processo acima por 30 dias, substituindo o sobrenadante da cultura por meio livre de glicose contendo ácido lático para posterior purificação. Incubar as células por 3 dias com este meio e substituir o sobrenadante por RPMI + B27. Cultivar as células continuamente por 30 dias até que os MC-hiPSC batam de forma estável e usar essas células para injeção intramiocárdica em camundongos.
2. Preparação de MC-hiPSC e o estabelecimento do modelo de infarto agudo do miocárdio em camundongos
- Aspirar a vácuo o sobrenadante da cultura de hiPSC-CMs cultivados por 60 dias, lavar as células 3x com PBS e dissociar as hiPSC-CMs em células individuais a 37 °C com a mistura de enzimas de desprendimento celular (~3-5 min). Coletar as células em um tubo centrífugo de 15 mL contendo 5 mL de meio RPMI + B27 e misturar bem antes de contar as células para calcular o número total de células. Centrifugar a suspensão da célula a 300 × g durante 2 minutos à temperatura ambiente. Eliminar o sobrenadante e adicionar o meio de suporte dos cardiomiócitos para ressuspender até uma concentração de 0,6 × 105 células/μL.
- Manter o tubo centrífugo contendo os hiPSC-CMs ressuspendidos pronto a 37 °C para injeção 14,17,18,19,20.
- Coloque os ratos em uma caixa de anestesia conectada com isoflurano para induzir a inalação anestésica seguida do uso de pomada veterinária nos olhos para evitar o ressecamento durante a anestesia.
OBS: A concentração de isoflurano foi de 5%. Preste atenção à ventilação do laboratório durante o experimento. - Procure perda de reflexos na região dos pés e cauda após beliscar quando o mouse é colocado na mesa de cirurgia, indicando anestesia suficiente. Administrar buprenorfina (0,1 mg/kg) por via intraperitoneal.
- Esfregue o cabelo no meio do pescoço e no peito esquerdo dos ratos com um creme depilatório e limpe o creme aplicado e o cabelo com gaze após 5 min.
- Fixe os membros e a cauda do rato com fita adesiva. Fixe os incisivos do mouse com um fio de seda 2-0 e fita. Esterilizar a área cirúrgica (pescoço mediano e tórax esquerdo) com três rodadas alternadas de betadina seguidas de álcool.
- Coloque um pano cirúrgico ao redor da área cirúrgica esterilizada. Em seguida, realizar incisão cervical mediana com tesoura anatômica fina e pinça dissecante fina para expor totalmente a traqueia. Se necessário, corte alguns músculos cervicais anteriores para estabilização.
NOTA: Os operadores foram cegados para os grupos de animais. - Insira um tubo traqueal (agulha de punção de cateter 20 G) pela boca.
- Conecte o tubo traqueal ao ventilador e verifique se há movimento torácico para garantir que ambos os pulmões estejam bem ventilados.
- Ajustar os parâmetros respiratórios (frequência respiratória: 100-150 bpm, volume corrente 250-300 μL). Em seguida, refixe o membro posterior esquerdo para o lado inferior direito, solte a fita ao redor do membro superior esquerdo e realize uma toracotomia no espaço intercostal 3-4 do tórax esquerdo usando tesoura e pinça dissecante fina para máxima exposição cardíaca.
- Com pinças, descascar o pericárdio ao microscópio para visualizar a artéria coronária descendente anterior (DA) na borda inferior do apêndice atrial esquerdo.
- Use um fio de seda 6-0 para ligar a extremidade proximal da DAD. Após garantir que o modelo de IM agudo esteja adequadamente estabelecido (quando a DA distal no local da ligadura muda de vermelho para branco), feche o tórax camada por camada e suture a pele com pontos intermitentes rosqueados 4-0. Realizar todos os procedimentos cirúrgicos acima mencionados para indução de IM para o grupo simulado de animais, exceto para ligadura.
- Desligue a anestesia inalatória, remova a cânula depois que o camundongo retomar a respiração espontânea e devolva-a à gaiola. Monitorar o animal até que ele tenha recuperado a consciência suficiente para manter a decúbito esternal. Não o devolva à companhia de outros animais até que esteja totalmente recuperado. Administrar injeções intraperitoneais de buprenorfina (0,1 mg/kg x 3 dias) e carprofeno (5 mg/kg x 1 dia) a cada 12 h de pós-operatório.
- Injetar ciclosporina A (10 mg·kg-1·dia-1) na cavidade intraperitoneal de camundongos 3 dias antes de administrar hiPSC-CMs para evitar a rejeição das células transplantadas. Injetar ciclosporina A continuamente por 1 mês após o transplante.
3. injeção de hiPSC-CM sob orientação ultrassonográfica
- Após a configuração do modelo de IM, atribuir os camundongos modelo MI (camundongos C57BL/6 com 12 semanas de idade; 22g a 24g de peso, 50% machos e 50% fêmeas) aos grupos de dose única (DP, n = 8 neste estudo) e dose múltipla (DM, n = 8 neste estudo) no primeiro dia pós-IM e colocá-los na primeira e segunda semanas após o IM em uma caixa de anestesia conectada com isoflurano a 5% para a indução da anestesia inalatória seguida de intubação traqueal.
- Esfregue o cabelo no peito e abdômen superior dos ratos com creme depilatório e limpe o creme com gaze 5 minutos depois. Monitorar a frequência cardíaca do mouse na placa de operação e administrar isoflurano inalatório até que a frequência cardíaca seja mantida em 400-500 bpm.
- Fixe os membros e a cauda do mouse com fita adesiva no console de detecção e ajuste a temperatura da plataforma em 37 °C.
- Aplique uma geleia de ultrassom especial no abdômen superior e use uma sonda de ultrassom veterinário de alta resolução menor para obter imagens do fígado de camundongo.
- Diminua a frequência ventilatória para 50 bpm. Use uma microseringa de 5 μL para extrair ~3 × 105 células (a partir da etapa 2.1). Segurando a seringa com um micromanipulador, insira uma agulha de 3 mm no processo paraxifóide esquerdo (Figura 1A). Seguir a borda superior do diafragma sob orientação ultrassonográfica (Figura 1B), observar o ritmo e a amplitude respiratória (Figura 1C,D) e entrar no pericárdio no final do ciclo expiratório, evitando danos ao fígado e ao pulmão (Figura 1D).
- Após a entrada da agulha do microinjetor na cavidade pericárdica, ajuste a frequência respiratória para o parâmetro original (150 bpm). Adquirir a imagem paraesternal de eixo longo do coração de camundongos por ecocardiografia em molde em M, de acordo com as instruções dofabricante17 (Figura 1E). Sob orientação ultra-sônica, injetar 3 × 10 5 células (Figura 1F) em três áreas marginais (1 × 105 células por local injetado) do local do infarto.
- Remova a sonda de ultrassom especial e enxágue a geleia. Desmame o rato da anestesia inalatória e devolva-o à sua gaiola após a plena consciência.
- Repita os procedimentos de injeção celular guiada por ultrassom acima 1 e 2 semanas após o estabelecimento do IM para os camundongos do grupo DM.
4. Avaliação da função cardíaca, marcação por fluorescência, contagem de células transplantadas, área de infarto do miocárdio e detecção de mitocôndrias humanas de órgãos em camundongos 30 dias após ligadura do ramo descendente anterior
- Avaliação da função cardíaca
- Coloque o rato numa caixa de anestesia ligada ao isoflurano para anestesia por indução-inalação, seguida do uso de pomada veterinária nos olhos para evitar o ressecamento durante a anestesia. Retire o pelo no peito esquerdo do rato com creme depilatório. Coloque o mouse no painel de operação para monitorar a frequência cardíaca e ajustar a inalação de isoflurano. Mantenha a frequência cardíaca do rato em 400-500 bpm. O desfecho experimental é o dia 30 (após a indução do IM).
- Fixe os membros e a cauda do mouse com fita adesiva no console de detecção e ajuste a temperatura da plataforma em 37 °C.
- Após a aplicação de um gel de ultrassom especial na área anterior do coração, utilizar uma sonda de ultrassom cardíaco de alta resolução (veterinária) para obter imagens paraesternais de eixo longo e eixo curto bidimensionais sob ecocardiografia de molde M e molde B de acordo com as instruções do fabricante17.
- Depois que a detecção ultra-sônica for concluída, enxágue o gel ultrassônico especial, desligue a anestesia inalatória e devolva o mouse à sua gaiola separadamente após a consciência total.
- Analisar os dados obtidos e calcular a fração de ejeção (FE) e fração de encurtamento (EF) do ventrículo esquerdo utilizando o software de análise. Certifique-se de que o operador esteja cego para os grupos experimentais17.
- Marcação por fluorescência de cortes
- Lave o coração isolado com PBS, mergulhe-o em paraformaldeído a 4% a 4 °C por 12 h. Retire o coração e mergulhe-o em sacarose a 30% por 24 h para desidratar.
- Incorpore o coração desidratado com o composto de temperatura de corte ideal (OCT) no gelo seco. Cortar o coração do fundo ao ápice com uma espessura de criostato de 10 μm e colocar as secções em lâminas e armazenar as lâminas a -20 °C.
- Lave as lâminas com o tecido cardíaco com PBS por 3 min.
- Permeabilizar o tecido em lâminas com Triton X-100 a 0,5% à temperatura ambiente por 8 min e lavá-las 3x com PBS por 5 min por lavagem.
- Depois de cobrir o tecido com soro de burro a 10% e PBS a 90% (solução de bloqueio), bloquear os cortes por 1 h à temperatura ambiente.
- Depois de remover a solução de bloqueio, incubar as secções com o anticorpo primário (diluído a 1:100 com a solução de bloqueio) durante a noite a 4 °C. Lave-os 3x com PBS por 5 min por lavagem.
- Incubar o tecido em lâminas com anticorpo secundário conjugado a fluoróforos (diluído a 1:100 com a solução bloqueadora) durante 1 h à temperatura ambiente.
NOTA: Evite expor os tecidos com o anticorpo secundário conjugado a fluoróforos à luz a partir deste ponto. - Lave as lâminas 3x com PBS por 5 min por lavagem.
- Montar as lâminas com meio de montagem contendo 4',6-diamidino-2-fenilindol (DAPI) e fotografar em microscópio de fluorescência17.
- Contagem de HIPSC-CMs transplantados17
- Realizar coloração de imunofluorescência tecidual em seções congeladas do coração para troponina T específica para pedestres (hcTnT), antígeno nuclear humano (HNA) e alfa actinina sarcomérica inespecífica.
- Depois que todo o coração foi seccionado em série, faça uma seção para cada 50 cortes para marcação por fluorescência.
- Capture aleatoriamente cinco imagens de alta ampliação por fatia. Conte o número enxertado de campos de visão, calcule o número médio de células enxertadas por unidade de área e defina-as como A1/μm2. Calcular a área total enxertada do corte utilizando ImageJ (https://imagej.nih.gov/ij/) e fixá-la como B1μm2 de modo que o número enxertado neste corte = A1 × B121,22.
- Calcular o número total de células enxertadas por coração de camundongo usando Eq (1) e a taxa percentual de enxertia usando Eq (2), uma vez que um corte foi escolhido a cada 50 cortes21,22.
- Número total de células enxertadas por coração de camundongo = (A1 × B1 + A2 × B2 +...+ An × Bn) × 50 (1)
taxa de enxertia =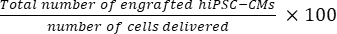 (2)
(2)
OBS: O número de partos foi de 3 × 10 5 para o grupo SD e 3 × 3 × 105 para o grupo DM.
- Avaliação da área de infarto do miocárdio
- Cortar uma seção transversa congelada (eixo curto) do coração isolado, do ápice à base do coração, com espessura de 10 μm.
- Depois que todo o coração tiver sido seccionado em série, pegue uma lâmina de seção para cada 30 seções e fixe-a em solução de Bouin pré-aquecida a 58 °C. Corar o corte com as colorações de colágeno Vermelho Direto 0,04% e Colágeno Verde Rápido 0,1% (diluído em PBS) de acordo com as instruções do fabricante17.
- Utilizar software (por exemplo, ImageJ) para analisar as imagens após fotografia transversal de corpo inteiro do coração ao microscópio usando Eq (3):14,17
Área de infarto % =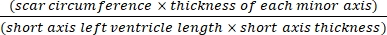 × 100% (3)
× 100% (3)
- Detecção de DNA mitocondrial humano em vários órgãos
- Anestesiar os camundongos com isoflurano a 5% e sacrificá-los por luxação cervical posterior. Dissecar os camundongos 4 semanas após o transplante celular. Retirar os órgãos (fígado, pulmão, cérebro, rim, baço) e parte do miocárdio (n = 3 nesta seção).
- Triture cada tecido do órgão em nitrogênio líquido e extraia o DNA do tecido usando o kit referenciado (consulte a Tabela de Materiais) de acordo com as instruções do fabricante.
- Siga as instruções do fabricante para utilizar o kit e os primers referenciados (ver Tabela de Materiais) para detectar o ADN mitocondrial humano nos tecidos acima mencionados (a partir do passo 4.5.1).
Resultados
O ecocardiograma para avaliação da função ventricular esquerda dos camundongos de cada grupo revelou que as lesões do IM foram efetivamente revertidas no grupo DM (Figura 2A). Em comparação com o grupo IM, o grupo SD apresentou aumento da fração de ejeção (FE) (de 30% para 35%; Figura 2B) e fração de encurtamento (EF) (de 18% para 22%; Figura 2C) após IM. No entanto, é ainda mais crucial notar que múltiplas injeçõe...
Discussão
As etapas críticas deste estudo incluem cultura de hiPSC, diferenciação de cardiomiócitos, purificação de hiPSC-CM e transplante de hiPSC-CM no local do infarto do miocárdio de camundongos. A chave é usar o ultrassom cardíaco para guiar transcutaneamente o tratamento em direção ao local do infarto na borda do infarto, onde os MC-hiPSC foram injetados na área.
Com o prolongamento do tempo de cultura, o fenótipo hiPSC-CM muda na morfologia (maior tamanho celular), estrutura (múscul...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pelo Plano de Pesquisa Principal da Fundação Nacional de Ciências Naturais da China (No. 91539111to JY), Projeto Chave de Ciência e Tecnologia da Província de Hunan (No. 2020SK53420 para JY) e pelo Programa de Inovação em Ciência e Tecnologia da Província de Hunan (2021RC2106 para CF).
Materiais
| Name | Company | Catalog Number | Comments |
| Antibody | |||
| Cardiac troponin T | Abcam | ab8295 | |
| Donkey Anti-Mouse IgG H&L (Alexa Fluor 488) | Abcam | ab150105 | |
| Donkey Anti-Mouse IgG H&L (Alexa Fluor 555) | Abcam | ab150110 | |
| Donkey Anti-Rabbit IgG H&L (Alexa Fluor 488) | Abcam | ab150073 | |
| Donkey Anti-Rabbit IgG H&L (Alexa Fluor 555) | Abcam | ab150062 | |
| Human cardiac troponin T | Abcam | ab91605 | |
| Isolectin B4 | Vector | FL-1201 | |
| Sarcomeric alpha actinin | Abcam | ab9465 | |
| Wheat germ agglutinin | Thermo Fisher Scientific | W11261 | |
| Reagent | |||
| Accutase | Thermo Fisher Scientific | 00-4555-56 | |
| B27 Supplement(minus insulin) | Thermo Fisher Scientific | A1895601 | |
| B27 Supplement(serum free) | Thermo Fisher Scientific | 17–504-044 | |
| Bouin's solution | Thermo Fisher Scientific | SDHT10132 | |
| CHIR99021 | Selleck | CT99021 | |
| cyclosporin A | Medchemexpress | HY-B0579 | |
| DIRECT RED | Sigma-Aldrich | 365548-25G | |
| DMEM/F12 | Thermo Fisher Scientific | 11320033 | |
| DNeasy Blood & Tissue Kit | Qiagen | 69504 | |
| FAST GREEN FCF | Sigma-Aldrich | F7252-5G | |
| Glucose-free RPMI 1640 | Thermo Fisher Scientific | 11879020 | |
| IWR1 | Selleck | S7086 | |
| lactic acid | Sigma-Aldrich | L6661 | |
| Matrigel | BD Biosciences | BD356234 | |
| mTeSR1 | Stem Cell Technologies | 72562 | |
| O.C.T. Compound | SAKURA | 4583 | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| PowerUP SYBR Green MasterMix kit | Thermo Fisher Scientific | A25742 | |
| RPMI1640 | Thermo Fisher Scientific | 11875119 | |
| STEMdif Cardiomyocyte Freezing Medium/STEMdiff | Stem Cell Technologies | 5030 | |
| STEMdiff Cardiomyocyte Support Medium | Stem Cell Technologies | 5027 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| ultrasound coupling agent | CARENT | 22396269389 | |
| Y-27632 | Selleck | S6390 | |
| Equipment and Supplies | |||
| Applied Biosystems | Thermo Fisher Scientific | 7500 Real-Time PCR | |
| cryostat | Leica | CM1950 | |
| fluoresence microscope | Olympus | IX83 | |
| fine anatomical scissors | Fine Science Tools | 15000-08 | |
| fine dissecting forceps | Fine Science Tools | 11255-20 | |
| Micro syringe | Hamilton | 7633 | |
| Small animal anesthesia machine | MATRX | VMR | |
| Ultra-high resolution small animal ultrasound imaging system | VisualSonics | Vevo 2100 | |
| Software | |||
| Statistical Product and Service Solutions | IBM | 21 | |
| Image J | NIH | 1.48 | |
| Human mitochondrial DNA primers | |||
| the forward primer sequence | CCGCTACCATAATCATCGCTAT | ||
| the reverse primer sequence | TGCTAATACAATGCCAGTCAGG |
Referências
- Leuschner, F., et al. Rapid monocyte kinetics in acute myocardial infarction are sustained by extramedullary monocytopoiesis. The Journal of Experimental Medicine. 209 (1), 123-137 (2012).
- Lázár, E., et al. Cardiomyocyte renewal in the human heart: insights from the fall-out. European Heart Journal. 38 (30), 2333-2342 (2017).
- Davis, M. K., et al. State of the art: cardiac transplantation. Trends in Cardiovascular Medicine. 24 (8), 341-349 (2014).
- Mancini, D., Colombo, P. C. Left ventricular assist devices: A rapidly evolving alternative to transplant. Journal of the American College of Cardiology. 65 (23), 2542-2555 (2015).
- Zimmermann, W. H. Translating myocardial remuscularization. Circulation Research. 120 (2), 278-281 (2017).
- Hu, X., et al. A large-scale investigation of hypoxia-preconditioned allogeneic mesenchymal stem cells for myocardial repair in nonhuman primates: Paracrine activity without remuscularization. Circulation Research. 118 (6), 970-983 (2016).
- Kempf, H., et al. Cardiac differentiation of human pluripotent stem cells in scalable suspension culture. Nature Protocols. 10 (9), 1345-1361 (2015).
- Chong, J. J., et al. Human embryonic-stem-cell-derived cardiomyocytes regenerate non-human primate hearts. Nature. 510 (7504), 273-277 (2014).
- Shiba, Y., et al. Allogeneic transplantation of iPS cell-derived cardiomyocytes regenerates primate hearts. Nature. 538 (7625), 388-391 (2016).
- Nguyen, P. K., et al. Potential strategies to address the major clinical barriers facing stem cell regenerative therapy for cardiovascular disease: A review. JAMA Cardiology. 1 (8), 953-962 (2016).
- Zimmermann, W. H. Remuscularization of the failing heart. The Journal of Physiology. 595 (12), 3685-3690 (2017).
- Hu, X., et al. Transplantation of hypoxia-preconditioned mesenchymal stem cells improves infarcted heart function via enhanced survival of implanted cells and angiogenesis. The Journal of Thoracic and Cardiovascular Surgery. 135 (4), 799-808 (2008).
- Feng, Y., et al. Heat shock improves Sca-1+ stem cell survival and directs ischemic cardiomyocytes toward a prosurvival phenotype via exosomal transfer: a critical role for HSF1/miR-34a/HSP70 pathway. Stem Cells. 32 (2), 462-472 (2014).
- Fan, C., et al. Cardiomyocytes from CCND2-overexpressing human induced-pluripotent stem cells repopulate the myocardial scar in mice: A 6-month study. Journal of Molecular and Cellular Cardiology. 137, 25-33 (2019).
- Lou, X., et al. N-cadherin overexpression enhances the reparative potency of human-induced pluripotent stem cell-derived cardiac myocytes in infarcted mouse hearts. Cardiovascular Research. 116 (3), 671-685 (2020).
- Sun, X., et al. Transplanted microvessels improve pluripotent stem cell-derived cardiomyocyte engraftment and cardiac function after infarction in rats. Science Translational Medicine. 12 (562), (2020).
- Wu, X., et al. Cardiac repair with echocardiography-guided multiple percutaneous left ventricular intramyocardial injection of hiPSC-CMs after myocardial infarction. Frontiers in Cardiovascular Medicine. 8, 768873 (2021).
- Kannappan, R., et al. Functionally competent DNA damage-free induced pluripotent stem cell-derived cardiomyocytes for myocardial repair. Circulation. 140 (6), 520-522 (2019).
- Lou, X., et al. N-cadherin overexpression enhances the reparative potency of human-induced pluripotent stem cell-derived cardiac myocytes in infarcted mouse hearts. Cardiovascular Research. 116 (3), 671-685 (2020).
- Zhao, M., et al. Y-27632 preconditioning enhances transplantation of human-induced pluripotent stem cell-derived cardiomyocytes in myocardial infarction mice. Cardiovascular Research. 115 (2), 343-356 (2019).
- Zhao, M., et al. Enhancing the engraftment of human induced pluripotent stem cell-derived cardiomyocytes via a transient inhibition of rho kinase activity. Journal of Visualized Experiments: JoVE. (149), e59452 (2019).
- O'Brien, J., Hayder, H., Peng, C. Automated quantification and analysis of cell counting procedures using ImageJ plugins. Journal of Visualized Experiments: JoVE. (117), e54719 (2016).
- Kain, V., Prabhu, S. D., Halade, G. V. Inflammation revisited: inflammation versus resolution of inflammation following myocardial infarction. Basic Research in Cardiology. 109 (6), 444 (2014).
- Rainer, P. P., et al. Cardiomyocyte-specific transforming growth factor β suppression blocks neutrophil infiltration, augments multiple cytoprotective cascades, and reduces early mortality after myocardial infarction. Circulation Research. 114 (8), 1246-1257 (2014).
- Yu, Y., et al. Human embryonic stem cell-derived cardiomyocyte therapy in mouse permanent ischemia and ischemia-reperfusion models. Stem Cell Research & Therapy. 10 (1), 167 (2019).
- Iwanaga, K., et al. Effects of G-CSF on cardiac remodeling after acute myocardial infarction in swine. Biochemical and Biophysical Research Communications. 325 (4), 1353-1359 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados