Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ultraschallgesteuerte induzierte pluripotente Stammzell-abgeleitete Kardiomyozyten-Implantation bei myokardinfarktierten Mäusen
In diesem Artikel
Zusammenfassung
Die ultraschallgesteuerte Zellabgabe um die Stelle des Myokardinfarkts bei Mäusen ist eine sichere, effektive und bequeme Art der Zelltransplantation.
Zusammenfassung
Das Hauptziel der Zelltherapie nach Myokardinfarkt (MI) ist es, die Zelltransplantationsrate effektiv zu erhöhen, und humane induzierte pluripotente Stammzell-abgeleitete Kardiomyozyten (hiPSC-CMs) sind eine vielversprechende Zellquelle für die Herzreparatur nach ischämischen Schäden. Eine niedrige Transplantatrate ist jedoch ein erhebliches Hindernis für eine effektive Regeneration des Herzgewebes nach der Transplantation. Dieses Protokoll zeigt, dass mehrere ultraschallgesteuerte perkutane Injektionen in einen MI-Bereich die Zelltransplantationsraten effektiv erhöhen. Die Studie beschreibt auch den gesamten hiPSC-CM-Kulturprozess, die Vorbehandlung und die ultraschallgesteuerten perkutanen Verabreichungsmethoden. Darüber hinaus hilft die Verwendung menschlicher mitochondrialer DNA, das Fehlen von hiPSC-CMs in anderen Mausorganen nachzuweisen. Schließlich beschreibt dieser Artikel die Veränderungen der Herzfunktion, der Angiogenese, der Zellgröße und der Apoptose an der infarktierten Grenzzone bei Mäusen 4 Wochen nach der Zellentbindung. Daraus kann geschlossen werden, dass die echokardiographiegesteuerte perkutane Injektion des linksventrikulären Myokards eine machbare, relativ invasive, zufriedenstellende, wiederholbare und wirksame Zelltherapie ist.
Einleitung
Wenn akuter MI auftritt, sterben Myokardzellen im Infarktbereich aufgrund von Ischämie und Hypoxie schnell ab. Mehrere Entzündungsfaktoren werden nach Zelltod und Ruptur freigesetzt, während Entzündungszellen die Infarktstelle infiltrieren, um eine Entzündung zu verursachen1. Bezeichnenderweise ersetzen Fibroblasten und Kollagen, sowohl ohne Kontraktilität als auch ohne elektrische Leitfähigkeit, die Myokardzellen an der Infarktstelle, um Narbengewebe zu bilden. Aufgrund der begrenzten Regenerationsfähigkeit von Kardiomyozyten bei erwachsenen Säugetieren ist lebensfähiges Gewebe, das nach einem großen Infarktbereich gebildet wird, in der Regel nicht ausreichend, um ein ausreichendes Herzzeitvolumen aufrechtzuerhalten2. MI verursacht Herzinsuffizienz, und in schweren Fällen von Herzinsuffizienz können sich die Patienten nur auf Herztransplantationen oder Herzunterstützungssysteme verlassen, um eine normale Herzfunktion aufrechtzuerhalten 3,4.
Nach MI besteht die ideale Behandlungsstrategie darin, die toten Kardiomyozyten durch neu gebildete Kardiomyozyten zu ersetzen und eine elektromechanische Kopplung mit gesundem Gewebe zu bilden. Die Behandlungsoptionen haben jedoch in der Regel eher eine myokardiale Rettung als einen Ersatz übernommen. Derzeit gehören stammzell- und vorläuferzellbasierte Therapien zu den vielversprechendsten Strategien zur Förderung der Myokardreparatur nach MI5. Die Transplantation dieser Zellen hat jedoch mehrere Probleme, vor allem die Unfähigkeit adulter Stammzellen, sich in Kardiomyozyten zu differenzieren, und ihre kurze Lebensdauer6.
Die ethischen Fragen im Zusammenhang mit der Verwendung embryonaler Stammzellen (ES-Zellen) können durch iPS-Zellen umgangen werden, die eine vielversprechende Quelle für Zellen darstellen. Darüber hinaus besitzen iPS-Zellen eine starke Selbsterneuerungsfähigkeit und können sich zu Kardiomyozytendifferenzieren 7. Studien haben gezeigt, dass hiPSC-CMs, die in die MI-Stelle transplantiert werden, überleben und Gap Junctions mit Wirtszellen bildenkönnen 8,9. Da sich diese transplantierten Zellen jedoch in der Mikroumgebung von Ischämie und Entzündung befinden, ist ihre Überlebensrate extrem niedrig10,11.
Es wurden mehrere Methoden etabliert, um die Überlebensrate transplantierter Zellen zu verbessern, wie z. B. Hypoxie und Hitzeschock-Vorbehandlung transplantierter Zellen12,13, genetische Modifikation 14,15 und die gleichzeitige Transplantation von Zellen und Kapillaren 16. Leider sind die meisten Methoden durch Komplexität und hohe Kosten begrenzt. Daher schlägt die vorliegende Studie eine reproduzierbare, bequeme, relativ invasive und effektive hiPSC-CM-Verabreichungsmethode vor.
Die ultraschallgesteuerte intramyokardiale Zellinjektion kann unabhängig von der Stelle nur mit einem hochauflösenden kleinen veterinärmedizinischen Ultraschallgerät und einem Mikroinjektor durchgeführt werden. Unter Ultraschallführung ist die direkte Abgabe von Zellen unter dem Xiphoid-Prozess vom Perikard in das Myokard bei Mäusen ein sicheres Protokoll, das Leber- und Lungenschäden vermeidet. Diese Methode kann gleichzeitig mit anderen Technologien kombiniert werden, um die Überlebensrate transplantierter Zellen deutlich zu verbessern.
Protokoll
Alle Tierversuche in dieser Studie wurden von der Ethikkommission des Zweiten Xiangya-Krankenhauses der Central South University überprüft und genehmigt. In der Materialtabelle finden Sie Einzelheiten zu allen Materialien und Geräten, die in diesem Protokoll verwendet werden. Die Zeitpläne für Zellinjektion, Bildgebung und Euthansie sind wie folgt: t0- Induktion des Infarkts, t1 Woche - Bild- und Implantatzellen, t2 Wochen - Bild- und Implantatzellen, t4 Wochen - endgültige Bildgebung, Euthanasie und Gewebeentnahme.
1. hiPSC-Kultur, Kardiomyozytendifferenzierung und Zellreinigung
- Mischen Sie DMEM/F12 und Basalmembran-Matrix-Stammlösung mit Eis bei 4 °C im Verhältnis 1,5:1, aliquot, und lagern Sie das resultierende Gemisch (Matrixverdünnungsmittel) bei -20 °C. Mischen Sie 25 ml DMEM/F12-Nährmedium bei 4 °C und 1 ml Matrixverdünnungsmittel gründlich mit Eis und verteilen Sie 1 ml/Well in einer 6-Well-Platte. Halten Sie die Platte 1 h lang aufrecht in einem Inkubator bei 37 °C und saugen Sie den DMEM/F12-Überstand aus den Vertiefungen ab. Berühren Sie nicht die Unterseite der 6-Well-Platte, wenn Sie den Vorgang durchführen.
- Entfernen Sie das Kryokonservierungsröhrchen mit den hiPS-Zellen aus flüssigem Stickstoff und tauen Sie sie schnell in einem 37 °C heißen Wasserbad auf. Sterilisieren Sie die äußere Oberfläche des Kryokonservierungsröhrchens mit 75% Alkohol, wischen Sie den Alkohol ab und stellen Sie das Röhrchen auf einen sterilen, ultrasauberen Tisch.
- Verwenden Sie eine Pipette, um die Kryokonservierungslösung, die hiPS-Zellen enthält, vorsichtig in ein 15-ml-Zentrifugenröhrchen zu überführen, fügen Sie 5 ml feederfreies ES-Medium hinzu und zentrifugieren Sie die Suspension bei 300 × g für 3 Minuten bei Raumtemperatur. Verwerfen Sie den Überstand und resuspendieren Sie die Zellen vorsichtig in 6 ml des feederfreien ES-Mediums. Zählen Sie die Zellen und stellen Sie die Zellkonzentration mit dem Kulturmedium auf 5 × 105 Zellen/ml ein.
- ROCK-Inhibitor (Y27632) zu den hiPS-Zellen bis zu einer Endkonzentration von 5 μM geben. Übertragen Sie die hiPS-Zellen mit Y27632 auf die mit Basalmembranmatrix vorbehandelte 6-Well-Platte und schwenken Sie die 6-Well-Platte vorsichtig, wobei Sie die Form der Zahl "8" nachzeichnen, um die hiPS-Zellen gleichmäßig zu verteilen. Stellen Sie die hiPS-Zellen für 24 h in einen 37 °C heißen, feuchten Inkubator mit 5 % CO2 in aufrechter Position. Ersetzen Sie den Überstand durch das zuführfreie ES-Medium ohne Y27632.
- Wenn hiPS-Zellen einen Konfluenzgrad von 80 % erreichen, saugen Sie den Kulturüberstand ab, waschen Sie die Zellen zweimal mit phosphatgepufferter Kochsalzlösung (PBS), fügen Sie insulinfreies RPMI1640 + B27 hinzu, das 10 μM CHIR99021 (GSK3-β-Inhibitor) enthält, und legen Sie die hiPS-Zellen 24 h lang in einen feuchten CO2 -Inkubator bei 37 °C.
- Ersetzen Sie die Hälfte des Überstands durch RPMI1640 + B27-Medium ohne Insulin und inkubieren Sie die Zellen für weitere 24 Stunden.
- Ersetzen Sie das Nährmedium vollständig durch RPMI1640 + B27 (ohne Insulin). Stellen Sie die Platten für 24 h in einen feuchten Inkubator bei 37 °C mit 5% CO2 in aufrechter Position.
- Ersetzen Sie das Nährmedium nach 3 Tagen vollständig durch insulinfreies RPMI1640 + B27 + 5 μM IWR1 (Wnt Signaling Pathway Inhibitor) und stellen Sie die Platten für 48 h in einen feuchten Inkubator bei 37 °C mit 5% CO2 .
- Ersetzen Sie das Nährmedium nach 5 Tagen durch RPMI1640 + B27 ohne Insulin und inkubieren Sie 48 h in einem feuchten CO2 -Inkubator bei 37 °C weiter.
- Ersetzen Sie das Nährmedium nach 7 Tagen durch das Medium RPMI + B27 (einschließlich Insulin) und stellen Sie die Platten für 3 Tage bei 37 °C in einen befeuchteten CO2 -Inkubator. Ersetzen Sie das Medium alle 3 Tage durch das RPMI + B27-Medium. Achten Sie auf das spontane Schlagen von Zellen nach 9-12 Tagen der Differenzierung.
- Ersetzen Sie nach der Beobachtung der pulsierenden Zellen das RPMI + B27-Medium durch ein glukosefreies RPMI 1640-Medium, das Milchsäure enthält (1 ml Milchsäure wird zu 500 ml glukosefreiem RPMI 1640-Medium hinzugefügt). Die Zellen werden 72 h in einem feuchten Inkubator bei 37 °C mit 5% CO2 inkubiert.
- Nach 72 h wird der Überstand durch RPMI + B27-Medium ersetzt und 48 h in einem feuchten Inkubator bei 37 °C mit 5 % CO2 inkubiert.
- Saugen Sie den Kulturüberstand unter Unterdruck ab und waschen Sie die Zellen 3x mit PBS, um Spuren des Nährmediums zu entfernen. Verwenden Sie die Zellablösungsenzymmischung, um die hiPSC-CMs bei 37 °C in einzelne Zellen zu dissoziieren. Die erhaltenen Zellen werden in ein 15-ml-Zentrifugenröhrchen mit 3 ml Kardiomyozyten-Trägerlösung gesammelt, bei 300 × g 2 min bei Raumtemperatur zentrifugiert und der Überstand verworfen.
- Resuspendieren Sie die Zellen mit RPMI + B27-Medium, säen Sie sie auf mit Basalmembranmatrix beschichtete 6-Well-Platten und inkubieren Sie sie 48 h lang in einem feuchten Inkubator bei 37 °C mit 5% CO2.
- Ersetzen Sie den Kulturüberstand zur Reinigung durch ein glukosefreies milchsäurehaltiges RPMI 1640-Medium und inkubieren Sie ihn 72 h in einem feuchten Inkubator bei 37 °C mit 5 % CO2.
- Ersetzen Sie den Kulturüberstand durch RPMI + B27-Medium und wechseln Sie das Medium alle 3 Tage.
- Setzen Sie den obigen Vorgang 30 Tage lang fort und ersetzen Sie den Kulturüberstand zur weiteren Reinigung durch ein glukosefreies Medium, das Milchsäure enthält. Inkubieren Sie die Zellen 3 Tage lang mit diesem Medium und ersetzen Sie den Überstand durch RPMI + B27. Kultivieren Sie die Zellen 30 Tage lang kontinuierlich, bis die hiPSC-CMs stabil schlagen, und verwenden Sie diese Zellen für die intramyokardiale Injektion bei Mäusen.
2. Herstellung von hiPSC-CMs und Etablierung eines akuten Myokardinfarktmodells der Maus
- Vakuumaspiration des Kulturüberstands von 60 Tagen kultivierten hiPSC-CMs, Waschen der Zellen 3x mit PBS und Dissoziieren der hiPSC-CMs bei 37 °C mit der Zellablösungsenzymmischung (~3-5 min) in einzelne Zellen. Sammeln Sie die Zellen in einem 15-ml-Zentrifugenröhrchen mit 5 ml RPMI + B27-Medium und mischen Sie es gut, bevor Sie die Zellen zählen, um die Gesamtzahl der Zellen zu berechnen. Zentrifugieren Sie die Zellsuspension bei 300 × g für 2 min bei Raumtemperatur. Verwerfen Sie den Überstand und fügen Sie Kardiomyozyten-Trägermedium hinzu, um auf eine Konzentration von 0,6 × 105 Zellen/μl zu resuspendieren.
- Halten Sie das Zentrifugenröhrchen mit den resuspendierten hiPSC-CMs bei 37 °C für die Injektion bereit 14,17,18,19,20.
- Legen Sie die Mäuse in eine Anästhesiebox, die mit Isofluran verbunden ist, um eine Anästhesieinhalation zu induzieren, gefolgt von der Verwendung von Tierarztsalbe auf den Augen, um Trockenheit während der Narkose zu verhindern.
HINWEIS: Die Isoflurankonzentration betrug 5%. Achten Sie während des Experiments auf die Belüftung im Labor. - Achten Sie nach dem Kneifen auf den Verlust von Reflexen im Fuß- und Schwanzbereich, wenn die Maus flach auf den Operationstisch gelegt wird, was auf eine ausreichende Anästhesie hinweist. Buprenorphin (0,1 mg/kg) intraperitoneal verabreichen.
- Schmieren Sie die Haare in der Mitte des Halses und der linken Brust der Mäuse mit einer Enthaarungscreme ein und wischen Sie die aufgetragene Creme und das Haar nach 5 Minuten mit Gaze ab.
- Befestigen Sie die Gliedmaßen und den Mausschwanz mit Klebeband. Befestigen Sie die Schneidezähne der Maus mit einem 2-0-Seidenfaden und Klebeband. Sterilisieren Sie den Operationsbereich (mittlerer Hals und linke Brust) mit drei abwechselnden Runden Betadin, gefolgt von Alkohol.
- Legen Sie ein chirurgisches Tuch um den sterilisierten chirurgischen Bereich. Machen Sie dann einen mittleren Halsschnitt mit einer feinen anatomischen Schere und einer feinen Sezierzange, um die Luftröhre vollständig freizulegen. Schneiden Sie gegebenenfalls einige vordere Halsmuskeln zur Stabilisierung ab.
HINWEIS: Die Bediener waren blind für die Tiergruppen. - Führen Sie einen Trachealtubus (20 G Katheterpunktionsnadel) durch den Mund ein.
- Schließen Sie den Trachealtubus an das Beatmungsgerät an und überprüfen Sie die Bewegung des Brustkorbs, um sicherzustellen, dass beide Lungen gut belüftet sind.
- Passen Sie die Atemparameter an (Atemfrequenz: 100-150 Schläge pro Minute, Atemzug 250-300 μL). Danach fixieren Sie das linke Hinterbein wieder auf der unteren rechten Seite, lösen Sie das Klebeband um die linke obere Extremität und führen Sie eine Thorakotomie im 3-4 Interkostalraum des linken Thorax mit einer feinen Sezierschere und einer Pinzette durch, um eine maximale Herzexposition zu erzielen.
- Ziehen Sie das Perikard mit einer Pinzette unter einem Mikroskop ab, um die linke vordere absteigende Koronararterie (LAD) am unteren Rand des linken Vorhofohrs sichtbar zu machen.
- Verwenden Sie einen 6-0-Seidenfaden, um das proximale Ende des LAD zu ligieren. Nachdem Sie sichergestellt haben, dass das akute MI-Modell ausreichend etabliert ist (wenn sich die distale LAD an der Ligaturstelle von rot nach weiß ändert), schließen Sie die Brust Schicht für Schicht und nähen Sie die Haut mit 4-0-Gewindestichen. Führen Sie alle oben genannten chirurgischen Eingriffe zur MI-Induktion für die Scheintiergruppe mit Ausnahme der Ligatur durch.
- Schalten Sie die Inhalationsanästhesie aus, entfernen Sie die Kanüle, nachdem die Maus die Spontanatmung wieder aufgenommen hat, und bringen Sie sie in ihren Käfig zurück. Überwachen Sie das Tier, bis es wieder genügend Bewusstsein erlangt hat, um das Brustbein aufrechtzuerhalten. Geben Sie es nicht an die Gesellschaft anderer Tiere zurück, bis es sich vollständig erholt hat. Verabreichen Sie intraperitoneale Injektionen von Buprenorphin (0,1 mg/kg x 3 Tage) und Carprofen (5 mg/kg x 1 Tag) alle 12 Stunden postoperativ.
- Injizieren Sie Cyclosporin A (10 mg·kg-1·Tag-1) 3 Tage vor der Verabreichung von hiPSC-CMs in die intraperitoneale Höhle von Mäusen, um die Abstoßung der transplantierten Zellen zu verhindern. Injizieren Sie Cyclosporin A kontinuierlich für 1 Monat nach der Transplantation.
3. hiPSC-CM-Injektion unter Ultraschallkontrolle
- Ordnen Sie nach dem Einrichten des MI-Modells die Mäuse des MI-Modells (12 Wochen alte C57BL/6-Mäuse; 22 g bis 24 g Gewicht, 50 % männlich und 50 % weiblich) am ersten Tag nach dem MI einer Einzeldosis (SD, n = 8 in dieser Studie) und einer Mehrfachdosis (MD, n = 8 in dieser Studie) zu und legen Sie sie in der ersten und zweiten Woche nach MI in eine Anästhesiebox, die mit 5% Isofluran zur Einleitung einer Inhalationsanästhesie verbunden ist, gefolgt von Tracheale Intubation.
- Schmieren Sie die Haare auf Brust und Oberbauch der Mäuse mit Enthaarungscreme ein und wischen Sie die Creme 5 Minuten später mit Gaze ab. Überwachen Sie die Herzfrequenz der Maus auf dem Operationsbrett und verabreichen Sie Inhalationsisofluran, bis die Herzfrequenz bei 400-500 Schlägen pro Minute gehalten wird.
- Befestigen Sie die Gliedmaßen und den Schwanz der Maus mit Klebeband an der Detektionskonsole und stellen Sie die Plattformtemperatur auf 37 °C ein.
- Tragen Sie ein spezielles Ultraschallgelee auf den Oberbauch auf und verwenden Sie eine kleinere hochauflösende veterinärmedizinische Ultraschallsonde, um Leberbilder von Mäusen zu erhalten.
- Verringern Sie die Beatmungsrate auf 50 Schläge pro Minute. Verwenden Sie eine 5-μl-Mikrospritze, um ~3 × 105 Zellen zu ziehen (aus Schritt 2.1). Halten Sie die Spritze mit einem Mikromanipulator fest und führen Sie eine 3-mm-Nadel am linken para-xiphoiden Prozess ein (Abbildung 1A). Folgen Sie der Oberkante des Zwerchfells unter Ultraschallkontrolle (Abbildung 1B), beobachten Sie den Atemrhythmus und -bereich (Abbildung 1C, D) und treten Sie am Ende des Exspirationszyklus in das Perikard ein, um Schäden an Leber und Lunge zu vermeiden (Abbildung 1D).
- Nachdem die Mikroinjektornadel in die Perikardhöhle eingedrungen ist, stellen Sie die Atemfrequenz auf den ursprünglichen Parameter (150 Schläge pro Minute) ein. Erfassen Sie das parasternale Langachsenbild des Mausherzens durch M-Form-Echokardiographie gemäß den Anweisungen des Herstellers17 (Abbildung 1E). Injizieren Sie unter Ultraschallkontrolle 3 × 10 5 Zellen (Abbildung 1F) in drei Randbereiche (1 × 105 Zellen pro Injektionsstelle) der Infarktstelle.
- Entfernen Sie die spezielle Ultraschallsonde und spülen Sie das Gelee ab. Entwöhnen Sie die Maus von der Inhalationsanästhesie und bringen Sie sie nach vollem Bewusstsein in ihren Käfig zurück.
- Wiederholen Sie die oben genannten ultraschallgesteuerten Zellinjektionsverfahren 1 und 2 Wochen nach der Etablierung des MI für die Mäuse der MD-Gruppe.
4. Bewertung der Herzfunktion, der Fluoreszenzmarkierung, der Anzahl der transplantierten Zellen, des Myokardinfarktbereichs und des Nachweises menschlicher Mitochondrien bei Mäusen 30 Tage nach der Ligatur des linken vorderen absteigenden Astes
- Beurteilung der Herzfunktion
- Legen Sie die Maus in eine mit Isofluran verbundene Anästhesiebox für die Induktions-Inhalationsanästhesie, gefolgt von der Verwendung einer Tierarztsalbe auf den Augen, um Trockenheit während der Narkose zu verhindern. Entfernen Sie die Haare auf der linken Brust der Maus mit Enthaarungscreme. Legen Sie die Maus auf das Bedienfeld, um die Herzfrequenz zu überwachen und die Isofluran-Inhalation anzupassen. Halten Sie die Herzfrequenz der Maus bei 400-500 Schlägen pro Minute. Der experimentelle Endpunkt ist Tag 30 (nach der MI-Induktion).
- Befestigen Sie die Gliedmaßen und den Schwanz der Maus mit Klebeband an der Detektionskonsole und stellen Sie die Plattformtemperatur auf 37 °C ein.
- Verwenden Sie nach dem Auftragen eines speziellen Ultraschallgels auf den vorderen Herzbereich eine (veterinär-)hochauflösende Herzultraschallsonde, um parasternale langachsige und zweidimensionale kurzachsige Bilder unter Echokardiographie von M-Form und B-Form gemäß den Anweisungen des Herstellers17 aufzunehmen.
- Nachdem die Ultraschallerkennung abgeschlossen ist, spülen Sie das spezielle Ultraschallgel ab, schalten Sie die Inhalationsanästhesie aus und bringen Sie die Maus nach vollem Bewusstsein separat in ihren Käfig zurück.
- Analysieren Sie die erhaltenen Daten und berechnen Sie die linksventrikuläre Ejektionsfraktion (EF) und die fraktionierte Verkürzung (FS) mit der Analysesoftware. Stellen Sie sicher, dass der Bediener für die Versuchsgruppen17 verblindet ist.
- Fluoreszenzmarkierung von Schnitten
- Waschen Sie das isolierte Herz mit PBS und tauchen Sie es 12 h lang bei 4 °C in 4% Paraformaldehyd. Nehmen Sie das Herz heraus und tauchen Sie es 24 Stunden lang in 30% Saccharose, um es zu dehydrieren.
- Betten Sie das dehydrierte Herz mit der optimalen Schnitttemperaturverbindung (OCT) auf Trockeneis ein. Schneiden Sie das Herz von unten bis zur Spitze mit einer Kryostatdicke von 10 μm in Scheiben und legen Sie die Abschnitte auf Objektträger und lagern Sie die Objektträger bei -20 °C.
- Waschen Sie die Objektträger mit dem Herzgewebe mit PBS für 3 min.
- Permeabilisieren Sie das Gewebe auf Objektträgern mit 0,5% Triton X-100 bei Raumtemperatur für 8 min und waschen Sie sie 3x mit PBS für 5 min pro Waschgang.
- Nachdem Sie das Gewebe mit 10% Eselserum und 90% PBS (Blockierlösung) bedeckt haben, blockieren Sie die Schnitte für 1 h bei Raumtemperatur.
- Nach dem Entfernen der Blockierlösung werden die Schnitte mit dem Primärantikörper (mit der Blockierlösung auf 1:100 verdünnt) über Nacht bei 4 °C inkubiert. Waschen Sie sie 3x mit PBS für 5 Minuten pro Waschgang.
- Inkubieren Sie das Gewebe auf Objektträgern mit Fluorophor-konjugierten Sekundärantikörpern (verdünnt auf 1:100 mit der Blockierlösung) für 1 h bei Raumtemperatur.
HINWEIS: Vermeiden Sie es, das Gewebe mit dem Fluorophor-konjugierten sekundären Antikörper ab diesem Zeitpunkt dem Licht auszusetzen. - Waschen Sie die Objektträger 3x mit PBS für 5 min pro Waschgang.
- Die Objektträger werden mit 4',6-Diamidino-2-phenylindol (DAPI)-haltigem Einbettmedium montiert und unter einem Fluoreszenzmikroskop17 fotografiert.
- Anzahl der transplantierten hiPSC-CMs17
- Führen Sie eine Gewebeimmunfluoreszenzfärbung an gefrorenen Herzschnitten für fußgängerspezifisches Troponin T (hcTnT), humanes nukleäres Antigen (HNA) und unspezifisches Sarkomer-Alpha-Actinin durch.
- Nachdem das ganze Herz seriell geschnitten wurde, nehmen Sie einen Abschnitt für jeweils 50 Abschnitte für die Fluoreszenzmarkierung.
- Nehmen Sie nach dem Zufallsprinzip fünf Bilder mit hoher Vergrößerung pro Schicht auf. Zählen Sie die Anzahl der gepfropften Sichtfelder, berechnen Sie die durchschnittliche Anzahl der gepfropften Zellen pro Flächeneinheit, und legen Sie sie als A1/μm2 fest. Berechnen Sie die gesamte gepfropfte Fläche der Scheibe mit ImageJ (https://imagej.nih.gov/ij/) und legen Sie sie auf B1 μm2 fest, so dass die gepfropfte Anzahl in dieser Scheibe = A1 × B121,22 ist.
- Berechnen Sie die Gesamtzahl der transplantierten Zellen pro Mausherz mit Gl (1) und die prozentuale Transplantationsrate mit Gl (2), wobei ein Abschnitt aus 50 Abschnitten ausgewählt wurde21,22.
- Gesamtzahl der transplantierten Zellen pro Mausherz = (A1 × B1 + A2 × B2 +...+ An × Bn) × 50 (1)
Transplantationsrate =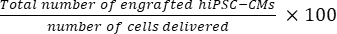 (2)
(2)
ANMERKUNG: Die Anzahl der Lieferungen betrug 3 × 10 5 für die SD-Gruppe und 3 × 3 × 105 für die MD-Gruppe.
- Beurteilung des Myokardinfarktbereichs
- Schneiden Sie einen gefrorenen Querschnittsabschnitt (kurze Achse) des isolierten Herzens von der Spitze bis zur Basis des Herzens mit einer Dicke von 10 μm.
- Nachdem das ganze Herz seriell geschnitten wurde, nehmen Sie einen Schnittschieber für jeweils 30 Abschnitte und fixieren Sie ihn in vorgewärmter Bouin-Lösung bei 58 °C. Färben Sie den Abschnitt mit 0,04 % Direct Red und 0,1 % Fast Green Kollagenflecken (verdünnt in PBS) gemäß den Anweisungen des Herstellers17.
- Verwenden Sie eine Software (z. B. ImageJ), um die Bilder nach einer Querschnitts-Ganzkörperfotografie des Herzens unter dem Mikroskop mit Gl (3) zu analysieren:14,17
Infarktfläche % =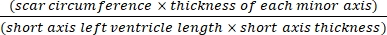 × 100% (3)
× 100% (3)
- Nachweis menschlicher mitochondrialer DNA in verschiedenen Organen
- Betäuben Sie die Mäuse mit 5% Isofluran und opfern Sie sie durch posteriore Zervixluxation. Sezieren Sie die Mäuse 4 Wochen nach der Zelltransplantation. Entnahme der Organe (Leber, Lunge, Gehirn, Niere, Milz) und eines Teils des Myokards (n = 3 in diesem Abschnitt).
- Mahlen Sie jedes Organgewebe in flüssigem Stickstoff und extrahieren Sie DNA aus dem Gewebe mit dem referenzierten Kit (siehe Materialtabelle) gemäß den Anweisungen des Herstellers.
- Befolgen Sie die Anweisungen des Herstellers, um das referenzierte Kit und die Primer (siehe Materialtabelle) zu verwenden, um menschliche mitochondriale DNA in den oben genannten Geweben nachzuweisen (ab Schritt 4.5.1).
Ergebnisse
Die Echokardiographie zur Beurteilung der linksventrikulären Funktion der Mäuse in jeder Gruppe zeigte, dass die MI-Verletzungen in der MD-Gruppe effektiv rückgängig gemacht wurden (Abbildung 2A). Im Vergleich zur MI-Gruppe zeigte die SD-Gruppe eine erhöhte Ejektionsfraktion (EF) (von 30% auf 35%; Abbildung 2B) und Fraktionsverkürzung (FS) (von 18 % auf 22 %; Abbildung 2C) nach MI. Es ist jedoch noch wichtiger zu beachten, das...
Diskussion
Zu den kritischen Schritten dieser Studie gehören die hiPSC-Kultur, die Differenzierung der Kardiomyozyten, die hiPSC-CM-Aufreinigung und die hiPSC-CM-Transplantation in die Myokardinfarktstelle der Maus. Der Schlüssel liegt darin, Herzultraschall zu verwenden, um die Behandlung transkutan zur Infarktstelle am Rand des Infarkts zu führen, wo hiPSC-CMs in den Bereich injiziert wurden.
Mit der Verlängerung der Kulturzeit ändert sich der hiPSC-CM-Phänotyp in der Morphologie (größere Zellg...
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Diese Arbeit wurde durch den großen Forschungsplan der National Natural Science Foundation of China (Nr. 91539111to JY), das Schlüsselprojekt für Wissenschaft und Technologie der Provinz Hunan (Nr. 2020SK53420 bis JY) und das Wissenschafts- und Technologieinnovationsprogramm der Provinz Hunan (2021RC2106 bis CF) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Antibody | |||
| Cardiac troponin T | Abcam | ab8295 | |
| Donkey Anti-Mouse IgG H&L (Alexa Fluor 488) | Abcam | ab150105 | |
| Donkey Anti-Mouse IgG H&L (Alexa Fluor 555) | Abcam | ab150110 | |
| Donkey Anti-Rabbit IgG H&L (Alexa Fluor 488) | Abcam | ab150073 | |
| Donkey Anti-Rabbit IgG H&L (Alexa Fluor 555) | Abcam | ab150062 | |
| Human cardiac troponin T | Abcam | ab91605 | |
| Isolectin B4 | Vector | FL-1201 | |
| Sarcomeric alpha actinin | Abcam | ab9465 | |
| Wheat germ agglutinin | Thermo Fisher Scientific | W11261 | |
| Reagent | |||
| Accutase | Thermo Fisher Scientific | 00-4555-56 | |
| B27 Supplement(minus insulin) | Thermo Fisher Scientific | A1895601 | |
| B27 Supplement(serum free) | Thermo Fisher Scientific | 17–504-044 | |
| Bouin's solution | Thermo Fisher Scientific | SDHT10132 | |
| CHIR99021 | Selleck | CT99021 | |
| cyclosporin A | Medchemexpress | HY-B0579 | |
| DIRECT RED | Sigma-Aldrich | 365548-25G | |
| DMEM/F12 | Thermo Fisher Scientific | 11320033 | |
| DNeasy Blood & Tissue Kit | Qiagen | 69504 | |
| FAST GREEN FCF | Sigma-Aldrich | F7252-5G | |
| Glucose-free RPMI 1640 | Thermo Fisher Scientific | 11879020 | |
| IWR1 | Selleck | S7086 | |
| lactic acid | Sigma-Aldrich | L6661 | |
| Matrigel | BD Biosciences | BD356234 | |
| mTeSR1 | Stem Cell Technologies | 72562 | |
| O.C.T. Compound | SAKURA | 4583 | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| PowerUP SYBR Green MasterMix kit | Thermo Fisher Scientific | A25742 | |
| RPMI1640 | Thermo Fisher Scientific | 11875119 | |
| STEMdif Cardiomyocyte Freezing Medium/STEMdiff | Stem Cell Technologies | 5030 | |
| STEMdiff Cardiomyocyte Support Medium | Stem Cell Technologies | 5027 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| ultrasound coupling agent | CARENT | 22396269389 | |
| Y-27632 | Selleck | S6390 | |
| Equipment and Supplies | |||
| Applied Biosystems | Thermo Fisher Scientific | 7500 Real-Time PCR | |
| cryostat | Leica | CM1950 | |
| fluoresence microscope | Olympus | IX83 | |
| fine anatomical scissors | Fine Science Tools | 15000-08 | |
| fine dissecting forceps | Fine Science Tools | 11255-20 | |
| Micro syringe | Hamilton | 7633 | |
| Small animal anesthesia machine | MATRX | VMR | |
| Ultra-high resolution small animal ultrasound imaging system | VisualSonics | Vevo 2100 | |
| Software | |||
| Statistical Product and Service Solutions | IBM | 21 | |
| Image J | NIH | 1.48 | |
| Human mitochondrial DNA primers | |||
| the forward primer sequence | CCGCTACCATAATCATCGCTAT | ||
| the reverse primer sequence | TGCTAATACAATGCCAGTCAGG |
Referenzen
- Leuschner, F., et al. Rapid monocyte kinetics in acute myocardial infarction are sustained by extramedullary monocytopoiesis. The Journal of Experimental Medicine. 209 (1), 123-137 (2012).
- Lázár, E., et al. Cardiomyocyte renewal in the human heart: insights from the fall-out. European Heart Journal. 38 (30), 2333-2342 (2017).
- Davis, M. K., et al. State of the art: cardiac transplantation. Trends in Cardiovascular Medicine. 24 (8), 341-349 (2014).
- Mancini, D., Colombo, P. C. Left ventricular assist devices: A rapidly evolving alternative to transplant. Journal of the American College of Cardiology. 65 (23), 2542-2555 (2015).
- Zimmermann, W. H. Translating myocardial remuscularization. Circulation Research. 120 (2), 278-281 (2017).
- Hu, X., et al. A large-scale investigation of hypoxia-preconditioned allogeneic mesenchymal stem cells for myocardial repair in nonhuman primates: Paracrine activity without remuscularization. Circulation Research. 118 (6), 970-983 (2016).
- Kempf, H., et al. Cardiac differentiation of human pluripotent stem cells in scalable suspension culture. Nature Protocols. 10 (9), 1345-1361 (2015).
- Chong, J. J., et al. Human embryonic-stem-cell-derived cardiomyocytes regenerate non-human primate hearts. Nature. 510 (7504), 273-277 (2014).
- Shiba, Y., et al. Allogeneic transplantation of iPS cell-derived cardiomyocytes regenerates primate hearts. Nature. 538 (7625), 388-391 (2016).
- Nguyen, P. K., et al. Potential strategies to address the major clinical barriers facing stem cell regenerative therapy for cardiovascular disease: A review. JAMA Cardiology. 1 (8), 953-962 (2016).
- Zimmermann, W. H. Remuscularization of the failing heart. The Journal of Physiology. 595 (12), 3685-3690 (2017).
- Hu, X., et al. Transplantation of hypoxia-preconditioned mesenchymal stem cells improves infarcted heart function via enhanced survival of implanted cells and angiogenesis. The Journal of Thoracic and Cardiovascular Surgery. 135 (4), 799-808 (2008).
- Feng, Y., et al. Heat shock improves Sca-1+ stem cell survival and directs ischemic cardiomyocytes toward a prosurvival phenotype via exosomal transfer: a critical role for HSF1/miR-34a/HSP70 pathway. Stem Cells. 32 (2), 462-472 (2014).
- Fan, C., et al. Cardiomyocytes from CCND2-overexpressing human induced-pluripotent stem cells repopulate the myocardial scar in mice: A 6-month study. Journal of Molecular and Cellular Cardiology. 137, 25-33 (2019).
- Lou, X., et al. N-cadherin overexpression enhances the reparative potency of human-induced pluripotent stem cell-derived cardiac myocytes in infarcted mouse hearts. Cardiovascular Research. 116 (3), 671-685 (2020).
- Sun, X., et al. Transplanted microvessels improve pluripotent stem cell-derived cardiomyocyte engraftment and cardiac function after infarction in rats. Science Translational Medicine. 12 (562), (2020).
- Wu, X., et al. Cardiac repair with echocardiography-guided multiple percutaneous left ventricular intramyocardial injection of hiPSC-CMs after myocardial infarction. Frontiers in Cardiovascular Medicine. 8, 768873 (2021).
- Kannappan, R., et al. Functionally competent DNA damage-free induced pluripotent stem cell-derived cardiomyocytes for myocardial repair. Circulation. 140 (6), 520-522 (2019).
- Lou, X., et al. N-cadherin overexpression enhances the reparative potency of human-induced pluripotent stem cell-derived cardiac myocytes in infarcted mouse hearts. Cardiovascular Research. 116 (3), 671-685 (2020).
- Zhao, M., et al. Y-27632 preconditioning enhances transplantation of human-induced pluripotent stem cell-derived cardiomyocytes in myocardial infarction mice. Cardiovascular Research. 115 (2), 343-356 (2019).
- Zhao, M., et al. Enhancing the engraftment of human induced pluripotent stem cell-derived cardiomyocytes via a transient inhibition of rho kinase activity. Journal of Visualized Experiments: JoVE. (149), e59452 (2019).
- O'Brien, J., Hayder, H., Peng, C. Automated quantification and analysis of cell counting procedures using ImageJ plugins. Journal of Visualized Experiments: JoVE. (117), e54719 (2016).
- Kain, V., Prabhu, S. D., Halade, G. V. Inflammation revisited: inflammation versus resolution of inflammation following myocardial infarction. Basic Research in Cardiology. 109 (6), 444 (2014).
- Rainer, P. P., et al. Cardiomyocyte-specific transforming growth factor β suppression blocks neutrophil infiltration, augments multiple cytoprotective cascades, and reduces early mortality after myocardial infarction. Circulation Research. 114 (8), 1246-1257 (2014).
- Yu, Y., et al. Human embryonic stem cell-derived cardiomyocyte therapy in mouse permanent ischemia and ischemia-reperfusion models. Stem Cell Research & Therapy. 10 (1), 167 (2019).
- Iwanaga, K., et al. Effects of G-CSF on cardiac remodeling after acute myocardial infarction in swine. Biochemical and Biophysical Research Communications. 325 (4), 1353-1359 (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten