A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
השתלת קרדיומיוציטים פלוריפוטנטיים פלוריפוטנטיים המושרים על ידי אולטרסאונד בעכברים עם אוטם שריר הלב
In This Article
Summary
העברת תאים מונחית אולטרסאונד סביב האתר של אוטם שריר הלב בעכברים היא דרך בטוחה, יעילה ונוחה להשתלת תאים.
Abstract
המטרה העיקרית של טיפול תאי לאחר אוטם שריר הלב (MI) היא לשפר ביעילות את קצב השתלת התא, וקרדיומיוציטים שמקורם בתאי גזע פלוריפוטנטיים המושרים על ידי בני אדם (hiPSC-CMs) הם מקור תאים מבטיח לתיקון לב לאחר נזק איסכמי. עם זאת, שיעור השתלות נמוך מהווה מכשול משמעותי להתחדשות יעילה של רקמת הלב לאחר ההשתלה. פרוטוקול זה מראה כי מספר זריקות מלעוריות מונחות אולטרסאונד hiPSC-CM לאזור MI מגדילות ביעילות את שיעורי השתלת התאים. המחקר מתאר גם את כל תהליך תרבית hiPSC-CM, טיפול מקדים ושיטות לידה מלעורית מונחות אולטרסאונד. בנוסף, השימוש בדנ"א מיטוכונדריאלי אנושי עוזר לזהות היעדר hiPSC-CMs באיברי עכבר אחרים. לבסוף, מאמר זה מתאר את השינויים בתפקוד הלב, אנגיוגנזה, גודל התא ואפופטוזיס באזור הגבול האוטם בעכברים 4 שבועות לאחר מסירת התא. ניתן להסיק כי הזרקה מלעורית מונחית אקוקרדיוגרפיה של שריר הלב של החדר השמאלי היא טיפול תאי אפשרי, פולשני יחסית, משביע רצון, חוזר ויעיל.
Introduction
כאשר MI חריפה מתרחשת, תאי שריר הלב באזור אוטם למות במהירות עקב איסכמיה היפוקסיה. מספר גורמים דלקתיים משתחררים לאחר מוות וקרע של תאים, בעוד שתאי דלקת חודרים לאתר האוטם וגורמים לדלקת1. באופן משמעותי, פיברובלסטים וקולגן, הן ללא התכווצות והן מוליכות חשמלית, מחליפים את תאי שריר הלב באתר האוטם ויוצרים רקמת צלקת. בשל יכולת ההתחדשות המוגבלת של קרדיומיוציטים ביונקים בוגרים, רקמה בת קיימא הנוצרת לאחר שטח גדול של אוטם אינה מספקת בדרך כלל לשמירה על תפוקת לב מספקת2. MI גורם לאי ספיקת לב, ובמקרים חמורים של אי ספיקת לב, חולים יכולים להסתמך רק על השתלות לב או מכשירי סיוע חדריים כדי לשמור על תפקודי לב תקינים 3,4.
לאחר MI, אסטרטגיית הטיפול האידיאלית היא להחליף את cardiomyocytes מת עם cardiomyocytes שזה עתה נוצרו, יצירת צימוד אלקטרומכני עם רקמות בריאות. עם זאת, אפשרויות הטיפול אימצו בדרך כלל הצלת שריר הלב ולא החלפה. נכון לעכשיו, טיפולים מבוססי תאי גזע ותאי אב הם בין האסטרטגיות המבטיחות ביותר לקידום תיקון שריר הלב לאחר MI5. עם זאת, להשתלה של תאים אלה יש מספר בעיות, בעיקר חוסר היכולת של תאי גזע בוגרים להתמיין לקרדיומיוציטים ותוחלת החיים הקצרה שלהם6.
ניתן לעקוף את הסוגיות האתיות הקשורות לשימוש בתאי גזע עובריים (ES) על ידי תאי גזע פלוריפוטנטיים מוגנים, שהם מקור מבטיח לתאים. בנוסף, iPSCs הם בעלי יכולות התחדשות עצמית חזקות ויכולים להתמיין לקרדיומיוציטים7. מחקרים הראו כי hiPSC-CMs המושתלים באתר MI יכולים לשרוד וליצור צמתים מרווחים עם תאים מארחים 8,9. עם זאת, מכיוון שתאים מושתלים אלה ממוקמים במיקרו-סביבה של איסכמיה ודלקת, שיעור ההישרדות שלהם נמוך ביותר10,11.
מספר שיטות הוקמו כדי לשפר את שיעור ההישרדות של תאים מושתלים, כגון היפוקסיה והלם חום טיפול מקדים של תאים מושתלים 12,13, שינוי גנטי 14,15, והשתלה בו זמנית של תאים ונימים 16. למרבה הצער, רוב השיטות מוגבלות על ידי מורכבות ועלות גבוהה. לפיכך, המחקר הנוכחי מציע שיטת מתן hiPSC-CM ניתנת לשחזור, נוחה, פולשנית יחסית ויעילה.
הזרקת תאים תוך שריר הלב מונחה אולטרסאונד יכולה להתבצע רק עם מכשיר אולטרסאונד וטרינרי קטן ברזולוציה גבוהה ומיקרו-מזרק, ללא קשר לאתר. בהנחיית אולטרסאונד, העברה ישירה של תאים בתהליך הקסיפואיד מקרום הלב אל שריר הלב בעכברים היא פרוטוקול בטוח המונע נזק לכבד ולריאות. שיטה זו יכולה להיות משולבת בו זמנית עם טכנולוגיות אחרות כדי לשפר באופן משמעותי את שיעור ההישרדות של תאים מושתלים.
Protocol
כל הניסויים בבעלי חיים במחקר זה נבדקו ואושרו על ידי ועדת האתיקה של בית החולים השני שיאנגיה באוניברסיטת מרכז דרום. עיין בטבלת החומרים לקבלת פרטים אודות כל החומרים והציוד המשמשים בפרוטוקול זה. לוחות הזמנים להזרקת תאים, הדמיה והמתת חסד הם כדלקמן: t0- לגרום אוטם, t1 שבוע- תמונה ותאי שתל, t2 שבועות - תמונה ותאי שתל, t4 שבועות - הדמיה סופית, המתת חסד ואיסוף רקמות.
1. תרבית hiPSC, התמיינות קרדיומיוציטים וטיהור תאים
- ערבב DMEM/F12 ותמיסת מלאי מטריצת קרום מרתף עם קרח ב -4 ° C ביחס של 1.5: 1, aliquot, ואחסן את התערובת המתקבלת (מדלל מטריצה) ב -20 ° C. יש לערבב 25 מ"ל של מדיום תרבית DMEM/F12 בטמפרטורה של 4°C ו-1 מ"ל של מדלל מטריצה ביסודיות עם קרח, ולפזר 1 מ"ל/באר בצלחת בעלת 6 בארות. שמור את הצלחת זקופה במשך שעה אחת באינקובטור ב 37 ° C, ושאפו את הסופרנאטנט DMEM/F12 מהבארות. אין לגעת בתחתית הצלחת בעלת 6 הבארות בעת ביצוע ההליך.
- הסר את צינור השימור הקריוגני המכיל את hiPSCs מחנקן נוזלי והפשיר אותם במהירות באמבט מים של 37 מעלות צלזיוס. יש לעקר את המשטח החיצוני של צינור ההקפאה ב-75% אלכוהול, לנגב את האלכוהול ולהעביר את הצינור לשולחן סטרילי נקי במיוחד.
- השתמש פיפטה כדי להעביר בעדינות את פתרון ההקפאה המכיל hiPSCs לתוך צינור צנטריפוגה 15 מ"ל, להוסיף 5 מ"ל של תווך ES ללא מזין, ולצנטריפוגה את המתלה ב 300 × גרם במשך 3 דקות בטמפרטורת החדר. השליכו את הסופרנאטנט והשהו מחדש בעדינות את התאים ב-6 מ"ל של מדיום ES נטול הזנה. ספור את התאים והתאם את ריכוז התא ל 5 × 105 תאים / מ"ל עם מדיום התרבית.
- הוסף מעכב ROCK (Y27632) ל- hiPSCs לריכוז סופי של 5 מיקרומטר. העבר את hiPSCs עם Y27632 לצלחת 6 בארות שטופלה במטריצת קרום מרתף, וסובב בעדינות את הצלחת בעלת 6 הקידוחים, תוך התחקות אחר צורת המספר "8" כדי לפזר באופן שווה את hiPSCs. מקם את hiPSCs באינקובטור לח של 37 מעלות צלזיוס עם 5% CO2 במצב זקוף למשך 24 שעות. החלף את הסופרנאטנט בתווך ES ללא מזין ללא Y27632.
- כאשר hiPSCs מגיעים לדרגת מפגש של 80%, שאפו את תרבית העל, שטפו את התאים פעמיים במי מלח חוצצי פוספט (PBS), הוסיפו RPMI1640 + B27 ללא אינסולין המכיל 10 מיקרומטר CHIR99021 (מעכב GSK3-β), והניחו את hiPSCs באינקובטור CO2 לח בטמפרטורה של 37°C למשך 24 שעות.
- החליפו מחצית מהסופרנאטנט במדיום RPMI1640 + B27 ללא אינסולין ודגרו על התאים למשך 24 שעות נוספות.
- להחליף לחלוטין את המדיום תרבית עם RPMI1640 + B27 (ללא אינסולין). הניחו את הצלחות באינקובטור לח ב 37 °C עם 5% CO2 במצב זקוף במשך 24 שעות.
- החלף לחלוטין את מדיום התרבית לאחר 3 ימים עם RPMI1640 ללא אינסולין + B27 + 5 מיקרומטר IWR1 (מעכב מסלול איתות Wnt) ומקם את הלוחות באינקובטור לח ב 37 ° C עם 5% CO2 במשך 48 שעות.
- החלף את מדיום התרבית לאחר 5 ימים עם RPMI1640 + B27 ללא אינסולין והמשך לדגור במשך 48 שעות באינקובטור CO2 לח ב 37 מעלות צלזיוס.
- החלף את מדיום התרבית בתווך RPMI + B27 (כולל אינסולין) לאחר 7 ימים והנח את הצלחות באינקובטור CO2 לח למשך 3 ימים ב 37 מעלות צלזיוס. החלף את המדיום בתווך RPMI + B27 כל 3 ימים. חפש את המכות הספונטניות של תאים ב 9-12 ימים של התמיינות.
- לאחר התבוננות בתאים הפועמים, החלף את מדיום RPMI + B27 בתווך RPMI 1640 ללא גלוקוז המכיל חומצה לקטית (1 מ"ל חומצה לקטית נוסף ל 500 מ"ל של מדיום RPMI 1640 ללא גלוקוז). לדגור על התאים במשך 72 שעות באינקובטור לח ב 37 ° C עם 5% CO2.
- לאחר 72 שעות, להחליף את supernatant עם RPMI + B27 בינוני לדגור במשך 48 שעות באינקובטור לח ב 37 ° C עם 5% CO2.
- שאפו את תרבית העל תחת לחץ שלילי ושטפו את התאים 3x עם PBS כדי להסיר עקבות של מדיום התרבית. השתמש בתערובת אנזימי ניתוק התאים כדי לנתק את hiPSC-CMs לתאים בודדים ב 37 ° C. לאסוף את התאים המתקבלים לתוך צינור צנטריפוגה 15 מ"ל המכיל 3 מ"ל של תמיסת תמיכה cardiomyocyte, צנטריפוגה ב 300 × גרם במשך 2 דקות בטמפרטורת החדר, ולהשליך את supernatant.
- להשעות מחדש את התאים עם RPMI + B27 בינוני, זרע אותם על ממברנת מרתף מטריקס מצופה 6 צלחות באר, לדגור אותם במשך 48 שעות באינקובטור לח ב 37 ° C עם 5% CO2.
- יש להחליף את הסופרנאטנט התרבית לטיהור בתווך RPMI 1640 ללא גלוקוז המכיל חומצה לקטית ולדגור במשך 72 שעות באינקובטור לח ב-37°C עם 5%CO2.
- החליפו את הסופרנאטנט התרבית במדיום RPMI + B27 והחליפו את המדיום כל 3 ימים.
- המשך בתהליך הנ"ל במשך 30 יום, החלפת supernatant תרבית עם מדיום ללא גלוקוז המכיל חומצה לקטית לטיהור נוסף. לדגור את התאים במשך 3 ימים עם מדיום זה ולהחליף את supernatant עם RPMI + B27. תרבית את התאים ברציפות במשך 30 יום עד hiPSC-CMs לפעום ביציבות, ולהשתמש בתאים אלה להזרקה תוך שריר הלב בעכברים.
2. הכנת hiPSC-CMs והקמת מודל אוטם חריף של שריר הלב בעכבר
- שאפו ואקום את תרבית העל מ-hiPSC-CMs בתרבית במשך 60 יום, שטפו את התאים 3x עם PBS, ונתקו את hiPSC-CMs לתאים בודדים ב-37°C עם תערובת אנזימי ניתוק התא (~3-5 דקות). לאסוף את התאים בצינור צנטריפוגה 15 מ"ל המכיל 5 מ"ל של RPMI + B27 בינוני ולערבב היטב לפני ספירת התאים כדי לחשב את מספר התאים הכולל. צנטריפוגה את מתלה התא ב 300 × גרם במשך 2 דקות בטמפרטורת החדר. יש להשליך את הסופרנאטנט ולהוסיף מדיום תמיכה קרדיומיוציטים להשעיה מחדש לריכוז של 0.6 × 105 תאים/μL.
- שמור את צינור הצנטריפוגה המכיל את hiPSC-CMs התלויים מחדש מוכן ב 37 ° C להזרקה 14,17,18,19,20.
- הניחו את העכברים בקופסת הרדמה המחוברת לאיזופלורן כדי לגרום לשאיפת הרדמה ולאחריה השתמשו במשחה וטרינרית על העיניים כדי למנוע יובש בזמן הרדמה.
הערה: ריכוז האיזופלורן היה 5%. שימו לב לאוורור המעבדה במהלך הניסוי. - חפש אובדן רפלקסים באזור הרגליים והזנב לאחר צביטה כאשר העכבר מונח שטוח על שולחן הניתוחים, מה שמצביע על הרדמה מספקת. מתן buprenorphine (0.1 מ"ג / ק"ג) intraperitoneally.
- מרחו את השיער על אמצע הצוואר ואת החזה השמאלי של העכברים עם קרם depilatory, ונגבו את הקרם והשיער עם גזה לאחר 5 דקות.
- תקן את הגפיים ואת זנב העכבר עם קלטת. תקן את חותכות העכבר עם חוט משי 2-0 קלטת. יש לעקר את אזור הניתוח (הצוואר החציוני והחזה השמאלי) עם שלושה סבבים לסירוגין של בטאדין ואחריו אלכוהול.
- מניחים וילון כירורגי סביב אזור הניתוח המעוקר. לאחר מכן, בצע חתך צוואר חציוני באמצעות מספריים אנטומיים עדינים ומלקחיים מנתחים עדינים כדי לחשוף את קנה הנשימה במלואו. במידת הצורך, יש לחתוך מספר שרירי צוואר הרחם הקדמיים לצורך ייצוב.
הערה: המפעילים היו עיוורים לקבוצות בעלי החיים. - החדרת צינור קנה הנשימה (מחט ניקוב קטטר 20 גרם) דרך הפה.
- חבר את צינור קנה הנשימה למכונת ההנשמה ובדוק את תנועת בית החזה כדי לוודא ששתי הריאות מאווררות היטב.
- התאם את פרמטרי הנשימה (קצב נשימה: 100-150 פעימות לדקה, נפח גאות ושפל 250-300 מיקרוליטר). לאחר מכן, מקבעים את הגפה האחורית השמאלית לצד ימין תחתון, משחררים את הסרט סביב הגפה השמאלית העליונה, ומבצעים כריתת בית החזה בחלל הבין-קוסטלי 3-4 של בית החזה השמאלי באמצעות מספריים ומלקחיים מנתחים עדינים לחשיפה מקסימלית ללב.
- באמצעות מלקחיים, לקלף את קרום הלב תחת מיקרוסקופ כדי לדמיין את העורק הכלילי היורד הקדמי השמאלי (LAD) בקצה התחתון של תוספתן פרוזדורים שמאל.
- השתמש בחוט משי 6-0 כדי לקשור את הקצה הפרוקסימלי של ה- LAD. לאחר שווידאתם שמודל MI החריף מבוסס כראוי (כאשר ה-LAD הדיסטלי באתר הקשירה משתנה מאדום ללבן), סגרו את החזה שכבה אחר שכבה ותפרו את העור ב-4-0 תפרים מושחלים לסירוגין. לבצע את כל ההליכים הכירורגיים הנ"ל להשראת MI לקבוצת בעלי החיים המזויפים למעט קשירה.
- כבו את חומר ההרדמה בשאיפה, הסירו את הצינורית לאחר שהעכבר חזר לנשימה ספונטנית, והחזירו אותה לכלוב. עקוב אחר בעל החיים עד שהוא חזר להכרה מספקת כדי לשמור על שכיבת עצם החזה. אל תחזירו אותו לחברתם של בעלי חיים אחרים עד שיחלים לחלוטין. מתן זריקות intraperitoneal של buprenorphine (0.1 מ"ג / ק"ג x 3 ימים) ו carprofen (5 מ"ג / ק"ג x 1 יום) כל 12 שעות לאחר הניתוח.
- הזריקו ציקלוספורין A (10 מ"ג·kg-1·day-1) לחלל התוך צפקי של עכברים 3 ימים לפני מתן hiPSC-CMs כדי למנוע דחייה של התאים המושתלים. להזריק cyclosporin A ברציפות במשך חודש לאחר ההשתלה.
3. הזרקת hiPSC-CM בהנחיית אולטרסאונד
- לאחר הגדרת מודל MI, הקצו את עכברי מודל MI (עכברי C57BL/6 בני 12 שבועות; משקל 22 גרם עד 24 גרם, 50% זכר ו-50% נקבה) לקבוצות מנה אחת (SD, n = 8 במחקר זה) ומנות מרובות (MD, n = 8 במחקר זה) ביום הראשון שלאחר MI והניחו אותם בשבוע הראשון והשני לאחר MI בקופסת הרדמה המחוברת עם 5% איזופלורן להשראת הרדמה באינהלציה ואחריה אינטובציה בקנה הנשימה.
- מורחים את השיער על החזה והבטן העליונה של העכברים עם קרם depilatory ולנגב את הקרם עם גזה 5 דקות מאוחר יותר. עקוב אחר קצב הלב של העכבר בלוח הניתוח ונהל איזופלורן שאיפה עד שקצב הלב נשמר ב 400-500 פעימות לדקה.
- תקן את גפיים העכבר ואת הזנב עם סרט על קונסולת האיתור ולהגדיר את טמפרטורת הפלטפורמה על 37 ° C.
- החל ג'לי אולטרסאונד מיוחד על הבטן העליונה והשתמש בבדיקת אולטרסאונד וטרינרית קטנה יותר ברזולוציה גבוהה כדי לקבל תמונות כבד עכבר.
- להקטין את קצב ההנשמה ל 50 פעימות לדקה. השתמש במיקרומזרק 5 μL כדי לצייר ~ 3 × 105 תאים (משלב 2.1). החזקת המזרק באמצעות מיקרומניפולטור, החדרת מחט בקוטר 3 מ"מ בתהליך הפארא-קסיפואיד השמאלי (איור 1A). עקבו אחר הקצה העליון של הסרעפת תחת הנחיית אולטרסאונד (איור 1B), התבוננו בקצב ובטווח הנשימה (איור 1C,D), והיכנסו לקרום הלב בסוף מחזור התפוגה תוך הימנעות מנזק לכבד ולריאות (איור 1D).
- לאחר שמחט המיקרו-מזרק נכנסת לחלל קרום הלב, התאם את קצב הנשימה לפרמטר המקורי (150 פעימות לדקה). רכשו את תמונת הציר הארוך של לב העכבר באמצעות אקוקרדיוגרפיה של M-mold בהתאם להוראות היצרן17 (איור 1E). תחת הנחיה על-קולית, הזריקו 3 × 105 תאים (איור 1F) לשלושה אזורים שוליים (1 × 105 תאים לכל אתר מוזרק) של אתר האוטם.
- הסר את בדיקת האולטרסאונד המיוחדת ושטוף את הג'לי. גמלו את העכבר מההרדמה באינהלציה, והחזירו אותו לכלוב לאחר הכרה מלאה.
- חזור על הליכי הזרקת התאים מונחי האולטרסאונד לעיל שבוע ושבועיים לאחר הקמת MI עבור עכברי קבוצת MD.
4. הערכת תפקוד הלב, תיוג פלואורסצנטי, ספירת תאים מושתלים, אזור אוטם שריר הלב וזיהוי מיטוכונדריה אנושית של איברים בעכברים 30 יום לאחר קשירת ענף יורד קדמי שמאלי
- הערכת תפקודי לב
- הכניסו את העכבר לקופסת הרדמה המחוברת לאיזופלורן לצורך הרדמה אינדוקציה-אינהלציה ואחריה שימוש במשחה וטרינרית על העיניים למניעת יובש בזמן הרדמה. הסר את השיער על החזה השמאלי של העכבר עם קרם depilatory. הנח את העכבר על לוח ההפעלה כדי לפקח על קצב הלב ולהתאים את שאיפת האיזופלורן. שמור על קצב הלב של העכבר על 400-500 פעימות לדקה. נקודת הסיום של הניסוי היא היום ה-30 (לאחר האינדוקציה של אמ"ן).
- תקן את גפיים העכבר ואת הזנב עם סרט על קונסולת האיתור ולהגדיר את טמפרטורת הפלטפורמה על 37 ° C.
- לאחר מריחת ג'ל אולטרסאונד מיוחד על אזור הלב הקדמי, יש להשתמש בבדיקת אולטרסאונד לב (וטרינרית) ברזולוציה גבוהה כדי לקבל תמונות פרסטרנליות ארוכות ציר ודו מימדי בציר קצר תחת אקוקרדיוגרפיה של M-mold ו- B-mold בהתאם להוראות היצרן17.
- לאחר השלמת הזיהוי האולטרסוני, יש לשטוף את הג'ל האולטרסוני המיוחד, לכבות את חומר ההרדמה בשאיפה, ולהחזיר את העכבר לכלוב בנפרד כשהוא בהכרה מלאה.
- נתח את הנתונים המתקבלים וחשב את מקטע פליטת החדר השמאלי (EF) ואת קיצור השבר (FS) באמצעות תוכנת הניתוח. ודא שהמפעיל עיוור לקבוצות הניסוי17.
- תיוג פלואורסצנטי של מקטעים
- לשטוף את הלב המבודד עם PBS, לטבול אותו 4% paraformaldehyde ב 4 ° C במשך 12 שעות. הוציאו את הלב וטבלו אותו ב-30% סוכרוז למשך 24 שעות כדי להתייבש.
- הטמע את הלב המיובש בתרכובת טמפרטורת החיתוך האופטימלית (OCT) על קרח יבש. פורסים את הלב מלמטה לקודקוד בעובי קריוסטט של 10 מיקרומטר ומניחים את החלקים על שקופיות ומאחסנים את המגלשות ב -20 מעלות צלזיוס.
- שטפו את המגלשות עם רקמת הלב עם PBS למשך 3 דקות.
- יש להחדיר את הרקמה במגלשות עם 0.5% Triton X-100 בטמפרטורת החדר למשך 8 דקות ולשטוף אותן 3 פעמים עם PBS למשך 5 דקות לכל כביסה.
- לאחר כיסוי הרקמה עם 10% נסיוב חמור ו 90% PBS (פתרון חוסם), לחסום את החלקים במשך 1 שעה בטמפרטורת החדר.
- לאחר הסרת תמיסת החסימה, יש לדגור על החלקים עם הנוגדן הראשוני (מדולל ל-1:100 עם תמיסת החסימה) למשך הלילה ב-4 מעלות צלזיוס. שטפו אותם 3 פעמים עם PBS במשך 5 דקות לכל כביסה.
- לדגור את הרקמה על שקופיות עם נוגדן משני מצומד פלואורופור (מדולל ל 1:100 עם הפתרון חוסם) במשך 1 שעה בטמפרטורת החדר.
הערה: הימנע מחשיפת הרקמות עם הנוגדן המשני המצומד פלואורופור לאור מנקודה זו ואילך. - שטפו את המגלשות 3 פעמים עם PBS למשך 5 דקות לכל כביסה.
- הרכיבו את השקופיות באמצעות מדיום הרכבה 4',6-diamidino-2-phenylindole (DAPI) המכיל וצילום תחת מיקרוסקופ פלואורסצנטי17.
- מספר ה-hiPSC-CMs המושתלים17
- בצע צביעה אימונופלואורסצנטית של רקמות על חלקים קפואים של הלב עבור טרופונין T ספציפי להולכי רגל (hcTnT), אנטיגן גרעיני אנושי (HNA), ואלפא אקטינין סרקומרי לא ספציפי.
- לאחר שכל הלב נחתך באופן סדרתי, קח קטע אחד לכל 50 חלקים לתיוג פלואורסצנטי.
- צלמו באופן אקראי חמש תמונות בהגדלה גבוהה לכל פרוסה. ספור את מספר שדות הראייה המושתלים, חשב את מספרי התאים המושתלים הממוצעים ליחידת שטח והגדר אותם כ- A1/μm2. חשב את השטח המושתל הכולל של הפרוסה באמצעות ImageJ (https://imagej.nih.gov/ij/) והגדר אותו כ- B1μm2 כך שהמספר המושתל בפרוסה זו = A1 ×- B121,22.
- חשב את המספר הכולל של תאים מושתלים לכל לב עכבר באמצעות Eq (1) ואת שיעור הקליטה באחוזים באמצעות Eq (2), בהינתן שנבחר קטע אחד מכל 50 מקטעים21,22.
- המספר הכולל של תאים מושתלים לכל לב עכבר = (A1 × B1 + A2 × B2 +...+ An × Bn) × 50 (1)
קצב קליטה =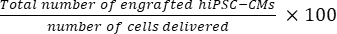 (2)
(2)
הערה: מספר המסירות היה 3 × 10 5 עבור קבוצת SD ו- 3 × 3 × 105 עבור קבוצת MD.
- הערכת אזור אוטם שריר הלב
- חותכים חתך קפוא (ציר קצר) של הלב המבודד, מהקודקוד לבסיס הלב בעובי של 10 מיקרומטר.
- לאחר שכל הלב נחתך באופן סדרתי, קח שקופית קטע אחת לכל 30 חלקים ותקן אותה בתמיסת Bouin שחוממה מראש ב 58 ° C. צבעו את החלק בכתמי קולגן 0.04% אדום ישיר ו-0.1% ירוק מהיר (מדולל ב-PBS) בהתאם להוראות היצרן17.
- השתמש בתוכנה (למשל, ImageJ) כדי לנתח את התמונות לאחר צילום חתך של כל הגוף של הלב תחת מיקרוסקופ באמצעות Eq (3):14,17
שטח אינפרקט % =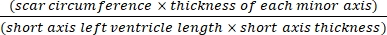 × 100% (3)
× 100% (3)
- איתור DNA מיטוכונדריאלי אנושי באיברים שונים
- מרדימים את העכברים עם איזופלורן 5% ומקריבים אותם על ידי נקע צוואר הרחם האחורי. נתחו את העכברים 4 שבועות לאחר השתלת התא. קצור את האיברים (כבד, ריאות, מוח, כליות, טחול) וחלק משריר הלב (n = 3 בסעיף זה).
- טוחנים כל רקמת איבר בחנקן נוזלי ומפיקים DNA מהרקמה באמצעות ערכת ההפניה (ראה טבלת חומרים) בהתאם להוראות היצרן.
- פעל בהתאם להוראות היצרן כדי להשתמש בערכה ובפריימרים שהוזכרו לעיל (ראה טבלת חומרים) כדי לזהות DNA מיטוכונדריאלי אנושי ברקמות שהוזכרו לעיל (משלב 4.5.1).
תוצאות
אקוקרדיוגרפיה להערכת תפקוד החדר השמאלי של העכברים בכל קבוצה גילתה שפציעות MI התהפכו ביעילות בקבוצת MD (איור 2A). בהשוואה לקבוצת MI, קבוצת SD הראתה מקטע פליטה מוגבר (EF) (מ -30% ל -35%; איור 2B) וקיצור שברים (FS) (מ-18% ל-22%; איור 2C) אחרי MI. עם זאת, חשוב עוד יותר לצ...
Discussion
השלבים הקריטיים של מחקר זה כוללים תרבית hiPSC, התמיינות קרדיומיוציטים, טיהור hiPSC-CM והשתלת hiPSC-CM באתר אוטם שריר הלב של עכבר. המפתח הוא להשתמש באולטרסאונד לב כדי לכוון את הטיפול באופן טרנסעורי לכיוון אתר האוטם בקצה האוטם שבו הוזרקו לאזור hiPSC-CMs.
עם התארכות זמן התרבית, הפנוטיפ hiPSC-CM ?...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי תוכנית המחקר העיקרית של הקרן הלאומית למדעי הטבע של סין (מס '91539111ל JY), פרויקט מפתח של מדע וטכנולוגיה של מחוז הונאן (מס '2020SK53420 ל- JY) ותוכנית החדשנות במדע וטכנולוגיה של מחוז הונאן (2021RC2106 עד CF).
Materials
| Name | Company | Catalog Number | Comments |
| Antibody | |||
| Cardiac troponin T | Abcam | ab8295 | |
| Donkey Anti-Mouse IgG H&L (Alexa Fluor 488) | Abcam | ab150105 | |
| Donkey Anti-Mouse IgG H&L (Alexa Fluor 555) | Abcam | ab150110 | |
| Donkey Anti-Rabbit IgG H&L (Alexa Fluor 488) | Abcam | ab150073 | |
| Donkey Anti-Rabbit IgG H&L (Alexa Fluor 555) | Abcam | ab150062 | |
| Human cardiac troponin T | Abcam | ab91605 | |
| Isolectin B4 | Vector | FL-1201 | |
| Sarcomeric alpha actinin | Abcam | ab9465 | |
| Wheat germ agglutinin | Thermo Fisher Scientific | W11261 | |
| Reagent | |||
| Accutase | Thermo Fisher Scientific | 00-4555-56 | |
| B27 Supplement(minus insulin) | Thermo Fisher Scientific | A1895601 | |
| B27 Supplement(serum free) | Thermo Fisher Scientific | 17–504-044 | |
| Bouin's solution | Thermo Fisher Scientific | SDHT10132 | |
| CHIR99021 | Selleck | CT99021 | |
| cyclosporin A | Medchemexpress | HY-B0579 | |
| DIRECT RED | Sigma-Aldrich | 365548-25G | |
| DMEM/F12 | Thermo Fisher Scientific | 11320033 | |
| DNeasy Blood & Tissue Kit | Qiagen | 69504 | |
| FAST GREEN FCF | Sigma-Aldrich | F7252-5G | |
| Glucose-free RPMI 1640 | Thermo Fisher Scientific | 11879020 | |
| IWR1 | Selleck | S7086 | |
| lactic acid | Sigma-Aldrich | L6661 | |
| Matrigel | BD Biosciences | BD356234 | |
| mTeSR1 | Stem Cell Technologies | 72562 | |
| O.C.T. Compound | SAKURA | 4583 | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| PowerUP SYBR Green MasterMix kit | Thermo Fisher Scientific | A25742 | |
| RPMI1640 | Thermo Fisher Scientific | 11875119 | |
| STEMdif Cardiomyocyte Freezing Medium/STEMdiff | Stem Cell Technologies | 5030 | |
| STEMdiff Cardiomyocyte Support Medium | Stem Cell Technologies | 5027 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| ultrasound coupling agent | CARENT | 22396269389 | |
| Y-27632 | Selleck | S6390 | |
| Equipment and Supplies | |||
| Applied Biosystems | Thermo Fisher Scientific | 7500 Real-Time PCR | |
| cryostat | Leica | CM1950 | |
| fluoresence microscope | Olympus | IX83 | |
| fine anatomical scissors | Fine Science Tools | 15000-08 | |
| fine dissecting forceps | Fine Science Tools | 11255-20 | |
| Micro syringe | Hamilton | 7633 | |
| Small animal anesthesia machine | MATRX | VMR | |
| Ultra-high resolution small animal ultrasound imaging system | VisualSonics | Vevo 2100 | |
| Software | |||
| Statistical Product and Service Solutions | IBM | 21 | |
| Image J | NIH | 1.48 | |
| Human mitochondrial DNA primers | |||
| the forward primer sequence | CCGCTACCATAATCATCGCTAT | ||
| the reverse primer sequence | TGCTAATACAATGCCAGTCAGG |
References
- Leuschner, F., et al. Rapid monocyte kinetics in acute myocardial infarction are sustained by extramedullary monocytopoiesis. The Journal of Experimental Medicine. 209 (1), 123-137 (2012).
- Lázár, E., et al. Cardiomyocyte renewal in the human heart: insights from the fall-out. European Heart Journal. 38 (30), 2333-2342 (2017).
- Davis, M. K., et al. State of the art: cardiac transplantation. Trends in Cardiovascular Medicine. 24 (8), 341-349 (2014).
- Mancini, D., Colombo, P. C. Left ventricular assist devices: A rapidly evolving alternative to transplant. Journal of the American College of Cardiology. 65 (23), 2542-2555 (2015).
- Zimmermann, W. H. Translating myocardial remuscularization. Circulation Research. 120 (2), 278-281 (2017).
- Hu, X., et al. A large-scale investigation of hypoxia-preconditioned allogeneic mesenchymal stem cells for myocardial repair in nonhuman primates: Paracrine activity without remuscularization. Circulation Research. 118 (6), 970-983 (2016).
- Kempf, H., et al. Cardiac differentiation of human pluripotent stem cells in scalable suspension culture. Nature Protocols. 10 (9), 1345-1361 (2015).
- Chong, J. J., et al. Human embryonic-stem-cell-derived cardiomyocytes regenerate non-human primate hearts. Nature. 510 (7504), 273-277 (2014).
- Shiba, Y., et al. Allogeneic transplantation of iPS cell-derived cardiomyocytes regenerates primate hearts. Nature. 538 (7625), 388-391 (2016).
- Nguyen, P. K., et al. Potential strategies to address the major clinical barriers facing stem cell regenerative therapy for cardiovascular disease: A review. JAMA Cardiology. 1 (8), 953-962 (2016).
- Zimmermann, W. H. Remuscularization of the failing heart. The Journal of Physiology. 595 (12), 3685-3690 (2017).
- Hu, X., et al. Transplantation of hypoxia-preconditioned mesenchymal stem cells improves infarcted heart function via enhanced survival of implanted cells and angiogenesis. The Journal of Thoracic and Cardiovascular Surgery. 135 (4), 799-808 (2008).
- Feng, Y., et al. Heat shock improves Sca-1+ stem cell survival and directs ischemic cardiomyocytes toward a prosurvival phenotype via exosomal transfer: a critical role for HSF1/miR-34a/HSP70 pathway. Stem Cells. 32 (2), 462-472 (2014).
- Fan, C., et al. Cardiomyocytes from CCND2-overexpressing human induced-pluripotent stem cells repopulate the myocardial scar in mice: A 6-month study. Journal of Molecular and Cellular Cardiology. 137, 25-33 (2019).
- Lou, X., et al. N-cadherin overexpression enhances the reparative potency of human-induced pluripotent stem cell-derived cardiac myocytes in infarcted mouse hearts. Cardiovascular Research. 116 (3), 671-685 (2020).
- Sun, X., et al. Transplanted microvessels improve pluripotent stem cell-derived cardiomyocyte engraftment and cardiac function after infarction in rats. Science Translational Medicine. 12 (562), (2020).
- Wu, X., et al. Cardiac repair with echocardiography-guided multiple percutaneous left ventricular intramyocardial injection of hiPSC-CMs after myocardial infarction. Frontiers in Cardiovascular Medicine. 8, 768873 (2021).
- Kannappan, R., et al. Functionally competent DNA damage-free induced pluripotent stem cell-derived cardiomyocytes for myocardial repair. Circulation. 140 (6), 520-522 (2019).
- Lou, X., et al. N-cadherin overexpression enhances the reparative potency of human-induced pluripotent stem cell-derived cardiac myocytes in infarcted mouse hearts. Cardiovascular Research. 116 (3), 671-685 (2020).
- Zhao, M., et al. Y-27632 preconditioning enhances transplantation of human-induced pluripotent stem cell-derived cardiomyocytes in myocardial infarction mice. Cardiovascular Research. 115 (2), 343-356 (2019).
- Zhao, M., et al. Enhancing the engraftment of human induced pluripotent stem cell-derived cardiomyocytes via a transient inhibition of rho kinase activity. Journal of Visualized Experiments: JoVE. (149), e59452 (2019).
- O'Brien, J., Hayder, H., Peng, C. Automated quantification and analysis of cell counting procedures using ImageJ plugins. Journal of Visualized Experiments: JoVE. (117), e54719 (2016).
- Kain, V., Prabhu, S. D., Halade, G. V. Inflammation revisited: inflammation versus resolution of inflammation following myocardial infarction. Basic Research in Cardiology. 109 (6), 444 (2014).
- Rainer, P. P., et al. Cardiomyocyte-specific transforming growth factor β suppression blocks neutrophil infiltration, augments multiple cytoprotective cascades, and reduces early mortality after myocardial infarction. Circulation Research. 114 (8), 1246-1257 (2014).
- Yu, Y., et al. Human embryonic stem cell-derived cardiomyocyte therapy in mouse permanent ischemia and ischemia-reperfusion models. Stem Cell Research & Therapy. 10 (1), 167 (2019).
- Iwanaga, K., et al. Effects of G-CSF on cardiac remodeling after acute myocardial infarction in swine. Biochemical and Biophysical Research Communications. 325 (4), 1353-1359 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved