Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Implantación de cardiomiocitos derivados de células madre pluripotentes inducida por ultrasonido en ratones con infartado de miocardio
En este artículo
Resumen
La administración de células guiadas por ultrasonido alrededor del sitio del infarto de miocardio en ratones es una forma segura, efectiva y conveniente de trasplante de células.
Resumen
El objetivo clave de la terapia celular después del infarto de miocardio (IM) es mejorar eficazmente la tasa de injerto celular, y los cardiomiocitos derivados de células madre pluripotentes inducidos por humanos (hiPSC-CM) son una fuente celular prometedora para la reparación cardíaca después del daño isquémico. Sin embargo, una tasa baja de injertos es un obstáculo significativo para la regeneración efectiva del tejido cardíaco después del trasplante. Este protocolo muestra que múltiples inyecciones percutáneas guiadas por ultrasonido hiPSC-CM en un área de IM aumentan efectivamente las tasas de trasplante celular. El estudio también describe todo el proceso de cultivo de hiPSC-CM, el pretratamiento y los métodos de administración percutánea guiados por ultrasonido. Además, el uso de ADN mitocondrial humano ayuda a detectar la ausencia de hiPSC-CMs en otros órganos de ratón. Por último, este artículo describe los cambios en la función cardíaca, la angiogénesis, el tamaño celular y la apoptosis en la zona fronteriza infartada en ratones 4 semanas después de la entrega celular. Se puede concluir que la inyección percutánea guiada por ecocardiografía del miocardio ventricular izquierdo es una terapia celular factible, relativamente invasiva, satisfactoria, repetible y efectiva.
Introducción
Cuando se produce un infarto agudo de miocardio, las células del miocardio en el área infartada mueren rápidamente debido a la isquemia y la hipoxia. Varios factores inflamatorios se liberan después de la muerte celular y la ruptura, mientras que las células inflamatorias se infiltran en el sitio infartado para causar inflamación1. Significativamente, los fibroblastos y el colágeno, ambos sin contractilidad y conductividad eléctrica, reemplazan las células miocárdicas en el sitio infartado para formar tejido cicatricial. Debido a la limitada capacidad de regeneración de los cardiomiocitos en mamíferos adultos, el tejido viable formado después de una gran área de infarto generalmente no es adecuado para mantener un gasto cardíaco suficiente2. El IM causa insuficiencia cardíaca, y en casos severos de insuficiencia cardíaca, los pacientes solo pueden confiar en trasplantes cardíacos o dispositivos de asistencia ventricular para mantener las funciones cardíacas normales 3,4.
Después del IM, la estrategia de tratamiento ideal es reemplazar los cardiomiocitos muertos con cardiomiocitos recién formados, formando acoplamiento electromecánico con tejidos sanos. Sin embargo, las opciones de tratamiento generalmente han adoptado el rescate miocárdico en lugar del reemplazo. Actualmente, las terapias basadas en células madre y células progenitoras se encuentran entre las estrategias más prometedoras para promover la reparación del miocardio después de la MI5. Sin embargo, el trasplante de estas células tiene varios problemas, principalmente la incapacidad de las células madre adultas para diferenciarse en cardiomiocitos y su corta vidaútil 6.
Las cuestiones éticas relacionadas con el uso de células madre embrionarias (ES) pueden ser eludidas por las iPSC, que son una fuente prometedora de células. Además, las iPSCs poseen fuertes capacidades de auto-renovación y pueden diferenciarse en cardiomiocitos7. Los estudios han demostrado que los hiPSC-CM trasplantados en el sitio IM pueden sobrevivir y formar uniones de brecha con las células huésped 8,9. Sin embargo, debido a que estas células trasplantadas se encuentran en el microambiente de la isquemia y la inflamación, su tasa de supervivencia es extremadamente baja10,11.
Se han establecido varios métodos para mejorar la tasa de supervivencia de las células trasplantadas, como el pretratamiento de hipoxia y choque térmico de células trasplantadas12,13, la modificación genética 14,15 y el trasplante simultáneo de células y capilares 16. Desafortunadamente, la mayoría de los métodos están limitados por la complejidad y el alto costo. Por lo tanto, el presente estudio propone un método de administración de hiPSC-CM reproducible, conveniente, relativamente invasivo y efectivo.
La inyección de células intramiocárdicas guiada por ultrasonido se puede llevar a cabo solo con una pequeña máquina de ultrasonido veterinario de alta resolución y un microinyector, independientemente del sitio. Bajo la guía de ultrasonido, la entrega directa de células bajo el proceso xifoide desde el pericardio al miocardio en ratones es un protocolo seguro que evita el daño hepático y pulmonar. Este método se puede combinar simultáneamente con otras tecnologías para mejorar significativamente la tasa de supervivencia de las células trasplantadas.
Protocolo
Todos los experimentos con animales en este estudio fueron revisados y aprobados por el comité de ética del Segundo Hospital Xiangya de la Universidad Central del Sur. Consulte la Tabla de materiales para obtener detalles sobre todos los materiales y equipos utilizados en este protocolo. Los plazos para la inyección celular, la imagen y la eutanasia son los siguientes: t0- inducir infarto, t1 semana- imagen y células de implante, t2 semanas- imagen y células de implante, t4 semanas- imagen final, eutanasia y recolección de tejido.
1. cultivo de hiPSC, diferenciación de cardiomiocitos y purificación celular
- Mezclar DMEM/F12 y la solución madre de matriz de membrana basal con hielo a 4 °C en una proporción de 1,5:1, alícuota, y almacenar la mezcla resultante (diluyente de matriz) a -20 °C. Mezclar 25 ml de medio de cultivo DMEM/F12 a 4 °C y 1 ml de diluyente de matriz a fondo con hielo, y esparcir 1 ml/pocillo en una placa de 6 pocillos. Mantener la placa en posición vertical durante 1 h en una incubadora a 37 °C y aspirar el sobrenadante DMEM/F12 de los pocillos. No toque la parte inferior de la placa de 6 pocillos cuando realice el procedimiento.
- Retirar el tubo de criopreservación que contiene las hiPSC del nitrógeno líquido y descongelarlas rápidamente en un baño maría a 37 °C. Esterilice la superficie externa del tubo de criopreservación con alcohol al 75%, limpie el alcohol y transfiera el tubo a una mesa estéril ultralimpia.
- Use una pipeta para transferir suavemente la solución de criopreservación que contiene hiPSC a un tubo de centrífuga de 15 ml, agregue 5 ml de medio ES sin alimentador y centrifugue la suspensión a 300 × g durante 3 minutos a temperatura ambiente. Deseche el sobrenadante y resuspenda suavemente las células en 6 ml del medio ES sin alimentador. Contar las células y ajustar la concentración celular a 5 × 105 células/ml con el medio de cultivo.
- Añadir el inhibidor de ROCK (Y27632) a las hiPSC hasta una concentración final de 5 μM. Transfiera las hiPSC con Y27632 a la placa de 6 pocillos pretratada con matriz de membrana basal, y agite suavemente la placa de 6 pocillos, trazando la forma del número "8" para distribuir uniformemente las hiPSC. Colocar las hiPSCs en una incubadora húmeda a 37 °C con un 5% deCO2 en posición vertical durante 24 h. Reemplace el sobrenadante con el medio ES sin alimentador sin el Y27632.
- Cuando las hiPSC alcancen el 80% de grado de confluencia, aspirar el sobrenadante de cultivo, lavar las células dos veces con solución salina tamponada con fosfato (PBS), añadir RPMI1640 + B27 libre de insulina que contenga 10 μM CHIR99021 (inhibidor de GSK3-β) y colocar las hiPSCs en una incubadora húmeda deCO2 a 37 °C durante 24 h.
- Reemplace la mitad del sobrenadante con RPMI1640 + B27 medio sin insulina e incube las células durante otras 24 h.
- Reemplace completamente el medio de cultivo con RPMI1640 + B27 (sin insulina). Colocar las placas en una incubadora húmeda a 37 °C con un 5% deCO2 en posición vertical durante 24 h.
- Reemplazar completamente el medio de cultivo después de 3 días con RPMI1640 + B27 + 5 μM IWR1 (inhibidor de la vía de señalización Wnt) libre de insulina y colocar las placas en una incubadora húmeda a 37 °C con 5% deCO2 durante 48 h.
- Sustituir el medio de cultivo después de 5 días por RPMI1640 + B27 sin insulina y continuar incubando durante 48 h en una incubadora húmeda deCO2 a 37 °C.
- Reemplace el medio de cultivo con el medio RPMI + B27 (incluida la insulina) después de 7 días y coloque las placas en una incubadora humidificada deCO2 durante 3 días a 37 °C. Reemplace el medio con el medio RPMI + B27 cada 3 días. Busque el latido espontáneo de las células a los 9-12 días de diferenciación.
- Después de observar las células pulsantes, reemplace el medio RPMI + B27 con un medio RPMI 1640 libre de glucosa que contenga ácido láctico (1 ml de ácido láctico agregado a 500 ml de medio RPMI 1640 libre de glucosa). Incubar las células durante 72 h en una incubadora húmeda a 37 °C con 5% deCO2.
- Después de 72 h, sustituir el sobrenadante por RPMI + B27 medio e incubar durante 48 h en una incubadora húmeda a 37 °C con 5% deCO2.
- Aspirar el sobrenadante de cultivo bajo presión negativa y lavar las células 3 veces con PBS para eliminar los restos del medio de cultivo. Utilice la mezcla de enzimas de desprendimiento celular para disociar los hiPSC-CM en células individuales a 37 °C. Recoger las células obtenidas en un tubo de centrífuga de 15 ml que contenga 3 ml de solución de soporte de cardiomiocitos, centrifugar a 300 × g durante 2 min a temperatura ambiente y desechar el sobrenadante.
- Resuspender las células con medio RPMI + B27, sembrarlas en placas de 6 pocillos recubiertas con matriz de membrana basal e incubarlas durante 48 h en una incubadora húmeda a 37 °C con 5% deCO2.
- Sustituir el sobrenadante de cultivo para purificación por un medio RPMI 1640 libre de glucosa que contenga ácido láctico e incubar durante 72 h en una incubadora húmeda a 37 °C con 5% deCO2.
- Reemplace el sobrenadante de cultivo con RPMI + medio B27 y cambie el medio cada 3 días.
- Continuar el proceso anterior durante 30 días, reemplazando el sobrenadante de cultivo con un medio libre de glucosa que contenga ácido láctico para su posterior purificación. Incubar las células durante 3 días con este medio y reemplazar el sobrenadante con RPMI + B27. Cultive las células continuamente durante 30 días hasta que los hiPSC-CM latan de manera estable, y use estas células para inyección intramiocárdica en ratones.
2. Preparación de hiPSC-CMs y establecimiento de modelo de infarto agudo de miocardio en ratón
- Aspirar al vacío el sobrenadante de cultivo de hiPSC-CMs cultivados durante 60 días, lavar las células 3 veces con PBS y disociar los hiPSC-CMs en células individuales a 37 °C con la mezcla de enzimas de desprendimiento celular (~3-5 min). Recoja las células en un tubo de centrífuga de 15 ml que contenga 5 ml de medio RPMI + B27 y mezcle bien antes de contar las células para calcular el número total de células. Centrifugar la suspensión celular a 300 × g durante 2 min a temperatura ambiente. Desechar el sobrenadante y añadir medio de soporte de cardiomiocitos para resuspender a una concentración de 0,6 × 105 células/μL.
- Mantener listo el tubo de centrífuga que contiene los hiPSC-CM resuspendidos a 37 °C para inyección 14,17,18,19,20.
- Coloque a los ratones en una caja de anestesia conectada con isoflurano para inducir la inhalación anestésica seguida del uso de ungüento veterinario en los ojos para evitar la sequedad mientras está bajo anestesia.
NOTA: La concentración de isoflurano fue del 5%. Preste atención a la ventilación del laboratorio durante el experimento. - Busque pérdida de reflejos en la región de los pies y la cola después de pellizcar cuando el mouse se coloca plano en la mesa de operaciones, lo que indica suficiente anestesia. Administrar buprenorfina (0,1 mg/kg) por vía intraperitoneal.
- Unte el pelo en la mitad del cuello y el pecho izquierdo de los ratones con una crema depilatoria, y limpie la crema aplicada y el cabello con una gasa después de 5 minutos.
- Fije las extremidades y la cola del ratón con cinta adhesiva. Fije los incisivos del ratón con un hilo de seda 2-0 y cinta adhesiva. Esterilice el área quirúrgica (cuello mediano y tórax izquierdo) con tres rondas alternas de betadine seguidas de alcohol.
- Coloque una cortina quirúrgica alrededor del área quirúrgica esterilizada. Luego, haga una incisión mediana en el cuello con tijeras anatómicas finas y pinzas de disección finas para exponer completamente la tráquea. Si es necesario, corte algunos músculos cervicales anteriores para estabilizarlos.
NOTA: Los operadores estaban cegados a los grupos de animales. - Inserte un tubo traqueal (aguja de punción con catéter de 20 G) a través de la boca.
- Conecte el tubo traqueal al ventilador y verifique el movimiento torácico para asegurarse de que ambos pulmones estén bien ventilados.
- Ajustar los parámetros respiratorios (frecuencia respiratoria: 100-150 lpm, volumen corriente 250-300 μL). Después de eso, vuelva a fijar la extremidad posterior izquierda al lado inferior derecho, afloje la cinta alrededor de la extremidad superior izquierda y realice una toracotomía en el espacio intercostal 3-4 del tórax izquierdo utilizando tijeras de disección fina y fórceps para una exposición cardíaca máxima.
- Usando fórceps, despegue el pericardio bajo un microscopio para visualizar la arteria coronaria descendente anterior izquierda (LAD) en el borde inferior del apéndice auricular izquierdo.
- Use un hilo de seda 6-0 para ligar el extremo proximal del LAD. Después de asegurarse de que el modelo de IM agudo está adecuadamente establecido (cuando la LAD distal en el sitio de ligadura cambia de rojo a blanco), cierre el pecho capa por capa y suture la piel con puntos intermitentes de 4-0 roscas. Realizar todos los procedimientos quirúrgicos mencionados anteriormente para la inducción de IM para el grupo simulado de animales, excepto para la ligadura.
- Apague la anestesia por inhalación, retire la cánula después de que el ratón reanude la respiración espontánea y devuélvala a su jaula. Vigile al animal hasta que haya recuperado la conciencia suficiente para mantener la decúbito esternal. No lo devuelva a la compañía de otros animales hasta que se haya recuperado por completo. Administrar inyecciones intraperitoneales de buprenorfina (0,1 mg/kg x 3 días) y carprofeno (5 mg/kg x 1 día) cada 12 h después de la operación.
- Inyectar ciclosporina A (10 mg·kg-1·día-1) en la cavidad intraperitoneal de ratones 3 días antes de administrar hiPSC-CMs para evitar el rechazo de las células trasplantadas. Inyecte ciclosporina A continuamente durante 1 mes después del trasplante.
3. Inyección de hiPSC-CM bajo guía ecográfica
- Después de configurar el modelo IM, asigne los ratones modelo MI (ratones C57BL / 6 de 12 semanas de edad; 22 g a 24 g de peso, 50% machos y 50% hembras) a grupos de dosis única (DE, n = 8 en este estudio) y dosis múltiples (DM, n = 8 en este estudio) en el primer día posterior al IM y colóquelos en la primera y segunda semana después del IM en una caja de anestesia conectada con isoflurano al 5% para la inducción de anestesia por inhalación seguida de Intubación traqueal.
- Unte el pelo en el pecho y la parte superior del abdomen de los ratones con crema depilatoria y limpie la crema con una gasa 5 minutos más tarde. Controle la frecuencia cardíaca del ratón en la placa de operaciones y administre isoflurano por inhalación hasta que la frecuencia cardíaca se mantenga en 400-500 lpm.
- Fije las extremidades y la cola del ratón con cinta adhesiva en la consola de detección y ajuste la temperatura de la plataforma a 37 °C.
- Aplique una jalea de ultrasonido especial en la parte superior del abdomen y use una sonda de ultrasonido veterinaria de alta resolución más pequeña para obtener imágenes del hígado del ratón.
- Disminuya la frecuencia del ventilador a 50 lpm. Utilice una microjeringa de 5 μL para extraer ~3 × 105 células (del paso 2.1). Sosteniendo la jeringa con un micromanipulador, inserte una aguja de 3 mm en el proceso paraxifoide izquierdo (Figura 1A). Siga el borde superior del diafragma bajo guía ecográfica (Figura 1B), observe el ritmo respiratorio y el rango (Figura 1C, D) y entre en el pericardio al final del ciclo espiratorio evitando daños en el hígado y el pulmón (Figura 1D).
- Después de que la aguja del microinyector ingrese a la cavidad pericárdica, ajuste la frecuencia respiratoria al parámetro original (150 lpm). Adquirir la imagen paraesternal de eje largo del corazón del ratón mediante ecocardiografía de molde M de acuerdo con las instrucciones del fabricante17 (Figura 1E). Bajo guía ultrasónica, inyecte 3 × 10 5 células (Figura 1F) en tres áreas marginales (1 × 105 células por sitio inyectado) del sitio del infarto.
- Retire la sonda de ultrasonido especial y enjuague la gelatina. Destete al ratón de la anestesia por inhalación y devuélvalo a su jaula después de la plena conciencia.
- Repita los procedimientos anteriores de inyección de células guiadas por ultrasonido 1 y 2 semanas después de establecer el IM para los ratones del grupo MD.
4. Evaluación de la función cardíaca, marcado de fluorescencia, recuento de células trasplantadas, área infartada de miocardio y detección de mitocondrias humanas de órganos en ratones 30 días después de la ligadura de la rama descendente anterior izquierda
- Evaluación de la función cardíaca
- Coloque el ratón en una caja de anestesia conectada con isoflurano para anestesia por inducción-inhalación seguida del uso de ungüento veterinario en los ojos para evitar la sequedad mientras está bajo anestesia. Retire el vello del pecho izquierdo del ratón con crema depilatoria. Coloque el ratón en el panel de control para controlar la frecuencia cardíaca y ajustar la inhalación de isoflurano. Mantenga la frecuencia cardíaca del ratón a 400-500 lpm. El criterio de valoración experimental es el día 30 (después de la inducción del IM).
- Fije las extremidades y la cola del ratón con cinta adhesiva en la consola de detección y ajuste la temperatura de la plataforma a 37 °C.
- Después de aplicar un gel especial de ultrasonido en el área anterior del corazón, use una sonda de ultrasonido cardíaco de alta resolución (veterinaria) para adquirir imágenes paraesternales de eje largo y bidimensionales de eje corto bajo ecocardiografía de molde M y molde B de acuerdo con las instrucciones del fabricante17.
- Una vez completada la detección ultrasónica, enjuague el gel ultrasónico especial, apague la anestesia por inhalación y devuelva el ratón a su jaula por separado después de la plena conciencia.
- Analizar los datos obtenidos y calcular la fracción de eyección del ventrículo izquierdo (FE) y el acortamiento fraccional (FS) utilizando el software de análisis. Asegúrese de que el operador esté cegado a los grupos experimentales17.
- Etiquetado fluorescente de secciones
- Lavar el corazón aislado con PBS, sumergirlo en paraformaldehído al 4% a 4 °C durante 12 h. Saca el corazón y sumérgelo en sacarosa al 30% durante 24 h para deshidratarte.
- Incruste el corazón deshidratado con el compuesto de temperatura de corte óptima (OCT) en hielo seco. Cortar el corazón desde la parte inferior hasta el ápice con un grosor de criostato de 10 μm y colocar las secciones en portaobjetos y almacenar los portaobjetos a -20 °C.
- Lave los portaobjetos con el tejido cardíaco con PBS durante 3 minutos.
- Permeabilizar el tejido en portaobjetos con Triton X-100 al 0,5% a temperatura ambiente durante 8 min y lavarlos 3 veces con PBS durante 5 min por lavado.
- Después de cubrir el tejido con suero de burro al 10% y PBS al 90% (solución de bloqueo), bloquee las secciones durante 1 h a temperatura ambiente.
- Después de retirar la solución bloqueante, incubar las secciones con el anticuerpo primario (diluido a 1:100 con la solución bloqueante) durante la noche a 4 °C. Lávelos 3 veces con PBS durante 5 minutos por lavado.
- Incubar el tejido en portaobjetos con anticuerpo secundario conjugado con fluoróforos (diluido a 1:100 con la solución de bloqueo) durante 1 h a temperatura ambiente.
NOTA: Evite exponer los tejidos con el anticuerpo secundario conjugado con fluoróforos a la luz a partir de este momento. - Lave las diapositivas 3 veces con PBS durante 5 minutos por lavado.
- Monte los portaobjetos utilizando un medio de montaje que contiene 4',6-diamidino-2-fenilindol (DAPI) y fotografíelos bajo un microscopio de fluorescencia17.
- Recuento de17 hiPSC-CMs trasplantados
- Realizar tinción de inmunofluorescencia tisular en secciones congeladas del corazón para detectar troponina T específica para peatones (hcTnT), antígeno nuclear humano (HNA) y alfa actinina sarcomérica inespecífica.
- Después de seccionar todo el corazón en serie, tome una sección por cada 50 secciones para el etiquetado de fluorescencia.
- Capture aleatoriamente cinco imágenes de gran aumento por sector. Cuente el número injertado de campos de visión, calcule el número promedio de células injertadas por unidad de área y configúrelos como A1/μm2. Calcule el área total injertada del sector utilizando ImageJ (https://imagej.nih.gov/ij/) y establézcalo como B1μm2 de modo que el número injertado en este sector = A1 × B121,22.
- Calcular el número total de células injertadas por corazón de ratón utilizando Eq (1) y la tasa porcentual de injerto utilizando Eq (2), dado que se eligió una sección de cada 50 secciones21,22.
- Número total de células injertadas por corazón de ratón = (A1 × B1 + A2 × B2 +...+ Un × Bn) × 50 (1)
Tasa de injerto =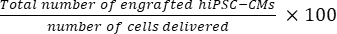 (2)
(2)
NOTA: El número de partos fue de 3 × 10 5 para el grupo SD y de 3 × 3 × 105 para el grupo DM.
- Evaluación del área infartada de miocardio
- Corte una sección transversal congelada (eje corto) del corazón aislado, desde el ápice hasta la base del corazón con un grosor de 10 μm.
- Después de seccionar en serie todo el corazón, tomar un portaobjetos de sección por cada 30 secciones y fijarlo en una solución de Bouin precalentada a 58 °C. Manchar la sección con tinciones de colágeno al 0,04% de Direct Red y 0,1% Fast Green (diluidas en PBS) según las instrucciones del fabricante17.
- Usar software (p. ej., ImageJ) para analizar las imágenes después de la fotografía transversal de cuerpo entero del corazón bajo un microscopio usando Eq (3):14,17
Área de infarto % =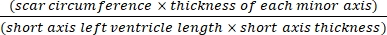 × 100% (3)
× 100% (3)
- Detección de ADN mitocondrial humano en diversos órganos
- Anestesiar a los ratones con isoflurano al 5% y sacrificarlos por luxación cervical posterior. Diseccionar los ratones 4 semanas después del trasplante de células. Extraer los órganos (hígado, pulmón, cerebro, riñón, bazo) y parte del miocardio (n = 3 en esta sección).
- Moler cada tejido de órgano en nitrógeno líquido y extraer ADN del tejido utilizando el kit de referencia (consulte la Tabla de materiales) de acuerdo con las instrucciones del fabricante.
- Siga las instrucciones del fabricante para utilizar el kit y los cebadores de referencia (consulte la Tabla de materiales) para detectar ADN mitocondrial humano en los tejidos mencionados anteriormente (a partir del paso 4.5.1).
Resultados
La ecocardiografía para la evaluación de la función ventricular izquierda de los ratones en cada grupo reveló que las lesiones de IM se revirtieron efectivamente en el grupo de DM (Figura 2A). En comparación con el grupo IM, el grupo SD mostró un aumento de la fracción de eyección (FE) (del 30% al 35%; Figura 2B) y acortamiento de fracciones (FS) (del 18% al 22%; Figura 2C) después de MI. Sin embargo, es aún más crucial t...
Discusión
Los pasos críticos de este estudio incluyen cultivo de hiPSC, diferenciación de cardiomiocitos, purificación de hiPSC-CM y trasplante de hiPSC-CM en el sitio de infarto de miocardio de ratón. La clave es usar ultrasonido cardíaco para guiar transcutáneamente el tratamiento hacia el sitio del infarto en el borde del infarto donde se inyectaron hiPSC-CM en el área.
Con la prolongación del tiempo de cultivo, el fenotipo hiPSC-CM cambia en morfología (mayor tamaño celular), estructura (m...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por el Plan de Investigación Principal de la Fundación Nacional de Ciencias Naturales de China (No. 91539111a JY), el Proyecto Clave de Ciencia y Tecnología de la Provincia de Hunan (No. 2020SK53420 a JY) y el Programa de Innovación Científica y Tecnológica de la Provincia de Hunan (2021RC2106 a CF).
Materiales
| Name | Company | Catalog Number | Comments |
| Antibody | |||
| Cardiac troponin T | Abcam | ab8295 | |
| Donkey Anti-Mouse IgG H&L (Alexa Fluor 488) | Abcam | ab150105 | |
| Donkey Anti-Mouse IgG H&L (Alexa Fluor 555) | Abcam | ab150110 | |
| Donkey Anti-Rabbit IgG H&L (Alexa Fluor 488) | Abcam | ab150073 | |
| Donkey Anti-Rabbit IgG H&L (Alexa Fluor 555) | Abcam | ab150062 | |
| Human cardiac troponin T | Abcam | ab91605 | |
| Isolectin B4 | Vector | FL-1201 | |
| Sarcomeric alpha actinin | Abcam | ab9465 | |
| Wheat germ agglutinin | Thermo Fisher Scientific | W11261 | |
| Reagent | |||
| Accutase | Thermo Fisher Scientific | 00-4555-56 | |
| B27 Supplement(minus insulin) | Thermo Fisher Scientific | A1895601 | |
| B27 Supplement(serum free) | Thermo Fisher Scientific | 17–504-044 | |
| Bouin's solution | Thermo Fisher Scientific | SDHT10132 | |
| CHIR99021 | Selleck | CT99021 | |
| cyclosporin A | Medchemexpress | HY-B0579 | |
| DIRECT RED | Sigma-Aldrich | 365548-25G | |
| DMEM/F12 | Thermo Fisher Scientific | 11320033 | |
| DNeasy Blood & Tissue Kit | Qiagen | 69504 | |
| FAST GREEN FCF | Sigma-Aldrich | F7252-5G | |
| Glucose-free RPMI 1640 | Thermo Fisher Scientific | 11879020 | |
| IWR1 | Selleck | S7086 | |
| lactic acid | Sigma-Aldrich | L6661 | |
| Matrigel | BD Biosciences | BD356234 | |
| mTeSR1 | Stem Cell Technologies | 72562 | |
| O.C.T. Compound | SAKURA | 4583 | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| PowerUP SYBR Green MasterMix kit | Thermo Fisher Scientific | A25742 | |
| RPMI1640 | Thermo Fisher Scientific | 11875119 | |
| STEMdif Cardiomyocyte Freezing Medium/STEMdiff | Stem Cell Technologies | 5030 | |
| STEMdiff Cardiomyocyte Support Medium | Stem Cell Technologies | 5027 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| ultrasound coupling agent | CARENT | 22396269389 | |
| Y-27632 | Selleck | S6390 | |
| Equipment and Supplies | |||
| Applied Biosystems | Thermo Fisher Scientific | 7500 Real-Time PCR | |
| cryostat | Leica | CM1950 | |
| fluoresence microscope | Olympus | IX83 | |
| fine anatomical scissors | Fine Science Tools | 15000-08 | |
| fine dissecting forceps | Fine Science Tools | 11255-20 | |
| Micro syringe | Hamilton | 7633 | |
| Small animal anesthesia machine | MATRX | VMR | |
| Ultra-high resolution small animal ultrasound imaging system | VisualSonics | Vevo 2100 | |
| Software | |||
| Statistical Product and Service Solutions | IBM | 21 | |
| Image J | NIH | 1.48 | |
| Human mitochondrial DNA primers | |||
| the forward primer sequence | CCGCTACCATAATCATCGCTAT | ||
| the reverse primer sequence | TGCTAATACAATGCCAGTCAGG |
Referencias
- Leuschner, F., et al. Rapid monocyte kinetics in acute myocardial infarction are sustained by extramedullary monocytopoiesis. The Journal of Experimental Medicine. 209 (1), 123-137 (2012).
- Lázár, E., et al. Cardiomyocyte renewal in the human heart: insights from the fall-out. European Heart Journal. 38 (30), 2333-2342 (2017).
- Davis, M. K., et al. State of the art: cardiac transplantation. Trends in Cardiovascular Medicine. 24 (8), 341-349 (2014).
- Mancini, D., Colombo, P. C. Left ventricular assist devices: A rapidly evolving alternative to transplant. Journal of the American College of Cardiology. 65 (23), 2542-2555 (2015).
- Zimmermann, W. H. Translating myocardial remuscularization. Circulation Research. 120 (2), 278-281 (2017).
- Hu, X., et al. A large-scale investigation of hypoxia-preconditioned allogeneic mesenchymal stem cells for myocardial repair in nonhuman primates: Paracrine activity without remuscularization. Circulation Research. 118 (6), 970-983 (2016).
- Kempf, H., et al. Cardiac differentiation of human pluripotent stem cells in scalable suspension culture. Nature Protocols. 10 (9), 1345-1361 (2015).
- Chong, J. J., et al. Human embryonic-stem-cell-derived cardiomyocytes regenerate non-human primate hearts. Nature. 510 (7504), 273-277 (2014).
- Shiba, Y., et al. Allogeneic transplantation of iPS cell-derived cardiomyocytes regenerates primate hearts. Nature. 538 (7625), 388-391 (2016).
- Nguyen, P. K., et al. Potential strategies to address the major clinical barriers facing stem cell regenerative therapy for cardiovascular disease: A review. JAMA Cardiology. 1 (8), 953-962 (2016).
- Zimmermann, W. H. Remuscularization of the failing heart. The Journal of Physiology. 595 (12), 3685-3690 (2017).
- Hu, X., et al. Transplantation of hypoxia-preconditioned mesenchymal stem cells improves infarcted heart function via enhanced survival of implanted cells and angiogenesis. The Journal of Thoracic and Cardiovascular Surgery. 135 (4), 799-808 (2008).
- Feng, Y., et al. Heat shock improves Sca-1+ stem cell survival and directs ischemic cardiomyocytes toward a prosurvival phenotype via exosomal transfer: a critical role for HSF1/miR-34a/HSP70 pathway. Stem Cells. 32 (2), 462-472 (2014).
- Fan, C., et al. Cardiomyocytes from CCND2-overexpressing human induced-pluripotent stem cells repopulate the myocardial scar in mice: A 6-month study. Journal of Molecular and Cellular Cardiology. 137, 25-33 (2019).
- Lou, X., et al. N-cadherin overexpression enhances the reparative potency of human-induced pluripotent stem cell-derived cardiac myocytes in infarcted mouse hearts. Cardiovascular Research. 116 (3), 671-685 (2020).
- Sun, X., et al. Transplanted microvessels improve pluripotent stem cell-derived cardiomyocyte engraftment and cardiac function after infarction in rats. Science Translational Medicine. 12 (562), (2020).
- Wu, X., et al. Cardiac repair with echocardiography-guided multiple percutaneous left ventricular intramyocardial injection of hiPSC-CMs after myocardial infarction. Frontiers in Cardiovascular Medicine. 8, 768873 (2021).
- Kannappan, R., et al. Functionally competent DNA damage-free induced pluripotent stem cell-derived cardiomyocytes for myocardial repair. Circulation. 140 (6), 520-522 (2019).
- Lou, X., et al. N-cadherin overexpression enhances the reparative potency of human-induced pluripotent stem cell-derived cardiac myocytes in infarcted mouse hearts. Cardiovascular Research. 116 (3), 671-685 (2020).
- Zhao, M., et al. Y-27632 preconditioning enhances transplantation of human-induced pluripotent stem cell-derived cardiomyocytes in myocardial infarction mice. Cardiovascular Research. 115 (2), 343-356 (2019).
- Zhao, M., et al. Enhancing the engraftment of human induced pluripotent stem cell-derived cardiomyocytes via a transient inhibition of rho kinase activity. Journal of Visualized Experiments: JoVE. (149), e59452 (2019).
- O'Brien, J., Hayder, H., Peng, C. Automated quantification and analysis of cell counting procedures using ImageJ plugins. Journal of Visualized Experiments: JoVE. (117), e54719 (2016).
- Kain, V., Prabhu, S. D., Halade, G. V. Inflammation revisited: inflammation versus resolution of inflammation following myocardial infarction. Basic Research in Cardiology. 109 (6), 444 (2014).
- Rainer, P. P., et al. Cardiomyocyte-specific transforming growth factor β suppression blocks neutrophil infiltration, augments multiple cytoprotective cascades, and reduces early mortality after myocardial infarction. Circulation Research. 114 (8), 1246-1257 (2014).
- Yu, Y., et al. Human embryonic stem cell-derived cardiomyocyte therapy in mouse permanent ischemia and ischemia-reperfusion models. Stem Cell Research & Therapy. 10 (1), 167 (2019).
- Iwanaga, K., et al. Effects of G-CSF on cardiac remodeling after acute myocardial infarction in swine. Biochemical and Biophysical Research Communications. 325 (4), 1353-1359 (2004).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados