JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
심근 경색 마우스에서 초음파 유도 유도 만능 줄기 세포 유래 심근 세포 이식
요약
생쥐의 심근 경색 부위 주변의 초음파 유도 세포 전달은 안전하고 효과적이며 편리한 세포 이식 방법입니다.
초록
심근경색(MI) 후 세포 치료의 주요 목적은 세포 이식률을 효과적으로 향상시키는 것이며, 인간 유도만능줄기세포 유래 심근세포(hiPSC-CM)는 허혈성 손상 후 심장 복구를 위한 유망한 세포 공급원입니다. 그러나 낮은 이식률은 이식 후 효과적인 심장 조직 재생에 중요한 장애물입니다. 이 프로토콜은 MI 영역에 여러 hiPSC-CM 초음파 유도 경피 주사가 세포 이식 속도를 효과적으로 증가시킨다는 것을 보여줍니다. 이 연구는 또한 전체 hiPSC-CM 배양 과정, 전처리 및 초음파 유도 경피적 전달 방법에 대해 설명합니다. 또한 인간 미토콘드리아 DNA를 사용하면 다른 마우스 기관에서 hiPSC-CM의 부재를 감지하는 데 도움이 됩니다. 마지막으로, 본 논문은 세포 전달 후 4주 동안 마우스의 경색된 경계 영역에서의 심장 기능, 혈관신생, 세포 크기 및 세포자멸사의 변화를 설명합니다. 좌심실 심근의 심 초음파 유도 경피 주사는 실현 가능하고 상대적으로 침습적이며 만족스럽고 반복 가능하며 효과적인 세포 요법이라고 결론 지을 수 있습니다.
서문
급성 MI가 발생하면 경색 부위의 심근 세포가 허혈과 저산소증으로 인해 빠르게 죽습니다. 세포 사멸 및 파열 후 여러 염증 인자가 방출되는 반면, 염증 세포는 경색 부위에 침투하여 염증을 유발합니다1. 의미심장하게도, 수축성과 전기 전도성이 없는 섬유아세포와 콜라겐은 경색 부위의 심근 세포를 대체하여 흉터 조직을 형성합니다. 성인 포유류에서 심근 세포의 제한된 재생 능력으로 인해, 넓은 면적의 경색 후에 형성되는 생존 조직은 일반적으로 충분한 심박출량을 유지하기에 적합하지 않다2. 심근경색은 심부전을 일으키며, 심한 심부전의 경우 환자는 정상적인 심장 기능을 유지하기 위해 심장 이식 또는 심실 보조 장치에만 의존할 수 있습니다 3,4.
MI 후 이상적인 치료 전략은 죽은 심근 세포를 새로 형성된 심근 세포로 대체하여 건강한 조직과 전기 기계적 결합을 형성하는 것입니다. 그러나 치료 옵션은 일반적으로 교체보다는 심근 구제를 채택했습니다. 현재, 줄기 세포 및 전구 세포 기반 요법은 MI5 후 심근 복구를 촉진하는 가장 유망한 전략 중 하나입니다. 그러나, 이들 세포의 이식은 몇 가지 문제를 가지고 있는데, 주로 성체 줄기세포가 심근 세포로 분화할 수 없고 수명이 짧다는 점이 있다6.
배아 줄기 세포(ES) 세포의 사용과 관련된 윤리적 문제는 유망한 세포 공급원인 iPSC에 의해 우회될 수 있습니다. 또한, iPSC는 강력한 자가 재생 능력을 가지고 있으며 심근 세포로 분화할 수 있다7. 연구에 따르면 MI 부위에 이식된 hiPSC-CM은 생존할 수 있고 숙주 세포와 갭 접합을 형성할 수 있습니다 8,9. 그러나, 이러한 이식된 세포는 허혈 및 염증의 미세환경에 위치하기 때문에, 이들의 생존율은 극히 낮다10,11.
이식된 세포의 생존율을 향상시키기 위해 저산소증과 열충격 전처리(12,13), 유전자 변형(gene modification)14,15, 세포와 모세혈관의 동시 이식(16) 등 여러 가지 방법이 확립되었다. 불행히도 대부분의 방법은 복잡성과 높은 비용으로 인해 제한됩니다. 따라서, 본 연구에서는 재현 가능하고 편리하며 비교적 침습적이며 효과적인 hiPSC-CM 전달 방법을 제안한다.
초음파 유도 심근 내 세포 주입은 부위에 관계없이 고해상도 소형 수의학 초음파 기계와 미세 주입기만으로 수행 할 수 있습니다. 초음파 유도에 따라 심낭에서 생쥐의 심근으로 검상돌기 과정에 따라 세포를 직접 전달하는 것은 간 및 폐 손상을 방지하는 안전한 프로토콜입니다. 이 방법은 이식 된 세포의 생존율을 크게 향상시키기 위해 다른 기술과 동시에 결합 될 수 있습니다.
프로토콜
본 연구의 모든 동물실험은 중남대학교 제2샹야병원 윤리위원회의 검토 및 승인을 받았다. 이 프로토콜에 사용된 모든 재료 및 장비에 대한 자세한 내용은 재료 표를 참조하십시오. 세포 주입, 영상화 및 안락사에 대한 타임라인은 다음과 같다: t0-유도 경색, t1주-영상 및 이식 세포, t2-영상 및 이식 세포, t4-최종 영상화, 안락사 및 조직 수집.
1. hiPSC 배양, 심근세포 분화 및 세포 정제
- DMEM/F12 및 기저막 매트릭스 원액을 4°C에서 얼음과 1.5:1의 비율로 혼합하고 분취액을 추출하고 생성된 혼합물(매트릭스 희석제)을 -20°C에서 보관합니다. 4°C에서 DMEM/F12 배양액 25mL와 매트릭스 희석제 1mL를 얼음으로 완전히 혼합하고 6웰 플레이트에 1mL/웰을 뿌립니다. 플레이트를 37°C의 인큐베이터에서 1시간 동안 똑바로 세우고 웰에서 DMEM/F12 상층액을 흡인합니다. 절차를 수행 할 때 6 웰 플레이트의 바닥을 만지지 마십시오.
- 액체 질소에서 hiPSC가 들어 있는 동결 보존 튜브를 제거하고 37°C 수조에서 빠르게 해동합니다. 냉동 보존 튜브의 외부 표면을 75% 알코올로 소독하고 알코올을 닦아내고 튜브를 멸균 초청정 테이블로 옮깁니다.
- 피펫을 사용하여 hiPSC가 포함된 동결 보존 용액을 15mL 원심분리기 튜브에 부드럽게 옮기고 5mL의 피더가 없는 ES 배지를 추가하고 실온에서 3분 동안 300× g 에서 현탁액을 원심분리합니다. 상층액을 버리고 6mL의 피더가 없는 ES 배지에 세포를 부드럽게 재현탁합니다. 세포 수를 세고 배양 배지를 사용하여 세포 농도를 5 × 105 cells/mL로 조정합니다.
- ROCK 억제제(Y27632)를 hiPSC에 5μM의 최종 농도로 추가합니다. Y27632가 있는 hiPSC를 기저막 매트릭스로 전처리된 6웰 플레이트로 옮기고 6웰 플레이트를 부드럽게 소용돌이치며 숫자 "8"의 모양을 추적하여 hiPSC를 고르게 분포시킵니다. hiPSC를 5%CO2 가 있는 37°C의 습한 인큐베이터에 24시간 동안 직립 자세로 놓습니다. 상층액을 Y27632가 없는 피더가 없는 ES 배지로 교체하십시오.
- hiPSC가 80% 합류도에 도달하면 배양 상청액을 흡인하고, 세포를 인산염 완충 식염수(PBS)로 두 번 세척하고, 10μM CHIR99021(GSK3-β 억제제)을 포함하는 인슐린이 없는 RPMI1640 + B27을 추가하고, hiPSC를 37°C의 습한CO2 인큐베이터에 24시간 동안 넣습니다.
- 상청액의 절반을 인슐린이 없는 RPMI1640 + B27 배지로 교체하고 세포를 24시간 더 배양합니다.
- 배양 배지를 RPMI1640 + B27 (인슐린 제외)로 완전히 교체하십시오. 플레이트를 5%CO2 와 함께 37°C의 습한 인큐베이터에 24시간 동안 직립 위치에 놓습니다.
- 3일 후 배양액을 인슐린이 없는 RPMI1640+B27+5 μM IWR1(Wnt 신호전달 경로 억제제)로 완전히 교체하고 플레이트를 48시간 동안 5%CO2 로 37°C의 습한 인큐베이터에 넣었다.
- 5일 후 배양액을 인슐린 없는 RPMI1640+B27로 교체하고 37°C의 습한CO2 인큐베이터에서 48시간 동안 계속 인큐베이션하였다.
- 7일 후 배양 배지를 RPMI + B27(인슐린 포함) 배지로 교체하고, 플레이트를 37°C에서 3일 동안 가습된CO2 배양기에 넣었다. 3일마다 배지를 RPMI + B27 배지로 교체하십시오. 분화 9-12 일에 세포의 자발적인 박동을 찾으십시오.
- 맥동하는 세포를 관찰한 후, RPMI + B27 배지를 젖산을 함유하는 무혈당 RPMI 1640 배지(500mL의 포도당이 없는 RPMI 1640 배지에 1mL의 젖산을 첨가함)로 교체한다. 세포를 5% CO2와 함께 37°C의 습한 인큐베이터에서72시간 동안 인큐베이션한다.
- 72시간 후, 상청액을 RPMI+B27 배지로 교체하고, 5%CO2를 갖는 37°C의 습한 인큐베이터에서 48시간 동안 인큐베이션한다.
- 배양 상청액을 음압 하에서 흡인하고 PBS로 세포를 3x 세척하여 배양 배지의 흔적을 제거합니다. 세포 분리 효소 혼합물을 사용하여 37°C에서 hiPSC-CM을 개별 세포로 해리합니다. 수득한 세포를 3mL의 심근세포 지지체용액이 들어 있는 15mL 원심분리 튜브에 모으고, 실온에서 2분 동안 300× g 에서 원심분리하고, 상층액을 버린다.
- 세포를 RPMI+ B27 배지로 재현탁시키고, 이들을 기저막 매트릭스-코팅된 6-웰 플레이트 상에 시딩하고, 이들을 5%CO2로 37°C의 습한 인큐베이터에서 48시간 동안 인큐베이션하였다.
- 정제를 위해 배양 상청액을 락트산을 함유하는 무혈당 RPMI 1640 배지로 교체하고, 5% CO2로 37°C의 습한 인큐베이터에서72시간 동안 인큐베이션한다.
- 배양 상청액을 RPMI + B27 배지로 교체하고 3일마다 배지를 교체합니다.
- 30일 동안 상기 과정을 계속하고, 추가 정제를 위해 배양 상청액을 젖산을 함유하는 무포도당 배지로 교체한다. 이 배지로 세포를 3일 동안 인큐베이션하고 상층액을 RPMI + B27로 교체합니다. hiPSC-CMs가 안정적으로 박동할 때까지 30일 동안 세포를 연속적으로 배양하고, 이들 세포를 마우스의 심근내 주사에 사용하였다.
2. hiPSC-CM의 준비 및 마우스 급성심근경색 모델의 확립
- 60일 동안 배양된 hiPSC-CM에서 배양 상층액을 진공 흡인하고, PBS로 세포를 3배 세척하고, 세포 분리 효소 혼합물(~3-5분)을 사용하여 37°C에서 hiPSC-CM을 개별 세포로 해리합니다. 5mL의 RPMI + B27 배지가 들어 있는 15mL 원심분리기 튜브에 세포를 수집하고 잘 혼합한 후 세포를 계수하여 총 세포 수를 계산합니다. 세포 현탁액을 실온에서 2분 동안 300× g 에서 원심분리합니다. 상층액을 버리고 심근 세포 지지 배지를 추가하여 0.6 × 105 cells/μL의 농도로 재현탁합니다.
- 재현탁된 hiPSC-CM이 들어 있는 원심분리기 튜브를 37°C에서 주입 14,17,18,19,20을 위해 준비합니다.
- 이소플루란과 연결된 마취 상자에 마우스를 넣어 마취 흡입을 유도한 다음 마취 상태에서 건조를 방지하기 위해 눈에 수의사 연고를 사용합니다.
참고: 이소플루란 농도는 5%였습니다. 실험 중 실험실 환기에주의하십시오. - 마우스를 수술대에 평평하게 눕힐 때 꼬집은 후 발과 꼬리 부위의 반사 상실을 확인하여 충분한 마취를 나타냅니다. 부프레노르핀(0.1 mg/kg)을 복강 내 투여한다.
- 목 중앙과 생쥐의 왼쪽 가슴에 털을 제모 크림으로 바르고 5 분 후에 거즈로 크림과 머리카락을 닦아냅니다.
- 팔다리와 마우스 꼬리를 테이프로 고정하십시오. 마우스 앞니를 2-0 실크 실과 테이프로 고정하십시오. 수술 부위(목과 왼쪽 가슴 중앙)를 베타딘을 세 번 번갈아 가며 소독한 후 알코올을 주입합니다.
- 멸균된 수술 부위 주위에 수술용 드레이프를 놓습니다. 그런 다음 미세한 해부학적 가위와 미세 해부 집게를 사용하여 중앙 목 절개를 하여 기관을 완전히 노출시킵니다. 필요한 경우 안정화를 위해 몇 개의 전방 자궁 경부 근육을 잘라냅니다.
참고: 운영자는 동물 그룹에 대해 눈이 멀었습니다. - 기관 튜브(20G 카테터 천자 바늘)를 입에 삽입합니다.
- 기관 튜브를 인공 호흡기에 연결하고 흉부 움직임을 확인하여 양쪽 폐가 잘 환기되는지 확인하십시오.
- 호흡 매개변수를 조정합니다(호흡수: 100-150bpm, 일회 호흡량 250-300μL). 그런 다음 왼쪽 뒷다리를 오른쪽 하단으로 다시 고정하고 왼쪽 상지 주위의 테이프를 풀고 미세 해부 가위와 집게를 사용하여 왼쪽 흉부의 3-4 늑간 공간에서 개흉술을 수행하여 심장 노출을 극대화합니다.
- 겸자를 사용하여 현미경으로 심낭을 떼어내어 왼쪽 심방 부속기의 아래쪽 가장자리에 있는 왼쪽 전방 하행 관상 동맥(LAD)을 시각화합니다.
- 6-0 실크 실을 사용하여 LAD의 근위 끝을 결찰합니다. 급성 MI 모델이 적절하게 확립되었는지 확인한 후(결찰 부위의 원위 LAD가 빨간색에서 흰색으로 변할 때) 흉부를 층별로 닫고 4-0 나사산 간헐적 바늘로 피부를 봉합합니다. 결찰을 제외한 가짜 동물 그룹에 대한 MI 유도를 위해 상기 언급된 모든 외과적 절차를 수행한다.
- 흡입 마취를 끄고 마우스가 자발적인 호흡을 재개 한 후 캐뉼라를 제거하고 케이지로 되돌립니다. 흉골 누운 자세를 유지하기에 충분한 의식을 회복 할 때까지 동물을 모니터링하십시오. 완전히 회복 될 때까지 다른 동물의 회사에 반환하지 마십시오. 수술 후 12시간마다 부프레노르핀(0.1mg/kg x 3일)과 카르프로펜(5mg/kg x 1일)을 복강주사한다.
- 이식된 세포의 거부반응을 방지하기 위해 hiPSC-CM을 투여하기 3일 전에 사이클로스포린 A(10mg·kg-1·day-1)를 생쥐의 복강내로 주사한다. 사이클로스포린 A를 이식 후 1개월 동안 지속적으로 주사한다.
3. 초음파 유도하에 hiPSC-CM 주입
- MI 모델을 설정한 후 MI 모델 마우스(12주령 C57BL/6 마우스; 체중 22g에서 24g, 수컷 50%, 암컷 50%)를 단일 용량(SD, 본 연구에서는 n = 8) 및 다중 용량(MD, n = 8 이 연구에서) MI 후 첫 번째 날에 흡입 마취 유도를 위해 5% 이소플루란과 연결된 마취 상자에 넣고 MI 후 첫 번째 및 두 번째 주에 기관 삽관.
- 생쥐의 가슴과 상복부에 털을 제모 크림으로 바르고 5 분 후에 거즈로 크림을 닦아냅니다. 수술 보드에서 마우스의 심박수를 모니터링하고 심박수가 400-500bpm으로 유지될 때까지 흡입 이소플루란을 투여합니다.
- 감지 콘솔에 테이프로 마우스 팔다리와 꼬리를 고정하고 플랫폼 온도를 37°C로 설정합니다.
- 상복부에 특수 초음파 젤리를 바르고 더 작은 고해상도 수의학 초음파 프로브를 사용하여 마우스 간 이미지를 얻습니다.
- 인공호흡기 속도를 50bpm으로 낮춥니다. 5μL 미세 주사기를 사용하여 ~3 × 105개의 세포를 그립니다(2.1단계에서). 미세 매니퓰레이터로 주사기를 잡고 왼쪽 para-xiphoid process에 3mm 바늘을 삽입합니다 (그림 1A). 초음파 유도 하에서 횡격막의 위쪽 가장자리를 따라가고(그림 1B), 호흡 리듬과 범위를 관찰하고(그림 1C, D), 호기 주기가 끝날 때 심낭으로 들어가 간과 폐의 손상을 방지합니다(그림 1D).
- 미세 주사기 바늘이 심낭강에 들어간 후 호흡수를 원래 매개변수(150bpm)로 조정합니다. 제조사의 지시에 따라 M-몰드 심초음파로 마우스 심장의 흉골주위 장축 이미지를 획득한다(도17)(도 1E). 초음파 유도하에 경색 부위의 3 개의 가장자리 영역 (주입 부위 당 1 × 105 세포)에 3 ×10 5 세포 (그림 1F)를 주입합니다.
- 특수 초음파 프로브를 제거하고 젤리를 헹굽니다. 마우스를 흡입 마취에서 떼어내고 의식이 완전히 끝나면 케이지로 되돌립니다.
- MD 그룹 마우스에 대해 MI를 확립한 후 1주 및 2주 후에 위의 초음파 유도 세포 주입 절차를 반복합니다.
4. 좌전하행 분지 결찰 후 30일 후 마우스에서 심장 기능, 형광 표지, 이식된 세포 수, 심근 경색 부위 및 장기 인간 미토콘드리아 검출 평가
- 심장 기능 평가
- 유도 흡입 마취를 위해 이소플루란 연결 마취 상자에 마우스를 넣은 다음 마취 상태에서 건조를 방지하기 위해 눈에 수의사 연고를 사용합니다. 탈모 크림으로 마우스의 왼쪽 가슴에있는 머리카락을 제거하십시오. 조작 패널에 마우스를 올려 놓고 심박수를 모니터링하고 이소플루란 흡입을 조정합니다. 마우스 심박수를 400-500bpm으로 유지하십시오. 실험 종점은 30일째(MI 유도 후)입니다.
- 감지 콘솔에 테이프로 마우스 팔다리와 꼬리를 고정하고 플랫폼 온도를 37°C로 설정합니다.
- 전방 심장 부위에 특수 초음파 젤을 적용한 후, (수의학) 고해상도 심장 초음파 프로브를 사용하여 제조업체의 지침에 따라 M- 몰드 및 B- 몰드의 심 초음파 하에서 흉골 주위 장축 및 2 차원 단축 이미지를 획득한다17.
- 초음파 감지가 완료되면 특수 초음파 젤을 헹구고 흡입 마취를 끄고 완전히 의식을 얻은 후 마우스를 케이지로 되돌립니다.
- 얻은 데이터를 분석하고 분석 소프트웨어를 사용하여 좌심실 박출률(EF) 및 부분 단축(FS)을 계산합니다. 작업자가 실험 그룹17에 대해 눈이 멀었는지 확인하십시오.
- 섹션의 형광 라벨링
- 분리된 심장을 PBS로 세척하고, 4°C에서 12시간 동안 4% 파라포름알데히드에 담근다. 심장을 꺼내 30% 자당에 24시간 동안 담가 탈수시킵니다.
- 드라이아이스에 최적 절단 온도(OCT) 화합물로 탈수된 심장을 삽입합니다. 10μm의 저온 유지 장치 두께로 심장을 바닥에서 정점까지 슬라이스하고 절편을 슬라이드에 놓고 슬라이드를 -20°C에서 보관합니다.
- 슬라이드를 PBS로 심장 조직으로 3분 동안 세척합니다.
- 실온에서 0.5% Triton X-100으로 슬라이드의 조직을 8분 동안 투과시키고 세척당 5분 동안 PBS로 3회 세척합니다.
- 조직을 10% 당나귀 혈청과 90% PBS(블로킹 용액)로 덮은 후 실온에서 1시간 동안 절편을 차단합니다.
- 블로킹 용액을 제거한 후, 4°C에서 밤새 1차 항체(블로킹 용액과 함께 1:100으로 희석됨)와 함께 절편을 인큐베이션한다. 세척당 3분 동안 PBS로 5회 세척합니다.
- 형광단 접합 2차 항체(블로킹 용액으로 1:100으로 희석)를 사용하여 실온에서 1시간 동안 슬라이드에서 조직을 배양합니다.
참고: 이 시점부터 형광단 결합 2차 항체가 있는 조직을 빛에 노출시키지 마십시오. - 슬라이드를 PBS로 세척당 5분 동안 3회 세척합니다.
- 4',6-디아미디노-2-페닐인돌(DAPI) 함유 마운팅 매질을 사용하여 슬라이드를 장착하고 형광 현미경(17)으로 사진을 찍습니다.
- 이식된 hiPSC-CM 수17
- 보행자 특이적 트로포닌 T(hcTnT), 인간 핵 항원(HNA) 및 비특이적 육종 알파 액티닌에 대해 심장의 동결 절편에서 조직 면역형광 염색을 수행합니다.
- 심장 전체를 연속적으로 절편한 후 형광 표지를 위해 50개 섹션마다 한 섹션을 채취합니다.
- 슬라이스당 5개의 고배율 이미지를 무작위로 캡처합니다. 접목된 시야 수를 세고, 단위 면적당 접목된 평균 세포 수를 계산하고, 이를 A1/μm2로 설정합니다. ImageJ(https://imagej.nih.gov/ij/)를 사용하여 슬라이스의 총 접목 면적을 계산하고 이 슬라이스의 접목 번호 = A1 × B1 21,22가 되도록 B1μm 2로 설정합니다.
- 매 50개의 섹션으로부터 하나의 섹션이 선택되었다는 점을 감안할 때, Eq(1)를 사용하여 마우스 심장당 이식된 세포의 총 수를 계산하고, Eq(2)를 사용하여 생착률백분율을 계산한다.
- 마우스 심장당 이식된 총 세포 수 = (A1 × B1 + A2 × B2 +...+ An × Bn) × 50 (1)
생착률 =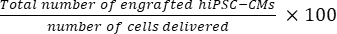 (2)
(2)
참고: 분만 횟수는 SD 그룹의 경우 3 × 10 5, MD 그룹의 경우 3 × 3 × 105였습니다.
- 심근 경색 부위 평가
- 10 μm의 두께로 심장의 정점에서 심장의 기저부까지 격리 된 심장의 단면 동결 부분 (짧은 축)을 자릅니다.
- 심장 전체를 연속적으로 절편한 후 30개 절편마다 하나의 단면 슬라이드를 가져와 58°C에서 예열된 Bouin 용액에 고정합니다. 제조업체의 지침에 따라 0.04% Direct Red 및 0.1% Fast Green 콜라겐 얼룩(PBS로 희석)으로 섹션을 얼룩지게 합니다17.
- 소프트웨어(예: ImageJ)를 사용하여 Eq(3):14,17을 사용하여 현미경으로 심장의 전신 단면 사진을 촬영한 후 이미지를 분석합니다.
경색 면적 % =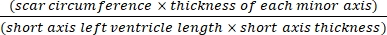 × 100% (3)
× 100% (3)
- 다양한 장기에서 인간 미토콘드리아 DNA 검출
- 5 % 이소 플루 란으로 마우스를 마취시키고 후방 자궁 경부 탈구로 희생하십시오. 세포 이식 4주 후에 마우스를 해부한다. 장기 (간, 폐, 뇌, 신장, 비장)와 심근의 일부 (이 섹션에서 n = 3)를 수확하십시오.
- 각 장기 조직을 액체 질소로 분쇄하고 제조업체의 지침에 따라 참조 키트( 재료 표 참조)를 사용하여 조직에서 DNA를 추출합니다.
- 제조업체의 지침에 따라 참조 된 키트와 프라이머 ( 재료 표 참조)를 사용하여 위에서 언급 한 조직에서 인간 미토콘드리아 DNA를 검출합니다 (4.5.1 단계에서).
결과
각 그룹에서 마우스의 좌심실 기능을 평가하기 위한 심초음파는 MI 손상이 MD 그룹에서 효과적으로 역전되었음을 보여주었습니다(그림 2A). MI 그룹과 비교하여 SD 그룹은 박출률(EF)이 증가한 것으로 나타났습니다(30%에서 35%로; 그림 2B) 및 분획 단축 (FS) (18 %에서 22 %까지; 그림 2C) MI 후. 그러나 MD 그룹 마우스에서 hiPSC-CM을 여러 번 주...
토론
이 연구의 중요한 단계에는 hiPSC 배양, 심근 세포 분화, hiPSC-CM 정제 및 마우스 심근 경색 부위로의 hiPSC-CM 이식이 포함됩니다. 핵심은 심장 초음파를 사용하여 hiPSC-CM이 해당 부위에 주입된 경색 가장자리의 경색 부위로 경피적으로 치료를 안내하는 것입니다.
배양 시간이 길어짐에 따라 hiPSC-CM 표현형은 시간이 지남에 따라 분화에 따라 형태(더 큰 세포 크기), 구조(근육, 섬유?...
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 연구는 중국 국립 자연 과학 재단의 주요 연구 계획 (No. 91539111to JY), 후난 성 과학 기술 핵심 프로젝트 (No. 2020SK53420-JY) 및 후난 성 과학 기술 혁신 프로그램 (2021RC2106-CF)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Antibody | |||
| Cardiac troponin T | Abcam | ab8295 | |
| Donkey Anti-Mouse IgG H&L (Alexa Fluor 488) | Abcam | ab150105 | |
| Donkey Anti-Mouse IgG H&L (Alexa Fluor 555) | Abcam | ab150110 | |
| Donkey Anti-Rabbit IgG H&L (Alexa Fluor 488) | Abcam | ab150073 | |
| Donkey Anti-Rabbit IgG H&L (Alexa Fluor 555) | Abcam | ab150062 | |
| Human cardiac troponin T | Abcam | ab91605 | |
| Isolectin B4 | Vector | FL-1201 | |
| Sarcomeric alpha actinin | Abcam | ab9465 | |
| Wheat germ agglutinin | Thermo Fisher Scientific | W11261 | |
| Reagent | |||
| Accutase | Thermo Fisher Scientific | 00-4555-56 | |
| B27 Supplement(minus insulin) | Thermo Fisher Scientific | A1895601 | |
| B27 Supplement(serum free) | Thermo Fisher Scientific | 17–504-044 | |
| Bouin's solution | Thermo Fisher Scientific | SDHT10132 | |
| CHIR99021 | Selleck | CT99021 | |
| cyclosporin A | Medchemexpress | HY-B0579 | |
| DIRECT RED | Sigma-Aldrich | 365548-25G | |
| DMEM/F12 | Thermo Fisher Scientific | 11320033 | |
| DNeasy Blood & Tissue Kit | Qiagen | 69504 | |
| FAST GREEN FCF | Sigma-Aldrich | F7252-5G | |
| Glucose-free RPMI 1640 | Thermo Fisher Scientific | 11879020 | |
| IWR1 | Selleck | S7086 | |
| lactic acid | Sigma-Aldrich | L6661 | |
| Matrigel | BD Biosciences | BD356234 | |
| mTeSR1 | Stem Cell Technologies | 72562 | |
| O.C.T. Compound | SAKURA | 4583 | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| PowerUP SYBR Green MasterMix kit | Thermo Fisher Scientific | A25742 | |
| RPMI1640 | Thermo Fisher Scientific | 11875119 | |
| STEMdif Cardiomyocyte Freezing Medium/STEMdiff | Stem Cell Technologies | 5030 | |
| STEMdiff Cardiomyocyte Support Medium | Stem Cell Technologies | 5027 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| ultrasound coupling agent | CARENT | 22396269389 | |
| Y-27632 | Selleck | S6390 | |
| Equipment and Supplies | |||
| Applied Biosystems | Thermo Fisher Scientific | 7500 Real-Time PCR | |
| cryostat | Leica | CM1950 | |
| fluoresence microscope | Olympus | IX83 | |
| fine anatomical scissors | Fine Science Tools | 15000-08 | |
| fine dissecting forceps | Fine Science Tools | 11255-20 | |
| Micro syringe | Hamilton | 7633 | |
| Small animal anesthesia machine | MATRX | VMR | |
| Ultra-high resolution small animal ultrasound imaging system | VisualSonics | Vevo 2100 | |
| Software | |||
| Statistical Product and Service Solutions | IBM | 21 | |
| Image J | NIH | 1.48 | |
| Human mitochondrial DNA primers | |||
| the forward primer sequence | CCGCTACCATAATCATCGCTAT | ||
| the reverse primer sequence | TGCTAATACAATGCCAGTCAGG |
참고문헌
- Leuschner, F., et al. Rapid monocyte kinetics in acute myocardial infarction are sustained by extramedullary monocytopoiesis. The Journal of Experimental Medicine. 209 (1), 123-137 (2012).
- Lázár, E., et al. Cardiomyocyte renewal in the human heart: insights from the fall-out. European Heart Journal. 38 (30), 2333-2342 (2017).
- Davis, M. K., et al. State of the art: cardiac transplantation. Trends in Cardiovascular Medicine. 24 (8), 341-349 (2014).
- Mancini, D., Colombo, P. C. Left ventricular assist devices: A rapidly evolving alternative to transplant. Journal of the American College of Cardiology. 65 (23), 2542-2555 (2015).
- Zimmermann, W. H. Translating myocardial remuscularization. Circulation Research. 120 (2), 278-281 (2017).
- Hu, X., et al. A large-scale investigation of hypoxia-preconditioned allogeneic mesenchymal stem cells for myocardial repair in nonhuman primates: Paracrine activity without remuscularization. Circulation Research. 118 (6), 970-983 (2016).
- Kempf, H., et al. Cardiac differentiation of human pluripotent stem cells in scalable suspension culture. Nature Protocols. 10 (9), 1345-1361 (2015).
- Chong, J. J., et al. Human embryonic-stem-cell-derived cardiomyocytes regenerate non-human primate hearts. Nature. 510 (7504), 273-277 (2014).
- Shiba, Y., et al. Allogeneic transplantation of iPS cell-derived cardiomyocytes regenerates primate hearts. Nature. 538 (7625), 388-391 (2016).
- Nguyen, P. K., et al. Potential strategies to address the major clinical barriers facing stem cell regenerative therapy for cardiovascular disease: A review. JAMA Cardiology. 1 (8), 953-962 (2016).
- Zimmermann, W. H. Remuscularization of the failing heart. The Journal of Physiology. 595 (12), 3685-3690 (2017).
- Hu, X., et al. Transplantation of hypoxia-preconditioned mesenchymal stem cells improves infarcted heart function via enhanced survival of implanted cells and angiogenesis. The Journal of Thoracic and Cardiovascular Surgery. 135 (4), 799-808 (2008).
- Feng, Y., et al. Heat shock improves Sca-1+ stem cell survival and directs ischemic cardiomyocytes toward a prosurvival phenotype via exosomal transfer: a critical role for HSF1/miR-34a/HSP70 pathway. Stem Cells. 32 (2), 462-472 (2014).
- Fan, C., et al. Cardiomyocytes from CCND2-overexpressing human induced-pluripotent stem cells repopulate the myocardial scar in mice: A 6-month study. Journal of Molecular and Cellular Cardiology. 137, 25-33 (2019).
- Lou, X., et al. N-cadherin overexpression enhances the reparative potency of human-induced pluripotent stem cell-derived cardiac myocytes in infarcted mouse hearts. Cardiovascular Research. 116 (3), 671-685 (2020).
- Sun, X., et al. Transplanted microvessels improve pluripotent stem cell-derived cardiomyocyte engraftment and cardiac function after infarction in rats. Science Translational Medicine. 12 (562), (2020).
- Wu, X., et al. Cardiac repair with echocardiography-guided multiple percutaneous left ventricular intramyocardial injection of hiPSC-CMs after myocardial infarction. Frontiers in Cardiovascular Medicine. 8, 768873 (2021).
- Kannappan, R., et al. Functionally competent DNA damage-free induced pluripotent stem cell-derived cardiomyocytes for myocardial repair. Circulation. 140 (6), 520-522 (2019).
- Lou, X., et al. N-cadherin overexpression enhances the reparative potency of human-induced pluripotent stem cell-derived cardiac myocytes in infarcted mouse hearts. Cardiovascular Research. 116 (3), 671-685 (2020).
- Zhao, M., et al. Y-27632 preconditioning enhances transplantation of human-induced pluripotent stem cell-derived cardiomyocytes in myocardial infarction mice. Cardiovascular Research. 115 (2), 343-356 (2019).
- Zhao, M., et al. Enhancing the engraftment of human induced pluripotent stem cell-derived cardiomyocytes via a transient inhibition of rho kinase activity. Journal of Visualized Experiments: JoVE. (149), e59452 (2019).
- O'Brien, J., Hayder, H., Peng, C. Automated quantification and analysis of cell counting procedures using ImageJ plugins. Journal of Visualized Experiments: JoVE. (117), e54719 (2016).
- Kain, V., Prabhu, S. D., Halade, G. V. Inflammation revisited: inflammation versus resolution of inflammation following myocardial infarction. Basic Research in Cardiology. 109 (6), 444 (2014).
- Rainer, P. P., et al. Cardiomyocyte-specific transforming growth factor β suppression blocks neutrophil infiltration, augments multiple cytoprotective cascades, and reduces early mortality after myocardial infarction. Circulation Research. 114 (8), 1246-1257 (2014).
- Yu, Y., et al. Human embryonic stem cell-derived cardiomyocyte therapy in mouse permanent ischemia and ischemia-reperfusion models. Stem Cell Research & Therapy. 10 (1), 167 (2019).
- Iwanaga, K., et al. Effects of G-CSF on cardiac remodeling after acute myocardial infarction in swine. Biochemical and Biophysical Research Communications. 325 (4), 1353-1359 (2004).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유