Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Implantation de cardiomyocytes induite par ultrasons dérivée de cellules souches pluripotentes chez des souris infarctus du myocarde
Dans cet article
Résumé
L’administration de cellules guidée par ultrasons autour du site de l’infarctus du myocarde chez la souris est un moyen sûr, efficace et pratique de transplantation cellulaire.
Résumé
L’objectif principal de la thérapie cellulaire après un infarctus du myocarde (IM) est d’améliorer efficacement le taux de greffe cellulaire, et les cardiomyocytes dérivés de cellules souches pluripotentes induites par l’homme (hiPSC-CM) sont une source cellulaire prometteuse pour la réparation cardiaque après une lésion ischémique. Cependant, un faible taux de greffe est un obstacle important à une régénération efficace du tissu cardiaque après la transplantation. Ce protocole montre que les injections percutanées multiples guidées par ultrasons hiPSC-CM dans une zone d’IM augmentent efficacement les taux de transplantation cellulaire. L’étude décrit également l’ensemble du processus de culture hiPSC-CM, le prétraitement et les méthodes d’administration percutanée guidées par ultrasons. En outre, l’utilisation de l’ADN mitochondrial humain aide à détecter l’absence de hiPSC-CMs dans d’autres organes de souris. Enfin, cet article décrit les changements dans la fonction cardiaque, l’angiogenèse, la taille des cellules et l’apoptose dans la zone frontalière infarctus chez la souris 4 semaines après l’accouchement cellulaire. On peut conclure que l’injection percutanée guidée par échocardiographie du myocarde ventriculaire gauche est une thérapie cellulaire réalisable, relativement invasive, satisfaisante, reproductible et efficace.
Introduction
Lorsque l’IM aigu se produit, les cellules myocardiques de la région infarctue meurent rapidement en raison de l’ischémie et de l’hypoxie. Plusieurs facteurs inflammatoires sont libérés après la mort et la rupture des cellules, tandis que les cellules inflammatoires infiltrent le site infarctus pour provoquer une inflammation1. De manière significative, les fibroblastes et le collagène, tous deux sans contractilité et conductivité électrique, remplacent les cellules myocardiques dans le site infarctus pour former du tissu cicatriciel. En raison de la capacité de régénération limitée des cardiomyocytes chez les mammifères adultes, les tissus viables formés après une grande zone d’infarctus ne sont généralement pas suffisants pour maintenir un débit cardiaque suffisant2. L’IM provoque une insuffisance cardiaque et, dans les cas graves d’insuffisance cardiaque, les patients ne peuvent compter que sur des transplantations cardiaques ou des dispositifs d’assistance ventriculaire pour maintenir des fonctions cardiaques normales 3,4.
Après l’IM, la stratégie de traitement idéale consiste à remplacer les cardiomyocytes morts par des cardiomyocytes nouvellement formés, formant un couplage électromécanique avec des tissus sains. Cependant, les options de traitement ont généralement adopté la récupération du myocarde plutôt que le remplacement. Actuellement, les thérapies à base de cellules souches et de cellules progénitrices sont parmi les stratégies les plus prometteuses pour promouvoir la réparation myocardique après l’IM5. Cependant, la transplantation de ces cellules présente plusieurs problèmes, principalement l’incapacité des cellules souches adultes à se différencier en cardiomyocytes et leur courte durée de vie6.
Les questions éthiques liées à l’utilisation de cellules souches embryonnaires (SE) peuvent être contournées par les CSPi, qui sont une source prometteuse de cellules. De plus, les CSPi possèdent de fortes capacités d’auto-renouvellement et peuvent se différencier en cardiomyocytes7. Des études ont montré que les CM-HiPSC transplantés dans le site MI peuvent survivre et former des jonctions lacunaires avec les cellules hôtes 8,9. Cependant, comme ces cellules transplantées sont situées dans le microenvironnement de l’ischémie et de l’inflammation, leur taux de survie est extrêmement faible10,11.
Plusieurs méthodes ont été mises au point pour améliorer le taux de survie des cellules transplantées, telles que le prétraitement par hypoxie et choc thermique des cellules transplantées12,13, la modification génétique 14,15 et la transplantation simultanée de cellules et de capillaires 16. Malheureusement, la plupart des méthodes sont limitées par la complexité et le coût élevé. Par conséquent, la présente étude propose une méthode d’administration reproductible, pratique, relativement invasive et efficace de hiPSC-CM.
L’injection intramyocardique guidée par ultrasons peut être réalisée uniquement avec un petit appareil à ultrasons vétérinaire haute résolution et un micro-injecteur, quel que soit le site. Sous guidage échographique, l’administration directe de cellules sous le processus xiphoïde du péricarde dans le myocarde chez la souris est un protocole sûr qui évite les dommages au foie et aux poumons. Cette méthode peut être combinée simultanément avec d’autres technologies pour améliorer considérablement le taux de survie des cellules transplantées.
Protocole
Toutes les expériences sur les animaux de cette étude ont été examinées et approuvées par le comité d’éthique du deuxième hôpital Xiangya de l’Université Central South. Voir le tableau des matériaux pour plus de détails concernant tous les matériaux et équipements utilisés dans ce protocole. Les délais pour l’injection cellulaire, l’imagerie et l’euthanasie sont les suivants : t0- induire un infarctus, t1 semaine - cellules d’image et d’implant, t2 semaines - cellules d’image et d’implant, t4 semaines - imagerie finale, euthanasie et prélèvement de tissus.
1. Culture de CSPhi, différenciation des cardiomyocytes et purification cellulaire
- Mélanger DMEM/F12 et la solution mère à matrice membranaire basale avec de la glace à 4 °C dans un rapport aliquote de 1,5:1 et entreposer le mélange obtenu (diluant matriciel) à -20 °C. Mélanger soigneusement 25 mL de milieu de culture DMEM/F12 à 4 °C et 1 mL de diluant matriciel avec de la glace, et étaler 1 mL/puits dans une plaque à 6 puits. Maintenir la plaque debout pendant 1 h dans un incubateur à 37 °C et aspirer le surnageant DMEM/F12 des puits. Ne touchez pas le fond de la plaque à 6 puits lors de l’exécution de la procédure.
- Retirer le tube de cryoconservation contenant les CSPhi de l’azote liquide et les décongeler rapidement au bain-marie à 37 °C. Stérilisez la surface externe du tube de cryoconservation avec de l’alcool à 75%, essuyez l’alcool et transférez le tube sur une table stérile ultra-propre.
- Utiliser une pipette pour transférer délicatement la solution de cryoconservation contenant des CSPh dans un tube à centrifuger de 15 mL, ajouter 5 mL de milieu ES sans alimentation et centrifuger la suspension à 300 × g pendant 3 min à température ambiante. Jeter le surnageant et remettre doucement les cellules en suspension dans 6 mL du milieu ES sans alimentation. Compter les cellules et ajuster la concentration cellulaire à 5 × 105 cellules/ml avec le milieu de culture.
- Ajouter l’inhibiteur de ROCK (Y27632) aux CSPh jusqu’à une concentration finale de 5 μM. Transférer les CSPh avec Y27632 sur la plaque à 6 puits prétraitée avec une matrice membranaire basale et agiter doucement la plaque à 6 puits, en traçant la forme du nombre « 8 » pour répartir uniformément les CSPhi. Placer les CSPh dans un incubateur humide à 37 °C contenant 5 % de CO2 en position verticale pendant 24 h. Remplacez le surnageant par le milieu ES sans alimentation sans Y27632.
- Lorsque les CSPhi atteignent 80% de confluence, aspirer le surnageant de culture, laver les cellules deux fois avec une solution saline tamponnée au phosphate (PBS), ajouter RPMI1640 + B27 sans insuline contenant 10 μM CHIR99021 (inhibiteur de GSK3-β) et placer les CSPhi dans un incubateurCO2 humide à 37 °C pendant 24 h.
- Remplacez la moitié du surnageant par un milieu RPMI1640 + B27 sans insuline et incuber les cellules pendant 24 heures supplémentaires.
- Remplacez complètement le milieu de culture par RPMI1640 + B27 (sans insuline). Placer les plaques dans un incubateur humide à 37 °C avec 5% de CO2 en position verticale pendant 24 h.
- Remplacer complètement le milieu de culture après 3 jours par RPMI1640 + B27 + 5 μM IWR1 (inhibiteur de la voie de signalisation Wnt) sans insuline et placer les plaques dans un incubateur humide à 37 °C avec 5% de CO2 pendant 48 h.
- Remplacer le milieu de culture après 5 jours par RPMI1640 + B27 sans insuline et continuer à incuber pendant 48 h dans un incubateurCO2 humide à 37 °C.
- Remplacer le milieu de culture par le milieu RPMI + B27 (y compris l’insuline) après 7 jours et placer les plaques dans un incubateur de CO2 humidifié pendant 3 jours à 37 °C. Remplacez le milieu par le support RPMI + B27 tous les 3 jours. Recherchez le battement spontané des cellules à 9-12 jours de différenciation.
- Après avoir observé les cellules pulsées, remplacer le milieu RPMI + B27 par un milieu RPMI 1640 sans glucose contenant de l’acide lactique (1 mL d’acide lactique ajouté à 500 mL de milieu RPMI 1640 sans glucose). Incuber les cellules pendant 72 h dans un incubateur humide à 37 °C avec 5% de CO2.
- Après 72 h, remplacer le surnageant par un milieu RPMI + B27 et incuber pendant 48 h dans un incubateur humide à 37 °C avec 5% de CO2.
- Aspirer le surnageant de culture sous pression négative et laver les cellules 3x avec du PBS pour éliminer les traces du milieu de culture. Utiliser le mélange enzymatique de détachement cellulaire pour dissocier les hiPSC-CM en cellules individuelles à 37 °C. Recueillir les cellules obtenues dans un tube à centrifuger de 15 mL contenant 3 mL de solution de support cardiomocytes, centrifuger à 300 × g pendant 2 min à température ambiante et jeter le surnageant.
- Remettez les cellules en suspension avec un milieu RPMI + B27, ensemencez-les sur des plaques à 6 puits revêtues de matrice membranaire basale et incuberez-les pendant 48 h dans un incubateur humide à 37 °C avec 5% de CO2.
- Remplacer le surnageant de culture pour purification par un milieu RPMI 1640 sans glucose contenant de l’acide lactique et incuber pendant 72 h dans un incubateur humide à 37 °C avec 5% de CO2.
- Remplacez le surnageant de culture par RPMI + milieu B27 et changez le milieu tous les 3 jours.
- Continuez le processus ci-dessus pendant 30 jours, en remplaçant le surnageant de culture par un milieu sans glucose contenant de l’acide lactique pour une purification ultérieure. Incuber les cellules pendant 3 jours avec ce milieu et remplacer le surnageant par RPMI + B27. Culture des cellules en continu pendant 30 jours jusqu’à ce que les hiPSC-CMs battent de manière stable, et utiliser ces cellules pour l’injection intramyocardique chez la souris.
2. Préparation des CSPhi-CM et établissement d’un modèle d’infarctus aigu du myocarde chez la souris
- Aspirer sous vide le surnageant de culture des hiPSC-CM cultivés pendant 60 jours, laver les cellules 3x avec du PBS et dissocier les hiPSC-CM en cellules individuelles à 37 °C avec le mélange d’enzymes de décollement cellulaire (~3-5 min). Recueillir les cellules dans un tube à centrifuger de 15 mL contenant 5 mL de milieu RPMI + B27 et bien mélanger avant de compter les cellules pour calculer le nombre total de cellules. Centrifuger la suspension cellulaire à 300 × g pendant 2 min à température ambiante. Jeter le surnageant et ajouter le milieu de support des cardiomyocytes pour le remettre en suspension à une concentration de 0,6 × 105 cellules/μL.
- Maintenir le tube à centrifuger contenant les hiPSC-CM remis en suspension prêt à 37 °C pour injection 14,17,18,19,20.
- Placez les souris dans une boîte d’anesthésie reliée à l’isoflurane pour induire l’inhalation d’anesthésique suivie de l’utilisation d’une pommade vétérinaire sur les yeux pour prévenir la sécheresse sous anesthésie.
REMARQUE : La concentration d’isoflurane était de 5 %. Faites attention à la ventilation du laboratoire pendant l’expérience. - Recherchez la perte de réflexes dans la région des pieds et de la queue après un pincement lorsque la souris est posée à plat sur la table d’opération, indiquant une anesthésie suffisante. Administrer la buprénorphine (0,1 mg/kg) par voie intrapéritonéale.
- Enduisez les poils au milieu du cou et sur la poitrine gauche des souris avec une crème dépilatoire et essuyez la crème appliquée et les cheveux avec de la gaze après 5 minutes.
- Fixez les membres et la queue de la souris avec du ruban adhésif. Fixez les incisives de la souris avec un fil de soie 2-0 et du ruban adhésif. Stérilisez la zone chirurgicale (cou médian et poitrine gauche) avec trois cycles alternés de bétadine suivis d’alcool.
- Placez un champ chirurgical autour de la zone chirurgicale stérilisée. Ensuite, faites une incision médiane du cou à l’aide de fins ciseaux anatomiques et de pinces à dissection fine pour exposer complètement la trachée. Si nécessaire, coupez quelques muscles cervicaux antérieurs pour la stabilisation.
REMARQUE : Les opérateurs ont été aveuglés par les groupes d’animaux. - Insérez un tube trachéal (aiguille de ponction du cathéter de 20 G) par la bouche.
- Connectez le tube trachéal au ventilateur et vérifiez les mouvements thoraciques pour vous assurer que les deux poumons sont bien ventilés.
- Ajustez les paramètres respiratoires (fréquence respiratoire: 100-150 bpm, volume courant 250-300 μL). Après cela, refixez le membre postérieur gauche sur le côté inférieur droit, desserrez la bande autour du membre supérieur gauche et effectuez une thoracotomie à l’espace intercostal 3-4 du thorax gauche à l’aide de ciseaux et de pinces à dissection fine pour une exposition cardiaque maximale.
- À l’aide d’une pince, décollez le péricarde au microscope pour visualiser l’artère coronaire descendante antérieure gauche (DAL) sur le bord inférieur de l’appendice auriculaire gauche.
- Utilisez un fil de soie 6-0 pour ligaturer l’extrémité proximale du LAD. Après s’être assuré que le modèle d’IM aigu est correctement établi (lorsque le DAL distal au site de ligature passe du rouge au blanc), fermer la poitrine couche par couche et suturer la peau avec 4-0 points intermittents filetés. Effectuer toutes les interventions chirurgicales mentionnées ci-dessus pour l’induction de l’IM pour le groupe d’animaux fictifs, à l’exception de la ligature.
- Éteignez l’anesthésie par inhalation, retirez la canule après que la souris a repris sa respiration spontanée et remettez-la dans sa cage. Surveillez l’animal jusqu’à ce qu’il ait repris suffisamment conscience pour maintenir une position couchée sternale. Ne le retournez pas en compagnie d’autres animaux tant qu’il n’est pas complètement rétabli. Administrer des injections intrapéritonéales de buprénorphine (0,1 mg/kg x 3 jours) et de carprofène (5 mg/kg x 1 jour) toutes les 12 heures postopératoires.
- Injecter de la cyclosporine A (10 mg·kg-1·jour-1) dans la cavité intrapéritonéale de souris 3 jours avant d’administrer des CM-HIPSC pour prévenir le rejet des cellules transplantées. Injecter de la cyclosporine A en continu pendant 1 mois après la transplantation.
3. injection hiPSC-CM sous guidage échographique
- Après avoir configuré le modèle IM, assigner les souris modèles IM (souris C57BL/6 âgées de 12 semaines; 22 g à 24 g en poids, 50 % mâles et 50 % femelles) aux groupes à dose unique (ET, n = 8 dans cette étude) et à doses multiples (DM, n = 8 dans cette étude) le premier jour post-IM et placez-les dans les première et deuxième semaines suivant l’IM dans une boîte d’anesthésie reliée à 5 % d’isoflurane pour l’induction d’une anesthésie par inhalation suivie de Intubation trachéale.
- Enduisez les poils de la poitrine et du haut de l’abdomen des souris avec de la crème dépilatoire et essuyez la crème avec de la gaze 5 minutes plus tard. Surveillez la fréquence cardiaque de la souris sur la carte d’opération et administrez de l’isoflurane par inhalation jusqu’à ce que la fréquence cardiaque soit maintenue à 400-500 bpm.
- Fixez les membres et la queue de la souris avec du ruban adhésif sur la console de détection et réglez la température de la plate-forme à 37 °C.
- Appliquez une gelée d’échographie spéciale sur le haut de l’abdomen et utilisez une sonde à ultrasons vétérinaire à haute résolution plus petite pour obtenir des images du foie de souris.
- Réduisez le taux de ventilation à 50 bpm. Utilisez une microseringue de 5 μL pour prélever ~3 × 105 cellules (à partir de l’étape 2.1). En tenant la seringue à l’aide d’un micromanipulateur, insérer une aiguille de 3 mm au niveau du processus para-xiphoïde gauche (Figure 1A). Suivez le bord supérieur du diaphragme sous guidage échographique (Figure 1B), observez le rythme respiratoire et la plage (Figure 1C,D) et entrez dans le péricarde à la fin du cycle expiratoire en évitant d’endommager le foie et les poumons (Figure 1D).
- Une fois que l’aiguille du micro-injecteur pénètre dans la cavité péricardique, ajustez la fréquence respiratoire au paramètre d’origine (150 bpm). Acquérir l’image parasternale à axe long du cœur de souris par échocardiographie M-moule selon les instructions du fabricant17 (Figure 1E). Sous guidage ultrasonique, injecter 3 × 105 cellules (Figure 1F) dans trois zones marginales (1 × 105 cellules par site injecté) du site de l’infarctus.
- Retirez la sonde à ultrasons spéciale et rincez la gelée. Sevrez la souris de l’anesthésie par inhalation et retournez-la dans sa cage après avoir pris conscience.
- Répétez les procédures d’injection cellulaire guidée par ultrasons ci-dessus 1 et 2 semaines après l’établissement de l’IM pour les souris du groupe MD.
4. Évaluation de la fonction cardiaque, du marquage par fluorescence, du nombre de cellules transplantées, de la zone infarctus du myocarde et de la détection des mitochondries humaines chez la souris 30 jours après la ligature de la branche descendante antérieure gauche
- Évaluation de la fonction cardiaque
- Placez la souris dans une boîte d’anesthésie liée à l’isoflurane pour l’anesthésie par induction-inhalation suivie de l’utilisation d’une pommade vétérinaire sur les yeux pour prévenir la sécheresse sous anesthésie. Enlevez les poils sur la poitrine gauche de la souris avec une crème dépilatoire. Posez la souris sur le panneau de contrôle pour surveiller la fréquence cardiaque et ajuster l’inhalation d’isoflurane. Maintenez la fréquence cardiaque de la souris à 400-500 bpm. Le critère d’évaluation expérimental est le jour 30 (après l’induction de l’IM).
- Fixez les membres et la queue de la souris avec du ruban adhésif sur la console de détection et réglez la température de la plate-forme à 37 °C.
- Après avoir appliqué un gel à ultrasons spécial sur la région antérieure du cœur, utiliser une sonde à ultrasons cardiaques (vétérinaire) à haute résolution pour acquérir des images parasternales à axe long et à axe court bidimensionnel sous échocardiographie de la moisissure M et de la moisissure B conformément aux instructions du fabricant17.
- Une fois la détection par ultrasons terminée, rincez le gel à ultrasons spécial, désactivez l’anesthésie par inhalation et remettez la souris dans sa cage séparément après avoir pris conscience.
- Analysez les données obtenues et calculez la fraction d’éjection ventriculaire gauche (FE) et le raccourcissement fractionnaire (FS) à l’aide du logiciel d’analyse. S’assurer que l’opérateur est aveugle aux groupes expérimentaux17.
- Marquage en fluorescence des sections
- Laver le cœur isolé avec du PBS, l’immerger dans 4% de paraformaldéhyde à 4 °C pendant 12 h. Sortez le cœur et plongez-le dans 30% de saccharose pendant 24 h pour le déshydrater.
- Intégrez le cœur déshydraté avec le composé à température de coupe optimale (OCT) sur de la glace sèche. Trancher le cœur du bas vers l’apex avec une épaisseur cryostat de 10 μm et placer les sections sur des lames et stocker les lames à -20 °C.
- Lavez les lames avec le tissu cardiaque avec du PBS pendant 3 min.
- Perméabiliser le tissu sur des lames avec 0,5% de Triton X-100 à température ambiante pendant 8 min et les laver 3x avec du PBS pendant 5 min par lavage.
- Après avoir recouvert le tissu avec 10% de sérum d’ânesse et 90% de PBS (solution bloquante), bloquez les sections pendant 1 h à température ambiante.
- Après avoir retiré la solution bloquante, incuber les coupes avec l’anticorps primaire (dilué à 1:100 avec la solution bloquante) pendant une nuit à 4 °C. Lavez-les 3x avec du PBS pendant 5 minutes par lavage.
- Incuber le tissu sur des lames avec un anticorps secondaire conjugué au fluorophore (dilué à 1:100 avec la solution bloquante) pendant 1 h à température ambiante.
REMARQUE: Évitez d’exposer les tissus contenant l’anticorps secondaire conjugué au fluorophore à la lumière à partir de ce point. - Lavez les lames 3x avec du PBS pendant 5 min par lavage.
- Monter les lames à l’aide d’un support de montage contenant du 4',6-diamidino-2-phénylindole (DAPI) et photographier au microscope à fluorescence17.
- Les CM-HiPSC transplantés comptent17
- Effectuer une coloration par immunofluorescence tissulaire sur les sections gelées du cœur pour la troponine T spécifique du piéton (hcTnT), l’antigène nucléaire humain (HNA) et l’alpha-actinine sarcomérique non spécifique.
- Une fois que tout le cœur a été sectionné en série, prenez une section pour 50 sections pour l’étiquetage de fluorescence.
- Capturez au hasard cinq images à fort grossissement par tranche. Comptez le nombre de champs de vision greffés, calculez le nombre moyen de cellules greffées par unité de surface et définissez-le comme A1/μm2. Calculez la surface totale greffée de la tranche à l’aide de ImageJ (https://imagej.nih.gov/ij/) et définissez-la comme B1μm2 de sorte que le nombre greffé dans cette tranche = A1 × B121,22.
- Calculer le nombre total de cellules greffées par cœur de souris en utilisant Eq (1) et le pourcentage de taux de greffe en utilisant Eq (2), étant donné qu’une section a été choisie toutes les 50 sections21,22.
- Nombre total de cellules greffées par cœur de souris = (A1 × B1 + A2 × B2 +...+ An × Bn) × 50 (1)
taux de greffe =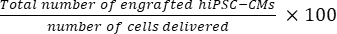 (2)
(2)
REMARQUE : Le nombre d’accouchements était de 3 × 10 5 pour le groupe SD et de 3 × 3 × 105 pour le groupe DM.
- Évaluation de la zone infarctus du myocarde
- Couper une section transversale congelée (axe court) du cœur isolé, de l’apex à la base du cœur avec une épaisseur de 10 μm.
- Une fois que tout le cœur a été sectionné en série, prendre une lame de section toutes les 30 sections et la fixer dans une solution Bouin préchauffée à 58 °C. Colorer la section avec 0,04% de colorations de collagène Direct Red et 0,1% Fast Green (dilué dans du PBS) conformément aux instructions du fabricant17.
- Utiliser un logiciel (p. ex., ImageJ) pour analyser les images après une photographie transversale du corps entier du cœur au microscope à l’aide de l’équation (3) :14,17
Superficie de l’infarctus % =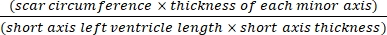 × 100 % (3)
× 100 % (3)
- Détection de l’ADN mitochondrial humain dans divers organes
- Anesthésiez les souris avec 5% d’isoflurane et sacrifiez-les par luxation cervicale postérieure. Disséquer les souris 4 semaines après la greffe de cellule. Prélever les organes (foie, poumon, cerveau, rein, rate) et une partie du myocarde (n = 3 dans cette section).
- Broyer chaque tissu d’organe dans de l’azote liquide et extraire l’ADN du tissu à l’aide de la trousse référencée (voir le tableau des matériaux) conformément aux instructions du fabricant.
- Suivez les instructions du fabricant pour utiliser la trousse et les amorces mentionnées (voir le tableau des matériaux) pour détecter l’ADN mitochondrial humain dans les tissus mentionnés ci-dessus (à partir de l’étape 4.5.1).
Résultats
L’échocardiographie pour l’évaluation de la fonction ventriculaire gauche des souris de chaque groupe a révélé que les lésions de l’IM étaient effectivement inversées dans le groupe DM (Figure 2A). Par rapport au groupe IM, le groupe SD a montré une augmentation de la fraction d’éjection (FE) (de 30 % à 35 %; Figure 2B) et le raccourcissement des fractions (FS) (de 18 % à 22 %; Figure 2C) après MI. Cependant, il...
Discussion
Les étapes critiques de cette étude comprennent la culture hiPSC, la différenciation des cardiomyocytes , la purification de l’hiPSC-CM et la transplantation d’hiPSC-CM dans le site d’infarctus du myocarde de la souris. La clé est d’utiliser l’échographie cardiaque pour guider le traitement par voie transcutanée vers le site de l’infarctus au bord de l’infarctus où des HIPSC-CM ont été injectés dans la région.
Avec la prolongation du temps de culture, le phénotype hiP...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par le Plan de recherche majeur de la Fondation nationale des sciences naturelles de Chine (n ° 91539111à JY), le projet clé de la science et de la technologie de la province du Hunan (n ° 2020SK53420 à JY) et le programme d’innovation scientifique et technologique de la province du Hunan (2021RC2106 à CF).
matériels
| Name | Company | Catalog Number | Comments |
| Antibody | |||
| Cardiac troponin T | Abcam | ab8295 | |
| Donkey Anti-Mouse IgG H&L (Alexa Fluor 488) | Abcam | ab150105 | |
| Donkey Anti-Mouse IgG H&L (Alexa Fluor 555) | Abcam | ab150110 | |
| Donkey Anti-Rabbit IgG H&L (Alexa Fluor 488) | Abcam | ab150073 | |
| Donkey Anti-Rabbit IgG H&L (Alexa Fluor 555) | Abcam | ab150062 | |
| Human cardiac troponin T | Abcam | ab91605 | |
| Isolectin B4 | Vector | FL-1201 | |
| Sarcomeric alpha actinin | Abcam | ab9465 | |
| Wheat germ agglutinin | Thermo Fisher Scientific | W11261 | |
| Reagent | |||
| Accutase | Thermo Fisher Scientific | 00-4555-56 | |
| B27 Supplement(minus insulin) | Thermo Fisher Scientific | A1895601 | |
| B27 Supplement(serum free) | Thermo Fisher Scientific | 17–504-044 | |
| Bouin's solution | Thermo Fisher Scientific | SDHT10132 | |
| CHIR99021 | Selleck | CT99021 | |
| cyclosporin A | Medchemexpress | HY-B0579 | |
| DIRECT RED | Sigma-Aldrich | 365548-25G | |
| DMEM/F12 | Thermo Fisher Scientific | 11320033 | |
| DNeasy Blood & Tissue Kit | Qiagen | 69504 | |
| FAST GREEN FCF | Sigma-Aldrich | F7252-5G | |
| Glucose-free RPMI 1640 | Thermo Fisher Scientific | 11879020 | |
| IWR1 | Selleck | S7086 | |
| lactic acid | Sigma-Aldrich | L6661 | |
| Matrigel | BD Biosciences | BD356234 | |
| mTeSR1 | Stem Cell Technologies | 72562 | |
| O.C.T. Compound | SAKURA | 4583 | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| PowerUP SYBR Green MasterMix kit | Thermo Fisher Scientific | A25742 | |
| RPMI1640 | Thermo Fisher Scientific | 11875119 | |
| STEMdif Cardiomyocyte Freezing Medium/STEMdiff | Stem Cell Technologies | 5030 | |
| STEMdiff Cardiomyocyte Support Medium | Stem Cell Technologies | 5027 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| ultrasound coupling agent | CARENT | 22396269389 | |
| Y-27632 | Selleck | S6390 | |
| Equipment and Supplies | |||
| Applied Biosystems | Thermo Fisher Scientific | 7500 Real-Time PCR | |
| cryostat | Leica | CM1950 | |
| fluoresence microscope | Olympus | IX83 | |
| fine anatomical scissors | Fine Science Tools | 15000-08 | |
| fine dissecting forceps | Fine Science Tools | 11255-20 | |
| Micro syringe | Hamilton | 7633 | |
| Small animal anesthesia machine | MATRX | VMR | |
| Ultra-high resolution small animal ultrasound imaging system | VisualSonics | Vevo 2100 | |
| Software | |||
| Statistical Product and Service Solutions | IBM | 21 | |
| Image J | NIH | 1.48 | |
| Human mitochondrial DNA primers | |||
| the forward primer sequence | CCGCTACCATAATCATCGCTAT | ||
| the reverse primer sequence | TGCTAATACAATGCCAGTCAGG |
Références
- Leuschner, F., et al. Rapid monocyte kinetics in acute myocardial infarction are sustained by extramedullary monocytopoiesis. The Journal of Experimental Medicine. 209 (1), 123-137 (2012).
- Lázár, E., et al. Cardiomyocyte renewal in the human heart: insights from the fall-out. European Heart Journal. 38 (30), 2333-2342 (2017).
- Davis, M. K., et al. State of the art: cardiac transplantation. Trends in Cardiovascular Medicine. 24 (8), 341-349 (2014).
- Mancini, D., Colombo, P. C. Left ventricular assist devices: A rapidly evolving alternative to transplant. Journal of the American College of Cardiology. 65 (23), 2542-2555 (2015).
- Zimmermann, W. H. Translating myocardial remuscularization. Circulation Research. 120 (2), 278-281 (2017).
- Hu, X., et al. A large-scale investigation of hypoxia-preconditioned allogeneic mesenchymal stem cells for myocardial repair in nonhuman primates: Paracrine activity without remuscularization. Circulation Research. 118 (6), 970-983 (2016).
- Kempf, H., et al. Cardiac differentiation of human pluripotent stem cells in scalable suspension culture. Nature Protocols. 10 (9), 1345-1361 (2015).
- Chong, J. J., et al. Human embryonic-stem-cell-derived cardiomyocytes regenerate non-human primate hearts. Nature. 510 (7504), 273-277 (2014).
- Shiba, Y., et al. Allogeneic transplantation of iPS cell-derived cardiomyocytes regenerates primate hearts. Nature. 538 (7625), 388-391 (2016).
- Nguyen, P. K., et al. Potential strategies to address the major clinical barriers facing stem cell regenerative therapy for cardiovascular disease: A review. JAMA Cardiology. 1 (8), 953-962 (2016).
- Zimmermann, W. H. Remuscularization of the failing heart. The Journal of Physiology. 595 (12), 3685-3690 (2017).
- Hu, X., et al. Transplantation of hypoxia-preconditioned mesenchymal stem cells improves infarcted heart function via enhanced survival of implanted cells and angiogenesis. The Journal of Thoracic and Cardiovascular Surgery. 135 (4), 799-808 (2008).
- Feng, Y., et al. Heat shock improves Sca-1+ stem cell survival and directs ischemic cardiomyocytes toward a prosurvival phenotype via exosomal transfer: a critical role for HSF1/miR-34a/HSP70 pathway. Stem Cells. 32 (2), 462-472 (2014).
- Fan, C., et al. Cardiomyocytes from CCND2-overexpressing human induced-pluripotent stem cells repopulate the myocardial scar in mice: A 6-month study. Journal of Molecular and Cellular Cardiology. 137, 25-33 (2019).
- Lou, X., et al. N-cadherin overexpression enhances the reparative potency of human-induced pluripotent stem cell-derived cardiac myocytes in infarcted mouse hearts. Cardiovascular Research. 116 (3), 671-685 (2020).
- Sun, X., et al. Transplanted microvessels improve pluripotent stem cell-derived cardiomyocyte engraftment and cardiac function after infarction in rats. Science Translational Medicine. 12 (562), (2020).
- Wu, X., et al. Cardiac repair with echocardiography-guided multiple percutaneous left ventricular intramyocardial injection of hiPSC-CMs after myocardial infarction. Frontiers in Cardiovascular Medicine. 8, 768873 (2021).
- Kannappan, R., et al. Functionally competent DNA damage-free induced pluripotent stem cell-derived cardiomyocytes for myocardial repair. Circulation. 140 (6), 520-522 (2019).
- Lou, X., et al. N-cadherin overexpression enhances the reparative potency of human-induced pluripotent stem cell-derived cardiac myocytes in infarcted mouse hearts. Cardiovascular Research. 116 (3), 671-685 (2020).
- Zhao, M., et al. Y-27632 preconditioning enhances transplantation of human-induced pluripotent stem cell-derived cardiomyocytes in myocardial infarction mice. Cardiovascular Research. 115 (2), 343-356 (2019).
- Zhao, M., et al. Enhancing the engraftment of human induced pluripotent stem cell-derived cardiomyocytes via a transient inhibition of rho kinase activity. Journal of Visualized Experiments: JoVE. (149), e59452 (2019).
- O'Brien, J., Hayder, H., Peng, C. Automated quantification and analysis of cell counting procedures using ImageJ plugins. Journal of Visualized Experiments: JoVE. (117), e54719 (2016).
- Kain, V., Prabhu, S. D., Halade, G. V. Inflammation revisited: inflammation versus resolution of inflammation following myocardial infarction. Basic Research in Cardiology. 109 (6), 444 (2014).
- Rainer, P. P., et al. Cardiomyocyte-specific transforming growth factor β suppression blocks neutrophil infiltration, augments multiple cytoprotective cascades, and reduces early mortality after myocardial infarction. Circulation Research. 114 (8), 1246-1257 (2014).
- Yu, Y., et al. Human embryonic stem cell-derived cardiomyocyte therapy in mouse permanent ischemia and ischemia-reperfusion models. Stem Cell Research & Therapy. 10 (1), 167 (2019).
- Iwanaga, K., et al. Effects of G-CSF on cardiac remodeling after acute myocardial infarction in swine. Biochemical and Biophysical Research Communications. 325 (4), 1353-1359 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon