このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
心筋梗塞マウスにおける超音波ガイド下多能性幹細胞由来心筋細胞移植術
要約
マウスの心筋梗塞部位周辺の超音波ガイド下細胞送達は、安全で効果的で便利な細胞移植方法です。
要約
心筋梗塞(MI)後の細胞治療の主な目的は、細胞移植率を効果的に高めることであり、ヒト人工多能性幹細胞由来心筋細胞(hiPSC-CM)は、虚血性損傷後の心臓修復のための有望な細胞源です。しかしながら、低い移植率は、移植後の効果的な心臓組織再生にとって重大な障害である。このプロトコルは、MI領域への複数のhiPSC-CM超音波ガイド下経皮注射が細胞移植率を効果的に増加させることを示しています。この研究では、hiPSC-CM培養プロセス全体、前処理、および超音波ガイド下経皮送達方法についても説明します。さらに、ヒトミトコンドリアDNAの使用は、他のマウス臓器におけるhiPSC-CMの不在を検出するのに役立ちます。最後に、本論文では、細胞送達後4週間におけるマウスの梗塞境界帯における心機能、血管新生、細胞サイズ、およびアポトーシスの変化について説明します。心エコー検査による左室心筋の経皮的注射は、実行可能で、比較的侵襲的で、満足のいく、再現性のある、効果的な細胞療法であると結論付けることができます。
概要
急性MIが発生すると、梗塞領域の心筋細胞は虚血と低酸素症のために急速に死滅します。いくつかの炎症因子は細胞死と破裂の後に放出されますが、炎症細胞は梗塞部位に浸潤して炎症を引き起こします1。重要なことに、線維芽細胞およびコラーゲンは、いずれも収縮性および導電性を伴わず、梗塞部位の心筋細胞に取って代わり、瘢痕組織を形成する。成体哺乳動物における心筋細胞の再生能力が限られているため、大面積の梗塞後に形成される生組織は、通常、十分な心拍出量を維持するのに十分ではありません2。MIは心不全を引き起こし、心不全の重症例では、患者は正常な心機能を維持するために心臓移植または補助人工心臓のみに頼ることができます3,4。
MI後の理想的な治療戦略は、死んだ心筋細胞を新しく形成された心筋細胞に置き換え、健康な組織との電気機械的結合を形成することです。ただし、治療オプションは通常、置換ではなく心筋サルベージを採用しています。現在、幹細胞および前駆細胞ベースの治療法は、MI5後の心筋修復を促進するための最も有望な戦略の1つです。しかし、これらの細胞の移植にはいくつかの問題があり、主に成体幹細胞が心筋細胞に分化できないことと、それらの寿命が短いことです6。
胚性幹細胞(ES)細胞の使用に関連する倫理的問題は、有望な細胞源であるiPS細胞によって回避することができます。さらに、iPS細胞は強力な自己複製能力を持ち、心筋細胞に分化することができます7。研究は、MI部位に移植されたhiPSC-CMが生存し、宿主細胞とギャップ結合を形成することができることを示しています8,9。しかし、これらの移植細胞は虚血や炎症の微小環境にあるため、生存率は極めて低い10,11。
移植細胞の低酸素症およびヒートショックの前処理12,13、遺伝子改変14,15、および細胞および毛細血管の同時移植16など、移植細胞の生存率を改善するためのいくつかの方法が確立されている。残念ながら、ほとんどの方法は複雑さと高コストによって制限されています。したがって、本研究では、再現性があり、便利で、比較的侵襲的で、効果的なhiPSC-CM送達方法を提案する。
超音波ガイド下心筋内細胞注入は、部位を問わず、高解像度の小型動物用超音波装置とマイクロインジェクターのみで行うことができます。超音波ガイダンスの下で、剣状突起下の細胞を心膜からマウスの心筋に直接送達することは、肝臓と肺の損傷を回避する安全なプロトコルです。この方法は、他の技術と同時に組み合わせて、移植細胞の生存率を大幅に向上させることができます。
プロトコル
この研究のすべての動物実験は、中南大学の第2襄雅病院の倫理委員会によってレビューおよび承認されました。このプロトコルで使用されるすべての材料と機器の詳細については、 材料の表 を参照してください。細胞注入、イメージング、安楽死のタイムラインは次のとおりです:t0-梗塞を誘発し、t1週間-画像およびインプラント細胞、t2週間-画像および移植細胞、t4週間-最終イメージング、安楽死および組織収集。
1. hiPS細胞培養、心筋細胞分化、細胞精製
- DMEM/F12と基底膜マトリックスストック溶液を4°Cの氷と1.5:1の比率で混合し、分注し、得られた混合物(マトリックス希釈液)を-20°Cで保存します。 DMEM/F12培地25 mLを4°Cで混合し、1 mLのマトリックス希釈液を氷と十分に混合し、1 mL/ウェルを6ウェルプレートに広げます。プレートを37°Cのインキュベーターで1時間直立させ、ウェルからDMEM/F12上清を吸引します。手順を実行するときは、6ウェルプレートの底に触れないでください。
- 液体窒素からhiPS細胞を含む凍結保存チューブを取り出し、37°Cの水浴中で素早く解凍します。凍結保存チューブの外面を75%アルコールで滅菌し、アルコールを拭き取り、チューブを滅菌済みの超清浄テーブルに移します。
- ピペットを使用して、hiPS細胞を含む凍結保存液を15 mLの遠沈管に穏やかに移し、5 mLのフィーダーフリーES培地を加え、懸濁液を300 × g で室温で3分間遠心分離します。上清を捨て、6 mLのフィーダーフリーES培地に細胞を静かに再懸濁します。細胞をカウントし、培養液で細胞濃度を5×105 細胞/mLに調整します。
- ROCK阻害剤(Y27632)を最終濃度5 μMになるようにhiPS細胞に加えます。 Y27632を含むhiPS細胞を基底膜マトリックスで前処理した6ウェルプレートに移し、6ウェルプレートをゆっくりと旋回させ、番号「8」の形状をトレースして、hiPS細胞を均等に分布させます。hiPS細胞を5%CO2 を入れた37°Cの湿潤インキュベーターに24時間直立させます。上清をY27632を含まないフィーダーフリーES培地と交換します。
- hiPS細胞が80%のコンフルエント度に達したら、培養上清を吸引し、リン酸緩衝生理食塩水(PBS)で細胞を2回洗浄し、10 μM CHIR99021(GSK3-β阻害剤)を含むインスリンフリーのRPMI1640 + B27を添加し、hiPS細胞を37°Cの湿潤CO2 インキュベーターに24時間置きます。
- 上清の半分をインスリンを含まないRPMI1640 + B27培地に交換し、細胞をさらに24時間インキュベートします。
- 培地をRPMI1640 + B27(インスリンなし)と完全に交換します。プレートを37°Cの湿潤インキュベーターに入れ、5%CO2 を直立させて24時間放置します。
- 3日後に培養液をインスリンフリーのRPMI1640 + B27 + 5 μM IWR1(Wntシグナル伝達経路阻害剤)で完全に交換し、プレートを5%CO2 を含む37°Cの湿潤インキュベーターに48時間置きます。
- 5日後に培養液をインスリンなしのRPMI1640 + B27に交換し、37°Cの湿潤CO2 インキュベーターで48時間インキュベートを続けます。
- 7日後に培養液をRPMI + B27(インスリンを含む)培地に交換し、プレートを加湿したCO2 インキュベーターに37°Cで3日間入れます。 3日ごとに培地をRPMI + B27培地と交換してください。分化の9-12日で細胞の自発的な鼓動を探します。
- 拍動細胞を観察した後、RPMI+B27培地を乳酸を含むグルコースフリーRPMI 1640培地(グルコースフリーRPMI 1640培地500mLに乳酸1mL添加)に交換する。細胞を5%CO2を含む37°Cの湿潤インキュベーター内で72時間インキュベートします。
- 72時間後、上清をRPMI + B27培地で交換し、5%CO2を含む37°Cの湿潤インキュベーター内で48時間インキュベートする。
- 培養上清を陰圧下で吸引し、細胞をPBSで3回洗浄して培養液の痕跡を除去します。細胞剥離酵素混合物を使用して、37°CでhiPSC-CMを個々の細胞に解離させます。 得られた細胞を心筋細胞支持液3mLを入れた15mL遠沈管に回収し、室温で300× gで2 分間遠心分離し、上清を廃棄する。
- 細胞をRPMI + B27培地で再懸濁し、基底膜マトリックスコーティングされた6ウェルプレートに播種し、5%CO2を含む37°Cの湿潤インキュベーターで48時間インキュベートします。
- 精製用の培養上清を乳酸を含むグルコースフリーRPMI 1640培地に交換し、5%CO2を含む37°Cの湿潤インキュベーター内で72時間インキュベートする。
- 培養上清をRPMI+B27培地に交換し、3日ごとに培地を交換してください。
- 上記の処理を30日間継続し、培養上清を乳酸を含むグルコース非含有培地に交換し、さらに精製する。この培地で細胞を3日間インキュベートし、上清をRPMI + B27で交換します。hiPSC-CMsが安定に拍動するまで30日間連続培養し、マウスの心筋内注射に使用します。
2. hiPSC-CMの作製とマウス急性心筋梗塞モデルの樹立
- 60日間培養したhiPSC-CMの培養上清を真空吸引し、細胞をPBSで3回洗浄し、細胞剥離酵素混合物を用いて37°CでhiPSC-CMを個々の細胞に解離させます(~3-5分)。5 mLのRPMI + B27培地を含む15 mLの遠沈管に細胞を回収し、細胞を数える前によく混合して細胞の総数を計算します。細胞懸濁液を300 × g で室温で2分間遠心分離します。上清を廃棄し、心筋細胞支持培地を加えて、0.6 × 105 細胞/μLの濃度に再懸濁します。
- 再懸濁したhiPSC-CMを入れた遠沈管を37°Cで注入用に準備しておきます14,17,18,19,20。
- マウスをイソフルランで接続された麻酔ボックスに入れて麻酔薬の吸入を誘発し、続いて麻酔下での乾燥を防ぐために目に獣医軟膏を使用します。
注:イソフルラン濃度は5%であった。実験中は実験室の換気に注意してください。 - マウスを手術台に平らに置いたときにつまんだ後の足と尾の領域の反射の喪失を探し、十分な麻酔を示します。ブプレノルフィン(0.1 mg / kg)を腹腔内に投与します。.
- マウスの首の中央と左胸の毛を脱毛クリームで塗りつけ、5分後にガーゼで塗布したクリームと髪を拭き取ります。
- 手足とマウスの尾をテープで固定します。マウス切歯を2-0の絹糸とテープで固定します。手術領域(正中頸部と左胸部)をベタジンとそれに続くアルコールの3ラウンド交互に消毒します。
- 滅菌された手術領域の周りに外科用ドレープを置きます。次に、細かい解剖学的ハサミと細かい解剖鉗子を使用して正中頸部を切開し、気管を完全に露出させます。必要に応じて、安定化のためにいくつかの前頸部筋肉を切り取ります。
注:オペレーターは動物群を知らされていませんでした。 - 気管チューブ(20Gカテーテル穿刺針)を口から挿入します。
- 気管チューブを人工呼吸器に接続し、胸部の動きをチェックして、両方の肺が十分に換気されていることを確認します。
- 呼吸パラメータを調整します(呼吸数:100〜150 bpm、一回換気量250〜300μL)。その後、左後肢を右下に固定し直し、左上肢周りのテープを緩め、細かい解剖ハサミと鉗子を使用して左胸部の3〜4肋間腔で開胸を行い、心臓の露出を最大化します。
- 鉗子を用いて顕微鏡下で心膜を剥離し、左心房付属器の下端にある左前下行冠動脈(LAD)を可視化する。
- 6-0シルク糸を使用して、LADの近位端を結紮します。急性MIモデルが適切に確立されていることを確認した後(結紮部位の遠位LADが赤から白に変化した場合)、胸部を層ごとに閉じ、4-0スレッドの断続的なステッチで皮膚を縫合します。結紮を除く偽の動物群のMI誘導のための上記のすべての外科的処置を実行する。
- 吸入麻酔をオフにし、マウスが自発呼吸を再開した後にカニューレを取り外し、ケージに戻します。胸骨横臥を維持するのに十分な意識を取り戻すまで動物を監視します。完全に回復するまで、他の動物の会社に戻さないでください。術後12時間ごとにブプレノルフィン(0.1 mg / kg x 3日)とカルプロフェン(5 mg / kg x 1日)の腹腔内注射を投与します。.
- hiPSC-CMを投与する3日前にシクロスポリンA(10mg・kg-1・day-1)をマウスの腹腔内に注射し、移植細胞の拒絶反応を防ぎます。移植後1ヶ月間シクロスポリンAを連続して注射する。
3.超音波ガイダンス下でのhiPSC-CM注射
- MIモデルをセットアップした後、MIモデルマウス(12週齢のC57BL / 6マウス、体重22gから24g、50%の男性と50%の女性)を単回投与(SD、この研究ではn = 8)および複数回投与(MD、この研究ではn = 8)のグループに割り当て、MI後の1週目と2週目に、吸入麻酔の誘導のために5%イソフルランに接続された麻酔ボックスに入れ、その後気管挿管。
- マウスの胸部と上腹部の毛を脱毛クリームで塗り、5分後にガーゼでクリームを拭き取ります。手術盤上でマウスの心拍数を監視し、心拍数が400〜500bpmに維持されるまで吸入イソフルランを投与する。
- マウスの手足と尾を検出コンソールのテープで固定し、プラットフォームの温度を37°Cに設定します。
- 上腹部に特別な超音波ゼリーを塗布し、より小さな高解像度の獣医用超音波プローブを使用してマウスの肝臓画像を取得します。
- 人工呼吸器のレートを50bpmに下げます。5 μLマイクロシリンジを使用して、~3 × 105セルを描画します(ステップ2.1から)。マイクロマニピュレーターでシリンジを保持し、左側の傍剣状突起に3 mmの針を挿入します(図1A)。超音波ガイダンスの下で横隔膜の上端をたどり(図1B)、呼吸のリズムと範囲を観察し(図1C、D)、呼気サイクルの終わりに心膜に入り、肝臓と肺への損傷を回避します(図1D)。
- マイクロインジェクターニードルが心膜腔に入ったら、呼吸数を元のパラメータ(150 bpm)に調整します。製造者説明書17に従ってM型心エコー検査によりマウス心臓の胸骨傍長軸画像を取得する(図1E)。超音波ガイダンスの下で、梗塞部位の3つの辺縁領域(注入部位あたり1×105細胞)に3×105細胞(図1F)を注入する。
- 特別な超音波プローブを取り外し、ゼリーを洗い流します。マウスを吸入麻酔から離し、完全に意識した後、ケージに戻します。
- MD群マウスについてMIを確立してから1週間後および2週間後に上記の超音波ガイド下細胞注入手順を繰り返す。
4. 左前下行枝結紮30日後のマウスにおける心機能、蛍光標識、移植細胞数、心筋梗塞領域、臓器ヒトミトコンドリア検出の評価
- 心機能評価
- 誘導吸入麻酔のためにマウスをイソフルラン結合麻酔ボックスに入れ、続いて麻酔下での乾燥を防ぐために目に獣医軟膏を使用します。マウスの左胸の毛を脱毛クリームで取り除きます。マウスを操作パネルに置いて心拍数を監視し、イソフルラン吸入を調整します。マウスの心拍数を400〜500bpmに維持します。実験エンドポイントは30日目(MI誘導後)です。
- マウスの手足と尾を検出コンソールのテープで固定し、プラットフォームの温度を37°Cに設定します。
- 特別な超音波ゲルを前心領域に塗布した後、(獣医)高解像度心臓超音波プローブを使用して、製造元の指示に従ってM型およびB型の心エコー検査で胸骨傍長軸および2次元短軸画像を取得します17。
- 超音波検出が完了したら、特殊な超音波ゲルを洗い流し、吸入麻酔をオフにし、完全な意識の後にマウスをケージに戻します。
- 得られたデータを解析し、解析ソフトを用いて左室駆出率(EF)と分数短縮率(FS)を算出する。操作者が実験群17を盲検化されていることを確認する。
- 切片の蛍光標識
- 単離した心臓をPBSで洗浄し、4%パラホルムアルデヒドに4°Cで12時間浸します。心臓を取り出し、30%スクロースに24時間浸して脱水します。
- ドライアイスに最適な切断温度(OCT)コンパウンドで脱水した心臓を埋め込みます。心臓を下から頂点までクライオスタットの厚さ10μmでスライスし、切片をスライドに置き、スライドを-20°Cで保存します。
- スライドを心臓組織でPBSで3分間洗浄します。
- スライド上の組織を0.5%Triton X-100で室温で8分間透過処理し、洗浄ごとにPBSで5分間3回洗浄します。
- 組織を10%ロバ血清および90%PBS(ブロッキング溶液)で覆った後、室温で1時間切片をブロックします。
- ブロッキング溶液を除去した後、切片を一次抗体(ブロッキング溶液で1:100に希釈)で4°Cで一晩インキュベートします。 洗浄ごとに3分間PBSで5回洗浄します。
- スライド上の組織を蛍光色素標識二次抗体(ブロッキング溶液で1:100に希釈)で室温で1時間インキュベートします。
注:この時点以降、蛍光色素を結合した二次抗体を含む組織を光にさらさないでください。 - スライドをPBSで3回、洗浄ごとに5分間洗浄します。
- 4',6-ジアミジノ-2-フェニルインドール(DAPI)含有封入剤を用いてスライドをマウントし、蛍光顕微鏡下で写真撮影した17。
- 移植されたhiPSC-CMは17個
- 歩行者特異的トロポニンT(hcTnT)、ヒト核抗原(HNA)、および非特異的サルコメアアルファアクチニンについて、心臓の凍結切片に対して組織免疫蛍光染色を実行します。
- 心臓全体を連続切片化した後、蛍光標識のために50切片ごとに1切片を取ります。
- スライスごとに5つの高倍率画像をランダムにキャプチャします。グラフト視野数をカウントし、単位面積あたりの平均グラフト細胞数を算出し、A1/μm2とする。ImageJ(https://imagej.nih.gov/ij/)を用いてスライスの総グラフト面積を算出し、このスライスのグラフト数=A1×B121,22となるようにB1μm2とする。
- 50のセクション21,22ごとに1つのセクションが選択されたと仮定して、Eq(1)を使用してマウス心臓あたりの移植細胞の総数を計算し、Eq(2)を使用して生着率パーセントを計算します。
- マウス心臓あたりの移植細胞の総数=(A1 × B1 + A2 × B2 +...+ × Bn) × 50 (1)
生着率=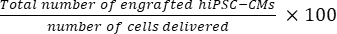 (2)
(2)
注:配達数は、SDグループで3 × 105 、MDグループで3 × 3 × 105 でした。
- 心筋梗塞領域の評価
- 単離した心臓の断面凍結切片(短軸)を、頂点から心臓の基部までの厚さ10μmで切り取ります。
- 心臓全体を連続切片にした後、30切片ごとに1つの切片スライドを取り、58°Cに予熱したブアン溶液に固定します。 製造元の指示に従って、0.04%ダイレクトレッドおよび0.1%ファストグリーンコラーゲン染色(PBSで希釈)で切片を染色します17。
- ソフトウェア(ImageJなど)を使用して、顕微鏡下で心臓の断面全身写真をEq(3):14,17を使用して分析します。
梗塞面積 % =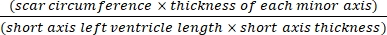 × 100% (3)
× 100% (3)
- 様々な臓器におけるヒトミトコンドリアDNAの検出
- マウスを5%イソフルランで麻酔し、後頸部脱臼によってマウスを犠牲にする。細胞移植の4週間後にマウスを解剖する。臓器(肝臓、肺、脳、腎臓、脾臓)と心筋の一部(このセクションではn = 3)を採取します。
- 各臓器組織を液体窒素で粉砕し、製造元の指示に従って参照キット( 材料表を参照)を使用して組織からDNAを抽出します。
- 製造元の指示に従って、参照されているキットとプライマー( 材料の表を参照)を使用して、上記の組織中のヒトミトコンドリアDNAを検出します(ステップ4.5.1から)。
結果
各群のマウスの左心室機能を評価するための心エコー検査により、MD群ではMI損傷が効果的に逆転していることが明らかになりました(図2A)。MI群と比較して、SD群は駆出率(EF)の増加を示しました(30%から35%; 図2B)およびフラクションショートニング(FS)(18%から22%; 図2C)MIの後。しかし、MD群マウスにおけるhiPSC-CMの複数回注射は経?...
ディスカッション
この研究の重要なステップには、hiPS細胞培養、心筋細胞の分化、hiPSC-CM精製、およびマウス心筋梗塞部位へのhiPSC-CM移植が含まれます。心筋超音波を用いて、hiPSC-CMを注入した梗塞の端にある梗塞部位に経皮的に治療を誘導することがポイントとなります。
培養時間の延長に伴い、hiPSC-CM表現型は、時間とともに分化し、形態(より大きな細胞サイズ)、構造(筋肉、フィブ?...
開示事項
著者は開示するものは何もありません。
謝辞
この研究は、中国国家自然科学財団の主要研究計画(第91539111号からJY)、湖南省科学技術重点プロジェクト(第2020SK53420号からJY)、湖南省科学技術イノベーションプログラム(2021RC2106からCF)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| Antibody | |||
| Cardiac troponin T | Abcam | ab8295 | |
| Donkey Anti-Mouse IgG H&L (Alexa Fluor 488) | Abcam | ab150105 | |
| Donkey Anti-Mouse IgG H&L (Alexa Fluor 555) | Abcam | ab150110 | |
| Donkey Anti-Rabbit IgG H&L (Alexa Fluor 488) | Abcam | ab150073 | |
| Donkey Anti-Rabbit IgG H&L (Alexa Fluor 555) | Abcam | ab150062 | |
| Human cardiac troponin T | Abcam | ab91605 | |
| Isolectin B4 | Vector | FL-1201 | |
| Sarcomeric alpha actinin | Abcam | ab9465 | |
| Wheat germ agglutinin | Thermo Fisher Scientific | W11261 | |
| Reagent | |||
| Accutase | Thermo Fisher Scientific | 00-4555-56 | |
| B27 Supplement(minus insulin) | Thermo Fisher Scientific | A1895601 | |
| B27 Supplement(serum free) | Thermo Fisher Scientific | 17–504-044 | |
| Bouin's solution | Thermo Fisher Scientific | SDHT10132 | |
| CHIR99021 | Selleck | CT99021 | |
| cyclosporin A | Medchemexpress | HY-B0579 | |
| DIRECT RED | Sigma-Aldrich | 365548-25G | |
| DMEM/F12 | Thermo Fisher Scientific | 11320033 | |
| DNeasy Blood & Tissue Kit | Qiagen | 69504 | |
| FAST GREEN FCF | Sigma-Aldrich | F7252-5G | |
| Glucose-free RPMI 1640 | Thermo Fisher Scientific | 11879020 | |
| IWR1 | Selleck | S7086 | |
| lactic acid | Sigma-Aldrich | L6661 | |
| Matrigel | BD Biosciences | BD356234 | |
| mTeSR1 | Stem Cell Technologies | 72562 | |
| O.C.T. Compound | SAKURA | 4583 | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| PowerUP SYBR Green MasterMix kit | Thermo Fisher Scientific | A25742 | |
| RPMI1640 | Thermo Fisher Scientific | 11875119 | |
| STEMdif Cardiomyocyte Freezing Medium/STEMdiff | Stem Cell Technologies | 5030 | |
| STEMdiff Cardiomyocyte Support Medium | Stem Cell Technologies | 5027 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| ultrasound coupling agent | CARENT | 22396269389 | |
| Y-27632 | Selleck | S6390 | |
| Equipment and Supplies | |||
| Applied Biosystems | Thermo Fisher Scientific | 7500 Real-Time PCR | |
| cryostat | Leica | CM1950 | |
| fluoresence microscope | Olympus | IX83 | |
| fine anatomical scissors | Fine Science Tools | 15000-08 | |
| fine dissecting forceps | Fine Science Tools | 11255-20 | |
| Micro syringe | Hamilton | 7633 | |
| Small animal anesthesia machine | MATRX | VMR | |
| Ultra-high resolution small animal ultrasound imaging system | VisualSonics | Vevo 2100 | |
| Software | |||
| Statistical Product and Service Solutions | IBM | 21 | |
| Image J | NIH | 1.48 | |
| Human mitochondrial DNA primers | |||
| the forward primer sequence | CCGCTACCATAATCATCGCTAT | ||
| the reverse primer sequence | TGCTAATACAATGCCAGTCAGG |
参考文献
- Leuschner, F., et al. Rapid monocyte kinetics in acute myocardial infarction are sustained by extramedullary monocytopoiesis. The Journal of Experimental Medicine. 209 (1), 123-137 (2012).
- Lázár, E., et al. Cardiomyocyte renewal in the human heart: insights from the fall-out. European Heart Journal. 38 (30), 2333-2342 (2017).
- Davis, M. K., et al. State of the art: cardiac transplantation. Trends in Cardiovascular Medicine. 24 (8), 341-349 (2014).
- Mancini, D., Colombo, P. C. Left ventricular assist devices: A rapidly evolving alternative to transplant. Journal of the American College of Cardiology. 65 (23), 2542-2555 (2015).
- Zimmermann, W. H. Translating myocardial remuscularization. Circulation Research. 120 (2), 278-281 (2017).
- Hu, X., et al. A large-scale investigation of hypoxia-preconditioned allogeneic mesenchymal stem cells for myocardial repair in nonhuman primates: Paracrine activity without remuscularization. Circulation Research. 118 (6), 970-983 (2016).
- Kempf, H., et al. Cardiac differentiation of human pluripotent stem cells in scalable suspension culture. Nature Protocols. 10 (9), 1345-1361 (2015).
- Chong, J. J., et al. Human embryonic-stem-cell-derived cardiomyocytes regenerate non-human primate hearts. Nature. 510 (7504), 273-277 (2014).
- Shiba, Y., et al. Allogeneic transplantation of iPS cell-derived cardiomyocytes regenerates primate hearts. Nature. 538 (7625), 388-391 (2016).
- Nguyen, P. K., et al. Potential strategies to address the major clinical barriers facing stem cell regenerative therapy for cardiovascular disease: A review. JAMA Cardiology. 1 (8), 953-962 (2016).
- Zimmermann, W. H. Remuscularization of the failing heart. The Journal of Physiology. 595 (12), 3685-3690 (2017).
- Hu, X., et al. Transplantation of hypoxia-preconditioned mesenchymal stem cells improves infarcted heart function via enhanced survival of implanted cells and angiogenesis. The Journal of Thoracic and Cardiovascular Surgery. 135 (4), 799-808 (2008).
- Feng, Y., et al. Heat shock improves Sca-1+ stem cell survival and directs ischemic cardiomyocytes toward a prosurvival phenotype via exosomal transfer: a critical role for HSF1/miR-34a/HSP70 pathway. Stem Cells. 32 (2), 462-472 (2014).
- Fan, C., et al. Cardiomyocytes from CCND2-overexpressing human induced-pluripotent stem cells repopulate the myocardial scar in mice: A 6-month study. Journal of Molecular and Cellular Cardiology. 137, 25-33 (2019).
- Lou, X., et al. N-cadherin overexpression enhances the reparative potency of human-induced pluripotent stem cell-derived cardiac myocytes in infarcted mouse hearts. Cardiovascular Research. 116 (3), 671-685 (2020).
- Sun, X., et al. Transplanted microvessels improve pluripotent stem cell-derived cardiomyocyte engraftment and cardiac function after infarction in rats. Science Translational Medicine. 12 (562), (2020).
- Wu, X., et al. Cardiac repair with echocardiography-guided multiple percutaneous left ventricular intramyocardial injection of hiPSC-CMs after myocardial infarction. Frontiers in Cardiovascular Medicine. 8, 768873 (2021).
- Kannappan, R., et al. Functionally competent DNA damage-free induced pluripotent stem cell-derived cardiomyocytes for myocardial repair. Circulation. 140 (6), 520-522 (2019).
- Lou, X., et al. N-cadherin overexpression enhances the reparative potency of human-induced pluripotent stem cell-derived cardiac myocytes in infarcted mouse hearts. Cardiovascular Research. 116 (3), 671-685 (2020).
- Zhao, M., et al. Y-27632 preconditioning enhances transplantation of human-induced pluripotent stem cell-derived cardiomyocytes in myocardial infarction mice. Cardiovascular Research. 115 (2), 343-356 (2019).
- Zhao, M., et al. Enhancing the engraftment of human induced pluripotent stem cell-derived cardiomyocytes via a transient inhibition of rho kinase activity. Journal of Visualized Experiments: JoVE. (149), e59452 (2019).
- O'Brien, J., Hayder, H., Peng, C. Automated quantification and analysis of cell counting procedures using ImageJ plugins. Journal of Visualized Experiments: JoVE. (117), e54719 (2016).
- Kain, V., Prabhu, S. D., Halade, G. V. Inflammation revisited: inflammation versus resolution of inflammation following myocardial infarction. Basic Research in Cardiology. 109 (6), 444 (2014).
- Rainer, P. P., et al. Cardiomyocyte-specific transforming growth factor β suppression blocks neutrophil infiltration, augments multiple cytoprotective cascades, and reduces early mortality after myocardial infarction. Circulation Research. 114 (8), 1246-1257 (2014).
- Yu, Y., et al. Human embryonic stem cell-derived cardiomyocyte therapy in mouse permanent ischemia and ischemia-reperfusion models. Stem Cell Research & Therapy. 10 (1), 167 (2019).
- Iwanaga, K., et al. Effects of G-CSF on cardiac remodeling after acute myocardial infarction in swine. Biochemical and Biophysical Research Communications. 325 (4), 1353-1359 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved