Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Индуцированная имплантация плюрипотентных стволовых клеток под контролем УЗИ у мышей с инфарктом миокарда
В этой статье
Резюме
Доставка клеток под контролем УЗИ вокруг места инфаркта миокарда у мышей является безопасным, эффективным и удобным способом трансплантации клеток.
Аннотация
Основной целью клеточной терапии после инфаркта миокарда (ИМ) является эффективное повышение скорости пересадки клеток, а индуцированные плюрипотентными стволовыми клетками человека кардиомиоциты (hiPSC-CM) являются перспективным источником клеток для восстановления сердца после ишемического повреждения. Однако низкая скорость пересадки является существенным препятствием для эффективной регенерации сердечной ткани после трансплантации. Этот протокол показывает, что многократные чрескожные инъекции hiPSC-CM под ультразвуковым контролем в область ИМ эффективно увеличивают частоту трансплантации клеток. В исследовании также описывается весь процесс культивирования hiPSC-CM, предварительная обработка и методы чрескожной доставки под ультразвуковым контролем. Кроме того, использование митохондриальной ДНК человека помогает обнаружить отсутствие hiPSC-CM в других органах мыши. Наконец, в этой статье описываются изменения сердечной функции, ангиогенеза, размера клеток и апоптоза в инфарктной пограничной зоне у мышей через 4 недели после доставки клеток. Можно сделать вывод, что чрескожная инъекция миокарда левого желудочка под контролем эхокардиографии является осуществимой, относительно инвазивной, удовлетворительной, воспроизводимой и эффективной клеточной терапией.
Введение
При возникновении острого ИМ клетки миокарда в области инфаркта быстро погибают из-за ишемии и гипоксии. Несколько воспалительных факторов высвобождаются после гибели и разрыва клеток, в то время как воспалительные клетки проникают в место инфаркта, вызывая воспаление1. Примечательно, что фибробласты и коллаген, не обладающие сократительной способностью и электропроводностью, заменяют клетки миокарда в месте инфаркта с образованием рубцовой ткани. Из-за ограниченной способности к регенерации кардиомиоцитов у взрослых млекопитающих жизнеспособная ткань, образовавшаяся после большой площади инфаркта, обычно недостаточна для поддержания достаточного сердечного выброса2. Инфаркт миокарда вызывает сердечную недостаточность, и в тяжелых случаях сердечной недостаточности пациенты могут полагаться только на трансплантацию сердца или вспомогательные желудочковые устройства для поддержания нормальных функций сердца 3,4.
После инфаркта миокарда идеальной стратегией лечения является замена мертвых кардиомиоцитов новообразованными кардиомиоцитами, образующими электромеханическую связь со здоровыми тканями. Тем не менее, варианты лечения, как правило, предусматривают спасение миокарда, а не замену. В настоящее время терапия на основе стволовых клеток и клеток-предшественников является одной из наиболее перспективных стратегий для содействия восстановлению миокарда после ИМ5. Однако трансплантация этих клеток имеет несколько проблем, в первую очередь неспособность взрослых стволовых клеток дифференцироваться в кардиомиоциты и их короткую продолжительность жизни6.
Этические проблемы, связанные с использованием эмбриональных стволовых клеток (ES), могут быть обойдены с помощью ИПСК, которые являются многообещающим источником клеток. Кроме того, ИПСК обладают сильными способностями к самообновлению и могут дифференцироваться в кардиомиоциты7. Исследования показали, что hiPSC-CM, трансплантированные в сайт ИМ, могут выживать и образовывать щелевые соединения с клетками-хозяевами 8,9. Однако, поскольку эти трансплантированные клетки находятся в микроокружении ишемии и воспаления, их выживаемость крайне низка10,11.
Было установлено несколько методов для повышения выживаемости трансплантированных клеток, таких как предварительная обработка трансплантированных клеток при гипоксии и тепловом шоке12,13, генетическая модификация 14,15 и одновременная трансплантация клеток и капилляров 16. К сожалению, большинство методов ограничены сложностью и дороговизной. Таким образом, в настоящем исследовании предлагается воспроизводимый, удобный, относительно инвазивный и эффективный метод доставки hiPSC-CM.
Инъекция клеток интрамиокарда под ультразвуковым контролем может быть выполнена только с помощью небольшого ветеринарного ультразвукового аппарата высокого разрешения и микроинжектора, независимо от места. Под ультразвуковым контролем непосредственная доставка клеток под мечевидным отростком из перикарда в миокард у мышей является безопасным протоколом, позволяющим избежать повреждения печени и легких. Этот метод можно комбинировать одновременно с другими технологиями, чтобы значительно улучшить выживаемость трансплантированных клеток.
протокол
Все эксперименты на животных в этом исследовании были рассмотрены и одобрены комитетом по этике Второй больницы Сянъя Центрального Южного университета. Подробную информацию обо всех материалах и оборудовании, используемых в этом протоколе, см. в таблице материалов . Сроки инъекции клеток, визуализации и эвтаназии следующие: t0 - индуцировать инфаркт, t1 неделя - изображение и имплантационные клетки, t2 недели - изображение и имплантационные клетки, t4 недели - окончательная визуализация, эвтаназия и сбор тканей.
1. Культура ИПСК, дифференцировка кардиомиоцитов и очистка клеток
- Смешайте ДМЭМ/F12 и исходный раствор матричной основы базальной мембраны со льдом при температуре 4 °C в соотношении 1,5:1, аликвота, и храните полученную смесь (разбавитель матрицы) при -20 °C. Тщательно смешайте 25 мл питательной среды DMEM/F12 при 4 °C и 1 мл матричного разбавителя со льдом и распределите 1 мл на лунку в 6-луночном планшете. Держите пластину в вертикальном положении в течение 1 часа в инкубаторе при температуре 37 °C и аспирируйте надосадочную жидкость DMEM/F12 из лунок. Не прикасайтесь к дну 6-луночной пластины при выполнении процедуры.
- Извлеките криоконсервационную трубку, содержащую ИПСК, из жидкого азота и быстро разморозьте их на водяной бане с температурой 37 °C. Стерилизуйте внешнюю поверхность пробирки для криоконсервации 75% спиртом, вытрите спирт и перенесите пробирку на стерильный ультрачистый стол.
- С помощью пипетки осторожно перенесите раствор криоконсервации, содержащий ИПСК, в центрифужную пробирку объемом 15 мл, добавьте 5 мл среды ES, не содержащей питателя, и центрифугируйте суспензию при 300 × г в течение 3 мин при комнатной температуре. Откажитесь от надосадочной жидкости и осторожно ресуспендируйте клетки в 6 мл среды ES, не содержащей фидера. Подсчитайте клетки и отрегулируйте концентрацию клеток до 5 × 105 клеток/мл с питательной средой.
- Добавьте ингибитор ROCK (Y27632) к ИПСК до конечной концентрации 5 мкМ. Перенесите ИПСК с Y27632 на 6-луночную пластину, предварительно обработанную матрицей базальной мембраны, и осторожно закрутите 6-луночную пластину, прослеживая форму числа «8», чтобы равномерно распределить ИПСК. Поместите ИПСК во влажный инкубатор с температурой 37 °C с 5% CO2 в вертикальном положении на 24 часа. Замените надосадочную жидкость средой ES, не содержащей питателя, без Y27632.
- Когда hiPSC достигают 80% степени слияния, аспирируйте супернатант культуры, дважды промойте клетки фосфатно-буферным физиологическим раствором (PBS), добавьте безинсулиновый RPMI1640 + B27, содержащий 10 мкМ CHIR99021 (ингибитор GSK3-β), и поместите hiPSC во влажный инкубатор CO2 при 37 ° C на 24 часа.
- Замените половину надосадочной жидкости средой RPMI1640 + B27 без инсулина и инкубируйте клетки еще 24 ч.
- Полностью замените питательную среду на RPMI1640 + B27 (без инсулина). Поместите планшеты во влажный инкубатор при температуре 37 °C с 5% CO2 в вертикальном положении на 24 часа.
- Через 3 дня полностью замените питательную среду безинсулиновым RPMI1640 + B27 + 5 мкМ IWR1 (ингибитор сигнального пути Wnt) и поместите планшеты во влажный инкубатор при 37 °C с 5%CO2 на 48 ч.
- Замените питательную среду через 5 дней на RPMI1640 + B27 без инсулина и продолжайте инкубацию в течение 48 ч во влажном инкубаторе CO2 при 37 °C.
- Замените питательную среду средой RPMI + B27 (включая инсулин) через 7 дней и поместите планшеты в увлажненный инкубатор CO2 на 3 дня при 37 ° C. Заменяйте носитель на носитель RPMI + B27 каждые 3 дня. Ищите самопроизвольное биение клеток на 9-12 день дифференцировки.
- После наблюдения за пульсирующими клетками замените среду RPMI + B27 на безглюкозную среду RPMI 1640, содержащую молочную кислоту (1 мл молочной кислоты добавляют к 500 мл среды RPMI 1640 без глюкозы). Инкубируйте клетки в течение 72 ч во влажном инкубаторе при 37 °C с 5%CO2.
- Через 72 ч замените надосадочную жидкость средой RPMI + B27 и инкубируйте в течение 48 ч во влажном инкубаторе при 37 °C с 5%CO2.
- Аспирируйте надосадочную жидкость культуры под отрицательным давлением и промойте клетки 3 раза PBS, чтобы удалить следы питательной среды. Используйте смесь ферментов для отсоединения клеток для диссоциации hiPSC-CM в отдельные клетки при 37 ° C. Собранные клетки соберите в центрифужную пробирку объемом 15 мл, содержащую 3 мл поддерживающего раствора кардиомиоцитов, центрифугу при 300 × г в течение 2 мин при комнатной температуре и выбросьте надосадочную жидкость.
- Ресуспендируют клетки средой RPMI + B27, высевают их на 6-луночные планшеты с матричным покрытием базальной мембраны и инкубируют в течение 48 ч во влажном инкубаторе при 37 °C с 5%CO2.
- Замените культуральную надосадочную жидкость для очистки безглюкозной средой RPMI 1640, содержащей молочную кислоту, и инкубируйте в течение 72 ч во влажном инкубаторе при 37 °C с 5%CO2.
- Замените надосадочную жидкость культуры средой RPMI + B27 и меняйте среду каждые 3 дня.
- Продолжайте вышеописанный процесс в течение 30 дней, заменив культуру надосадочной жидкостью на безглюкозную среду, содержащую молочную кислоту для дальнейшей очистки. Инкубируйте клетки в течение 3 дней с этой средой и замените надосадочную жидкость на RPMI + B27. Культивируйте клетки непрерывно в течение 30 дней, пока hiPSC-CM не будут стабильно биться, и используйте эти клетки для интрамиокардиальной инъекции мышам.
2. Подготовка hiPSC-CM и создание модели острого инфаркта миокарда у мышей
- Вакуум-аспирируют супернатант культуры из культивируемых hiPSC-CM в течение 60 дней, промывают клетки 3 раза PBS и диссоциируют hiPSC-CM на отдельные клетки при 37 ° C с помощью смеси ферментов отсоединения клеток (~ 3-5 мин). Соберите клетки в центрифужную пробирку объемом 15 мл, содержащую 5 мл среды RPMI + B27, и хорошо перемешайте перед подсчетом клеток, чтобы рассчитать общее количество клеток. Центрифугируют клеточную суспензию при 300 × г в течение 2 мин при комнатной температуре. Откажитесь от надосадочной жидкости и добавьте поддерживающую среду кардиомиоцитов для ресуспендирования до концентрации 0,6 ×10,5 клеток/мкл.
- Держите центрифужную пробирку, содержащую ресуспендированные hiPSC-CM, наготове при 37 °C для впрыска 14,17,18,19,20.
- Поместите мышей в анестезиологическую коробку, связанную с изофлураном, чтобы вызвать ингаляцию анестетика с последующим использованием ветеринарной мази на глазах, чтобы предотвратить сухость во время анестезии.
ПРИМЕЧАНИЕ: Концентрация изофлурана составляла 5%. Обратите внимание на лабораторную вентиляцию во время эксперимента. - Обратите внимание на потерю рефлексов в области ног и хвоста после ущипывания, когда мышь лежит плашмя на операционном столе, что указывает на достаточную анестезию. Вводят бупренорфин (0,1 мг/кг) внутрибрюшинно.
- Смажьте волосы на середине шеи и левой груди мышей кремом для депиляции, а нанесенный крем и волосы сотрите марлей через 5 минут.
- Зафиксируйте конечности и мышиный хвост скотчем. Зафиксируйте резцы мыши шелковой нитью 2-0 и скотчем. Стерилизуйте операционную область (срединную шею и левую грудную клетку) тремя чередующимися раундами бетадина с последующим добавлением алкоголя.
- Поместите хирургическую простыню вокруг стерилизованной хирургической области. Затем сделайте срединный разрез шеи, используя тонкие анатомические ножницы и тонкие рассекающие щипцы, чтобы полностью обнажить трахею. При необходимости отрежьте несколько передних шейных мышц для стабилизации.
ПРИМЕЧАНИЕ: Операторы были слепы к группам животных. - Вставьте трахеальную трубку (иглу для пункции катетера 20 г) через рот.
- Подключите трахеальную трубку к аппарату искусственной вентиляции легких и проверьте движение грудной клетки, чтобы убедиться, что оба легких хорошо вентилируются.
- Отрегулируйте параметры дыхания (частота дыхания: 100-150 уд/мин, дыхательный объем 250-300 мкл). После этого зафиксируйте левую заднюю конечность на нижней правой стороне, ослабьте ленту вокруг левой верхней конечности и выполните торакотомию в 3-4 межреберных промежутках левой грудной клетки с использованием тонких рассекающих ножниц и щипцов для максимального воздействия на сердце.
- Используя щипцы, снимите перикард под микроскопом, чтобы визуализировать левую переднюю нисходящую коронарную артерию (LAD) на нижнем краю ушка левого предсердия.
- Используйте шелковую нить 6-0, чтобы перевязать проксимальный конец LAD. Убедившись, что модель острого инфаркта миокарда адекватно установлена (когда дистальный LAD в месте перевязки меняется с красного на белый), закройте грудную клетку слой за слоем и зашите кожу прерывистыми швами 4-0. Выполните все вышеупомянутые хирургические процедуры для индукции индукции ИМ для фиктивной группы животных, за исключением перевязки.
- Отключите ингаляционную анестезию, удалите канюлю после того, как мышь возобновит спонтанное дыхание, и верните ее в клетку. Наблюдайте за животным до тех пор, пока оно не придет в сознание, достаточное для поддержания лежачего положения на грудине. Не возвращайте его в компанию других животных, пока он полностью не выздоровеет. Внутрибрюшинные инъекции бупренорфина (0,1 мг/кг х 3 дня) и карпрофена (5 мг/кг х 1 день) каждые 12 ч после операции.
- Вводят циклоспорин А (10 мг·кг-1·день-1) во внутрибрюшинную полость мышей за 3 дня до введения hiPSC-CM, чтобы предотвратить отторжение трансплантированных клеток. Вводите циклоспорин А непрерывно в течение 1 месяца после трансплантации.
3. Инъекция hiPSC-CM под ультразвуковым контролем
- После настройки модели инфаркта миокарда назначьте мышей модели инфаркта миокарда (12-недельные мыши C57BL/6; вес от 22 г до 24 г, 50% самцов и 50% женщин) в группы однократной дозы (SD, n = 8 в этом исследовании) и многократной дозы (MD, n = 8 в этом исследовании) в первый день после инфаркта миокарда и поместите их в первую и вторую недели после инфаркта миокарда в анестезиологическую коробку, соединенную с 5% изофлураном, для индукции ингаляционной анестезии с последующим интубация трахеи.
- Смажьте волосы на груди и верхней части живота мышей кремом для депиляции и сотрите крем марлей через 5 минут. Контролируйте частоту сердечных сокращений мыши на операционной панели и вводите ингаляционный изофлуран до тех пор, пока частота сердечных сокращений не будет поддерживаться на уровне 400-500 ударов в минуту.
- Закрепите конечности и хвост мыши лентой на консоли обнаружения и установите температуру платформы на 37 °C.
- Нанесите специальное ультразвуковое желе на верхнюю часть живота и используйте меньший ветеринарный ультразвуковой зонд высокого разрешения для получения изображений печени мыши.
- Уменьшите частоту вращения вентилятора до 50 ударов в минуту. Используйте микрошприц объемом 5 мкл для забора ~ 3 × 10клеток 5 (из шага 2.1). Держа шприц с микроманипулятором, введите иглу диаметром 3 мм в левый пара-мечевидный отросток (рис. 1А). Следуйте за верхним краем диафрагмы под ультразвуковым контролем (рис. 1B), наблюдайте за ритмом и диапазоном дыхания (рис. 1C, D) и входите в перикард в конце цикла выдоха, избегая повреждения печени и легких (рис. 1D).
- После того, как игла микроинжектора попадет в полость перикарда, отрегулируйте частоту дыхания до исходного параметра (150 уд/мин). Получите парастернальное длинноосное изображение сердца мыши с помощью эхокардиографии M-плесени в соответствии с инструкциямипроизводителя 17 (рис. 1E). Под ультразвуковым контролем вводят 3 × 10 5 клеток (рис. 1F) в три крайние области (1 × 105 клеток на место инъекции) места инфаркта.
- Снимите специальный ультразвуковой датчик и смойте желе. Отучите мышь от ингаляционной анестезии и верните ее в клетку после полного сознания.
- Повторите вышеуказанные процедуры инъекции клеток под ультразвуковым контролем через 1 и 2 недели после установления инфаркта миокарда для мышей группы МД.
4. Оценка функции сердца, флуоресцентная маркировка, количество трансплантированных клеток, область инфаркта миокарда и обнаружение митохондрий органа человека у мышей через 30 дней после перевязки левой передней нисходящей ветви
- Оценка функции сердца
- Поместите мышь в анестезиологическую коробку, подключенную к изофлурану, для индукционно-ингаляционной анестезии с последующим использованием ветеринарной мази на глаза, чтобы предотвратить сухость во время анестезии. Удалите волосы на левой груди мыши с помощью крема для депиляции. Положите мышь на панель управления, чтобы контролировать частоту сердечных сокращений и регулировать ингаляцию изофлурана. Поддерживайте частоту сердечных сокращений мыши на уровне 400-500 ударов в минуту. Экспериментальная конечная точка - 30-й день (после индукции ИМ).
- Закрепите конечности и хвост мыши лентой на консоли обнаружения и установите температуру платформы на 37 °C.
- После нанесения специального ультразвукового геля на переднюю область сердца используйте (ветеринарный) ультразвуковой датчик сердца высокого разрешения для получения парастернальных длинноосных и двумерных короткоосевых изображений при эхокардиографии М-формы и В-формы в соответствии с инструкциями производителя17.
- После того, как ультразвуковое обнаружение будет завершено, смойте специальный ультразвуковой гель, отключите ингаляционную анестезию и верните мышь в клетку отдельно после полного сознания.
- Проанализируйте полученные данные и рассчитайте фракцию выброса левого желудочка (EF) и фракционное укорочение (FS) с помощью программного обеспечения для анализа. Убедитесь, что оператор слеп к экспериментальным группам17.
- Флуоресцентная маркировка срезов
- Изолированное сердце промыть PBS, погрузить его в 4% параформальдегид при 4 °C на 12 ч. Выньте сердце и погрузите его в 30% сахарозу на 24 часа для обезвоживания.
- Поместите обезвоженное сердце с составом оптимальной температуры резки (OCT) на сухой лед. Нарежьте сердце снизу до вершины криостатом толщиной 10 мкм, поместите срезы на предметные стекла и храните предметные стекла при температуре -20 °C.
- Промойте предметные стекла сердечной тканью с помощью PBS в течение 3 минут.
- Пронизывайте ткань на предметных стеклах 0,5% Triton X-100 при комнатной температуре в течение 8 минут и стирайте их 3 раза с PBS в течение 5 минут за стирку.
- Покрыв ткань 10% ослиной сывороткой и 90% PBS (блокирующим раствором), заблокируйте срезы на 1 ч при комнатной температуре.
- После удаления блокирующего раствора инкубировать срезы с первичным антителом (разбавленным до 1:100 блокирующим раствором) в течение ночи при 4 °C. Стирайте их 3 раза с PBS в течение 5 минут на стирку.
- Инкубируют ткань на предметных стеклах с флуорофор-конъюгированным вторичным антителом (разбавленным до 1:100 блокирующим раствором) в течение 1 ч при комнатной температуре.
ПРИМЕЧАНИЕ: С этого момента избегайте воздействия света на ткани с флуорофор-конъюгированным вторичным антителом. - Стирайте предметные стекла 3 раза с помощью PBS в течение 5 минут на стирку.
- Установите предметные стекла с использованием 4',6-диамидино-2-фенилиндола, содержащего (DAPI)-содержащую монтажную среду, и сфотографируйте под флуоресцентным микроскопом17.
- Количество трансплантированных hiPSC-CM17
- Проведите тканевое иммунофлуоресцентное окрашивание замороженных участков сердца для пешеход-специфического тропонина Т (hcTnT), ядерного антигена человека (HNA) и неспецифического саркомерного альфа-актинина.
- После того, как все сердце было последовательно разделено, возьмите один срез на каждые 50 срезов для флуоресцентной маркировки.
- Случайным образом захватывайте пять изображений с большим увеличением на срез. Подсчитайте количество привитых полей зрения, рассчитайте среднее количество привитых клеток на единицу площади и установите их как A1/мкм 2. Рассчитайте общую привитую площадь среза с помощью ImageJ (https://imagej.nih.gov/ij/) и установите ее как B1мкм 2 так, чтобы привитое число в этом срезе = A1 × B121,22.
- Рассчитайте общее количество пересаженных клеток на сердце мыши с помощью Eq (1) и процентную частоту приживления с помощью Eq (2), учитывая, что из каждых 50 секций был выбран один срез21,22.
- Общее количество привитых клеток на сердце мыши = (A1 × B1 + A2 × B2 +...+ An × Bn) × 50 (1)
Коэффициент приживления =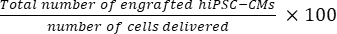 (2)
(2)
ПРИМЕЧАНИЕ: Количество поставок составило 3 × 10 5 для группы СД и 3 × 3 × 105 для группы МД.
- Оценка площади инфаркта миокарда
- Вырезают поперечный замороженный срез (короткую ось) изолированного сердца, от верхушки до основания сердца толщиной 10 мкм.
- После того, как все сердце будет последовательно разделено, возьмите одно предметное стекло для каждых 30 секций и зафиксируйте его в предварительно подогретом растворе Буэна при 58 ° C. Окрасьте срез 0,04% пятнами от коллагена Direct Red и 0,1% Fast Green (разбавленными в PBS) в соответствии с инструкциями производителя17.
- Используйте программное обеспечение (например, ImageJ) для анализа изображений после поперечного среза всего тела сердца под микроскопом с использованием эквалайзера (3):14,17
Площадь инфаркта % =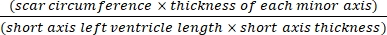 × 100% (3)
× 100% (3)
- Обнаружение митохондриальной ДНК человека в различных органах
- Обезболивают мышей 5% изофлураном и приносят их в жертву при вывихе задней шейки матки. Препарируют мышей через 4 недели после трансплантации клеток. Заготавливают органы (печень, легкие, мозг, почки, селезенка) и часть миокарда (n = 3 в этом разрезе).
- Измельчите каждую ткань органа в жидком азоте и извлеките ДНК из ткани, используя указанный набор (см. Таблицу материалов) в соответствии с инструкциями производителя.
- Следуйте инструкциям производителя, чтобы использовать указанный набор и праймеры (см. Таблицу материалов) для обнаружения митохондриальной ДНК человека в вышеупомянутых тканях (из шага 4.5.1).
Результаты
Эхокардиография для оценки функции левого желудочка мышей в каждой группе показала, что травмы ИМ были эффективно обращены вспять в группе МД (рис. 2А). По сравнению с группой ИМ в группе СД наблюдалась повышенная фракция выброса (ФВ) (с 30% до 35%; Рисунок 2В) и...
Обсуждение
Важнейшие этапы этого исследования включают культивирование hiPSC, дифференцировку кардиомиоцитов, очистку hiPSC-CM и трансплантацию hiPSC-CM в место инфаркта миокарда мыши. Ключевым моментом является использование ультразвука сердца для чрескожного направления лечения к месту инфаркта на к?...
Раскрытие информации
Авторам раскрывать нечего.
Благодарности
Эта работа была поддержана Крупным планом исследований Национального фонда естественных наук Китая (No 91539111 до JY), Ключевым проектом по науке и технологиям провинции Хунань (No 2020SK53420 до JY) и Программой научно-технических инноваций провинции Хунань (2021RC2106 до CF).
Материалы
| Name | Company | Catalog Number | Comments |
| Antibody | |||
| Cardiac troponin T | Abcam | ab8295 | |
| Donkey Anti-Mouse IgG H&L (Alexa Fluor 488) | Abcam | ab150105 | |
| Donkey Anti-Mouse IgG H&L (Alexa Fluor 555) | Abcam | ab150110 | |
| Donkey Anti-Rabbit IgG H&L (Alexa Fluor 488) | Abcam | ab150073 | |
| Donkey Anti-Rabbit IgG H&L (Alexa Fluor 555) | Abcam | ab150062 | |
| Human cardiac troponin T | Abcam | ab91605 | |
| Isolectin B4 | Vector | FL-1201 | |
| Sarcomeric alpha actinin | Abcam | ab9465 | |
| Wheat germ agglutinin | Thermo Fisher Scientific | W11261 | |
| Reagent | |||
| Accutase | Thermo Fisher Scientific | 00-4555-56 | |
| B27 Supplement(minus insulin) | Thermo Fisher Scientific | A1895601 | |
| B27 Supplement(serum free) | Thermo Fisher Scientific | 17–504-044 | |
| Bouin's solution | Thermo Fisher Scientific | SDHT10132 | |
| CHIR99021 | Selleck | CT99021 | |
| cyclosporin A | Medchemexpress | HY-B0579 | |
| DIRECT RED | Sigma-Aldrich | 365548-25G | |
| DMEM/F12 | Thermo Fisher Scientific | 11320033 | |
| DNeasy Blood & Tissue Kit | Qiagen | 69504 | |
| FAST GREEN FCF | Sigma-Aldrich | F7252-5G | |
| Glucose-free RPMI 1640 | Thermo Fisher Scientific | 11879020 | |
| IWR1 | Selleck | S7086 | |
| lactic acid | Sigma-Aldrich | L6661 | |
| Matrigel | BD Biosciences | BD356234 | |
| mTeSR1 | Stem Cell Technologies | 72562 | |
| O.C.T. Compound | SAKURA | 4583 | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| PowerUP SYBR Green MasterMix kit | Thermo Fisher Scientific | A25742 | |
| RPMI1640 | Thermo Fisher Scientific | 11875119 | |
| STEMdif Cardiomyocyte Freezing Medium/STEMdiff | Stem Cell Technologies | 5030 | |
| STEMdiff Cardiomyocyte Support Medium | Stem Cell Technologies | 5027 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| ultrasound coupling agent | CARENT | 22396269389 | |
| Y-27632 | Selleck | S6390 | |
| Equipment and Supplies | |||
| Applied Biosystems | Thermo Fisher Scientific | 7500 Real-Time PCR | |
| cryostat | Leica | CM1950 | |
| fluoresence microscope | Olympus | IX83 | |
| fine anatomical scissors | Fine Science Tools | 15000-08 | |
| fine dissecting forceps | Fine Science Tools | 11255-20 | |
| Micro syringe | Hamilton | 7633 | |
| Small animal anesthesia machine | MATRX | VMR | |
| Ultra-high resolution small animal ultrasound imaging system | VisualSonics | Vevo 2100 | |
| Software | |||
| Statistical Product and Service Solutions | IBM | 21 | |
| Image J | NIH | 1.48 | |
| Human mitochondrial DNA primers | |||
| the forward primer sequence | CCGCTACCATAATCATCGCTAT | ||
| the reverse primer sequence | TGCTAATACAATGCCAGTCAGG |
Ссылки
- Leuschner, F., et al. Rapid monocyte kinetics in acute myocardial infarction are sustained by extramedullary monocytopoiesis. The Journal of Experimental Medicine. 209 (1), 123-137 (2012).
- Lázár, E., et al. Cardiomyocyte renewal in the human heart: insights from the fall-out. European Heart Journal. 38 (30), 2333-2342 (2017).
- Davis, M. K., et al. State of the art: cardiac transplantation. Trends in Cardiovascular Medicine. 24 (8), 341-349 (2014).
- Mancini, D., Colombo, P. C. Left ventricular assist devices: A rapidly evolving alternative to transplant. Journal of the American College of Cardiology. 65 (23), 2542-2555 (2015).
- Zimmermann, W. H. Translating myocardial remuscularization. Circulation Research. 120 (2), 278-281 (2017).
- Hu, X., et al. A large-scale investigation of hypoxia-preconditioned allogeneic mesenchymal stem cells for myocardial repair in nonhuman primates: Paracrine activity without remuscularization. Circulation Research. 118 (6), 970-983 (2016).
- Kempf, H., et al. Cardiac differentiation of human pluripotent stem cells in scalable suspension culture. Nature Protocols. 10 (9), 1345-1361 (2015).
- Chong, J. J., et al. Human embryonic-stem-cell-derived cardiomyocytes regenerate non-human primate hearts. Nature. 510 (7504), 273-277 (2014).
- Shiba, Y., et al. Allogeneic transplantation of iPS cell-derived cardiomyocytes regenerates primate hearts. Nature. 538 (7625), 388-391 (2016).
- Nguyen, P. K., et al. Potential strategies to address the major clinical barriers facing stem cell regenerative therapy for cardiovascular disease: A review. JAMA Cardiology. 1 (8), 953-962 (2016).
- Zimmermann, W. H. Remuscularization of the failing heart. The Journal of Physiology. 595 (12), 3685-3690 (2017).
- Hu, X., et al. Transplantation of hypoxia-preconditioned mesenchymal stem cells improves infarcted heart function via enhanced survival of implanted cells and angiogenesis. The Journal of Thoracic and Cardiovascular Surgery. 135 (4), 799-808 (2008).
- Feng, Y., et al. Heat shock improves Sca-1+ stem cell survival and directs ischemic cardiomyocytes toward a prosurvival phenotype via exosomal transfer: a critical role for HSF1/miR-34a/HSP70 pathway. Stem Cells. 32 (2), 462-472 (2014).
- Fan, C., et al. Cardiomyocytes from CCND2-overexpressing human induced-pluripotent stem cells repopulate the myocardial scar in mice: A 6-month study. Journal of Molecular and Cellular Cardiology. 137, 25-33 (2019).
- Lou, X., et al. N-cadherin overexpression enhances the reparative potency of human-induced pluripotent stem cell-derived cardiac myocytes in infarcted mouse hearts. Cardiovascular Research. 116 (3), 671-685 (2020).
- Sun, X., et al. Transplanted microvessels improve pluripotent stem cell-derived cardiomyocyte engraftment and cardiac function after infarction in rats. Science Translational Medicine. 12 (562), (2020).
- Wu, X., et al. Cardiac repair with echocardiography-guided multiple percutaneous left ventricular intramyocardial injection of hiPSC-CMs after myocardial infarction. Frontiers in Cardiovascular Medicine. 8, 768873 (2021).
- Kannappan, R., et al. Functionally competent DNA damage-free induced pluripotent stem cell-derived cardiomyocytes for myocardial repair. Circulation. 140 (6), 520-522 (2019).
- Lou, X., et al. N-cadherin overexpression enhances the reparative potency of human-induced pluripotent stem cell-derived cardiac myocytes in infarcted mouse hearts. Cardiovascular Research. 116 (3), 671-685 (2020).
- Zhao, M., et al. Y-27632 preconditioning enhances transplantation of human-induced pluripotent stem cell-derived cardiomyocytes in myocardial infarction mice. Cardiovascular Research. 115 (2), 343-356 (2019).
- Zhao, M., et al. Enhancing the engraftment of human induced pluripotent stem cell-derived cardiomyocytes via a transient inhibition of rho kinase activity. Journal of Visualized Experiments: JoVE. (149), e59452 (2019).
- O'Brien, J., Hayder, H., Peng, C. Automated quantification and analysis of cell counting procedures using ImageJ plugins. Journal of Visualized Experiments: JoVE. (117), e54719 (2016).
- Kain, V., Prabhu, S. D., Halade, G. V. Inflammation revisited: inflammation versus resolution of inflammation following myocardial infarction. Basic Research in Cardiology. 109 (6), 444 (2014).
- Rainer, P. P., et al. Cardiomyocyte-specific transforming growth factor β suppression blocks neutrophil infiltration, augments multiple cytoprotective cascades, and reduces early mortality after myocardial infarction. Circulation Research. 114 (8), 1246-1257 (2014).
- Yu, Y., et al. Human embryonic stem cell-derived cardiomyocyte therapy in mouse permanent ischemia and ischemia-reperfusion models. Stem Cell Research & Therapy. 10 (1), 167 (2019).
- Iwanaga, K., et al. Effects of G-CSF on cardiac remodeling after acute myocardial infarction in swine. Biochemical and Biophysical Research Communications. 325 (4), 1353-1359 (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены