需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
超声引导诱导多能干细胞来源心肌细胞植入心肌梗死小鼠
摘要
在小鼠心肌梗死部位周围进行超声引导的细胞递送是一种安全、有效、方便的细胞移植方式。
摘要
心肌梗死(MI)后细胞治疗的主要目的是有效提高细胞移植率,人诱导多能干细胞来源的心肌细胞(hiPSC-CMs)是缺血性损伤后心脏修复的有希望的细胞来源。然而,低移植率是移植后有效心脏组织再生的重大障碍。该协议表明,多次hiPSC-CM超声引导经皮注射到MI区域可有效提高细胞移植率。该研究还描述了整个hiPSC-CM培养过程,预处理和超声引导的经皮递送方法。此外,使用人类线粒体DNA有助于检测其他小鼠器官中hiPSC-CMs的缺失。最后,本文描述了小鼠细胞递送后4周梗死边界区心脏功能、血管生成、细胞大小和细胞凋亡的变化。可以得出结论,超声心动图引导下经皮注射左心室心肌是一种可行、侵入性相对较强、令人满意、可重复且有效的细胞治疗。
引言
当急性心肌梗死发生时,梗死区域的心肌细胞因缺血和缺氧而迅速死亡。细胞死亡和破裂后释放几种炎症因子,而炎性细胞浸润梗死部位引起炎症1。值得注意的是,没有收缩性和导电性的成纤维细胞和胶原蛋白取代梗死部位的心肌细胞形成疤痕组织。由于成年哺乳动物心肌细胞的再生能力有限,大面积梗死后形成的活组织通常不足以维持足够的心输出量2。心肌梗死引起心力衰竭,在心力衰竭严重的情况下,患者只能依靠心脏移植或心室辅助装置来维持正常的心脏功能3,4。
心肌梗死后,理想的治疗策略是用新形成的心肌细胞替换死亡的心肌细胞,与健康组织形成机电耦合。然而,治疗方案通常采用心肌挽救而不是替代。目前,基于干细胞和祖细胞的疗法是MI5后促进心肌修复的最有希望的策略之一。然而,这些细胞的移植有几个问题,主要是成体干细胞无法分化成心肌细胞并且它们的寿命短6。
与使用胚胎干(ES)细胞相关的伦理问题可以通过iPSCs来规避,iPSCs是一种有希望的细胞来源。此外,iPSCs具有很强的自我更新能力,可以分化为心肌细胞7。研究表明,移植到MI位点的hiPSC-CMs可以存活并与宿主细胞形成间隙连接8,9。然而,由于这些移植的细胞位于缺血和炎症的微环境中,它们的存活率极低10,11。
已经建立了几种提高移植细胞存活率的方法,例如移植细胞的缺氧和热休克预处理12,13,基因修饰14,15以及同时移植细胞和毛细血管16。不幸的是,大多数方法都受到复杂性和高成本的限制。因此,本研究提出了一种可重复、方便、侵入性相对较强且有效的hiPSC-CM递送方法。
超声引导下心肌细胞注射只能用高分辨率小型兽医超声机和显微注射器进行,无论部位如何。在超声引导下,剑突下的细胞从心包直接输送到小鼠心肌是一种安全的方案,可以避免肝和肺损伤。该方法可以与其他技术同时使用,以显着提高移植细胞的存活率。
研究方案
本研究所有动物实验均经中南大学湘雅二医院伦理委员会审核通过。有关本协议中使用的所有材料和设备的详细信息,请参阅 材料表 。细胞注射,成像和安乐死的时间表如下:t0-诱导梗死,t1周-成像和植入细胞,t2周-成像和植入细胞,t4周-最终成像,安乐死和组织收集。
1. hiPSC培养、心肌细胞分化和细胞纯化
- 将DMEM / F12和基底膜基质储备溶液与冰在4°C下以1.5:1的比例等分混合,并将所得混合物(基质稀释剂)储存在-20°C。 将 25 mL DMEM/F12 培养基在 4 °C 和 1 mL 基质稀释剂与冰彻底混合,并在 6 孔板中铺展 1 mL/孔。将板在37°C的培养箱中直立1小时,并从孔中吸出DMEM / F12上清液。执行该程序时,请勿触摸6孔板的底部。
- 从液氮中取出含有hiPSC的冷冻保存管,并在37°C水浴中快速解冻。用75%的酒精对冷冻保存管的外表面进行消毒,擦去酒精,然后将管子转移到无菌超洁净台上。
- 使用移液管将含有hiPSCs的冷冻保存溶液轻轻转移到15 mL离心管中,加入5 mL无饲养层ES培养基,并在室温下以300 × g 离心悬浮液3分钟。弃去上清液并将细胞轻轻重悬于 6 mL 无饲养层 ES 培养基中。计数细胞并用培养基将细胞浓度调节至5×105 细胞/ mL。
- 将ROCK抑制剂(Y27632)加入hiPSC中至终浓度为5μM。 将带有Y27632的hiPSC转移到用基底膜基质预处理的6孔板中,轻轻旋转6孔板,追踪数字" 8"的形状以均匀分布hiPSC。将hiPSCs置于37°C,潮湿的培养箱中,5%CO2 直立放置24小时。用不含Y27632的无进料器ES培养基替换上清液。
- 当hiPSC达到80%汇合度时,吸出培养物上清液,用磷酸盐缓冲盐水(PBS)洗涤细胞两次,加入含有10μM CHIR99021(GSK3-β抑制剂)的无胰岛素RPMI1640 + B27,并将hiPSC置于37°C的潮湿CO2 培养箱中24小时。
- 用不含胰岛素的RPMI1640 + B27培养基替换一半的上清液,并将细胞再孵育24小时。
- 用RPMI1640 + B27(不含胰岛素)完全替换培养基。将板置于37°C的潮湿培养箱中,5%CO2 直立放置24小时。
- 3天后用无胰岛素RPMI1640 + B27 + 5μM IWR1(Wnt信号通路抑制剂)完全替换培养基,并将板置于37°C的潮湿培养箱中,5%CO248 小时。
- 5天后用不含胰岛素的RPMI1640 + B27替换培养基,并在37°C的潮湿CO2 培养箱中继续孵育48小时。
- 7天后用RPMI + B27(包括胰岛素)培养基替换培养基,并将板置于37°C的加湿CO2 培养箱中3天。 每 3 天用 RPMI + B27 培养基更换培养基。寻找细胞在分化9-12天时的自发跳动。
- 观察脉动细胞后,用含有乳酸的无葡萄糖RPMI 1640培养基(将1mL乳酸添加到500mL无葡萄糖RPMI 1640培养基中)替换RPMI + B27培养基。将细胞在37°C的潮湿培养箱中用5%CO2孵育72小时。
- 72小时后,用RPMI + B27培养基替换上清液,并在37°C的潮湿培养箱中用5%CO2孵育48小时。
- 在负压下吸出培养物上清液,并用PBS洗涤细胞3倍以除去痕量培养基。使用细胞分离酶混合物在37°C下将hiPSC-CMs解离成单个细胞。 将获得的细胞收集到含有3mL心肌细胞支持溶液的15mL离心管中,在室温下以300× g 离心2分钟,并弃去上清液。
- 用RPMI + B27培养基重悬细胞,将它们接种在基底膜基质包被的6孔板上,并在37°C的潮湿培养箱中用5%CO2孵育48小时。
- 用含有乳酸的无葡萄糖RPMI 1640培养基替换培养上清液进行纯化,并在37°C的潮湿培养箱中用5%CO2孵育72小时。
- 用RPMI + B27培养基替换培养上清液,每3天更换一次培养基。
- 继续上述过程30天,用含有乳酸的无葡萄糖培养基替换培养上清液以进一步纯化。用该培养基孵育细胞3天,并用RPMI + B27替换上清液。连续培养细胞30天,直到hiPSC-CMs稳定跳动,并使用这些细胞在小鼠中进行心肌内注射。
2. hiPSC-CMs的制备及小鼠急性心肌梗死模型的建立
- 从培养60天的hiPSC-CMs中真空吸出培养物上清液,用PBS洗涤细胞3倍,并在37°C下用细胞分离酶混合物(~3-5分钟)将hiPSC-CMs解离成单个细胞。将细胞收集在含有 5 mL RPMI + B27 培养基的 15 mL 离心管中,并在计数细胞之前充分混合以计算细胞总数。在室温下以300× g 离心细胞悬液2分钟。弃去上清液并加入心肌细胞支持培养基以重悬至0.6×105 个细胞/μL的浓度。
- 将含有重悬hiPSC-CMs的离心管保持在37°C下,以便进样14,17,18,19,20。
- 将小鼠置于与异氟醚连接的麻醉盒中以诱导麻醉吸入,然后在眼睛上使用兽医软膏以防止麻醉时干燥。
注意:异氟醚浓度为5%。实验过程中注意实验室通风。 - 当鼠标平放在手术台上时,捏住后寻找脚和尾部区域的反射丧失,表明麻醉充分。腹腔内给予丁丙诺啡(0.1mg / kg)。
- 用脱毛膏涂抹小鼠颈部中部和左胸部的毛发,5分钟后用纱布擦去涂抹的乳霜和毛发。
- 用胶带固定四肢和鼠标尾巴。用 2-0 丝线和胶带固定鼠标门牙。对手术区域(颈部正中和左胸部)进行消毒,先交替三轮服用甜菜碱,然后加酒。
- 在消毒的手术区域周围放置手术单。然后,使用精细解剖剪刀和精细解剖钳做一个正中颈部切口,以充分暴露气管。如有必要,切断一些颈椎前部肌肉以稳定。
注意:操作员对动物群体视而不见。 - 通过口腔插入气管插管(20 G 导管穿刺针)。
- 将气管插管连接到呼吸机并检查胸部运动,以确保双肺通气良好。
- 调整呼吸参数(呼吸频率:100-150 bpm,潮气量 250-300 μL)。之后,将左后肢重新固定到右下侧,松开左上肢周围的胶带,并使用精细的解剖剪刀和镊子在左胸的 3-4 肋间隙进行开胸术,以获得最大的心脏暴露。
- 使用镊子在显微镜下剥离心包,以观察左心耳下边缘的左前降冠状动脉 (LAD)。
- 使用 6-0 丝线连接 LAD 的近端。在确保充分建立急性心肌梗死模型后(当结扎部位的远端LAD从红色变为白色时),逐层闭合胸部,并用4-0线间歇缝合皮肤。对假动物组进行除结扎外的所有上述MI诱导外科手术。
- 关闭吸入麻醉,在小鼠恢复自主呼吸后取出套管,然后将其放回笼子中。监测动物,直到它恢复足够的意识以维持胸骨卧位。在完全康复之前,不要将其归还给其他动物。术后每12小时腹膜内注射丁丙诺啡(0.1mg / kg x 3天)和卡洛芬(5mg / kg x 1天)。
- 在给予hiPSC-CMs前3天将环孢菌素A(10mg·kg-1·day-1)注射到小鼠腹膜腔中,以防止移植细胞的排斥反应。移植后连续注射环孢菌素A1个月。
3. 超声引导下注射hiPSC-CM
- 建立MI模型后,将MI模型小鼠(12周龄C57BL / 6小鼠;体重22g至24g,50%雄性和50%雌性)分配到单剂量(SD,本研究中n = 8)和多剂量(MD,n = 8在本研究中)组在MI后的第一个天,并将它们放置在MI后的第一周和第二周,在与5%异氟醚连接的麻醉盒中,用于诱导吸入麻醉,然后气管插管。
- 用脱毛膏涂抹小鼠胸部和上腹部的毛发,5分钟后用纱布擦去乳膏。在操作板上监测鼠标的心率并给予吸入异氟醚,直到心率保持在400-500 bpm。
- 用胶带将鼠标四肢和尾巴固定在检测控制台上,并将平台温度设置为37°C。
- 在上腹部应用特殊的超声果冻,并使用较小的高分辨率兽医超声探头获得小鼠肝脏图像。
- 将呼吸机速率降低至 50 次/分。使用 5 μL 微量注射器抽取 ~3 × 105 个细胞(来自步骤 2.1)。用显微操纵器握住注射器,在左侧剑突处插入3毫米针头(图1A)。在超声引导下沿着横膈膜的上边缘(图1B),观察呼吸节律和范围(图1C,D),并在呼气周期结束时进入心包,避免损害肝和肺(图1D)。
- 显微注射器针进入心包腔后,将呼吸频率调节到原始参数(150 bpm)。根据制造商的说明17 ,通过M霉菌超声心动图获取小鼠心脏的胸骨旁长轴图像(图1E)。在超声引导下,将3×105 细胞(图1F)注射到梗死部位的三个边缘区域(每个注射部位1×105 个细胞)。
- 取下特殊的超声波探头并冲洗掉果冻。使小鼠脱离吸入麻醉,并在完全清醒后将其放回笼子。
- 在为MD组小鼠建立MI后1周和2周重复上述超声引导的细胞注射程序。
4.左前降支结扎术后30天小鼠心脏功能、荧光标记、移植细胞计数、心肌梗死区和器官人线粒体检测的评估
- 心脏功能评估
- 将鼠标放入异氟醚连接的麻醉盒中进行诱导吸入麻醉,然后在眼睛上使用兽医软膏以防止麻醉时干燥。用脱毛膏去除小鼠左胸部的毛发。将鼠标放在操作面板上以监测心率并调整异氟醚吸入。将小鼠心率维持在 400-500 bpm。实验终点是第30天(MI诱导后)。
- 用胶带将鼠标四肢和尾巴固定在检测控制台上,并将平台温度设置为37°C。
- 在心脏前部区域应用特殊的超声凝胶后,根据制造商的说明,使用(兽医)高分辨率心脏超声探头在M霉和B霉的超声心动图下获取胸骨旁长轴和二维短轴图像17。
- 超声检测完成后,冲洗掉专用超声凝胶,关闭吸入麻醉,完全清醒后将小鼠分别放回笼子。
- 分析获得的数据并使用分析软件计算左心室射血分数(EF)和分数缩短(FS)。确保操作人员对实验组不知情17.
- 切片的荧光标记
- 用PBS洗涤分离的心脏,将其浸入4°C的4%多聚甲醛中12小时。取出心脏,将其浸入30%蔗糖中24小时脱水。
- 将脱水的心脏与最佳切割温度 (OCT) 化合物嵌入干冰上。用10μm的低温恒温器从底部到顶点切开心脏,并将切片放在载玻片上并将载玻片储存在-20°C。
- 用PBS用心脏组织清洗载玻片3分钟。
- 在室温下用0.5%Triton X-100透化载玻片上的组织8分钟,每次洗涤用PBS洗涤3次5分钟。
- 用10%驴血清和90%PBS(封闭溶液)覆盖组织后,在室温下封闭切片1小时。
- 除去封闭溶液后,将切片与一抗(用封闭溶液稀释至1:100)在4°C孵育过夜。 用PBS洗涤3次,每次洗涤5分钟。
- 在载玻片上用荧光团偶联的二抗(用封闭溶液稀释至1:100)在室温下孵育组织1小时。
注意:从此时开始,避免将带有荧光团偶联二抗的组织暴露在光线下。 - 用PBS清洗载玻片3次,每次洗涤5分钟。
- 使用含4',6-二脒基-2-苯基吲哚(DAPI)的封片剂安装载玻片,并在荧光显微镜下拍照17。
- 移植的 hiPSC-CM 计数17
- 对心脏的冷冻切片进行行人特异性肌钙蛋白 T (hcTnT)、人核抗原 (HNA) 和非特异性肌钙体 α 肌动蛋白的组织免疫荧光染色。
- 整个心脏连续切片后,每50个切片取一个切片进行荧光标记。
- 每个切片随机捕获五个高放大倍率图像。计算视场的移植数,计算每单位面积的平均移植细胞数,并将其设置为A1 / μm2。使用 ImageJ (https://imagej.nih.gov/ij/) 计算切片的总嫁接面积并将其设置为 B1μm2 ,以便该切片中的嫁接数 = A1 × B121,22。
- 使用方程(1)计算每只小鼠心脏的移植细胞总数,使用等式(2)计算植入率百分比,假设从每50个切片中选择一个切片21,22。
- 每只小鼠心脏移植细胞总数 = (A1 × B1 + A2 × B2 +...+ 十亿×) × 50 (1)
植入率 =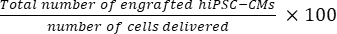 (2)
(2)
注意:SD组的交付次数为3×105 ,MD组的交付次数为3×3×105 。
- 评估心肌梗死区域
- 切割孤立心脏的横截面冷冻切片(短轴),从心脏的顶点到底部,厚度为10μm。
- 在整个心脏连续切片后,每30个切片取一个切片载玻片,并将其固定在58°C的预热Bouin溶液中。 根据制造商的说明,用 0.04% 直接红和 0.1% 快绿胶原蛋白染色(在 PBS 中稀释)染色切片17.
- 使用软件(例如ImageJ)使用方程(3):14,17在显微镜下分析心脏横截面全身摄影后的图像
梗死面积 % =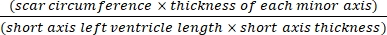 × 100% (3)
× 100% (3)
- 检测各种器官中的人类线粒体DNA
- 用5%异氟醚麻醉小鼠,并通过颈椎后脱位处死它们。细胞移植后4周解剖小鼠。收获器官(肝,肺,脑,肾,脾脏)和部分心肌(本节中的n = 3)。
- 根据制造商的说明,在液氮中研磨每个器官组织,并使用参考试剂盒(参见 材料表)从组织中提取DNA。
- 按照制造商的说明使用参考试剂盒和引物(参见 材料表)检测上述组织中的人线粒体DNA(来自步骤4.5.1)。
结果
用于评估每组小鼠左心室功能的超声心动图显示,MD组的MI损伤有效逆转(图2A)。与MI组相比,SD组的射血分数(EF)增加(从30%增加到35%; 图2B)和分数缩短(FS)(从18%增加到22%; 图2C)在MI之后。然而,更值得注意的是,在MD组小鼠中多次注射hiPSC-CMs经皮增加了EF(从30%增加到42%; 图2B)和满量程(从18%降至28...
讨论
本研究的关键步骤包括hiPSC培养,心肌细胞分化,hiPSC-CM纯化和hiPSC-CM移植到小鼠心肌梗死部位。关键是使用心脏超声经皮引导治疗到梗死边缘的梗死部位,在那里将hiPSC-CMs注射到该区域。
随着培养时间的延长,hiPSC-CM表型在形态(较大的细胞大小)、结构(肌肉、原纤维密度、排列、微观细胞簇)和生理(钙处理和β-肾上腺素能反应)上随时间变化。本研究在hiPSC分化为心肌?...
披露声明
作者没有什么可透露的。
致谢
这项工作得到了国家自然科学基金重大研究计划(编号:91539111-JY)、湖南省科技重点项目(编号:2020SK53420至JY)和湖南省科技创新计划(2021RC2106-CF)的支持。
材料
| Name | Company | Catalog Number | Comments |
| Antibody | |||
| Cardiac troponin T | Abcam | ab8295 | |
| Donkey Anti-Mouse IgG H&L (Alexa Fluor 488) | Abcam | ab150105 | |
| Donkey Anti-Mouse IgG H&L (Alexa Fluor 555) | Abcam | ab150110 | |
| Donkey Anti-Rabbit IgG H&L (Alexa Fluor 488) | Abcam | ab150073 | |
| Donkey Anti-Rabbit IgG H&L (Alexa Fluor 555) | Abcam | ab150062 | |
| Human cardiac troponin T | Abcam | ab91605 | |
| Isolectin B4 | Vector | FL-1201 | |
| Sarcomeric alpha actinin | Abcam | ab9465 | |
| Wheat germ agglutinin | Thermo Fisher Scientific | W11261 | |
| Reagent | |||
| Accutase | Thermo Fisher Scientific | 00-4555-56 | |
| B27 Supplement(minus insulin) | Thermo Fisher Scientific | A1895601 | |
| B27 Supplement(serum free) | Thermo Fisher Scientific | 17–504-044 | |
| Bouin's solution | Thermo Fisher Scientific | SDHT10132 | |
| CHIR99021 | Selleck | CT99021 | |
| cyclosporin A | Medchemexpress | HY-B0579 | |
| DIRECT RED | Sigma-Aldrich | 365548-25G | |
| DMEM/F12 | Thermo Fisher Scientific | 11320033 | |
| DNeasy Blood & Tissue Kit | Qiagen | 69504 | |
| FAST GREEN FCF | Sigma-Aldrich | F7252-5G | |
| Glucose-free RPMI 1640 | Thermo Fisher Scientific | 11879020 | |
| IWR1 | Selleck | S7086 | |
| lactic acid | Sigma-Aldrich | L6661 | |
| Matrigel | BD Biosciences | BD356234 | |
| mTeSR1 | Stem Cell Technologies | 72562 | |
| O.C.T. Compound | SAKURA | 4583 | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| PowerUP SYBR Green MasterMix kit | Thermo Fisher Scientific | A25742 | |
| RPMI1640 | Thermo Fisher Scientific | 11875119 | |
| STEMdif Cardiomyocyte Freezing Medium/STEMdiff | Stem Cell Technologies | 5030 | |
| STEMdiff Cardiomyocyte Support Medium | Stem Cell Technologies | 5027 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| ultrasound coupling agent | CARENT | 22396269389 | |
| Y-27632 | Selleck | S6390 | |
| Equipment and Supplies | |||
| Applied Biosystems | Thermo Fisher Scientific | 7500 Real-Time PCR | |
| cryostat | Leica | CM1950 | |
| fluoresence microscope | Olympus | IX83 | |
| fine anatomical scissors | Fine Science Tools | 15000-08 | |
| fine dissecting forceps | Fine Science Tools | 11255-20 | |
| Micro syringe | Hamilton | 7633 | |
| Small animal anesthesia machine | MATRX | VMR | |
| Ultra-high resolution small animal ultrasound imaging system | VisualSonics | Vevo 2100 | |
| Software | |||
| Statistical Product and Service Solutions | IBM | 21 | |
| Image J | NIH | 1.48 | |
| Human mitochondrial DNA primers | |||
| the forward primer sequence | CCGCTACCATAATCATCGCTAT | ||
| the reverse primer sequence | TGCTAATACAATGCCAGTCAGG |
参考文献
- Leuschner, F., et al. Rapid monocyte kinetics in acute myocardial infarction are sustained by extramedullary monocytopoiesis. The Journal of Experimental Medicine. 209 (1), 123-137 (2012).
- Lázár, E., et al. Cardiomyocyte renewal in the human heart: insights from the fall-out. European Heart Journal. 38 (30), 2333-2342 (2017).
- Davis, M. K., et al. State of the art: cardiac transplantation. Trends in Cardiovascular Medicine. 24 (8), 341-349 (2014).
- Mancini, D., Colombo, P. C. Left ventricular assist devices: A rapidly evolving alternative to transplant. Journal of the American College of Cardiology. 65 (23), 2542-2555 (2015).
- Zimmermann, W. H. Translating myocardial remuscularization. Circulation Research. 120 (2), 278-281 (2017).
- Hu, X., et al. A large-scale investigation of hypoxia-preconditioned allogeneic mesenchymal stem cells for myocardial repair in nonhuman primates: Paracrine activity without remuscularization. Circulation Research. 118 (6), 970-983 (2016).
- Kempf, H., et al. Cardiac differentiation of human pluripotent stem cells in scalable suspension culture. Nature Protocols. 10 (9), 1345-1361 (2015).
- Chong, J. J., et al. Human embryonic-stem-cell-derived cardiomyocytes regenerate non-human primate hearts. Nature. 510 (7504), 273-277 (2014).
- Shiba, Y., et al. Allogeneic transplantation of iPS cell-derived cardiomyocytes regenerates primate hearts. Nature. 538 (7625), 388-391 (2016).
- Nguyen, P. K., et al. Potential strategies to address the major clinical barriers facing stem cell regenerative therapy for cardiovascular disease: A review. JAMA Cardiology. 1 (8), 953-962 (2016).
- Zimmermann, W. H. Remuscularization of the failing heart. The Journal of Physiology. 595 (12), 3685-3690 (2017).
- Hu, X., et al. Transplantation of hypoxia-preconditioned mesenchymal stem cells improves infarcted heart function via enhanced survival of implanted cells and angiogenesis. The Journal of Thoracic and Cardiovascular Surgery. 135 (4), 799-808 (2008).
- Feng, Y., et al. Heat shock improves Sca-1+ stem cell survival and directs ischemic cardiomyocytes toward a prosurvival phenotype via exosomal transfer: a critical role for HSF1/miR-34a/HSP70 pathway. Stem Cells. 32 (2), 462-472 (2014).
- Fan, C., et al. Cardiomyocytes from CCND2-overexpressing human induced-pluripotent stem cells repopulate the myocardial scar in mice: A 6-month study. Journal of Molecular and Cellular Cardiology. 137, 25-33 (2019).
- Lou, X., et al. N-cadherin overexpression enhances the reparative potency of human-induced pluripotent stem cell-derived cardiac myocytes in infarcted mouse hearts. Cardiovascular Research. 116 (3), 671-685 (2020).
- Sun, X., et al. Transplanted microvessels improve pluripotent stem cell-derived cardiomyocyte engraftment and cardiac function after infarction in rats. Science Translational Medicine. 12 (562), (2020).
- Wu, X., et al. Cardiac repair with echocardiography-guided multiple percutaneous left ventricular intramyocardial injection of hiPSC-CMs after myocardial infarction. Frontiers in Cardiovascular Medicine. 8, 768873 (2021).
- Kannappan, R., et al. Functionally competent DNA damage-free induced pluripotent stem cell-derived cardiomyocytes for myocardial repair. Circulation. 140 (6), 520-522 (2019).
- Lou, X., et al. N-cadherin overexpression enhances the reparative potency of human-induced pluripotent stem cell-derived cardiac myocytes in infarcted mouse hearts. Cardiovascular Research. 116 (3), 671-685 (2020).
- Zhao, M., et al. Y-27632 preconditioning enhances transplantation of human-induced pluripotent stem cell-derived cardiomyocytes in myocardial infarction mice. Cardiovascular Research. 115 (2), 343-356 (2019).
- Zhao, M., et al. Enhancing the engraftment of human induced pluripotent stem cell-derived cardiomyocytes via a transient inhibition of rho kinase activity. Journal of Visualized Experiments: JoVE. (149), e59452 (2019).
- O'Brien, J., Hayder, H., Peng, C. Automated quantification and analysis of cell counting procedures using ImageJ plugins. Journal of Visualized Experiments: JoVE. (117), e54719 (2016).
- Kain, V., Prabhu, S. D., Halade, G. V. Inflammation revisited: inflammation versus resolution of inflammation following myocardial infarction. Basic Research in Cardiology. 109 (6), 444 (2014).
- Rainer, P. P., et al. Cardiomyocyte-specific transforming growth factor β suppression blocks neutrophil infiltration, augments multiple cytoprotective cascades, and reduces early mortality after myocardial infarction. Circulation Research. 114 (8), 1246-1257 (2014).
- Yu, Y., et al. Human embryonic stem cell-derived cardiomyocyte therapy in mouse permanent ischemia and ischemia-reperfusion models. Stem Cell Research & Therapy. 10 (1), 167 (2019).
- Iwanaga, K., et al. Effects of G-CSF on cardiac remodeling after acute myocardial infarction in swine. Biochemical and Biophysical Research Communications. 325 (4), 1353-1359 (2004).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。