È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Impianto di cardiomiociti derivati da cellule staminali pluripotenti indotte ecoguidate in topi infartuati miocardici
In questo articolo
Riepilogo
La somministrazione cellulare guidata da ultrasuoni intorno al sito di infarto miocardico nei topi è un modo sicuro, efficace e conveniente di trapianto cellulare.
Abstract
L'obiettivo chiave della terapia cellulare dopo infarto miocardico (IM) è quello di migliorare efficacemente il tasso di innesto cellulare e i cardiomiociti derivati da cellule staminali pluripotenti indotte umane (hiPSC-CM) sono una fonte cellulare promettente per la riparazione cardiaca dopo danno ischemico. Tuttavia, un basso tasso di innesto è un ostacolo significativo per un'efficace rigenerazione del tessuto cardiaco dopo il trapianto. Questo protocollo mostra che più iniezioni percutanee guidate da ultrasuoni hiPSC-CM in un'area MI aumentano efficacemente i tassi di trapianto cellulare. Lo studio descrive anche l'intero processo di coltura hiPSC-CM, il pretrattamento e i metodi di somministrazione percutanea ecoguidati. Inoltre, l'uso del DNA mitocondriale umano aiuta a rilevare l'assenza di hiPSC-CM in altri organi del topo. Infine, questo articolo descrive i cambiamenti nella funzione cardiaca, nell'angiogenesi, nelle dimensioni delle cellule e nell'apoptosi nella zona di confine infartuato nei topi 4 settimane dopo il parto cellulare. Si può concludere che l'iniezione percutanea guidata dall'ecocardiografia del miocardio ventricolare sinistro è una terapia cellulare fattibile, relativamente invasiva, soddisfacente, ripetibile ed efficace.
Introduzione
Quando si verifica un'infarto miocardica acuta, le cellule del miocardio nell'area infartuata muoiono rapidamente a causa di ischemia e ipossia. Diversi fattori infiammatori vengono rilasciati dopo la morte e la rottura delle cellule, mentre le cellule infiammatorie si infiltrano nel sito infartuato per causare infiammazione1. Significativamente, i fibroblasti e il collagene, entrambi senza contrattilità e conduttività elettrica, sostituiscono le cellule miocardiche nel sito infartuato per formare tessuto cicatriziale. A causa della limitata capacità di rigenerazione dei cardiomiociti nei mammiferi adulti, il tessuto vitale formato dopo una vasta area di infarto di solito non è adeguato per mantenere una gittata cardiaca sufficiente2. L'infarto miocardico causa insufficienza cardiaca e, nei casi gravi di insufficienza cardiaca, i pazienti possono fare affidamento solo su trapianti di cuore o dispositivi di assistenza ventricolare per mantenere le normali funzioni cardiache 3,4.
Dopo l'infarto miocardico, la strategia di trattamento ideale è quella di sostituire i cardiomiociti morti con cardiomiociti di nuova formazione, formando accoppiamenti elettromeccanici con tessuti sani. Tuttavia, le opzioni di trattamento hanno tipicamente adottato il salvataggio miocardico piuttosto che la sostituzione. Attualmente, le terapie basate su cellule staminali e cellule progenitrici sono tra le strategie più promettenti per promuovere la riparazione miocardica dopo l'MI5. Tuttavia, il trapianto di queste cellule ha diversi problemi, in primo luogo l'incapacità delle cellule staminali adulte di differenziarsi in cardiomiociti e la loro breve durata di vita6.
Le questioni etiche relative all'uso di cellule staminali embrionali (ES) possono essere aggirate dalle iPSC, che sono una fonte promettente di cellule. Inoltre, le iPSC possiedono forti capacità di auto-rinnovamento e possono differenziarsi in cardiomiociti7. Gli studi hanno dimostrato che le hiPSC-CM trapiantate nel sito MI possono sopravvivere e formare giunzioni gap con le cellule ospiti 8,9. Tuttavia, poiché queste cellule trapiantate si trovano nel microambiente di ischemia e infiammazione, il loro tasso di sopravvivenza è estremamente basso10,11.
Sono stati stabiliti diversi metodi per migliorare il tasso di sopravvivenza delle cellule trapiantate, come il pretrattamento con ipossia e shock termico delle cellule trapiantate12,13, la modificazione genetica 14,15 e il trapianto simultaneo di cellule e capillari 16. Sfortunatamente, la maggior parte dei metodi sono limitati dalla complessità e dai costi elevati. Quindi, il presente studio propone un metodo di somministrazione hiPSC-CM riproducibile, conveniente, relativamente invasivo ed efficace.
L'iniezione di cellule intramiocardiche guidata da ultrasuoni può essere eseguita solo con una piccola ecografia veterinaria ad alta risoluzione e un microiniettore, indipendentemente dal sito. Sotto la guida ecografica, la consegna diretta delle cellule sotto il processo xifoideo dal pericardio al miocardio nei topi è un protocollo sicuro che evita danni al fegato e ai polmoni. Questo metodo può essere combinato contemporaneamente ad altre tecnologie per migliorare significativamente il tasso di sopravvivenza delle cellule trapiantate.
Protocollo
Tutti gli esperimenti sugli animali in questo studio sono stati esaminati e approvati dal comitato etico del Secondo Xiangya Hospital della Central South University. Vedere la tabella dei materiali per i dettagli relativi a tutti i materiali e le attrezzature utilizzati in questo protocollo. Le tempistiche per l'iniezione cellulare, l'imaging e l'eutanasia sono le seguenti: t0- indurre infarto, t1 settimana- immagine e cellule implantari, t2 settimane- immagine e cellule implantari, t4 settimane - imaging finale, eutanasia e raccolta di tessuti.
1. coltura hiPSC, differenziazione dei cardiomiociti e purificazione cellulare
- Miscelare DMEM/F12 e la soluzione madre a membrana basale con ghiaccio a 4 °C in rapporto 1,5:1, aliquota, e conservare la miscela risultante (diluente della matrice) a -20 °C. Mescolare accuratamente 25 mL di terreno di coltura DMEM/F12 a 4 °C e 1 mL di diluente della matrice con ghiaccio e distribuire 1 mL/pozzetto in una piastra a 6 pozzetti. Tenere la piastra in posizione verticale per 1 ora in un'incubatrice a 37 °C e aspirare il surnatante DMEM/F12 dai pozzetti. Non toccare il fondo della piastra a 6 pozzetti durante l'esecuzione della procedura.
- Rimuovere il tubo di crioconservazione contenente le hiPSC dall'azoto liquido e scongelarlo rapidamente in un bagno d'acqua a 37 °C. Sterilizzare la superficie esterna del tubo di crioconservazione con alcool al 75%, rimuovere l'alcol e trasferire il tubo su un tavolo sterile ultra-pulito.
- Utilizzare una pipetta per trasferire delicatamente la soluzione di crioconservazione contenente hiPSC in una provetta da centrifuga da 15 ml, aggiungere 5 ml di mezzo ES privo di alimentatore e centrifugare la sospensione a 300 × g per 3 minuti a temperatura ambiente. Eliminare il surnatante e risospendere delicatamente le cellule in 6 mL del mezzo ES privo di alimentatore. Contare le cellule e regolare la concentrazione cellulare a 5 × 105 cellule/ml con il terreno di coltura.
- Aggiungere l'inibitore ROCK (Y27632) alle hiPSC fino a una concentrazione finale di 5 μM. Trasferire le hiPSC con Y27632 alla piastra a 6 pozzetti pretrattata con matrice a membrana basale e ruotare delicatamente la piastra a 6 pozzetti, tracciando la forma del numero "8" per distribuire uniformemente le hiPSC. Collocare le hiPSC in un incubatore umido a 37 °C con il 5% di CO2 in posizione verticale per 24 ore. Sostituire il surnatante con il mezzo ES privo di alimentatore senza Y27632.
- Quando le hiPSCs raggiungono l'80% di grado di confluenza, aspirare il surnatante di coltura, lavare le cellule due volte con soluzione salina tamponata fosfato (PBS), aggiungere RPMI1640 + B27 senza insulina contenente 10 μM CHIR99021 (inibitore GSK3-β) e posizionare le hiPSCs in un incubatore di CO2 umido a 37 °C per 24 ore.
- Sostituire metà del surnatante con RPMI1640 + B27 mezzo senza insulina e incubare le cellule per altre 24 ore.
- Sostituire completamente il terreno di coltura con RPMI1640 + B27 (senza insulina). Porre le piastre in un incubatore umido a 37 °C con il 5% di CO2 in posizione verticale per 24 ore.
- Sostituire completamente il terreno di coltura dopo 3 giorni con RPMI1640 + B27 + 5 μM IWR1 (inibitore della via di segnalazione Wnt) e posizionare le piastre in un incubatore umido a 37 °C con CO2 al 5% per 48 ore.
- Sostituire il terreno di coltura dopo 5 giorni con RPMI1640 + B27 senza insulina e continuare ad incubare per 48 ore in un incubatore di CO2 umido a 37 °C.
- Sostituire il terreno di coltura con il terreno RPMI + B27 (compresa l'insulina) dopo 7 giorni e posizionare le piastre in un incubatore di CO2 umidificato per 3 giorni a 37 °C. Sostituire il mezzo con il mezzo RPMI + B27 ogni 3 giorni. Cerca il battito spontaneo delle cellule a 9-12 giorni di differenziazione.
- Dopo aver osservato le cellule pulsanti, sostituire il mezzo RPMI + B27 con un mezzo RPMI 1640 privo di glucosio contenente acido lattico (1 mL di acido lattico aggiunto a 500 mL di terreno RPMI 1640 senza glucosio). Incubare le cellule per 72 ore in un incubatore umido a 37 °C con il 5% di CO2.
- Dopo 72 h, sostituire il surnatante con RPMI + B27 mezzo e incubare per 48 ore in un incubatore umido a 37 °C con 5% di CO2.
- Aspirare il surnatante di coltura a pressione negativa e lavare le cellule 3 volte con PBS per rimuovere le tracce del terreno di coltura. Utilizzare la miscela enzimatica di distacco cellulare per dissociare gli hiPSC-CM in singole cellule a 37 °C. Raccogliere le cellule ottenute in una provetta da centrifuga da 15 mL contenente 3 mL di soluzione di supporto cardiomiocitaria, centrifugare a 300 × g per 2 minuti a temperatura ambiente ed eliminare il surnatante.
- Risospendere le cellule con mezzo RPMI + B27, seminarle su piastre a 6 pozzetti rivestite con matrice basale e incubarle per 48 ore in un incubatore umido a 37 °C con il 5% di CO2.
- Sostituire il surnatante di coltura per la purificazione con terreno RPMI 1640 privo di glucosio contenente acido lattico e incubare per 72 ore in un incubatore umido a 37 °C con il 5% di CO2.
- Sostituire il surnatante di coltura con RPMI + B27 mezzo e cambiare il terreno ogni 3 giorni.
- Continuare il processo di cui sopra per 30 giorni, sostituendo il surnatante di coltura con terreno privo di glucosio contenente acido lattico per un'ulteriore purificazione. Incubare le cellule per 3 giorni con questo mezzo e sostituire il surnatante con RPMI + B27. Coltiva le cellule continuamente per 30 giorni fino a quando gli hiPSC-CM battono stabilmente e usa queste cellule per l'iniezione intramiocardica nei topi.
2. Preparazione di hiPSC-CMs e definizione di un modello di infarto miocardico acuto del topo
- Aspirare sottovuoto il surnatante di coltura da hiPSC-CMs coltivato per 60 giorni, lavare le cellule 3 volte con PBS e dissociare gli hiPSC-CMs in singole cellule a 37 °C con la miscela enzimatica di distacco cellulare (~3-5 min). Raccogliere le cellule in una provetta da centrifuga da 15 mL contenente 5 ml di terreno RPMI + B27 e mescolare bene prima di contare le celle per calcolare il numero totale di cellule. Centrifugare la sospensione cellulare a 300 × g per 2 minuti a temperatura ambiente. Scartare il surnatante e aggiungere il mezzo di supporto cardiomiocitario per risospendere a una concentrazione di 0,6 × 105 cellule/μL.
- Tenere la provetta da centrifuga contenente gli hiPSC-CM risospesi pronti a 37 °C per l'iniezione 14,17,18,19,20.
- Mettere i topi in una scatola di anestesia collegata con isoflurano per indurre l'inalazione anestetica seguita dall'uso di unguento veterinario sugli occhi per prevenire la secchezza durante l'anestesia.
NOTA: La concentrazione di isoflurano era del 5%. Prestare attenzione alla ventilazione di laboratorio durante l'esperimento. - Cerca la perdita di riflessi nella regione dei piedi e della coda dopo aver pizzicato quando il mouse è disteso sul tavolo operatorio, indicando un'anestesia sufficiente. Somministrare buprenorfina (0,1 mg/kg) per via intraperitoneale.
- Spalmare i capelli al centro del collo e sul petto sinistro dei topi con una crema depilatoria e asciugare la crema e i capelli applicati con una garza dopo 5 minuti.
- Fissare gli arti e la coda del mouse con del nastro adesivo. Fissare gli incisivi del mouse con un filo di seta 2-0 e del nastro adesivo. Sterilizzare l'area chirurgica (collo mediano e torace sinistro) con tre cicli alternati di betadine seguiti da alcol.
- Posizionare un drappo chirurgico intorno all'area chirurgica sterilizzata. Quindi, eseguire un'incisione mediana del collo usando forbici anatomiche sottili e pinze da dissezione fine per esporre completamente la trachea. Se necessario, tagliare alcuni muscoli cervicali anteriori per la stabilizzazione.
NOTA: Gli operatori sono stati accecati ai gruppi di animali. - Inserire un tubo tracheale (ago da puntura del catetere da 20 G) attraverso la bocca.
- Collegare il tubo tracheale al ventilatore e controllare il movimento toracico per assicurarsi che entrambi i polmoni siano ben ventilati.
- Regolare i parametri respiratori (frequenza respiratoria: 100-150 bpm, volume corrente 250-300 μL). Successivamente, rifissare l'arto posteriore sinistro sul lato inferiore destro, allentare il nastro attorno all'arto superiore sinistro ed eseguire una toracotomia nello spazio intercostale 3-4 del torace sinistro usando forbici e pinze da dissezione fine per la massima esposizione cardiaca.
- Usando una pinza, staccare il pericardio al microscopio per visualizzare l'arteria coronaria discendente anteriore sinistra (LAD) sul bordo inferiore dell'appendice atriale sinistra.
- Usa un filo di seta 6-0 per legare l'estremità prossimale del LAD. Dopo essersi assicurati che il modello di infarto miocardico acuto sia adeguatamente stabilito (quando il LAD distale nel sito di legatura cambia da rosso a bianco), chiudere il torace strato per strato e suturare la pelle con 4-0 punti intermittenti filettati. Eseguire tutte le procedure chirurgiche sopra menzionate per l'induzione dell'infarto miocardico per il gruppo fittizio di animali ad eccezione della legatura.
- Spegnere l'anestesia per inalazione, rimuovere la cannula dopo che il topo ha ripreso la respirazione spontanea e riportarla nella sua gabbia. Monitorare l'animale fino a quando non ha riacquistato sufficiente coscienza per mantenere la recumbency sternale. Non restituirlo alla compagnia di altri animali fino a quando non si è completamente ristabilito. Somministrare iniezioni intraperitoneali di buprenorfina (0,1 mg/kg x 3 giorni) e carprofen (5 mg/kg x 1 giorno) ogni 12 ore postoperatorie.
- Iniettare ciclosporina A (10 mg·kg-1·giorno-1) nella cavità intraperitoneale dei topi 3 giorni prima della somministrazione di hiPSC-CMs per prevenire il rigetto delle cellule trapiantate. Iniettare ciclosporina A continuamente per 1 mese dopo il trapianto.
3. iniezione hiPSC-CM sotto guida ecografica
- Dopo aver impostato il modello di IM, assegnare i topi modello MI (topi C57BL / 6 di 12 settimane; da 22 g a 24 g di peso, 50% maschi e 50% femmine) a gruppi monodose (SD, n = 8 in questo studio) e multidose (MD, n = 8 in questo studio) il primo giorno post-MI e posizionarli nella prima e nella seconda settimana successiva all'infarto miocardico in una scatola per anestesia collegata con isoflurano al 5% per l'induzione dell'anestesia inalatoria seguita da intubazione tracheale.
- Spalmare i peli sul petto e sulla parte superiore dell'addome dei topi con crema depilatoria e pulire la crema con una garza 5 minuti dopo. Monitorare la frequenza cardiaca del mouse sulla scheda operatoria e somministrare isoflurano per inalazione fino a quando la frequenza cardiaca non viene mantenuta a 400-500 bpm.
- Fissare gli arti e la coda del mouse con del nastro adesivo sulla console di rilevamento e impostare la temperatura della piattaforma a 37 °C.
- Applicare una speciale gelatina ad ultrasuoni sulla parte superiore dell'addome e utilizzare una sonda ecografica veterinaria ad alta risoluzione più piccola per ottenere immagini del fegato del topo.
- Ridurre la velocità del ventilatore a 50 bpm. Utilizzare una microsiringa da 5 μL per prelevare ~3 × 105 cellule (dal punto 2.1). Tenendo la siringa con un micromanipolatore, inserire un ago da 3 mm nel processo para-xifoideo sinistro (Figura 1A). Seguire il bordo superiore del diaframma sotto la guida ecografica (Figura 1B), osservare il ritmo respiratorio e la gamma (Figura 1C, D) ed entrare nel pericardio alla fine del ciclo espiratorio evitando danni al fegato e ai polmoni (Figura 1D).
- Dopo che l'ago del microiniettore entra nella cavità pericardica, regolare la frequenza respiratoria al parametro originale (150 bpm). Acquisire l'immagine parasternale dell'asse lungo del cuore del topo mediante ecocardiografia M-mold secondo le istruzioni del produttore17 (Figura 1E). Sotto guida ultrasonica, iniettare 3 × 10 5 cellule (Figura 1F) in tre aree marginali (1 × 105 cellule per sito iniettato) del sito di infarto.
- Rimuovere la speciale sonda ad ultrasuoni e risciacquare la gelatina. Svezzare il topo dall'anestesia per inalazione e riportarlo nella sua gabbia dopo la piena consapevolezza.
- Ripetere le suddette procedure di iniezione cellulare guidata da ultrasuoni 1 e 2 settimane dopo aver stabilito l'MI per i topi del gruppo MD.
4. Valutazione della funzione cardiaca, marcatura della fluorescenza, conta delle cellule trapiantate, area dell'infarto miocardico e rilevamento dei mitocondri umani degli organi nei topi 30 giorni dopo la legatura del ramo discendente anteriore sinistro
- Valutazione della funzione cardiaca
- Posizionare il topo in una scatola per anestesia collegata all'isoflurano per l'anestesia di induzione-inalazione, seguita dall'uso di unguento veterinario sugli occhi per prevenire la secchezza durante l'anestesia. Rimuovere i peli sul petto sinistro del topo con crema depilatoria. Posizionare il mouse sul pannello operativo per monitorare la frequenza cardiaca e regolare l'inalazione di isoflurano. Mantenere la frequenza cardiaca del mouse a 400-500 bpm. L'endpoint sperimentale è il giorno 30 (dopo l'induzione dell'infarto miocardico).
- Fissare gli arti e la coda del mouse con del nastro adesivo sulla console di rilevamento e impostare la temperatura della piattaforma a 37 °C.
- Dopo aver applicato uno speciale gel ad ultrasuoni sull'area cardiaca anteriore, utilizzare una sonda ecografica cardiaca ad alta risoluzione (veterinaria) per acquisire immagini parasternali ad asse lungo e bidimensionale ad asse corto sotto ecocardiografia di M-mold e B-mold secondo le istruzioni del produttore17.
- Al termine del rilevamento ad ultrasuoni, sciacquare lo speciale gel ad ultrasuoni, spegnere l'anestesia per inalazione e riportare il mouse nella sua gabbia separatamente dopo la piena consapevolezza.
- Analizzare i dati ottenuti e calcolare la frazione di eiezione ventricolare sinistra (EF) e l'accorciamento frazionario (FS) utilizzando il software di analisi. Assicurarsi che l'operatore sia cieco ai gruppi sperimentali17.
- Etichettatura a fluorescenza delle sezioni
- Lavare il cuore isolato con PBS, immergerlo in paraformaldeide al 4% a 4 °C per 12 ore. Estrarre il cuore e immergerlo nel 30% di saccarosio per 24 ore per disidratare.
- Incorporare il cuore disidratato con il composto della temperatura di taglio ottimale (OCT) su ghiaccio secco. Tagliare il cuore dal basso all'apice con uno spessore del criostato di 10 μm e posizionare le sezioni sui vetrini e conservare i vetrini a -20 °C.
- Lavare i vetrini con il tessuto cardiaco con PBS per 3 minuti.
- Permeabilizzare il tessuto su vetrini con Triton X-100 allo 0,5% a temperatura ambiente per 8 minuti e lavarli 3 volte con PBS per 5 minuti per lavaggio.
- Dopo aver coperto il tessuto con siero d'asino al 10% e PBS al 90% (soluzione bloccante), bloccare le sezioni per 1 ora a temperatura ambiente.
- Dopo aver rimosso la soluzione bloccante, incubare le sezioni con l'anticorpo primario (diluito a 1:100 con la soluzione bloccante) per una notte a 4 °C. Lavarli 3 volte con PBS per 5 minuti a lavaggio.
- Incubare il tessuto su vetrini con anticorpo secondario coniugato con fluorofori (diluito a 1:100 con la soluzione bloccante) per 1 ora a temperatura ambiente.
NOTA: Evitare di esporre alla luce i tessuti con l'anticorpo secondario coniugato con fluorofori da questo punto in poi. - Lavare i vetrini 3 volte con PBS per 5 minuti per lavaggio.
- Montare i vetrini utilizzando un mezzo di montaggio contenente 4',6-diamidino-2-fenilindolo (DAPI) e fotografarli al microscopio a fluorescenza17.
- Le hiPSC-CM trapiantate contano17
- Eseguire la colorazione con immunofluorescenza tissutale su sezioni congelate del cuore per troponina T pedone-specifica (hcTnT), antigene nucleare umano (HNA) e alfa actinina sarcomerica non specifica.
- Dopo che l'intero cuore è stato sezionato in serie, prendere una sezione ogni 50 sezioni per l'etichettatura a fluorescenza.
- Cattura casualmente cinque immagini ad alto ingrandimento per fetta. Contare il numero innestato di campi visivi, calcolare il numero medio di cellule innestate per unità di area e impostarli come A1/μm2. Calcolare l'area totale dell'innesto della fetta utilizzando ImageJ (https://imagej.nih.gov/ij/) e impostarla come B1μm2 in modo che il numero innestato in questa fetta = A1 × B121,22.
- Calcolare il numero totale di cellule innestate per cuore di topo usando Eq (1) e il tasso percentuale di attecchimento usando Eq (2), dato che una sezione è stata scelta ogni 50 sezioni21,22.
- Numero totale di cellule innestate per cuore di topo = (A1 × B1 + A2 × B2 +...+ Un × miliardi) × 50 (1)
tasso di attecchimento =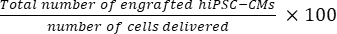 (2)
(2)
NOTA: Il numero di consegne è stato 3 × 10 5 per il gruppo SD e 3 × 3 × 105 per il gruppo MD.
- Valutazione dell'area dell'infarto miocardico
- Tagliare una sezione trasversale congelata (asse corto) del cuore isolato, dall'apice alla base del cuore con uno spessore di 10 μm.
- Dopo che l'intero cuore è stato sezionato in serie, prendere un vetrino per ogni 30 sezioni e fissarlo in soluzione di Bouin preriscaldata a 58 °C. Colorare la sezione con macchie di collagene 0,04% Direct Red e 0,1% Fast Green (diluite in PBS) secondo le istruzioni del produttore17.
- Utilizzare un software (ad esempio, ImageJ) per analizzare le immagini dopo la fotografia trasversale di tutto il corpo del cuore al microscopio utilizzando Eq (3):14,17
Area dell'infarto % =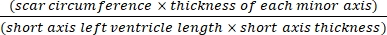 × 100% (3)
× 100% (3)
- Rilevazione del DNA mitocondriale umano in vari organi
- Anestetizzare i topi con isoflurano al 5% e sacrificarli mediante lussazione cervicale posteriore. Sezionare i topi 4 settimane dopo il trapianto di cellule. Raccogliere gli organi (fegato, polmone, cervello, rene, milza) e parte del miocardio (n = 3 in questa sezione).
- Macinare ogni tessuto dell'organo in azoto liquido ed estrarre il DNA dal tessuto utilizzando il kit di riferimento (vedere la tabella dei materiali) secondo le istruzioni del produttore.
- Seguire le istruzioni del produttore per utilizzare il kit e i primer di riferimento (vedere la tabella dei materiali) per rilevare il DNA mitocondriale umano nei tessuti sopra menzionati (dal punto 4.5.1).
Risultati
L'ecocardiografia per la valutazione della funzione ventricolare sinistra dei topi in ciascun gruppo ha rivelato che le lesioni dell'infarto miocardico erano effettivamente invertite nel gruppo MD (Figura 2A). Rispetto al gruppo MI (MI), il gruppo SD ha mostrato un aumento della frazione di eiezione (EF) (dal 30% al 35%; Figura 2B) e accorciamento frazionario (FS) (dal 18% al 22%; Figura 2C) dopo MI. Tuttavia, è ancora più crucial...
Discussione
Le fasi critiche di questo studio includono la coltura di hiPSC, la differenziazione dei cardiomiociti, la purificazione di hiPSC-CM e il trapianto di hiPSC-CM nel sito di infarto miocardico del topo. La chiave è utilizzare l'ecografia cardiaca per guidare transcutaneamente il trattamento verso il sito dell'infarto ai margini dell'infarto in cui sono stati iniettati gli hiPSC-CM nell'area.
Con il prolungamento del tempo di coltura, il fenotipo hiPSC-CM cambia nella morfologia (dimensioni cell...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato supportato dal Grande Piano di Ricerca della National Natural Science Foundation of China (No. 91539111to JY), Key Project of Science and Technology of Hunan Province (No. 2020SK53420 to JY) e The Science and Technology Innovation Program of Hunan Province (2021RC2106 to CF).
Materiali
| Name | Company | Catalog Number | Comments |
| Antibody | |||
| Cardiac troponin T | Abcam | ab8295 | |
| Donkey Anti-Mouse IgG H&L (Alexa Fluor 488) | Abcam | ab150105 | |
| Donkey Anti-Mouse IgG H&L (Alexa Fluor 555) | Abcam | ab150110 | |
| Donkey Anti-Rabbit IgG H&L (Alexa Fluor 488) | Abcam | ab150073 | |
| Donkey Anti-Rabbit IgG H&L (Alexa Fluor 555) | Abcam | ab150062 | |
| Human cardiac troponin T | Abcam | ab91605 | |
| Isolectin B4 | Vector | FL-1201 | |
| Sarcomeric alpha actinin | Abcam | ab9465 | |
| Wheat germ agglutinin | Thermo Fisher Scientific | W11261 | |
| Reagent | |||
| Accutase | Thermo Fisher Scientific | 00-4555-56 | |
| B27 Supplement(minus insulin) | Thermo Fisher Scientific | A1895601 | |
| B27 Supplement(serum free) | Thermo Fisher Scientific | 17–504-044 | |
| Bouin's solution | Thermo Fisher Scientific | SDHT10132 | |
| CHIR99021 | Selleck | CT99021 | |
| cyclosporin A | Medchemexpress | HY-B0579 | |
| DIRECT RED | Sigma-Aldrich | 365548-25G | |
| DMEM/F12 | Thermo Fisher Scientific | 11320033 | |
| DNeasy Blood & Tissue Kit | Qiagen | 69504 | |
| FAST GREEN FCF | Sigma-Aldrich | F7252-5G | |
| Glucose-free RPMI 1640 | Thermo Fisher Scientific | 11879020 | |
| IWR1 | Selleck | S7086 | |
| lactic acid | Sigma-Aldrich | L6661 | |
| Matrigel | BD Biosciences | BD356234 | |
| mTeSR1 | Stem Cell Technologies | 72562 | |
| O.C.T. Compound | SAKURA | 4583 | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| PowerUP SYBR Green MasterMix kit | Thermo Fisher Scientific | A25742 | |
| RPMI1640 | Thermo Fisher Scientific | 11875119 | |
| STEMdif Cardiomyocyte Freezing Medium/STEMdiff | Stem Cell Technologies | 5030 | |
| STEMdiff Cardiomyocyte Support Medium | Stem Cell Technologies | 5027 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| ultrasound coupling agent | CARENT | 22396269389 | |
| Y-27632 | Selleck | S6390 | |
| Equipment and Supplies | |||
| Applied Biosystems | Thermo Fisher Scientific | 7500 Real-Time PCR | |
| cryostat | Leica | CM1950 | |
| fluoresence microscope | Olympus | IX83 | |
| fine anatomical scissors | Fine Science Tools | 15000-08 | |
| fine dissecting forceps | Fine Science Tools | 11255-20 | |
| Micro syringe | Hamilton | 7633 | |
| Small animal anesthesia machine | MATRX | VMR | |
| Ultra-high resolution small animal ultrasound imaging system | VisualSonics | Vevo 2100 | |
| Software | |||
| Statistical Product and Service Solutions | IBM | 21 | |
| Image J | NIH | 1.48 | |
| Human mitochondrial DNA primers | |||
| the forward primer sequence | CCGCTACCATAATCATCGCTAT | ||
| the reverse primer sequence | TGCTAATACAATGCCAGTCAGG |
Riferimenti
- Leuschner, F., et al. Rapid monocyte kinetics in acute myocardial infarction are sustained by extramedullary monocytopoiesis. The Journal of Experimental Medicine. 209 (1), 123-137 (2012).
- Lázár, E., et al. Cardiomyocyte renewal in the human heart: insights from the fall-out. European Heart Journal. 38 (30), 2333-2342 (2017).
- Davis, M. K., et al. State of the art: cardiac transplantation. Trends in Cardiovascular Medicine. 24 (8), 341-349 (2014).
- Mancini, D., Colombo, P. C. Left ventricular assist devices: A rapidly evolving alternative to transplant. Journal of the American College of Cardiology. 65 (23), 2542-2555 (2015).
- Zimmermann, W. H. Translating myocardial remuscularization. Circulation Research. 120 (2), 278-281 (2017).
- Hu, X., et al. A large-scale investigation of hypoxia-preconditioned allogeneic mesenchymal stem cells for myocardial repair in nonhuman primates: Paracrine activity without remuscularization. Circulation Research. 118 (6), 970-983 (2016).
- Kempf, H., et al. Cardiac differentiation of human pluripotent stem cells in scalable suspension culture. Nature Protocols. 10 (9), 1345-1361 (2015).
- Chong, J. J., et al. Human embryonic-stem-cell-derived cardiomyocytes regenerate non-human primate hearts. Nature. 510 (7504), 273-277 (2014).
- Shiba, Y., et al. Allogeneic transplantation of iPS cell-derived cardiomyocytes regenerates primate hearts. Nature. 538 (7625), 388-391 (2016).
- Nguyen, P. K., et al. Potential strategies to address the major clinical barriers facing stem cell regenerative therapy for cardiovascular disease: A review. JAMA Cardiology. 1 (8), 953-962 (2016).
- Zimmermann, W. H. Remuscularization of the failing heart. The Journal of Physiology. 595 (12), 3685-3690 (2017).
- Hu, X., et al. Transplantation of hypoxia-preconditioned mesenchymal stem cells improves infarcted heart function via enhanced survival of implanted cells and angiogenesis. The Journal of Thoracic and Cardiovascular Surgery. 135 (4), 799-808 (2008).
- Feng, Y., et al. Heat shock improves Sca-1+ stem cell survival and directs ischemic cardiomyocytes toward a prosurvival phenotype via exosomal transfer: a critical role for HSF1/miR-34a/HSP70 pathway. Stem Cells. 32 (2), 462-472 (2014).
- Fan, C., et al. Cardiomyocytes from CCND2-overexpressing human induced-pluripotent stem cells repopulate the myocardial scar in mice: A 6-month study. Journal of Molecular and Cellular Cardiology. 137, 25-33 (2019).
- Lou, X., et al. N-cadherin overexpression enhances the reparative potency of human-induced pluripotent stem cell-derived cardiac myocytes in infarcted mouse hearts. Cardiovascular Research. 116 (3), 671-685 (2020).
- Sun, X., et al. Transplanted microvessels improve pluripotent stem cell-derived cardiomyocyte engraftment and cardiac function after infarction in rats. Science Translational Medicine. 12 (562), (2020).
- Wu, X., et al. Cardiac repair with echocardiography-guided multiple percutaneous left ventricular intramyocardial injection of hiPSC-CMs after myocardial infarction. Frontiers in Cardiovascular Medicine. 8, 768873 (2021).
- Kannappan, R., et al. Functionally competent DNA damage-free induced pluripotent stem cell-derived cardiomyocytes for myocardial repair. Circulation. 140 (6), 520-522 (2019).
- Lou, X., et al. N-cadherin overexpression enhances the reparative potency of human-induced pluripotent stem cell-derived cardiac myocytes in infarcted mouse hearts. Cardiovascular Research. 116 (3), 671-685 (2020).
- Zhao, M., et al. Y-27632 preconditioning enhances transplantation of human-induced pluripotent stem cell-derived cardiomyocytes in myocardial infarction mice. Cardiovascular Research. 115 (2), 343-356 (2019).
- Zhao, M., et al. Enhancing the engraftment of human induced pluripotent stem cell-derived cardiomyocytes via a transient inhibition of rho kinase activity. Journal of Visualized Experiments: JoVE. (149), e59452 (2019).
- O'Brien, J., Hayder, H., Peng, C. Automated quantification and analysis of cell counting procedures using ImageJ plugins. Journal of Visualized Experiments: JoVE. (117), e54719 (2016).
- Kain, V., Prabhu, S. D., Halade, G. V. Inflammation revisited: inflammation versus resolution of inflammation following myocardial infarction. Basic Research in Cardiology. 109 (6), 444 (2014).
- Rainer, P. P., et al. Cardiomyocyte-specific transforming growth factor β suppression blocks neutrophil infiltration, augments multiple cytoprotective cascades, and reduces early mortality after myocardial infarction. Circulation Research. 114 (8), 1246-1257 (2014).
- Yu, Y., et al. Human embryonic stem cell-derived cardiomyocyte therapy in mouse permanent ischemia and ischemia-reperfusion models. Stem Cell Research & Therapy. 10 (1), 167 (2019).
- Iwanaga, K., et al. Effects of G-CSF on cardiac remodeling after acute myocardial infarction in swine. Biochemical and Biophysical Research Communications. 325 (4), 1353-1359 (2004).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon