A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تقنيات الفحص المجهري لتفسير الاستعمار الفطري في أنسجة النباتات المتغايرة والإنبات التكافلي للبذور
In This Article
Summary
يهدف هذا البروتوكول إلى توفير إجراءات مفصلة لجمع وتثبيت وصيانة عينات النباتات المتغايرة ، وتطبيق تقنيات الفحص المجهري المختلفة مثل المسح المجهري الإلكتروني ونقله ، والمجهر الضوئي ، والكونفوكال ، والمجهر الفلوري لدراسة الاستعمار الفطري في الأنسجة النباتية والبذور المنبتة بالفطريات الفطرية.
Abstract
علم النبات الهيكلي هو منظور لا غنى عنه لفهم كامل للبيئة وعلم وظائف الأعضاء والتنمية وتطور النباتات. عند البحث في النباتات المتغايرة (أي النباتات التي تحصل على الكربون من الفطريات) ، يمكن للجوانب الرائعة من تكيفاتها الهيكلية ، وأنماط استعمار الأنسجة بواسطة الفطريات ، والتشريح المورفوغرافي للأعضاء الجوفية أن تنير استراتيجياتها التنموية وعلاقاتها مع hyphae ، مصدر العناصر الغذائية. دور مهم آخر للفطريات التكافلية يرتبط بإنبات بذور السحلية. جميع أنواع Orchidaceae هي mycoheterotrophic أثناء مرحلة الإنبات والشتلات (المتفطرة الأولية) ، حتى تلك التي تقوم بعملية التمثيل الضوئي في مراحل البالغين. بسبب نقص الاحتياطيات الغذائية في بذور السحلية ، فإن التكافل الفطري ضروري لتوفير الركائز وتمكين الإنبات. يمكن أن يجيب تحليل مراحل الإنبات من خلال وجهات النظر الهيكلية أيضا على أسئلة مهمة تتعلق بتفاعل الفطريات مع البذور. يمكن تطبيق تقنيات تصوير مختلفة للكشف عن النباتات الداخلية للفطريات في الأنسجة النباتية ، كما هو مقترح في هذه المقالة. يمكن تلطيخ الأجزاء اليدوية والرقيقة من الأعضاء النباتية ثم ملاحظتها باستخدام المجهر الخفيف. يمكن تطبيق الفلوروكروم المترافق مع أجغلوتينين جنين القمح على الفطريات واحتضانه مع Calcofluor White لتسليط الضوء على جدران الخلايا النباتية في المجهر البؤري. بالإضافة إلى ذلك ، يتم تفصيل منهجيات المسح المجهري الإلكتروني ونقله لبساتين الفاكهة المتغايرة ، ويتم استكشاف إمكانيات تطبيق هذه البروتوكولات في النباتات ذات الصلة. يتم وصف الإنبات التكافلي لبذور السحلية (أي في وجود الفطريات الفطرية) في البروتوكول بالتفصيل ، إلى جانب إمكانيات إعداد الهياكل التي تم الحصول عليها من مراحل مختلفة من الإنبات للتحليل باستخدام المجهر الضوئي والمشبك والإلكتروني.
Introduction
البحوث الهيكلية في علم النبات ، والتي تغطي مورفولوجيا النبات والتشريح ، أساسية في فهم الكائن الحي بأكمله1،2 ، وتوفر وجهات نظر لا غنى عنها لدمج والمساهمة في المعرفة المتعلقة بالبيئة وعلم وظائف الأعضاء والتنمية وتطور النباتات3. تشمل الطرق في مورفولوجيا النبات والتشريح حاليا البروتوكولات والمعدات والمعرفة التي تم تطويرها مؤخرا وكذلك منذ أكثر من قرن من الزمان2. إن التنفيذ المستمر والتكيف مع الأساليب الكلاسيكية (مثل المجهر الضوئي) جنبا إلى جنب مع التقنيات الحديثة (مثل المجهر البؤري ، التصوير المقطعي المصغر بالأشعة السينية) لها نفس الأساس الأساسي: المعرفة النظرية التي تمكن من تطوير منهجية.
الأداة الرئيسية في تشريح النبات والمورفولوجيا هي الصورة. على الرغم من الاعتقاد الخاطئ بأن هذه التحليلات هي ملاحظات بسيطة ، مما يعطي مساحة للتفسيرات الذاتية2 ، فإن تحليل وفهم الصور في هذا المجال يتطلب معرفة الأساليب المطبقة (المعدات ، ونوع التحليل ، والإجراءات المنهجية) ، ومكونات الخلية ، والكيمياء النسيجية ، وجسم النبات (تنظيم الأنسجة ووظيفتها ، وعلم الوراثة ، والتكيفات المورفولوجية). يمكن أن يؤدي تفسير الصور التي تم الحصول عليها عبر مجموعة متنوعة من الطرق إلى ربط الشكل والوظيفة ، وفك رموز التركيب الكيميائي للبنية ، والتأييد في وصف الأصناف ، وفهم العدوى بمسببات الأمراض النباتية ، وغيرها من التقييمات المماثلة.
عند البحث في النباتات المتغايرة (MH) (أي النباتات غير الضوئية التي تحصل على الكربون من الفطريات الفطرية 4,5) ، يمكن للجوانب الرائعة من تكيفاتها الهيكلية ، وأنماط استعمار الأنسجة بواسطة الفطريات ، والتشريح المورفوغرافي للأعضاء الجوفية أن تنير استراتيجيات تنميتها وعلاقاتها مع hyphae ، والتي هي مصدر العناصر الغذائية. عادة ما تظهر الأعضاء الجوفية لنباتات MH تكيفات مهمة تتعلق بارتباطها بفطريات التربة ، وبالتالي من الضروري إجراء هذه التحقيقات التشريحية والمورفولوجية6. لا ينبغي تجاهل الأعضاء الهوائية لأنواع MH ، حيث يمكن أن تكون النباتات الداخلية موجودة أيضا في هذه الأنسجة ، حتى لو لم تكن فطريات فطرية (ملاحظات شخصية ، لم تنشر بعد).
إلى جانب الجوهرية الراسخة لارتباط الفطريات الفطرية بأنواع MH خلال دورة حياتها بأكملها7 ، فإن كل أنواع السحلية ، حتى الأنواع ذاتية التغذية ، لها مرحلة أولية ملزمة من التغذية الفطرية في البيئات الطبيعية. يحدث ذلك لأن جنين بساتين الفاكهة غير متمايز ويفتقر إلى السويداء أو النبتات ، وبالتالي فهو غير قادر على التطور وتأسيس نفسه في البيئات الطبيعية دون الدعم الغذائي من الشركاء الفطريين 4,8. وبالنظر إلى أنه يمكن تطبيق بروتوكولات الإنبات التكافلي ليس فقط على أنواع MH ولكن أيضا على بساتين الفاكهة الضوئية ، بهدف التحقيق في خصوصية فطريات السحلية في الإنبات وتطوير البروتوكروم ، وهي منهجية مطبقة على نطاق واسع في مبادرات الحفاظ على الأنواع المهددة بالانقراض9،10،11.
في تجميع الطرق هذا ، نصف الخطوات المهمة التي ينطوي عليها جمع وتثبيت وتخزين عينات نبات MH للدراسات التشريحية (القسم 1) ، وتحليل السطح واختيار العينات (القسم 2) ، وطرق التقسيم (اليدوي: القسم 3 ، الميكروتوميا: القسم 4 ، الاستئصال المجهري بالتبريد: القسم 5) ، التلطيخ والتركيب (القسم 6) ، التألق والمجهر البؤري للنباتات الداخلية الفطرية (القسم 7) ، المجهر الإلكتروني الماسح (القسم 8) ، والمجهر الإلكتروني الناقل (القسم 9). بالإضافة إلى ذلك ، نصف طريقة الإنبات التكافلي لبذور السحلية (MH و autotrophic ، القسم 10) ، حيث يمكن تطبيق طرق التصوير المذكورة سابقا بنجاح لتحليل الاستعمار الفطري للبذور والبروتوكورمات والشتلات في عملية الإنبات.
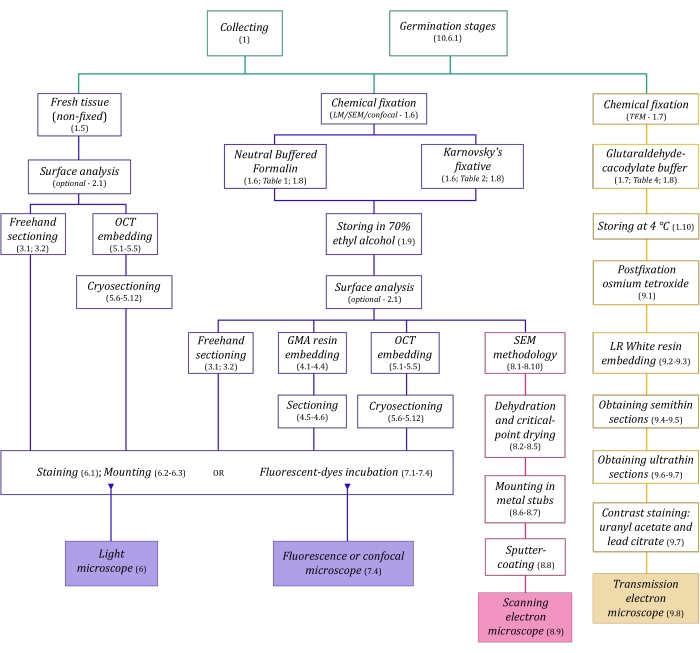
الشكل 1: التلخيص التخطيطي لطرق التصوير. توفر المخططات مؤشرات على خطوات البروتوكول التي يتم تفصيلها فيها. الاختصارات: GMA = ميثاكريلات غليكول ، OCT = مركب درجة حرارة القطع الأمثل ، SEM = المجهر الإلكتروني الماسح. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
يسبق تقنيات الفحص المجهري الموصوفة هنا بالتفصيل (الشكل 1) الخطوات الأساسية التالية: جمع العينات وإصلاحها وتجفيفها وتضمينها وتقسيمها. نظرا لأن الخطوات متغيرة (الشكل 1) اعتمادا على التقنية (التقنيات) المختارة ، فمن المهم التفكير في المستقبل ، مع مراعاة المثبتات التي سيتم إعدادها ونقلها إلى موقع التجميع ، وكيفية إعداد العينات قبل التثبيت ، وعمليات الجفاف التي سيتم استخدامها (القسم 1) ، وإمكانيات التضمين المختلفة وطرق التقسيم (الأقسام 4 ، 5 ، و 9). يلخص الشكل 1 بالتتابع جميع الخطوات المطلوبة لكل تقنية من تقنيات الفحص المجهري الموضحة بدقة أدناه.
Protocol
1. جمع العينات وتثبيتها وصيانتها
ملاحظة: يمكن العثور على نباتات MH بالكامل عادة في الغابة المظلمة تحت الأرض 12,13 ، خاصة في المناطق الرطبة والوفيرة بالقمامة ، في حين يمكن العثور على نباتات MH جزئيا في الغابات الأكثر انفتاحا 12,13. عادة ما تحتوي نباتات MH على أعضاء جوفية متطورة في مجموعة متنوعة من الأشكال والأحجام.
- عند جمع أنواع MH ، استكشف التربة حول قاعدة النبات ، مع الحرص على عدم إتلاف الأعضاء تحت الأرض ، وتجنب سحب النباتات من الأرض لمنع فصل الأعضاء الهوائية عن الأعضاء الجوفية.
- حفر بعناية حول الهياكل الهوائية باستخدام مجرفة البستنة أثناء استكشاف الأعضاء الجوفية مثل الجذور والسيقان والجذور وأجهزة التخزين ، دون الإضرار بهذه الهياكل.
- قم بإزالة جزيئات التربة للحفاظ على الهياكل الهشة ، واغسل هذه الأعضاء بدقة بماء الصنبور لشطف جزيئات التربة المتبقية قبل تثبيت العينات.
- تتطلب نباتات MH المرتبطة بفضلات الأوراق مزيدا من الاهتمام ؛ جمع الأعضاء المتصلة بالمواد المتحللة بعناية من خلال hyphae ، وتجنب سحب هذه الأعضاء من الهياكل المتصلة ، وجمعها بعناية لأن هذه الأجزاء حساسة للغاية. الحفاظ على الهياكل مع مثل هذه الاتصالات وجمع القمامة وكذلك للتحليل.
- إذا اخترت تحليل المواد الطازجة باستخدام تقنيات التصوير ، فقم بالحفاظ على العينات في أكياس بلاستيكية مغلقة ذات رطوبة كافية ، وكمية كافية من الماء تتبخر وترطب النبات ، مما يمنع الماء الزائد من ملامسة العينات. نقلها إلى المختبر فورا وتحليل العينات في نفس اليوم الذي تم جمعها فيه، مع الانتباه إلى ما إذا كانت العينات لا تزال محفوظة عند تحليلها.
- احمل المثبتات إلى موقع التجميع في حاويات محكمة الغلق. قم بإصلاح العينات بسرعة بعد جمعها للفحص المجهري الضوئي (LM) والمجهر الإلكتروني الماسح (SEM) في أي من المثبتات التالية: الفورمالين المخزن مؤقتا المحايد بنسبة 10٪ (NBF14 ، الجدول 1) أو محلول Karnovsky (المعدل15 ، الجدول 2). يمكن تحضير محلول كارنوفسكي باستخدام مخزن فوسفات15 سعة 0.2 متر ، وهي الوصفة الموضحة في الجدول 3.
- للتحليل بواسطة المجهر الإلكتروني الناقل (TEM) ، قسم العينات بسماكة 4-3 مم داخل قطرة من المخزن المؤقت لكاكوديليت الجلوتارالدهيد الصوديوم (المعدل16 ، الجدول 4) إلى أقسام أصغر بسماكة 1-2 مم. تخلص من الحواف المقطوعة خارج القطرة. انقل المقاطع على الفور إلى أنبوب تجميع بحجم مثبت أكبر بأكثر من 10 مرات من حجم العينات ، لأنه مثبت مضاف (أي أن جزيئاته تضاف كيميائيا إلى البروتينات الثابتة16).
تحذير: المثبتات الثلاثة الموصوفة شديدة السمية. تجنب الاستنشاق ، خاصة أثناء استخدامها في الميدان. تحضير جميع المثبتات في غطاء الدخان باستخدام القفازات. لا تخلط الكاكوديلات والأحماض ، حيث يمكن تشكيل غاز الزرنيخ16. - إذا كانت العينات الثابتة تطفو في المثبت ، فهذا يشير إلى وجود غاز في الأنسجة النباتية. يمنع الهواء والغازات الأخرى المثبت من اختراق العينة بأكملها2. قم بإزالة الغاز من الأنسجة عن طريق إعادة تشكيلها في أجزاء أصغر واستخدام مضخة تفريغ (ضغط -300 إلى -400 inHg) حتى تغرق جميع العينات في قاع المحلول17. كن حذرا لأن الضغط المفرط الذي تمارسه المضخة يمكن أن يتلف العينات.
- بعد 48 ساعة على الأقل في محلول كارنوفسكي أو 10٪ NBF ، اغسل العينات في 0.2 M PB (الجدول 3) وجففها بسلسلة من 10٪ و 30٪ و 50٪ وأخيرا 70٪ من الإيثانول. بالنسبة للعينات الحساسة ، قم بتجفيف لمدة 30 دقيقة في كل تركيز. بالنسبة للعينات الأكبر حجما، قم بتجفيف البشرة لمدة 1 ساعة أو أكثر.
ملاحظة: محلول الإيثانول بنسبة 70٪ هو الوسيط المثالي لتخزين العينات. يمكن تخزين العينات في 70٪ من الإيثانول في درجة حرارة الغرفة لسنوات. لا تقم بتخزين المواد النباتية لفترات طويلة في المثبتات ، لأن إزالة عوامل التثبيت هي خطوة أساسية بعد التثبيت2. - تخزين العينات في غلوتارالدهيد-كاكوديليت عند 4 درجات مئوية قبل الشروع في مرحلة ما بعد التثبيت (الخطوة 9.1).
| فورمالين مخزن مؤقتا محايد بنسبة 10٪ (NBF)14 | |
| الخطوة 1 | إضافة 10 مل من محلول الفورمالديهايد 37-40٪ في 80 مل من الماء المقطر |
| الخطوة 2 | إضافة 0.4 غرام من فوسفات الصوديوم مونوهيدرات أحادي القاعدة (NaH2PO4· H2O) إلى الحل |
| الخطوة 3 | إضافة 0.65 غرام من فوسفات الصوديوم ثنائي القاعدة ، اللامائي (Na2HPO4) |
| الخطوة 4 | تشكل حجم إلى 100 مل |
الجدول 1: 10٪ وصفة الفورمالين المخزن مؤقتا المحايد14.
| حل كارنوفسكي (المعدل15) | |
| الخطوة 1 | في 20 مل من الماء المقطر عند 60-70 درجة مئوية |
| الخطوة 2 | أضف 0.8 غرام من بارافورمالديهايد (للحصول على 4٪ ث / ف) ، مع التحريك |
| الخطوة 3 | أضف 1-4 قطرات من 40٪ NaOH وحرك حتى يصبح المحلول واضحا |
| الخطوة 4 | قم بتبريده وإضافة 30 مل من 0.2 م فوسفات عازل درجة الحموضة 7.2 (الجدول 3) |
| الخطوة 5 | تمييع 25٪ غلوتارالدهيد في 0.1 M PB (الرقم الهيدروجيني 7.2) للحصول على 1٪ glutaraldehyde (الحجم النهائي: ~ 60 مل) |
| الخطوة 6 | أضف 1٪ glutaraldehyde (الخطوة 5) إلى المحلول الذي تم الحصول عليه في الخطوة 4 حتى يتم تكوين ما يصل إلى 100 مل من المثبت |
الجدول 2: وصفة حل كارنوفسكي (المعدلة15).
| 0.2 م الفوسفات العازل (PB) درجة الحموضة 7.2 | |
| الخطوة 1 | إضافة 14.196 غرام من فوسفات الصوديوم ثنائي القاعدة ، اللامائي (Na2HPO4) إلى 400 مل من الماء المقطر |
| الخطوة 2 | إضافة 13.8 غرام من فوسفات الصوديوم مونوهيدرات أحادي القاعدة (NaH2PO4· H2O) |
| الخطوة 3 | يحرك المزيج حتى يصبح الحل واضحا |
| الخطوة 4 | ضبط الحجم النهائي إلى 500 مل بالماء المقطر |
| الخطوة 5 | ضبط الرقم الهيدروجيني إلى 7.2 |
| الخطوة 6 | للحصول على 0.1 م PB، قم بتخفيف 1:1 |
الجدول 3: وصفة العازلة للفوسفات 0.2 م.
| 3٪ غلوتارالدهيد 0.2 م الصوديوم كاكوديلات المخزن المؤقت (تعديل16) | |
| الخطوة 1 | 0.2 M كاكوديليت العازل: إضافة 4.28 غرام من الصوديوم كاكوديلات ثلاثي الهيدرات في 100 مل من الماء المقطر |
| الخطوة 2 | ضبط الرقم الهيدروجيني إلى 7.2 |
| الخطوة 3 | أضف 12 مل من 25٪ glutaraldehyde في 25 مل من المحلول في الخطوة 2 (0.2 M cacodylate buffer pH 7.2) |
| الخطوة 4 | تشكل حجم يصل إلى 100 مل مع الماء المقطر |
الجدول 4: 3٪ غلوتارالدهيد 0.2 م وصفة المخزن المؤقت كاكوديلات الصوديوم (المعدلة16).
2. التحليل السطحي للأعضاء في المواد الثابتة وغير الثابتة
- لتحليل الضجيج السطحي في الأعضاء ، وخاصة الأعضاء الجوفية ، وتلك التي تتلامس مع فضلات الأوراق ، لاحظ المواد الثابتة أو الطازجة في مجهر تشريح (المجهر المجسم) عند تكبير 7.5x أو أعلى ، اعتمادا على العينات التي تم تحليلها.
- تصور العينات المغمورة في الإيثانول المثبت بنسبة 70٪ (إذا تم تخزينها فيه) ، أو ماء الصنبور في حالة المواد الطازجة. منع الضوء المباشر من المجهر تشريح لأنه يمكن أن يجف وتلف العينات.
- ابحث عن مجالات الاهتمام في العينات ، مسترشدا ب hyphae السطحية و rhizomorphs. حدد العينات التي تحتوي على مناطق ذات ريزومورفات سطحية حيث يمكن تقسيمها لتصور بيلوتون ولفائف hyphae داخل الخلايا القشرية في الجذور والسيقان.
- بعد التحديد، اتبع الخطوتين 1.6 و1.9 إذا لم يتم إصلاح العينات بعد. إذا رغبت في ذلك ، قم بتصوير عينات جديدة باستخدام مجهر ضوئي دون تثبيت ، كما هو موضح في القسم 3.
- استخدم الكاميرا المقترنة بالمجهر المجسم لجمع الصور من أسطح الأعضاء والريزومورفات والهياكل الأخرى التي تمت ملاحظتها. في مثل هذه الحالات ، رتب للحصول على لون خلفية مناسب للتباين بشكل جيد مع المادة ، وإذا أمكن ، اختر مادة خلفية ذات سطح أقل خشونة (على سبيل المثال ، الورق).
3. أقسام اليد الحرة من الأعضاء النباتية
ملاحظة: يمكن أن تكون الأقسام اليدوية من الأعضاء النباتية صعبة ، خاصة بالنسبة للهياكل الصغيرة والرقيقة. ومع ذلك ، فإن هذه الأقسام من الأنسجة ذات النباتات الداخلية الفطرية يمكن ، في بعض الحالات ، أن تظهر بشكل أفضل hyphae وغيرها من الميزات مقارنة بالأقسام الرقيقة.
- قسم العينات الطازجة أو الثابتة بشفرة حادة ، وقطعها بأكبر قدر ممكن من النحافة وضعها على الفور في طبق بتري صغير بالماء (إذا كانت طازجة) أو 70٪ إيثانول (إذا تم إصلاحه). استخدم فرشاة طلاء صغيرة للتعامل مع الأقسام دون إتلافها.
- لتسهيل تقسيم المواد الأكثر تحديا (أي الأعضاء الصغيرة والرقيقة والمرنة) ، أحاط العينة في هيكل ، على سبيل المثال ، البوليسترين أو سيكروبيا بيتيول. نحت الدعم لاستيعاب العينة وجعل قسم رقيق من العينة والدعم تماما.
- قم بتلطيخ العينات وتركيبها كما هو موضح في القسم 6.
4. تضمين عينات النبات في الراتنج والتقسيم
- قم بتجفيف العينات المخزنة في 70٪ من الإيثانول بنسبة 80٪ ، و 96٪ ، و 2x في الإيثانول بنسبة 100٪ ، لمدة 30 دقيقة إلى 2 ساعة اعتمادا على حجم العينات وتكوينها.
- استخدم مجموعة راتنج ميثاكريليت جليكول (GMA) وفقا لتعليمات الشركة المصنعة. تحقق من Gerrits and Horobin (1996)18 لمزيد من الاعتبارات. اتبع خطوات التسلل والتضمين وفقا لذلك.
تحذير: راتنج GMA سام ، ويمكن أن يسبب الحساسية وتهيج الجلد والعينين والغشاء المخاطي. استخدم الكواشف في غطاء الدخان واستخدم القفازات. - استخدم صواني صب البولي إيثيلين للتضمين، والتي يتم اختيارها حسب حجم العينات (على سبيل المثال، 13 مم × 19 مم × 5 مم للعينات الكبيرة، 6 مم × 8 مم × 5 مم للعينات الأصغر). انتبه إلى اتجاه العينة المطلوب داخل القالب ، واستخدم إبرة للمساعدة في التوجيه.
- اتركيه للبلمرة ، ويفضل أن يكون ذلك في درجة حرارة الغرفة ، حتى يتصلب تماما. تستغرق عملية التصلب عادة بضع ساعات ، على الرغم من أنه يوصى بفك الكتل في اليوم التالي. بعد البلمرة ، افصل كتل الراتنج بعناية عن القوالب واستمر في إرفاق الكتل في أقرب وقت ممكن لتجنب انحناء الكتلة.
- قم برمل وجه كتلة الراتنج التي سيتم إرفاقها ، مما يخلق سطحا مستويا. قم بلصق كتلة الراتنج على مكعب خشبي (يوصى ب 2 سم × 2 سم × 3 سم) باستخدام مادة لاصقة سائلة من سيانواكريليت متوسطة اللزوجة (انظر جدول المواد). تأكد من أن الراتنج متصل تماما لتجنب المساس بالتقسيم.
- قم بإجراء التقسيم في ميكروتوم دوار كما هو موضح أدناه.
تنبيه: شفرات سكاكين microtome حادة جدا ويمكن أن تسبب حوادث. تأكد من التعامل معها باتباع جميع تدابير السلامة. قبل الاقتراب من السكين (على سبيل المثال ، لتغيير الكتلة ، لترطيب الراتنج) ، قم بقفل عجلة اليد الخشنة ووضع غطاء أمان الشفرة عليها. تخزين الشفرات التي تستخدم لمرة واحدة في الحالات المناسبة. كن حذرا للغاية عند استبدال الشفرات.
ملاحظة: يمكن استخدام أنواع مختلفة من السكاكين (على سبيل المثال ، يمكن التخلص منها أو ثابتة ؛ الزجاج أو الصلب) لقسم راتنج GMA18. تعتمد جودة الأقسام على مدى حدة السكين. تأكد من أن السكين متصل جيدا ولا يمكنه الحركة. قد تحتاج السكاكين التي تستخدم لمرة واحدة إلى تغييرها بانتظام لتحقيق تقسيم أفضل.- نعلق المكعب الخشبي بإحكام على حامل الكتلة. اضبط اتجاه التقسيم باستخدام مسامير التوجيه وتأكد من زاوية كافية للسكين باستخدام إمالة السكين. حدد سمك الأقسام ؛ استخدام إعداد أكثر سمكا للتشذيب وإعداد أرق للأقسام المحددة ، حيث تلتصق أقسام GMA بشكل أكثر ملاءمة بالشريحة الزجاجية عندما تكون أرق ؛ السماكة المقترحة للأنسجة النباتية هي 5-8 ميكرومتر.
- قبل البدء ، قم بتبريد الغرفة ، إذا لزم الأمر ، لأن درجات الحرارة المرتفعة تؤدي إلى تفاقم جودة الأقسام. قم بإعداد ما يلي للتقسيم: كوب بالماء المقطر ، صفيحة ساخنة ، فرش الطلاء (اثنان على الأقل) ، ملاقط دقيقة ، ماصة باستور ، شرائح زجاجية ، ورق ترشيح (أو ورق مناديل) ، وقلم رصاص (لتحديد العينات التي يتم تقسيمها).
- اضبط الصفيحة الساخنة على 50 درجة مئوية وضع الكأس عليها. انتبه إلى الاختلافات في التدفئة اعتمادا على مساحة الصفيحة الساخنة (عادة ، تسخن المنطقة الوسطى أكثر من الحواف ؛ تسخين الماء في الوسط ، ويفضل ذلك).
- اختر شريحة زجاجية ، وحددها بقلم رصاص ، وقم بماصة الماء المقطر الدافئ في جميع أنحاء سطح الشريحة. إذا لزم الأمر ، استخدم محلولا (على سبيل المثال ، المنظفات والماء ، أو 70٪ من الإيثانول) لكسر التوتر بين الماء والزجاج ، بحيث يتم تغطية الشريحة بأكملها بالتساوي. يجب تنظيف بعض أنواع الشرائح مسبقا باستخدام الإيثانول بنسبة 70٪ للحصول على التزام كاف بالقسم.
- ابدأ بالتقدم تدريجيا على وجه كتلة الراتنج نحو شفرة السكين. لا تحاول التقسيم دون التقدم في الكتلة أولا ، وإلا فقد تتلف المعدات والكتلة. إذا لزم الأمر ، قم بقص الكتلة باستخدام سمك أعلى (10 ميكرومتر وما فوق).
- عند الاقتراب من قسم مناسب ، قم بإجراء حركة ثابتة أحادية الاتجاه باستخدام عجلة اليد ، بحيث يتم إجراء القسم في وقت واحد. تحقق من رطوبة الراتنج. أثناء التقسيم ، قم بترطيب وجه الكتلة التي يتم قطعها بانتظام باستخدام فرشاة طلاء مغموسة في الماء المقطر إذا كانت هناك مشكلة في أقسام التجعيد. إزالة الماء الزائد مع المناديل الورقية.
- باستخدام زوج من الملقط الدقيق ، ضع القسم الذي تم الحصول عليه في الماء فوق الشريحة. عند ملامسة الماء ، يمتد راتنج GMA. إذا لزم الأمر ، استخدم فرشاة الطلاء لكشف الأقسام وتمديدها بلطف. استخدم فرشاة طلاء أخرى للحفاظ على الشفرة خالية باستمرار من حطام الراتنج. لا تقم بالتبديل بين فرش الطلاء لتجنب ترطيب الشفرة.
- بعد وضع جميع الأقسام المطلوبة في الشريحة في قائمة الانتظار ، جفف الوجه السفلي للشريحة وضعه فوق اللوحة الساخنة. قم بإزالة الماء الزائد من أعلى الشريحة عن طريق الغمس بلطف باستخدام ورق تصفية (اختياري). سوف تلتصق الأقسام عندما يتبخر الماء من الشريحة. لا تترك الشرائح لفترة طويلة جدا لمنع تلف الأقسام بسبب الحرارة الزائدة.
- قم بتخزين الشرائح في صندوق شرائح ، بعيدا عن الغبار والشمس ، واستخدمها للتلطيخ والإجراءات الأخرى. يمكن تخزين الشرائح لعدة سنوات.
5. تجميد العينات النباتية وتقسيمها باستخدام كريوستات
ملاحظة: الاعتبار الأساسي في التقسيم المبرد للأنسجة البيولوجية هو تقليل الضرر الناجم عن تكوين بلورات الجليد عند تجميد العينات. عادة ما يتم العلاج بالتبريد عن طريق غرس محاليل خاملة كيميائيا مثل الجلسرين أو السكروز19,20.
- قبل يوم واحد من تقسيم العينة، قم بتنفيذ الخطوات التالية.
- قم بتخفيف 100 مل من 0.2 م PB (الجدول 3) في 100 مل من الماء المقطر للحصول على 200 مل من 0.1 م PB. قم بإعداد حلول السكروز بنسبة 10٪ و 20٪ و 30٪ في 0.1 M PB (على سبيل المثال ، للحصول على محلول 10٪ ، أضف 2 جم من السكروز في 20 مل من المخزن المؤقت).
- للحصول على عينات طازجة، اغسلها في 0.1 م PB لمدة 30 دقيقة. بالنسبة للعينات في مثبت ، اغسلها في نفس المخزن المؤقت المستخدم لإعداد المثبت لمدة 30 دقيقة. بالنسبة للعينات التي تحتوي على 70٪ من الإيثانول ، قم بترطبها في 50٪ و 30٪ من الإيثانول واغسلها في 0.1 M PB لمدة 1 ساعة في كل محلول.
- احتضان العينات لمدة 2 ساعة في 10 ٪ السكروز ، 2 ساعة في 20 ٪ السكروز ، و 2 ساعة في 30 ٪ السكروز ، في درجة حرارة الغرفة. بعد ذلك ، احتضن بين عشية وضحاها في 30٪ من السكروز عند 4 درجات مئوية (أو على الأقل لمدة 3 ساعات ؛ الحد الأقصى للوقت هو 48 ساعة).
- في يوم التقسيم ، قم بإعداد 40٪ و 50٪ من السكروز في 0.1 مليون PB ؛ لا تقم بإعداد حلول السكروز أكثر من 12 ساعة مقدما. احتضان لمدة 2 ساعة في كل تركيز السكروز ، عند 4 درجات مئوية.
- للتضمين ، في قوالب صغيرة ، قم بعمل طبقة من مركب OCT (وسط درجة حرارة القطع الأمثل ، المستخدم لتضمين العينات وتجميدها ) واحتفظ بها عند -20 درجة مئوية للتجميد. يمكن أن تكون القوالب قوالب نسيجية منتظمة ، على الرغم من أنه لتسهيل فك تشكيل الكتل ، يمكن صنع الورق أو الصفيح باستخدام مكعب صغير كإطار وشريط لاصق.
- بعد تجميد الطبقة السفلية من مركب OCT في القوالب ، اعمل داخل غرفة cryostat (حوالي -27 درجة مئوية). ضع العينات المحتضنة في 50٪ من السكروز في القوالب ، في الاتجاه الذي سيتم تقسيمها فيه. عادة ما يكون الوجه العلوي للكتلة المكعبة وجها أفضل للتقسيم. ضع علامة في القالب حيث يتم وضع العينات ، بحيث يمكن قطع الكتلة بسهولة ، والحفاظ على الاتجاه الصحيح.
- أحاط العينات في مركب OCT وفجر أي فقاعة هواء تلمس العينات. قم بتجميدها عند -20 درجة مئوية. مع تجميد الكتل بالكامل ، ضعها داخل غرفة cryostat (حوالي -27 درجة مئوية). قم بفك تشكيل كل منها فقط قبل الاستخدام وانتبه إلى العلامات التي تشير إلى موقع العينة داخل الكتلة.
- نظرا لأن مركب OCT يتم قطعه بسهولة باستخدام شفرة ، فقم بقص الكتل بشكل مناسب قبل وضعها على الظرف. ضع بعض مركب OCT في تشاك cryostat وضع الكتلة بحيث يتم تقسيم الوجه العلوي. توفر الوجوه ذات المساحات الأصغر أقساما أفضل. انتظر حتى يتم توصيل الكتلة جيدا بالظرف واختبرها قبل البدء في القسم.
- ضع الظرف بإحكام في حامل الظرف. اضبط اتجاه التقسيم باستخدام مسامير الاتجاه. اضبط زاوية السكين باستخدام إمالة السكين. حدد سمك الأقسام. يمكن تقسيم العينات أكثر سمكا من أقسام الراتنج المعتادة. يتم الحصول على أقسام تتراوح بين 5-20 ميكرومتر بنجاح ، مع سهولة إنشاء أقسام أكثر سمكا (تجعيد أقل وضرر أقل للهياكل).
- تقدم وجه الكتلة المجمدة نحو شفرة السكين. لا تحاول التقسيم دون القيام بذلك ، وإلا يمكن فصل الكتلة عن الظرف وتلفها. إذا لزم الأمر ، قم بقص الكتلة باستخدام سمك أعلى (10 ميكرومتر وما فوق).
- عند الاقتراب من قسم مناسب ، ضع اللوحة المضادة للتدحرج (أي لوحة شفافة تحتفظ بالقسم) فوق السكين وقم بحركة ثابتة في اتجاه واحد باستخدام عجلة اليد ، بحيث يتم تصنيع القسم في وقت واحد. يمكن أن تحدث مشاكل التجعيد إذا كانت اللوحة المضادة للتدحرج بحاجة إلى تعديل (عادة ما تكون قابلة للتعديل في إشارة إلى الشفرة) أو إذا كان هناك حطام في الشفرة. نظف الشفرة باستمرار باستخدام فرشاة الطلاء لإزالة الحطام.
- استخدم شرائح خاصة بحيث تعلق الأقسام بسهولة ، مثل الشرائح المعزولة (التجارية أو المحضرة بنسبة 2٪ aminoalkylsilane في الأسيتون 21) ، أو الشرائح المحضرة باستخدام 500 ميكروغرام / مل poly-L-Lysine في الماء المقطر 21 أو 0.2٪ الجيلاتين (انظر التفاصيل21). حافظ على الشرائح في درجة حرارة الغرفة.
- لإلصاق القسم بالشريحة، ارفع اللوحة المضادة للتدحرج واجعل الشريحة تلمس القسم بسرعة. نظرا لأن الشريحة في درجة حرارة الغرفة ، يذوب القسم على الفور ويلتصق بالشرائح. انتبه إلى تحويل الوجه المعالج للشريحة إلى القسم ، والذي قد يبقى فوق السكين أو على الوجه الداخلي للوحة المضادة للتدحرج. لتجنب تجعيد المقاطع ، قم بتنفيذ هذه الخطوة بسرعة بمجرد رفع اللوحة واحرص على عدم التواء القسم.
- اترك الشريحة خارج غرفة cryostat (في درجة حرارة الغرفة) إذا كان سيتم إضافة أقسام جديدة إليها. بعد لصق جميع الأقسام المطلوبة على الشريحة ، احتفظ بها داخل غرفة cryostat أو في الفريزر (-20 درجة مئوية أو أقل). لا تعرض الشرائح للرطوبة. احتفظ بها في مربع شرائح وتذكر تحديد الشرائح بقلم رصاص.
ملاحظة: يمكن تخزين شرائح وكتل OCT عند -20 درجة مئوية ، وإن لم يكن لفترة طويلة جدا. لتحقيق نتائج أفضل، استخدم الشرائح والكتل في غضون بضعة أيام.
6. تلطيخ أقسام النبات والنباتات الداخلية للفحص المجهري الخفيف
ملاحظة: يمكن استخدام العديد من أنواع البقع لأقسام النباتات. من الصعب تلطيخ الفطريات الداخلية والأنسجة النباتية بشكل مختلف. على الرغم من أنه ليس إجراء تلطيخ ، يتم تقديم طريقة لوضع علامات على هياكل الفطريات في القسم 7 (التألق مع اقتران جرثومة القمح agglutinin). يمكن تلطيخ المقاطع اليدوية (الموضحة في القسم 3) ، وأقسام الراتنج (القسم 4) ، والمقاطع المبردة (القسم 5) ، على الرغم من أن البقع القائمة على الفينول والكحول تشكل تحديا لهذه العينات حيث يفقد راتنج GMA و OCT الالتزام بالشريحة في هذه الحالات.
- استخدم واحدة أو اجمع بين طرق التلطيخ المعتادة التالية لعينات النباتات.
- Toluidine Blue O22,23 ، وهي طريقة مطبقة على نطاق واسع للتلطيخ العام لأقسام النبات. تحضير محلول من 0.05٪ تولويدين الأزرق O في 0.1 M الفوسفات (الرقم الهيدروجيني 6.8) أو 0.09 M سيترات العازلة (الرقم الهيدروجيني 4.5-4.8) ، وهذا يتوقف على أنواع وأنواع الأنسجة. احتضان أقسام راتنج GMA لمدة 2-10 دقائق باستخدام جرة تلطيخ الشرائح أو عن طريق وضع بعض القطرات فوق الأقسام إذا كانت بعض الشرائح ملطخة. اغسل بعناية بالماء المقطر أو العازل بعد الحضانة وقم بتركيب الشرائح بالماء أو جففها على صفيحة ساخنة لإنتاج شرائح دائمة كما هو موضح في الخطوة 6.3.
- كاشف Lugol2 يشير إلى وجود النشا. تحضير محلول اليود 5٪ (I2) و 10٪ يوديد البوتاسيوم (KI) في الماء المقطر. بقع المقاطع لمدة 2 دقيقة ، عن طريق إضافة بضع قطرات فوق الشريحة ، ثم تغسل بالماء المقطر. عادة ما يتم تطبيق هذا الاختبار الكيميائي النسيجي على الشرائح المؤقتة.
- السودان الثالث والرابع والأسود B24,25 وصمة عار للدهون المختلفة. تحضير محلول من 0.3 ٪ السودان (الثالث ، الرابع ، أو الأسود B) في 70 ٪ من الإيثانول ، وتسخينه حتى الغليان ، واتركه يبرد. استخدم السوبرناتانت ، وقم بتصفيته ، واحتضن الأقسام لمدة 15-30 دقيقة في طبق بتري مغلق. اغسل الأقسام بعناية بنسبة 70٪ من الإيثانول والماء المقطر. قم بتركيب الشرائح بالماء (عادة ما يتم تطبيقها فقط على الشرائح المؤقتة).
ملاحظة: بما أن السودان عبارة عن صبغة تعتمد على الكحول ، فهي أكثر ملاءمة للأقسام اليدوية. قم بإجراء تلطيخ قسم راتنج GMA بعناية لأنها عادة ما تنفصل عن الشريحة.
- بالنسبة للشرائح المؤقتة ، قم بتركيب الأقسام في الماء أو الجلسرين وراقبها لاحقا. قم بإغلاق الغطاء بطلاء الأظافر للحفاظ عليه لفترة أطول قليلا.
- بالنسبة للشرائح الدائمة، قم بتركيب الأقسام باستخدام راتنجات اصطناعية (على سبيل المثال، وسط التركيب السريع، انظر جدول المواد). قم بالتنقيط بضع قطرات من وسط التركيب (يمكن أن يفيض الغطاء على الغطاء) ، وضع الغطاء بعناية لتجنب الفقاعات ، واستخدم أوتاد الملابس للضغط على الشريحة ضد الغطاء حتى تجف تماما. قم بإزالة الفائض من وسط التركيب المجفف باستخدام شفرة حلاقة.
7. تطبيق الفلوروكروم المترافق مع أجلوتينين جنين القمح في التألق والمجهر البؤري
ملاحظة: يمكن تطبيق هذه الطريقة على الأقسام اليدوية (الموضحة في القسم 3) وأقسام الراتنج (القسم 4) والمقاطع المبردة (القسم 5). يمكن أن تكون المقاطع المبردة كافية لأغراض الفحص المجهري البؤري ، حيث يمكن توفير عينات أكثر سمكا عند مقارنتها بمقاطع الراتنج ، ولكن ليس بسمك العينات اليدوية. يتم تطبيق الفلوروكروم المقترن بجرثومة القمح agglutinin (WGA ، انظر جدول المواد) على التصوير الفطري في المجهر الفلوري26. المجهر البؤري ليس ضروريا ، على الرغم من أنه يمكن أن يوفر صورا ثلاثية الأبعاد واضحة للهياكل النباتية27.
- قم بإعداد محلول من 0.2 ملغ / مل من WGA-fluorochrome المقترن في 0.1 M PB28 (الرقم الهيدروجيني 7.2 ، تحقق من الخطوة 5.1.1 والجدول 3). تحضير محلول من 1 ٪ Calcofluor الأبيض في 0.1 M PB (الرقم الهيدروجيني 7.2). قم بإعداد كميات صغيرة من هذه الحلول ، حيث يتم احتضان الأقسام مباشرة معها.
- احتضن الأقسام الموجودة في الشرائح الزجاجية لمدة 30 دقيقة في محلول WGA-fluorochrome المقترن29 ، باستخدام حجم كاف لتغطية الأقسام ، ثم اغسلها في 0.1 M PB.
- احتضان الأقسام في محلول calcofluor ، باستخدام حجم كاف كوسيط تركيب. يمكن الحفاظ على الحل خلال فترة الملاحظة.
- ضع أغطية على الشرائح وراقبها في المجهر البؤري أو المجهر الضوئي الفلوري باستخدام المرشحات التالية: TC / GFP (الإثارة: 470-440 ، الانبعاثات: 525-550 ، ل WGA-fluorochrome في جدول المواد - فلوريسات جدار الخلية الفطرية الخضراء تحت هذا المرشح29) و DAPI (الإثارة: 358 ، الانبعاثات: 463 ، ل Calcofluor White)30.
ملاحظة: يمكن الحصول على صور ثلاثية الأبعاد باستخدام وظيفة السلسلة Z في المجهر البؤري27.
8. المجهر الإلكتروني الماسح للأعضاء النباتية
- بعد تثبيت العينات ، وإجراء الجفاف ، وتخزين 70٪ من الإيثانول (القسم 1) ، فإن أحد الاحتمالات هو قطع العينات لفضح أي سطح مرغوب فيه لتحليل SEM ، إذا لزم الأمر (على سبيل المثال ، الأنسجة الداخلية ، بنية المبيض). استخدم شفرة حلاقة حادة وجديدة وقم بإجراء جروح بحركة أحادية الاتجاه ، وتجنب المظهر التالف لهذه المناطق في SEM. إذا لزم الأمر ، استخدم المجهر المجسم لاختيار العينات والنظر في منطقة الكعوب المعدنية لتحديد أحجام العينات.
- مزيد من عينات الجفاف ل SEM في سلسلة إيثانوليك: 80٪ ، 96٪ ، و 2x في الكحول الإيثيلي المطلق (≥99.8٪). الحفاظ على عينات صغيرة وحساسة لمدة 30 دقيقة في كل تركيز وعينات أكبر وأكثر كثافة لمدة 1 ساعة.
- قم بطي المظاريف الصغيرة باستخدام المناديل الورقية لتنظيم العينات للخطوات التالية ، ويمكن التعامل مع العينات الأكبر حجما بدون مظروف. حدد المغلفات بقلم رصاص عن طريق كتابة حرف أو رقم، واحتفظ بسجل لجميع العينات في كل منها. احتفظ بالعينات في الإيثانول المطلق ، وإن لم يكن لفترة طويلة ، وانتقل إلى الخطوة 8.4 في أقرب وقت ممكن.
- تابع تجفيف النقطة الحرجة (CP). قم بتشغيل مجفف CP وفقا لإجراءات التشغيل القياسية. ضع عينات في الإيثانول المطلق (السائل المتوسط) في غرفة الضغط. عند النقطة الحرجة CO2 (31 درجة مئوية ، 7.3 × 106 باسكال) يذوب السائل الوسيط في السائل الانتقالي (ثاني أكسيد الكربون السائل) ، ويتم تجفيف العينات31.
- بعد تجفيف CP ، قم بتخزين العينات في أقرب وقت ممكن في حاوية تجفيف ، على سبيل المثال ، قارورة مغلقة تحتوي على هلام السيليكا. الرطوبة الجوية يمكن أن تدمر العينات إذا أعيد امتصاصها31.
- استخدم كعبا معدنيا لتركيب العينات. قبل التركيب ، ضع قفازات للتلاعب بالكعب ، واغمرها في الأسيتون لمدة 5 دقائق للقضاء على أي دهون ، واتركها تجف. استخدم شريطا لاصقا كربونيا موصلا على الوجهين لإصلاح العينات على الكعب ، ومجهرا مجسما للمساعدة في وضع العينات ، مع الأخذ في الاعتبار أن البصر من الأعلى هو المنظور الوحيد الممكن في صور SEM.
- تعامل مع العينات باستخدام ملاقط النقاط الدقيقة ، مع توخي الحذر لأن جزء العينة الذي تلمسه الملقط عادة ما يكون تالفا ، لذا حاول لمس الأجزاء الموضوعة بعيدا عن مناطق الاهتمام (على سبيل المثال ، المناطق الملامسة للشريط). الحفاظ على الكعب مع عينات في طبق بتري مختوم مع هلام السيليكا. انتقل إلى الخطوة 8.8 في أقرب وقت ممكن.
- استخدم طبقة من المعدن ، عادة ما تكون ذهبية أو بلاتينية ، على سطح العينات في جو منخفض الضغط لغاز خامل ، وغالبا ما يكون الأرجون31. اتبع إجراءات التشغيل القياسية عند استخدام طبقة التخفيف. يعتمد سمك الطلاء على تضاريس العينات ، وعادة ما يتراوح بين 15-40 نانومتر32.
- حافظ على الكعوب المطلية في طبق بتري مختوم مع هلام السيليكا ، وبشرط أن يحتفظ هلام السيليكا بالرطوبة ، يمكن تخزين العينات بهذه الطريقة لأسابيع. استخدم المجهر الإلكتروني الماسح لتحليل العينات. يتم ضرب العينات الموجودة في الفجوات بواسطة حزمة من الإلكترونات ، ويتم تفسير انبعاث الإشارات من هذا التفاعل على أنه صور31. للحصول على تفاصيل حول تشغيل المجهر الإلكتروني الماسح ، اقرأ Jeffree and Read (1991)31 و Bozzola and Russell (1999)32.
- لإعادة استخدام الكعب ، اسحب الشريط اللاصق وافركه بالصوف السلكي. اغسل في ماء الصنبور ، وانغمس في الإيثانول المطلق ، وجففه بشكل كاف ، مما يمنع أكسدة المعدن المكون.
9. المجهر الإلكتروني الناقل
- عينات البادئة مع المخزن المؤقت غلوتارالدهيد-كاكوديليت كما هو موضح في الخطوتين 1.7 و 1.10. بعد 12-24 ساعة من البادئة ، اغسل العينات 3x في 0.2 M cacodylate buffer (الرقم الهيدروجيني 7.25) لمدة 10 دقائق. قم بإجراء التثبيت اللاحق باستخدام رابع أكسيد الأوزميوم بنسبة 1٪ (OsO4) في مخزن مؤقت كاكوديليت 0.2 M ، لمدة 12 ساعة في الظلام ، في درجة حرارة الغرفة. اغسل 3 مرات بالماء المقطر لمدة 5 دقائق.
تحذير: الكاكوديلات ورابع أكسيد الأوزميوم شديدا السمية ولا ينبغي استنشاقهما. استخدمها في أغطية الدخان ، بعد أوراق بيانات السلامة المعنية. - تجفيف العينات بنسبة 30٪ و 50٪ و 70٪ و 96٪ من الإيثانول ، 2x في كل تركيز ، لمدة 10 دقائق. ثم ، جفف 3x في الكحول المطلق ، لمدة 15 دقيقة في كل مرة.
- تسلل العينات في راتنجات الأكريليك المحبة للماء (انظر جدول المواد) ، مرة واحدة مع راتنج 1: 1 + الإيثانول المطلق و 3x مع الراتنج النقي لمدة 8-12 ساعة لكل منهما. قم بإجراء البلمرة في كبسولات الجيلاتين عند 60 درجة مئوية حتى تتصلب تماما (12 ساعة كحد أقصى17).
- تقييم دقيق لاتجاه العينات داخل كتلة الراتنج ؛ قطع الجزء العلوي من الكتلة ، باستخدام شفرة حلاقة ، مما يجعل الشكل الهرمي الذي يركز العينة في منطقة التقسيم. احصل على مقاطع شبه رقيقة (250-500 نانومتر)33 في ميكروتوم فائق الصغر بسكين الماس وضعها على شرائح زجاجية في بضع قطرات من الماء.
- احتفظ بالشرائح على صفيحة ساخنة عند 60 درجة مئوية. قم بتلطيخ الأقسام باللون الأزرق تولويدين O كما في الخطوة 6.1.1 واترك البقعة تجف تماما. يغسل بعناية بماء الصنبور. تقييم القسم الذي تم الحصول عليه عن طريق رسم أربعة أرباع واختيار الربع الأنسب للتحليل.
- قم بقص الكتلة بحيث يركز الشكل الهرمي على الربع المختار على الوجه العلوي للكتلة. إنتاج أقسام رقيقة جدا (50-100 نانومتر) 33,34. يتم تقييم السماكة وفقا للون التداخل للأقسام: تظهر الأقسام التي يبلغ طولها حوالي 70 نانومتر من الفضة والذهب ، مع حوالي 100 نانومتر تظهر من الذهب ، ومع حوالي 200 نانومتر تظهر باللون الأزرق34.
- اجمع المقاطع الرقيقة جدا من الماء باستخدام شبكات نحاسية وانتقل إلى طريقة تلطيخ التباين مع خلات اليورانيل وسترات الرصاص ، كما هو موضح أدناه.
- تحضير محلول سترات الرصاص (الجدول 5) وتجميد الحل النهائي في أنابيب الطرد المركزي الدقيق مع 1 مل من المحلول في كل منها ، فقط تذوب مباشرة قبل الاستخدام.
- تحضير محلول أسيتات اليورانيل: قم بإذابة 0.625 جم من خلات اليورانيل [UO 2 (CH3COO)2] في 25 مل من الماء المقطر المغلي والمبرد مؤخرا. يخزن في قارورة داكنة في الفريزر.
تحذير: نترات الرصاص سامة إذا تم تناولها. 1 N NaOH شديد التآكل. خلات أورانيل مشعة وسامة. يجب عدم تناوله أو استنشاقه أو ملامسته للجلد. - عند التلطيخ ، ضع كلا الكواشف المحضرة في محاقن منفصلة سعة 3 مل مع وحدات تصفية (مسام 0.22 ميكرومتر ، انظر جدول المواد). قم بإعداد طبق بتري مقلوبا رأسا على عقب مع فيلم لدائن حرارية مانعة للتسرب فوقه (انظر جدول المواد) وداخل طبق أوسع ، مع كريات NaOH على الحواف كمصيدة ل CO 2 32 (انظر الشكل 2).
- تخلص من القطرة الأولى ، وفوق الفيلم ضع قطرة من خلات اليورانيل وثلاث قطرات من الماء المقطر لكل شبكة ملطخة. افعل الشيء نفسه مع سترات الرصاص وأضف ثلاث قطرات أخرى من الماء المقطر.
- احتضان الشبكة (مع الجانب غير الشفاف لأسفل ، حيث توجد الأقسام) في اليورانيل لمدة 30 دقيقة (وقت متغير). اغسل 3 أضعاف في قطرات الماء المقطر ، وقم بتجفيف الشبكة في كل مرة بلطف باستخدام ورق الترشيح على الجانب اللامع. كرر ذلك مع قطرة سترات الرصاص (30 دقيقة) واغسلها.
- بعد 4 ساعات على الأقل ، قم بتحليل الشبكات في المجهر الإلكتروني الناقل. في هذا المجهر ، يمر شعاع من الإلكترونات عبر الأقسام الموجودة في فراغ ويتم عرض الصورة على شاشة فلورسنت. للحصول على تفاصيل حول تشغيل المجهر الإلكتروني الناقل ، اقرأ Bozzola and Russell (1999) 32.
| محلول سترات الرصاص (لتلطيخ تباين TEM) | |
| الخطوة 1 | تحيط دورق مع تينفويل |
| الخطوة 2 | إذابة 0.266 غرام من نترات الرصاص [Pb(NO3)2] في 6 مل من الماء المقطر المغلي والمبرد مؤخرا |
| الخطوة 3 | إثارة لمدة 2 دقيقة |
| الخطوة 4 | أضف 0.352 جم من سترات الصوديوم الثلاثية [Na3 (C6H5O7).2H2O] (يجب أن يكتسب المحلول مظهرا حليبي) |
| الخطوة 5 | حرك لمدة 15 دقيقة ، وختم الكأس مع صفيح ونقل الحل إلى كوب 10 مل |
| الخطوة 6 | أضف 1.6 مل من 1N NaOH و 2.4 مل من الماء المقطر (يجب أن يكون المحلول شفافا) |
| الخطوة 7 | إذا لزم الأمر ، اضبط الرقم الهيدروجيني بالقرب من 12 |
الجدول 5: وصفة محلول سترات الرصاص.

الشكل 2: مخطط تلطيخ التباين مع محاليل سترات الرصاص وأسيتات اليورانيل . (أ) تحضير أطباق بتري ، واحدة مقلوبة رأسا على عقب (في الوسط) مع فيلم اللدائن الحرارية بحيث يمكن وضع قطرات فوقها ، داخل واحدة أوسع. كريات NaOH هي أماكن حول الطبق المركزي. (ب) توضع قطرات خلات اليورانيل في الدوائر بالحرف U ، وقطرات سترات الرصاص في الدوائر التي تحمل علامة L. DW تشير إلى قطرات من الماء المقطر. يتم تلطيخ الشبكات بالتتابع في العمود ، لذلك يمكن تلطيخ خمس شبكات في وقت واحد كما هو ممثل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
10. الإنبات التكافلي لبذور السحلية
- تأكد من أن المحاليل وجميع المواد المستخدمة في الإنبات التكافلي للبذور معقمة لتجنب التلوث. ابدأ بتعقيمها لمدة 20 دقيقة عند 121 درجة مئوية. يتم تلخيص خطوات الإنبات التكافلي في الشكل 3.
- قم بتطهير الفواكه والبذور بشكل سطحي عن طريق غمرها في محلول هيبوكلوريت الصوديوم الذي يحتوي على 2٪ من الكلور النشط لمدة 10-15 دقيقة للفواكه و 7-10 دقائق للبذور ، مع مراعاة صلابة وسمك معطف البذور9. يمكن غمر البذور الرفيعة والهشة في محلول هيبوكلوريت الصوديوم المخفف 1: 1. بعد ذلك ، اغسل 3x في الماء المقطر المعقم لإزالة محلول هيبوكلوريت.
- استرجع البذور عن طريق التصفية في نسيج تسلسلي واستخدم البذور للمضي قدما في اختبارات الإنبات (يفضل ذلك). إذا لزم الأمر ، قم بتخزينها في مظاريف ورقية مصفاة داخل قوارير زجاجية مع هلام السيليكا ، عند 4 درجات مئوية ، وأغلق القوارير بإحكام وأغلقها بفيلم التشبث. انقل بعض قطرات الماء من الغسيل الأخير إلى أجار سكر العنب البطاطس (PDA ، 39 جم / لتر) ، لتقييم فعالية عملية الغسيل.
- قبل بذر البذور في وسط الاستزراع ، قم بتقييم جدواها من خلال اختبار التترازوليوم (اختياري) كما هو موضح أدناه35.
- احتضان ما يقرب من 10 ملغ من البذور في أنبوب الطرد المركزي الدقيق مع 1 مل من السكروز 10 ٪ في الماء المقطر ، لمدة 24 ساعة في درجة حرارة الغرفة (حوالي 25 درجة مئوية) ، في الضوء.
- قم بإزالة محلول السكروز باستخدام ماصة دقيقة وأضف 1 مل من محلول رباعي الأزيوليوم بنسبة 1٪ (كلوريد ثلاثي فينيل تترازوليوم) في الماء المقطر. احتضان في 40 درجة مئوية في كتلة حرارية لمدة 24 ساعة في الظلام.
- قم بإزالة محلول التترازوليوم باستخدام ماصة دقيقة واغسل البذور بالماء المقطر 2x أو حتى تتم إزالة المحلول. إزالة جميع السوائل. إذا لزم الأمر ، يمكن تخزين البذور في الفريزر لمدة تصل إلى أسبوع (كما هو الحال في الخطوة 10.3) قبل تحليلها.
- أعد تعليق البذور في الماء المقطر وقم بتحليلها تحت المجهر الضوئي. تكتسب البذور القابلة للحياة لونا أحمر فاتحا إلى داكن ، بينما تحتفظ البذور غير القابلة للحياة بلونها الطبيعي.
- قم بإجراء بروتوكول9 المعدل التالي للإنبات التكافلي لبذور السحلية.
- احتضن البذور فوق أقراص ورق ترشيح معقمة (قطرها 1-2 سم) موضوعة في أطباق بتري مع وسط استزراع أجار الشوفان (OMA) (2.5 جم / لتر من رقائق الشوفان و 7 جم / لتر من الأجار ، درجة الحموضة 6).
- في وسط طبق بتري ، قم بتلقيح جزء من وسط الثقافة (حوالي 1 سم2) يحتوي على الميسيليوم من الفطريات المعزولة المختارة لإجراء الإنبات. قم بإغلاق أطباق بتري بفيلم التشبث واحتضنها في الظلام عند حوالي 25 درجة مئوية أو درجة حرارة الغرفة ، لأنها أكثر ملاءمة للنمو الفطري.
- قم بإعداد بعض الأطباق بالبذور وبدون تلقيح فطري ، كعنصر تحكم سلبي لاختبار الإنبات.
- تحليل نتائج الإنبات أسبوعيا ، من خلال جمع البيانات الكمية والنوعية وتصوير البروتوكورمات والشتلات. يجب إجراء مراقبة البذور والبروتوكورمات باستخدام المجهر المجسم لإجراء تقييم أكثر دقة للإنبات. استخدم مصدر ضوء قادم من الأسفل ، لأنه يسمح بمزيد من التباين ، مما يجعل من الممكن التمييز بين الميسيليوم الفطري والبروتوكورمات بسهولة أكبر.
- جمع العينات في مراحل النمو المختلفة وإصلاحها للتحليلات التشريحية (القسم 1). تطبيق جميع تحليلات الصور الموصوفة سابقا للتحقيق في النباتات الداخلية الفطرية في البذور والبروتوكورمات والشتلات أثناء الإنبات (الفحص المجهري الضوئي - الأقسام 4 و 5 و 6 ؛ البؤرة والفلورية - القسم 7 ؛ SEM و TEM - القسمان 8 و 9).
- توليد نتائج كمية بعد تصنيف المراحل وفقا للجدول 6. تصف المراحل التطور المعتاد للبذور من بساتين الفاكهة المتغايرة التجميلية. جمع البيانات أسبوعيا وجدولتها بالتواريخ الأولية لكل مرحلة تمت ملاحظتها.
- بالإضافة إلى ذلك ، قم بجمع بيانات كمية تقدر نسبة الإنبات ومعدله. عد ما لا يقل عن 100 بذرة أو حدد حقول العد35. حدد ثلاثة حقول عد أو أكثر لكل طبق بتري ، يتكون من مناطق ثابتة ذات منطقة موحدة ، وقم بتقييمها أسبوعيا. حساب البيانات المجمعة وفقا لمعادلة مؤشر النمو (GI):

حيث N 0 هو عدد البذور المعدودة في المرحلة0 ، يشير N 1 إلى المرحلة1 ، ويتبع حتى المرحلة 6 (المسجلة باسم N6)36.
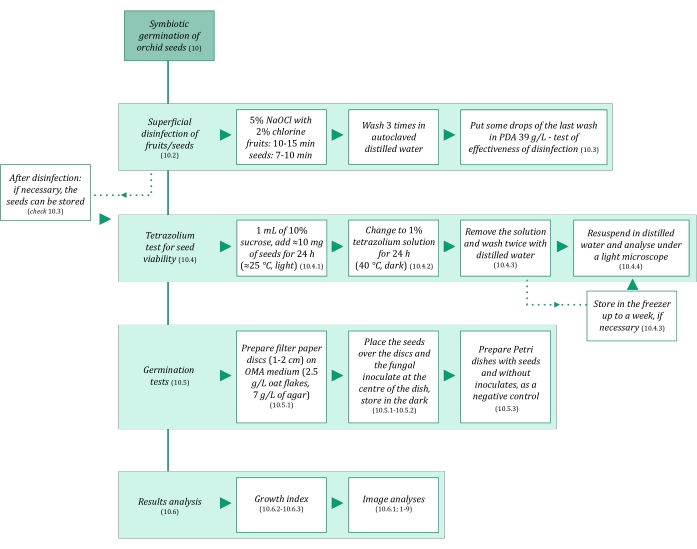
الشكل 3: التلخيص التخطيطي لمنهجية الإنبات التكافلي للبذور. وتقدم المخططات مؤشرات على الخطوات التفصيلية الواردة في البروتوكول. الاختصارات: OMA = أجار دقيق الشوفان ، PDA = أجار سكر العنب البطاطا. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| مرحلة الإنبات | وصف |
| 0 | لا إنبات |
| 1 | تورم الجنين |
| 2 | تمزق تيستا |
| 3 | تطور الشعر الماص |
| 4 | تطور الإسقاط الجذعي |
| 5 | تطوير موازين الحماية (الشقوق) |
| 6 | الجذور الأولى تتطور |
الجدول 6: وصف مراحل نمو البروتوكورم المطبقة على التحليلات الدورية لاختبارات الإنبات. () عدلت من المراحل الموصوفة في Otero et al.36.
النتائج
بعد المراحل الأساسية لتثبيت الأنسجة النباتية ينتج هياكل خلوية مشابهة قدر الإمكان للحالة الحية ، مع الأخذ في الاعتبار مورفولوجيا المكونات والأنسجة الخلوية وحجمها وتنظيمها المكاني16. لاحظ هذه السمات في العينات بعد التثبيت الكيميائي (الشكل 4). يمثل ا?...
Discussion
تتمتع تحليلات الصور في تشريح النبات ومورفولوجيا بإمكانات مهمة لتحقيق الأهداف والمساعدة في فهم العلاقات بين النباتات المتغايرة والنباتات الداخلية الفطرية التي لا غنى عنها ، كما يتضح من دراسات الأعضاء الجوفية 6,40 ، والتحليلات الهيكلية للإنبات التكافلي للبذور3...
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
يشكر المؤلفون التمويل المقدم من FAEPEX و FAPESP (2015/26479-6). يشكر MPP Capes على منحة درجة الماجستير (العملية 88887.600591/2021-00) و CNPq. JLSM يشكر CNPq على منح الإنتاجية (303664/2020-7). ويشكر المؤلفون أيضا الوصول إلى المعدات والمساعدة التي يقدمها مختبر المجهر الإلكتروني - IB/Unicamp)، والمعهد الوطني للعلوم والتكنولوجيا في مجال الضوئيات المطبقة على بيولوجيا الخلية - Unicamp)، ومختبر بيولوجيا الأوعية الدموية - DBEF/IB/Unicamp)؛ LAMEB (UFSC) وإليانا دي ميديروس أوليفيرا (UFSC) للمساهمات في بروتوكول الحماية من التبريد ؛ LME للمساهمات في بروتوكول TEM.
Materials
| Name | Company | Catalog Number | Comments |
| Acetone | Sigma-Aldrich | 179124 | (for SEM stubs mounting) |
| Agar-agar (AA) | Sigma-Aldrich | A1296 | (for seeds germination tests) |
| Calcofluor White Stain | Sigma-Aldrich | 18909 | fluorescent dye (detects cellulose) |
| Citrate Buffer Solution, 0.09M pH 4.8 | Sigma-Aldrich | C2488 | (for toluidine blue O staining) |
| Conductive Double-Sided Carbon Tape | Fisher Scientific | 50-285-81 | (for SEM) |
| Confocal Microscope | Zeiss | (any model) | |
| Copper Grids | Sigma-Aldrich | G4776 | (for TEM) |
| Critical-point dryer | Balzers | (any model) | |
| Cryostat | Leica Biosystems | (any model) | |
| Dissecting microscope | Leica Biosystems | (= stereomicroscope, any model) | |
| Entellan | Sigma-Aldrich | 107960 | rapid mounting medium for microscopy |
| Ethyl alcohol, pure (≥99.5%) | Sigma-Aldrich | 459836 | (= ethanol, for dehydration processes) |
| Formaldehyde solution, 37% | Sigma-Aldrich | 252549 | (for NBF solution preparation) |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128 | histological tissue fixative |
| Gelatin capsules for TEM | Fisher Scientific | 50-248-71 | (for resin polymerisation in TEM) |
| Gelatin solution, 2% in H2O | Sigma-Aldrich | G1393 | (dilute for slides preparation - OCT adherence) |
| Glutaraldehyde solution, 25% | Sigma-Aldrich | G6257 | (for Karnovsky’s solution preparation) |
| HistoResin | Leica Biosystems | 14702231731 | glycol methacrylate (GMA) embedding kit |
| Iodine | Sigma-Aldrich | 207772 | (for Lugol solution preparation) |
| Lead(II) nitrate | Sigma-Aldrich | 228621 | Pb(NO3)2 (for TEM contrast staining) |
| Light Microscope | Olympus | (any model) | |
| LR White acrylic resin | Sigma-Aldrich | L9774 | hydrophilic acrylic resin for TEM |
| Lugol solution | Sigma-Aldrich | 62650 | (for staining) |
| Metal stubs for specimen mounts | Rave Scientific | (for SEM, different models) | |
| Microtome | Leica Biosystems | manual rotary microtome or other model | |
| Oatmeal agar (OMA) | Millipore | O3506 | (for seeds germination tests) |
| OCT Compound, Tissue-Tek | Sakura Finetek USA | 4583 | embedding medium for frozen tissues |
| Osmium tetroxide | Sigma-Aldrich | 201030 | OsO4 (for TEM postfixation) |
| Parafilm M | Sigma-Aldrich | P7793 | sealing thermoplastic film |
| Paraformaldehyde | Sigma-Aldrich | 158127 | (for Karnovsky’s solution preparation) |
| Poly-L-lysine solution, 0.1% in H2O | Sigma-Aldrich | P8920 | (for slides preparation - OCT adherence) |
| Poly-Prep Slides | Sigma-Aldrich | P0425 | poly-L-lysine coated glass slides |
| Polyethylene Molding Cup Trays | Polysciences | 17177A-3 | (6x8x5 mm, for embbeding samples in GMA resin) |
| Polyethylene Molding Cup Trays | Polysciences | 17177C-3 | (13x19x5 mm, for embbeding samples in GMA resin) |
| Potassium iodide | Sigma-Aldrich | 221945 | (for Lugol solution preparation) |
| Potato Dextrose Agar (PDA) | Millipore | 70139 | (for seeds germination tests) |
| Scanning Electron Microscope | Jeol | (any model) | |
| Silane [(3-Aminopropyl)triethoxysilane] | Sigma-Aldrich | A3648 | (for slides preparation - OCT adherence) |
| Silane-Prep Slides | Sigma-Aldrich | S4651 | glass slides coated with silane |
| Silica gel orange, granular | Supelco | 10087 | (for dessicating processes) |
| Sodium cacodylate trihydrate | Sigma-Aldrich | C0250 | (for glutaraldehyde-sodium cacodylate buffer) |
| Sodium hydroxide | Sigma-Aldrich | S5881 | NaOH (for Karnovsky’s solution preparation and TEM contrast staining) |
| Sodium hypochlorite solution | Sigma-Aldrich | 425044 | NaClO (for seeds surface disinfection) |
| Sodium phosphate dibasic, anhydrous | Sigma-Aldrich | 71640 | Na2HPO4 (for NBF solution and PB preparation) |
| Sodium phosphate monobasic monohydrate | Sigma-Aldrich | S9638 | NaH2PO4·H2O (for NBF and PB) |
| Sputter coater | Balzers | (any model) | |
| Sucrose | Sigma-Aldrich | S0389 | C12H22O11 (for cryoprotection and germination test) |
| Sudan III | Sigma-Aldrich | S4131 | (for staining) |
| Sudan IV | Sigma-Aldrich | 198102 | (for staining) |
| Sudan Black B | Sigma-Aldrich | 199664 | (for staining) |
| Syringe | (3 mL, any brand, for TEM contrast staining) | ||
| Syringe Filter Unit, Millex-GV 0.22 µm | Millipore | SLGV033R | PVDF, 33 mm, gamma sterilized (for TEM contrast staining) |
| Tek Bond Super Glue 793 | Tek Bond Saint-Gobain | 78072720018 | liquid cyanoacrylate adhesive, medium viscosity |
| Toluidine Blue O | Sigma-Aldrich | T3260 | (for staining) |
| Transmission Electron Microscope | Jeol | (any model) | |
| Triphenyltetrazolium chloride | Sigma-Aldrich | T8877 | (for the tetrazolium test in seeds germination) |
| Trisodium citrate dihydrate | Sigma-Aldrich | S1804 | Na3(C6H5O7)·2H2O (for TEM contrast staining) |
| Ultramicrotome | Leica Biosystems | (any model) | |
| Uranyl acetate | Fisher Scientific | 18-607-645 | UO2(CH3COO)2 (for TEM contrast staining) |
| Vacuum pump | (any model) | ||
| Wheat Germ Agglutinin, Alexa Fluor 488 Conjugate | TermoFisher Scientific | W11261 | fluorescent dye-conjugated lectin (detects sialic acid and N-acetylglucosaminyl residues) |
References
- Evert, R. F. . Esau’s Plant Anatomy: Meristems, Cells, and Tissues of the Plant Body: Their Structure, Function, and Development. , (2006).
- Yeung, E. C. T., Stasolla, C., Sumner, M. J., Huang, B. Q. . Plant Microtechniques and Protocols. , (2015).
- Sokoloff, D. D., Jura-Morawiec, J., Zoric, L., Fay, M. F. Plant anatomy: at the heart of modern botany. Botanical Journal of the Linnean Society. 195 (3), 249-253 (2021).
- Leake, J. R. The biology of myco-heterotrophic (‘saprophytic’) plants. New Phytologist. 127 (2), 171-216 (1994).
- Bidartondo, M. I. The evolutionary ecology of myco-heterotrophy. New Phytologist. 167 (2), 335-352 (2005).
- Imhof, S., Massicotte, H. B., Melville, L. H., Peterson, R. L. Subterranean morphology and mycorrhizal structures. Mycoheterotrophy. , 157-214 (2013).
- Rasmussen, H. N., Rasmussen, F. N. Orchid mycorrhiza: implications of a mycophagous life style. Oikos. 118 (3), 334-345 (2009).
- Rasmussen, H. N., Dixon, K. W., Jersáková, J., Těšitelová, T. Germination and seedling establishment in orchids: a complex of requirements. Annals of Botany. 116 (3), 391-402 (2015).
- Zettler, L. W. Terrestrial orchid conservation by symbiotic seed germination: techniques and perspectives. Selbyana. 18 (2), 188-194 (1997).
- Stewart, S. L., Kane, M. E. Symbiotic seed germination and evidence for in vitro mycobiont specificity in Spiranthes brevilabris (Orchidaceae) and its implications for species-level conservation. In Vitro Cellular & Developmental Biology - Plant. 43 (3), 178-186 (2007).
- Zhao, D. -. K., et al. Orchid reintroduction based on seed germination-promoting mycorrhizal fungi derived from protocorms or seedlings. Frontiers in Plant Science. 12, 701152 (2021).
- Selosse, M. A., Roy, M. Green plants that feed on fungi: facts and questions about mixotrophy. Trends in Plant Science. 14 (2), 64-70 (2009).
- Merckx, V. S. F. T., Mennes, C. B., Peay, K. G., Geml, J. Evolution and diversification. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 215-244 (2013).
- Boon, M. E., Drijver, J. Routine Cytological Staining Techniques: Theoretical Background and Practice. Macmillan International Higher Education. , (1986).
- Karnovsky, M. A formaldehyde-glutaraldehyde fixative of high osmolality for use in electron microscopy. Journal of Cell Biology. 27 (2), 137-138 (1964).
- Hayat, M. . Fixation for Electron Microscopy. , (1981).
- Roland, J. C., Vian, B. General preparation and staining of thin sections. Electron Microscopy of Plant Cells. 1, 675 (1991).
- Gerrits, P. O., Horobin, R. W. Glycol methacrylate embedding for light microscopy: basic principles and trouble-shooting. Journal of Histotechnology. 19 (4), 297-311 (1996).
- Zhang, Z., Niu, L., Chen, X., Xu, X., Ru, Z. Improvement of plant cryosection. Frontiers in Biology. 7 (4), 374-377 (2012).
- BeneŠ, K. On the media improving freeze-sectioning of plant material. Biologia Plantarum. 15 (1), 50-56 (1973).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Preparation of slides and coverslips for microscopy. Cold Spring Harbor Protocols. 2008 (5), (2008).
- Sakai, W. S. Simple method for differential staining of paraffin embedded plant material using toluidine blue O. Stain Technology. 48 (5), 247-249 (1973).
- O’Brien, T., Feder, N., McCully, M. E. Polychromatic staining of plant cell walls by toluidine blue O. Protoplasma. 59 (2), 368-373 (1964).
- Ventrella, M. C., Almeida, A. L., Nery, L. A., Coelho, V. P. d. e. M. Métodos Histoquímicos Aplicados às Sementes. Universidade Federal de Viçosa. , (2013).
- Pearse, A. G. E. . Histochemistry, Theoretical and Applied. , (1960).
- Andrade-Linares, D. R., Franken, P. Fungal endophytes in plant roots: taxonomy, colonization patterns, and functions. Symbiotic Endophytes. , 311-334 (2013).
- Wymer, C. L., Beven, A. F., Boudonck, K., Lloyd, C. W. Confocal microscopy of plant cells. Confocal Microscopy Methods and Protocols. , 103-130 (1999).
- Marques, J. P. R., Soares, M. K. M. Manual de Técnicas Aplicadas à Histopatologia Vegetal. FEALQ. , (2021).
- Navarro, B. L., Marques, J. P. R., Appezzato-da-Glória, B., Spósito, M. B. Histopathology of Phakopsora euvitis on Vitis vinifera. European Journal of Plant Pathology. 154 (4), 1185-1193 (2019).
- Marques, J. P. R., et al. Sugarcane cell wall-associated defense responses to infection by Sporisorium scitamineum. Frontiers in Plant Science. 9, 698 (2018).
- Jeffree, C. E., Read, N. D. Ambient-and low-temperature scanning electron microscopy. Electron Microscopy of Plant Cells. , 313-413 (1991).
- Bozzola, J. J., Russell, L. D. . Electron Microscopy: Principles and Techniques for Biologists. , (1999).
- Murray, S. Basic transmission and scanning electron microscopy. Introduction to electron Microscopy for Biologists. , 3-18 (2008).
- . Glossary of TEM terms Available from: https://www.jeol.co.jp/en/words/emterms/ (2021)
- Seaton, P. T., et al. Orchid seed and pollen: a toolkit for long-term storage, viability assessment and conservation. Orchid Propagation: From Laboratories to Greenhouses—Methods and Protocols. , 71-98 (2018).
- Otero, J. T., Ackerman, J. D., Bayman, P. Differences in mycorrhizal preferences between two tropical orchids. Molecular Ecology. 13 (8), 2393-2404 (2004).
- Koch, R. A., et al. Marasmioid rhizomorphs in bird nests: Species diversity, functional specificity, and new species from the tropics. Mycologia. 112 (6), 1086-1103 (2020).
- Webster, J., Weber, R. . Introduction to Fungi. , (2007).
- Sisti, L. S., et al. The role of non-mycorrhizal fungi in germination of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. Frontiers in Plant Science. 10, 1589 (2019).
- Martos, F., et al. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids. New Phytologist. 184 (3), 668-681 (2009).
- Alves, M. F., et al. Reproductive development and genetic structure of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. BMC Plant Biology. 21 (1), 332 (2021).
- Merckx, V. S. F. T. Mycoheterotrophy: an introduction. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 1-17 (2013).
- Hall, J. L., Hawes, C. . Electron Microscopy of Plant Cells. , (1991).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved