A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
טכניקות מיקרוסקופיה לפענוח התיישבות פטרייתית ברקמות צמחים מיקוהטרוטרופיים ונביטה סימביוטית של זרעים
In This Article
Summary
פרוטוקול זה נועד לספק נהלים מפורטים לאיסוף, תיקון ותחזוקה של דגימות צמחים מיקוהטרוטרופיים, תוך יישום טכניקות מיקרוסקופיה שונות כגון מיקרוסקופיית אלקטרונים סורקת והולכה, מיקרוסקופיית אור, קונפוקלית ופלואורסצנטית כדי לחקור התיישבות פטרייתית ברקמות צמחים ובזרעים שנבטו בפטריות מיקוריזאליות.
Abstract
בוטניקה מבנית היא נקודת מבט חיונית להבנה מלאה של האקולוגיה, הפיזיולוגיה, ההתפתחות והאבולוציה של צמחים. כאשר חוקרים צמחים מיקוהטרוטרופיים (כלומר, צמחים המקבלים פחמן מפטריות), היבטים יוצאי דופן של ההסתגלות המבנית שלהם, דפוסי התיישבות הרקמות על ידי פטריות והמורפואאנטומיה של איברים תת-קרקעיים יכולים להאיר את אסטרטגיות ההתפתחות שלהם ואת הקשרים שלהם עם hyphae, המקור של חומרים מזינים. תפקיד חשוב נוסף של פטריות סימביוטיות קשור לנביטת זרעי סחלב; כל מיני הסחלבים הם מיקוהטרוטרופיים בשלב הנביטה והשתילים (מיקוהטרוטרופיה ראשונית), אפילו אלה שמבצעים פוטוסינתזה בשלבים בוגרים. בשל היעדר עתודות תזונתיות בזרעי סחלב, סימביונטים פטרייתיים חיוניים כדי לספק מצעים ולאפשר נביטה. ניתוח שלבי הנביטה על ידי פרספקטיבות מבניות יכול גם לענות על שאלות חשובות לגבי האינטראקציה של הפטריות עם הזרעים. ניתן ליישם טכניקות הדמיה שונות כדי לחשוף אנדופיטים של פטריות ברקמות צמחים, כפי שמוצע במאמר זה. ניתן להכתים חלקים חופשיים ודקים של איברי הצמח ואז לצפות בהם באמצעות מיקרוסקופיה קלה. פלואורוכרום המצומד לאגלוטינין של נבט חיטה יכול להיות מיושם על הפטריות ולדגור יחד עם Calcofluor White כדי להדגיש את דפנות תאי הצמח במיקרוסקופיה קונפוקלית. בנוסף, המתודולוגיות של מיקרוסקופיית אלקטרונים סריקה והעברה מפורטות עבור סחלבים מיקוהטרוטרופיים, ונבחנות האפשרויות ליישם פרוטוקולים כאלה בצמחים קשורים. נביטה סימביוטית של זרעי סחלב (כלומר, בנוכחות פטריות מיקוריזאליות) מתוארת בפרוטוקול בפירוט, יחד עם אפשרויות להכנת המבנים המתקבלים משלבי נביטה שונים לניתוחים עם אור, קונפוקל ומיקרוסקופיית אלקטרונים.
Introduction
מחקר מבני בבוטניקה, המכסה מורפולוגיה ואנטומיה של צמחים, הוא בסיסי בהבנת האורגניזםכולו 1,2, ומספק נקודות מבט חיוניות לשילוב ותרומה לידע בנוגע לאקולוגיה, פיזיולוגיה, התפתחות ואבולוציה של צמחים3. שיטות במורפולוגיה ואנטומיה של צמחים כוללות כיום פרוטוקולים, ציוד וידע שפותחו לאחרונה כמו גם לפני יותר ממאה שנה2. לביצוע והתאמה מתמשכים של שיטות קלאסיות (למשל, מיקרוסקופיית אור) יחד עם טכניקות עדכניות יותר (למשל, מיקרוסקופיה קונפוקלית, מיקרוטומוגרפיה של קרני רנטגן) יש אותו בסיס חיוני: ידע תיאורטי המאפשר פיתוח מתודולוגיה.
הכלי העיקרי באנטומיה ובמורפולוגיה של צמחים הוא התמונה. למרות התפיסה המוטעית שניתוחים כאלה הם תצפיות פשוטות, הנותנות מקום לפרשנויות סובייקטיביות2, ניתוח והבנה של תמונות בתחום זה דורש ידע בשיטות המיושמות (הציוד, סוג הניתוח, הליכים מתודולוגיים), מרכיבי התא, היסטוכימיה וגוף הצמח (ארגון ותפקוד רקמות, אונטוגניה, התאמות מורפולוגיות). פירוש התמונות המתקבלות במגוון שיטות יכול להוביל לקורלציה בין צורה ותפקוד, פענוח ההרכב הכימי של מבנה, אימות בתיאור טקסה, הבנת זיהומים על ידי פיטופתוגנים והערכות אחרות מסוג זה.
כאשר חוקרים צמחים מיקוהטרוטרופיים (MH) (כלומר, צמחים שאינם פוטוסינתטיים המקבלים פחמן מפטריות מיקוריזאליות4,5), היבטים יוצאי דופן של ההתאמות המבניות שלהם, דפוסי התיישבות הרקמות על ידי פטריות, והמורפואאנטומיה של איברים תת-קרקעיים יכולים להאיר את אסטרטגיות ההתפתחות שלהם ואת הקשרים שלהם עם hyphae, שהם המקור לחומרים מזינים. האיברים התת-קרקעיים של צמחי MH מראים בדרך כלל התאמות חשובות הקשורות לקשר שלהם עם פטריות אדמה, ולכן חיוני לבצע חקירות אנטומיות ומורפולוגיות אלה6. אין להתעלם מאיברים אוויריים של מיני MH, שכן אנדופיטים יכולים להימצא גם ברקמות אלה, גם אם הם אינם פטריות מיקוריזאליות (תצפיות אישיות, טרם פורסמו).
מלבד החיוניות המבוססת היטב של קשר פטריות מיקוריזאליות עם מיני MH במהלך כל מחזור החיים שלהם7, לכל מיני הסחלבים, אפילו האוטוטרופיים, יש שלב מיקוהטרוטרופי מחייב ראשוני בסביבות טבעיות. זה קורה כי העובר של הסחלבים הוא מובחן וחסר אנדוספרם או cotyledons, ובכך להיות מסוגל לפתח ולהתבסס בסביבות טבעיות ללא תמיכה תזונתיים של שותפים פטרייתיים 4,8. בהתחשב בכך, פרוטוקולי נביטה סימביוטיים יכולים להיות מיושמים לא רק על מיני MH אלא גם על פוטוסינתזה של סחלבים, במטרה לחקור את הספציפיות של פטריית הסחלבים בנביטה ובפיתוח פרוטוקורם, מתודולוגיה מיושמת במידה רבה ביוזמות לשימור מינים בסכנת הכחדה 9,10,11.
בהרכבת שיטות זו, אנו מתארים שלבים חשובים הכרוכים באיסוף, תיקון ואחסון דגימות צמחי MH למחקרים אנטומיים (סעיף 1), ניתוח פני שטח ובחירת דגימות (סעיף 2), שיטות חתך (יד חופשית: סעיף 3, מיקרוטומיה: סעיף 4, קריומיקרוטומיה: סעיף 5), צביעה והרכבה (סעיף 6), מיקרוסקופיה פלואורסצנטית וקונפוקלית של אנדופיטים פטרייתיים (סעיף 7), מיקרוסקופיית אלקטרונים סורקת (סעיף 8), ומיקרוסקופיית אלקטרונים (סעיף 9). בנוסף, אנו מתארים שיטת נביטה סימביוטית לזרעי סחלב (MH ואוטוטרופי, סעיף 10), שכן ניתן ליישם בהצלחה את שיטות ההדמיה שהוזכרו קודם לכן כדי לנתח התיישבות פטרייתית של זרעים, פרוטוקורמים ושתילים בתהליך הנביטה.
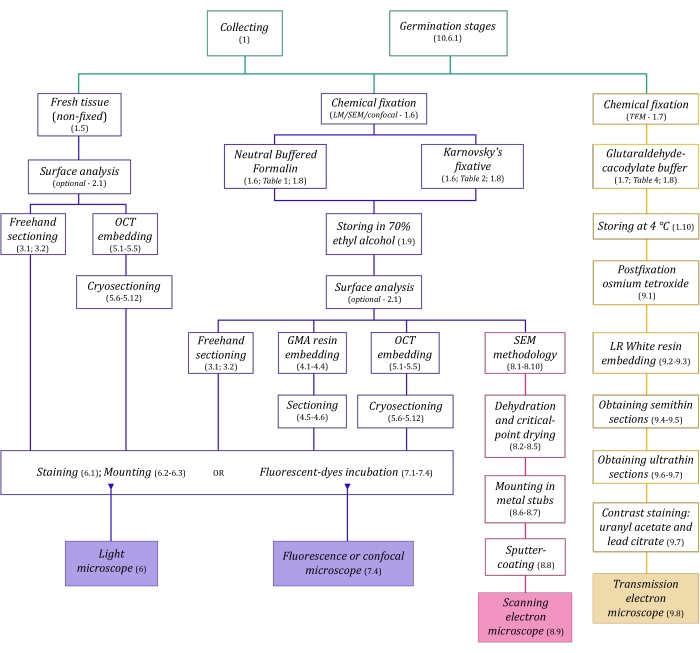
איור 1: סיכום סכמטי של שיטות הדמיה. הסכמות מספקות אינדיקציות לשלבי הפרוטוקול שבהם הן מפורטות. קיצורים: GMA = גליקול מתקרילט, OCT = תרכובת טמפרטורת חיתוך אופטימלית, SEM = מיקרוסקופ אלקטרונים סורק. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
לטכניקות המיקרוסקופיה המתוארות כאן בפירוט (איור 1) קדמו השלבים החיוניים הבאים: איסוף, תיקון, התייבשות, הטמעה וחיתוך דגימות. מכיוון שהשלבים משתנים (איור 1) בהתאם לטכניקות שנבחרו, חשוב לחשוב קדימה, בהתחשב בקיבועים שיש להכין ולהעביר לאתר האיסוף, כיצד יש להכין את הדגימות לפני התיקון, את תהליכי ההתייבשות שיש להשתמש בהם (סעיף 1), ואת אפשרויות ההטמעה ושיטות החיתוך השונות (סעיפים 4, 5, ו-9). איור 1 מסכם ברצף את כל השלבים הנדרשים עבור כל טכניקת מיקרוסקופיה המתוארת ביסודיות להלן.
Protocol
1. איסוף, תיקון ותחזוקה של דוגמאות
הערה: צמחי MH מלאים ניתן למצוא בדרך כלל ביער החשוך מתחת ל-12,13, בעיקר באזורים לחים ושופעי פסולת, בעוד שצמחי MH באופן חלקי ניתן למצוא ביערות פתוחים יותר12,13. לצמחי MH יש בדרך כלל איברים תת-קרקעיים מפותחים במגוון צורות וגדלים.
- בעת איסוף מיני MH, חקרו את האדמה סביב בסיס הצמח, היזהרו שלא לפגוע באיברים תת-קרקעיים, והימנעו ממשיכת הצמחים מהקרקע כדי למנוע ניתוק האיברים האוויריים מהתת-קרקעיים.
- חפרו בזהירות סביב מבנים אוויריים באמצעות תרנגולת גינון תוך כדי חקירת האיברים התת-קרקעיים כמו שורשים, גבעולים, קני שורש ואיברי אחסון, מבלי לפגוע במבנים אלה.
- הסר חלקיקי אדמה כדי לשמר מבנים שבירים, ושטוף בעדינות איברים אלה במי ברז כדי לשטוף את חלקיקי הקרקע הנותרים לפני תיקון הדגימות.
- צמחי MH הקשורים לפסולת עלים דורשים תשומת לב נוספת; לאסוף בזהירות איברים המחוברים לחומר המתפרק באמצעות הקורים שלהם, להימנע ממשיכת איברים אלה מהמבנים המחוברים, ולאסוף אותם בזהירות מכיוון שחלקים אלה עדינים מאוד. לשמר מבנים עם קשרים כאלה ולאסוף את המלטה גם כן לניתוח.
- אם בוחרים לנתח חומר טרי באמצעות טכניקות הדמיה, שמרו את הדגימות בשקיות ניילון סגורות עם לחות מספקת, מספיק מים מתאדים ומעניקים לחות לצמח, ומונעים עודף מים במגע עם הדגימות. העבירו אותם למעבדה באופן מיידי ונתחו את הדגימות באותו יום בו נאספו, תוך שימת לב אם הדגימות עדיין נשמרות בעת ניתוחן.
- יש לשאת חומרים מקבעים לאתר האיסוף במיכלים אטומים היטב. תקן דגימות במהירות לאחר איסוף עבור מיקרוסקופ אור (LM) ומיקרוסקופיית אלקטרונים סורקת (SEM) בכל אחד מהקיבועים הבאים: 10% פורמלין חוצץ נייטרלי (NBF14, טבלה 1) או הפתרון של קרנובסקי (שונה15, טבלה 2). הפתרון של קרנובסקי יכול להיות מוכן עם 0.2 M פוספט חיץ15, המתכון אשר מתואר בטבלה 3.
- לצורך ניתוח על ידי מיקרוסקופיית אלקטרונים (TEM), חתך את הדגימות בעובי של 4-3 מ"מ בתוך טיפה של חיץ גלוטרלדהיד-נתרן קקודילאט (שונה 16, טבלה 4) למקטעים קטנים יותר בעובי 1-2 מ"מ. השליכו את הקצוות שנחתכו מחוץ לטיפה. מעבירים מיד את החלקים לצינור איסוף עם נפח של קיבוע גדול פי 10 מנפח הדגימות, מכיוון שהוא תוסף מקובע (כלומר, המולקולות שלו מתווספות כימית לחלבונים הקבועים16).
זהירות: שלושת הקיבעונות המתוארים רעילים ביותר. הימנע שאיפה, במיוחד במהלך השימוש בהם בשטח. הכינו את כל הקיבועים במכסה אדים באמצעות כפפות. אין לערבב קקודילאט וחומצות, שכן גז ארסן יכול להיווצר16. - אם הדגימות הקבועות צפות בקיבוע, הדבר מצביע על נוכחות של גז ברקמות הצמח. אוויר וגזים אחרים מונעים מהמקבע לחדור את כל הדגימה2. הסר גז מרקמות על ידי דגימה מחדש שלהן בחלקים קטנים יותר ושימוש במשאבת ואקום (-300 עד -400 בלחץ כספית) עד שכל הדגימות שוקעות לתחתית התמיסה17. היזהר מכיוון שלחץ יתר המופעל על ידי המשאבה עלול לפגוע בדגימות.
- לאחר לפחות 48 שעות בתמיסה של קרנובסקי או 10% NBF, לשטוף את הדגימות ב 0.2 M PB (טבלה 3) ולייבש אותם עם סדרה של 10%, 30%, 50%, ולבסוף 70% אתנול. עבור דגימות עדינות, להתייבש במשך 30 דקות בכל ריכוז; עבור דגימות גדולות יותר, יש להתייבש למשך שעה או יותר.
הערה: תמיסת אתנול של 70% היא המדיום האידיאלי לאחסון דגימות. דגימות ב-70% אתנול ניתן לאחסן בטמפרטורת החדר במשך שנים. אין לאחסן חומר צמחי לתקופות ארוכות בקיבועים, שכן הסרת חומרי קיבוע היא שלב חיוני לאחר קיבוע2. - אחסנו דגימות בגלוטאראלדהיד-קקודילאט בטמפרטורה של 4 מעלות צלזיוס לפני שתמשיכו לפוסט-פיקסידציה (שלב 9.1).
| 10% פורמלין נאגר ניטרלי (NBF)14 | |
| שלב 1 | להוסיף 10 מ"ל של תמיסת פורמלדהיד 37-40% ב-80 מ"ל מים מזוקקים |
| שלב 2 | להוסיף 0.4 גרם של מונוהידרט מונובסיק נתרן פוספט (NaH2PO4· H2O) לפתרון |
| שלב 3 | להוסיף 0.65 גרם של נתרן פוספט dibasic, נטול מים (Na2HPO4) |
| שלב 4 | הגדל את עוצמת הקול עד 100 מ"ל |
טבלה 1: 10% מתכון פורמלין נאגר נייטרלי 14.
| הפתרון של קרנובסקי (שונה 15) | |
| שלב 1 | ב 20 מ"ל של מים מזוקקים ב 60-70 מעלות צלזיוס |
| שלב 2 | מוסיפים 0.8 גרם של פרפורמלדהיד (כדי לקבל 4% W/V), תוך ערבוב |
| שלב 3 | מוסיפים 1-4 טיפות של 40% NaOH ומערבבים עד שהתמיסה מתבהרת |
| שלב 4 | מקררים אותו ומוסיפים 30 מ"ל של חיץ פוספט 0.2 M pH 7.2 (טבלה 3) |
| שלב 5 | יש לדלל 25% גלוטראלדהיד ב-0.1 M PB (pH 7.2) כדי לקבל 1% גלוטראלדהיד (נפח סופי: ~60 מ"ל) |
| שלב 6 | להוסיף 1% גלוטראלדהיד (שלב 5) לתמיסה המתקבלת בשלב 4 עד לקבלת עד 100 מ"ל של קיבוע |
טבלה 2: מתכון הפתרון של קרנובסקי (שונה 15).
| 0.2 M מאגר פוספט (PB) pH 7.2 | |
| שלב 1 | להוסיף 14.196 גרם של נתרן פוספט dibasic, נטול מים (Na2HPO4) ל 400 מ"ל של מים מזוקקים |
| שלב 2 | להוסיף 13.8 גרם של נתרן פוספט מונוהידרט מונוהידרט (NaH2PO4· ח2או) |
| שלב 3 | מערבבים עד שהתמיסה צלולה |
| שלב 4 | התאם את הנפח הסופי ל-500 מ"ל עם מים מזוקקים |
| שלב 5 | התאם את ה-pH ל-7.2 |
| שלב 6 | עבור PB של 0.1 M, מדולל 1:1 |
טבלה 3: מתכון חיץ פוספט 0.2 M.
| 3% גלוטראלדהיד 0.2 M חיץ נתרן קקודילאט (שונה 16) | |
| שלב 1 | 0.2 M מאגר קקודיט: להוסיף 4.28 גרם של נתרן cacodylate trihydrate ב 100 מ"ל של מים מזוקקים |
| שלב 2 | התאם את ה-pH ל-7.2 |
| שלב 3 | להוסיף 12 מ"ל של 25% גלוטרלדהיד ב 25 מ"ל של התמיסה בשלב 2 (0.2 M קקודילאט חיץ pH 7.2) |
| שלב 4 | לפצות את נפח עד 100 מ"ל עם מים מזוקקים |
טבלה 4: 3% גלוטראלדהיד 0.2 M נתרן קקודילאט מתכון חיץ (שונה 16).
2. ניתוח פני השטח של איברים בחומר קבוע ולא קבוע
- כדי לנתח מקף שטחי באיברים, במיוחד תת-קרקעיים, ואלה שבאו במגע עם פסולת עלים, התבונן בחומר קבוע או טרי במיקרוסקופ מנתח (סטריאומיקרוסקופ) בהגדלה של פי 7.5 ומעלה, בהתאם לדגימות שנותחו.
- דמיינו את הדגימות הטבולות בקיבוע, 70% אתנול (אם מאוחסנים בו), או מי ברז במקרה של חומר טרי. מנעו אור ישיר מהמיקרוסקופ המנתח מכיוון שהוא עלול להתייבש ולפגוע בדגימות.
- חפש תחומי עניין בדגימות, בהנחיית הקורים השטחיים והריזומורפים. בחר דגימות המכילות אזורים עם ריזומורפים שטחיים שכן ניתן לחלק אותם כדי לדמיין פלוטונים וסלילי hyphae בתוך תאי קליפת המוח בשורשים ובגבעולים.
- לאחר הבחירה, בצע את שלבים 1.6 ו- 1.9 אם הדוגמאות עדיין לא תוקנו. אם תרצה, צלם דגימות טריות באמצעות מיקרוסקופ אור ללא תיקון, כמתואר בסעיף 3.
- השתמש במצלמה המוצמד לסטריאומיקרוסקופ כדי לאסוף תמונות ממשטחי איברים, ריזומורפים ומבנים אחרים שנצפו. במקרים כאלה, דאגו לכך שצבע הרקע יהיה מנוגד היטב לחומר, ובמידת האפשר, בחרו חומר רקע עם משטח פחות מחוספס (למשל, נייר).
3. קטעים ביד חופשית של איברי הצמח
הערה: חלקים ביד חופשית של איברים צמחיים יכולים להיות מאתגרים, במיוחד עבור מבנים קטנים ודקים. עם זאת, חלקים אלה של רקמות עם אנדופיטים פטרייתיים יכולים, במקרים מסוימים, טוב יותר evince hyphae ותכונות אחרות בהשוואה חתכים דקים.
- חותכים דגימות טריות או קבועות עם להב חד, חותכים אותם דק ככל האפשר ומניחים אותם מיד בצלחת פטרי קטנה עם מים (אם טריים) או 70% אתנול (אם קבוע). השתמש במכחול קטן כדי לתפעל את החלקים מבלי לגרום להם נזק.
- כדי להקל על חיתוך חומרים מאתגרים יותר (כלומר, איברים קטנים, דקים וגמישים), הקיפו את הדגימה במבנה, למשל, פוליסטירן או Cecropia petiole. גלפו את התמיכה כך שתתאים לדגימה וצרו מקטע דק של המדגם והתמיכה כולה.
- להכתים ולהרכיב את הדגימות כמתואר בסעיף 6.
4. הטמעת דגימות צמחים בשרף ובחיתוך
- בנוסף, יש לייבש את הדגימות המאוחסנות ב-70% אתנול ב-80%, 96% ופי 2 ב-100% אתנול, למשך 30 דקות עד שעתיים, תלוי בגודל הדגימות ובהרכבן.
- יש להשתמש בערכת שרף גליקול מתקרילט (GMA) בהתאם להוראות היצרן. בדוק Gerrits and Horobin (1996)18 לשיקולים נוספים. בצע את שלבי החדירה וההטמעה בהתאם.
אזהרה: שרף מהונדס גנטית הוא רעיל, הוא עלול לגרום לתגובה אלרגית ולגירוי בעור, בעיניים וברירית. השתמשו בריאגנטים במכסה אדים והשתמשו בכפפות. - השתמש במגשי יציקה מפוליאתילן להטמעה, שנבחרו לפי גודל הדגימות (לדוגמה, 13 מ"מ x 19 מ"מ x 5 מ"מ לדגימות גדולות יותר, 6 מ"מ x 8 מ"מ x 5 מ"מ לדגימות קטנות יותר). שימו לב לכיוון המדגם הרצוי בתוך התבנית, והשתמשו במחט כדי לסייע בהתמצאות.
- משאירים לפימור, רצוי בטמפרטורת החדר, עד להתמצקות מלאה. תהליך ההקשחה נמשך בדרך כלל מספר שעות, אם כי מומלץ לפתוח את הבלוקים ביום שלמחרת. לאחר פילמור, נתקו בזהירות את גושי השרף מהתבניות והמשיכו לחבר את הבלוקים בהקדם האפשרי כדי למנוע עיקול בלוקים.
- לשייף את פני גוש השרף שיחובר וליצור משטח שטוח. הדביקו את גוש השרף לקוביית עץ (מומלץ 2 ס"מ על 2 ס"מ על 3 ס"מ) עם דבק ציאנואקרילט נוזלי בעל צמיגות בינונית (ראו טבלת חומרים). יש לוודא כי השרף מחובר לחלוטין כדי למנוע פגיעה בחתך.
- בצע חתך במיקרוטום סיבובי כמתואר להלן.
אזהרה: הלהבים של סכיני המיקרוטום חדים מאוד ועלולים לגרום לתאונות. הקפד לטפל בהם בעקבות כל אמצעי הבטיחות. לפני שמתקרבים לסכין (למשל, כדי להחליף את הבלוק, כדי להרטיב את השרף), נעל את הגלגל הגס והנח את כיסוי הבטיחות של הלהב. אחסנו להבים חד פעמיים במקרים המתאימים. היזהר מאוד בעת החלפת להבים.
הערה: ניתן להשתמש בסוגים שונים של סכינים (למשל, חד פעמיים או קבועות; זכוכית או פלדה) כדי לחלק שרף GMA18. איכות הסעיפים תלויה במידת החדות של הסכין. וודאו שהסכין מחוברת היטב ואינה יכולה לזוז. ייתכן שיהיה צורך להחליף סכינים חד פעמיות באופן קבוע כדי להשיג חלוקה טובה יותר.- חברו את קוביית העץ בחוזקה למחזיק הבלוק. התאם את כיוון החיתוך באמצעות ברגי הכיוון והבטח זווית נאותה של הסכין באמצעות הטיית הסכין. בחר את עובי החלקים; השתמש בהגדרה עבה יותר לחיתוך ובהגדרה דקה יותר עבור מקטעים נבחרים, מכיוון שמקטעי GMA נצמדים בצורה הולמת יותר למגלשת הזכוכית כאשר הם דקים יותר; העובי המומלץ לרקמות הצמח הוא 5-8 מיקרומטר.
- לפני שמתחילים, מקררים את החדר, במידת הצורך, שכן טמפרטורות גבוהות יותר מחמירות את איכות הסעיפים. הכינו את הפריטים הבאים לחתך: עם מים מזוקקים, פלטה חמה, מכחולים (לפחות שניים), פינצטה עדינה, פיפטה פסטר, שקופיות זכוכית, נייר סינון (או נייר טישו) ועיפרון (כדי לזהות את הדגימות שנחתכו).
- התאימו את הצלחת החמה ל-50°C והניחו עליה את הכוס. שימו לב להבדלים בחימום בהתאם לאזור הצלחת החמה (בדרך כלל, האזור האמצעי מתחמם יותר מהקצוות; מחממים את המים באמצע, רצוי).
- בחרו מגלשת זכוכית, זהו אותה בעזרת עיפרון, והפיפטו את המים המזוקקים החמים על כל משטח ההחלקה. במידת הצורך, השתמשו בתמיסה (למשל, חומר ניקוי ומים, או 70% אתנול) כדי לשבור את המתח בין המים לכוס, כך שכל המגלשה תהיה מכוסה באופן שווה. סוגים מסוימים של שקופיות חייבים להיות מנוקים מראש עם 70% אתנול כדי להשיג הקפדה מספקת על המקטע.
- התחל על ידי התקדמות הדרגתית של פני בלוק השרף לכיוון להב הסכין. אל תנסה לחתוך מבלי לקדם את הבלוק תחילה, אחרת הציוד והבלוק עלולים להינזק. במידת הצורך, לחתוך את הבלוק באמצעות עובי גבוה יותר (10 μm ומעלה).
- כאשר מתקרבים קטע מתאים, לעשות תנועה חד כיוונית מוצקה עם גלגל היד, כך הקטע נעשה בבת אחת. בדוק את לחות השרף. במהלך החתך, לחות באופן קבוע את פני הבלוק שנחתך באמצעות מכחול טבול במים מזוקקים אם יש בעיה עם חלקים מסתלסלים. הסר עודפי מים עם נייר טישו.
- בעזרת זוג פינצטות עדינות, הניחו את החלק המתקבל במים מעל המגלשה. כאשר באים במגע עם מים, שרף GMA נמתח. במידת הצורך, השתמש במכחול כדי לפתוח בעדינות ולמתוח את החלקים. השתמש במכחול אחר כדי לשמור כל הזמן על הלהב נקי מפסולת שרף. אין לעבור בין המכחולים כדי למנוע הרטבת הלהב.
- לאחר התור של כל החלקים הרצויים בשקופית, יבשו את החלק התחתון של המגלשה והניחו אותו מעל הפלטה החמה. הסר את עודפי המים מראש המגלשה על-ידי טפטוף עדין עם נייר סינון (אופציונלי). החלקים יידבקו כאשר המים יתאדו מהמגלשה. אין להשאיר את המגלשות זמן רב מדי כדי למנוע נזק למקטעים מחום מוגזם.
- אחסנו את המגלשות בקופסת שקופיות, הרחק מאבק ושמש, והשתמשו בהן להכתמה ולהליכים אחרים. ניתן לאחסן את השקופיות במשך מספר שנים.
5. הקפאת דגימות צמחים וחתך עם קריוסטאט
הערה: השיקול החיוני בהקראת רקמות ביולוגיות הוא להפחית את הנזק עקב היווצרות גבישי קרח בעת הקפאת דגימות. Cryoprotection נעשה בדרך כלל על ידי החדרת פתרונות אינרטיים כימיים כגון גליצרול או סוכרוז 19,20.
- יום לפני החלוקה לדוגמה, בצע את השלבים הבאים.
- יש לדלל 100 מ"ל של 0.2 מ' PB (טבלה 3) ב-100 מ"ל מים מזוקקים כדי לקבל 200 מ"ל של 0.1 מ' PB. הכינו 10%, 20% ו-30% תמיסות סוכרוז ב-0.1 M PB (למשל, לפתרון של 10%, הוסיפו 2 גרם סוכרוז ב-20 מ"ל של חיץ).
- לקבלת דגימות טריות, יש לשטוף אותן ב-0.1 M PB למשך 30 דקות. עבור דוגמאות בקיבוע, לשטוף אותם באותו חיץ המשמש להכנת fixative במשך 30 דקות. עבור דגימות ב-70% אתנול, יש להרטיב אותן ב-50% ו-30% אתנול ולשטוף ב-0.1 M PB במשך שעה אחת בכל תמיסה.
- דגרו את הדגימות במשך שעתיים ב-10% סוכרוז, שעתיים ב-20% סוכרוז ושעתיים ב-30% סוכרוז, בטמפרטורת החדר. לאחר מכן, לדגור לילה ב 30% סוכרוז ב 4 מעלות צלזיוס (או לפחות במשך 3 שעות; הזמן המרבי הוא 48 שעות).
- ביום החתך, להכין 40% ו 50% סוכרוז ב 0.1 M PB; אין להכין תמיסות סוכרוז יותר מ-12 שעות מראש. דגירה במשך 2 שעות בכל ריכוז סוכרוז, ב 4 מעלות צלזיוס.
- להטמעה, בתבניות קטנות, הכינו שכבה של תרכובת OCT (מדיום טמפרטורת חיתוך אופטימלי, המשמש להטמעה והקפאה של הדגימות) ושמרו אותה בטמפרטורה של -20 מעלות צלזיוס להקפאה. התבניות יכולות להיות תבניות היסטולוגיות רגילות, אם כי כדי להקל על הסרת הבלוקים, ניתן להכין נייר או פח באמצעות קובואיד קטן כמסגרת וסרט דבק.
- לאחר שהשכבה התחתונה של תרכובת OCT קפואה בתבניות, עובדים בתוך תא קריוסטאט (בערך -27 מעלות צלזיוס). מניחים את הדגימות מודגרות ב 50% סוכרוז בתבניות, בכיוון שבו הם יהיו חתך. הפנים העליונות של גוש קובואידי הן בדרך כלל פנים טובות יותר של חתך. סמן בתבנית שבה ממוקמות הדגימות, כך שניתן יהיה לחתוך את הבלוק בקלות, ולשמור על הכיוון הנכון.
- הקיפו את הדגימות בתרכובת OCT ופוצצו כל בועת אוויר שנוגעת בדגימות. מקפיאים אותם ב -20 מעלות צלזיוס. כאשר הבלוקים קפואים לחלוטין, מניחים אותם בתוך תא cryostat (בערך -27 מעלות צלזיוס). בטל את התבנית של כל אחד מהם רק לפני השימוש ושים לב לסימנים המציינים את מיקום הדגימה בתוך הבלוק.
- מכיוון שתרכובת OCT נחתכת בקלות עם להב, יש לחתוך כראוי את הבלוקים לפני הצבתם על הצ'אקים. שים קצת תרכובת OCT בצ'אק cryostat ומקם את הבלוק כך שהפנים העליונות יחתכו. פרצופים עם שטחים קטנים יותר מספקים חלקים טובים יותר. המתן עד שהבלוק מחובר היטב לצ'אק ובדוק אותו לפני שתתחיל לחתוך.
- הניחו את הצ'אק בחוזקה במחזיק הצ'אק. התאם את כיוון החתך באמצעות ברגי הכיוון. כוונן את זווית הסכין באמצעות הטיית הסכין. בחר את עובי המקטעים. ניתן לחתוך את הדגימות עבות יותר ממקטעי שרף רגילים. מקטעים בטווח שבין 5-20 מיקרומטר מתקבלים בהצלחה, עם חלקים עבים יותר להיות קל יותר לעשות (פחות סלסול ופחות נזק של מבנים).
- קדם את פני הבלוק הקפוא לעבר להב הסכין. אל תנסו לחתוך בלי לעשות זאת, אחרת הבלוק יכול להיות מנותק מהצ'אק ופגום. במידת הצורך, לחתוך את הבלוק באמצעות עובי גבוה יותר (10 μm ומעלה).
- כאשר מתקרבים לקטע מתאים, מניחים את צלחת האנטי-רול (כלומר, צלחת שקופה שתשמור על הקטע) מעל הסכין ומבצעים תנועה חד כיוונית יציבה עם גלגל היד, כך שהקטע נעשה בבת אחת. בעיות סלסול יכולות להיגרם אם יש צורך להתאים את צלחת האנטי-רול (היא בדרך כלל מתכווננת בהתייחס ללהב) או אם יש פסולת בלהב. נקו את הלהב כל הזמן עם מכחול כדי להסיר לכלוך.
- השתמשו בשקופיות מיוחדות כדי שהמקטעים יתחברו בקלות, כמו שקופיות מבודדות (מסחריות או מוכנות עם 2% אמינואלקילסילן באצטון 21), או שקופיות שהוכנו עם 500 מיקרוגרם/מ"ל פולי-ל-ליזין במים מזוקקים 21 או 0.2% ג'לטין (ראו פרטים21). יש לשמור על המגלשות בטמפרטורת החדר.
- כדי להדביק את המקטע לשקופית, הרם את הלוח נגד גלילה וגרם לשקופית לגעת במהירות במקטע. כאשר המגלשה נמצאת בטמפרטורת החדר, הקטע מיד נמס ונצמד לשקופית. שימו לב להפנות את הפנים המטופלות של השקופית לקטע, אשר עשוי להישאר מעל הסכין או על הפנים הפנימיות של צלחת אנטי רול. כדי למנוע סלסול של מקטעים, בצע שלב זה במהירות ברגע שהצלחת מורמת והיזהר שלא לעקם את הקטע.
- השאירו את המגלשה מחוץ לתא הקריוסטאט (בטמפרטורת החדר) אם יש להוסיף לה חלקים חדשים. לאחר הדבקת כל החלקים הרצויים לשקופית, שמור אותו בתוך תא cryostat או במקפיא (-20 מעלות צלזיוס ומטה). אין לחשוף את השקופיות ללחות. שמור אותם בתיבת שקופיות וזכור לזהות את השקופיות באמצעות עיפרון.
הערה: ניתן לאחסן שקופיות ובלוקים של OCT בטמפרטורה של -20°C, אם כי לא למשך זמן רב מדי. כדי להשיג תוצאות טובות יותר, השתמש בשקופיות ובבלוקים תוך מספר ימים.
6. צביעת חתכי צמחים ואנדופיטים למיקרוסקופיית אור
הערה: ניתן להשתמש בסוגים רבים של כתמים עבור חלקים של צמחים. מאתגר להכתים באופן דיפרנציאלי פטריות אנדופיטיות ורקמות צמחים. אמנם לא הליך צביעה, שיטה לסימון מבנים פטריות מוצג בסעיף 7 (פלואורסצנציה עם נבט חיטה agglutinin מצומד). ניתן להכתים סעיפים של יד חופשית (מוסברים בסעיף 3), סעיפי שרף (סעיף 4) וקריוסקסים (סעיף 5), אם כי כתמים מבוססי פנול ואלכוהול מאתגרים עבור דגימות אלה מכיוון ששרף GMA ו- OCT מאבדים דבקות בשקופית במקרים אלה.
- השתמשו באחת מהן או שלבו את שיטות הצביעה הרגילות הבאות עבור דגימות צמחים.
- Toluidine blueO 22,23, שיטה מיושמת היטב להכתמה כללית של חלקי צמחים. הכינו תמיסה של 0.05% טולואידין כחול O ב-0.1 M פוספט (pH 6.8) או חיץ ציטראט 0.09 M (pH 4.5-4.8), בהתאם למינים ולסוגי הרקמות. לדגום קטעי שרף GMA במשך 2-10 דקות באמצעות צנצנת צביעת שקופיות או על ידי הנחת כמה טיפות מעל החלקים אם כמה שקופיות מוכתמות. יש לשטוף בזהירות במים מזוקקים או במאגר לאחר הדגירה ולהרכיב את המגלשות במים או לייבש אותן על פלטה חמה כדי לייצר מגלשות קבועות כמתואר בשלב 6.3.
- מגיב Lugol2 מציין את נוכחותו של עמילן. הכינו תמיסת 5% יוד (I2) ו-10% אשלגן יודיד (KI) במים מזוקקים. מקטעי כתמים במשך 2 דקות, על ידי הוספת כמה טיפות מעל המגלשה, ולאחר מכן לשטוף עם מים מזוקקים. בדיקה היסטוכימית זו מוחלת בדרך כלל על שקופיות זמניות.
- סודן III, IV, ושחור B 24,25 כתמים עבור שומנים שונים. מכינים תמיסה של 0.3% סודן (III, IV או B שחור) ב-70% אתנול, מחממים אותה עד להרתיחה ומניחים להתקרר. השתמשו בסופרנטנט, סננו אותו ודגרו קטעים במשך 15-30 דקות בצלחת פטרי סגורה. לשטוף את החלקים בזהירות עם 70% אתנול ומים מזוקקים. הר את המגלשות עם מים (בדרך כלל מוחל רק על מגלשות זמניות).
הערה: מכיוון שסודן הוא צבע על בסיס אלכוהול, הוא מתאים יותר למקטעים ביד חופשית. בצעו צביעת מקטע שרף GMA בזהירות מכיוון שהם בדרך כלל מתנתקים מהשקופית.
- עבור מגלשות זמניות, הרכב את החלקים במים או גליצרין והתבונן לאחר מכן. אטמו את הכיסוי עם לק כדי לשמר אותם עוד קצת.
- עבור שקופיות קבועות, הרכב את החלקים עם שרפים סינתטיים (לדוגמה, מדיום הרכבה מהירה, ראה טבלת חומרים). טפחו כמה טיפות של מדיום ההרכבה (הוא יכול לעלות על גדותיו של הכיסוי), הניחו את הכיסוי בזהירות כדי למנוע בועות, והשתמשו ביתדות בגדים כדי ללחוץ על המגלשה כנגד הכיסוי עד לייבוש מלא. הסר את עודף של מדיום הרכבה מיובש עם סכין גילוח.
7. יישום של פלואורוכרום מצומד לאגלוטינין נבט חיטה במיקרוסקופיה פלואורסצנטית וקונפוקלית
הערה: ניתן ליישם שיטה זו על מקטעי יד חופשית (מוסבר בסעיף 3), סעיפי שרף (סעיף 4) וקריופים (סעיף 5). קריוסקרים יכולים להיות מתאימים למטרות מיקרוסקופיה קונפוקלית, שכן ניתן לספק דגימות עבות יותר בהשוואה למקטעי שרף, אך לא עבים כמו אלה החופשיים. פלואורוכרום המצומד לאגלוטינין של נבט חיטה (WGA, ראו טבלת חומרים) מוחל על הדמיה פטרייתית במיקרוסקופיה פלואורסצנטית26. מיקרוסקופ קונפוקלי אינו חיוני, אם כי הוא יכול לספק תמונות תלת מימדיות ברורות של מבני צמחים27.
- הכן תמיסה של 0.2 מ"ג/מ"ל WGA-פלואורוכרום מצומד ב-0.1 M PB28 (pH 7.2, בדוק את שלב 5.1.1 וטבלה 3). הכינו תמיסה של 1% Calcofluor White ב-0.1 M PB (pH 7.2). הכן כמויות קטנות של פתרונות אלה, כמו סעיפים הם דגירה ישירות איתם.
- דגרו את החלקים במגלשות הזכוכית במשך 30 דקות בתמיסת ההצמדה WGA-fluorochrome29, תוך שימוש בנפח מספיק כדי לכסות את החלקים, ולאחר מכן שטפו ב-0.1 M PB.
- דגירה של החלקים בתמיסת calcofluor, תוך שימוש בנפח מספיק כמדיום הרכבה. הפתרון יכול להישמר במהלך תקופת התצפית.
- שים כיסויים על השקופיות והתבונן במיקרוסקופ קונפוקלי או במיקרוסקופ אור פלואורסצנטי באמצעות המסננים הבאים: TC/GFP (עירור: 470-440, פליטה: 525-550, עבור WGA-fluorochrome בטבלת החומרים - דופן תא פטרייתי פלואורסצנטית ירוקה מתחת למסנן זה29) ו- DAPI (עירור: 358, פליטה: 463, עבור Calcofluor White)30.
הערה: ניתן לקבל תמונות תלת-ממדיות באמצעות הפונקציה Z-series במיקרוסקופ הקונפוקלי27.
8. מיקרוסקופיית אלקטרונים סורקת של איברי הצמח
- לאחר תיקון דגימות, ביצוע התייבשות ואחסון ב-70% אתנול (סעיף 1), אפשרות אחת היא לחתוך דגימות כדי לחשוף כל משטח רצוי לניתוח SEM, במידת הצורך (למשל, רקמות פנימיות, מבנה השחלות). השתמש בסכין גילוח חדה וחדשה ובצע חתכים בתנועה חד כיוונית, תוך הימנעות ממראה פגום של אזורים אלה ב- SEM. במידת הצורך, השתמש בסטריאומיקרוסקופ כדי לבחור את הדגימות ולשקול את אזור גושי המתכת כדי לקבוע את גודל הדגימה.
- דגימות התייבשות נוספות עבור SEM בסדרה אתנולית: 80%, 96% ו-2x באלכוהול אתילי מוחלט (≥99.8%). שמור דגימות קטנות ועדינות למשך 30 דקות בכל ריכוז ודגימות גדולות וצפופות יותר למשך שעה אחת.
- קפל מעטפות קטנות באמצעות נייר טישו כדי לארגן דגימות לשלבים הבאים, ניתן לטפל בדגימות גדולות יותר ללא מעטפה. זהה את המעטפות עם עיפרון על ידי כתיבת אות או מספר, ונהל יומן של כל הדוגמאות בכל אחת מהן. שמור את הדגימות באתנול מוחלט, אם כי לא לאורך זמן, והמשך לשלב 8.4 בהקדם האפשרי.
- המשך לייבוש נקודה קריטית (CP). הפעלת מייבש CP על פי נהלי הפעלה סטנדרטיים. מניחים דגימות באתנול מוחלט (נוזל ביניים) בתא לחץ. בנקודה הקריטית CO2 (31 מעלות צלזיוס, 7.3 x 106 Pa ) נוזל הביניים מתמוסס לתוך נוזל המעבר (פחמן דו חמצני נוזלי), והדגימות מיובשות31.
- לאחר ייבוש CP, אחסנו דגימות בהקדם האפשרי במיכל ייבוש, למשל, בקבוקון אטום המכיל ג'ל סיליקה. לחות אטמוספרית יכולה להרוס את הדגימות אם נספגים מחדש31.
- השתמש במוטות מתכת כדי להרכיב את הדגימות. לפני הרכבה, לשים כפפות על מנת לתמרן את stubs, לטבול אותם אצטון במשך 5 דקות כדי לחסל כל שומן, ולתת להם להתייבש. השתמש בסרט דבק פחמן דו-צדדי מוליך כדי לקבע דגימות על הסטאב, ובסטריאומיקרוסקופ כדי לסייע במיקום הדגימות, תוך התחשבות בכך שהמראה מלמעלה היא הפרספקטיבה היחידה האפשרית בתמונות SEM.
- תפעל דגימות באמצעות פינצטה עדינה, היזהר מכיוון שחלק הדגימה שהפינצטה נוגעת בו פגום בדרך כלל, לכן נסה לגעת בחלקים הממוקמים הרחק מאזורי העניין (למשל, אזורים במגע עם הקלטת). מתחזקים את הסטוצים עם דגימות בצלחת פטרי אטומה עם ג'ל סיליקה. המשך לשלב 8.8 בהקדם האפשרי.
- השתמש במעיל sputter כדי להפקיד שכבה של מתכת, בדרך כלל זהב או פלטינה, על פני השטח של הדגימות באטמוספירה בלחץ נמוך של גז אינרטי, לעתים קרובות ארגון31. עקוב אחר נהלי ההפעלה הסטנדרטיים בעת שימוש במעיל sputter. עובי הציפוי תלוי בטופוגרפיה של הדגימות, בדרך כלל בין 15-40 ננומטר32.
- שמרו על השקעים המצופים בצלחת פטרי אטומה עם ג'ל סיליקה, ובתנאי שג'ל הסיליקה שומר על הלחות, ניתן לאחסן דגימות בדרך זו במשך שבועות. השתמש במיקרוסקופ אלקטרונים סורק כדי לנתח את הדגימות. הדגימות בוואקו נפגעות על ידי קרן של אלקטרונים, ופליטת האותות מאינטראקציה כזו מתפרשת כתמונות31. לפרטים על הפעלת מיקרוסקופ אלקטרונים סורק, קראו את Jeffree and Read (1991)31 ו-Bozzola and Russell (1999)32.
- כדי לעשות שימוש חוזר בסטוצים, משכו את סרט ההדבקה ושפשפו אותם בצמר חוטים. לשטוף במי ברז, לטבול אתנול מוחלט, ולייבש אותם כראוי, מניעת חמצון של המתכת המרכיבה.
9. מיקרוסקופיית אלקטרונים
- דגימות קידומת עם חיץ גלוטראלדהיד-קקודילאט כפי שמוסבר בשלבים 1.7 ו-1.10. לאחר 12-24 שעות של קידומת, יש לשטוף את הדגימות 3x ב-0.2 M cacodylate buffer (pH 7.25) למשך 10 דקות. בצע פוסט-פיקציה עם 1% אוסמיום טטרוקסיד (OsO4) בחיץ קקודילאט של 0.2 M, למשך 12 שעות בחושך, בטמפרטורת החדר. יש לשטוף 3x במים מזוקקים למשך 5 דקות.
אזהרה: קקודילאט ואוסמיום טטרוקסיד רעילים מאוד ואין לשאוף אותם. השתמש בהם במנדפים אדים, בהתאם לגיליונות נתוני הבטיחות המתאימים. - יש לייבש את הדגימות ב-30%, 50%, 70% ו-96% אתנול, פי 2 בכל ריכוז, למשך 10 דקות. לאחר מכן, להתייבש 3x באלכוהול מוחלט, במשך 15 דקות בכל פעם.
- יש לחדור את הדגימות בשרפים אקריליים הידרופיליים (ראו טבלת חומרים), פעם אחת עם שרף 1:1 + אתנול מוחלט ופי 3 עם שרף טהור למשך 8-12 שעות כל אחת. יש לבצע פילמור בכמוסות ג'לטין בטמפרטורה של 60°C עד להתמצקות מלאה (12 שעות לכל היותר17).
- להעריך מקרוב את הכיוון של דגימות בתוך בלוק שרף; חותכים את החלק העליון של הבלוק, עם סכין גילוח, ויוצרים צורה פירמידלית שמרכזת את הדגימה באזור החתך. מקבלים חתכים חצי-דקים (250-500 ננומטר)33 באולטרה-מיקרוטום עם סכין יהלום ומניחים על מגלשות זכוכית בכמה טיפות מים.
- שמור את השקופיות על צלחת חמה ב 60 מעלות צלזיוס. הכתימו את החלקים ב-O כחול טולוידין כמו בשלב 6.1.1 ותנו לכתם להתייבש לחלוטין. יש לשטוף בזהירות במי ברז. הערך את החלק המתקבל על ידי ציור ארבעה רבעים ובחירת הרביע המתאים ביותר לניתוח.
- חותכים את הבלוק כך שהצורה הפירמידלית תרכז את הרביע הנבחר על פניו העליונות של הבלוק. לייצר חלקים דקים במיוחד (50-100 ננומטר)33,34. העובי מוערך על פי צבע ההפרעה של הסעיפים: קטעים עם כ -70 ננומטר נראים כסף-זהב, עם כ -100 ננומטר מופיעים זהב, ועם כ -200 ננומטר מופיעים כחולים34.
- אספו את החלקים האולטרה-דקים מהמים באמצעות רשתות נחושת והמשיכו לשיטת צביעת הניגודיות עם אורניל אצטט ועופרת ציטראט, כמתואר להלן.
- הכינו תמיסת עופרת ציטראט (טבלה 5) והקפיאו את התמיסה הסופית בצינורות מיקרוצנטריפוגה עם 1 מ"ל של תמיסה בכל אחד מהם, רק להפשיר ממש לפני השימוש.
- הכינו תמיסת אורניל אצטט: המיסו 0.625 גרם של אורניל אצטט [UO 2(CH3COO)2] ב-25 מ"ל של מים מזוקקים שהורתחו והתקררו לאחרונה. יש לאחסן בבקבוקון כהה במקפיא.
אזהרה: עופרת חנקתית רעילה בבליעה. 1 N NaOH הוא מאוד קורוזיבי. אורניל אצטט הוא רדיואקטיבי ורעיל. אסור לבלוע אותו, לשאוף אותו או לבוא במגע עם העור. - בעת הכתמה, שים את שני הריאגנטים המוכנים במזרקים נפרדים של 3 מ"ל עם יחידות מסנן (נקבובית 0.22 מיקרומטר, ראה טבלת חומרים). הכינו צלחת פטרי הפוכה עם סרט תרמופלסטי אוטם מעליה (ראו טבלת חומרים) ובתוך צלחת רחבה יותר, עם כדורי NaOH בקצוות כמלכודת ל-CO 232 (ראו איור 2).
- השליכו את הטיפה הראשונה, ומעל הסרט הניחו טיפה של אורניל אצטט ושלוש טיפות מים מזוקקים לכל רשת מוכתמת. עשו את אותו הדבר עם עופרת ציטראט והוסיפו עוד שלוש טיפות של מים מזוקקים.
- דגירה של הרשת (עם הצד האטום כלפי מטה, היכן שהקטעים נמצאים) באורניל למשך 30 דקות (זמן משתנה). יש לשטוף 3x בטיפות המים המזוקקים, ולייבש את הרשת בכל פעם בעדינות עם נייר סינון בצד המבריק. חזרו על הפעולה עם טיפת עופרת ציטראט (30 דקות) ושטפו אותה.
- לאחר 4 שעות לפחות, נתחו את הרשתות במיקרוסקופ אלקטרונים הולכה. במיקרוסקופ זה, קרן של אלקטרונים עוברת דרך החלקים בוואקו והתמונה מוקרנת על מסך פלואורסצנטי. לפרטים על הפעלת מיקרוסקופ אלקטרונים להולכה, קראו Bozzola and Russell (1999)32.
| תמיסת עופרת ציטראט (להכתמת ניגודיות TEM) | |
| שלב 1 | הקף עם פח |
| שלב 2 | להמיס 0.266 גרם של עופרת חנקתית [Pb(NO3)2] ב 6 מ"ל של מים מזוקקים מבושלים מקוררים לאחרונה |
| שלב 3 | תסיסה במשך 2 דקות |
| שלב 4 | להוסיף 0.352 גרם של טריסודיום ציטראט [Na3(C6H5O7).2H2O] (התמיסה חייבת לרכוש מראה חלבי) |
| שלב 5 | מתסיסים במשך 15 דקות, אוטמים את הכוס עם פח ומעבירים את התמיסה לכוס 10 מ"ל |
| שלב 6 | להוסיף 1.6 מ"ל של 1N NaOH ו 2.4 מ"ל של מים מזוקקים (הפתרון חייב להיות שקוף) |
| שלב 7 | במידת הצורך, כוונן את ה- pH קרוב ל- 12 |
טבלה 5: מתכון לתמיסת עופרת ציטראט.

איור 2: סכמת הכתמה מנוגדת לתמיסות עופרת ציטראט ואורניל אצטט . (A) הכינו את צלחות הפטרי, אחת הפוכה (במרכז) עם סרט תרמופלסטי כך שניתן יהיה להניח מעליה טיפות, בתוך אחת רחבה יותר. כדורי NaOH הם מקומות סביב המנה המרכזית. (B) טיפות אורניל אצטט מונחות במעגלים עם האות U, וטיפות ציטראט עופרת במעגלים המסומנים L. DW מציין טיפות של מים מזוקקים. הרשתות מוכתמות ברצף בעמודה, כך שניתן להכתים חמש רשתות בו-זמנית כפי שהן מיוצגות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
10. נביטה סימביוטית של זרעי סחלב
- ודא שהתמיסות וכל החומרים המשמשים לנביטה סימביוטית של זרעים הם סטריליים כדי למנוע זיהום. התחל על ידי autoclaving אותם במשך 20 דקות ב 121 מעלות צלזיוס. שלבי הנביטה הסימביוטיים מסוכמים באיור 3.
- לחטא באופן שטחי פירות וזרעים על ידי טבילתם בתמיסת נתרן היפוכלוריט המכילה 2% כלור פעיל למשך 10-15 דקות לפירות ו-7-10 דקות לזרעים, בהתחשב בנוקשות ובעובי של שכבת הזרעים9. זרעים דקים ושבירים ניתן לטבול בתמיסת נתרן היפוכלוריט מדולל ביחס של 1:1. לאחר מכן, לשטוף 3x במים מזוקקים autoclaved כדי להסיר את תמיסת hypochlorite.
- משחזרים את הזרעים על ידי סינון בבד סריגרפי ומשתמשים בזרעים כדי להמשיך בבדיקות נביטה (רצוי). במידת הצורך, לאחסן אותם במעטפות נייר סינון בתוך צלוחיות זכוכית עם ג'ל סיליקה, ב 4 מעלות צלזיוס, לסגור הרמטית את הצלוחיות ולאטום אותם עם סרט נצמד. העבירו כמה טיפות מים מהכביסה האחרונה לאגר דקסטרוז תפוחי אדמה (PDA, 39 גרם לליטר), כדי להעריך את יעילות תהליך הכביסה.
- לפני זריעת זרעים במדיום התרבית, להעריך את הכדאיות שלהם באמצעות מבחן tetrazolium (אופציונלי) כמתואר להלן35.
- לדגום כ-10 מ"ג זרעים בצינור מיקרוצנטריפוגה עם 1 מ"ל של 10% סוכרוז במים מזוקקים, למשך 24 שעות בטמפרטורת החדר (כ-25 מעלות צלזיוס), באור.
- הסר את תמיסת הסוכרוז עם מיקרופיפט והוסף 1 מ"ל של תמיסת טטרזוליום 1% (טריפנילטטרזוליום כלוריד) במים מזוקקים. דגירה ב 40 °C ב thermoblock במשך 24 שעות בחושך.
- הסר את תמיסת tetrazolium עם micropipette ולשטוף את הזרעים עם מים מזוקקים 2x או עד הפתרון מוסר. יש להסיר את כל הנוזלים. במידת הצורך, ניתן לאחסן את הזרעים במקפיא עד שבוע (כמו בשלב 10.3) לפני ניתוחם.
- יש לתלות את הזרעים במים מזוקקים ולנתח אותם תחת מיקרוסקופ אור. זרעים בני קיימא רוכשים צבע אדום בהיר עד כהה, בעוד שזרעים שאינם בני קיימא שומרים על צבעם הטבעי.
- בצע את פרוטוקול9 המותאם הבא לנביטה סימביוטית של זרעי סחלב.
- דגירה של הזרעים מעל דיסקיות נייר סינון אוטומטיות (בקוטר 1-2 ס"מ) המונחות בכלי פטרי עם תרבית אגר שיבולת שועל (OMA) בינונית (2.5 גרם לליטר של פתיתי שיבולת שועל ו-7 גרם/ליטר של אגר, pH 6).
- במרכז צלחת פטרי, לחסן שבר של מדיום תרבית (כ 1 ס"מ2) המכיל תפטיר מן הפטרייה המבודדת שנבחרה להליך נביטה. אוטמים את צלחות הפטרי עם סרט נצמד ומדגרים אותם בחושך בסביבות 25 מעלות צלזיוס או בטמפרטורת החדר, מכיוון שהוא מתאים יותר לצמיחת פטריות.
- הכן כמה מנות עם זרעים וללא חיסון פטרייתי, כמו שליטה שלילית עבור מבחן הנביטה.
- לנתח את תוצאות הנביטה מדי שבוע, על ידי איסוף נתונים כמותיים ואיכותיים וצילום פרוטוקורמים ושתילים. התצפית של זרעים ופרוטוקורמים צריכה להתבצע באמצעות סטריאומיקרוסקופ להערכה מדויקת יותר של נביטה. השתמש במקור אור המגיע מלמטה, מכיוון שהוא מאפשר ניגודיות רבה יותר, מה שמאפשר להבחין בין התפטיר הפטרייתי לפרוטוקורמים ביתר קלות.
- לאסוף דגימות בשלבי התפתחות שונים ולתקן לניתוחים אנטומיים (סעיף 1). ליישם את כל ניתוחי התמונה שתוארו קודם לכן כדי לחקור אנדופיטים פטרייתיים בזרעים, פרוטוקורמים ושתילים במהלך הנביטה (מיקרוסקופיית אור - סעיפים 4, 5 ו-6; קונפוקל ופלואורסצנציה - סעיף 7; SEM ו- TEM - סעיפים 8 ו -9).
- הפקת תוצאות כמותיות לאחר סיווג השלבים לפי טבלה 6. השלבים מתארים את ההתפתחות הרגילה של זרעים מסחלבים מיקוהטרוטרופיים. אסוף נתונים מדי שבוע וטבלה עם התאריכים הראשוניים של כל שלב שנצפה.
- בנוסף, אספו נתונים כמותיים המעריכים את אחוזי הנביטה ואת קצב הנביטה. ספרו לפחות 100 זרעים או הגדירו שדות ספירה35. תיחום שלושה שדות ספירה או יותר לכל צלחת פטרי, המורכבת מאזורים קבועים עם אזור סטנדרטי, והערך מדי שבוע. חישוב הנתונים שנאספו על פי משוואת מדד הצמיחה (GI):

כאשר N 0 הוא מספר הזרעים שנספרו בשלב0 , N 1 מתייחס לשלב1 , והוא נמשך עד שלב 6 (רשום כ-N6)36.
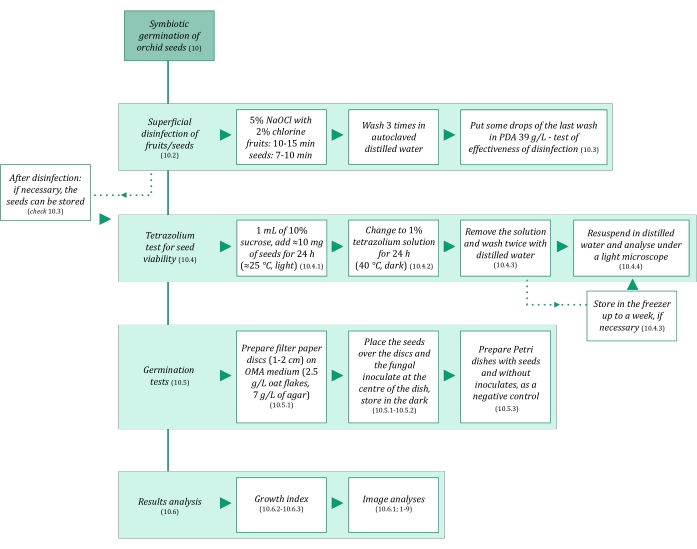
איור 3: סיכום סכמטי של מתודולוגיית נביטה סימביוטית של זרעים. הסכמות מספקות אינדיקציות לשלבים מפורטים בפרוטוקול. קיצורים: OMA = אגר שיבולת שועל, PDA = אגר דקסטרוז תפוחי אדמה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
| שלב הנביטה | תיאור: __________ |
| 0 | ללא נביטה |
| 1 | נפיחות של העובר |
| 2 | קרע בטסטה |
| 3 | שערות סופגות מתפתחות |
| 4 | הקרנת גזע מתפתחת |
| 5 | הקשקשים להגנה (פלטות) מתפתחים |
| 6 | שורשים ראשונים מתפתחים |
טבלה 6: תיאור שלבי התפתחות הפרוטוקורם המיושמים בניתוחים תקופתיים של בדיקות נביטה. שונה מהשלבים המתוארים ב- Otero et al.36.
תוצאות
בעקבות השלבים החיוניים של קיבוע רקמת הצמח מניב מבנים תאיים דומים ככל האפשר למצב החי, בהתחשב במורפולוגיה, נפח וארגון מרחבי של רכיבים תאיים ורקמות16. שימו לב לתכונות כאלה בדגימות לאחר קיבוע כימי (איור 4). איור 4C-F מייצג דגימות קבו?...
Discussion
לניתוחי תמונות באנטומיה ובמורפולוגיה של צמחים יש פוטנציאל חשוב להגשים מטרות ולסייע בהבנת הקשרים בין צמחים מיקוהטרוטרופיים לבין אנדופיטים פטרייתיים חיוניים שלהם, כפי שהוכח על ידי מחקרים של איברים תת-קרקעיים 6,40, ניתוחים מבניים של נביטה סימביוטית של זרעים39,...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחברים מודים למימון מ-FAEPEX ו-FAPESP (2015/26479-6). MPP מודה לקייפס על מלגת התואר השני שלו (תהליך 88887.600591/2021-00) ו- CNPq. JLSM מודה ל- CNPq על מענקי פרודוקטיביות (303664/2020-7). המחברים מודים גם על הגישה לציוד ולסיוע הניתנים על ידי LME (המעבדה למיקרוסקופיית אלקטרונים - IB/Unicamp), INFABiC (המכון הלאומי למדע וטכנולוגיה על פוטוניקה יישומית לביולוגיה של התא - Unicamp), ו- LaBiVasc (המעבדה לביולוגיה של כלי הדם - DBEF/IB/Unicamp); LAMEB (UFSC) ואליאנה דה מדיירוס אוליביירה (UFSC) על תרומות לפרוטוקול cryoprotection; LME עבור תרומות לפרוטוקול TEM.
Materials
| Name | Company | Catalog Number | Comments |
| Acetone | Sigma-Aldrich | 179124 | (for SEM stubs mounting) |
| Agar-agar (AA) | Sigma-Aldrich | A1296 | (for seeds germination tests) |
| Calcofluor White Stain | Sigma-Aldrich | 18909 | fluorescent dye (detects cellulose) |
| Citrate Buffer Solution, 0.09M pH 4.8 | Sigma-Aldrich | C2488 | (for toluidine blue O staining) |
| Conductive Double-Sided Carbon Tape | Fisher Scientific | 50-285-81 | (for SEM) |
| Confocal Microscope | Zeiss | (any model) | |
| Copper Grids | Sigma-Aldrich | G4776 | (for TEM) |
| Critical-point dryer | Balzers | (any model) | |
| Cryostat | Leica Biosystems | (any model) | |
| Dissecting microscope | Leica Biosystems | (= stereomicroscope, any model) | |
| Entellan | Sigma-Aldrich | 107960 | rapid mounting medium for microscopy |
| Ethyl alcohol, pure (≥99.5%) | Sigma-Aldrich | 459836 | (= ethanol, for dehydration processes) |
| Formaldehyde solution, 37% | Sigma-Aldrich | 252549 | (for NBF solution preparation) |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128 | histological tissue fixative |
| Gelatin capsules for TEM | Fisher Scientific | 50-248-71 | (for resin polymerisation in TEM) |
| Gelatin solution, 2% in H2O | Sigma-Aldrich | G1393 | (dilute for slides preparation - OCT adherence) |
| Glutaraldehyde solution, 25% | Sigma-Aldrich | G6257 | (for Karnovsky’s solution preparation) |
| HistoResin | Leica Biosystems | 14702231731 | glycol methacrylate (GMA) embedding kit |
| Iodine | Sigma-Aldrich | 207772 | (for Lugol solution preparation) |
| Lead(II) nitrate | Sigma-Aldrich | 228621 | Pb(NO3)2 (for TEM contrast staining) |
| Light Microscope | Olympus | (any model) | |
| LR White acrylic resin | Sigma-Aldrich | L9774 | hydrophilic acrylic resin for TEM |
| Lugol solution | Sigma-Aldrich | 62650 | (for staining) |
| Metal stubs for specimen mounts | Rave Scientific | (for SEM, different models) | |
| Microtome | Leica Biosystems | manual rotary microtome or other model | |
| Oatmeal agar (OMA) | Millipore | O3506 | (for seeds germination tests) |
| OCT Compound, Tissue-Tek | Sakura Finetek USA | 4583 | embedding medium for frozen tissues |
| Osmium tetroxide | Sigma-Aldrich | 201030 | OsO4 (for TEM postfixation) |
| Parafilm M | Sigma-Aldrich | P7793 | sealing thermoplastic film |
| Paraformaldehyde | Sigma-Aldrich | 158127 | (for Karnovsky’s solution preparation) |
| Poly-L-lysine solution, 0.1% in H2O | Sigma-Aldrich | P8920 | (for slides preparation - OCT adherence) |
| Poly-Prep Slides | Sigma-Aldrich | P0425 | poly-L-lysine coated glass slides |
| Polyethylene Molding Cup Trays | Polysciences | 17177A-3 | (6x8x5 mm, for embbeding samples in GMA resin) |
| Polyethylene Molding Cup Trays | Polysciences | 17177C-3 | (13x19x5 mm, for embbeding samples in GMA resin) |
| Potassium iodide | Sigma-Aldrich | 221945 | (for Lugol solution preparation) |
| Potato Dextrose Agar (PDA) | Millipore | 70139 | (for seeds germination tests) |
| Scanning Electron Microscope | Jeol | (any model) | |
| Silane [(3-Aminopropyl)triethoxysilane] | Sigma-Aldrich | A3648 | (for slides preparation - OCT adherence) |
| Silane-Prep Slides | Sigma-Aldrich | S4651 | glass slides coated with silane |
| Silica gel orange, granular | Supelco | 10087 | (for dessicating processes) |
| Sodium cacodylate trihydrate | Sigma-Aldrich | C0250 | (for glutaraldehyde-sodium cacodylate buffer) |
| Sodium hydroxide | Sigma-Aldrich | S5881 | NaOH (for Karnovsky’s solution preparation and TEM contrast staining) |
| Sodium hypochlorite solution | Sigma-Aldrich | 425044 | NaClO (for seeds surface disinfection) |
| Sodium phosphate dibasic, anhydrous | Sigma-Aldrich | 71640 | Na2HPO4 (for NBF solution and PB preparation) |
| Sodium phosphate monobasic monohydrate | Sigma-Aldrich | S9638 | NaH2PO4·H2O (for NBF and PB) |
| Sputter coater | Balzers | (any model) | |
| Sucrose | Sigma-Aldrich | S0389 | C12H22O11 (for cryoprotection and germination test) |
| Sudan III | Sigma-Aldrich | S4131 | (for staining) |
| Sudan IV | Sigma-Aldrich | 198102 | (for staining) |
| Sudan Black B | Sigma-Aldrich | 199664 | (for staining) |
| Syringe | (3 mL, any brand, for TEM contrast staining) | ||
| Syringe Filter Unit, Millex-GV 0.22 µm | Millipore | SLGV033R | PVDF, 33 mm, gamma sterilized (for TEM contrast staining) |
| Tek Bond Super Glue 793 | Tek Bond Saint-Gobain | 78072720018 | liquid cyanoacrylate adhesive, medium viscosity |
| Toluidine Blue O | Sigma-Aldrich | T3260 | (for staining) |
| Transmission Electron Microscope | Jeol | (any model) | |
| Triphenyltetrazolium chloride | Sigma-Aldrich | T8877 | (for the tetrazolium test in seeds germination) |
| Trisodium citrate dihydrate | Sigma-Aldrich | S1804 | Na3(C6H5O7)·2H2O (for TEM contrast staining) |
| Ultramicrotome | Leica Biosystems | (any model) | |
| Uranyl acetate | Fisher Scientific | 18-607-645 | UO2(CH3COO)2 (for TEM contrast staining) |
| Vacuum pump | (any model) | ||
| Wheat Germ Agglutinin, Alexa Fluor 488 Conjugate | TermoFisher Scientific | W11261 | fluorescent dye-conjugated lectin (detects sialic acid and N-acetylglucosaminyl residues) |
References
- Evert, R. F. . Esau’s Plant Anatomy: Meristems, Cells, and Tissues of the Plant Body: Their Structure, Function, and Development. , (2006).
- Yeung, E. C. T., Stasolla, C., Sumner, M. J., Huang, B. Q. . Plant Microtechniques and Protocols. , (2015).
- Sokoloff, D. D., Jura-Morawiec, J., Zoric, L., Fay, M. F. Plant anatomy: at the heart of modern botany. Botanical Journal of the Linnean Society. 195 (3), 249-253 (2021).
- Leake, J. R. The biology of myco-heterotrophic (‘saprophytic’) plants. New Phytologist. 127 (2), 171-216 (1994).
- Bidartondo, M. I. The evolutionary ecology of myco-heterotrophy. New Phytologist. 167 (2), 335-352 (2005).
- Imhof, S., Massicotte, H. B., Melville, L. H., Peterson, R. L. Subterranean morphology and mycorrhizal structures. Mycoheterotrophy. , 157-214 (2013).
- Rasmussen, H. N., Rasmussen, F. N. Orchid mycorrhiza: implications of a mycophagous life style. Oikos. 118 (3), 334-345 (2009).
- Rasmussen, H. N., Dixon, K. W., Jersáková, J., Těšitelová, T. Germination and seedling establishment in orchids: a complex of requirements. Annals of Botany. 116 (3), 391-402 (2015).
- Zettler, L. W. Terrestrial orchid conservation by symbiotic seed germination: techniques and perspectives. Selbyana. 18 (2), 188-194 (1997).
- Stewart, S. L., Kane, M. E. Symbiotic seed germination and evidence for in vitro mycobiont specificity in Spiranthes brevilabris (Orchidaceae) and its implications for species-level conservation. In Vitro Cellular & Developmental Biology - Plant. 43 (3), 178-186 (2007).
- Zhao, D. -. K., et al. Orchid reintroduction based on seed germination-promoting mycorrhizal fungi derived from protocorms or seedlings. Frontiers in Plant Science. 12, 701152 (2021).
- Selosse, M. A., Roy, M. Green plants that feed on fungi: facts and questions about mixotrophy. Trends in Plant Science. 14 (2), 64-70 (2009).
- Merckx, V. S. F. T., Mennes, C. B., Peay, K. G., Geml, J. Evolution and diversification. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 215-244 (2013).
- Boon, M. E., Drijver, J. Routine Cytological Staining Techniques: Theoretical Background and Practice. Macmillan International Higher Education. , (1986).
- Karnovsky, M. A formaldehyde-glutaraldehyde fixative of high osmolality for use in electron microscopy. Journal of Cell Biology. 27 (2), 137-138 (1964).
- Hayat, M. . Fixation for Electron Microscopy. , (1981).
- Roland, J. C., Vian, B. General preparation and staining of thin sections. Electron Microscopy of Plant Cells. 1, 675 (1991).
- Gerrits, P. O., Horobin, R. W. Glycol methacrylate embedding for light microscopy: basic principles and trouble-shooting. Journal of Histotechnology. 19 (4), 297-311 (1996).
- Zhang, Z., Niu, L., Chen, X., Xu, X., Ru, Z. Improvement of plant cryosection. Frontiers in Biology. 7 (4), 374-377 (2012).
- BeneŠ, K. On the media improving freeze-sectioning of plant material. Biologia Plantarum. 15 (1), 50-56 (1973).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Preparation of slides and coverslips for microscopy. Cold Spring Harbor Protocols. 2008 (5), (2008).
- Sakai, W. S. Simple method for differential staining of paraffin embedded plant material using toluidine blue O. Stain Technology. 48 (5), 247-249 (1973).
- O’Brien, T., Feder, N., McCully, M. E. Polychromatic staining of plant cell walls by toluidine blue O. Protoplasma. 59 (2), 368-373 (1964).
- Ventrella, M. C., Almeida, A. L., Nery, L. A., Coelho, V. P. d. e. M. Métodos Histoquímicos Aplicados às Sementes. Universidade Federal de Viçosa. , (2013).
- Pearse, A. G. E. . Histochemistry, Theoretical and Applied. , (1960).
- Andrade-Linares, D. R., Franken, P. Fungal endophytes in plant roots: taxonomy, colonization patterns, and functions. Symbiotic Endophytes. , 311-334 (2013).
- Wymer, C. L., Beven, A. F., Boudonck, K., Lloyd, C. W. Confocal microscopy of plant cells. Confocal Microscopy Methods and Protocols. , 103-130 (1999).
- Marques, J. P. R., Soares, M. K. M. Manual de Técnicas Aplicadas à Histopatologia Vegetal. FEALQ. , (2021).
- Navarro, B. L., Marques, J. P. R., Appezzato-da-Glória, B., Spósito, M. B. Histopathology of Phakopsora euvitis on Vitis vinifera. European Journal of Plant Pathology. 154 (4), 1185-1193 (2019).
- Marques, J. P. R., et al. Sugarcane cell wall-associated defense responses to infection by Sporisorium scitamineum. Frontiers in Plant Science. 9, 698 (2018).
- Jeffree, C. E., Read, N. D. Ambient-and low-temperature scanning electron microscopy. Electron Microscopy of Plant Cells. , 313-413 (1991).
- Bozzola, J. J., Russell, L. D. . Electron Microscopy: Principles and Techniques for Biologists. , (1999).
- Murray, S. Basic transmission and scanning electron microscopy. Introduction to electron Microscopy for Biologists. , 3-18 (2008).
- . Glossary of TEM terms Available from: https://www.jeol.co.jp/en/words/emterms/ (2021)
- Seaton, P. T., et al. Orchid seed and pollen: a toolkit for long-term storage, viability assessment and conservation. Orchid Propagation: From Laboratories to Greenhouses—Methods and Protocols. , 71-98 (2018).
- Otero, J. T., Ackerman, J. D., Bayman, P. Differences in mycorrhizal preferences between two tropical orchids. Molecular Ecology. 13 (8), 2393-2404 (2004).
- Koch, R. A., et al. Marasmioid rhizomorphs in bird nests: Species diversity, functional specificity, and new species from the tropics. Mycologia. 112 (6), 1086-1103 (2020).
- Webster, J., Weber, R. . Introduction to Fungi. , (2007).
- Sisti, L. S., et al. The role of non-mycorrhizal fungi in germination of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. Frontiers in Plant Science. 10, 1589 (2019).
- Martos, F., et al. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids. New Phytologist. 184 (3), 668-681 (2009).
- Alves, M. F., et al. Reproductive development and genetic structure of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. BMC Plant Biology. 21 (1), 332 (2021).
- Merckx, V. S. F. T. Mycoheterotrophy: an introduction. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 1-17 (2013).
- Hall, J. L., Hawes, C. . Electron Microscopy of Plant Cells. , (1991).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved