Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Методы микроскопии для интерпретации грибковой колонизации в микогетеротрофных тканях растений и симбиотической прорастания семян
В этой статье
Резюме
Этот протокол направлен на обеспечение подробных процедур сбора, фиксации и поддержания микогетеротрофных образцов растений, применяя различные методы микроскопии, такие как сканирующая и просвечивающая электронная микроскопия, световая, конфокальная и флуоресцентная микроскопия для изучения грибковой колонизации в тканях растений и семенах, прорастающих микоризными грибами.
Аннотация
Структурная ботаника является незаменимой перспективой для полного понимания экологии, физиологии, развития и эволюции растений. При исследовании микогетеротрофных растений (то есть растений, которые получают углерод из грибов) замечательные аспекты их структурных адаптаций, закономерности колонизации тканей грибами и морфоанатомия подземных органов могут просветить их стратегии развития и их отношения с гифами, источником питательных веществ. Еще одна важная роль симбиотических грибов связана с прорастанием семян орхидеи; все виды Orchidaceae являются микогетеротрофными на стадии прорастания и рассады (начальная микогетеротрофия), даже те, которые фотосинтезируют на взрослых стадиях. Из-за отсутствия питательных запасов в семенах орхидей грибковые симбионты необходимы для обеспечения субстратов и обеспечения прорастания. Анализ стадий прорастания по структурным перспективам также может ответить на важные вопросы, касающиеся взаимодействия грибов с семенами. Различные методы визуализации могут быть применены для выявления эндофитов грибов в тканях растений, как предлагается в этой статье. От руки и тонкие участки органов растений можно окрашивать, а затем наблюдать с помощью световой микроскопии. Фторхром, конъюгированный с агглютинином зародышей пшеницы, может быть применен к грибам и инкубирован совместно с Calcofluor White для выделения клеточных стенок растений в конфокальной микроскопии. Кроме того, подробно описаны методологии сканирующей и просвечивающей электронной микроскопии для микогетеротрофных орхидей, а также исследуются возможности применения таких протоколов в родственных растениях. Симбиотическое прорастание семян орхидеи (т.е. в присутствии микоризных грибов) подробно описано в протоколе, наряду с возможностями подготовки структур, полученных с разных стадий прорастания, для анализов с помощью световой, конфокальной и электронной микроскопии.
Введение
Структурные исследования в ботанике, охватывающие морфологию и анатомию растений, являются базовыми для понимания всего организма 1,2 и обеспечивают необходимые перспективы для интеграции и внесения вклада в знания об экологии, физиологии, развитии и эволюции растений3. Методы в морфологии и анатомии растений в настоящее время включают протоколы, оборудование и знания, разработанные недавно, а также более века назад2. Непрерывное выполнение и адаптация классических методов (например, световая микроскопия) наряду с более современными методами (например, конфокальной микроскопией, рентгеновской микротомографией) имеют одну и ту же существенную основу: теоретические знания, позволяющие разрабатывать методологию.
Основным инструментом в анатомии и морфологии растений является изображение. Несмотря на ошибочное представление о том, что такие анализы являются простыми наблюдениями, давая пространство субъективным интерпретациям2, анализ и понимание изображений в этой области требует знания применяемых методов (оборудование, тип анализа, методологические процедуры), клеточных компонентов, гистохимии и растительного тела (организация и функция тканей, онтогенез, морфологические адаптации). Интерпретация изображений, полученных с помощью различных методов, может привести к корреляции формы и функции, расшифровке химического состава структуры, подтверждению в описании таксонов, пониманию инфекций фитопатогенами и другим подобным оценкам.
При исследовании микогетеротрофных (MH) растений (т.е. нефотосинтезирующих растений, получающих углерод из микоризных грибов 4,5) замечательные аспекты их структурных адаптаций, закономерности колонизации тканей грибами и морфоанатомия подземных органов могут просветить их стратегии развития и отношения с гифами, которые являются источником питательных веществ. Подземные органы растений MH обычно демонстрируют важные адаптации, связанные с их связью с почвенными грибами, поэтому необходимо выполнить эти анатомические и морфологические исследования6. Не следует игнорировать воздушные органы видов MH, так как эндофиты также могут присутствовать в этих тканях, даже если они не являются микоризными грибами (личные наблюдения, пока не опубликованы).
Помимо устоявшейся сущности ассоциации микоризных грибов с видами MH в течение всего их жизненного цикла7, каждый вид орхидеи, даже автотрофный, имеет начальную облигатную микогетеротрофную стадию в естественной среде. Это происходит потому, что эмбрион орхидеи недифференцирован и не имеет эндосперма или семядолий, таким образом, будучи неспособным развиваться и утвердиться в естественной среде без питательной поддержки грибковых партнеров 4,8. Учитывая, что протоколы симбиотического прорастания могут применяться не только к видам MH, но и к фотосинтезирующим орхидеям, с целью изучения специфичности орхидеи-гриба в прорастании и развитии протокормы, широко применяемая методология в инициативах по сохранению угрожаемых видов 9,10,11.
В этой сборке методов мы описываем важные этапы, связанные со сбором, фиксацией и хранением образцов растений MH для анатомических исследований (раздел 1), анализа поверхности и отбора образцов (раздел 2), методов секционирования (от руки: раздел 3, микротомия: секция 4, криомикротомия: секция 5), окрашивание и монтаж (раздел 6), флуоресценция и конфокальная микроскопия грибковых эндофитов (раздел 7), сканирующая электронная микроскопия (секция 8), и просвечивающая электронная микроскопия (раздел 9). Кроме того, мы описываем симбиотический метод прорастания семян орхидей (MH и автотрофный, раздел 10), поскольку ранее упомянутые методы визуализации могут быть успешно применены для анализа грибковой колонизации семян, протокорм и саженцев в процессе прорастания.
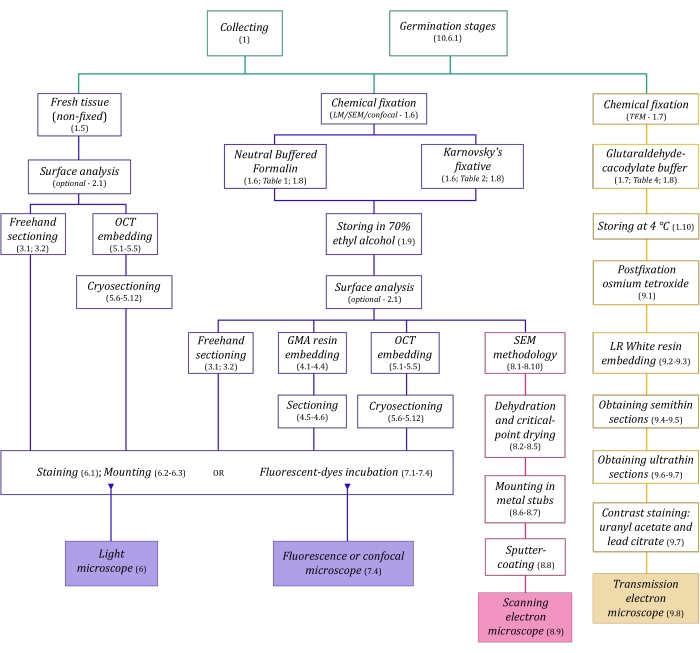
Рисунок 1: Схематическое обобщение методов визуализации. Схемы содержат указания на этапы протокола, в которых они подробно описаны. Сокращения: GMA = метакрилат гликоля, OCT = соединение оптимальной температуры резания, SEM = сканирующая электронная микроскопия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Методам микроскопии, подробно описанным здесь (рисунок 1), предшествуют следующие основные этапы: сбор, фиксация, обезвоживание, встраивание и секционирование образцов. Поскольку этапы являются переменными (рисунок 1) в зависимости от выбранного метода (методов), важно думать заранее, учитывая фиксаторы, которые должны быть подготовлены и транспортированы на место сбора, как образцы должны быть подготовлены перед фиксацией, процессы обезвоживания, которые будут использоваться (раздел 1), а также различные возможности встраивания и методы секционирования (разделы 4, 5, и 9). На рисунке 1 последовательно обобщены все этапы, необходимые для каждого метода микроскопии, подробно описанного ниже.
протокол
1. Сбор, фиксация и обслуживание образцов
ПРИМЕЧАНИЕ: Полностью MH растения обычно можно найти в темном лесном подлеске12,13, в основном во влажных и обильных мусором районах, тогда как частично растения MH можно найти в более открытых лесах12,13. Растения MH обычно имеют хорошо развитые подземные органы в различных формах и размерах.
- При сборе видов MH исследуйте почву вокруг основания растения, заботясь о том, чтобы не повредить подземные органы, и избегайте вытаскивания растений из земли, чтобы предотвратить отключение воздушных органов от подземных.
- Тщательно копайте вокруг воздушных структур, используя садовый мастерок, исследуя подземные органы, такие как корни, стебли, корневища и органы хранения, не повреждая эти структуры.
- Удалите частицы почвы, чтобы сохранить хрупкие структуры, и деликатно промыть эти органы водопроводной водой, чтобы смыть оставшиеся частицы почвы перед фиксацией образцов.
- Растения MH, связанные с опавшими листьями, требуют дополнительного внимания; тщательно собирайте органы, связанные с разлагающимся материалом через их гифы, избегайте вытаскивания этих органов из связанных структур и тщательно собирайте их, так как эти части очень деликатны. Сохраняйте структуры с такими связями и собирайте подстилку, а также для анализа.
- Если вы решите проанализировать свежий материал с использованием методов визуализации, храните образцы в закрытых пластиковых пакетах с достаточной влажностью, достаточным количеством воды, испаряющей и увлажняющей растение, предотвращая чрезмерный контакт воды с образцами. Немедленно транспортируйте их в лабораторию и анализируйте образцы в тот же день, когда они были собраны, обращая внимание, сохранились ли образцы при их анализе.
- Несите фиксаторы на место сбора в хорошо запечатанных контейнерах. Быстро фиксируйте образцы после сбора для световой микроскопии (ЛМ) и сканирующей электронной микроскопии (СЭМ) в любом из следующих фиксаторов: 10% нейтральном буферизованном формалине (NBF 14, таблица 1) или растворе Карновского (модифицированный15, таблица 2). Раствор Карновского может быть приготовлен с 0,2 М фосфатного буфера15, рецепт для которого описан в таблице 3.
- Для анализа методом просвечивающей электронной микроскопии (ТЭМ) разрезают образцы толщиной 4-3 мм внутри капли буфера какодилата глутаральдегида-натрия (модифицированного16, таблица 4) на более мелкие срезы толщиной 1-2 мм. Отбросьте края, вырезанные снаружи капли. Немедленно переложите срезы в сборную трубку с объемом фиксатора более чем в 10 раз превышающим объем образцов, так как он является аддитивным фиксатором (т.е. его молекулы химически добавляются к белкам фиксированным16).
ВНИМАНИЕ: Три описанных фиксатора очень токсичны. Избегайте вдохов, особенно во время их использования в полевых условиях. Подготовьте все фиксаторы в вытяжном капюшоне с помощью перчаток. Не следует смешивать какодилат и кислоты, так как может образоваться газообразный мышьяк16. - Если фиксированные образцы плавают в фиксаторе, это свидетельствует о наличии газа в тканях растений. Воздух и другие газы препятствуют проникновению фиксатора во весь образец2. Удалите газ из тканей путем их ресамплировки в более мелких частях и с помощью вакуумного насоса (давление от -300 до -400 inHg) до тех пор, пока все образцы не опустятся на дно раствора17. Будьте осторожны, так как чрезмерное давление, оказываемое насосом, может повредить образцы.
- После не менее 48 ч в растворе Карновского или 10% НБФ промыть образцы в 0,2 М ПБ (табл. 3) и обезвоживать их серией 10%, 30%, 50% и, наконец, 70% этанолом. Для деликатных образцов обезвоживать в течение 30 мин в каждой концентрации; для более крупных образцов обезвоживать в течение 1 ч или дольше.
ПРИМЕЧАНИЕ: 70% раствор этанола является идеальной средой для хранения образцов. Образцы в 70% этаноле могут храниться при комнатной температуре в течение многих лет. Не храните растительный материал в течение длительного времени в фиксаторах, так как удаление фиксирующих агентов является важным шагом после фиксации2. - Хранить образцы в глутаральдегид-какодилате при 4 °C, прежде чем приступить к постфиксации (этап 9.1).
| 10% нейтральный буферизованный формалин (NBF)14 | |
| шаг 1 | добавить 10 мл 37-40% раствора формальдегида в 80 мл дистиллированной воды |
| шаг 2 | добавить 0,4 г моноосновного моногидрата фосфата натрия (2PO4· H2O) к решению |
| Шаг 3 | добавить 0,65 г фосфата натрия двухосновного, безводного (Na2HPO4) |
| Шаг 4 | увеличить объем до 100 мл |
Таблица 1: 10% нейтральный буферизованный формалин рецепт14.
| Решение Карновского (модифицировано15) | |
| шаг 1 | в 20 мл дистиллированной воды при 60-70 °C |
| шаг 2 | добавить 0,8 г параформальдегида (до получения 4% мас./об.), перемешивая |
| Шаг 3 | добавить 1-4 капли 40% NaOH и перемешивать до тех пор, пока раствор не станет прозрачным. |
| Шаг 4 | охладить его и добавить 30 мл 0,2 М фосфатного буфера рН 7,2 (таблица 3) |
| Шаг 5 | разбавить 25% глутарового альдегида в 0,1 М ПБ (рН 7,2) для получения 1% глутаральдегида (конечный объем: ~60 мл) |
| Шаг 6 | добавить 1% глутаровый альдегид (стадия 5) к раствору, полученному на стадии 4, до получения до 100 мл фиксирующего средства |
Таблица 2: Рецепт решения Карновского (модифицированный15).
| 0,2 М фосфатного буфера (ПБ) pH 7,2 | |
| шаг 1 | добавить 14,196 г двухосновного фосфата натрия безводного (Na2HPO4) в 400 мл дистиллированной воды |
| шаг 2 | добавить 13,8 г моноосновного моногидрата фосфата натрия (2PO4· Н2О) |
| Шаг 3 | перемешивать до тех пор, пока раствор не станет прозрачным |
| Шаг 4 | отрегулировать конечный объем до 500 мл с дистиллированной водой |
| Шаг 5 | отрегулируйте pH до 7,2 |
| Шаг 6 | для 0,1 М ПБ разбавить 1:1 |
Таблица 3: Рецепт фосфатного буфера 0,2 М.
| 3% буфер глутаральдегида 0,2 М какодилата натрия (модифицированный16) | |
| шаг 1 | 0,2 М какодилатного буфера: добавить 4,28 г тригидрата какодилата натрия в 100 мл дистиллированной воды |
| шаг 2 | отрегулируйте pH до 7,2 |
| Шаг 3 | добавить 12 мл 25% глутаральдегида в 25 мл раствора на стадии 2 (0,2 М какодилатного буфера рН 7,2) |
| Шаг 4 | увеличить объем до 100 мл дистиллированной водой |
Таблица 4: 3% глутаровый альдегид 0,2 М натрия какодилат буферный рецепт (модифицированный16).
2. Анализ поверхности органов в фиксированном и неподвижном материале
- Для анализа поверхностных гиф в органах, особенно подземных, и тех, которые контактируют с опавшими листьями, наблюдают неподвижный или свежий материал в рассекающем микроскопе (стереомикроскопе) с увеличением 7,5х и выше, в зависимости от анализируемых образцов.
- Визуализируйте образцы, погруженные в фиксатор, 70% этанол (если он хранится в нем) или водопроводную воду в случае свежего материала. Предотвратите попадание прямого света от рассекающего микроскопа, так как он может высушить и повредить образцы.
- Поиск областей интереса в образцах, руководствуясь поверхностными гифами и ризоморфами. Выберите образцы, которые содержат области с поверхностными ризоморфами, поскольку они могут быть разделены для визуализации пелотонов и гифовых катушек в корковых клетках в корнях и стеблях.
- После выбора выполните шаги 1.6 и 1.9, если образцы еще не зафиксированы. При желании сфотографируйте свежие образцы с помощью светового микроскопа без фиксации, как описано в разделе 3.
- Используйте камеру, соединенную со стереомикроскопом, для сбора изображений с поверхностей органов, ризоморфов и других наблюдаемых структур. В таких случаях организуйте адекватный цвет фона, чтобы хорошо контрастировать с материалом, и, если возможно, выберите фоновый материал с менее шероховатой поверхностью (например, бумагу).
3. Свободные от руки участки органов растений
ПРИМЕЧАНИЕ: Свободные участки органов растений могут быть сложными, особенно для небольших и тонких структур. Однако эти участки тканей с грибковыми эндофитами могут в некоторых случаях лучше проявлять гифы и другие признаки по сравнению с тонкими срезами.
- Разделите свежие или фиксированные образцы острым лезвием, разрезайте их как можно тоньше и поместите сразу в небольшую чашку Петри с водой (если она пресная) или 70% этанолом (если фиксированная). Используйте небольшую кисть, чтобы манипулировать секциями, не повреждая их.
- Чтобы облегчить секционирование более сложных материалов (т.е. маленьких, тонких, гибких органов), окружите образец структурой, например, полистиролом или черешком Цекропии . Вырежьте опору для размещения образца и сделайте тонкий участок образца и опору в целом.
- Окрашивайте и монтируйте образцы, как описано в разделе 6.
4. Встраивание образцов растений в смолу и расщепление
- Далее обезвоживают образцы, хранящиеся в 70% этаноле в 80%, 96% и 2x в 100% этаноле, в течение 30 мин до 2 ч в зависимости от размера и состава образцов.
- Используйте набор смолы гликоля метакрилата (GMA) в соответствии с инструкциями производителя. Проверьте Gerrits and Horobin (1996)18 для дальнейших соображений. Следуйте инструкциям по проникновению и внедрению соответственно.
ВНИМАНИЕ: Смола GMA токсична, она может вызвать аллергическую реакцию и раздражение кожи, глаз и слизистой оболочки. Используйте реагенты в вытяжном капюшоне и используйте перчатки. - Используйте полиэтиленовые формовочные лотки для встраивания, выбранные по размеру образцов (например, 13 мм x 19 мм x 5 мм для более крупных образцов, 6 мм x 8 мм x 5 мм для более мелких). Обратите внимание на желаемую ориентацию образца внутри формы и используйте иглу, чтобы помочь сориентироваться.
- Оставить для полимеризации, желательно при комнатной температуре, до полного затвердевания. Процесс затвердевания обычно занимает несколько часов, хотя рекомендуется отформовывать блоки на следующий день. После полимеризации тщательно отсоедините смоляные блоки от форм и приступайте к прикреплению блоков как можно скорее, чтобы избежать искривления блоков.
- Шлифуйте поверхность смоляного блока, который будет прикреплен, создавая ровную поверхность. Приклейте смоляной блок к деревянному кубоиду (рекомендуется 2 см х 2 см х 3 см) жидким цианоакрилатным клеем средней вязкости (см. Таблицу материалов). Убедитесь, что смола полностью прикреплена, чтобы избежать компрометации секционирования.
- Выполните секционирование в ротационном микротоме, как описано ниже.
ВНИМАНИЕ: Лезвия микротомных ножей очень острые и могут привести к несчастным случаям. Обязательно обращайтесь с ними, соблюдая все меры безопасности. Перед приближением к ножу (например, чтобы поменять блок, смочить смолу), зафиксируйте грубый маховик и наденьте защитную крышку лезвия. Храните одноразовые лезвия в соответствующих случаях. Будьте предельно осторожны при замене лезвий.
ПРИМЕЧАНИЕ: Различные типы ножей (например, одноразовые или фиксированные; стеклянные или стальные) могут быть использованы для секционирования смолыGMA 18. Качество секций зависит от того, насколько острым является нож. Убедитесь, что нож хорошо прикреплен и не может двигаться. Одноразовые ножи, возможно, потребуется регулярно менять для достижения лучшего сечения.- Плотно прикрепите деревянный кубоид к держателю блока. Отрегулируйте ориентацию сечения с помощью направляющих винтов и обеспечьте адекватный угол наклона ножа с помощью наклона ножа. Выберите толщину секций; использовать более толстую настройку для обрезки и более тонкую настройку для выбранных секций, так как секции GMA более уместно прилипают к стеклянному слайду, когда они тоньше; рекомендуемая толщина для растительных тканей составляет 5-8 мкм.
- Перед началом работы охладите помещение, если это необходимо, так как более высокие температуры ухудшают качество секций. Подготовьте к разделению следующее: стакан с дистиллированной водой, конфорку, кисти (не менее двух), пинцет тонкой точки, пипетку Пастера, стеклянные слайды, фильтровальную бумагу (или папиросную бумагу) и карандаш (для идентификации рассекаемых образцов).
- Отрегулируйте конфорку до 50 °C и поместите на нее стакан. Обратите внимание на различия в нагреве в зависимости от площади конфорки (обычно средняя область нагревается больше, чем края; нагревайте воду посередине, предпочтительно).
- Выберите стеклянную горку, определите ее карандашом и нанесите теплую дистиллированную воду по всей поверхности слайда. При необходимости используйте раствор (например, моющее средство и воду или 70% этанол), чтобы разрушить напряжение между водой и стеклом, чтобы весь слайд был одинаково покрыт. Некоторые типы слайдов должны быть предварительно очищены 70% этанолом для получения адекватного соответствия сечению.
- Начните с постепенного продвижения лицевой стороны смоляного блока к лезвию ножа. Не пытайтесь секционировать, не продвигая сначала блок, иначе оборудование и блок могут быть повреждены. При необходимости обрезают блок, используя более высокую толщину (10 мкм и выше).
- При приближении к подходящему участку сделайте твердое одностороннее движение маховиком, чтобы секция была выполнена сразу. Следите за влажностью смолы. Во время секционирования регулярно увлажняйте лицо разрезаемого блока с помощью кисти, смоченной в дистиллированной воде, если есть проблема с закручиванием секций. Удалите лишнюю воду папиросной бумагой.
- Парой тонкоточечных пинцетов поместите полученный участок в воду над горкой. При контакте с водой смола GMA растягивается. При необходимости используйте кисть, чтобы аккуратно развернуть и растянуть участки. Используйте другую кисть, чтобы постоянно держать лезвие свободным от остатков смолы. Не переключайтесь между кистями, чтобы избежать смачивания лезвия.
- Выстроив в очередь все нужные участки в горке, высушите нижнюю поверхность горки и поместите ее над конфоркой. Удалите лишнюю воду с верхней части слайда, аккуратно смазав фильтровальной бумагой (необязательно). Секции будут прилипать, когда вода испаряется с горки. Не оставляйте слайды слишком длинными, чтобы предотвратить повреждение секций чрезмерным нагревом.
- Храните слайды в коробке для слайдов, вдали от пыли и солнца, и используйте их для окрашивания и других процедур. Слайды могут храниться в течение нескольких лет.
5. Замораживание образцов растений и секционирование с помощью криостата
ПРИМЕЧАНИЕ: Основным соображением при криосечении биологической ткани является уменьшение повреждений из-за образования кристаллов льда при замораживании образцов. Криопротекция обычно осуществляется путем введения химически инертных растворов, таких как глицерин или сахароза19,20.
- За день до секционирования образца выполните следующие действия.
- Развести 100 мл 0,2 М ПБ (таблица 3) в 100 мл дистиллированной воды для получения 200 мл 0,1 М ПБ. Готовят 10%, 20% и 30% растворы сахарозы в 0,1 М ПБ (например, для 10% раствора добавляют 2 г сахарозы в 20 мл буфера).
- Для свежих образцов промыть их в 0,1 М ПБ в течение 30 мин. Для образцов в фиксаторе промывайте их в том же буфере, который использовался для приготовления фиксатора в течение 30 мин. Для образцов в 70% этаноле гидратируют их в 50% и 30% этаноле и промывают по 0,1 М ПБ в течение 1 ч в каждом растворе.
- Инкубируют образцы в течение 2 ч в 10% сахарозы, 2 ч в 20% сахарозы и 2 ч в 30% сахарозы при комнатной температуре. После этого инкубируют в течение ночи в 30% сахарозы при 4 °C (или, по крайней мере, в течение 3 ч; максимальное время составляет 48 ч).
- В день секционирования готовят 40% и 50% сахарозы в 0,1 М ПБ; не готовьте растворы сахарозы более чем за 12 ч. Инкубировать в течение 2 ч в каждой концентрации сахарозы при 4 °C.
- Для встраивания, в небольшие формы, сделайте слой OCT компаунда (оптимальная температура резки среды, используемой для встраивания и замораживания образцов) и держите его при -20 °C для замораживания. Формы могут быть обычными гистологическими формами, хотя для облегчения расплавления блоков, бумажные или фольговые могут быть изготовлены с использованием небольшого кубоида в качестве рамы и клейкой ленты.
- После того, как нижний слой соединения OCT заморожен в формах, работайте внутри криостатной камеры (около -27 °C). Поместите образцы, инкубированные в 50% сахарозе, в формы, в той ориентации, в которой они будут секционированы. Верхняя грань кубоидного блока обычно является лучшей гранью секционирования. Отметьте в пресс-форме, где размещены образцы, чтобы блок можно было легко обрезать, а правильную ориентацию сохранить.
- Окружите образцы соединением OCT и лопните любой пузырь воздуха, коснущийся образцов. Заморозьте их при -20 °C. Когда блоки полностью замерзнут, поместите их в криостатную камеру (около -27 °C). Раздавливайте каждый из них только перед использованием и обратите внимание на отметки, которые указывают на местоположение образца внутри блока.
- Поскольку состав OCT легко разрезается лезвием, соответствующим образом обрежьте блоки, прежде чем размещать их на патронах. Поместите некоторое соединение OCT в криостатный патрон и расположите блок так, чтобы верхняя поверхность была разделена. Грани с меньшими площадями обеспечивают лучшие секции. Подождите, пока блок хорошо прикрепится к патрону, и проверьте его, прежде чем приступать к секционированию.
- Плотно поместите патрон в держатель патрона. Отрегулируйте ориентацию секционирования с помощью винтов ориентации. Отрегулируйте угол наклона ножа с помощью наклона ножа. Выберите толщину секций. Образцы могут быть разделены толще, чем обычные смоляные срезы. Успешно получены участки в диапазоне 5-20 мкм, причем более толстые участки легче сделать (меньше скручивания и меньше повреждений конструкций).
- Продвиньте лицевую сторону замороженного блока к лезвию ножа. Не пытайтесь разделить без этого, иначе блок может быть отделен от патрона и поврежден. При необходимости обрезают блок, используя более высокую толщину (10 мкм и выше).
- При приближении к подходящему участку поместите противовалочную пластину (т.е. прозрачную пластину, которая будет удерживать секцию) над ножом и сделайте твердое одностороннее движение маховиком, чтобы секция была сделана сразу. Проблемы с закручиванием могут быть вызваны, если пластина поперечной устойчивости должна быть отрегулирована (она обычно регулируется по отношению к лезвию) или если в лезвии есть мусор. Постоянно чистите лезвие кистью, чтобы удалить мусор.
- Используйте специальные слайды, чтобы секции легко прикреплялись, например, силанизированные слайды (коммерческие или приготовленные с 2% аминоалкилсиланом в ацетоне21) или слайды, приготовленные с 500 мкг / мл поли-L-лизина в дистиллированной воде21 или 0,2% желатина (см. детали21). Поддерживайте горки при комнатной температуре.
- Чтобы приклеить секцию к слайду, поднимите стабилизатор поперечной устойчивости и быстро сделайте так, чтобы слайд коснулся секции. Поскольку горка находится при комнатной температуре, секция сразу же плавится и прилипает к горке. Обратите внимание на поворот обработанной грани слайда к секции, которая может оставаться над ножом или на внутренней поверхности стабилизатора поперечной пластины. Чтобы избежать скручивания секций, выполните этот шаг быстро, как только пластина будет поднята, и будьте осторожны, чтобы не искривить секцию.
- Оставьте слайд за пределами криостатной камеры (при комнатной температуре), если в нее будут добавлены новые секции. Приклеив все нужные участки к слайду, держите его внутри криостатной камеры или в морозильной камере (-20 °C или ниже). Не подвергайте слайды воздействию влаги. Храните их в поле для слайдов и не забудьте идентифицировать слайды карандашом.
ПРИМЕЧАНИЕ: Слайды и блоки OCT могут храниться при -20 °C, хотя и не слишком долго. Для достижения лучших результатов используйте слайды и блоки в течение нескольких дней.
6. Окрашивание срезов растений и эндофитов для световой микроскопии
ПРИМЕЧАНИЕ: Многие типы пятен могут быть использованы для секций растений. Дифференциально окрашивать эндофитные грибы и растительные ткани сложно. Хотя это и не процедура окрашивания, способ маркировки структур грибов представлен в разделе 7 (флуоресценция с конъюгатом агглютинина зародышей пшеницы). Секции от руки (объясненные в разделе 3), смоляные секции (раздел 4) и криосекции (раздел 5) могут быть окрашены, хотя фенольные и спиртовые пятна являются сложными для этих образцов, поскольку смола GMA и OCT теряют приверженность к слайду в этих случаях.
- Используйте один или комбинируйте следующие обычные методы окрашивания образцов растений.
- Толуидин синий O 22,23, широко применяемый метод для общего окрашивания срезов растений. Готовят раствор 0,05% толуидина синего О в 0,1 М фосфата (рН 6,8) или 0,09 М цитратного буфера (рН 4,5-4,8) в зависимости от вида и типов тканей. Инкубируйте смоляные срезы GMA в течение 2-10 минут, используя баллончик для окрашивания слайдов или поместив несколько капель над секциями, если окрашено несколько слайдов. Тщательно вымойте дистиллированной водой или буфером после инкубации и установите горки водой или высушите их на конфорке для получения постоянных горок, как описано в шаге 6.3.
- Реагент Люголя2 указывает на наличие крахмала. Готовят 5% раствор йода (I2) и 10% йодида калия (KI) в дистиллированной воде. Окрашивают срезы в течение 2 мин, добавляя несколько капель над горкой, а затем промывайте дистиллированной водой. Этот гистохимический тест обычно применяется к временным слайдам.
- Судан III, IV и черное окрашивание B24,25 для разных липидов. Приготовьте раствор 0,3% Судана (III, IV или черный B) в 70% этаноле, прогрейте до кипения и дайте остыть. Используйте надодержание, процедите его и высиживайте срезы в течение 15-30 мин в закрытой чашке Петри. Тщательно вымойте секции 70% этанолом и дистиллированной водой. Монтируйте горки водой (обычно применяется только к временным слайдам).
ПРИМЕЧАНИЕ: Поскольку Судан является красителем на спиртовой основе, он больше подходит для секций от руки. Проводите окрашивание смоляных секций GMA осторожно, так как они обычно отделяются от слайда.
- Для временных слайдов установите секции в воде или глицерине и наблюдайте за ними впоследствии. Запечатайте крышку лаком для ногтей, чтобы сохранить их немного дольше.
- Для постоянных слайдов монтируйте секции синтетическими смолами (например, средой быстрого монтажа, см. Таблицу материалов). Капните несколько капель монтажной среды (она может переполнить крышку), осторожно положите крышку, чтобы избежать пузырьков, и используйте колышки для одежды, чтобы прижать слайд к крышке до полного высыхания. Удалите излишки высушенной монтажной среды лезвием бритвы.
7. Применение фторхрома, конъюгированного с агглютинином зародышей пшеницы в флуоресценции и конфокальной микроскопии
ПРИМЕЧАНИЕ: Этот метод может быть применен к секциям от руки (объяснено в разделе 3), смоляным секциям (раздел 4) и криосекциям (раздел 5). Криосекций может быть достаточно для целей конфокальной микроскопии, так как более толстые образцы могут быть предоставлены по сравнению с секциями смолы, но не такими толстыми, как от руки. Флуорохром, конъюгированный с агглютинином зародышей пшеницы (WGA, см. Таблицу материалов), применяется для визуализации грибов в флуоресцентной микроскопии26. Конфокальный микроскоп не является необходимым, хотя он может обеспечить четкие трехмерные изображения растительных структур27.
- Готовят раствор 0,2 мг/мл WGA-фторхромового конъюгата в 0,1 М ПБ28 (рН 7,2, проверьте шаг 5.1.1 и таблицу 3). Готовят раствор 1% кальцифтор белого цвета в 0,1 М ПБ (рН 7,2). Приготовьте небольшое количество этих растворов, так как срезы непосредственно инкубируются с ними.
- Инкубируют секции в стеклянных слайдах в течение 30 мин в WGA-фторхромовом сопряженном растворе29, используя достаточный объем для покрытия секций, затем промыть в 0,1 М ПБ.
- Инкубируют срезы в растворе калькофтора, используя достаточный объем в качестве монтажной среды. Раствор может поддерживаться в течение периода наблюдения.
- Поместите обшивки на слайды и наблюдайте в конфокальном микроскопе или флуоресцентном световом микроскопе с помощью следующих фильтров: TC/GFP (возбуждение: 470-440, излучение: 525-550, для WGA-флуорохрома в Таблице материалов - грибковая клеточная стенка флуоресцирует зеленым под этим фильтром29) и DAPI (возбуждение: 358, излучение: 463, для Calcofluor White)30.
ПРИМЕЧАНИЕ: Трехмерные изображения могут быть получены с помощью функции Z-серии в конфокальном микроскопе27.
8. Сканирующая электронная микроскопия органов растений
- После фиксации образцов, выполнения обезвоживания и хранения в 70% этанола (раздел 1) одна из возможностей состоит в том, чтобы разрезать образцы для обнажения любой желаемой поверхности для анализа SEM, если это необходимо (например, внутренние ткани, структура яичников). Используйте острое и новое лезвие бритвы и делайте надрезы односторонним движением, избегая поврежденного появления этих участков в SEM. При необходимости используйте стереомикроскоп для выбора образцов и рассмотрите область металлических заглушек для определения размеров образца.
- Дальнейшее обезвоживание образцов для SEM в этаноловой серии: 80%, 96% и 2x в абсолютном этиловом спирте (≥99,8%). Поддерживайте мелкие и деликатные образцы в течение 30 минут в каждой концентрации и более крупные и плотные образцы в течение 1 ч.
- Складывайте небольшие конверты, используя папиросную бумагу, чтобы организовать образцы для следующих шагов, более крупные образцы можно обрабатывать без конверта. Определите конверты карандашом, написав письмо или цифру, и ведите журнал всех образцов в каждом из них. Храните образцы в абсолютном этаноле, хотя и недолго, и как можно скорее переходите к этапу 8.4.
- Приступайте к сушке в критических точках (CP). Эксплуатация сушилки CP в соответствии со стандартными рабочими процедурами. Поместите образцы в абсолютный этанол (промежуточную жидкость) в барокамеру. В критической точке CO2 (31 °C, 7,3 x 106 Па) промежуточная жидкость растворяется в переходной жидкости (жидкий углекислый газ), и образцы сушат31.
- После сушки CP храните образцы как можно скорее в контейнере для высыхания, например, в герметичной колбе, содержащей силикагель. Атмосферная влажность может разрушить образцы при реабсорбции31.
- Используйте металлические заглушки для монтажа образцов. Перед установкой наденьте перчатки, чтобы манипулировать заглушками, погрузите их в ацетон на 5 минут, чтобы удалить жир, и дайте им высохнуть. Используйте проводящую двухстороннюю углеродную клейкую ленту для фиксации образцов на заглушке и стереомикроскоп, чтобы помочь позиционировать образцы, имея в виду, что вид сверху является единственно возможной перспективой на изображениях SEM.
- Манипулируйте образцами с помощью тонкоточечного пинцета, соблюдая осторожность, так как часть образца, к которой прикасается пинцет, обычно повреждается, поэтому попробуйте коснуться частей, расположенных вдали от интересующих областей (например, областей, контактирующих с лентой). Храните заглушки с образцами в герметичной чашке Петри с силикагелем. Как можно скорее перейдите к шагу 8.8.
- Используйте напыляющий коатер для нанесения слоя металла, обычно золота или платины, на поверхность образцов в атмосфере низкого давления инертного газа, часто аргона31. Следуйте стандартным рабочим процедурам при использовании напыляющего коатера. Толщина покрытия зависит от топографии образцов, обычно между 15-40 нм32.
- Поддерживайте покрытые оболочкой заглушки в герметичной чашке Петри с силикагелем, и при условии, что силикагель сохраняет влажность, образцы могут храниться таким образом в течение нескольких недель. Используйте сканирующий электронный микроскоп для анализа образцов. Образцы в вакууме поражены пучком электронов, а испускание сигналов от такого взаимодействия интерпретируется как изображения31. Для получения подробной информации о работе сканирующего электронного микроскопа прочитайте Jeffree and Read (1991)31 и Bozzola and Russell (1999)32.
- Чтобы повторно использовать заглушки, потяните клейкую ленту и протрите их проволочной ватой. Промыть в водопроводной воде, погрузить в абсолютный этанол и адекватно высушить их, предотвращая окисление составляющего металла.
9. Просвечивающая электронная микроскопия
- Префиксные образцы с буфером глутаральдегид-какодилата, как описано на этапах 1.7 и 1.10. Через 12-24 ч префиксации промыть образцы 3 раза в 0,2 М какодилатного буфера (рН 7,25) в течение 10 мин. Проводят постфиксацию 1% тетроксидом осмия (OsO4) в 0,2 М какодилатного буфера, в течение 12 ч в темноте, при комнатной температуре. Промыть 3x дистиллированной водой в течение 5 мин.
ВНИМАНИЕ: Какодилат и тетроксид осмия очень токсичны и не должны вдыхаться. Используйте их в вытяжных шкафах, следуя соответствующим паспортам безопасности. - Обезвоживать образцы с 30%, 50%, 70% и 96% этанолом, по 2 раза в каждой концентрации, в течение 10 мин. Затем обезвоживать 3 раза в абсолютном спирте, в течение 15 мин каждый раз.
- Инфильтрируют образцы гидрофильными акриловыми смолами (см. Таблицу материалов), один раз смолой 1:1 + абсолютным этанолом и 3 раза чистой смолой в течение 8-12 ч каждая. Проводят полимеризацию в желатиновых капсулах при 60 °С до полного затвердевания (максимум 12 ч17).
- Внимательно оценить ориентацию образцов внутри смоляного блока; вырежьте верхнюю часть блока лезвием бритвы, сделав пирамидальную форму, которая концентрирует образец в области секционирования. Получают полутонкие срезы (250-500 нм)33 в ультрамикротоме алмазным ножом и помещают на стеклянные горки в несколько капель воды.
- Держите слайды на конфорке при температуре 60 °C. Окрасьте участки толуидиновым синим O, как на этапе 6.1.1, и дайте пятну полностью высохнуть. Тщательно вымойте водопроводной водой. Оцените полученный раздел, нарисовав четыре квадранта и выбрав наиболее подходящий квадрант для анализа.
- Обрежьте блок так, чтобы пирамидальная форма концентрировала выбранный квадрант на верхней грани блока. Производят ультратонкие сечения (50-100 нм)33,34. Толщина оценивается в соответствии с интерференционным цветом секций: участки с примерно 70 нм кажутся серебристо-золотыми, с примерно 100 нм - золотыми, а с примерно 200 нм - синими34.
- Соберите ультратонкие срезы из воды с помощью медных решеток и приступайте к методу контрастного окрашивания уранилацетатом и цитратом свинца, как описано ниже.
- Приготовьте раствор цитрата свинца (таблица 5) и заморозьте конечный раствор в микроцентрифужных пробирках по 1 мл раствора в каждой, только оттаивая непосредственно перед использованием.
- Приготовьте раствор уранилацетата: растворите 0,625 г уранилацетата [UO2(CH3COO)2] в 25 мл недавно кипяченой и охлажденной дистиллированной воды. Хранить в темной колбе в морозильной камере.
ВНИМАНИЕ: Нитрат свинца токсичен при попадании в организм. 1 N NaOH обладает высокой коррозионной активностью. Уранилацетат радиоактивен и токсичен. Он не должен проглатываться, вдыхаться или вступать в контакт с кожей. - При окрашивании поместите оба подготовленных реагента в отдельные шприцы по 3 мл с фильтрующими блоками (пора 0,22 мкм, см. Таблицу материалов). Приготовьте чашку Петри, перевернутую вверх дном с герметизирующей термопластичной пленкой над ней (см. Таблицу материалов) и внутри более широкой чашки, с гранулами NaOH по краям в качестве ловушки для CO232 (см. Рисунок 2).
- Отбросьте первую каплю, а поверх пленки поместите каплю уранилацетата и три капли дистиллированной воды на каждую окрашенную сетку. Проделайте то же самое с цитратом свинца и добавьте еще три капли дистиллированной воды.
- Инкубировать сетку (непрозрачной стороной вниз, где находятся срезы) в ураниле в течение 30 мин (переменное время). Вымойте 3x в дистиллированной воде каплями, каждый раз аккуратно высушивая сетку фильтровальной бумагой на блестящей стороне. Повторите с каплей цитрата свинца (30 мин) и промойте его.
- По прошествии не менее 4 ч проанализируйте сетки в просвечивающем электронном микроскопе. В этом микроскопе пучок электронов проходит через участки в вакууме , и изображение проецируется на флуоресцентный экран. Для получения подробной информации об эксплуатации просвечивающего электронного микроскопа прочитайте Bozzola and Russell (1999)32.
| раствор цитрата свинца (для контрастного окрашивания ТЕА) | |
| шаг 1 | окружить стакан фольгой |
| шаг 2 | растворить 0,266 г нитрата свинца [Pb(NO3)2] в 6 мл недавно кипяченой и охлажденной дистиллированной воды |
| Шаг 3 | перемешивать в течение 2 мин |
| Шаг 4 | добавить 0,352 г цитрата тринатрия [Na3(C6H5O7).2H2O] (раствор должен приобрести молочный вид) |
| Шаг 5 | перемешивать в течение 15 мин, заклеить стакан фольгой и переложить раствор на стакан емкостью 10 мл |
| Шаг 6 | добавить 1,6 мл 1N NaOH и 2,4 мл дистиллированной воды (раствор должен быть полупрозрачным) |
| шаг 7 | при необходимости отрегулируйте рН вблизи 12 |
Таблица 5: Рецепт раствора цитрата свинца.

Рисунок 2: Схема контрастного окрашивания растворами цитрата свинца и уранилацетата. (А) Приготовьте чашку Петри, перевернутую вверх дном (в центре) термопластичной пленкой, чтобы капли можно было поместить над ней, внутри более широкой. Гранулы NaOH - это места вокруг центрального блюда. (B) Капли уранилацетата помещают по кругам с буквой U, а капли цитрата свинца в кругах с пометкой L. DW указывает на капли дистиллированной воды. Сетки окрашиваются последовательно в колонне, поэтому пять сеток могут быть окрашены одновременно, как показано. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
10. Симбиотическое прорастание семян орхидеи
- Убедитесь, что растворы и все материалы, используемые в симбиотическом прорастании семян, стерильны, чтобы избежать загрязнения. Начните с автоклавирования их в течение 20 мин при 121 °C. Этапы симбиотического прорастания обобщены на рисунке 3.
- Поверхностно дезинфицировать плоды и семена, погружая их в раствор гипохлорита натрия, содержащий 2% активный хлор, на 10-15 мин для плодов и 7-10 мин для семян, учитывая жесткость и толщину семенной оболочки9. Тонкие и хрупкие семена можно погружать в разбавленный раствор гипохлорита натрия 1:1. После этого промыть 3 раза в автоклавной дистиллированной воде, чтобы удалить раствор гипохлорита.
- Рекуперируйте семена путем фильтрации в сериграфической ткани и используйте семена для продолжения испытаний на прорастание (предпочтительно). При необходимости храните их в конвертах из фильтровальной бумаги внутри стеклянных колб с силикагелем, при 4 °C, герметично закрывайте колбы и запечатывайте их пищевой пленкой. Переложите несколько капель воды с последней промывки на картофельный агар декстрозы (КПК, 39 г/л), чтобы оценить эффективность процесса промывки.
- Перед посевом семян в культуральную среду оцените их жизнеспособность с помощью теста тетразолия (необязательно), как описано ниже35.
- Инкубировать приблизительно 10 мг семян в микроцентрифужной трубке с 1 мл 10% сахарозы в дистиллированной воде в течение 24 ч при комнатной температуре (около 25 °C) при свете.
- Раствор сахарозы удалить микропипеткой и добавить 1 мл 1% раствора тетразолия (трифенилтетразолия хлорида) в дистиллированную воду. Инкубировать при 40 °C в термоблоке в течение 24 ч в темноте.
- Раствор тетразолия удалить микропипеткой и промыть семена дистиллированной водой в 2 раза или до удаления раствора. Удалите все жидкости. При необходимости семена можно хранить в морозильной камере до недели (как на этапе 10.3) перед анализом.
- Повторно суспендируйте семена в дистиллированной воде и проанализируйте их под легким микроскопом. Жизнеспособные семена приобретают светло-темно-красный цвет, в то время как нежизнеспособные семена сохраняют свой естественный цвет.
- Выполните следующий адаптированный протокол9 для симбиотического прорастания семян орхидеи.
- Инкубировать семена на автоклавных дисках из фильтровальной бумаги (диаметром 1-2 см), помещенных в чашки Петри со средой для культивирования овсяного агара (ОМА) (2,5 г/л овсяных хлопьев и 7 г/л агара, рН 6).
- В центре чашки Петри привить фрагмент питательной среды (около 1см2), содержащий мицелий из выбранного изолированного гриба для процедуры прорастания. Запечатайте чашки Петри пищевой пленкой и высиживайте их в темноте при температуре около 25 °C или комнатной температуре, так как она более адекватна для роста грибков.
- Приготовьте некоторые блюда с семенами и без грибковой прививки, в качестве отрицательного контроля для теста на прорастание.
- Еженедельно анализируйте результаты всхожести, собирая количественные и качественные данные и фотографируя протокормы и рассаду. Наблюдение за семенами и протокормами следует проводить с помощью стереомикроскопа для более точной оценки прорастания. Используйте источник света, идущий снизу, так как он обеспечивает большую контрастность, что позволяет легче отличить грибковый мицелий от протокормов.
- Соберите образцы на разных стадиях развития и зафиксируйте для анатомических анализов (раздел 1). Применять все ранее описанные анализы изображений для исследования грибковых эндофитов в семенах, протокормах и саженцах во время прорастания (световая микроскопия - разделы 4, 5 и 6; конфокальная и флуоресцентная - секция 7; СЭМ и ТЕА - разделы 8 и 9).
- Генерация количественных результатов по классификации стадий согласно таблице 6. Стадии описывают обычное развитие семян микогетеротрофных орхидей. Сбор данных еженедельно и таблица с начальными датами каждого наблюдаемого этапа.
- Кроме того, соберите количественные данные, оценивающие процент и скорость всхожести. Подсчитайте не менее 100 семян или определите количество полей35. Разграничьте три или более счетных поля на чашку Петри, состоящих из фиксированных областей со стандартизированной площадью, и оценивайте еженедельно. Рассчитайте собранные данные по уравнению индекса роста (GI):

где N0 - число подсчитанных семян на стадии 0, N1 относится к стадии 1 и следует до стадии 6 (зарегистрированной как N6)36.
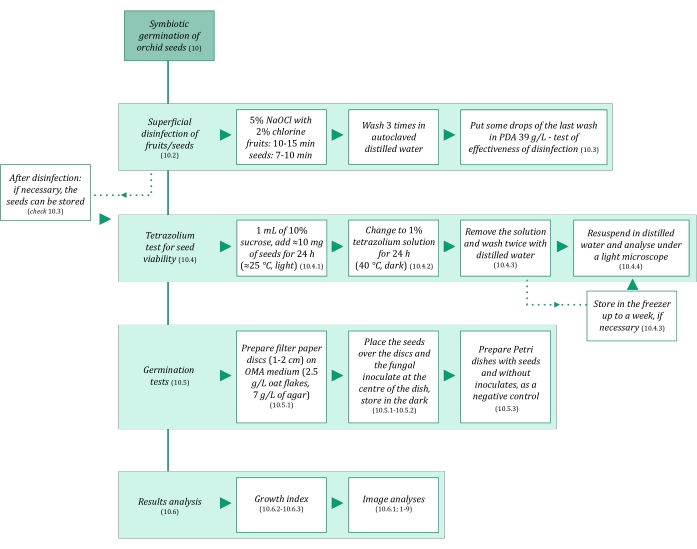
Рисунок 3: Схематическое обобщение методологии симбиотического прорастания семян. Схемы содержат указания на подробные шаги в протоколе. Сокращения: OMA = овсяный агар, PDA = картофельный агар декстрозы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Стадия прорастания | Приметы:__________ |
| 0 | Отсутствие прорастания |
| 1 | Отек эмбриона |
| 2 | Разрыв теста |
| 3 | Развиваются впитывающие волоски |
| 4 | Развивается стеблевая проекция |
| 5 | Защитные чешуйки (прицветники) развиваются |
| 6 | Первые корни развиваются |
Таблица 6: Описание стадий развития протокормы, применяемых к периодическому анализу тестов на прорастание. Модифицировано из стадий, описанных в Otero et al.36.
Результаты
После существенных этапов фиксации растительной ткани получаются клеточные структуры, максимально сходные с живым состоянием, учитывая морфологию, объем и пространственную организацию клеточных компонентов и тканей16. Наблюдать такие признаки в образцах после химическо...
Обсуждение
Анализ изображений в анатомии и морфологии растений имеет важный потенциал для достижения целей и помогает понять взаимосвязи между микогетеротрофными растениями и их незаменимыми грибковыми эндофитами, о чем свидетельствуют исследования подземных органов 6,40
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы благодарят финансирование от FAEPEX и FAPESP (2015/26479-6). MPP благодарит Кейпса за стипендию магистратуры (процесс 88887.600591/2021-00), а CNPq. JLSM благодарит CNPq за гранты на производительность (303664/2020-7). Авторы также благодарят доступ к оборудованию и помощь, предоставляемые LME (Лаборатория электронной микроскопии - IB / Unicamp), INFABiC (Национальный институт науки и техники по фотонике, применяемой к клеточной биологии - Unicamp) и LaBiVasc (Лаборатория сосудистой биологии - DBEF / IB / Unicamp); LAMEB (UFSC) и Eliana de Medeiros Oliveira (UFSC) за вклад в протокол криозащиты; LME за вклад в протокол ТЕА.
Материалы
| Name | Company | Catalog Number | Comments |
| Acetone | Sigma-Aldrich | 179124 | (for SEM stubs mounting) |
| Agar-agar (AA) | Sigma-Aldrich | A1296 | (for seeds germination tests) |
| Calcofluor White Stain | Sigma-Aldrich | 18909 | fluorescent dye (detects cellulose) |
| Citrate Buffer Solution, 0.09M pH 4.8 | Sigma-Aldrich | C2488 | (for toluidine blue O staining) |
| Conductive Double-Sided Carbon Tape | Fisher Scientific | 50-285-81 | (for SEM) |
| Confocal Microscope | Zeiss | (any model) | |
| Copper Grids | Sigma-Aldrich | G4776 | (for TEM) |
| Critical-point dryer | Balzers | (any model) | |
| Cryostat | Leica Biosystems | (any model) | |
| Dissecting microscope | Leica Biosystems | (= stereomicroscope, any model) | |
| Entellan | Sigma-Aldrich | 107960 | rapid mounting medium for microscopy |
| Ethyl alcohol, pure (≥99.5%) | Sigma-Aldrich | 459836 | (= ethanol, for dehydration processes) |
| Formaldehyde solution, 37% | Sigma-Aldrich | 252549 | (for NBF solution preparation) |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128 | histological tissue fixative |
| Gelatin capsules for TEM | Fisher Scientific | 50-248-71 | (for resin polymerisation in TEM) |
| Gelatin solution, 2% in H2O | Sigma-Aldrich | G1393 | (dilute for slides preparation - OCT adherence) |
| Glutaraldehyde solution, 25% | Sigma-Aldrich | G6257 | (for Karnovsky’s solution preparation) |
| HistoResin | Leica Biosystems | 14702231731 | glycol methacrylate (GMA) embedding kit |
| Iodine | Sigma-Aldrich | 207772 | (for Lugol solution preparation) |
| Lead(II) nitrate | Sigma-Aldrich | 228621 | Pb(NO3)2 (for TEM contrast staining) |
| Light Microscope | Olympus | (any model) | |
| LR White acrylic resin | Sigma-Aldrich | L9774 | hydrophilic acrylic resin for TEM |
| Lugol solution | Sigma-Aldrich | 62650 | (for staining) |
| Metal stubs for specimen mounts | Rave Scientific | (for SEM, different models) | |
| Microtome | Leica Biosystems | manual rotary microtome or other model | |
| Oatmeal agar (OMA) | Millipore | O3506 | (for seeds germination tests) |
| OCT Compound, Tissue-Tek | Sakura Finetek USA | 4583 | embedding medium for frozen tissues |
| Osmium tetroxide | Sigma-Aldrich | 201030 | OsO4 (for TEM postfixation) |
| Parafilm M | Sigma-Aldrich | P7793 | sealing thermoplastic film |
| Paraformaldehyde | Sigma-Aldrich | 158127 | (for Karnovsky’s solution preparation) |
| Poly-L-lysine solution, 0.1% in H2O | Sigma-Aldrich | P8920 | (for slides preparation - OCT adherence) |
| Poly-Prep Slides | Sigma-Aldrich | P0425 | poly-L-lysine coated glass slides |
| Polyethylene Molding Cup Trays | Polysciences | 17177A-3 | (6x8x5 mm, for embbeding samples in GMA resin) |
| Polyethylene Molding Cup Trays | Polysciences | 17177C-3 | (13x19x5 mm, for embbeding samples in GMA resin) |
| Potassium iodide | Sigma-Aldrich | 221945 | (for Lugol solution preparation) |
| Potato Dextrose Agar (PDA) | Millipore | 70139 | (for seeds germination tests) |
| Scanning Electron Microscope | Jeol | (any model) | |
| Silane [(3-Aminopropyl)triethoxysilane] | Sigma-Aldrich | A3648 | (for slides preparation - OCT adherence) |
| Silane-Prep Slides | Sigma-Aldrich | S4651 | glass slides coated with silane |
| Silica gel orange, granular | Supelco | 10087 | (for dessicating processes) |
| Sodium cacodylate trihydrate | Sigma-Aldrich | C0250 | (for glutaraldehyde-sodium cacodylate buffer) |
| Sodium hydroxide | Sigma-Aldrich | S5881 | NaOH (for Karnovsky’s solution preparation and TEM contrast staining) |
| Sodium hypochlorite solution | Sigma-Aldrich | 425044 | NaClO (for seeds surface disinfection) |
| Sodium phosphate dibasic, anhydrous | Sigma-Aldrich | 71640 | Na2HPO4 (for NBF solution and PB preparation) |
| Sodium phosphate monobasic monohydrate | Sigma-Aldrich | S9638 | NaH2PO4·H2O (for NBF and PB) |
| Sputter coater | Balzers | (any model) | |
| Sucrose | Sigma-Aldrich | S0389 | C12H22O11 (for cryoprotection and germination test) |
| Sudan III | Sigma-Aldrich | S4131 | (for staining) |
| Sudan IV | Sigma-Aldrich | 198102 | (for staining) |
| Sudan Black B | Sigma-Aldrich | 199664 | (for staining) |
| Syringe | (3 mL, any brand, for TEM contrast staining) | ||
| Syringe Filter Unit, Millex-GV 0.22 µm | Millipore | SLGV033R | PVDF, 33 mm, gamma sterilized (for TEM contrast staining) |
| Tek Bond Super Glue 793 | Tek Bond Saint-Gobain | 78072720018 | liquid cyanoacrylate adhesive, medium viscosity |
| Toluidine Blue O | Sigma-Aldrich | T3260 | (for staining) |
| Transmission Electron Microscope | Jeol | (any model) | |
| Triphenyltetrazolium chloride | Sigma-Aldrich | T8877 | (for the tetrazolium test in seeds germination) |
| Trisodium citrate dihydrate | Sigma-Aldrich | S1804 | Na3(C6H5O7)·2H2O (for TEM contrast staining) |
| Ultramicrotome | Leica Biosystems | (any model) | |
| Uranyl acetate | Fisher Scientific | 18-607-645 | UO2(CH3COO)2 (for TEM contrast staining) |
| Vacuum pump | (any model) | ||
| Wheat Germ Agglutinin, Alexa Fluor 488 Conjugate | TermoFisher Scientific | W11261 | fluorescent dye-conjugated lectin (detects sialic acid and N-acetylglucosaminyl residues) |
Ссылки
- Evert, R. F. . Esau’s Plant Anatomy: Meristems, Cells, and Tissues of the Plant Body: Their Structure, Function, and Development. , (2006).
- Yeung, E. C. T., Stasolla, C., Sumner, M. J., Huang, B. Q. . Plant Microtechniques and Protocols. , (2015).
- Sokoloff, D. D., Jura-Morawiec, J., Zoric, L., Fay, M. F. Plant anatomy: at the heart of modern botany. Botanical Journal of the Linnean Society. 195 (3), 249-253 (2021).
- Leake, J. R. The biology of myco-heterotrophic (‘saprophytic’) plants. New Phytologist. 127 (2), 171-216 (1994).
- Bidartondo, M. I. The evolutionary ecology of myco-heterotrophy. New Phytologist. 167 (2), 335-352 (2005).
- Imhof, S., Massicotte, H. B., Melville, L. H., Peterson, R. L. Subterranean morphology and mycorrhizal structures. Mycoheterotrophy. , 157-214 (2013).
- Rasmussen, H. N., Rasmussen, F. N. Orchid mycorrhiza: implications of a mycophagous life style. Oikos. 118 (3), 334-345 (2009).
- Rasmussen, H. N., Dixon, K. W., Jersáková, J., Těšitelová, T. Germination and seedling establishment in orchids: a complex of requirements. Annals of Botany. 116 (3), 391-402 (2015).
- Zettler, L. W. Terrestrial orchid conservation by symbiotic seed germination: techniques and perspectives. Selbyana. 18 (2), 188-194 (1997).
- Stewart, S. L., Kane, M. E. Symbiotic seed germination and evidence for in vitro mycobiont specificity in Spiranthes brevilabris (Orchidaceae) and its implications for species-level conservation. In Vitro Cellular & Developmental Biology - Plant. 43 (3), 178-186 (2007).
- Zhao, D. -. K., et al. Orchid reintroduction based on seed germination-promoting mycorrhizal fungi derived from protocorms or seedlings. Frontiers in Plant Science. 12, 701152 (2021).
- Selosse, M. A., Roy, M. Green plants that feed on fungi: facts and questions about mixotrophy. Trends in Plant Science. 14 (2), 64-70 (2009).
- Merckx, V. S. F. T., Mennes, C. B., Peay, K. G., Geml, J. Evolution and diversification. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 215-244 (2013).
- Boon, M. E., Drijver, J. Routine Cytological Staining Techniques: Theoretical Background and Practice. Macmillan International Higher Education. , (1986).
- Karnovsky, M. A formaldehyde-glutaraldehyde fixative of high osmolality for use in electron microscopy. Journal of Cell Biology. 27 (2), 137-138 (1964).
- Hayat, M. . Fixation for Electron Microscopy. , (1981).
- Roland, J. C., Vian, B. General preparation and staining of thin sections. Electron Microscopy of Plant Cells. 1, 675 (1991).
- Gerrits, P. O., Horobin, R. W. Glycol methacrylate embedding for light microscopy: basic principles and trouble-shooting. Journal of Histotechnology. 19 (4), 297-311 (1996).
- Zhang, Z., Niu, L., Chen, X., Xu, X., Ru, Z. Improvement of plant cryosection. Frontiers in Biology. 7 (4), 374-377 (2012).
- BeneŠ, K. On the media improving freeze-sectioning of plant material. Biologia Plantarum. 15 (1), 50-56 (1973).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Preparation of slides and coverslips for microscopy. Cold Spring Harbor Protocols. 2008 (5), (2008).
- Sakai, W. S. Simple method for differential staining of paraffin embedded plant material using toluidine blue O. Stain Technology. 48 (5), 247-249 (1973).
- O’Brien, T., Feder, N., McCully, M. E. Polychromatic staining of plant cell walls by toluidine blue O. Protoplasma. 59 (2), 368-373 (1964).
- Ventrella, M. C., Almeida, A. L., Nery, L. A., Coelho, V. P. d. e. M. Métodos Histoquímicos Aplicados às Sementes. Universidade Federal de Viçosa. , (2013).
- Pearse, A. G. E. . Histochemistry, Theoretical and Applied. , (1960).
- Andrade-Linares, D. R., Franken, P. Fungal endophytes in plant roots: taxonomy, colonization patterns, and functions. Symbiotic Endophytes. , 311-334 (2013).
- Wymer, C. L., Beven, A. F., Boudonck, K., Lloyd, C. W. Confocal microscopy of plant cells. Confocal Microscopy Methods and Protocols. , 103-130 (1999).
- Marques, J. P. R., Soares, M. K. M. Manual de Técnicas Aplicadas à Histopatologia Vegetal. FEALQ. , (2021).
- Navarro, B. L., Marques, J. P. R., Appezzato-da-Glória, B., Spósito, M. B. Histopathology of Phakopsora euvitis on Vitis vinifera. European Journal of Plant Pathology. 154 (4), 1185-1193 (2019).
- Marques, J. P. R., et al. Sugarcane cell wall-associated defense responses to infection by Sporisorium scitamineum. Frontiers in Plant Science. 9, 698 (2018).
- Jeffree, C. E., Read, N. D. Ambient-and low-temperature scanning electron microscopy. Electron Microscopy of Plant Cells. , 313-413 (1991).
- Bozzola, J. J., Russell, L. D. . Electron Microscopy: Principles and Techniques for Biologists. , (1999).
- Murray, S. Basic transmission and scanning electron microscopy. Introduction to electron Microscopy for Biologists. , 3-18 (2008).
- . Glossary of TEM terms Available from: https://www.jeol.co.jp/en/words/emterms/ (2021)
- Seaton, P. T., et al. Orchid seed and pollen: a toolkit for long-term storage, viability assessment and conservation. Orchid Propagation: From Laboratories to Greenhouses—Methods and Protocols. , 71-98 (2018).
- Otero, J. T., Ackerman, J. D., Bayman, P. Differences in mycorrhizal preferences between two tropical orchids. Molecular Ecology. 13 (8), 2393-2404 (2004).
- Koch, R. A., et al. Marasmioid rhizomorphs in bird nests: Species diversity, functional specificity, and new species from the tropics. Mycologia. 112 (6), 1086-1103 (2020).
- Webster, J., Weber, R. . Introduction to Fungi. , (2007).
- Sisti, L. S., et al. The role of non-mycorrhizal fungi in germination of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. Frontiers in Plant Science. 10, 1589 (2019).
- Martos, F., et al. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids. New Phytologist. 184 (3), 668-681 (2009).
- Alves, M. F., et al. Reproductive development and genetic structure of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. BMC Plant Biology. 21 (1), 332 (2021).
- Merckx, V. S. F. T. Mycoheterotrophy: an introduction. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 1-17 (2013).
- Hall, J. L., Hawes, C. . Electron Microscopy of Plant Cells. , (1991).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены