需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
用于解释霉菌异养植物组织中真菌定植和种子共生萌发的显微镜技术
摘要
该协议旨在提供收集,固定和维护霉菌异养植物样品的详细程序,应用不同的显微镜技术,例如扫描和透射电子显微镜,光学,共聚焦和荧光显微镜,以研究植物组织和种子中的真菌定植与菌根真菌发芽。
摘要
结构植物学是充分了解植物生态、生理、发育和进化不可或缺的视角。在研究霉菌异养植物(即从真菌中获取碳的植物)时,它们的结构适应、真菌组织定植模式以及地下器官的形态解剖学的显着方面可以启发它们的发育策略以及它们与营养来源菌丝的关系。共生真菌的另一个重要作用与兰花种子的发芽有关;所有兰科物种在发芽和幼苗阶段(初始分枝异养)都是分枝异养的,即使是在成虫阶段进行光合作用的物种。由于兰花种子缺乏营养储备,真菌共生体对于提供基质和发芽至关重要。从结构角度分析发芽阶段也可以回答有关真菌与种子相互作用的重要问题。正如本文所提出的,可以应用不同的成像技术来揭示植物组织中的真菌内生菌。可以对植物器官的手绘和薄片进行染色,然后使用光学显微镜观察。与小麦胚芽凝集素偶联的荧光染料可以应用于真菌,并与Calcofluor White共同孵育,以在共聚焦显微镜中突出显示植物细胞壁。此外,还详细介绍了分生异养兰花的扫描和透射电子显微镜方法,并探讨了在相关植物中应用此类方案的可能性。协议中详细描述了兰花种子的共生发芽(即,在菌根真菌存在下),以及制备从不同发芽阶段获得的结构以用光学,共聚焦和电子显微镜进行分析的可能性。
引言
植物学的结构研究,涵盖植物形态学和解剖学,是理解整个生物体的基础1,2,并为整合和促进有关植物的生态学,生理学,发育和进化的知识提供了不可或缺的视角3。植物形态学和解剖学方法目前包括最近以及一个多世纪前开发的协议、设备和知识2.经典方法(例如光学显微镜)与最新技术(例如共聚焦显微镜,X射线显微断层扫描)的连续执行和调整具有相同的基本基础:能够开发方法的理论知识。
植物解剖学和形态学的主要工具是图像。尽管误解这种分析是简单的观察,但给主观解释留出了空间2,但分析和理解该领域的图像需要了解应用的方法(设备,分析类型,方法程序),细胞成分,组织化学和植物体(组织组织和功能,个体发生,形态适应)。解释通过各种方法 获得 的图像可以导致关联形式和功能,破译结构的化学成分,证实描述分类群,了解植物病原体感染以及其他此类评估。
在研究霉菌异养(MH)植物(即从菌根真菌4,5中获取碳的非光合植物)时,其结构适应的显着方面,真菌组织定植的模式以及地下器官的形态解剖学可以启发它们的发展战略以及与菌丝的关系,菌丝是营养的来源。MH植物的地下器官通常显示出与其与土壤真菌相关的重要适应性,因此必须进行这些解剖学和形态学研究6。MH物种的气生器官不应被忽视,因为内生菌也可以存在于这些组织中,即使它们不是菌根真菌(个人观察,尚未发表)。
除了菌根真菌在其整个生命周期中与MH物种相关的既定必要性7外,每种兰花物种,甚至是自养兰花物种,在自然环境中都具有初始专性霉菌异养阶段。这是因为兰花的胚胎未分化并且缺乏胚乳或子叶,因此在没有真菌伴侣的营养支持的情况下,它们无法在自然环境中发育和建立自己4,8。考虑到共生发芽方案不仅可以应用于MH物种,还可以应用于光合作用兰花,旨在研究兰花真菌在发芽和原球茎发育中的特异性,这是一种广泛应用的方法保护受威胁物种9,10,11。
在该方法组装中,我们描述了收集,固定和储存MH植物样品以进行解剖学研究(第1节),表面分析和样品选择(第2节),切片方法(徒手:第3节,切片术:第4节,冷冻切片术:第5节),染色和镶嵌(第6节),真菌内生菌的荧光和共聚焦显微镜(第7节),扫描电子显微镜(第8节), 和透射电子显微镜(第9节)。此外,我们描述了兰花种子的共生发芽方法(MH和自养,第10节),因为前面提到的成像方法可以成功地应用于分析种子,原球茎和幼苗在发芽过程中的真菌定植。
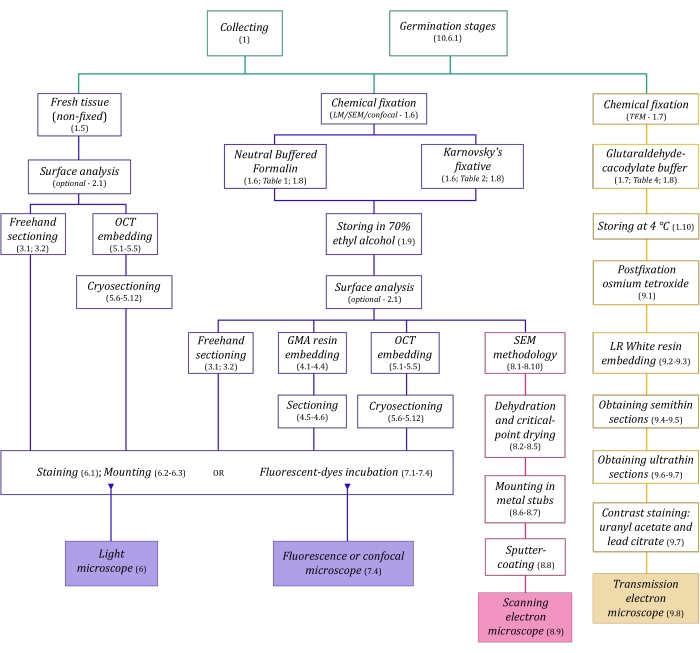
图 1:成像方法的示意图摘要。 原理图提供了详细协议步骤的指示。缩写:GMA = 甲基丙烯酸乙二醇酯,OCT = 最佳切割温度化合物,SEM = 扫描电子显微镜。 请点击此处查看此图的大图。
此处详细描述的显微镜技术(图1)之前有以下基本步骤:收集、固定、脱水、包埋和切片样品。由于步骤因所选技术而异(图 1),因此提前考虑要制备和运输到收集部位的固定剂、固定前必须如何制备样品、要使用的脱水过程(第 1 节)以及不同的包埋可能性和切片方法(第 4、5、5、 和 9)。 图1 依次总结了下面详细描述的每种显微镜技术所需的所有步骤。
研究方案
1. 收集、固定和维护样品
注意:完全MH植物通常可以在黑暗的森林下找到12,13,主要在潮湿和垃圾丰富的地区,而部分MH植物可以在更开阔的森林中找到12,13。MH植物通常具有各种形状和大小的发达地下器官。
- 采集MH物种时,探索植物基部周围的土壤,注意不要损坏地下器官,并避免将植物从地面拉出,以防止将空中器官与地下器官断开。
- 使用园艺抹子小心地挖掘空中结构,同时探索根、茎、根茎和储存器官等地下器官,而不会损坏这些结构。
- 去除土壤颗粒以保护脆弱的结构,并在固定样品之前用自来水仔细清洗这些器官以冲洗掉剩余的土壤颗粒。
- 与落叶相关的MH植物需要格外注意;小心地收集通过菌丝与分解材料相连的器官,避免将这些器官从连接的结构中拉出,并仔细收集它们,因为这些部分非常脆弱。保护具有这种连接的结构,并收集垃圾进行分析。
- 如果选择使用成像技术分析新鲜材料,请将样品保存在密封的塑料袋中,水分充足,水分蒸发并滋润植物,防止过多的水与样品接触。立即将它们运送到实验室,并在收集样品的同一天分析样品,同时在分析时注意样品是否仍然保存。
- 将固定剂装在密封良好的容器中运送到收集地点。收集后,在以下任何固定剂中进行光学显微镜(LM)和扫描电子显微镜(SEM)快速固定样品:10%中性缓冲福尔马林(NBF14,表 1)或Karnovsky溶液(改性15, 表2)。Karnovsky的溶液可以用0.2M磷酸盐缓冲液15制备,其配方如 表3所述。
- 为了通过透射电子显微镜(TEM)进行分析,将厚度为4-3mm的样品切入一滴戊二醛 - 二甲胂酸钠缓冲液(修饰16, 表4)中,分成1-2mm厚的较小部分。丢弃在液滴外切开的边缘。立即将切片转移到固定剂体积大于样品体积10倍的收集管中,因为它是一种添加剂固定剂(即,其分子被化学添加到固定的蛋白质16中)。
注意:所描述的三种固定剂是剧毒的。避免吸入,尤其是在现场使用期间。用手套在通风橱中准备所有固定剂。不要将二甲胂酸盐和酸混合,因为会形成砷气16。 - 如果固定样品漂浮在固定剂中,则表明植物组织中存在气体。空气和其他气体会阻止固定剂渗透整个样品2.通过将气体重新采样成较小的部分并使用真空泵(-300至-400 inHg压力)从组织中除去气体,直到所有样品都沉入溶液底部17。要小心,因为泵施加的过大压力会损坏样品。
- 在Karnovsky溶液或10%NBF中至少48小时后,在0.2M PB(表3)中洗涤样品,并用一系列10%,30%,50%和最后70%乙醇脱水。对于精致的样品,每种浓度脱水30分钟;对于较大的样品,脱水1小时或更长时间。
注意:70%乙醇溶液是储存样品的理想培养基。70%乙醇中的样品可以在室温下储存多年。不要将植物材料长时间存放在固定剂中,因为去除固定剂是固定后必不可少的步骤2. - 在进行后固定(步骤9.1)之前,将样品储存在4°C的戊二醛 - 二甲胂酸酯中。
| 10% 中性缓冲福尔马林 (NBF)14 | |
| 步骤 1 | 在80 mL蒸馏水中加入10 mL 37-40%甲醛溶液 |
| 步骤 2 | 加入0.4克磷酸钠一水合物(NaH2PO4·H2O) 到溶液 |
| 步骤 3 | 加入0.65克磷酸二钠,无水(Na2HPO4) |
| 步骤 4 | 将体积补足至 100 mL |
表1:10%中性缓冲福尔马林配方14。
| 卡尔诺夫斯基的解决方案 (修改15) | |
| 步骤 1 | 在 60-70 °C 的 20 mL 蒸馏水中 |
| 步骤 2 | 加入0.8g多聚甲醛(得到4%w/v),搅拌 |
| 步骤 3 | 加入1-4滴40%NaOH并搅拌直至溶液变澄清 |
| 步骤 4 | 冷却并加入 30 mL pH 7.2 的 0.2 M 磷酸盐缓冲液(表 3) |
| 步骤 5 | 在 0.1 M PB (pH 7.2) 中稀释 25% 戊二醛,得到 1% 戊二醛(最终体积:~60 mL) |
| 步骤 6 | 向步骤4中获得的溶液中加入1%戊二醛(步骤5),直到补充至100 mL固定剂 |
表2:卡尔诺夫斯基溶液配方 (修改15)。
| 0.2 M 磷酸盐缓冲液 (PB) pH 7.2 | |
| 步骤 1 | 将 14.196 g 无水磷酸二钠 (Na2HPO4) 加入 400 mL 蒸馏水中 |
| 步骤 2 | 加入磷酸钠一水合物13.8克(NaH2PO4·H2O) |
| 步骤 3 | 搅拌直至溶液澄清 |
| 步骤 4 | 用蒸馏水将最终体积调节至 500 mL |
| 步骤 5 | 调节pH值至7.2 |
| 步骤 6 | 对于 0.1 M PB,以 1:1 稀释 |
表3:0.2 M磷酸盐缓冲液配方。
| 3%戊二醛0.2 M二甲胂酸钠缓冲液 (改性16) | |
| 步骤 1 | 0.2 M 二甲胂酸钠缓冲液:在 100 mL 蒸馏水中加入 4.28 g 二甲胂酸钠三水合物 |
| 步骤 2 | 调节pH值至7.2 |
| 步骤 3 | 在步骤 2 的 25 mL 溶液中加入 12 mL 的 25% 戊二醛(0.2 M 二甲胂酸缓冲液 pH 7.2) |
| 步骤 4 | 用蒸馏水补足体积至 100 mL |
表4:3%戊二醛0.2 M二甲胂酸钠缓冲液配方 (修改16)。
2. 固定和非固定材料中器官的表面分析
- 要分析器官(尤其是地下器官)中的浅表菌丝以及与落叶接触的菌丝,请根据分析的样品,在解剖显微镜(体视显微镜)中以7.5倍或以上的放大倍率观察固定或新鲜的材料。
- 可视化浸入固定剂,70%乙醇(如果储存在其中)或自来水中的样品(如果是新鲜材料)。防止解剖显微镜的直射光,因为它会干燥并损坏样品。
- 在浅层菌丝和根状体的指导下搜索样品中感兴趣的区域。选择包含具有浅表根状体的区域的样品,因为这些区域可以切片以可视化根和茎中皮质细胞内的柱状体和菌丝线圈。
- 选择后,如果样本尚未修复,请按照步骤 1.6 和 1.9 进行操作。如果需要,使用光学显微镜拍摄新鲜样品而不固定,如第3节所述。
- 使用与体视显微镜耦合的相机从器官表面、根状体和其他观察到的结构中收集图像。在这种情况下,安排足够的背景颜色以与材料形成鲜明对比,如果可能,选择表面不那么粗糙的背景材料(例如纸张)。
3.植物器官的手绘切片
注意:植物器官的徒手切片可能具有挑战性,特别是对于小而薄的结构。然而,与薄切片相比,这些具有真菌内生菌的组织切片在某些情况下可以更好地显示菌丝和其他特征。
- 用锋利的刀片切片新鲜或固定的样品,将它们切得尽可能薄,并立即将它们放入装有水(如果新鲜)或70%乙醇(如果固定)的小培养皿中。使用小画笔在不损坏部分的情况下操纵这些部分。
- 为了便于切片更具挑战性的材料(即,小,薄,灵活的器官),将样品包围在结构中,例如聚苯乙烯或 Cecropia 叶柄。雕刻支撑以容纳样品,并将样品和支撑物完全制成薄部分。
- 按照第 6 节所述对样品进行染色和安装。
4. 将植物样品嵌入树脂中并切片
- 根据样品的大小和组成,将样品进一步脱水储存在70%乙醇中的80%,96%和2x中的100%乙醇中30分钟至2小时。
- 根据制造商的说明使用甲基丙烯酸乙二醇酯 (GMA) 树脂套件。查看Gerrits and Horobin (1996)18 ,了解进一步的考虑。相应地遵循渗透和嵌入步骤。
注意:GMA树脂有毒,会引起过敏反应和皮肤,眼睛和粘膜刺激。在通风橱中使用试剂并戴手套。 - 使用聚乙烯成型托盘进行嵌入,根据样品尺寸选择(例如,较大样品为 13 mm x 19 mm x 5 mm,较小样品为 6 mm x 8 mm x 5 mm)。注意模具内所需的样品取向,并使用针头帮助取向。
- 最好在室温下进行聚合,直到完全凝固。硬化过程通常需要几个小时,但建议在第二天对块进行脱模。聚合后,小心地将树脂块从模具上拆下,并尽快附着块,以避免块弯曲。
- 打磨将要附着的树脂块的表面,形成平坦的表面。用中等粘度的液态氰基丙烯酸酯粘合剂将树脂块粘在木制长方体上(推荐 2 cm x 2 cm x 3 cm)(参见 材料表)。确保树脂完全附着,以免影响切片。
- 如下所述,在旋转切片机中进行切片。
注意:切片刀的刀片非常锋利,可能会引起事故。请务必按照所有安全措施处理它们。在接近刀之前(例如,更换块,润湿树脂),锁定粗糙的手轮并放置刀片安全盖。将一次性刀片存放在适当的箱子中。更换刀片时要格外小心。
注意:不同类型的刀具(例如,一次性或固定;玻璃或钢)可用于分割GMA树脂18。切片的质量取决于刀的锋利程度。确保刀连接良好且不能移动。一次性刀具可能需要定期更换,以实现更好的切片。- 将木制长方体牢固地连接到块支架上。使用定向螺钉调整切片方向,并使用刀倾斜确保刀的适当角度。选择截面的厚度;使用较厚的设置进行修剪,对选定的部分使用较薄的设置,因为 GMA 部分在较薄时更适合粘附在载玻片上;植物组织的建议厚度为5-8μm。
- 在开始之前,如有必要,请冷却房间,因为较高的温度会降低部分的质量。准备以下切片:装有蒸馏水的烧杯、热板、画笔(至少两个)、细点镊子、巴斯德移液管、载玻片、滤纸(或薄纸)和铅笔(用于识别要切片的样品)。
- 将热板调节至50°C并将烧杯放在其上。注意加热的差异取决于热板的面积(通常,中间区域比边缘加热更多;最好加热中间的水)。
- 选择载玻片,用铅笔识别它,然后将温热的蒸馏水移液到载玻片表面。如有必要,使用溶液(例如,洗涤剂和水,或70%乙醇)来打破水和玻璃之间的张力,以便均匀覆盖整个载玻片。某些载玻片类型必须用 70% 乙醇预先清洁,以获得足够的截面附着力。
- 首先逐渐将树脂块的表面向刀片推进。不要在没有先推进块的情况下尝试切片,否则可能会损坏设备和块。如有必要,使用更高的厚度(10 μm及以上)修剪块。
- 当接近合适的部分时,用手轮进行坚定的单向运动,以便立即完成该部分。检查树脂水分。在切片过程中,如果卷曲部分有问题,请使用蘸有蒸馏水的画笔定期润湿被切割块的表面。用纸巾去除多余的水。
- 用一对细尖镊子,将获得的部分放入滑梯上方的水中。与水接触后,GMA树脂会伸展。如有必要,使用画笔轻轻展开和拉伸这些部分。使用另一支画笔始终保持刀片没有树脂碎屑。请勿在画笔之间切换,以免弄湿刀片。
- 在幻灯片中将所有所需部分排队后,干燥幻灯片的底面并将其放在热板上方。用滤纸(可选)轻轻轻拍,从载玻片顶部去除多余的水。当水从载玻片中蒸发时,这些部分将粘附。不要将载玻片放置太久,以防止切片因过热而损坏。
- 将载玻片存放在载玻片盒中,远离灰尘和阳光,并将它们用于染色和其他程序。幻灯片可以存放数年。
5. 冷冻植物样品并用低温恒温器切片
注意:冷冻生物组织的基本考虑因素是减少冷冻样品时冰晶形成造成的损害。冷冻保护通常通过注入化学惰性溶液(如甘油或蔗糖19,20)来完成。
- 样品切片前一天,请执行以下步骤。
- 在 100 mL 蒸馏水中稀释 100 mL 的 0.2 M PB(表 3),以获得 200 mL 的 0.1 M PB。在 0.1 M PB 中制备 10%、20% 和 30% 蔗糖溶液(例如,对于 10% 溶液,在 20 mL 缓冲液中加入 2 g 蔗糖)。
- 对于新鲜样品,在0.1M PB中洗涤30分钟。对于固定剂中的样品,在用于制备固定剂的相同缓冲液中洗涤30分钟。对于70%乙醇中的样品,将它们水合在50%和30%乙醇中,并在每种溶液中以0.1M PB洗涤1小时。
- 将样品在室温下在10%蔗糖中孵育2小时,在20%蔗糖中孵育2小时,在30%蔗糖中孵育2小时。之后,在4°C(或至少3小时;最长时间为48小时)的30%蔗糖中孵育过夜。
- 在切片当天,在0.1M PB中准备40%和50%蔗糖;不要提前12小时以上准备蔗糖溶液。在4°C下以每种蔗糖浓度孵育2小时。
- 对于包埋,在小模具中,制作一层OCT化合物(最佳切割温度介质,用于包埋和冷冻样品),并将其保持在-20°C冷冻。模具可以是常规的组织学模具,但为了便于脱模块,可以使用小长方体作为框架和胶带制作纸或锡箔模具。
- OCT化合物的底层在模具中冷冻后,在低温恒温室(约-27°C)内工作。将孵育在50%蔗糖中的样品放在模具中,按切片的方向放置。长方体块的上表面通常是切片的更好面。在放置样品的模具中标记,以便可以轻松修剪块,并保持正确的方向。
- 将样品包围在OCT化合物中,并爆破接触样品的任何气泡。在-20°C冷冻。 将块完全冷冻后,将它们放入低温恒温器室(约-27°C)。仅在使用前对每个进行脱模,并注意指示样品在块内位置的标记。
- 由于OCT化合物很容易用刀片切割,因此在将块放置在卡盘上之前,请适当修剪块。将一些OCT化合物放入低温恒温器卡盘中,并定位块,使上表面被分割。面积较小的面提供更好的部分。等到块很好地连接到卡盘上并对其进行测试,然后再开始切片。
- 将卡盘牢固地放入卡盘支架中。使用方向螺钉调整切片方向。使用刀倾斜调整刀的角度。选择截面的粗细。样品的切片可以比通常的树脂切片更厚。成功获得5-20μm范围内的切片,较厚的切片更容易制作(卷曲更少,结构损坏更少)。
- 将冷冻块的表面朝刀刃前进。如果不这样做,请勿尝试切片,否则块可能会从卡盘上脱落并损坏。如有必要,使用更高的厚度(10 μm及以上)修剪块。
- 当接近合适的部分时,将防侧倾板(即将保留该部分的透明板)放在刀上方,并用手轮进行牢固的单向运动,以便立即制作该部分。如果需要调整防侧倾板(通常可参考刀片进行调节)或刀片中有碎屑,则可能会导致卷曲问题。用画笔不断清洁刀片以清除碎屑。
- 使用特殊的载玻片,使切片易于附着,如硅烷化载玻片(市售或用2%氨基烷基硅烷在丙酮21中制备),或用500 μg/mL聚-L-赖氨酸在蒸馏水21或0.2%明胶中制备的载玻片(见细节21)。将载玻片保持在室温下。
- 要将截面粘附在滑块上,请抬起防侧倾板并快速使滑块接触该部分。由于载玻片处于室温下,该切片立即熔化并粘附在载玻片上。注意将滑块的处理面转向可能保留在刀上方或防侧倾板内表面的部分。为避免截面卷曲,请在抬起板后立即快速执行此步骤,并注意不要扭曲截面。
- 如果要添加新部分,请将载玻片放在低温恒温器室外(在室温下)。将所有想要的部分粘附到载玻片上后,将其保存在低温恒温器室或冰箱(-20°C或更低)中。不要将载玻片暴露在潮湿的环境中。将它们放在幻灯片框中,并记住用铅笔识别幻灯片。
注意:载玻片和OCT块可以在-20°C下储存,但不能储存太久。为了获得更好的效果,请在几天内使用幻灯片和积木。
6. 用于光学显微镜的植物切片和内生菌染色
注意:许多类型的污渍可用于植物部分。对内生真菌和植物组织进行差异染色具有挑战性。虽然不是染色程序,但标记真菌结构的方法在第7节(用小麦胚芽凝集素偶联物荧光)中介绍。手绘切片(在第 3 节中解释)、树脂切片(第 4 节)和冷冻切片(第 5 节)可以染色,尽管苯酚和醇基染色对于这些样品具有挑战性,因为在这些情况下 GMA 树脂和 OCT 会失去对载玻片的粘附。
- 对植物样品使用一种或组合以下常用染色方法。
- 甲苯胺蓝O22,23,一种广泛用于植物切片一般染色的方法。根据组织的种类和类型,在0.1M磷酸盐(pH 6.8)或0.09M柠檬酸盐缓冲液(pH 4.5-4.8)中制备0.05%甲苯胺蓝O的溶液。使用载玻片染色罐孵育GMA树脂切片2-10分钟,如果染色的载玻片很少,则在切片上方放置一些滴剂。孵育后用蒸馏水或缓冲液仔细洗涤,用水安装载玻片或将其干燥在热板上以产生永久性载玻片,如步骤6.3中所述。
- Lugol试剂2 表明淀粉的存在。在蒸馏水中制备5%碘(I2)和10%碘化钾(KI)溶液。通过在载玻片上方添加几滴来染色切片2分钟,然后用蒸馏水洗涤。这种组织化学测试通常适用于临时载玻片。
- 苏丹III,IV和黑色B24,25 染色,用于不同的脂质。在70%乙醇中制备0.3%苏丹(III,IV或黑B)的溶液,加热至沸腾,然后冷却。使用上清液,过滤,并在封闭的培养皿中孵育切片15-30分钟。用70%乙醇和蒸馏水仔细清洗切片。用水安装载玻片(通常仅适用于临时载玻片)。
注意:由于苏丹是一种醇基染料,因此更适合写意部分。仔细进行GMA树脂切片染色,因为它们通常会从载玻片上分离。
- 对于临时载玻片,将切片安装在水或甘油中,随后观察。用指甲油密封盖玻片,以便保存更长时间。
- 对于永久性载玻片,用合成树脂(例如,快速镶样介质,参见 材料表)安装切片。滴几滴封片剂(它可以溢出盖玻片),小心地放置盖玻片以避免气泡,并使用衣夹将载玻片压在盖玻片上,直到完全干燥。用剃须刀片去除多余的干燥封片剂。
7. 与小麦胚芽凝集素偶联的荧光染料在荧光和共聚焦显微镜中的应用
注意:此方法可应用于手绘切片(在第 3 节中解释)、树脂切片(第 4 节)和冷冻切片(第 5 节)。冷冻切片足以用于共聚焦显微镜目的,因为与树脂切片相比,可以提供更厚的样品,但不如徒手切片那么厚。与小麦胚芽凝集素(WGA,参见 材料表)偶联的荧光染料应用于荧光显微镜中的真菌成像26。共聚焦显微镜不是必需的,尽管它可以提供植物结构的清晰三维图像27。
- 在0.1M PB28 (pH 7.2,检查步骤5.1.1和 表3)中制备0.2mg / mL WGA-荧光染料偶联物的溶液。在0.1M PB(pH 7.2)中制备1%Calcofluor White溶液。准备少量这些溶液,因为这些切片直接与它们一起孵育。
- 将载玻片中的切片在WGA-荧光染料共轭溶液29中孵育30分钟,使用足够的体积覆盖切片,然后在0.1M PB中洗涤。
- 孵育钙氟溶液中的切片,使用足够的体积作为安装介质。在观察期间可以保持溶液。
- 将盖玻片放在载玻片上,并使用以下滤光片在共聚焦显微镜或荧光显微镜中进行观察:TC / GFP(激发:470-440,发射:525-550, 对于材料表中的WGA-荧光染料 - 真菌细胞壁在此过滤器29下发出绿色荧光)和DAPI(激发:358,发射:463,对于Calcofluor White)30。
注意:可以使用共聚焦显微镜27中的Z系列功能获得三维图像。
8. 植物器官扫描电镜
- 固定样品、脱水并储存在 70% 乙醇中(第 1 节)后,一种可能性是切割样品以暴露任何所需的表面以进行 SEM 分析(例如,内部组织、卵巢结构)。使用锋利的新剃须刀片,并以单向运动进行切割,避免这些区域在 SEM 中受损。如有必要,使用体视显微镜选择样品并考虑金属短截区域以确定样品大小。
- 进一步脱水样品的乙醇系列中的SEM:80%,96%和2x无水乙醇(≥99.8%)。在每个浓度下保持小而精致的样品30分钟,将较大和更密集的样品保持1小时。
- 使用薄纸折叠小信封以组织样品以进行下一步,无需信封即可处理较大的样品。用铅笔写一个字母或一个数字来识别信封,并记录每个信封中的所有样品。将样品保存在无水乙醇中,尽管不要太久,并尽快进行步骤8.4。
- 进行临界点 (CP) 干燥。根据标准操作程序操作 CP 干燥机。将样品置于压力室中的无水乙醇(中间流体)中。在CO2 临界点(31°C,7.3×106Pa ),中间流体溶解到过渡流体(液态二氧化碳)中,样品干燥31。
- CP干燥后,尽快将样品储存在干燥容器中,例如装有硅胶的密封烧瓶。大气湿度如果重新吸收会破坏样品31。
- 使用金属短截线安装样品。在安装之前,戴上手套以操纵短截,将它们浸入丙酮中5分钟以消除任何脂肪,然后让它们干燥。使用导电双面碳胶带将样品固定在短截图上,并使用体视显微镜帮助定位样品,请记住,从上方看线是SEM图像中唯一可能的视角。
- 使用细点镊子操作样品,小心,因为镊子接触的样品部分通常会损坏,因此请尝试触摸远离感兴趣区域(例如,与胶带接触的区域)的零件。将样品保持在带有硅胶的密封培养皿中的存根。请尽快执行步骤 8.8。
- 使用溅射镀膜机在惰性气体(通常是氩气31)的低压气氛中在样品表面沉积一层金属,通常是金或铂。使用溅射镀膜机时遵循标准操作程序。涂层厚度取决于样品的形貌,通常在15-40nm32之间。
- 将包被的存根保持在带有硅胶的密封培养皿中,并且只要硅胶保持湿度,样品可以以这种方式储存数周。使用扫描电子显微镜分析样品。 真空中的 样品被电子束击中,这种相互作用的信号发射被解释为图像31。有关操作扫描电子显微镜的详细信息,请阅读Jeffree and Read (1991)31 和Bozzola and Russell (1999)32。
- 要重复使用存根,请拉动胶带并用丝绒擦洗。在自来水中洗涤,浸入无水乙醇中,并充分干燥,防止组成金属氧化。
9. 透射电子显微镜
- 按照步骤1.7和1.10中的说明,在样品上添加戊二醛-二甲胂酸缓冲液的前缀。预固定12-24小时后,在0.2M二甲胂酸盐缓冲液(pH 7.25)中洗涤样品3倍10分钟。在0.2M二甲胂酸盐缓冲液中用1%四氧化锇(OsO 4)进行后固定,在室温下在黑暗中12小时。用蒸馏水洗涤3次5分钟。
注意:二甲胂酸盐和四氧化锇具有剧毒,不应吸入。按照相应的安全数据表在通风橱中使用它们。 - 用30%,50%,70%和96%乙醇(每种浓度2x)使样品脱水10分钟。然后,在无水酒精中脱水3次,每次15分钟。
- 将样品浸润在亲水性丙烯酸树脂中(见 材料表),一次用1:1树脂+无水乙醇和3x用纯树脂每次8-12小时。在60°C的明胶胶囊中进行聚合,直到完全凝固(12小时最多17)。
- 仔细评估树脂块内样品的方向;用剃须刀片切割块的顶部,形成金字塔形,将样品集中在切片区域。用金刚石刀在超薄切片机中获得半薄切片(250-500nm)33 ,并在几滴水中放在载玻片上。
- 将载玻片保持在60°C的热板上。 如步骤6.1.1所示,用甲苯胺蓝O染色切片,让染色剂完全干燥。用自来水仔细清洗。通过绘制四个象限并选择最合适的象限进行分析来评估获得的部分。
- 修剪块,使金字塔形状将所选象限集中在块的上表面。生产超薄切片(50-100nm)33,34。厚度根据截面的干涉颜色进行评估:约70 nm的切片显示为银金色,约100 nm的部分显示为金,约200 nm的切片显示为蓝色34。
- 使用铜网格从水中收集超薄切片,然后用乙酸铀酰和柠檬酸铅进行对比染色方法,如下所述。
- 制备柠檬酸铅溶液(表5),并将最终溶液冷冻在微量离心管中,每个管中含有1 mL溶液,仅在使用前解冻。
- 制备乙酸铀酰溶液:将0.625g乙酸铀酰[UO 2(CH3COO)2]溶解在25mL最近煮沸和冷却的蒸馏水中。储存在冰箱的深色烧瓶中。
注意:硝酸铅如果摄入是有毒的。1 N NaOH具有高腐蚀性。乙酸铀酰具有放射性和毒性。不得摄入、吸入或与皮肤接触。 - 染色时,将两种制备的试剂放入带有过滤单元(0.22μm孔,参见材料表)的单独3 mL注射器中。准备一个倒置的培养皿,上面有密封的热塑性薄膜(见材料表)并在一个更宽的培养皿内,边缘有NaOH颗粒作为CO 232的陷阱(见图2)。
- 丢弃第一滴,并在薄膜上放置一滴乙酸铀酰和三滴蒸馏水,用于每个网格染色。用柠檬酸铅做同样的事情,再加入三滴蒸馏水。
- 将网格(不透明的一面朝下,部分所在的地方)在铀酰中孵育30分钟(可变时间)。在蒸馏水滴中洗涤 3 次,每次用亮面上的滤纸轻轻擦干网格。重复柠檬酸铅滴(30分钟)并洗涤。
- 至少4小时后,在透射电子显微镜中分析网格。在该显微镜中,电子束在 真空中 穿过切片,并将图像投射到荧光屏上。有关操作透射电子显微镜的详细信息,请阅读Bozzola和Russell(1999)32。
| 柠檬酸铅溶液 (用于 TEM 对比染色) | |
| 步骤 1 | 用锡纸包围烧杯 |
| 步骤 2 | 将 0.266 g 硝酸铅 [Pb(NO3)2] 溶解在 6 mL 最近煮沸和冷却的蒸馏水中 |
| 步骤 3 | 搅拌2分钟 |
| 步骤 4 | 加入0.352g柠檬酸三钠[Na3(C6H5O7).2H2O](溶液必须获得乳白色外观) |
| 步骤 5 | 搅拌15分钟,用锡纸密封烧杯,并将溶液转移到10mL烧杯中 |
| 步骤 6 | 加入 1.6 mL 的 1N NaOH 和 2.4 mL 的蒸馏水(溶液必须是半透明的) |
| 步骤 7 | 如有必要,将pH值调节到接近12 |
表 5:柠檬酸铅溶液配方。

图 2:使用柠檬酸铅和乙酸铀酰溶液的对比染色方案 。 (A)准备培养皿,一个用热塑性薄膜倒置(在中心),以便可以将液滴放在其上方,在更宽的培养皿内。氢氧化钠颗粒是中央培养皿周围的地方。(B)乙酸铀酰滴剂放在带有字母U的圆圈中,柠檬酸铅滴剂在标有L.DW的圆圈中表示蒸馏水滴。网格在色谱柱中按顺序染色,因此可以同时对五个网格进行染色。 请点击此处查看此图的大图。
10. 兰花种子的共生萌发
- 确保种子共生发芽中使用的溶液和所有材料都是无菌的,以避免污染。首先在121°C下高压灭菌20分钟。 共生萌发步骤总结在 图3中。
- 考虑到种皮的硬度和厚度,将水果和种子浸入含有2%活性氯的次氯酸钠溶液中10-15分钟,种子7-10分钟,对水果和种子进行表面消毒9。纤细而脆弱的种子可以浸入1:1稀释的次氯酸钠溶液中。之后,在高压灭菌的蒸馏水中洗涤3次以除去次氯酸盐溶液。
- 通过在丝网织物中过滤来回收种子,并使用种子进行发芽测试(最好)。如有必要,将它们储存在带有硅胶的玻璃烧瓶内的滤纸信封中,在4°C下,密封烧瓶并用保鲜膜密封。将最后一次洗涤中的几滴水转移到马铃薯葡萄糖琼脂(PDA,39 g / L)中,以评估洗涤过程的有效性。
- 在培养基中播种之前,通过四唑测试(可选)评估其活力,如下所述35。
- 在微量离心管中用1mL的10%蔗糖在蒸馏水中孵育约10mg种子,在室温(约25°C)下光照孵育24小时。
- 用微量移液管除去蔗糖溶液,并在蒸馏水中加入1mL的1%四唑溶液(三苯基氯化四唑)。在40°C的热块中在黑暗中孵育24小时。
- 用微量移液管除去四唑溶液,用蒸馏水洗涤种子2次或直到溶液被除去。取出所有液体。如有必要,种子可以在分析之前在冰箱中储存长达一周(如步骤10.3)。
- 将种子重悬于蒸馏水中,并在光学显微镜下进行分析。有活力的种子获得浅到深红色,而没有活力的种子则保留其自然颜色。
- 执行以下适应的9 方案,用于兰花种子的共生发芽。
- 将种子在高压灭菌的滤纸盘(直径1-2厘米)上孵育,置于带有燕麦琼脂(OMA)培养基(2.5g / L燕麦片和7g / L琼脂,pH 6)的培养皿中。
- 在培养皿的中心,接种含有来自所选分离真菌的菌丝体的培养基片段(约1cm2),用于发芽程序。用保鲜膜密封培养皿,并在约25°C或室温的黑暗中孵育它们,因为它更适合真菌生长。
- 准备一些有种子且没有真菌接种的菜肴,作为发芽试验的阴性对照。
- 通过收集定量和定性数据并拍摄原球茎和幼苗,每周分析发芽结果。应使用体视显微镜观察种子和原球茎,以便更准确地评估发芽情况。使用来自下方的光源,因为它允许更大的对比度,从而可以更容易地将真菌菌丝体与原球体区分开来。
- 收集不同发育阶段的样本并固定以进行解剖分析(第 1 节)。应用前面描述的所有图像分析来研究发芽期间种子、原球茎和幼苗中的真菌内生菌(光学显微镜 - 第 4、5 和 6 节;共聚焦和荧光 - 第 7 节;SEM 和 TEM - 第 8 节和第 9 节)。
- 根据 表6对阶段进行分类后生成定量结果。这些阶段描述了霉菌异养兰花种子的通常发育。每周收集数据并附上每个观察阶段的初始日期。
- 此外,收集估计发芽百分比和发芽率的定量数据。计数至少 100 个种子或定义计数字段35。为每个培养皿划分三个或更多计数区域,由具有标准化区域的固定区域组成,并每周进行评估。根据生长指数(GI)公式计算收集的数据:

其中 N 0 是阶段0 中计数的种子数,N 1 是指阶段1 ,直到阶段 6(注册为 N6)36。
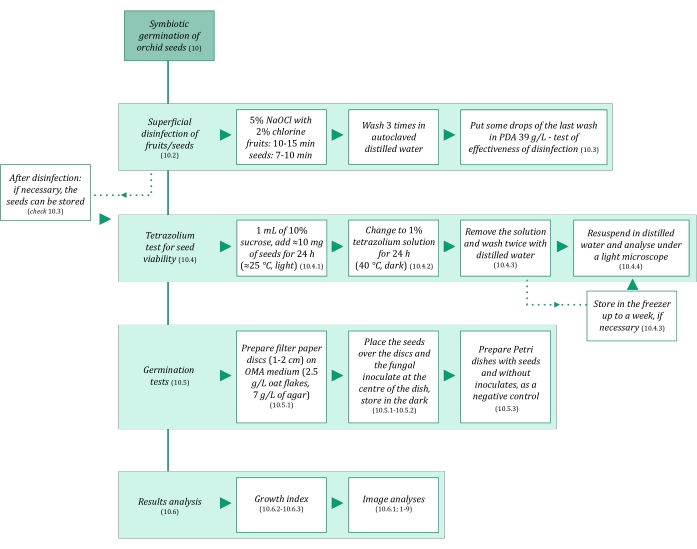
图3:种子共生发芽方法的示意图摘要。 原理图提供了协议中详细步骤的指示。缩写:OMA = 燕麦琼脂,PDA = 马铃薯葡萄糖琼脂。 请点击此处查看此图的大图。
| 萌发阶段 | 描述 |
| 0 | 不发芽 |
| 1 | 胚胎肿胀 |
| 2 | 睾丸破裂 |
| 3 | 吸收性毛发发育 |
| 4 | 茎突起发展 |
| 5 | 保护鳞片(苞片)发育 |
| 6 | 第一根发育 |
表6:应用于发芽试验定期分析的原球茎发育阶段的描述。 根据Otero等人36中描述的阶段修改。
结果
在固定植物组织的基本阶段之后,考虑到细胞成分和组织的形态、体积和空间组织,产生尽可能与活态相似的细胞结构16。化学固定后观察样品中的这些特征(图4)。图4C-F表示光学显微镜下充分固定的样品。遵循所描述的固定程序并熟悉样品结构有助于分析固定成功与否。
讨论
植物解剖学和形态学中的图像分析具有实现目标的重要潜力,并有助于理解分枝异养植物与其不可或缺的真菌内生菌之间的关系,如地下器官研究6,40,种子共生发芽的结构分析39以及地上和生殖结构41所证明的那样.结构植物学尽管在过去十年中失去了对植物科学其他领域的声望和空间1,但在回答?...
披露声明
作者没有什么可透露的。
致谢
作者感谢FAEPEX和FAPESP的资助(2015/26479-6)。MPP 感谢 Capes 的硕士学位奖学金(流程 88887.600591/2021-00)和 CNPq。 JLSM 感谢 CNPq 的生产力补助金 (303664/2020-7)。作者还感谢LME(电子显微镜实验室 - IB / Unicamp),INFABiC(国家应用于细胞生物学的光子学科学技术研究所 - Unicamp)和LaBiVasc(血管生物学实验室 - DBEF / IB / Unicamp)提供的设备和帮助;LAMEB(UFSC)和Eliana de Medeiros Oliveira(UFSC)对冷冻保护方案的贡献;LME对TEM协议的贡献。
材料
| Name | Company | Catalog Number | Comments |
| Acetone | Sigma-Aldrich | 179124 | (for SEM stubs mounting) |
| Agar-agar (AA) | Sigma-Aldrich | A1296 | (for seeds germination tests) |
| Calcofluor White Stain | Sigma-Aldrich | 18909 | fluorescent dye (detects cellulose) |
| Citrate Buffer Solution, 0.09M pH 4.8 | Sigma-Aldrich | C2488 | (for toluidine blue O staining) |
| Conductive Double-Sided Carbon Tape | Fisher Scientific | 50-285-81 | (for SEM) |
| Confocal Microscope | Zeiss | (any model) | |
| Copper Grids | Sigma-Aldrich | G4776 | (for TEM) |
| Critical-point dryer | Balzers | (any model) | |
| Cryostat | Leica Biosystems | (any model) | |
| Dissecting microscope | Leica Biosystems | (= stereomicroscope, any model) | |
| Entellan | Sigma-Aldrich | 107960 | rapid mounting medium for microscopy |
| Ethyl alcohol, pure (≥99.5%) | Sigma-Aldrich | 459836 | (= ethanol, for dehydration processes) |
| Formaldehyde solution, 37% | Sigma-Aldrich | 252549 | (for NBF solution preparation) |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128 | histological tissue fixative |
| Gelatin capsules for TEM | Fisher Scientific | 50-248-71 | (for resin polymerisation in TEM) |
| Gelatin solution, 2% in H2O | Sigma-Aldrich | G1393 | (dilute for slides preparation - OCT adherence) |
| Glutaraldehyde solution, 25% | Sigma-Aldrich | G6257 | (for Karnovsky’s solution preparation) |
| HistoResin | Leica Biosystems | 14702231731 | glycol methacrylate (GMA) embedding kit |
| Iodine | Sigma-Aldrich | 207772 | (for Lugol solution preparation) |
| Lead(II) nitrate | Sigma-Aldrich | 228621 | Pb(NO3)2 (for TEM contrast staining) |
| Light Microscope | Olympus | (any model) | |
| LR White acrylic resin | Sigma-Aldrich | L9774 | hydrophilic acrylic resin for TEM |
| Lugol solution | Sigma-Aldrich | 62650 | (for staining) |
| Metal stubs for specimen mounts | Rave Scientific | (for SEM, different models) | |
| Microtome | Leica Biosystems | manual rotary microtome or other model | |
| Oatmeal agar (OMA) | Millipore | O3506 | (for seeds germination tests) |
| OCT Compound, Tissue-Tek | Sakura Finetek USA | 4583 | embedding medium for frozen tissues |
| Osmium tetroxide | Sigma-Aldrich | 201030 | OsO4 (for TEM postfixation) |
| Parafilm M | Sigma-Aldrich | P7793 | sealing thermoplastic film |
| Paraformaldehyde | Sigma-Aldrich | 158127 | (for Karnovsky’s solution preparation) |
| Poly-L-lysine solution, 0.1% in H2O | Sigma-Aldrich | P8920 | (for slides preparation - OCT adherence) |
| Poly-Prep Slides | Sigma-Aldrich | P0425 | poly-L-lysine coated glass slides |
| Polyethylene Molding Cup Trays | Polysciences | 17177A-3 | (6x8x5 mm, for embbeding samples in GMA resin) |
| Polyethylene Molding Cup Trays | Polysciences | 17177C-3 | (13x19x5 mm, for embbeding samples in GMA resin) |
| Potassium iodide | Sigma-Aldrich | 221945 | (for Lugol solution preparation) |
| Potato Dextrose Agar (PDA) | Millipore | 70139 | (for seeds germination tests) |
| Scanning Electron Microscope | Jeol | (any model) | |
| Silane [(3-Aminopropyl)triethoxysilane] | Sigma-Aldrich | A3648 | (for slides preparation - OCT adherence) |
| Silane-Prep Slides | Sigma-Aldrich | S4651 | glass slides coated with silane |
| Silica gel orange, granular | Supelco | 10087 | (for dessicating processes) |
| Sodium cacodylate trihydrate | Sigma-Aldrich | C0250 | (for glutaraldehyde-sodium cacodylate buffer) |
| Sodium hydroxide | Sigma-Aldrich | S5881 | NaOH (for Karnovsky’s solution preparation and TEM contrast staining) |
| Sodium hypochlorite solution | Sigma-Aldrich | 425044 | NaClO (for seeds surface disinfection) |
| Sodium phosphate dibasic, anhydrous | Sigma-Aldrich | 71640 | Na2HPO4 (for NBF solution and PB preparation) |
| Sodium phosphate monobasic monohydrate | Sigma-Aldrich | S9638 | NaH2PO4·H2O (for NBF and PB) |
| Sputter coater | Balzers | (any model) | |
| Sucrose | Sigma-Aldrich | S0389 | C12H22O11 (for cryoprotection and germination test) |
| Sudan III | Sigma-Aldrich | S4131 | (for staining) |
| Sudan IV | Sigma-Aldrich | 198102 | (for staining) |
| Sudan Black B | Sigma-Aldrich | 199664 | (for staining) |
| Syringe | (3 mL, any brand, for TEM contrast staining) | ||
| Syringe Filter Unit, Millex-GV 0.22 µm | Millipore | SLGV033R | PVDF, 33 mm, gamma sterilized (for TEM contrast staining) |
| Tek Bond Super Glue 793 | Tek Bond Saint-Gobain | 78072720018 | liquid cyanoacrylate adhesive, medium viscosity |
| Toluidine Blue O | Sigma-Aldrich | T3260 | (for staining) |
| Transmission Electron Microscope | Jeol | (any model) | |
| Triphenyltetrazolium chloride | Sigma-Aldrich | T8877 | (for the tetrazolium test in seeds germination) |
| Trisodium citrate dihydrate | Sigma-Aldrich | S1804 | Na3(C6H5O7)·2H2O (for TEM contrast staining) |
| Ultramicrotome | Leica Biosystems | (any model) | |
| Uranyl acetate | Fisher Scientific | 18-607-645 | UO2(CH3COO)2 (for TEM contrast staining) |
| Vacuum pump | (any model) | ||
| Wheat Germ Agglutinin, Alexa Fluor 488 Conjugate | TermoFisher Scientific | W11261 | fluorescent dye-conjugated lectin (detects sialic acid and N-acetylglucosaminyl residues) |
参考文献
- Evert, R. F. . Esau’s Plant Anatomy: Meristems, Cells, and Tissues of the Plant Body: Their Structure, Function, and Development. , (2006).
- Yeung, E. C. T., Stasolla, C., Sumner, M. J., Huang, B. Q. . Plant Microtechniques and Protocols. , (2015).
- Sokoloff, D. D., Jura-Morawiec, J., Zoric, L., Fay, M. F. Plant anatomy: at the heart of modern botany. Botanical Journal of the Linnean Society. 195 (3), 249-253 (2021).
- Leake, J. R. The biology of myco-heterotrophic (‘saprophytic’) plants. New Phytologist. 127 (2), 171-216 (1994).
- Bidartondo, M. I. The evolutionary ecology of myco-heterotrophy. New Phytologist. 167 (2), 335-352 (2005).
- Imhof, S., Massicotte, H. B., Melville, L. H., Peterson, R. L. Subterranean morphology and mycorrhizal structures. Mycoheterotrophy. , 157-214 (2013).
- Rasmussen, H. N., Rasmussen, F. N. Orchid mycorrhiza: implications of a mycophagous life style. Oikos. 118 (3), 334-345 (2009).
- Rasmussen, H. N., Dixon, K. W., Jersáková, J., Těšitelová, T. Germination and seedling establishment in orchids: a complex of requirements. Annals of Botany. 116 (3), 391-402 (2015).
- Zettler, L. W. Terrestrial orchid conservation by symbiotic seed germination: techniques and perspectives. Selbyana. 18 (2), 188-194 (1997).
- Stewart, S. L., Kane, M. E. Symbiotic seed germination and evidence for in vitro mycobiont specificity in Spiranthes brevilabris (Orchidaceae) and its implications for species-level conservation. In Vitro Cellular & Developmental Biology - Plant. 43 (3), 178-186 (2007).
- Zhao, D. -. K., et al. Orchid reintroduction based on seed germination-promoting mycorrhizal fungi derived from protocorms or seedlings. Frontiers in Plant Science. 12, 701152 (2021).
- Selosse, M. A., Roy, M. Green plants that feed on fungi: facts and questions about mixotrophy. Trends in Plant Science. 14 (2), 64-70 (2009).
- Merckx, V. S. F. T., Mennes, C. B., Peay, K. G., Geml, J. Evolution and diversification. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 215-244 (2013).
- Boon, M. E., Drijver, J. Routine Cytological Staining Techniques: Theoretical Background and Practice. Macmillan International Higher Education. , (1986).
- Karnovsky, M. A formaldehyde-glutaraldehyde fixative of high osmolality for use in electron microscopy. Journal of Cell Biology. 27 (2), 137-138 (1964).
- Hayat, M. . Fixation for Electron Microscopy. , (1981).
- Roland, J. C., Vian, B. General preparation and staining of thin sections. Electron Microscopy of Plant Cells. 1, 675 (1991).
- Gerrits, P. O., Horobin, R. W. Glycol methacrylate embedding for light microscopy: basic principles and trouble-shooting. Journal of Histotechnology. 19 (4), 297-311 (1996).
- Zhang, Z., Niu, L., Chen, X., Xu, X., Ru, Z. Improvement of plant cryosection. Frontiers in Biology. 7 (4), 374-377 (2012).
- BeneŠ, K. On the media improving freeze-sectioning of plant material. Biologia Plantarum. 15 (1), 50-56 (1973).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Preparation of slides and coverslips for microscopy. Cold Spring Harbor Protocols. 2008 (5), (2008).
- Sakai, W. S. Simple method for differential staining of paraffin embedded plant material using toluidine blue O. Stain Technology. 48 (5), 247-249 (1973).
- O’Brien, T., Feder, N., McCully, M. E. Polychromatic staining of plant cell walls by toluidine blue O. Protoplasma. 59 (2), 368-373 (1964).
- Ventrella, M. C., Almeida, A. L., Nery, L. A., Coelho, V. P. d. e. M. Métodos Histoquímicos Aplicados às Sementes. Universidade Federal de Viçosa. , (2013).
- Pearse, A. G. E. . Histochemistry, Theoretical and Applied. , (1960).
- Andrade-Linares, D. R., Franken, P. Fungal endophytes in plant roots: taxonomy, colonization patterns, and functions. Symbiotic Endophytes. , 311-334 (2013).
- Wymer, C. L., Beven, A. F., Boudonck, K., Lloyd, C. W. Confocal microscopy of plant cells. Confocal Microscopy Methods and Protocols. , 103-130 (1999).
- Marques, J. P. R., Soares, M. K. M. Manual de Técnicas Aplicadas à Histopatologia Vegetal. FEALQ. , (2021).
- Navarro, B. L., Marques, J. P. R., Appezzato-da-Glória, B., Spósito, M. B. Histopathology of Phakopsora euvitis on Vitis vinifera. European Journal of Plant Pathology. 154 (4), 1185-1193 (2019).
- Marques, J. P. R., et al. Sugarcane cell wall-associated defense responses to infection by Sporisorium scitamineum. Frontiers in Plant Science. 9, 698 (2018).
- Jeffree, C. E., Read, N. D. Ambient-and low-temperature scanning electron microscopy. Electron Microscopy of Plant Cells. , 313-413 (1991).
- Bozzola, J. J., Russell, L. D. . Electron Microscopy: Principles and Techniques for Biologists. , (1999).
- Murray, S. Basic transmission and scanning electron microscopy. Introduction to electron Microscopy for Biologists. , 3-18 (2008).
- . Glossary of TEM terms Available from: https://www.jeol.co.jp/en/words/emterms/ (2021)
- Seaton, P. T., et al. Orchid seed and pollen: a toolkit for long-term storage, viability assessment and conservation. Orchid Propagation: From Laboratories to Greenhouses—Methods and Protocols. , 71-98 (2018).
- Otero, J. T., Ackerman, J. D., Bayman, P. Differences in mycorrhizal preferences between two tropical orchids. Molecular Ecology. 13 (8), 2393-2404 (2004).
- Koch, R. A., et al. Marasmioid rhizomorphs in bird nests: Species diversity, functional specificity, and new species from the tropics. Mycologia. 112 (6), 1086-1103 (2020).
- Webster, J., Weber, R. . Introduction to Fungi. , (2007).
- Sisti, L. S., et al. The role of non-mycorrhizal fungi in germination of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. Frontiers in Plant Science. 10, 1589 (2019).
- Martos, F., et al. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids. New Phytologist. 184 (3), 668-681 (2009).
- Alves, M. F., et al. Reproductive development and genetic structure of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. BMC Plant Biology. 21 (1), 332 (2021).
- Merckx, V. S. F. T. Mycoheterotrophy: an introduction. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 1-17 (2013).
- Hall, J. L., Hawes, C. . Electron Microscopy of Plant Cells. , (1991).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。