Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Mikoheterotrofik Bitki Dokularında Mantar Kolonizasyonunu Yorumlamak ve Tohumların Simbiyotik Çimlenmesi için Mikroskopi Teknikleri
Bu Makalede
Özet
Bu protokol, mikoheterotrofik bitki örneklerinin toplanması, sabitlenmesi ve sürdürülmesi için ayrıntılı prosedürler sağlamayı, mikorizal mantarlarla çimlenmiş bitki dokularında ve tohumlarda mantar kolonizasyonunu incelemek için tarama ve iletim elektron mikroskobu, ışık, konfokal ve floresan mikroskobu gibi farklı mikroskopi tekniklerini uygulamayı amaçlamaktadır.
Özet
Yapısal botanik, bitkilerin ekolojisini, fizyolojisini, gelişimini ve evrimini tam olarak anlamak için vazgeçilmez bir bakış açısıdır. Mikoheterotrofik bitkileri (yani, mantarlardan karbon elde eden bitkileri) araştırırken, yapısal adaptasyonlarının dikkat çekici yönleri, mantarlar tarafından doku kolonizasyonu kalıpları ve yeraltı organlarının morfoanatomisi, gelişim stratejilerini ve besin kaynağı olan hiflerle ilişkilerini aydınlatabilir. Simbiyotik mantarların bir diğer önemli rolü orkide tohumlarının çimlenmesi ile ilgilidir; Tüm Orchidaceae türleri, çimlenme ve fide aşamasında (ilk mikoheterotrofi), hatta yetişkin aşamalarında fotosentez yapanlar bile mikoheterotrofiktir. Orkide tohumlarında besin rezervlerinin bulunmaması nedeniyle, mantar simbiyontları substratlar sağlamak ve çimlenmeyi sağlamak için gereklidir. Çimlenme aşamalarını yapısal perspektiflerle analiz etmek, mantarların tohumlarla etkileşimi ile ilgili önemli soruları da cevaplayabilir. Bu makalede önerildiği gibi, bitki dokularındaki mantar endofitlerini ortaya çıkarmak için farklı görüntüleme teknikleri uygulanabilir. Bitki organlarının serbest ve ince bölümleri boyanabilir ve daha sonra ışık mikroskobu kullanılarak gözlemlenebilir. Buğday tohumu aglutininine konjuge edilmiş bir florokrom, mantarlara uygulanabilir ve konfokal mikroskopide bitki hücre duvarlarını vurgulamak için Calcofluor White ile birlikte inkübe edilebilir. Ek olarak, tarama ve iletim elektron mikroskobu metodolojileri mikoheterotrofik orkideler için detaylandırılmıştır ve bu protokollerin ilgili bitkilerde uygulanması olanakları araştırılmaktadır. Orkide tohumlarının simbiyotik çimlenmesi (yani, mikorizal mantarların varlığında), protokolde, çimlenmenin farklı aşamalarından elde edilen yapıların ışık, konfokal ve elektron mikroskobu ile analizler için hazırlanması olanakları ile birlikte ayrıntılı olarak açıklanmaktadır.
Giriş
Bitki morfolojisi ve anatomisini kapsayan botanik alanındaki yapısal araştırmalar, tüm organizmayı anlamada temeldir1,2 ve bitkilerin ekolojisi, fizyolojisi, gelişimi ve evrimi ile ilgili bilgileri bütünleştirmek ve katkıda bulunmak için vazgeçilmez perspektifler sağlar3. Bitki morfolojisi ve anatomisindeki yöntemler şu anda yakın zamanda ve bir asırdan fazla bir süre önce geliştirilen protokolleri, ekipmanları ve bilgileri içermektedir2. Klasik yöntemlerin (örneğin, ışık mikroskobu) ve daha yeni tekniklerin (örneğin, konfokal mikroskopi, X-ışını mikrotomografisi) sürekli olarak uygulanması ve uyarlanması aynı temel temele sahiptir: bir metodolojinin geliştirilmesini sağlayan teorik bilgi.
Bitki anatomisi ve morfolojisinde ana araç görüntüdür. Bu tür analizlerin basit gözlemler olduğu yanılgısına rağmen, öznel yorumlara yer vermek2, bu alandaki görüntüleri analiz etmek ve anlamak, uygulanan yöntemler (ekipman, analiz türü, metodolojik prosedürler), hücre bileşenleri, histokimya ve bitki gövdesi (doku organizasyonu ve fonksiyonu, ontojeni, morfolojik adaptasyonlar) hakkında bilgi gerektirir. Çeşitli yöntemlerle elde edilen görüntülerin yorumlanması, form ve fonksiyonun ilişkilendirilmesine, bir yapının kimyasal bileşiminin deşifre edilmesine, taksonların tanımlanmasında doğrulanmasına, fitopatojenlerin enfeksiyonlarının anlaşılmasına ve diğer bu tür değerlendirmelere yol açabilir.
Mikoheterotrofik (MH) bitkileri (yani, mikorizal mantarlardan karbon elde eden fotosentetik olmayan bitkiler4,5) araştırırken, yapısal adaptasyonlarının dikkat çekici yönleri, mantarlar tarafından doku kolonizasyonu kalıpları ve yeraltı organlarının morfoanatomisi, gelişim stratejilerini ve besin kaynağı olan hiflerle ilişkilerini aydınlatabilir. MH bitkilerinin yeraltı organları genellikle toprak mantarları ile olan ilişkileriyle ilgili önemli adaptasyonlar gösterir, bu nedenle bu anatomik ve morfolojik araştırmaların yapılması esastır6. MH türlerinin hava organları göz ardı edilmemelidir, çünkü endofitler mikorizal mantar olmasalar bile bu dokularda da bulunabilir (kişisel gözlemler, henüz yayınlanmamıştır).
Mikorizal mantarların MH türleri ile tüm yaşam döngüleriboyunca 7 olan ilişkisinin köklü özünün yanı sıra, her orkide türü, ototrofik olanlar bile, doğal ortamlarda başlangıçta zorunlu bir mikoheterotrofik aşamaya sahiptir. Orkidelerin embriyosunun farklılaşmamış olması ve endosperm veya kotiledonlardan yoksun olması, dolayısıyla mantar ortaklarının beslenme desteği olmadan doğal ortamlarda kendini geliştirememesi ve kuramamasıdır 4,8. Simbiyotik çimlenme protokollerinin sadece MH türlerine değil, aynı zamanda fotosentez yapan orkidelere de uygulanabileceği göz önüne alındığında, çimlenme ve protocorm gelişiminde orkide-mantar özgüllüğünü araştırmayı amaçlayan, tehdit altındaki türlerin korunmasına yönelik girişimlerde çok uygulanan bir metodoloji 9,10,11.
Bu yöntem derlemesinde, anatomik çalışmalar için MH bitki örneklerinin toplanması, sabitlenmesi ve depolanması (bölüm 1), yüzey analizi ve numune seçimi (bölüm 2), bölümleme yöntemleri (serbest: bölüm 3, mikrotomi: bölüm 4, kriyomikrotomi: bölüm 5), boyama ve montaj (bölüm 6), mantar endofitlerinin floresan ve konfokal mikroskopisi (bölüm 7), taramalı elektron mikroskobu (bölüm 8), ve transmisyon elektron mikroskobu (bölüm 9). Ek olarak, orkide tohumları için simbiyotik çimlenme yöntemini (MH ve ototrofik, bölüm 10) tanımlamaktayız, çünkü daha önce bahsedilen görüntüleme yöntemleri, çimlenme sürecinde tohumların, protokormların ve fidelerin mantar kolonizasyonunu analiz etmek için başarıyla uygulanabilir.
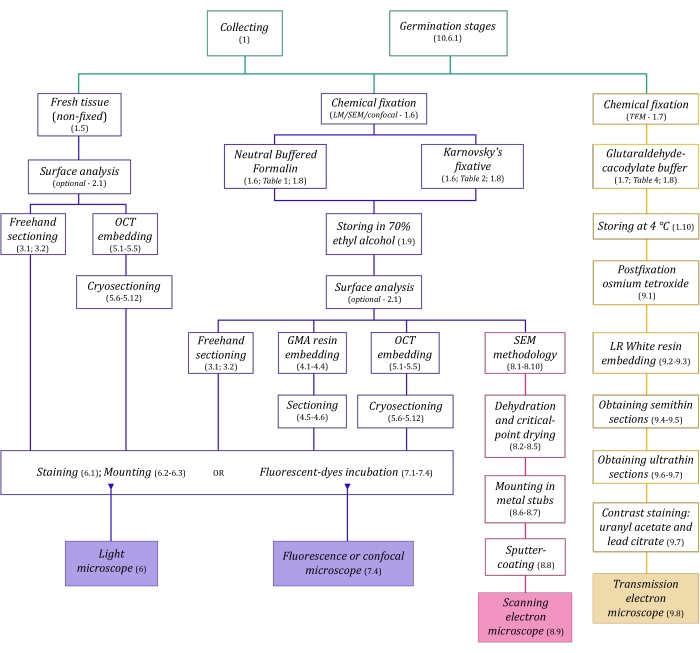
Şekil 1: Görüntüleme yöntemlerinin şematik özeti. Şemalar, ayrıntılı olarak açıklandığı protokol adımlarının göstergelerini sağlar. Kısaltmalar: GMA = glikol metakrilat, OCT = optimal kesme sıcaklığı bileşiği, SEM = taramalı elektron mikroskobu. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Burada ayrıntılı olarak açıklanan mikroskopi teknikleri (Şekil 1) aşağıdaki temel adımlardan önce gelir: numunelerin toplanması, sabitlenmesi, dehidrasyonu, gömülmesi ve bölümlenmesi. Seçilen teknik(ler)e bağlı olarak adımlar değişken olduğundan (Şekil 1), hazırlanacak ve toplama alanına taşınacak fiksatörleri, numunelerin sabitlemeden önce nasıl hazırlanması gerektiğini, kullanılacak dehidrasyon işlemlerini (bölüm 1) ve farklı gömme olanakları ve kesitleme yöntemlerini (bölüm 4, 5, ve 9). Şekil 1 , aşağıda ayrıntılı olarak açıklanan her mikroskopi tekniği için gerekli tüm adımları sırayla özetlemektedir.
Protokol
1. Numunelerin toplanması, sabitlenmesi ve bakımı
NOT: Tamamen MH bitkileri genellikle 12,13 numaralı karanlık ormanda, çoğunlukla nemli ve çöp içeren alanlarda bulunabilirken, kısmen MH bitkileri daha açık ormanlardabulunabilir 12,13. MH bitkileri genellikle çeşitli şekil ve boyutlarda iyi gelişmiş yeraltı organlarına sahiptir.
- MH türlerini toplarken, bitki tabanının etrafındaki toprağı keşfedin, yeraltı organlarına zarar vermemeye dikkat edin ve hava organlarının yeraltı organlarından ayrılmasını önlemek için bitkileri yerden çekmekten kaçının.
- Kökler, gövdeler, rizomlar ve depolama organları gibi yeraltı organlarını bu yapılara zarar vermeden keşfederken bir bahçe mala kullanarak hava yapılarını dikkatlice kazın.
- Kırılgan yapıları korumak için toprak parçacıklarını çıkarın ve numuneleri sabitlemeden önce kalan toprak parçacıklarını durulamak için bu organları musluk suyuyla hassas bir şekilde yıkayın.
- Yaprak çöpü ile ilişkili MH bitkileri ekstra dikkat gerektirir; Ayrışan malzemeye hifleri aracılığıyla bağlı organları dikkatlice toplayın, bu organları bağlı yapılardan çekmekten kaçının ve bu parçalar oldukça hassas olduğu için dikkatlice toplayın. Bu tür bağlantılara sahip yapıları koruyun ve çöpü analiz için de toplayın.
- Görüntüleme tekniklerini kullanarak taze malzemeyi analiz etmeyi tercih ediyorsanız, numuneleri yeterli neme sahip, yeterli su buharlaşan ve bitkiyi nemlendiren kapalı plastik torbalarda saklayın ve aşırı suyun numunelerle temas etmesini önleyin. Onları derhal laboratuvara taşıyın ve numuneleri toplandıkları gün analiz edin, analiz ederken numunelerin hala korunup korunmadığına dikkat edin.
- Fiksatörleri iyi kapatılmış kaplarda toplama alanına taşıyın. Işık mikroskobu (LM) ve taramalı elektron mikroskobu (SEM) için toplandıktan sonra aşağıdaki fiksatörlerden herhangi birinde örnekleri hızlı bir şekilde sabitleyin: % 10 nötr tamponlu formalin (NBF14, Tablo 1) veya Karnovsky'nin çözeltisi (modifiyeedilmiş 15, Tablo 2). Karnovsky'nin çözeltisi, tarifi Tablo 3'te açıklanan 0.2 M fosfat tamponu15 ile hazırlanabilir.
- İletim elektron mikroskobu (TEM) ile analiz için, bir damla glutaraldehit-sodyum kakodilat tamponu (modifiyeedilmiş 16, Tablo 4) içinde 4-3 mm kalınlığındaki numuneleri 1-2 mm kalınlığında daha küçük bölümlere ayırın. Damlanın dışında kesilmiş kenarları atın. Bölümleri, numunelerin hacminden 10 kat daha fazla fiksatif hacme sahip bir toplama tüpüne derhal aktarın, çünkü bu bir katkı fiksatifi (yani, molekülleri kimyasal olarak sabitlenmiş proteinlere eklenir16).
DİKKAT: Tarif edilen üç fiksatif oldukça toksiktir. Özellikle sahada kullanımları sırasında solumaktan kaçının. Tüm fiksatörleri eldiven kullanarak bir duman davlumbazında hazırlayın. Kakodilat ve asitleri karıştırmayın, çünkü arsenik gazı oluşabilir16. - Sabit numuneler fiksatif içinde yüzerse, bu bitki dokularında gazın varlığını gösterir. Hava ve diğer gazlar, fiksatifin tüm numuneye nüfuz etmesini önler2. Gazı, daha küçük parçalar halinde yeniden örnekleyerek ve tüm numuneler çözeltinin dibine batana kadar bir vakum pompası (-300 ila -400 inHg basınç) kullanarak dokulardan çıkarın17. Pompa tarafından uygulanan aşırı basınç numunelere zarar verebileceğinden dikkatli olun.
- Karnovsky'nin çözeltisinde en az 48 saat veya% 10 NBF'den sonra, numuneleri 0.2 M PB'de yıkayın (Tablo 3) ve% 10,% 30,% 50 ve son olarak% 70 etanol serisi ile dehidre edin. Hassas numuneler için, her konsantrasyonda 30 dakika boyunca dehidratasyon; daha büyük numuneler için, 1 saat veya daha uzun süre dehidratasyon.
NOT: %70 etanol çözeltisi, numunelerin depolanması için ideal ortamdır. %70 etanoldeki numuneler yıllarca oda sıcaklığında saklanabilir. Bitki materyalini fiksatörlerde uzun süre saklamayın, çünkü sabitleme maddelerinin çıkarılması sabitleme2'den sonra önemli bir adımdır. - Postfiksasyona geçmeden önce örnekleri glutaraldehit-kakodilat içinde 4 ° C'de saklayın (adım 9.1).
| %10 nötr tamponlu formalin (NBF)14 | |
| 1. adım | 80 mL damıtılmış suya 10 mL% 37-40 formaldehit çözeltisi ekleyin |
| adım 2 | 0.4 g sodyum fosfat monobazik monohidrat ekleyin (NaH2PO4 · H2O) çözeltiye |
| 3. adım | 0.65 g sodyum fosfat dibazik, susuz (Na2HPO4) ekleyin |
| adım 4 | hacmi 100 mL'ye kadar oluşturur |
Tablo 1:% 10 nötr tamponlu formalin tarifi 14.
| Karnovsky'nin çözümü (modifiyeedilmiş 15) | |
| 1. adım | 60-70 °C'de 20 mL damıtılmış suda |
| adım 2 | 0.8 g paraformaldehit ekleyin (% 4 w / v elde etmek için), karıştırın |
| 3. adım | 1-4 damla% 40 NaOH ekleyin ve çözelti netleşene kadar karıştırın |
| adım 4 | soğutun ve 30 mL 0,2 M fosfat tamponu pH 7,2 ekleyin (Tablo 3) |
| adım 5 | %1 glutaraldehit elde etmek için 0,1 M PB'de (pH 7,2) %25 glutaraldehit seyreltin (son hacim: ~60 mL) |
| adım 6 | 100 mL'ye kadar fiksatif yapana kadar adım 4'te elde edilen çözeltiye% 1 glutaraldehit (adım 5) ekleyin |
Tablo 2: Karnovsky'nin çözüm tarifi (değiştirilmiş15).
| 0,2 M fosfat tamponu (PB) pH 7,2 | |
| 1. adım | 400 mL damıtılmış suya 14.196 g sodyum fosfat dibazik, susuz (Na2HPO 4) ekleyin |
| adım 2 | 13.8 g sodyum fosfat monobazik monohidrat ekleyin (NaH2PO4· H2O) |
| 3. adım | çözelti netleşene kadar karıştırın |
| adım 4 | Damıtılmış su ile son hacmi 500 mL'ye ayarlayın |
| adım 5 | pH'ı 7,2'ye ayarlayın |
| adım 6 | 0,1 M PB için 1:1 oranında seyreltin |
Tablo 3: 0.2 M fosfat tampon tarifi.
| %3 glutaraldehit 0.2 M sodyum kakodilat tamponu (modifiye16) | |
| 1. adım | 0.2 M kakodilat tamponu: 100 mL damıtılmış suya 4.28 g sodyum kakodilat trihidrat ekleyin |
| adım 2 | pH'ı 7,2'ye ayarlayın |
| 3. adım | adım 2'de çözeltinin 25 mL'sine 12 mL% 25 glutaraldehit ekleyin (0.2 M kakodilat tamponu pH 7.2) |
| adım 4 | hacmi damıtılmış su ile 100 mL'ye kadar yükseltin |
Tablo 4: %3 glutaraldehit 0.2 M sodyum kakodilat tampon tarifi (modifiye16).
2. Sabit ve sabit olmayan malzemedeki organların yüzey analizi
- Organlarda, özellikle yeraltı organlarında ve yaprak çöpü ile temas halinde olanlarda yüzeysel hifleri analiz etmek için, analiz edilen örneklere bağlı olarak, diseksiyon mikroskobunda (stereomikroskop) 7.5x veya daha yüksek bir büyütmede sabit veya taze materyal gözlemleyin.
- Fiksatif,% 70 etanol (içinde depolanmışsa) veya taze malzeme durumunda musluk suyuna batırılmış numuneleri görselleştirin. Diseksiyon mikroskobundan gelen doğrudan ışığı önleyin, çünkü numuneleri kurutabilir ve zarar verebilir.
- Yüzeysel hifalar ve rizomorflar tarafından yönlendirilen örneklerdeki ilgi alanlarını arayın. Yüzeysel rizomorflara sahip alanlar içeren örnekleri seçin, çünkü bunlar köklerde ve gövdelerde kortikal hücreler içindeki pelotonları ve hifa bobinlerini görselleştirmek için kesitlenebilir.
- Seçimden sonra, örnekler henüz düzeltilmemişse 1.6 ve 1.9 adımlarını izleyin. İstenirse, bölüm 3'te açıklandığı gibi, sabitlemeden bir ışık mikroskobu kullanarak taze örnekleri fotoğraflayın.
- Organ yüzeylerinden, rizomorflardan ve gözlemlenen diğer yapılardan görüntü toplamak için stereomikroskopla birleştirilmiş kamerayı kullanın. Bu gibi durumlarda, malzemeyle iyi kontrast oluşturacak yeterli bir arka plan rengi ayarlayın ve mümkünse, daha az pürüzlü bir yüzeye (örneğin, kağıt) sahip bir arka plan malzemesi seçin.
3. Bitki organlarının serbest el bölümleri
NOT: Bitki organlarının serbest bölümleri, özellikle küçük ve ince yapılar için zor olabilir. Bununla birlikte, fungal endofitli dokuların bu bölümleri, bazı durumlarda, ince bölümlere kıyasla daha iyi sonuç verebilir.
- Taze veya sabit numuneleri keskin bir bıçakla kesitleyin, mümkün olduğunca ince kesin ve hemen su (tazeyse) veya% 70 etanol (sabitse) içeren küçük bir Petri kabına yerleştirin. Bölümleri zarar vermeden manipüle etmek için küçük bir boya fırçası kullanın.
- Daha zorlu malzemelerin (yani küçük, ince, esnek organlar) bölümlenmesini kolaylaştırmak için, numuneyi polistiren veya Cecropia yaprak sapı gibi bir yapıda çevreleyin. Numuneyi yerleştirmek için desteği oyun ve numunenin ve desteğin ince bir bölümünü tamamen yapın.
- Numuneleri bölüm 6'da açıklandığı gibi sabitleyin ve monte edin.
4. Bitki örneklerinin reçineye gömülmesi ve kesitlenmesi
- Ayrıca, numunelerin boyutuna ve bileşimine bağlı olarak, %80, %96 ve %100 etanolde %70 etanol içinde %2 etanol içinde depolanan numuneleri 30 dakika ila 2 saat arasında kurutun.
- Üreticinin talimatlarına göre bir glikol metakrilat (GMA) reçine kiti kullanın. Daha fazla bilgi için Gerrits ve Horobin (1996)18'e bakınız. Filtreleme ve gömme adımlarını buna göre izleyin.
DİKKAT: GMA reçinesi toksiktir, alerjik reaksiyona ve cilt, göz ve mukoza tahrişine neden olabilir. Reaktifleri bir duman başlığında kullanın ve eldiven kullanın. - Gömme için numune boyutuna göre seçilen polietilen kalıplama tepsileri kullanın (ör. daha büyük numuneler için 13 mm x 19 mm x 5 mm, daha küçük numuneler için 6 mm x 8 mm x 5 mm). Kalıbın içinde istenen numune oryantasyonuna dikkat edin ve yönlendirmeye yardımcı olması için bir iğne kullanın.
- Tamamen katılaşana kadar, tercihen oda sıcaklığında, polimerizasyon için bırakın. Sertleştirme işlemi genellikle birkaç saat sürer, ancak blokların ertesi gün çözülmesi önerilir. Polimerizasyondan sonra, reçine bloklarını kalıplardan dikkatlice ayırın ve blok eğriliğini önlemek için blokları mümkün olan en kısa sürede takmaya devam edin.
- Tutturulacak reçine bloğunun yüzünü zımparalayarak düz bir yüzey oluşturun. Reçine bloğunu, orta viskoziteli sıvı bir siyanoakrilat yapıştırıcı ile ahşap bir küboide (2 cm x 2 cm x 3 cm önerilir) yapıştırın (bkz. Kesitlemeden ödün vermemek için reçinenin tamamen takılı olduğundan emin olun.
- Aşağıda açıklandığı gibi döner bir mikrotomda bölümleme yapın.
DİKKAT: Mikrotom bıçakların bıçakları çok keskindir ve kazalara neden olabilir. Tüm güvenlik önlemlerini izleyerek bunları ele aldığınızdan emin olun. Bıçağa yaklaşmadan önce (örneğin, bloğu değiştirmek, reçineyi nemlendirmek için), kaba el çarkını kilitleyin ve bıçak güvenlik kapağını yerleştirin. Tek kullanımlık bıçakları uygun durumlarda saklayın. Bıçakları değiştirirken son derece dikkatli olun.
NOT: GMA reçine18'i kesitlemek için farklı tipte bıçaklar (örneğin, tek kullanımlık veya sabit; cam veya çelik) kullanılabilir. Bölümlerin kalitesi, bıçağın ne kadar keskin olduğuna bağlıdır. Bıçağın iyi tutturulmuş olduğundan ve hareket edemediğinden emin olun. Tek kullanımlık bıçakların daha iyi kesitleme elde etmek için düzenli olarak değiştirilmesi gerekebilir.- Ahşap küboidi blok tutucuya sıkıca takın. Oryantasyon vidalarını kullanarak kesitleme yönünü ayarlayın ve bıçak eğimini kullanarak bıçağın yeterli açısını sağlayın. Bölümlerin kalınlığını seçin; GMA bölümleri inceltildiğinde cam slayta daha uygun şekilde yapıştığından, kırpma için daha kalın bir ayar ve seçilen bölümler için daha ince bir ayar kullanın; bitki dokuları için önerilen kalınlık 5-8 μm'dir.
- Başlamadan önce, gerekirse odayı soğutun, çünkü daha yüksek sıcaklıklar bölümlerin kalitesini kötüleştirir. Bölümleme için aşağıdakileri hazırlayın: damıtılmış su içeren bir beher, bir sıcak plaka, boya fırçaları (en az iki), ince noktalı cımbız, bir Pasteur pipeti, cam slaytlar, filtre kağıdı (veya kağıt mendil) ve bir kalem (kesitlenen numuneleri tanımlamak için).
- Sıcak plakayı 50 ° C'ye ayarlayın ve beheri üzerine yerleştirin. Sıcak plakanın alanına bağlı olarak ısıtmadaki farklılıklara dikkat edin (genellikle, orta alan kenarlardan daha fazla ısınır; suyu ortada ısıtın, tercihen).
- Bir cam slayt seçin, bir kalemle tanımlayın ve ılık damıtılmış suyu slayt yüzeyinin her tarafına pipetleyin. Gerekirse, su ve cam arasındaki gerilimi kırmak için bir çözelti (örneğin, deterjan ve su veya% 70 etanol) kullanın, böylece tüm slayt eşit şekilde kaplanır. Bazı sürgü tipleri yeterli kesit aderansı elde etmek için %70 etanol ile önceden temizlenmelidir.
- Reçine bloğunun yüzünü bıçak bıçağına doğru kademeli olarak ilerlederek başlayın. Önce bloğu ilerletmeden bölümlemeyi denemeyin, aksi takdirde ekipman ve blok hasar görebilir. Gerekirse, bloğu daha yüksek bir kalınlık (10 μm ve üstü) kullanarak kesin.
- Uygun bir bölüme yaklaşırken, el çarkı ile sağlam bir tek yönlü hareket yapın, böylece bölüm bir kerede yapılır. Reçine nemini kontrol edin. Bölümleme sırasında, kıvrılma bölümlerinde bir sorun varsa, damıtılmış suya batırılmış bir boya fırçası kullanarak kesilen bloğun yüzünü düzenli olarak nemlendirin. Fazla suyu bir kağıt mendille çıkarın.
- Bir çift ince nokta cımbızla, elde edilen bölümü kaydırağın üzerindeki suya yerleştirin. Su ile temas ettiğinde, GMA reçinesi gerilir. Gerekirse, bölümleri yavaşça açmak ve germek için bir boya fırçası kullanın. Bıçağı sürekli reçine kalıntılarından uzak tutmak için başka bir boya fırçası kullanın. Bıçağın ıslanmasını önlemek için boya fırçaları arasında geçiş yapmayın.
- Slaytta istenen tüm bölümleri sıraya koyduktan sonra, slaytın alt yüzünü kurutun ve sıcak plakanın üzerine yerleştirin. Slaytın üstündeki fazla suyu, bir filtre kağıdıyla hafifçe delerek çıkarın (isteğe bağlı). Su slayttan buharlaştığında bölümler yapışacaktır. Bölümlerin aşırı sıcaktan zarar görmesini önlemek için slaytları çok uzun süre bırakmayın.
- Slaytları toz ve güneşten uzakta bir slayt kutusunda saklayın ve boyama ve diğer prosedürler için kullanın. Slaytlar birkaç yıl saklanabilir.
5. Bitki örneklerinin dondurulması ve kriyostat ile bölümlenmesi
NOT: Biyolojik dokunun kriyoseksiyonunda göz önünde bulundurulması gereken temel husus, numuneleri dondururken buz kristali oluşumundan kaynaklanan hasarı azaltmaktır. Kriyoproteksiyon genellikle gliserol veya sakkaroz19,20 gibi kimyasal olarak inert çözeltiler infüze edilerek yapılır.
- Örnek bölümlemeden bir gün önce aşağıdaki adımları gerçekleştirin.
- 200 mL 0,1 M PB elde etmek için 100 mL 0,2 M PB (Tablo 3) 100 mL damıtılmış suda seyreltin. 0,1 M PB'de %10, %20 ve %30 sakkaroz çözeltileri hazırlayın (örneğin, %10'luk bir çözelti için 20 mL tampona 2 g sakkaroz ekleyin).
- Taze numuneler için bunları 30 dakika boyunca 0,1 M PB'de yıkayın. Fiksatif numuneler için, fiksatifi 30 dakika boyunca hazırlamak için kullanılan aynı tamponda yıkayın. %70 etanol içeren numuneler için, bunları %50 ve %30 etanol içinde nemlendirin ve her çözeltide 1 saat boyunca 0,1 M PB'de yıkayın.
- Numuneleri oda sıcaklığında %10 sakarozda 2 saat, %20 sakarozda 2 saat ve %30 sakarozda 2 saat inkübe edin. Daha sonra, 4 ° C'de% 30 sakkarozda gece boyunca inkübe edin (veya en az 3 saat boyunca; maksimum süre 48 saattir).
- Bölümleme gününde, 0.1 M PB'de% 40 ve% 50 sakkaroz hazırlayın; sakkaroz çözeltilerini 12 saatten daha önceden hazırlamayın. Her sakkaroz konsantrasyonunda, 4 ° C'de 2 saat boyunca inkübe edin.
- Küçük kalıplara gömmek için, bir OCT bileşiği tabakası (numuneleri gömmek ve dondurmak için kullanılan optimum kesme sıcaklığı ortamı) yapın ve dondurmak için -20 ° C'de tutun. Kalıplar düzenli histolojik kalıplar olabilir, ancak blokların çözülmesini kolaylaştırmak için kağıt veya infoil olanlar çerçeve ve yapışkan bant olarak küçük bir küboid kullanılarak yapılabilir.
- OCT bileşiğinin alt tabakası kalıplarda dondurulduktan sonra, bir kriyostat odasının içinde çalışın (yaklaşık -27 ° C). % 50 sakkarozda inkübe edilmiş numuneleri, kalıplara, kesitlenecekleri yöne yerleştirin. Bir küboid bloğun üst yüzü genellikle daha iyi bir kesitleme yüzüdür. Numunelerin yerleştirildiği kalıbı işaretleyin, böylece blok kolayca kesilebilir ve doğru yönlendirme korunabilir.
- Numuneleri OCT bileşiğinde çevreleyin ve numunelere dokunan herhangi bir hava kabarcığını patlatın. Onları -20 ° C'de dondurun. Bloklar tamamen donmuşken, kriyostat odasının içine yerleştirin (yaklaşık -27 ° C). Her birini yalnızca kullanmadan önce çözün ve bloğun içindeki numune yerini gösteren işaretlere dikkat edin.
- OCT bileşiği bir bıçakla kolayca kesildiğinden, blokları mandrenler üzerine yerleştirmeden önce uygun şekilde kesin. Kriyostat mandrenine bir miktar OCT bileşiği koyun ve bloğu üst yüz kesitlenecek şekilde konumlandırın. Daha küçük alanlara sahip yüzler daha iyi bölümler sağlar. Blok aynaya iyice bağlanana kadar bekleyin ve bölüme başlamadan önce test edin.
- Kandreti ayna tutucusuna sıkıca yerleştirin. Oryantasyon vidalarını kullanarak kesitleme yönünü ayarlayın. Bıçağın eğimini kullanarak bıçağın açısını ayarlayın. Bölümlerin kalınlığını seçin. Numuneler normal reçine kesitlerinden daha kalın kesitlenebilir. 5-20 μm aralığındaki kesitler başarılı bir şekilde elde edilir, daha kalın kesitlerin yapılması daha kolaydır (daha az kıvrılma ve yapıların daha az hasar görmesi).
- Donmuş bloğun yüzünü bıçak bıçağına doğru ilerletin. Bunu yapmadan bölümlemeyi denemeyin, aksi takdirde blok aynadan ayrılabilir ve hasar görebilir. Gerekirse, bloğu daha yüksek bir kalınlık (10 μm ve üstü) kullanarak kesin.
- Uygun bir bölüme yaklaşırken, yuvarlanma önleyici plakayı (yani, bölümü tutacak şeffaf bir plaka) bıçağın üzerine yerleştirin ve el çarkı ile sağlam bir tek yönlü hareket yapın, böylece bölüm bir kerede yapılır. Kıvrılma problemleri, yuvarlanma önleyici plakanın ayarlanması gerekiyorsa (genellikle bıçağa göre ayarlanabilir) veya bıçakta döküntü varsa ortaya çıkabilir. Kalıntıları gidermek için bıçağı bir boya fırçasıyla sürekli temizleyin.
- Özel slaytlar kullanın, böylece dilimize slaytlar (ticari veya aseton 21'de% 2 aminoalkilsilan ile hazırlanmış) veya damıtılmış su 21 veya%0.2 jelatin içinde 500 μg / mL poli-L-Lizin ile hazırlanan slaytlar (bkz. ayrıntılar21) gibi bölümler kolayca yapışır. Slaytları oda sıcaklığında tutun.
- Bölümü bir slayda yapıştırmak için, yuvarlanma önleyici plakayı kaldırın ve slaytın bölüme hızla dokunmasını sağlayın. Slayt oda sıcaklığında olduğundan, bölüm hemen erir ve slayda yapışır. Slaytın işlenmiş yüzünü, bıçağın üstünde veya yuvarlanma önleyici plakanın iç yüzünde kalabilecek bölüme çevirmeye dikkat edin. Bölümlerin kıvrılmasını önlemek için, plaka kaldırılır kaldırılmaz bu adımı hızlı bir şekilde gerçekleştirin ve bölümü bükmemeye dikkat edin.
- Yeni bölümler eklenecekse, slaytı kriyostat odasının dışında (oda sıcaklığında) bırakın. İstenen tüm bölümleri slayta yapıştırdıktan sonra, kriyostat odasının içinde veya dondurucuda (-20 ° C veya altında) saklayın. Slaytları neme maruz bırakmayın. Bunları bir slayt kutusunda tutun ve slaytları kurşun kalemle tanımlamayı unutmayın.
NOT: OCT slaytları ve blokları çok uzun olmasa da -20 °C'de saklanabilir. Daha iyi sonuçlar elde etmek için, slaytları ve blokları birkaç gün içinde kullanın.
6. Işık mikroskobu için bitki kesitlerinin ve endofitlerin boyanması
NOT: Bitki kesitleri için birçok leke türü kullanılabilir. Endofitik mantarları ve bitki dokularını farklı şekilde boyamak zordur. Bir boyama prosedürü olmamasına rağmen, mantar yapılarını işaretlemek için bir yöntem bölüm 7'de (buğday tohumu aglutinin konjugatı ile floresan) sunulmaktadır. Serbest el bölümleri (bölüm 3'te açıklanmıştır), reçine bölümleri (bölüm 4) ve kriyoseksiyonlar (bölüm 5) boyanabilir, ancak fenol ve alkol bazlı lekeler bu örnekler için zordur, çünkü GMA reçinesi ve OCT bu durumlarda slayda yapışmayı kaybeder.
- Bitki örnekleri için aşağıdaki olağan boyama yöntemlerinden birini kullanın veya birleştirin.
- Toluidin mavisi O22,23, bitki kesitlerinin genel boyanması için çok uygulanan bir yöntem. Doku türlerine ve türlerine bağlı olarak 0.1 M fosfat (pH 6.8) veya 0.09 M sitrat tamponunda (pH 4.5-4.8) % 0.05 toluidin mavisi O çözeltisi hazırlayın. GMA reçine kesitlerini bir slayt boyama kavanozu kullanarak veya birkaç slayt lekelenmişse bölümlerin üzerine bazı damlalar yerleştirerek 2-10 dakika boyunca inkübe edin. Kuluçkadan sonra damıtılmış su veya tamponla dikkatlice yıkayın ve slaytları suyla monte edin veya adım 6.3'te açıklandığı gibi kalıcı slaytlar üretmek için sıcak bir plaka üzerinde kurutun.
- Lugol reaktifi2 , nişasta varlığını gösterir. Damıtılmış suda %5 iyot (I2) ve %10 potasyum iyodür (KI) çözeltisi hazırlayın. Lekeleri 2 dakika boyunca, slaytın üzerine birkaç damla ekleyerek ve daha sonra damıtılmış suyla yıkayın. Bu histokimyasal test genellikle geçici slaytlara uygulanır.
- Sudan III, IV ve siyah B24,25 farklı lipitler için leke. % 70 etanol içinde% 0.3'lük bir Sudan (III, IV veya siyah B) çözeltisi hazırlayın, kaynayana kadar ısıtın ve soğumaya bırakın. Supernatant'ı kullanın, filtreleyin ve bölümleri kapalı bir Petri kabında 15-30 dakika boyunca inkübe edin. Bölümleri% 70 etanol ve damıtılmış su ile dikkatlice yıkayın. Slaytları suyla monte edin (genellikle sadece geçici slaytlara uygulanır).
NOT: Sudan alkol bazlı bir boya olduğundan, serbest bölümler için daha uygundur. GMA reçine kesit boyamasını genellikle slayttan ayrıldıkları için dikkatlice yapın.
- Geçici slaytlar için, bölümleri suya veya gliserine monte edin ve daha sonra gözlemleyin. Biraz daha uzun süre korumak için kapak kapağını oje ile kapatın.
- Kalıcı kızaklar için, bölümleri sentetik reçinelerle monte edin (örneğin, hızlı montaj ortamı, Malzeme Tablosuna bakınız). Montaj ortamından birkaç damla damlatın (kapak kaymasından taşabilir), kabarcıkları önlemek için kapak kaymasını dikkatlice yerleştirin ve slaytı tamamen kuruyana kadar kapak kaymasına bastırmak için giysi mandalları kullanın. Kurutulmuş montaj ortamının fazlalığını bir tıraş bıçağı ile çıkarın.
7. Buğday tohumu aglütinine konjuge edilmiş bir florokromun floresan ve konfokal mikroskopide uygulanması
NOT: Bu yöntem serbest bölümlere (bölüm 3'te açıklanmıştır), reçine bölümlerine (bölüm 4) ve kriyoseksiyonlara (bölüm 5) uygulanabilir. Kriyoseksiyonlar konfokal mikroskopi amaçları için yeterli olabilir, çünkü reçine kesitlerine kıyasla daha kalın örnekler sağlanabilir, ancak serbest olanlar kadar kalın değildir. Buğday tohumu aglutininine konjuge edilmiş bir florokrom (WGA, bakınız Malzeme Tablosu), floresan mikroskobu26'da mantar görüntülemeye uygulanır. Konfokal mikroskop gerekli değildir, ancak bitki yapılarının net üç boyutlu görüntülerini sağlayabilir27.
- 0.1 M PB28'de 0.2 mg/mL WGA-florokrom konjugat çözeltisi hazırlayın (pH 7.2, adım 5.1.1 ve Tablo 3'ü kontrol edin). 0.1 M PB'de (pH 7.2) % 1'lik bir Calcofluor Beyazı çözeltisi hazırlayın. Bölümler doğrudan onlarla inkübe edildiğinden, bu çözeltilerden az miktarda hazırlayın.
- Cam slaytlardaki bölümleri WGA-florokrom konjugat çözeltisi29'da 30 dakika boyunca inkübe edin, bölümleri örtmek için yeterli hacim kullanın, ardından 0,1 M PB'de yıkayın.
- Kalkoflor çözeltisindeki bölümleri, montaj ortamı olarak yeterli hacim kullanarak inkübe edin. Çözelti gözlem süresi boyunca korunabilir.
- Slaytların üzerine örtüler koyun ve aşağıdaki filtreleri kullanarak konfokal mikroskopta veya floresan ışık mikroskobunda gözlemleyin: TC / GFP (uyarım: 470-440, emisyon: 525-550, Malzeme Tablosundaki WGA-florokrom için - mantar hücresi duvarı floresanları bu filtrealtında yeşil 29) ve DAPI (uyarma: 358, emisyon: 463, Calcofluor White için)30.
NOT: Konfokal mikroskop27'deki Z serisi fonksiyonu kullanılarak üç boyutlu görüntüler elde edilebilir.
8. Bitki organlarının taramalı elektron mikroskobu
- Numuneleri sabitledikten sonra, dehidrasyon gerçekleştirdikten ve% 70 etanol içinde (bölüm 1) sakladıktan sonra, bir olasılık, gerekirse SEM analizi için istenen herhangi bir yüzeyi (örneğin, iç dokular, yumurtalık yapısı) ortaya çıkarmak için numuneleri kesmektir. Keskin ve yeni bir tıraş bıçağı kullanın ve SEM'de bu alanların hasarlı bir görünümünü önleyerek tek yönlü bir hareketle kesikler yapın. Gerekirse, numuneleri seçmek için bir stereomikroskop kullanın ve numune boyutlarını belirlemek için metal saplamalar alanını göz önünde bulundurun.
- Etanolik bir seride SEM için daha fazla dehidrat numunesi: mutlak etil alkolde% 80,% 96 ve 2x (% ≥99.8). Her konsantrasyonda 30 dakika boyunca küçük ve hassas numuneleri ve 1 saat boyunca daha büyük ve daha yoğun numuneleri saklayın.
- Sonraki adımlar için numuneleri düzenlemek üzere kağıt mendil kullanarak küçük zarfları katlayın, daha büyük numuneler zarf olmadan işlenebilir. Bir harf veya sayı yazarak zarfları bir kalemle tanımlayın ve her birindeki tüm örneklerin bir günlüğünü tutun. Numuneleri uzun süre olmasa da mutlak etanolde tutun ve mümkün olan en kısa sürede adım 8.4'e geçin.
- Kritik nokta (CP) kurutma için devam edin. CP kurutucuyu standart çalışma prosedürlerine göre çalıştırın. Numuneleri bir basınç odasındaki mutlak etanol (ara sıvı) içine yerleştirin. CO2 kritik noktasında (31 °C, 7,3 x 106 Pa) ara sıvı geçiş sıvısına (sıvı karbondioksit) çözünür ve numunelerkurutulur 31.
- CP kuruduktan sonra, numuneleri mümkün olan en kısa sürede bir kurutma kabında, örneğin silika jel içeren kapalı bir şişede saklayın. Atmosferik nem, yeniden emilirse numuneleri tahrip edebilir31.
- Numuneleri monte etmek için metal saplamalar kullanın. Montajdan önce, saplamaları manipüle etmek için eldivenleri giyin, herhangi bir yağı gidermek için 5 dakika boyunca asetona batırın ve kurumasını bekleyin. Numuneleri saplama üzerine sabitlemek için iletken çift taraflı karbon yapışkan bant ve SEM görüntülerinde yukarıdan görmenin mümkün olan tek perspektif olduğunu akılda tutarak numunelerin konumlandırılmasına yardımcı olacak bir stereomikroskop kullanın.
- Numuneleri ince noktalı cımbızla manipüle edin, cımbızla dokunulan numune parçası genellikle hasar gördüğünden dikkatli olun, bu nedenle ilgi alanlarından (örneğin, bantla temas eden alanlar) uzağa yerleştirilmiş parçalara dokunmayı deneyin. Saplamaları, silika jel ile kapalı bir Petri kabında numunelerle koruyun. En kısa sürede adım 8.8'e geçin.
- Numunelerin yüzeyinde, inert bir gazın, sıklıkla argon31'in düşük basınçlı bir atmosferinde bir metal tabakası, genellikle altın veya platin biriktirmek için bir püskürtme kaplayıcı kullanın. Püskürtmeli kaplayıcı kullanırken standart çalışma prosedürlerini izleyin. Kaplama kalınlığı, numunelerin topografyasına bağlıdır, genellikle 15-40 nm32 arasındadır.
- Kaplanmış saplamaları silika jel ile kapalı bir Petri kabında tutun ve silika jelin nemi koruması şartıyla, numuneler haftalarca bu şekilde saklanabilir. Örnekleri analiz etmek için taramalı elektron mikroskobu kullanın. Vakumdaki örnekler bir elektron demeti tarafından vurulur ve bu etkileşimden kaynaklanan sinyallerin emisyonu görüntü31 olarak yorumlanır. Taramalı elektron mikroskobunun çalıştırılmasıyla ilgili ayrıntılar için Jeffree ve Read (1991)31 ve Bozzola ve Russell (1999)32'yi okuyun.
- Saplamaları tekrar kullanmak için, yapışkan bandı çekin ve tel yünü ile ovalayın. Musluk suyunda yıkayın, mutlak etanol içine daldırın ve bileşen metalin oksidasyonunu önleyerek yeterince kurutun.
9. İletim elektron mikroskobu
- Adım 1.7 ve 1.10'da açıklandığı gibi glutaraldehit-kakodilat tamponlu ön ek örnekleri. 12-24 saatlik ön fiksasyondan sonra, numuneleri 10 dakika boyunca 0,2 M kakodilat tamponunda (pH 7,25) 3 kat yıkayın. 0.2 M kakodilat tamponunda% 1 ozmiyum tetroksit (OsO4) ile, karanlıkta, oda sıcaklığında 12 saat boyunca postfiksasyon gerçekleştirin. 3x'i damıtılmış suyla 5 dakika yıkayın.
DİKKAT: Kakodilat ve osmiyum tetroksit oldukça toksiktir ve solunmamalıdır. Bunları, ilgili güvenlik bilgi formlarını takip ederek davlumbazlarda kullanın. - Numuneleri 10 dakika boyunca her konsantrasyonda 2x olmak üzere %30, %50, %70 ve %96 etanol ile dehidre edin. Daha sonra, her seferinde 15 dakika boyunca mutlak alkolde 3 kat dehidrate edin.
- Numuneleri hidrofilik akrilik reçinelere (bakınız Malzeme Tablosu) bir kez 1: 1 reçine + mutlak etanol ve 3x saf reçine ile her biri 8-12 saat boyunca sızın. Jelatin kapsüllerde polimerizasyonu 60 ° C'de tamamen katılaşana kadar (12 saat maksimum17) iletin.
- Reçine bloğu içindeki numunelerin oryantasyonunu yakından değerlendirin; bloğun üst kısmını bir tıraş bıçağı ile kesin ve numuneyi kesit alanında yoğunlaştıran piramidal bir şekil oluşturun. Elmas bıçaklı bir ultramikrotomda yarı ince kesitler (250-500 nm)33 elde edin ve birkaç damla su içinde cam slaytlara yerleştirin.
- Slaytları 60 °C'de sıcak bir plakada tutun. Bölümleri 6.1.1 adımında olduğu gibi toluidin mavisi O ile lekeleyin ve lekenin tamamen kurumasını bekleyin. Musluk suyuyla dikkatlice yıkayın. Dört kadran çizerek ve analiz için en uygun çeyreği seçerek elde edilen bölümü değerlendirin.
- Bloğu kesin, böylece piramidal şekil seçilen kadranı bloğun üst yüzünde yoğunlaştırır. Ultra ince kesitler üretin (50-100 nm)33,34. Kalınlık, bölümlerin girişim rengine göre değerlendirilir: yaklaşık 70 nm olan bölümler gümüş-altın, yaklaşık 100 nm altın ve yaklaşık 200 nm ile mavi34 görünür.
- Ultra ince kesitleri bakır ızgaralar kullanarak sudan toplayın ve aşağıda açıklandığı gibi uranil asetat ve kurşun sitrat ile kontrast boyama yöntemine geçin.
- Bir kurşun sitrat çözeltisi hazırlayın (Tablo 5) ve nihai çözeltiyi mikrosantrifüj tüplerinde her birinde 1 mL çözelti ile dondurun, sadece kullanımdan hemen önce çözün.
- Bir uranil asetat çözeltisi hazırlayın: 0.625 g uranil asetat [UO 2 (CH3COO)2] 25 mL'lik yakın zamanda kaynatılmış ve soğutulmuş damıtılmış suda çözün. Dondurucuda koyu renkli bir şişede saklayın.
DİKKAT: Kurşun nitrat yutulduğunda toksiktir. 1 N NaOH oldukça aşındırıcıdır. Uranil asetat radyoaktif ve toksiktir. Yutulmamalı, solunmamalı veya cilde temas etmemelidir. - Boyama yaparken, hazırlanan her iki reaktifi de filtre ünitelerine sahip ayrı 3 mL şırıngalara koyun (0,22 μm gözenek, bkz. Üzerinde sızdırmazlık termoplastik filmi ile baş aşağı çevrilmiş bir Petri kabı hazırlayın (bakınız Malzeme Tablosu) ve daha geniş bir kabın içinde, kenarlarında CO 232 için bir tuzak olarak NaOH peletleri bulundurun (bkz. Şekil 2).
- İlk damlayı atın ve filmin üzerine lekelenmiş her ızgara için bir damla uranil asetat ve üç damla damıtılmış su yerleştirin. Aynı şeyi kurşun sitrat ile yapın ve üç damla daha damıtılmış su ekleyin.
- Izgarayı (opak tarafı aşağıya, bölümlerin bulunduğu yerde) uranilde 30 dakika (değişken süre) boyunca inkübe edin. Damıtılmış su damlalarında 3 kat yıkayın, ızgarayı her seferinde parlak taraftaki filtre kağıdıyla nazikçe kurutun. Kurşun sitrat damlası (30 dakika) ile tekrarlayın ve yıkayın.
- En az 4 saat sonra, ızgaraları bir iletim elektron mikroskobunda analiz edin. Bu mikroskopta, bir elektron demeti vakumdaki bölümlerden geçer ve görüntü bir floresan ekrana yansıtılır. İletim elektron mikroskobunun çalıştırılması hakkında ayrıntılar için, Bozzola ve Russell (1999)32'yi okuyun.
| kurşun sitrat çözeltisi (TEM kontrast boyama için) | |
| 1. adım | Bir beheri infoil ile çevreleyin |
| adım 2 | 0.266 g kurşun nitratın [Pb(NO3)2] 6 mL'lik yakın zamanda kaynatılmış ve soğutulmuş damıtılmış suda çözülmesi |
| 3. adım | 2 dakika ajitasyon |
| adım 4 | 0.352 g trisodyum sitrat [Na3 (C6H5O7).2H2O] ekleyin (çözelti sütlü bir görünüm kazanmalıdır) |
| adım 5 | 15 dakika çalkalayın, beheri infoil ile kapatın ve çözeltiyi 10 mL'lik bir beher'e aktarın |
| adım 6 | 1,6 mL 1N NaOH ve 2,4 mL damıtılmış su ekleyin (çözelti yarı saydam olmalıdır) |
| adım 7 | Gerekirse, pH'ı 12'ye yakın ayarlayın |
Tablo 5: Kurşun sitrat çözeltisi tarifi.

Şekil 2: Kurşun sitrat ve uranil asetat çözeltileri ile kontrast boyama şeması . (A) Petri kaplarını, biri termoplastik film ile baş aşağı (ortada) hazırlayın, böylece damlalar üstüne, daha geniş bir filmin içine yerleştirilebilir. NaOH peletleri merkezi çanağın etrafındaki yerlerdir. (B) Uranil asetat damlaları U harfi olan dairelere yerleştirilir ve L. DW işaretli dairelerdeki kurşun sitrat damlaları damıtılmış su damlalarını gösterir. Izgaralar sütunda sırayla boyanır, böylece beş ızgara temsil edildiği gibi aynı anda boyanabilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
10. Orkide tohumlarının simbiyotik çimlenmesi
- Kirlenmeyi önlemek için tohumların simbiyotik çimlenmesinde kullanılan çözeltilerin ve tüm malzemelerin steril olduğundan emin olun. 121 ° C'de 20 dakika boyunca otoklavlayarak başlayın. Simbiyotik çimlenme adımları Şekil 3'te özetlenmiştir.
- Meyveleri ve tohumları, tohum kabuğunun sertliği ve kalınlığı göz önüne alındığında, meyveler için 10-15 dakika ve tohumlar için 7-10 dakika boyunca% 2 aktif klor içeren sodyum hipokloritçözeltisine batırarak yüzeysel olarak dezenfekte edin. İnce ve kırılgan tohumlar 1: 1 seyreltilmiş sodyum hipoklorit çözeltisine daldırılabilir. Daha sonra, hipoklorit çözeltisini çıkarmak için otoklavlanmış damıtılmış suda 3x yıkayın.
- Tohumları serigrafik kumaşta filtreleyerek geri kazanın ve çimlenme testlerine (tercihen) devam etmek için tohumları kullanın. Gerekirse, silika jel içeren cam şişelerin içindeki filtre kağıdı zarflarında saklayın, 4 ° C'de, şişeleri hermetik olarak kapatın ve sarılma filmi ile kapatın. Yıkama işleminin etkinliğini değerlendirmek için son yıkamadan patates dekstroz agarına (PDA, 39 g / L) birkaç damla su aktarın.
- Kültür ortamında tohum ekmeden önce, aşağıda açıklandığı gibi tetrazolium testi (isteğe bağlı) ile canlılıklarını değerlendirin35.
- Damıtılmış suda 1 mL% 10 sakkaroz içeren bir mikrosantrifüj tüpünde yaklaşık 10 mg tohumu, oda sıcaklığında (yaklaşık 25 ° C) 24 saat boyunca ışıkta inkübe edin.
- Sakkaroz çözeltisini bir mikropipetle çıkarın ve damıtılmış suya 1 mL% 1 tetrazolyum çözeltisi (trifeniltetrazolyum klorür) ekleyin. Karanlıkta 24 saat boyunca bir termoblokta 40 ° C'de inkübe edin.
- Tetrazolium çözeltisini bir mikropipetle çıkarın ve tohumları 2x damıtılmış suyla veya çözelti çıkarılana kadar yıkayın. Tüm sıvıları çıkarın. Gerekirse, tohumlar analiz edilmeden önce dondurucuda bir haftaya kadar (adım 10.3'te olduğu gibi) saklanabilir.
- Tohumları damıtılmış suda yeniden askıya alın ve hafif bir mikroskop altında analiz edin. Canlı tohumlar açık ila koyu kırmızı renk kazanırken, canlı olmayan tohumlar doğal renklerini korur.
- Orkide tohumlarının simbiyotik çimlenmesi için aşağıdaki uyarlanmış9 protokolünü uygulayın.
- Tohumları, yulaf ezmesi agar (OMA) kültür ortamı (2.5 g / L yulaf gevreği ve 7 g / L agar, pH 6) ile Petri kaplarına yerleştirilen otoklavlanmış filtre kağıdı diskleri (1-2 cm çapında) üzerinde inkübe edin.
- Petri kabının merkezinde, çimlenme prosedürü için seçilen izole mantardan miselyum içeren bir kültür ortamı parçasını (yaklaşık 1cm2) aşılayın. Petri kaplarını sarılma filmi ile kapatın ve mantar büyümesi için daha uygun olduğu için karanlıkta yaklaşık 25 ° C veya oda sıcaklığında inkübe edin.
- Çimlenme testi için negatif kontrol olarak tohumlu ve mantar aşılaması olmayan bazı yemekler hazırlayın.
- Çimlenme sonuçlarını, nicel ve nitel verileri toplayarak ve protokormları ve fideleri fotoğraflayarak haftalık olarak analiz edin. Tohumların ve protokormların gözlemi, çimlenmenin daha doğru bir şekilde değerlendirilmesi için bir stereomikroskop kullanılarak yapılmalıdır. Aşağıdan gelen bir ışık kaynağı kullanın, çünkü daha fazla kontrasta izin verir, bu da mantar miselyumunu protokormlardan daha kolay ayırt etmeyi mümkün kılar.
- Farklı gelişim aşamalarındaki örnekleri toplayın ve anatomik analizler için düzeltin (bölüm 1). Çimlenme sırasında tohumlarda, protokormlarda ve fidelerde mantar endofitlerini araştırmak için daha önce tarif edilen tüm görüntü analizlerini uygulayın (ışık mikroskobu - bölüm 4, 5 ve 6; konfokal ve floresan - bölüm 7; SEM ve TEM - bölüm 8 ve 9).
- Aşamaların Tablo 6'ya göre sınıflandırılmasını takiben nicel sonuçlar üretir. Aşamalar, mikoheterotrofik orkidelerden tohumların olağan gelişimini tanımlar. Verileri haftalık olarak toplayın ve gözlemlenen her aşamanın başlangıç tarihlerini içeren tablo oluşturun.
- Ek olarak, çimlenme yüzdesini ve oranını tahmin eden nicel veriler toplayın. En az 100 tohum sayın veya sayma alanlarını tanımlayın35. Petri kabı başına, standartlaştırılmış bir alana sahip sabit bölgelerden oluşan üç veya daha fazla sayma alanı ayırın ve haftalık olarak değerlendirin. Toplanan verileri büyüme endeksi (GI) denklemine göre hesaplayın:

burada N 0, aşama0'da sayılan tohumların sayısıdır, N 1, aşama1'i ifade eder ve aşama 6'ya kadar (N 6 olarak kayıtlı)36'ya kadar devam eder.
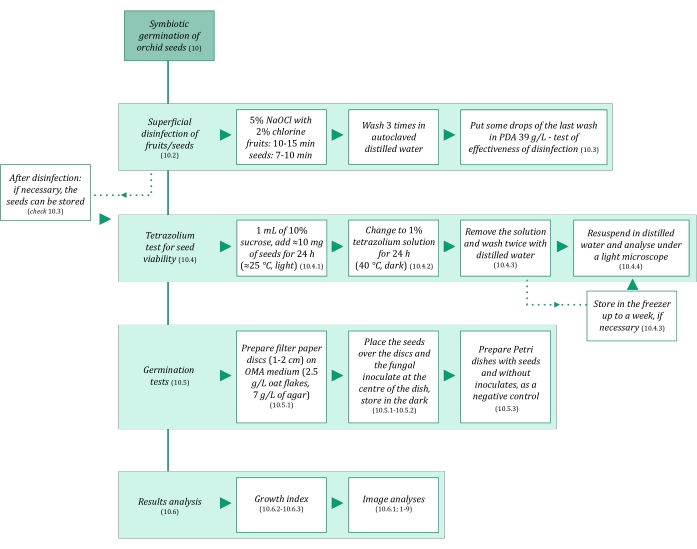
Şekil 3: Tohumların simbiyotik çimlenmesi metodolojisinin şematik özeti. Şemalar, protokoldeki ayrıntılı adımların göstergelerini sağlar. Kısaltmalar: OMA = yulaf ezmesi agar, PDA = patates dekstroz agar. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
| Çimlenme aşaması | Tarif |
| 0 | Çimlenme yok |
| 1 | Embriyonun şişmesi |
| 2 | Testa kopması |
| 3 | Emici tüyler gelişir |
| 4 | Kök projeksiyonu gelişir |
| 5 | Koruma terazileri (bracts) gelişir |
| 6 | İlk kökler gelişir |
Tablo 6: Çimlenme testlerinin periyodik analizlerine uygulanan protocorm gelişim aşamalarının tanımı. Otero ve ark.36'da açıklanan aşamalardan modifiye edilmiştir.
Sonuçlar
Bitki dokusunun sabitlenmesinin temel aşamalarını takiben, hücresel bileşenlerin ve dokuların morfolojisi, hacmi ve mekansal organizasyonu göz önüne alındığında, canlı duruma mümkün olduğunca benzer hücresel yapılar verir16. Kimyasal fiksasyondan sonra numunelerde bu özellikleri gözlemleyin (Şekil 4). Şekil 4C-F, ışık mikroskobu altında yeterince sabitlenmiş örnekleri temsil e...
Tartışmalar
Bitki anatomisi ve morfolojisindeki görüntü analizleri, yeraltı organları6,40, tohumların simbiyotik çimlenmesinin yapısal analizleri39 ve hava ve üreme yapıları 41 ile gösterildiği gibi, amaçları yerine getirmek ve mikoheterotrofik bitkiler ile vazgeçilmez mantar endofitleri arasındaki ilişkileri anlamaya yardımcı olmak için önemli bir potansiyele sahiptir. . Yapısal botanik, son on yılda bi...
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Yazarlar FAEPEX ve FAPESP'in (2015/26479-6) finansmanına teşekkür ediyor. MPP, yüksek lisans bursu için Capes'e teşekkür eder (süreç 88887.600591/2021-00) ve CNPq. JLSM, verimlilik hibeleri için CNPq'ya teşekkür eder (303664/2020-7). Yazarlar ayrıca LME (Elektron Mikroskobu Laboratuvarı - IB / Unicamp), INFABiC (Hücre Biyolojisine Uygulanan Fotonik Ulusal Bilim ve Teknoloji Enstitüsü - Unicamp) ve LaBiVasc (Vasküler Biyoloji Laboratuvarı - DBEF / IB / Unicamp) tarafından sağlanan ekipman ve yardıma erişime teşekkür eder; LAMEB (UFSC) ve Eliana de Medeiros Oliveira (UFSC) kriyoproteksiyon protokolüne katkılarından dolayı; TEM protokolüne katkılarından dolayı LME.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Acetone | Sigma-Aldrich | 179124 | (for SEM stubs mounting) |
| Agar-agar (AA) | Sigma-Aldrich | A1296 | (for seeds germination tests) |
| Calcofluor White Stain | Sigma-Aldrich | 18909 | fluorescent dye (detects cellulose) |
| Citrate Buffer Solution, 0.09M pH 4.8 | Sigma-Aldrich | C2488 | (for toluidine blue O staining) |
| Conductive Double-Sided Carbon Tape | Fisher Scientific | 50-285-81 | (for SEM) |
| Confocal Microscope | Zeiss | (any model) | |
| Copper Grids | Sigma-Aldrich | G4776 | (for TEM) |
| Critical-point dryer | Balzers | (any model) | |
| Cryostat | Leica Biosystems | (any model) | |
| Dissecting microscope | Leica Biosystems | (= stereomicroscope, any model) | |
| Entellan | Sigma-Aldrich | 107960 | rapid mounting medium for microscopy |
| Ethyl alcohol, pure (≥99.5%) | Sigma-Aldrich | 459836 | (= ethanol, for dehydration processes) |
| Formaldehyde solution, 37% | Sigma-Aldrich | 252549 | (for NBF solution preparation) |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128 | histological tissue fixative |
| Gelatin capsules for TEM | Fisher Scientific | 50-248-71 | (for resin polymerisation in TEM) |
| Gelatin solution, 2% in H2O | Sigma-Aldrich | G1393 | (dilute for slides preparation - OCT adherence) |
| Glutaraldehyde solution, 25% | Sigma-Aldrich | G6257 | (for Karnovsky’s solution preparation) |
| HistoResin | Leica Biosystems | 14702231731 | glycol methacrylate (GMA) embedding kit |
| Iodine | Sigma-Aldrich | 207772 | (for Lugol solution preparation) |
| Lead(II) nitrate | Sigma-Aldrich | 228621 | Pb(NO3)2 (for TEM contrast staining) |
| Light Microscope | Olympus | (any model) | |
| LR White acrylic resin | Sigma-Aldrich | L9774 | hydrophilic acrylic resin for TEM |
| Lugol solution | Sigma-Aldrich | 62650 | (for staining) |
| Metal stubs for specimen mounts | Rave Scientific | (for SEM, different models) | |
| Microtome | Leica Biosystems | manual rotary microtome or other model | |
| Oatmeal agar (OMA) | Millipore | O3506 | (for seeds germination tests) |
| OCT Compound, Tissue-Tek | Sakura Finetek USA | 4583 | embedding medium for frozen tissues |
| Osmium tetroxide | Sigma-Aldrich | 201030 | OsO4 (for TEM postfixation) |
| Parafilm M | Sigma-Aldrich | P7793 | sealing thermoplastic film |
| Paraformaldehyde | Sigma-Aldrich | 158127 | (for Karnovsky’s solution preparation) |
| Poly-L-lysine solution, 0.1% in H2O | Sigma-Aldrich | P8920 | (for slides preparation - OCT adherence) |
| Poly-Prep Slides | Sigma-Aldrich | P0425 | poly-L-lysine coated glass slides |
| Polyethylene Molding Cup Trays | Polysciences | 17177A-3 | (6x8x5 mm, for embbeding samples in GMA resin) |
| Polyethylene Molding Cup Trays | Polysciences | 17177C-3 | (13x19x5 mm, for embbeding samples in GMA resin) |
| Potassium iodide | Sigma-Aldrich | 221945 | (for Lugol solution preparation) |
| Potato Dextrose Agar (PDA) | Millipore | 70139 | (for seeds germination tests) |
| Scanning Electron Microscope | Jeol | (any model) | |
| Silane [(3-Aminopropyl)triethoxysilane] | Sigma-Aldrich | A3648 | (for slides preparation - OCT adherence) |
| Silane-Prep Slides | Sigma-Aldrich | S4651 | glass slides coated with silane |
| Silica gel orange, granular | Supelco | 10087 | (for dessicating processes) |
| Sodium cacodylate trihydrate | Sigma-Aldrich | C0250 | (for glutaraldehyde-sodium cacodylate buffer) |
| Sodium hydroxide | Sigma-Aldrich | S5881 | NaOH (for Karnovsky’s solution preparation and TEM contrast staining) |
| Sodium hypochlorite solution | Sigma-Aldrich | 425044 | NaClO (for seeds surface disinfection) |
| Sodium phosphate dibasic, anhydrous | Sigma-Aldrich | 71640 | Na2HPO4 (for NBF solution and PB preparation) |
| Sodium phosphate monobasic monohydrate | Sigma-Aldrich | S9638 | NaH2PO4·H2O (for NBF and PB) |
| Sputter coater | Balzers | (any model) | |
| Sucrose | Sigma-Aldrich | S0389 | C12H22O11 (for cryoprotection and germination test) |
| Sudan III | Sigma-Aldrich | S4131 | (for staining) |
| Sudan IV | Sigma-Aldrich | 198102 | (for staining) |
| Sudan Black B | Sigma-Aldrich | 199664 | (for staining) |
| Syringe | (3 mL, any brand, for TEM contrast staining) | ||
| Syringe Filter Unit, Millex-GV 0.22 µm | Millipore | SLGV033R | PVDF, 33 mm, gamma sterilized (for TEM contrast staining) |
| Tek Bond Super Glue 793 | Tek Bond Saint-Gobain | 78072720018 | liquid cyanoacrylate adhesive, medium viscosity |
| Toluidine Blue O | Sigma-Aldrich | T3260 | (for staining) |
| Transmission Electron Microscope | Jeol | (any model) | |
| Triphenyltetrazolium chloride | Sigma-Aldrich | T8877 | (for the tetrazolium test in seeds germination) |
| Trisodium citrate dihydrate | Sigma-Aldrich | S1804 | Na3(C6H5O7)·2H2O (for TEM contrast staining) |
| Ultramicrotome | Leica Biosystems | (any model) | |
| Uranyl acetate | Fisher Scientific | 18-607-645 | UO2(CH3COO)2 (for TEM contrast staining) |
| Vacuum pump | (any model) | ||
| Wheat Germ Agglutinin, Alexa Fluor 488 Conjugate | TermoFisher Scientific | W11261 | fluorescent dye-conjugated lectin (detects sialic acid and N-acetylglucosaminyl residues) |
Referanslar
- Evert, R. F. . Esau’s Plant Anatomy: Meristems, Cells, and Tissues of the Plant Body: Their Structure, Function, and Development. , (2006).
- Yeung, E. C. T., Stasolla, C., Sumner, M. J., Huang, B. Q. . Plant Microtechniques and Protocols. , (2015).
- Sokoloff, D. D., Jura-Morawiec, J., Zoric, L., Fay, M. F. Plant anatomy: at the heart of modern botany. Botanical Journal of the Linnean Society. 195 (3), 249-253 (2021).
- Leake, J. R. The biology of myco-heterotrophic (‘saprophytic’) plants. New Phytologist. 127 (2), 171-216 (1994).
- Bidartondo, M. I. The evolutionary ecology of myco-heterotrophy. New Phytologist. 167 (2), 335-352 (2005).
- Imhof, S., Massicotte, H. B., Melville, L. H., Peterson, R. L. Subterranean morphology and mycorrhizal structures. Mycoheterotrophy. , 157-214 (2013).
- Rasmussen, H. N., Rasmussen, F. N. Orchid mycorrhiza: implications of a mycophagous life style. Oikos. 118 (3), 334-345 (2009).
- Rasmussen, H. N., Dixon, K. W., Jersáková, J., Těšitelová, T. Germination and seedling establishment in orchids: a complex of requirements. Annals of Botany. 116 (3), 391-402 (2015).
- Zettler, L. W. Terrestrial orchid conservation by symbiotic seed germination: techniques and perspectives. Selbyana. 18 (2), 188-194 (1997).
- Stewart, S. L., Kane, M. E. Symbiotic seed germination and evidence for in vitro mycobiont specificity in Spiranthes brevilabris (Orchidaceae) and its implications for species-level conservation. In Vitro Cellular & Developmental Biology - Plant. 43 (3), 178-186 (2007).
- Zhao, D. -. K., et al. Orchid reintroduction based on seed germination-promoting mycorrhizal fungi derived from protocorms or seedlings. Frontiers in Plant Science. 12, 701152 (2021).
- Selosse, M. A., Roy, M. Green plants that feed on fungi: facts and questions about mixotrophy. Trends in Plant Science. 14 (2), 64-70 (2009).
- Merckx, V. S. F. T., Mennes, C. B., Peay, K. G., Geml, J. Evolution and diversification. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 215-244 (2013).
- Boon, M. E., Drijver, J. Routine Cytological Staining Techniques: Theoretical Background and Practice. Macmillan International Higher Education. , (1986).
- Karnovsky, M. A formaldehyde-glutaraldehyde fixative of high osmolality for use in electron microscopy. Journal of Cell Biology. 27 (2), 137-138 (1964).
- Hayat, M. . Fixation for Electron Microscopy. , (1981).
- Roland, J. C., Vian, B. General preparation and staining of thin sections. Electron Microscopy of Plant Cells. 1, 675 (1991).
- Gerrits, P. O., Horobin, R. W. Glycol methacrylate embedding for light microscopy: basic principles and trouble-shooting. Journal of Histotechnology. 19 (4), 297-311 (1996).
- Zhang, Z., Niu, L., Chen, X., Xu, X., Ru, Z. Improvement of plant cryosection. Frontiers in Biology. 7 (4), 374-377 (2012).
- BeneŠ, K. On the media improving freeze-sectioning of plant material. Biologia Plantarum. 15 (1), 50-56 (1973).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Preparation of slides and coverslips for microscopy. Cold Spring Harbor Protocols. 2008 (5), (2008).
- Sakai, W. S. Simple method for differential staining of paraffin embedded plant material using toluidine blue O. Stain Technology. 48 (5), 247-249 (1973).
- O’Brien, T., Feder, N., McCully, M. E. Polychromatic staining of plant cell walls by toluidine blue O. Protoplasma. 59 (2), 368-373 (1964).
- Ventrella, M. C., Almeida, A. L., Nery, L. A., Coelho, V. P. d. e. M. Métodos Histoquímicos Aplicados às Sementes. Universidade Federal de Viçosa. , (2013).
- Pearse, A. G. E. . Histochemistry, Theoretical and Applied. , (1960).
- Andrade-Linares, D. R., Franken, P. Fungal endophytes in plant roots: taxonomy, colonization patterns, and functions. Symbiotic Endophytes. , 311-334 (2013).
- Wymer, C. L., Beven, A. F., Boudonck, K., Lloyd, C. W. Confocal microscopy of plant cells. Confocal Microscopy Methods and Protocols. , 103-130 (1999).
- Marques, J. P. R., Soares, M. K. M. Manual de Técnicas Aplicadas à Histopatologia Vegetal. FEALQ. , (2021).
- Navarro, B. L., Marques, J. P. R., Appezzato-da-Glória, B., Spósito, M. B. Histopathology of Phakopsora euvitis on Vitis vinifera. European Journal of Plant Pathology. 154 (4), 1185-1193 (2019).
- Marques, J. P. R., et al. Sugarcane cell wall-associated defense responses to infection by Sporisorium scitamineum. Frontiers in Plant Science. 9, 698 (2018).
- Jeffree, C. E., Read, N. D. Ambient-and low-temperature scanning electron microscopy. Electron Microscopy of Plant Cells. , 313-413 (1991).
- Bozzola, J. J., Russell, L. D. . Electron Microscopy: Principles and Techniques for Biologists. , (1999).
- Murray, S. Basic transmission and scanning electron microscopy. Introduction to electron Microscopy for Biologists. , 3-18 (2008).
- . Glossary of TEM terms Available from: https://www.jeol.co.jp/en/words/emterms/ (2021)
- Seaton, P. T., et al. Orchid seed and pollen: a toolkit for long-term storage, viability assessment and conservation. Orchid Propagation: From Laboratories to Greenhouses—Methods and Protocols. , 71-98 (2018).
- Otero, J. T., Ackerman, J. D., Bayman, P. Differences in mycorrhizal preferences between two tropical orchids. Molecular Ecology. 13 (8), 2393-2404 (2004).
- Koch, R. A., et al. Marasmioid rhizomorphs in bird nests: Species diversity, functional specificity, and new species from the tropics. Mycologia. 112 (6), 1086-1103 (2020).
- Webster, J., Weber, R. . Introduction to Fungi. , (2007).
- Sisti, L. S., et al. The role of non-mycorrhizal fungi in germination of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. Frontiers in Plant Science. 10, 1589 (2019).
- Martos, F., et al. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids. New Phytologist. 184 (3), 668-681 (2009).
- Alves, M. F., et al. Reproductive development and genetic structure of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. BMC Plant Biology. 21 (1), 332 (2021).
- Merckx, V. S. F. T. Mycoheterotrophy: an introduction. Mycoheterotrophy: The Biology of Plants Living on Fungi. , 1-17 (2013).
- Hall, J. L., Hawes, C. . Electron Microscopy of Plant Cells. , (1991).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır