Method Article
دليل لفحص تكوين الدهون العضلية وأصلها الخلوي في العضلات الهيكلية
In This Article
Summary
يعد استبدال الأنسجة العضلية السليمة بالدهون العضلية سمة بارزة للأمراض والظروف البشرية. يحدد هذا البروتوكول كيفية تصور الدهون العضلية وتصويرها وقياسها كميا ، مما يسمح بإجراء دراسة دقيقة للآليات الكامنة وراء تكوين الدهون العضلية.
Abstract
السلف الليفي الشحمي المنشأ (FAPs) هي خلايا لحمية وسيطة تلعب دورا حاسما أثناء توازن العضلات الهيكلية وتجديدها. تقوم FAPs ببناء والحفاظ على المصفوفة خارج الخلية التي تعمل كسقالة من الألياف العضلية الجزيئية. بالإضافة إلى ذلك ، لا غنى عن FAPs لتجديد الألياف العضلية لأنها تفرز العديد من العوامل المفيدة التي تستشعرها الخلايا الجذعية العضلية (MuSCs). ومع ذلك ، في الحالات المريضة ، فإن FAPs هي الأصل الخلوي للدهون العضلية والأنسجة الندبية الليفية. هذا التليف الدهني هو السمة المميزة للساركوبينيا والأمراض العصبية العضلية ، مثل ضمور دوشين العضلي. أحد الحواجز المهمة في تحديد سبب وكيفية تمييز FAPs إلى دهون عضلية هو الحفظ الفعال والتصور اللاحق للخلايا الشحمية ، خاصة في أقسام الأنسجة المجمدة. الطرق التقليدية لمعالجة الأنسجة العضلية الهيكلية ، مثل التجميد المفاجئة ، لا تحافظ بشكل صحيح على مورفولوجيا الخلايا الدهنية الفردية ، وبالتالي تمنع التصور الدقيق والقياس الكمي. للتغلب على هذه العقبة ، تم تطوير بروتوكول صارم يحافظ على مورفولوجيا الخلايا الدهنية في أقسام العضلات الهيكلية مما يسمح بالتصور والتصوير وتحديد كمية الدهون العضلية. يحدد البروتوكول أيضا كيفية معالجة جزء من الأنسجة العضلية ل RT-qPCR ، مما يتيح للمستخدمين تأكيد التغيرات الملحوظة في تكوين الدهون من خلال عرض الاختلافات في التعبير عن الجينات الشحمية. بالإضافة إلى ذلك ، يمكن تكييفه لتصور الخلايا الشحمية عن طريق التألق المناعي الكامل لعينات العضلات. وأخيرا، يحدد هذا البروتوكول كيفية إجراء تتبع النسب الجينية ل FAPs المعبرة عن Pdgfrα لدراسة التحويل الشحمي المنشأ ل FAPs. ينتج عن هذا البروتوكول باستمرار صور مناعية عالية الدقة ودقيقة من الناحية المورفولوجية للخلايا الشحمية ، إلى جانب تأكيد RT-qPCR ، مما يسمح بتصور قوي وصارم وقابل للتكرار وتحديد كمية الدهون العضلية. معا ، يعد خط أنابيب التحليل الموصوف هنا الخطوة الأولى لتحسين فهمنا لكيفية تمييز FAPs إلى دهون عضلية ، ويوفر إطارا للتحقق من صحة التدخلات الجديدة لمنع تكوين الدهون.
Introduction
يعد تسلل الأنسجة العضلية السليمة مع التليف الدهني سمة بارزة من سمات ضمور دوشين العضلي (DMD) والأمراض العصبية العضلية الأخرى ، وكذلك ساركوبينيا والسمنة والسكري1،2،3،4،5،6،7،8،9،10 . على الرغم من أن زيادة تسلل الدهون في هذه الحالات يرتبط ارتباطا وثيقا بانخفاض وظيفة العضلات ، إلا أن معرفتنا لماذا وكيف تتشكل الدهون العضلية لا تزال محدودة. FAPs هي مجموعة من الخلايا اللحمية الوسيطة متعددة القدرات موجودة في معظم الأعضاء البالغة ، بما في ذلك العضلات الهيكلية11,12. ومع ذلك ، مع تقدم العمر وفي الأمراض المزمنة ، تنتج FAPs أنسجة ندبية ليفية وتتمايز إلى خلايا دهنية ، والتي تقع بين الألياف العضلية الفردية وتشكل الدهون العضلية 13،14،15،16،17،18،19،20.
لبدء مكافحة تكوين الدهون العضلية ، يجب تحديد آليات كيفية تحول FAPs إلى خلايا دهنية. PDGFRα هي علامة "المعيار الذهبي" في هذا المجال لتحديد FAPs داخل عضلات الأنواع المتعددة 13،16،17،18،20،21،22،23،24،25،26،27. ونتيجة لذلك ، تم إنشاء العديد من خطوط Cre المستحثة بتاموكسيفين الفئران ، تحت سيطرة محرك Pdgfrα ، مما يسمح بالتلاعب وراثيا ب FAPs في الجسم الحي باستخدام نظام Cre-LoxP27,28,29. على سبيل المثال ، من خلال الجمع بين خط Cre المستحث هذا مع مراسل وراثي ، يمكن إجراء تتبع نسب FAPs ، وهي استراتيجية طبقناها بنجاح على FAPs خريطة المصير في العضلات والأنسجة الدهنية البيضاء20,30. إلى جانب تتبع النسب ، توفر خطوط Cre هذه أدوات قيمة لدراسة تحويل FAP إلى دهون.
تتمثل إحدى العقبات الرئيسية في تحديد آلية التحويل الشحمي المنشأ ل FAPs إلى دهون عضلية في القدرة على تحديد كمية الدهون العضلية التي تشكلت في ظل ظروف مختلفة بدقة وتكرار. المفتاح هو تحقيق التوازن بين الحفاظ على العضلات والأنسجة الدهنية ومطابقة ذلك مع طرق التلطيخ المتاحة لتصور الخلايا الشحمية. على سبيل المثال ، غالبا ما يتم تجميد العضلات الهيكلية دون تثبيت مسبق ، مما يحافظ على الألياف العضلية ولكنه يعطل مورفولوجيا الخلايا الدهنية (الشكل 1). في المقابل ، فإن التثبيت الذي يتبعه تضمين البارافين ، مع عرض أفضل أنسجة الأنسجة ، بما في ذلك الخلايا الشحمية ، يزيل جميع الدهون ، مما يجعل معظم الأصباغ المحبة للدهون ، مثل صبغة الزيت الأحمر O شائعة الاستخدام ، غير صالحة للاستخدام.
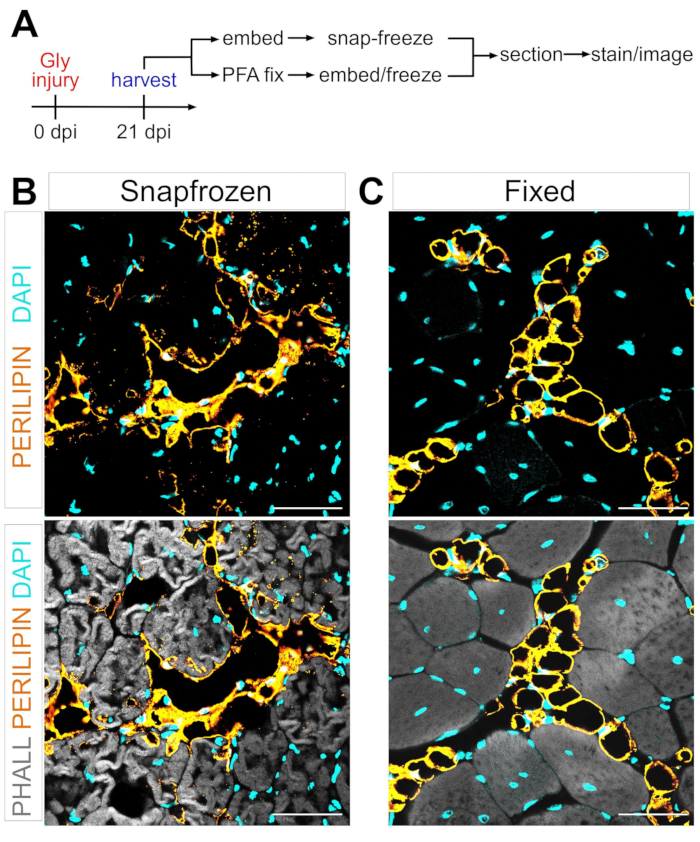
الشكل 1: صور تمثيلية للدهون العضلية في الأنسجة العضلية المجمدة مقابل الأنسجة العضلية الثابتة . (أ) نظرة عامة تخطيطية على الإعداد التجريبي. تظهر صور الفلورسنت المناعي الخلايا الشحمية (الصفراء) والألياف العضلية (الرمادية) والنوى (السماوية) داخل كل من (B) المجمدة المفاجئة و (C) TAs الثابتة في 21 يوما بعد إصابة الجلسرين. أشرطة المقياس: 50 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
يحافظ البروتوكول الموصوف هنا على مورفولوجيا الألياف العضلية والخلايا الشحمية ويسمح بالتصور والتحليل لأنواع متعددة من الخلايا. يعتمد هذا النهج على تلطيخ التألق المناعي للخلايا الشحمية في الأنسجة العضلية الثابتة بارافورمالديهايد (PFA) ، مما يسمح بالتلطيخ المشترك مع الأجسام المضادة المتعددة. كما يمكن تكييفه بسهولة لعرض الدهون العضلية مكانيا في الأنسجة السليمة باستخدام التصوير الكامل ، وبالتالي توفير معلومات عن البيئة الدقيقة الخلوية للدهون داخل العضلات. بالإضافة إلى ذلك ، يمكن دمج هذا البروتوكول مع نهجنا المنشور مؤخرا لتحديد منطقة المقطع العرضي للألياف العضلية في الأنسجة العضلية الثابتة31 ، وهو مقياس مهم لتقييم صحة العضلات. الجمع بين هذا النهج مع تتبع النسب الجينية لرسم خريطة المصير يتم أيضا توضيح تمايز FAPs إلى الخلايا الشحمية هنا. وبالتالي ، فإن البروتوكول متعدد الاستخدامات الموصوف هنا يتيح إجراء تقييم صارم وقابل للتكرار ل FAPs وتمايزها إلى دهون عضلية في أقسام الأنسجة والأنسجة السليمة.
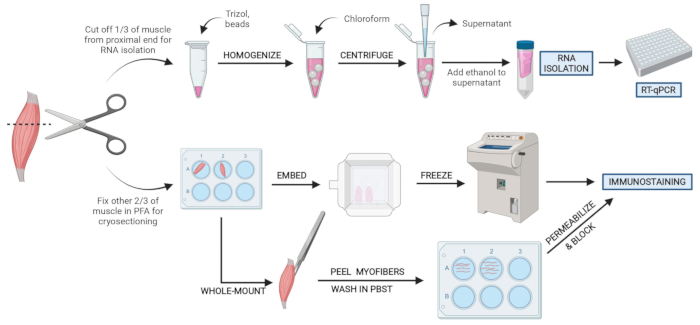
الشكل 2: نظرة عامة على البروتوكول التخطيطي. نظرة عامة تخطيطية على معالجة الأنسجة التي تتم فيها إزالة ثلث TA وتجميده المفاجئة وتجانسه لعزل الحمض النووي الريبي اللاحق وتحليل النسخ عبر RT-qPCR. الثلثان الآخران من TA مثبتان ب PFA ومعالجان للتلطيخ المناعي على الأقسام المجمدة أو الألياف الكاملة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
تمت الموافقة على جميع البروتوكولات الحيوانية من قبل اللجنة المؤسسية لرعاية الحيوانات واستخدامها (IACUC) بجامعة فلوريدا.
1. تتبع النسب الجيني ل FAPs
ملاحظة: إذا لم يكن من المرغوب فيه تتبع النسب الجيني ل FAPs ، فيمكن تخطي الخطوة 1.
- لإجراء تتبع النسب من FAPs ، احصل على أليلات الماوس اللازمة.
ملاحظة: تم إنشاء العديد من خطوط Cre المستحثة بالتاموكسيفين ، تحت سيطرة محرك Pdgfrα ، لاستهداف FAPs بنجاح ، بما في ذلك من مختبرات Hogan29 و Rando27 و Bergles32. كمراسل وراثي لنشاط Cre ، تتوفر العديد من أليلات مراسل Rosa26 مثل Rosa26EYFP33. في حين يقترح على كل مختبر تحديد تركيبة Cre-Reporter الأكثر فعالية ، عن طريق عبور الفئران Pdgfrα CreERT2 (29 و Jax # 032770) إلى مراسل Rosa26EYFP (33 و Jax # 006148) ، PdgfrαCreERT2 الناتج ؛ يمكن استخدام الفئران Rosa26EYFPلوضع علامة على FAPs20 بكفاءة وعلى وجه التحديد. لتتبع مصير FAPs الناضجة ، يوصى بالانتظار حتى تصل الفئران إلى 10 أسابيع على الأقل من العمر قبل إعطاء تاموكسيفين. يمكن إجراء تجارب تتبع النسب على كل من الذكور والإناث. - إعطاء تاموكسيفين من خلال الغسل عن طريق الفم
- تحضير 40 ملغ / مل تاموكسيفين في زيت الذرة والدوامة جيدا لخلط 1 يوم قبل gavaging. احتضان O / N عند 37 درجة مئوية في فرن التهجين الدوار.
تحذير: تاموكسيفين هو مادة مسرطنة ويجب التعامل معها بعناية. دائما ارتداء القفازات عند التعامل وارتداء قناع عند وزنه كمسحوق ، حيث يوجد خطر الاستنشاق. - نظف المنطقة وفقا للبروتوكول وأرفق إبرة التجفيف بحقنة 1 مل. اسحب 200 ميكرولتر من تاموكسيفين في المحقنة.
- Scruff PdgfrαCreERT2 ; الفئران Rosa26EYFP (10 أسابيع من العمر ؛ كلا الجنسين المستخدمة) عن طريق وضعها على سطح مستو والإمساك بقوة بقاعدة الذيل. استخدم يدا حرة للإمساك بمنتصف الماوس باستخدام إصبعي الإبهام والسبابة ، ثم حرك القبضة بلطف وبضغط طفيف حتى تجاوز الكتفين مباشرة.
- قرصة الجلد مرة أخرى مع الإبهام والسبابة ، والتقاط الماوس وقلب اليد بحيث يواجه الماوس المستخدم ، ودس الذيل بين الخنصر والإصبع البنصر من اليد التي تحمل الماوس.
- في هذه المرحلة ، تأكد من أن الماوس مشلول بشكل جيد وغير قادر على تحريك رأسه أو ذراعيه. أدخل إبرة الثقب في الفم واستخدمها لإمالة رأس الماوس قليلا إلى الخلف ؛ هذا يسمح للمريء أن يكون الوصول إليها أفضل.
- أدخل الإبرة بعناية وببطء في المريء. لا تجبر الإبرة إذا تم تلبية أي مقاومة ؛ يجب أن تنزلق الإبرة بسهولة. حقن تاموكسيفين ببطء. راقب الفئران لمدة 15-20 دقيقة لضمان عدم حدوث أي مشاكل أثناء الحفر.
ملاحظة: إدارة تاموكسيفين على 2 أيام متتالية يؤدي عادة إلى ~ 75٪ -85٪ كفاءة إعادة تركيب FAPs دون التسبب في أي آثار ضارة. من المستحسن أن ينتظر المستخدم لمدة 1-2 أسابيع قبل إحداث إصابة ، مما سيسمح بإزالة تاموكسيفين المتبقي من النظام وقلب أي بروتين متبقي.
- تحضير 40 ملغ / مل تاموكسيفين في زيت الذرة والدوامة جيدا لخلط 1 يوم قبل gavaging. احتضان O / N عند 37 درجة مئوية في فرن التهجين الدوار.
2. إصابة عضلة الظنبوب الأمامية (TA)
ملاحظة: لدراسة الدهون العضلية ، يوصى باستخدام نموذج إصابة قائم على الجلسرين (50٪ من الجلسرين في محلول ملحي معقم) ، مما يؤدي إلى تكوين دهون عضلية ضخمة34،35،36،37.
- قم بإعداد آلة التخدير عن طريق إضافة الأيزوفلوران وضمان فتح الأنابيب إلى كل من غرفة الماوس ومخروط الأنف. نظف الغرفة ومنطقة العمل إما بمحلول الإيثانول أو البيروكسيد بنسبة 70٪ (حسب البروتوكولات).
- اضبط معدل تدفق الأكسجين على 2.5 لتر / دقيقة وتركيز الأيزوفلوران على 2.5٪. ضع الماوس في غرفة التخدير وانتظر حوالي 5 دقائق حتى يتم تخديره.
- ضع الماوس أسفل مستلق على وسادة تسخين نظيفة وأدخل الأنف في مخروط الأنف. ضعي مرهم العيون البيطري بلطف على العينين باستخدام قضيب ذو رأس قطني لمنع الجفاف أثناء التخدير. راقب التخدير باستمرار وقم بإجراء قرصة إصبع القدم على الماوس قبل الإصابة لضمان تخدير الماوس بالكامل.
- نظف الساق المراد حقنها بمنديل كحولي طازج لتطهيرها.
- ارسم 30-50 ميكرولتر من الجلسرين بنسبة 50٪ (اعتمادا على حجم الفئران) في حقنة الأنسولين. قم بتنظيف الشعر بلطف على الساق لكشف موقع TA.
ملاحظة: من الأسهل تحريك الشعر وتحقيق تصور أفضل عندما لا يزال مبللا من مسح الكحول. - بعد تحديد موقع TA (جانبي فقط إلى الساق ، يبرز قليلا من خلال الجلد ويمكن الشعور به بملامسة لطيفة) ، أدخل الإبرة في TA بشكل بعيد ، بالقرب من الكاحل. أدخل الإبرة بالكامل في العضلات وحقن الجلسرين ببطء مع سحب الإبرة تدريجيا ، مما يساعد على إصابة معظم العضلات.
ملاحظة: من الأفضل إدخال الإبرة موازية للساق ، بزاوية مرتفعة قليلا. عادة ما تسبب الإصابة الجيدة الانثناء الظهري حيث ينقبض TA بعد سحب الإبرة. إذا انتشرت أصابع قدم الفأر ، فمن المحتمل أن تكون العضلة الباسطة الرقمية الطويلة (EDL) قد تم حقنها. - ضع الماوس مرة أخرى في القفص وراقبه لمدة 15-20 دقيقة لضمان استعادة التخدير.
- تخلص من الإبرة في حاوية الأدوات الحادة. لا تلخص أبدا إبرة.
ملاحظة: يجب توفير تسكين ما بعد حقن الجلسرين على النحو المعتمد من قبل اللجنة المؤسسية لرعاية الحيوانات واستخدامها. يمكن ملاحظة الخلايا الشحمية في أقرب وقت بعد 5 أيام من الإصابة (dpi). بمقدار 7 نقاط في البوصة ، تشكلت جميع الخلايا الشحمية ، وبحلول 21 نقطة في البوصة ، نضجت بالكامل.
3. حصاد الأنسجة
- تحضير 4٪ PFA في 1x PBS ووضعها على الجليد قبل البدء في الحصاد.
- ضع أي ألواح (12 أو 24 بئرا) تستخدم لتثبيت العضلات على الجليد وأضف 4٪ PFA إلى كل بئر ، مع التأكد من أن كل بئر يحتوي على حجم PFA أكبر ب 10-20 مرة من الأنسجة التي يتم إصلاحها.
- بين 7 و 21 يوما بعد إصابة الجلسرين ، القتل الرحيم للفأر وفقا للمبادئ التوجيهية المؤسسية (أي جرعة زائدة من الأيزوفلوران تليها خلع عنق الرحم).
- ابدأ في حصاد أي أنسجة لاستخدامها في علم الأنسجة أو عزل الحمض النووي الريبي.
ملاحظة: يجب تجميد الأنسجة أو وضعها في PFA في غضون 10-15 دقيقة من التضحية (الشكل 2). - رش أي مناطق من الماوس بحرية لتقطيعها بنسبة 70٪ من الإيثانول للمساعدة في الحفاظ على الشعر بعيدا عن منطقة وأدوات التشريح.
- استخدم المقص لقطع الجلد حول الجزء العلوي من الساق ، بالقرب من الحوض (الشكل 3A).
- اسحب جلد الساق بلطف من الأعلى إلى الكاحل (الشكل 3B).
ملاحظة: TA هي عضلة على شكل دمعة مع وتر بعيد محدد بوضوح يرتبط بالمسمارية الإنسية وعظم مشط القدم الأول. وهو جانبي للساق ويمتد حتى أسفل الركبة. - أولا ، قم بإزالة طبقة النسيج الضام الخارجي (epimysium) باستخدام ملاقط حادة الرؤوس قبل حصاد TA (الشكل 3C). استخدم مجهرا تشريحيا لتصور epimysium بشكل أفضل.
- حرك الملقط أسفل TA من أسفل العضلات، بدءا من الوتر البعيد، واسحب بلطف لأعلى نحو الركبة (الشكل 3D). توقف في نهاية العضلات. لا تتجاوز المقاومة التي شعرت بها في أسفل الركبة.
- إذا كانت هناك مقاومة كبيرة قبل الوصول إلى أسفل الركبة ، فتوقف واستمر في إزالة الطبقات المتبقية من النسيج الضام.
ملاحظة: هناك وتر بعيد آخر جانبي فقط لوتر TA يرتبط ب EDL ، وهو عضلة نحيلة جانبية ل TA. إن الحرص على تحريك الملقط فقط تحت وتر TA يمنع الحصاد العرضي ل EDL ، ولكن يمكن أيضا إزالته بسهولة بعد التثبيت. - بمجرد رفع TA جزئيا من الساق باستخدام الملقط ، استخدم نفس الحركة مع مشرط لقطع اتصال TA بالركبة السفلية (الشكل 3E). قطع الوتر في الكاحل مع مقص لإزالة TA بالكامل. تعامل فقط مع العضلات الموجودة في الوتر لتجنب إتلاف الألياف.
- قطع 1/3 من TA في النهاية المقابلة للوتر (الشكل 3F) ، وضعه في أنبوب جهاز طرد مركزي دقيق ، وتجميده المفاجئة عن طريق إسقاطه في النيتروجين السائل (الشكل 3H).
- اغمر 2/3 الأخرى من الأنسجة في بئر مصنف مع 4٪ PFA لعلم الأنسجة (الشكل 3I). تأكد من تتبع متى تم وضع الأنسجة الأولى والأخيرة في المثبت. ضع على شاكر لمدة 2-2.5 ساعة عند 4 درجات مئوية.
- تعتمد مدة التثبيت على الأنسجة وحجمها. تحديد المدة اللازمة لإصلاح الأنسجة. عادة ما يحافظ تثبيت TAs لمدة 2-2.5 ساعة عند 4 درجات مئوية على مورفولوجيا الخلايا الدهنية بشكل جيد دون التسبب في الإفراط في تثبيت الأنسجة.
ملاحظة: إذا كنت تخطط لاستخدام TA لتلطيخ الفلورسنت المناعي الكامل ، فتخطى بقية هذا البروتوكول حتى الوصول إلى القسم 7: "تلطيخ الفلورسنت المناعي الكامل للجبل". - بعد التثبيت ، قم بإزالة PFA من الآبار ، وشطف الأنسجة ب 1x PBS بارد 2-3 مرات ، ثم اغسل 2-3 مرات مع PBS بارد 1x لمدة 5 دقائق لكل غسلة.
- قم بإزالة PBS من الآبار وإضافة ما يكفي من السكروز بنسبة 30٪ في 1x PBS للسماح للأنسجة بالطفو. ضعيه على الخلاط على حرارة 4 درجات مئوية طوال الليل.
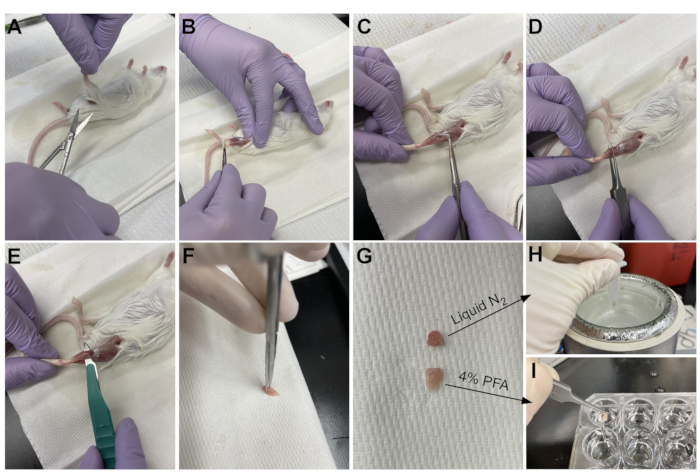
الشكل 3: ملخص حصاد الأنسجة . (أ) يتم قطع الجلد في قاعدة الساق و (ب) تتعرض عضلات الطرف الخلفي. (ج) بمجرد إزالة epimysium من TA ، يتم استخدام ملقط (D) لفصل العضلات جزئيا وضمان إزالة epimysium تماما. (ه) يتم قطع TA من الساق بمشرط وإزالته بعد قطع الوتر. (G) بعد قطع TA إلى ثلث وثلثي قطعة ، (H) يتم تجميد الثلث في النيتروجين السائل لتحليل RT-qPCR و (I) يتم تثبيت الثلثين الآخرين في 4٪ PFA لعلم الأنسجة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. التضمين
- قم بإعداد قوالب العينات لاستخدامها في التضمين عن طريق وضع العلامات والتعبئة بوسط تضمين كاف لغمر الأنسجة بالكامل.
- قم بإزالة الأنسجة من الآبار ، وجفف السكروز الزائد على منشفة ورقية ، وانتقل إلى قوالب العينات متوسطة الملء المتجمدة.
ملاحظة: من المفيد معرفة في أي اتجاه يتم تقسيم القالب على الكريوستات. بهذه الطريقة ، يمكن للمستخدم توجيه الأنسجة في القالب بطريقة تسمح بالوصول بسهولة إلى منطقة الاهتمام. بالنسبة ل TA ، سيتم تحقيق ذلك عن طريق وضع الطرف الأكثر سمكا (عكس جانب الوتر) في مواجهة السطح الذي سيتم تقسيمه. هذا يسمح بتقسيم TA بسهولة في الجزء الأكثر سمكا (البطن) ويسمح بقطع المقطع العرضي لألياف العضلات. - تحضير ملاط الأيزوبنتان عن طريق غمر جزئي لحاوية تحتوي على الأيزوبنتان في النيتروجين السائل. تأكد من وجود ما يكفي من الأيزوبنتان السائل في الحاوية لغمر حوالي نصف قالب العينة لاستخدامه في تضمين الأنسجة.
- ابدأ في تجميد القوالب عن طريق وضعها بعناية في ملاط الأيزوبنتان والتأكد من غمر حوالي نصف القالب. تأكد أيضا من أن القالب يتجمد بالتساوي من جميع الجوانب الأربعة.
- أخرج القالب من الأيزوبنتان قبل أن يتم تجميد القالب بأكمله بشكل واضح من الأعلى. يعتمد مقدار الوقت الذي يستغرقه ذلك على القوالب المستخدمة.
- احتفظ بالقوالب المجمدة في وعاء به ثلج جاف مع تجميد بقية الكتل ، ثم قم بتخزينها عند -80 درجة مئوية.
ملاحظة: يمكن إعادة استخدام الأيزوبنتان للتجميد. ضعه في زجاجة زجاجية ولكن لا تشد الغطاء حتى يصل الأيزوبنتان إلى درجة حرارة الغرفة (RT). خلاف ذلك ، فإن التغيير في الضغط يمكن أن يحطم الزجاجة.
5. التقسيم
- اضبط cryostat على -22 إلى -24 درجة مئوية ، وأضف قوالب تحتوي على TAs إلى المبرد ، وانتظر لمدة لا تقل عن 30 دقيقة للتأقلم مع درجة الحرارة. في غضون ذلك ، قم بتسمية سلسلة من شرائح المجهر المشحونة إيجابيا.
- أدخل صفيحة مضادة للتدحرج ومحاذاة إلى cryostat بحيث يكون هناك الحد الأدنى من النكات في اللوحة حيث تتلامس مع كتلة العينة. آمن في مكانه.
- أدخل شفرة cryostat جديدة في حامل الشفرة وثبتها في مكانها.
تنبيه: الشفرة حادة. قم بتغطية الشفرة عند التلاعب بأجزاء أخرى من cryostat أو القوالب المجمدة. - إزالة كتلة المجمدة من القالب. أضف طبقة موحدة من وسط التضمين إلى تشاك cryostat وضع الكتلة في الوسط. اتركيه لمدة 1-3 دقائق حتى يتم تجميد وسط التضمين تماما (أبيض غير شفاف).
ملاحظة: بالنسبة ل TAs ، يجب أن تكون المنطقة الأكثر سمكا (البطن) مرئية عندما تكون على الظرف. - ضع تشاك cryostat مع كتلة الأنسجة في المبردة. اكشف الشفرة وتقدم ب cryostat إلى الأمام حتى تتلامس مع الشفرة. قسم من خلال كتلة في أقسام 25 ميكرومتر حتى الأنسجة لم تعد محجوبة من قبل وسيط التضمين.
ملاحظة: أثناء التقسيم، اضبط زاوية ال cryostat و/أو موضع المرحلة بحيث تكون المقاطع ذات سمك موحد. قد يكون من المفيد جمع بضعة أقسام لضمان التوحيد في سمك القسم. من المستحسن أن يجد المستخدم موضع اللوحة المضاد للتدحرج المناسب قبل التقسيم إلى المنطقة ذات الأهمية داخل TA (البطن) ، لأن هذا يسمح للمستخدم بتجربة عدة مواضع من اللوحة المضادة للتدحرج حتى تخرج الأقسام مباشرة دون إهدار الأنسجة. - تغيير سمك القسم إلى 10-12 ميكرومتر وجمع الأقسام على شرائح المجهر الموسومة. يوصى بالتقسيم التسلسلي عن طريق جمع الأقسام المجاورة على 6-10 شرائح (تسمى 1-x) ، مما يسمح بالتلطيخ لعلامات متعددة. إذا لزم الأمر، استخدم فرشاة رقيقة لفك تجعيد المقاطع قبل جمعها على الشريحة.
ملاحظة: إذا كانت الأقسام تتجعد، فتحقق من ثبات درجة الحرارة ضمن نطاق -22 إلى -24 درجة مئوية. إذا كانت هناك خطوط رأسية في الأقسام ، فقد يكون ذلك بسبب في اللوحة المضادة للتدحرج أو الشفرة ؛ يمكن إصلاح ذلك عن طريق ضبط موضع اللوحة المضادة للتدحرج و / أو التبديل إلى شفرة جديدة. - بعد جمع المقاطع المجاورة من نفس مستوى التقسيم على كل شريحة ، اضبط السماكة مرة أخرى إلى 25 ميكرومتر للتقدم 150-200 ميكرومتر عبر الكتلة ، ثم اضبط السمك مرة أخرى إلى 10-12 ميكرومتر وابدأ التقسيم مرة أخرى.
ملاحظة: يسمح هذا التقسيم التسلسلي للمستخدم بالتصور والصورة والقياس الكمي على أعماق مختلفة من خلال TA ؛ ثلاثة إلى أربعة أقسام تسلسلية لكل شريحة كافية. - تخزين الشرائح وكتل الأنسجة في -80 درجة مئوية.
6. تلطيخ الفلورسنت المناعي (IF) لأقسام الأنسجة
ملاحظة: نظرا لأن تركيزات الأجسام المضادة يمكن أن تختلف بين الكثير والشركات المصنعة ، يوصى بالتحسين من خلال تقييم عدة تركيزات مختلفة من الأجسام المضادة على شرائح الاختبار قبل تلطيخ الشرائح محل الاهتمام.
- الشرائح الذائبة/الجافة إما في RT أو على طبق دافئ عند 37 درجة مئوية لمدة 10-20 دقيقة.
- استخدم قلما معاديا للماء لرسم خط على حافة سطح ورق الشريحة، حيث يلتقي بالزجاج.
- ضع الشرائح في جرة كوبلن واغسلها ب 1x PBS + 0.1٪ Tween20 (PBST) 3-5x على شاكر لمدة 5 دقائق على الأقل لكل غسل لإعادة ترطيب أقسام الأنسجة.
ملاحظة: في هذه المرحلة ، من المهم عدم السماح للشرائح بالجلوس دون غمرها في PBST (حتى خط مسعور) ، وإلا فإن أقسام الأنسجة سوف تجف. - ضع الشرائح على رف غرفة الترطيب وقم بتراكب الشرائح بمحلول حجب 310-350 ميكرولتر (مصل الحمير بنسبة 5٪ و 0.3٪ Triton X-100 في 1x PBS) لمدة 1-2 ساعة في RT.
ملاحظة: ليست هناك حاجة إلى خطوة نفاذية إضافية ، حيث يحتوي محلول الحجب على 0.3٪ Triton X-100 مما يسمح بنفاذية كافية لأقسام الأنسجة. عند استخدام الأجسام المضادة الأولية المشتقة من الفئران (أي PAX7 و MYOD1 المدرجة أدناه) ، يوصى بتضمين خطوة حظر الماوس على الماوس باستخدام شظايا Fab (1:50) في حل الحظر لخطوة الحظر. سيساعد ذلك في تقليل الخلفية بسبب الارتباط غير المحدد للجسم المضاد الثانوي للفأر بالأجسام المضادة بخلاف الأجسام المضادة الأولية. - قم بتخفيف الأجسام المضادة الأولية لاستخدامها في محلول الحجب قبل وقت قصير من الانتقال إلى الخطوة التالية على النحو التالي:
- الأجسام المضادة الأولية لتلطيخ الخلايا الشحمية وتصوير القسم بأكمله: تمييع الأرانب المضادة للبيريلين بنسبة تخفيف 1:1000.
- الأجسام المضادة الأولية لتتبع نسب الخلايا الشحمية: تمييع الدجاج المضاد GFP بنسبة 1:1000 والأرانب المضادة للبيريبين في 1:1000.
- الأجسام المضادة الأولية لتتبع نسب FAPs: تمييع الدجاج المضاد GFP بنسبة 1: 1000 والماعز المضاد PDGFRα في 1: 250.
- الأجسام المضادة الأولية للعلامات العضلية: تمييع الماوس المضاد ل PAX7 بنسبة 1:25 أو الماوس المضاد ل MYOD1 في 1:250 ، والأرانب المضادة لللامينين في 1:1000.
ملاحظة: في حين تم تقييم الأجسام المضادة المذكورة أعلاه بنجاح باستخدام هذا البروتوكول ، فمن المحتمل أن تكون العلامات والأجسام المضادة الأخرى لتسمية FAPs و / أو الخلايا الشحمية و / أو أنواع الخلايا الأخرى متوافقة أيضا مع هذا البروتوكول. يوصى بشدة عند استخدام الأجسام المضادة الأولية لأول مرة أن يقوم المستخدم بتضمين شريحة تحكم سلبية ، حيث يتم حذف الأجسام المضادة الأولية. هذا سوف يتحكم في خصوصية الأجسام المضادة. يتم اتباع جميع الخطوات الأخرى في البروتوكول ، بما في ذلك إضافة الأجسام المضادة الثانوية ، ولكن يتم استخدام محلول الحجب وحده في الخطوة التالية بدلا من الجسم المضاد الأساسي في محلول الحظر.
- قم بتفريغ محلول الحجب من الشرائح وتراكب مع 310-350 ميكرولتر من محلول الحجب بالأجسام المضادة الأولية واحتضنه بين عشية وضحاها عند 4 درجات مئوية في غرفة الترطيب.
- في اليوم التالي ، قم بتفريغ محلول الحجب / الأجسام المضادة الأولية من الشرائح وضعها في جرة كوبلن. شطف الشرائح 2-3 مرات مع PBST وغسل 3-5x مع PBST على الخلاط لمدة 5 دقائق على الأقل لكل غسلة.
- أثناء الغسيل الأخير ، قم بإعداد الأجسام المضادة الثانوية أو أي مترافقات مباشرة لاستخدامها في محلول الحظر. قلل من مقدار الوقت الذي تقضيه هذه الأجسام المضادة في الضوء لتجنب التبييض الضوئي.
- تمييع الأجسام المضادة الثانوية / المترافقات المباشرة: 488 نانومتر حمار مضاد للدجاج (1:1000) أو مضاد للأرانب (1:1000) أو مضاد للفأر (1:1000) أو 568 نانومتر حمار مضاد للماعز (1:1000) أو مضاد للأرانب (1:1000) أو Phalloidin (ألياف عضلية ؛ 1:100) ، وصمة عار DAPI (النوى ؛ 1:500).
- تراكب الشرائح مع 310-350 ميكرولتر من محلول الحجب مع الأجسام المضادة الثانوية و / أو الاقترانات المباشرة في غرفة الترطيب. احتضان في RT لمدة 1-2 ساعة. حماية العينات من الضوء من الآن فصاعدا.
- قم بتفريغ محلول الحجب / الأجسام المضادة الثانوية وضعها في جرة كوبلن. شطف مع PBST مرة واحدة وغسل 3-5x مع PBST على الخلاط لمدة 5 دقائق على الأقل لكل غسلة. حافظ على تغطية جرة كوبلن لمنع التعرض للضوء.
- جفف الشرائح قدر الإمكان عن طريق النقر على الحواف ومسح الظهر بمنشفة ورقية ، ولكن لا تدع أقسام الأنسجة تجف.
- أضف ثلاث أو أربع قطرات من وسط التركيب المائي إلى الحافة الأفقية العلوية للشريحة وأضف رفق غطاء علوي. لا تضغط لأسفل أو تتحرك إذا تشكلت فقاعات الهواء تحت الغطاء ؛ أي ضغط أو حركة يمكن أن تشوه البنية الخلوية الهشة للخلايا الشحمية.
- اسمح لوسط التركيب بالضبط في الظلام طوال الليل قبل التصوير.
7. كامل جبل تلطيخ الفلورسنت المناعي
- بعد حوالي 1 ساعة من التثبيت (انظر الخطوة 3.14) ، استخدم ملاقط ذات رؤوس حادة لتقشير الألياف العضلية من TA الثابت.
- ضع الألياف المنفصلة في طبق من 24 بئرا واغسلها 3x لمدة 3 دقائق لكل منها باستخدام PBST. بالنسبة لجميع الحضانات اللاحقة ، تأكد من إضافة الغطاء لمنع التبخر.
- احتضان لمدة 1 ساعة في 1٪ Triton X-100 في 1x PBS في RT (200-300 ميكرولتر) على شاكر للسماح باختراق أفضل للأجسام المضادة.
- بعد الشطف عدة مرات باستخدام PBST ، تراكب بمحلول مانع (200-300 ميكرولتر) وكتلة على جوزة أو شاكر بين عشية وضحاها عند 4 درجات مئوية.
- تمييع الأجسام المضادة الأولية عند التركيز المطلوب (مضاعفة التركيز يميل إلى أن يكون نقطة انطلاق جيدة) في محلول الحظر. احتضان العينات (200-300 ميكرولتر) على جوزة أو شاكر بين عشية وضحاها عند 4 درجات مئوية.
- اغسل العينات بدقة باستخدام PBST طوال اليوم مع تغييرات متكررة في RT على الخلاط ، حوالي 4-6x لمدة 30-60 دقيقة لكل غسلة.
- قم بتخفيف الأجسام المضادة الثانوية في محلول الحجب بالتركيز المطلوب (1:500 يميل إلى العمل بشكل جيد) بالإضافة إلى التلطيخ النووي واحتضان العينات (200-300 ميكرولتر) على جوزة أو شاكر بين عشية وضحاها عند 4 درجات مئوية.
- اغسل العينات بدقة مع PBST طوال اليوم مع تغييرات متكررة في RT على الخلاط ، حوالي 4-6 مرات لمدة 30-60 دقيقة لكل غسل أو غسل بين عشية وضحاها عند 4 درجات مئوية.
- للتركيب ، جفف PBST الزائد بلطف ثم ضع الألياف في قطرة أو قطرتين من وسط التركيب على شريحة زجاجية (الشكل 4A). لرفع الغطاء (18 مم × 18 مم) ، أضف القليل من أقدام الطين ؛ هذا سيمنع الألياف من أن يتم سحقها وتأمين الغطاء إلى الشريحة. مركبات النمذجة تعمل بشكل جيد لهذا الغرض. بمجرد تأمين الغطاء ، أضف المزيد من الوسط إلى الحافة حتى تمتلئ المنطقة الموجودة أسفل الغطاء .
ملاحظة: بدلا من استخدام وسيط تركيب يحتوي على عوامل مضادة للتلاشي ، يمكن أيضا نقل الأنسجة من خلال سلسلة تصاعدية من الجلسرين (30٪ إلى 80٪ من الجلسرين في PBS). - انتظر لمدة 1-2 أيام قبل التصوير للسماح بمعالجة وسط التركيب.
8. تصوير الدهون العضلية
- قم بتشغيل المجهر وقم بتشغيل برنامج التصوير. قم بتأمين الشريحة على المسرح.
ملاحظة: بالنسبة لتصوير الخلايا الشحمية في أقسام العضلات، غالبا ما يكون الهدف 5x أو 10x جنبا إلى جنب مع الفحص المجهري واسع المجال كافيا. لتصور WM-IF ، يلزم وجود مجهر بؤري. - استخدم أي قناة لتحديد المنطقة المراد تصويرها.
- في برنامج التصوير، اضبط وقت الكسب والتعرض لكل قناة.
- التقط صورا للأنسجة بأكملها في كل قناة (تلقائية أو يدوية وفقا للمجهر والبرامج المستخدمة) وادمج البلاط الفردي لإنشاء مركب من المقطع العرضي الكامل ل TA.
ملاحظة: يوصى بالتقاط صور لقسمين أو ثلاثة أقسام مختلفة من نفس TA على أعماق مختلفة. من خلال تحديد كمية الخلايا الشحمية في كل قسم ثم الإبلاغ عن المتوسط ، سيتم تجنب الاختلافات الموضعية في كمية الدهون العضلية بسبب ، على سبيل المثال ، أخطاء الحقن.
9. تحديد كمية الخلايا الشحمية
- إذا لم يكن مثبتا مسبقا، فأضف المكون الإضافي Cell Counter إلى ImageJ (https://imagej.nih.gov/ij/plugins/cell-counter.html).
- استيراد الصور إلى ImageJ كملفات TIF أو ملفات المجهر الأصلية. عرض كل قناة في ImageJ كملف TIF منفصل.
ملاحظة: في حالة استخدام LIF أو أنواع ملفات مجهرية مشابهة، ضمن خيارات استيراد التنسيقات الحيوية، اختر Hyperstack لعرض المكدس مع وحدد المربع الخاص بالقنوات المقسمة. انقر فوق موافق لفتح الملف. تأكد أيضا من إلغاء تحديد المربع Autoscale. - تأكد من أن الصور لكل قناة بتنسيق 8 بت (ورمادي): نوع > الصورة > 8 بت.
- دمج صور DAPI (أزرق) وGFP (أخضر) وPERILIPIN (أحمر) وPHALLOIDIN (رمادي): > الصور > الألوان ودمج القنوات.
- تحقق من أن المقياس (تحليل > تعيين المقياس) بالميكرون. باستخدام أداة الاختيار الحر ، حدد الجزء المصاب وغير المصاب من كل مقطع عرضي ، ثم قم بالقياس (تحليل > القياس) وتسجيل المنطقة المصابة مقابل المنطقة غير المصابة في جدول بيانات.
ملاحظة: يمكن تحديد العضلات المصابة على أنها مناطق خالية من الألياف العضلية أو المناطق المأهولة بالألياف العضلية التي تحتوي على نوى في موقع مركزي. - تشغيل عداد الخلايا: > تهيئة المكونات الإضافية > CellCounter.
- حدد نوع العداد، ثم عد كل خلية دهنية. سجل العدد الإجمالي للخلايا الشحمية في جدول بيانات، ثم احسب عدد الخلايا الشحمية لكل 1 مم2 من المنطقة المصابة.
10. تحليل التعبير الجيني Adipogenic باستخدام RT-qPCR
- عزل الحمض النووي الريبي
- قبل البدء ، قم بتسخين المياه الخالية من RNASE إلى 45 درجة مئوية وقم بإعداد 70٪ EtOH الطازج (350 ميكرولتر لكل عينة).
- أضف 1000 ميكرولتر من ثيوسيانات غوانيديوم إلى كل أنبوب يحتوي على العينة (انظر الخطوة 3.12). من المهم أن يتم استخدام أنابيب معتمدة من مضرب الخرز.
تحذير: جوانيديوم ثيوسيانات سامة. ارتداء معدات الحماية الشخصية المناسبة والتعامل معها في غطاء الدخان. - أضف ثلاث حبات متوسطة الحجم أو حبة كبيرة وخرزة صغيرة إلى كل أنبوب.
- تجانس الأنسجة عند 50 هرتز لمدة 2-4 دقائق باستخدام مضرب الخرز. اعتمادا على نوع الأنسجة وحجم العينة، قد يستغرق الأمر ما يصل إلى 10 دقائق.
- أضف 200 ميكرولتر من الكلوروفورم.
تحذير: الكلوروفورم سام. ارتداء معدات الحماية الشخصية والتعامل معها في غطاء الدخان. - هز العينات لمدة 15 ثانية. احتضن لمدة 2-3 دقائق في RT.
- جهاز طرد مركزي لمدة 15 دقيقة عند 12000 × جم. ابتصاق 350 ميكرولتر من المادة الفائقة الواضحة (الطبقة العليا التي تحتوي على الحمض النووي الريبي) وأضف إلى أنبوب طرد مركزي دقيق جديد يحتوي على 350 ميكرولتر من الإيثانول بنسبة 70٪. احرص على عدم استنشاق طبقات البروتين و / أو الحمض النووي السفلية
- انقل ما يصل إلى 700 ميكرولتر من الخليط إلى عمود دوران صغير يوضع في أنبوب تجميع 2 مل. استمر في عزل الحمض النووي الريبي باتباع تعليمات الشركة المصنعة.
- العذاب مع 30-50 ميكرولتر من الماء الخالي من RNase ، اعتمادا على العائد المتوقع. احتفظ بالحمض النووي الريبي على الجليد وقم بقياس العائد باستخدام مقياس الطيف الضوئي. حافظ على تخزين الحمض النووي الريبي عند -80 درجة مئوية
ملاحظة: من الممكن حذف خطوة معالجة الحمض النووي ، حيث أن الإقلاع بعناية عن 350 ميكرولتر العلوي فقط من طبقة الحمض النووي الريبي يكفي لمنع تلوث الحمض النووي. بالإضافة إلى تحليل RT-qPCR ، يمكن أيضا استخدام الحمض النووي الريبي المعزول لتسلسل الحمض النووي الريبي ، وفي هذه الحالة يوصى بشدة بخطوة علاج DNase.
- تخليق cDNA
- استخدم ما يصل إلى 1 ميكروغرام من الحمض النووي الريبي لتوليف cDNA مع مجموعة توليف cDNA ، باتباع تعليمات الشركة المصنعة.
- بعد اكتمال التشغيل ، أضف 80 ميكرولتر من الماء الخالي من RNase. تخزين العينات في -20 درجة مئوية.
- RT-qPCR من الجينات الانتقائية للخلايا الشحمية.
- باستخدام تنسيق 384 بئرا ، أضف 1 ميكرولتر من التمهيدي (التركيز النهائي ~ 1 ميكرومتر) إلى قاع كل بئر. ينتج عن الاشعال قبل التجفيف تكرارات تقنية أكثر إحكاما. اتركيه مغطى حتى تتبخر الاشعال تماما (يمكن وضع اللوحة على كتلة تسخين مضبوطة على 37 درجة مئوية لتسريع التبخر).
- قم بإعداد تفاعلات العينة مع أربعة إلى ثمانية تكرارات تقنية على النحو التالي: 2.5 ميكرولتر من المزيج الرئيسي RT-PCR القائم على الصبغة ، و 2.1 ميكرولتر من الماء الخالي من RNase ، و 0.4 ميكرولتر من cDNA (~ 1 ng) مع إجمالي حجم 5 ميكرولتر لكل بئر. تم استخدام ظروف ركوب الدراجات الحرارية التالية: إزالة الطبيعة عند 95 درجة مئوية لمدة 15 ثانية و anneal / تمتد عند 60 درجة مئوية لمدة 25 ثانية لمدة 40 دورة.
- تطبيع قيم CT الخام (عتبة الدورة) إلى مستويات جينات التدبير المنزلي (أي Hprt و Pde12) عن طريق حساب ΔΔCT كما هو موضح هنا38. انظر20 للاطلاع على تسلسلات التمهيدي.
ملاحظة: يجب اتباع الممارسة القياسية لتحليل RT-qPCR ، مثل استخدام عنصر تحكم النسخ العكسي (-RT) ناقص ، ورد تفاعل PCR ، والتحقق من صحة التمهيدي.
النتائج
التصور المناعي الفلورسنت للدهون العضلية
باتباع الخطوات المذكورة أعلاه وعرض الشكل 1A ، تم جمع أقسام أنسجة TA من إصابة الجلسرين بعد 21 يوما والتي تم تجميدها مباشرة بعد الحصاد في الأيزوبنتان المبرد ب LN2 أو تم تثبيتها في PFA بنسبة 4٪ لمدة 2.5 ساعة. بعد التقسيم بالتبريد وتلطيخ كلتا العينتين ، تم التقاط الصور في منتصف البطن ، وهي أكبر منطقة في TA. لقد غيرت الخلايا الشحمية PERILIPIN+ من TAs غير الثابتة (الشكل 1B) بشكل كبير المورفولوجيا مقارنة بالمقاطع الثابتة (الشكل 1C) ، مما يجعل تحديدها وتصورها وتحديدها كميا لاحقا أكثر صعوبة وربما غير دقيق. تجدر الإشارة إلى أنه تم اكتشاف أول قطرات دهنية PERILIPIN + في حوالي 5 أيام بعد الإصابة ، مع تشكل معظم الخلايا الشحمية بحلول اليوم 7. بحلول 21 يوما بعد الإصابة ، نضجت الخلايا الشحمية بالكامل.
نظرا لأن كمية الدهون لكل TA ترتبط ارتباطا وثيقا بشدة الإصابة المستحثة ، يجب أن تصاب TAs بشكل كبير لمراقبة ودراسة تكوين الدهون العضلية بشكل فعال. تعد ممارسة الحقن باستخدام الحبر في TAs الجثث طريقة رائعة لتحسين شدة الإصابة. تميل الإصابات الناجحة إلى أن تكون أعلى من 50٪ من العضلات. تجدر الإشارة إلى أن المناطق المصابة من العضلات تمثل مناطق خالية من ألياف العضلات أو المناطق التي تسكنها ألياف العضلات التي تحتوي على نواة واحدة على الأقل في موقع مركزي ، وهي سمة مميزة معروفة لألياف العضلات المجددة.
يمكن تكييف هذا البروتوكول بسهولة مع وصمة عار ل FAPs والدهون في 3D. لهذا ، تم فصل العديد من الألياف العضلية من TA بعد التثبيت بعناية ، تليها التألق المناعي الكامل. المفتاح هو تأمين الألياف بشكل صحيح على الشريحة الزجاجية ، وفي الوقت نفسه ، لتجنب الإفراط في ضغط الأنسجة. باستخدام أقدام طينية قابلة للتشكيل ، يمكن للمستخدم ضبط السماكة المطلوبة وتأمين الغطاء على الشريحة ، حتى السماح باستخدام المجهر المقلوب (الشكل 4A). تم استخدام هذه الطريقة بنجاح لتسمية PDGFRα + FAPs و Phalloidin + myofibers والخلايا الشحمية المعبرة عن PERILIPIN (الشكل 4B والفيديو التكميلي 1 والفيديو التكميلي 2). بعد الحصول على صور في طائرات z متعددة تمتد بسماكة تصل إلى 150 ميكرومتر ، تم استخدام وحدة العرض ثلاثية الأبعاد داخل برنامج المجهر لإنشاء إعادة بناء ثلاثية الأبعاد.
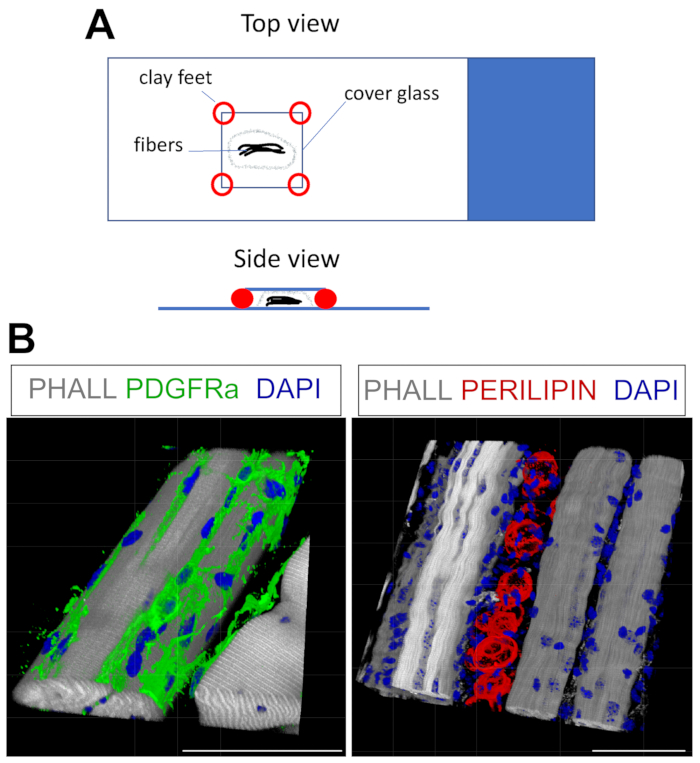
الشكل 4: تلطيخ الفلورسنت المناعي الكامل (أ) منظر علوي وجانبي لكيفية تركيب العينة وإضافة غطاء للتلطيخ الكامل. (ب) إعادة بناء تمثيلية ثلاثية الأبعاد ل FAPs (أخضر ؛ يسار) والخلايا الشحمية (أحمر ؛ يمين) جنبا إلى جنب مع الألياف العضلية (رمادي) ونوى (أزرق). أشرطة المقياس: 50 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
تحديد كمية الدهون العضلية
بمجرد التقاط صور للدهون العضلية ، تم استخدام وظيفة عداد الخلايا في ImageJ / FIJI لحساب عدد الخلايا الشحمية PERLIPIN + يدويا (الشكل 5A). بعد ذلك ، تم تحديد المساحة الإجمالية لقسم العضلات وكذلك المنطقة المصابة ، والتي تم تحديدها بواسطة نوى مركزية داخل الألياف العضلية. للتحكم في شدة الإصابة ، تم تقسيم العدد الإجمالي للخلايا الشحمية على المنطقة المصابة مما أدى إلى عدد الخلايا الدهنية لكل 1 مم2 من العضلات المصابة. عادة ، يتم استبعاد TAs التي تعرض إصابة بنسبة <30٪ من الكميات. تجدر الإشارة إلى أنه على الرغم من أن الخلايا الشحمية نادرة دون إصابة ، تتراوح من صفر إلى ثمانية لكل منطقة مقطعية عرضية ، إلا أن العدد الإجمالي للخلايا الشحمية لا يزال طبيعيا حسب المساحة الكلية. كما هو موضح في الشكل 5B ، تسبب إصابة الجلسرين كميات هائلة من الدهون العضلية مقارنة بعضلة TA غير المصابة. بدلا من ذلك ، نظرا لأن تلطيخ Perilipin نظيف للغاية مع نسبة إشارة إلى ضوضاء عالية ، فمن الممكن أيضا استخدام وظيفة تحليل الجسيمات لتحديد المساحة الإجمالية التي يشغلها Perilipin. ومع ذلك ، لن تتمكن هذه الطريقة من التمييز بين الخلايا الشحمية الأصغر مقابل الأقل. تم تصوير ما يصل إلى ثلاثة أقسام من ما لا يقل عن أربعة فردية وتحديدها كميا ، وتم الإبلاغ عن متوسط عدد الخلايا الدهنية الموجودة لكل فأر.
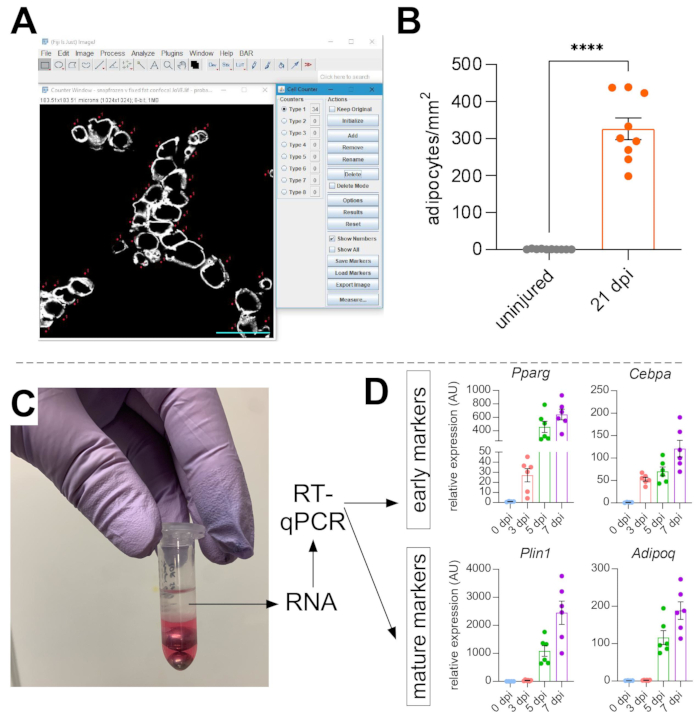
الشكل 5: القياسات الكمية للدهون العضلية . (أ) صورة تمثيلية لكيفية حساب الخلايا الشحمية PERILIPIN+ (بيضاء) باستخدام دالة عداد الخلايا في ImageJ. شريط المقياس: 50 ميكرومتر (ب) تكميم الخلايا الشحمية TA الكاملة بعد 21 يوما من حقن الجلسرين إلى 1 مم2 من المنطقة المصابة. تمثل كل نقطة متوسط ماوس واحد. أشرطة الخطأ المعروضة ك SEM. **** = p < 0.0001. (ج) تستخدم طبقة الحمض النووي الريبي بعد التجانس وفصل الطور اللاحق بواسطة الكلوروفورم لتحليل RT-qPCR. (د) التغيرات الطوية في مستويات التعبير عن Pparg و Cepbα ، الجينات الشحمية المبكرة ، و Plin1 و Adipoq ، وهما علامتان للخلايا الشحمية الناضجة ، في نقاط زمنية مختلفة بعد إصابة الجلسرين. تمثل كل نقطة متوسط ماوس واحد. أشرطة الخطأ المعروضة على أنها SEM. يرجى النقر هنا لعرض إصدار أكبر من هذا الشكل.
للتأكد بشكل مستقل من كمية الدهون العضلية الموجودة ، يمكن تحديد مستويات التعبير الجيني لمختلف العلامات الشحمية. لهذا ، يمكن عزل الحمض النووي الريبي من جزء من نفس عضلة TA المستخدمة للتألق المناعي (انظر الخطوات أعلاه) في نقاط مختلفة بعد الإصابة. تم استخدام مضرب الخرز في تركيبة مع جوانيديوم ثيوسيانات لتجانس الأنسجة. بعد إضافة الكلوروفورم متبوعا بالطرد المركزي ، تم استخراج الطبقة العلوية المحتوية على الحمض النووي الريبي بعناية ، وتم استخدام أعمدة الدوران الصغيرة لتنظيف الحمض النووي الريبي (الشكل 5C). تنتج هذه الطريقة بشكل روتيني جودة وكمية عالية من الحمض النووي الريبي مناسبة لجميع التحليلات النهائية مثل RT-qPCR و RNAseq. بالنسبة ل RT-qPCR ، تم تحديد مستويات التعبير النسبية لجينات الإدمان إلى التدبير المنزلي ، وتم تقييم أي تغييرات نسبية باتباع طريقة ΔΔCT38. كما هو موضح في الشكل 5D ، مقارنة بعضلة TA غير المصابة ، تحفز إصابة الجلسرين على التعبير عن العلامات الشحمية المبكرة مثل Pparg و Cebpα في أقرب وقت بعد 3 أيام من الإصابة. يمكن الكشف عن العلامات الناضجة ، مثل Adiponectin (Adipoq) و Perilipin (Plin1) ، في وقت مبكر من 5 أيام بعد إصابة الجلسرين.
تتبع النسب الجيني للخلايا الشحمية
يمكن بسهولة تكييف بروتوكول تلطيخ الخلايا الشحمية المعروض هنا ليشمل تتبع النسب الجيني ل FAPs لرسم خريطة ومتابعة مصيرها في الخلايا الشحمية. لقد أثبتنا ، على سبيل المثال ، سابقا أنه يمكن تحفيز إعادة التركيب عن طريق إدارة تاموكسيفين في PdgfrαCreERT2 ؛ الفئران Rosa26 EYFP قبل أسبوعين من الإصابة ، وإزالة ترميز التوقف المفلبد بشكل فعال وتنشيط تعبير EYFP بشكل لا يمحى في FAPs (الشكل 6A). لقد حققنا كفاءات عالية في إعادة التركيب مع نظام تاموكسيفين المعروض هنا ، مع ~ 75٪ من PDGFRα + FAPs التي تعبر عن EYFP 20 ، على غرار ما أبلغت عنه المختبرات الأخرى27،39،40. مما يدل على أن FAPs هي في الواقع الأصل الخلوي للدهون العضلية ، تحولت غالبية FAPs إلى الخلايا الشحمية المعبرة عن EYFP + PERILIPIN بعد 7 أيام من إصابة الجلسرين (الشكل 6B).
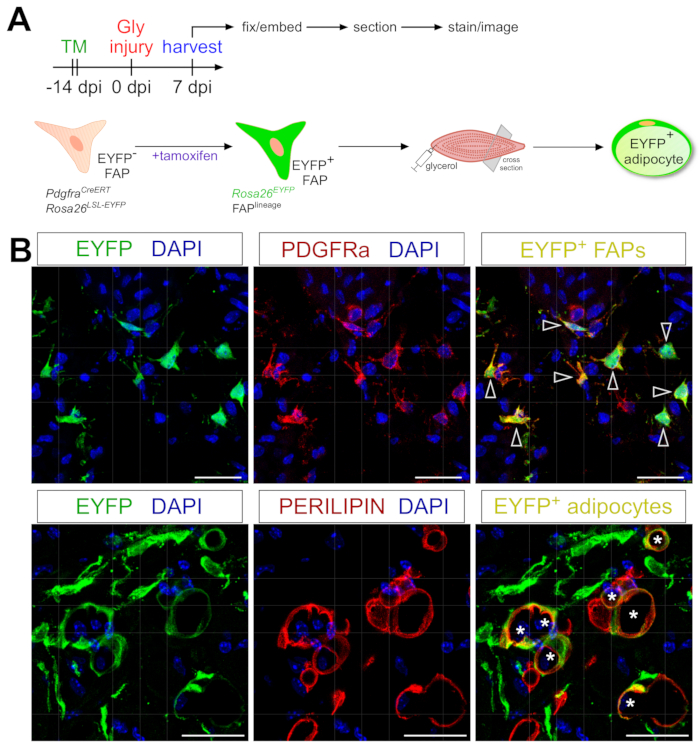
الشكل 6: تتبع نسب FAPs . (أ) نظرة عامة تخطيطية على الإعداد التجريبي. (ب) صور تمثيلية للفلورسنت المناعي تظهر نجاح إعادة تركيب وتنشيط EYFP (أصفر) داخل PDGFRα+ FAPs (أحمر ، رؤوس أسهم) والخلايا الشحمية PERILIPIN + (أحمر ، علامات نجمية). أشرطة المقياس: 25 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الكشف عن أنواع متعددة من الخلايا
يمكن أيضا استخدام هذا البروتوكول لتصور المقصورة العضلية. باستخدام الأجسام المضادة ضد PAX7 و MYOD1 ، يمكن اكتشاف الخلايا الجذعية العضلية (MuSCs) والأرومات العضلية ، على التوالي ، بسهولة بعد 5 أيام من إصابة الجلسرين حتى في قسم الأنسجة العضلية الثابتة PFA (الشكل 7). وبالتالي ، فإن البروتوكول المقدم متعدد الاستخدامات وقابل للتكيف ليس فقط مع الخلايا الشحمية والصور و FAPs ولكن أيضا مع أنواع الخلايا الأخرى من السلالة العضلية المنشأ.
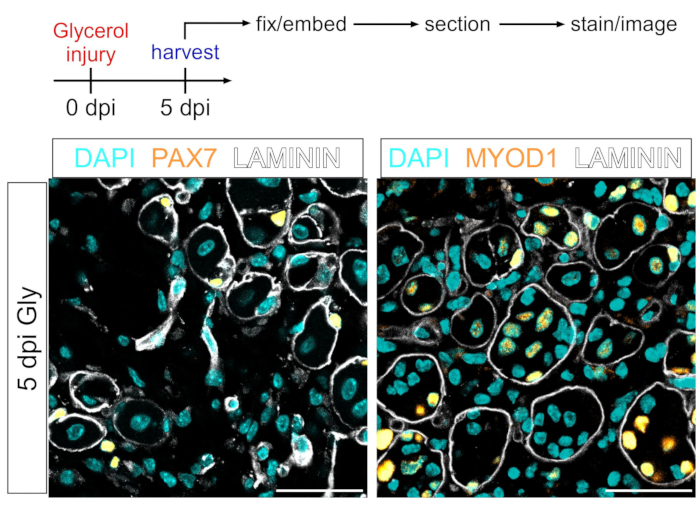
الشكل 7: الخلايا الجذعية العضلية وتلطيخ الفلورسنت المناعي للكتلة العضلية . (أ) نظرة عامة تخطيطية على الإعداد التجريبي. (ب) صور تمثيلية للفلورسنت المناعي تظهر تلطيخا ناجحا للخلايا الجذعية العضلية (MuSC) (الأصفر ، الأيسر) مع PAX7 والأروميات العضلية (الأصفر ، الأيمن) مع MYOD1. يحدد LAMININ الألياف العضلية (البيضاء) ، والنوى باللون السماوي. أشرطة المقياس: 50 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
فيديو تكميلي 1: تقديم 3D من FAPs. إعادة بناء ثلاثية الأبعاد للألياف العضلية ، FAPs ، والنوى الملطخة ل PHALLOIDIN (رمادي) ، PDGFRα (أخضر) ، و DAPI (أزرق) ، على التوالي ، بعد 21 يوما من الإصابة. يرجى النقر هنا لتنزيل هذا الفيديو.
فيديو تكميلي 2: تقديم 3D من الدهون العضلية. العرض الحجمي لحزم الألياف العضلية (الرمادي ، PHALLOIDIN) والدهون العضلية (الأحمر ، PERILIPIN) ، والتي حلت محل myofiber بعد 21 يوما من إصابة الجلسرين. يرجى النقر هنا لتنزيل هذا الفيديو.
Discussion
يحدد هذا البروتوكول بروتوكولا شاملا ومفصلا يسمح بالتصور الفعال والقياس الكمي الدقيق للدهون العضلية. من خلال تقسيم نفس العضلة إلى قسمين ، أحدهما يستخدم للتألق المناعي والآخر لتحليل RT-qPCR ، فإن هذا البروتوكول متعدد الاستخدامات أيضا. ويمكن أيضا دمجه مع تتبع النسب الجيني ل FAPs لدراسة تحولها إلى خلايا دهنية في ظل ظروف معينة وهو قابل للتكيف بشكل كبير مع تسمية وتصوير أنواع خلايا إضافية متعددة.
الطرق الأكثر استخداما لتصور الدهون العضلية هي أقسام البارافين تليها تلطيخ الهيماتوكسيلين والإيوسين أو الأقسام المجمدة الملطخة بالأصباغ المحبة للدهون مثل Oil Red O (ORO). ومع ذلك ، في حين أن الأنسجة المعالجة بالبارافين تحافظ على أفضل الأنسجة ، فإن نفس العملية تستخرج أيضا جميع الدهون التي تمنع استخدام الأصباغ المحبة للدهون. على الرغم من أن طرق تلطيخ الدهون ستعمل على كل من أقسام الأنسجة الثابتة وغير الثابتة PFA ، إلا أن قطرات الدهون يتم إزاحتها بسهولة عن طريق الضغط على الغطاء ، وبالتالي تشويه التوزيع المكاني للدهون العضلية. للتحايل على هذا ، أنشأت دراسة حديثة بروتوكولا صارما لتصور الخلايا الشحمية ORO+ باستخدام نهج كامل التركيب. لهذا ، قام المؤلفون بإزالة الخلايا من TA لتصور التوزيع المكاني للدهون العضلية في جميع أنحاء TA41 بأكمله. على الرغم من قوة هذه التقنية ، إلا أنها تمنع أيضا استخدام بقع مشتركة أخرى لتحديد الهياكل الخلوية الإضافية. يمكن استخدام نهج التألق المناعي الكامل للجبل المعروض هنا للمشاركة في تلطيخ الخلايا الشحمية مع مجموعة متنوعة من العلامات التي تسمح برسم خرائط دقيقة للبيئة الخلوية. ومع ذلك ، فإن أحد التحديات الرئيسية هو اختراق الأنسجة للأجسام المضادة. كلما تم الاحتفاظ بالمزيد من الألياف معا ، كلما كان من الصعب على الأجسام المضادة اختراق جميع المستضدات المتاحة وربطها بالتساوي. وبالتالي ، فإن هذه الطريقة هي الأكثر فعالية عند النظر إلى مجموعات صغيرة من الألياف. في الوقت نفسه ، هذا أيضا قيد حيث يتم فقدان الموقع التشريحي العام للدهون العضلية عند التركيز على حزم الألياف الصغيرة المقشرة فقط. ومع ذلك ، مع التطور الحالي لطرق مسح الأنسجة الجديدة بالإضافة إلى تقنية التصوير الجديدة ، سيكون من الممكن زيادة اختراق الأنسجة والتصور في المستقبل42،43،44.
في حين أن التثبيت المسبق للأنسجة العضلية يحافظ على مورفولوجيا الخلايا الشحمية ، فإنه يخلق أيضا تحديا لتقييم حجم الألياف العضلية ، وهو مقياس مهم لصحة العضلات. يتم تحديد حجم الألياف العضلية عن طريق قياس منطقة المقطع العرضي للألياف العضلية. لقد أبلغنا سابقا أن التثبيت المسبق للأنسجة العضلية سيؤدي إلى فشل معظم العلامات المتاحة لتحديد الألياف العضلية31. للتغلب على هذه العقبة ، قمنا بتطوير خط أنابيب جديد لتجزئة الصور ، والذي يسمح بقياس حجم الألياف العضلية حتى في أقسام العضلات الثابتة31. وبالتالي ، أنشأنا خط أنابيب قوي وفعال لمعالجة الأنسجة ، جنبا إلى جنب مع هذا البروتوكول ، يتغلب على معظم العيوب الناجمة عن التثبيت المسبق للأنسجة العضلية.
ميزة رئيسية أخرى لهذا النهج هي التنوع. من خلال تقسيم TA إلى قسمين ، يتم زيادة كمية المعلومات التي يمكن الحصول عليها من عضلة واحدة. هذا لا يقلل من أعداد الحيوانات فحسب ، بل يضيف أيضا طبقة إضافية من التحكم من خلال تأكيد علم الأنسجة من خلال التعبير الجيني والعكس صحيح. بالإضافة إلى ذلك ، يمكن فحص العديد من الجينات المختلفة خارج الجينات الشحمية. يمكن أيضا استخدام الحمض النووي الريبي المعزول لتجربة RNAseq للعضلات بأكملها. أخيرا ، يمكن أيضا استخدام قطعة العضلات المجمدة المفاجئة لعمل البروتين. أحد قيود هذا البروتوكول هو إمكانية عدم اتساق الضرر عبر كامل طول TA. هذا يمكن أن يؤدي إلى سيناريو حيث يتباعد جزءا العضلات في كمية الدهون العضلية التي يحتويان عليها وقد يبرر استبعاد مثل هذه العينة من أي تحليل في المصب. لذلك ، يوصى بعدم الاعتماد ببساطة على RT-qPCR لاستخلاص استنتاجات رئيسية حول كمية الدهون العضلية ، ولكن بدلا من ذلك كبيانات داعمة للكميات النسيجية.
معا ، يحدد هذا البروتوكول خط أنابيب قوي وفعال وصارم لمعالجة الأنسجة يسمح بتصور الدهون العضلية وتحديدها كميا ، وهي الخطوة الأولى في تطوير خيارات علاج جديدة لمكافحة التليف الدهني. في الوقت نفسه ، فهي متعددة الاستخدامات ويمكن تكييفها مع العديد من أنواع الخلايا المختلفة داخل العضلات وكذلك الخلايا الشحمية في الأنسجة الأخرى.
Disclosures
ويعلن صاحبا البلاغ عدم وجود مصالح متنافسة.
Acknowledgements
نشكر أعضاء مختبر Kopinke على المساعدة في جمع البيانات والقراءة النقدية للمخطوطة. كما نشكر أعضاء معهد علم الميولوجيا في جامعة فلوريدا على مدخلاتهم القيمة في المخطوطة. تم دعم العمل من خلال منحة المعاهد الوطنية للصحة 1R01AR079449. تم إنشاء الشكل 2 باستخدام Biorender.
Materials
| Name | Company | Catalog Number | Comments |
| 16% PFA (Pack of 12, 10 mL bottles) | Electron Miscroscopy Sciences | 15710 | |
| 2.0 mL Microcentrifuge Tubes | Fisher Scientific | 05-408-138 | microcentrifuge tubes for snapfreezing/bead beating |
| 2-Methylbutane (4 L) | Fisher Chemical | O3551-4 | isopentane |
| Absolute Ethanol (200 proof) | ThermoFisher Scientific | BP2818100 | |
| AffiniPure Fab fragment donkey anti-mouse | Jackson ImmunoResearch | 715-007-003 | mouse-on-mouse blocking |
| Alexa Fluor 488 donkey anti-chicken secondary antibody | Jackson ImmunoResearch | 703-545-155 | |
| Alexa Fluor 488 donkey anti-mouse secondary antibody | Invitrogen | A21202 | |
| Alexa Fluor 488 donkey anti-rabbit secondary antibody | Invitrogen | A21206 | |
| Alexa Fluor 568 donkey anti-goat secondary antibody | Invitrogen | A11057 | |
| Alexa Fluor 568 donkey anti-rabbit secondary antibody | Invitrogen | A11037 | |
| Alexa Fluor 568 Phalloidin antibody | Invitrogen | A12380 | Dissolved in 1.5 mL methanol (~66 µM working solution) |
| BioLite 24-well Multidishes | ThermoFisher Scientific | 930186 | 24 well plate for PFA tissue incubation |
| Biometra TOne | analytikjena | 8462070301 | Thermal cycler |
| Chicken anti-GFP antibody | Aves Labs | GFP-1020 | |
| Chloroform/isoamyl alcohol 24:1(v/v) for molecular biology, DNAse, RNAse, and Protease free | ThermoFisher Scientific | AC327155000 | |
| Corn oil | Sigma Aldrich | C8267 | |
| DAPI stain | Invitrogen | D1306 | 150 µM working solution in dH2O |
| Donkey Serum (100 mL) | Millipore Sigma | 5058837 | for blocking solution |
| Dumont #5 Forceps | Fine Science Tools | 11251-20 | sharp-tipped tweezers |
| Fine Scissors Straight 9 cm | Fine Science Tools | 14060-09 | |
| Fluoromount-G | SouthernBiotech | 0100-01 | mounting medium |
| Glycerol, 99.5%, for molecular biology (500 mL) | Acros Organics | 327255000 | |
| Goat anti-PDGFRα antibody | R&D | AF1062 | |
| Hybridization Oven | VWR | 230301V | for Tamoxifen incubation |
| ImmEdge Hydrophobic Barrier PAP Pen | Vector Laboratories | H-4000 | hydrophobic pen |
| Insulin Syringe with Micro-Fine IV needle (28 G) | BD | 329461 | |
| Insulin Syringe with Slip Tip, 1 mL | BD | 329654 | Insulin syringe without needle, for oral gavaging |
| iScript cDNA Synthesis Kit | Bio-Rad | 1708890 | |
| Isoflurane | Patterson Veterinary | 78938441 | |
| Leica DMi8 inverted microscope | Leica | micrscope used for widefield IF and confocal imaging | |
| Micro Slides | VWR | 48311-703 | positively charged microscope slides |
| mouse anti-MYOD antibody | Invitrogen | MA1-41017 | |
| mouse anti-PAX7 antibody (supernatant) | DSHB | AB 428528 | |
| MX35 Premier+ Microtome blades | ThermoFisher Scientific | 3052835 | microtome blades |
| NanoDrop 2000 Spectrophotometer | ThermoFisher Scientific | ND2000 | spectrophotometer for RNA yield |
| Play-Doh | Hasbro | modeling compound | |
| PowerUp SYBR Green Master Mix | ThermoFisher Scientific | A25742 | green dye PCR master mix |
| Puralube Vet Ointment | Puralube | 17033-211-38 | vet ophthalmic ointment |
| QuantStudi 6 Flex Real-Time 384-well PCR System | Applied Biosystems | 4485694 | qPCR machine |
| Rabbit anti-perilipin antibody | Cell Signaling Technology | 9349S | |
| Red-Rotor Shaker | Hoefer Scientific | PR70-115V | shaker for IF staining |
| Richard-Allan Scientific Slip-Rite Cover Glass | ThermoFisher Scientific | 152460 | coverslips |
| RNeasy Mini Kit | QIAGEN | 74106 | contains mini spin columns |
| Safe-Lock Tubes 1.5 ml, natural | Eppendorf | 22363204 | |
| Sample Tubes RB (2 mL) | QIAGEN | 990381 | |
| Sodium azide | Alfa Aesar | 14314 | |
| Stainless Steel Beads, 2.8 mm | Precellys | KT03961-1-101.BK | small beads |
| Stainless Steel Beads, 5 mm | QIAGEN | 69989 | medium beads |
| Stainless Steel Beads, 7 mm | QIAGEN | 69990 | large beads |
| Stainless Steel Disposable Scalpels | Miltex | 327-4102 | scalpel |
| Stainless steel feeding tube, 20 G x 38 mm, straight | Instech Laboratories | FTSS-20S-3 | gavage needle |
| Tamoxifen | Toronto Research Chemicals | T006000 | |
| Tissue Plus O.C.T. Compound | Fisher HealthCare | 4585 | embedding medium |
| TissueLyser LT | QIAGEN | 85600 | bead beater |
| TissueLyser LT Adapter, 12-Tube | QIAGEN | 69980 | |
| Tissue-Tek Cryomold | Sakura | 4566 | specimen molds |
| Triton X-100 | Alfa Aesar | A16046 | |
| TRIzol Reagent | ThermoFisher Scientific | 15596026 | guanidium thiocyanate |
| Tween20 (500 mL) | Fisher BioReagents | BP337-500 | |
| VWR Micro Slides - Superfrost Plus | VWR | 48311703 | |
| Wheaton Coplin staining jars | Millipore Sigma | S6016 | Coplin jar |
References
- Milad, N., et al. Increased plasma lipid levels exacerbate muscle pathology in the mdx mouse model of Duchenne muscular dystrophy. Skeletal Muscle. 7 (1), 19 (2017).
- Goodpaster, B. H., et al. Obesity, regional body fat distribution, and the metabolic syndrome in older men and women. Archives of Internal Medicine. 165 (7), 777-783 (2005).
- Goodpaster, B. H., et al. Association between regional adipose tissue distribution and both type 2 diabetes and impaired glucose tolerance in elderly men and women. Diabetes Care. 26 (2), 372-379 (2003).
- Goodpaster, B. H., et al. The loss of skeletal muscle strength, mass, and quality in older adults: the health, aging and body composition study. The Journals of Gerontology, Series A: Biological Sciences and Medical Sciences. 61 (10), 1059-1064 (2006).
- Goodpaster, B. H., Thaete, F. L., Kelley, D. E. Thigh adipose tissue distribution is associated with insulin resistance in obesity and in type 2 diabetes mellitus. American Journal of Clinical Nutrition. 71 (4), 885-892 (2000).
- Goodpaster, B. H., Theriault, R., Watkins, S. C., Kelley, D. E. Intramuscular lipid content is increased in obesity and decreased by weight loss. Metabolism. 49 (4), 467-472 (2000).
- Burakiewicz, J., et al. Quantifying fat replacement of muscle by quantitative MRI in muscular dystrophy. Journal of Neurology. 264 (10), 2053-2067 (2017).
- Murphy, W. A., Totty, W. G., Carroll, J. E. MRI of normal and pathologic skeletal muscle. American Journal of Roentgenology. 146 (3), 565-574 (1986).
- Willcocks, R. J., et al. Multicenter prospective longitudinal study of magnetic resonance biomarkers in a large duchenne muscular dystrophy cohort. Annals of Neurology. 79 (4), 535-547 (2016).
- Wokke, B. H., et al. Quantitative MRI and strength measurements in the assessment of muscle quality in Duchenne muscular dystrophy. Neuromuscular Disorders. 24 (5), 409-416 (2014).
- Contreras, O., Rossi, F. M. V., Theret, M. Origins, potency, and heterogeneity of skeletal muscle fibro-adipogenic progenitors-time for new definitions. Skeletal Muscle. 11 (1), 16 (2021).
- El Agha, E., et al. Mesenchymal stem cells in fibrotic disease. Cell Stem Cell. 21 (2), 166-177 (2017).
- Joe, A. W., et al. Muscle injury activates resident fibro/adipogenic progenitors that facilitate myogenesis. Nature Cell Biology. 12 (2), 153-163 (2010).
- Liu, W., Liu, Y., Lai, X., Kuang, S. Intramuscular adipose is derived from a non-Pax3 lineage and required for efficient regeneration of skeletal muscles. Developmental Biology. 361 (1), 27-38 (2012).
- Scott, R. W., Arostegui, M., Schweitzer, R., Rossi, F. M. V., Underhill, T. M. Hic1 defines quiescent mesenchymal progenitor subpopulations with distinct functions and fates in skeletal muscle regeneration. Cell Stem Cell. 25 (6), 797-813 (2019).
- Uezumi, A., et al. Fibrosis and adipogenesis originate from a common mesenchymal progenitor in skeletal muscle. Journal of Cell Science. 124, 3654-3664 (2011).
- Hogarth, M. W., et al. Fibroadipogenic progenitors are responsible for muscle loss in limb girdle muscular dystrophy 2B. Nature Communications. 10 (1), 2430 (2019).
- Uezumi, A., Fukada, S., Yamamoto, N., Takeda, S., Tsuchida, K. Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle. Nature Cell Biology. 12 (2), 143-152 (2010).
- Stumm, J., et al. Odd skipped-related 1 (Osr1) identifies muscle-interstitial fibro-adipogenic progenitors (FAPs) activated by acute injury. Stem Cell Research. 32, 8-16 (2018).
- Kopinke, D., Roberson, E. C., Reiter, J. F. Ciliary Hedgehog signaling restricts injury-induced adipogenesis. Cell. 170 (2), 340-351 (2017).
- Huang, Y., Das, A. K., Yang, Q. Y., Zhu, M. J., Du, M. Zfp423 promotes adipogenic differentiation of bovine stromal vascular cells. PLoS One. 7 (10), 47496 (2012).
- Sun, Y. -. M., et al. PDGFRα regulated by miR-34a and FoxO1 promotes adipogenesis in porcine intramuscular preadipocytes through Erk signaling pathway. International Journal of Molecular Sciences. 18 (11), 2424 (2017).
- Te, L. J. I., Doherty, C., Correa, J., Batt, J. Identification, isolation, and characterization of fibro-adipogenic progenitors (FAPs) and myogenic progenitors (MPs) in skeletal muscle in the rat. Journal of Visualized Experiments: JoVE. (172), e61750 (2021).
- Lukjanenko, L., et al. Aging disrupts muscle stem cell function by impairing matricellular WISP1 secretion from fibro-adipogenic progenitors. Cell Stem Cell. 24 (3), 433-446 (2019).
- Santini, M. P., et al. Tissue-resident PDGFRalpha(+) progenitor cells contribute to fibrosis versus healing in a context- and spatiotemporally dependent manner. Cell Reports. 30 (2), 555-570 (2020).
- Uezumi, A., et al. Identification and characterization of PDGFRalpha+ mesenchymal progenitors in human skeletal muscle. Cell Death & Disease. 5, 1186 (2014).
- Wosczyna, M. N., et al. Mesenchymal stromal cells are required for regeneration and homeostatic maintenance of skeletal muscle. Cell Reports. 27 (7), 2029-2035 (2019).
- Soliman, H., et al. Pathogenic potential of Hic1-expressing cardiac stromal progenitors. Cell Stem Cell. 26 (2), 205-220 (2020).
- Chung, M. I., Bujnis, M., Barkauskas, C. E., Kobayashi, Y., Hogan, B. L. M. Niche-mediated BMP/SMAD signaling regulates lung alveolar stem cell proliferation and differentiation. Development. 145 (9), (2018).
- Hilgendorf, K. I., et al. Omega-3 fatty acids activate ciliary FFAR4 to control adipogenesis. Cell. 179 (6), 1289-1305 (2019).
- Waisman, A., Norris, A. M., Elías Costa, M., Kopinke, D. Automatic and unbiased segmentation and quantification of myofibers in skeletal muscle. Scientific Reports. 11 (1), 11793 (2021).
- Kang, S. H., Fukaya, M., Yang, J. K., Rothstein, J. D., Bergles, D. E. NG2+ CNS glial progenitors remain committed to the oligodendrocyte lineage in postnatal life and following neurodegeneration. Neuron. 68 (4), 668-681 (2010).
- Srinivas, S., et al. Cre reporter strains produced by targeted insertion of EYFP and ECFP into the ROSA26 locus. BMC Developmental Biology. 1, 4 (2001).
- Lukjanenko, L., Brachat, S., Pierrel, E., Lach-Trifilieff, E., Feige, J. N. Genomic profiling reveals that transient adipogenic activation is a hallmark of mouse models of skeletal muscle regeneration. PLoS One. 8 (8), 71084 (2013).
- Mahdy, M. A., Lei, H. Y., Wakamatsu, J., Hosaka, Y. Z., Nishimura, T. Comparative study of muscle regeneration following cardiotoxin and glycerol injury. Annals of Anatomy = Anatomischer Anzeiger: Official Organ of the Anatomische Gesellscaft. 202, 18-27 (2015).
- Pisani, D. F., Bottema, C. D., Butori, C., Dani, C., Dechesne, C. A. Mouse model of skeletal muscle adiposity: a glycerol treatment approach. Biochemical and Biophysical Research Communications. 396 (3), 767-773 (2010).
- Kawai, H., et al. Experimental glycerol myopathy: a histological study. Acta Neuropathologica. 80 (2), 192-197 (1990).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative CT method. Nature Protocols. 3 (6), 1101-1108 (2008).
- Uezumi, A., et al. Mesenchymal Bmp3b expression maintains skeletal muscle integrity and decreases in age-related sarcopenia. The Journal of Clinical Investigation. 131 (1), 139617 (2021).
- Biferali, B., et al. Prdm16-mediated H3K9 methylation controls fibro-adipogenic progenitors identity during skeletal muscle repair. Science Advances. 7 (23), 9371 (2021).
- Biltz, N. K., Meyer, G. A. A novel method for the quantification of fatty infiltration in skeletal muscle. Skeletal Muscle. 7 (1), (2017).
- Vieites-Prado, A., Renier, N. Tissue clearing and 3D imaging in developmental biology. Development. 148 (18), (2021).
- Gómez-Gaviro, M. V., Sanderson, D., Ripoll, J., Desco, M. Biomedical applications of tissue clearing and three-dimensional imaging in health and disease. iScience. 23 (8), 101432 (2020).
- Ueda, H. R., et al. Tissue clearing and its applications in neuroscience. Nature Reviews Neuroscience. 21 (2), 61-79 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved