Method Article
Una guía para examinar la formación de grasa intramuscular y su origen celular en el músculo esquelético
En este artículo
Resumen
El reemplazo del tejido muscular sano con grasa intramuscular es una característica prominente de las enfermedades y afecciones humanas. Este protocolo describe cómo visualizar, visualizar y cuantificar la grasa intramuscular, lo que permite el estudio riguroso de los mecanismos subyacentes a la formación de grasa intramuscular.
Resumen
Los progenitores fibroadipogénicos (FAP) son células del estroma mesenquimal que desempeñan un papel crucial durante la homeostasis y regeneración del músculo esquelético. Los FAP construyen y mantienen la matriz extracelular que actúa como un andamio molecular de miofibra. Además, los FAP son indispensables para la regeneración de miofiberes, ya que secretan una multitud de factores beneficiosos detectados por las células madre musculares (MuSC). En estados enfermos, sin embargo, los FAPs son el origen celular de la grasa intramuscular y el tejido cicatricial fibrótico. Esta fibrosis grasa es un sello distintivo de la sarcopenia y las enfermedades neuromusculares, como la distrofia muscular de Duchenne. Una barrera importante para determinar por qué y cómo los FAP se diferencian en grasa intramuscular es la preservación efectiva y la posterior visualización de los adipocitos, especialmente en las secciones de tejido congelado. Los métodos convencionales de procesamiento del tejido muscular esquelético, como la congelación instantánea, no preservan adecuadamente la morfología de los adipocitos individuales, lo que impide una visualización y cuantificación precisas. Para superar este obstáculo, se desarrolló un riguroso protocolo que preserva la morfología de los adipocitos en las secciones del músculo esquelético, lo que permite la visualización, la obtención de imágenes y la cuantificación de la grasa intramuscular. El protocolo también describe cómo procesar una porción de tejido muscular para RT-qPCR, lo que permite a los usuarios confirmar los cambios observados en la formación de grasa al ver las diferencias en la expresión de genes adipogénicos. Además, se puede adaptar para visualizar adipocitos mediante inmunofluorescencia de montaje completo de muestras musculares. Finalmente, este protocolo describe cómo realizar el rastreo genético del linaje de los FAPs que expresan Pdgfrα para estudiar la conversión adipogénica de los FAPs. Este protocolo produce consistentemente imágenes inmunofluorescentes de alta resolución y morfológicamente precisas de adipocitos, junto con la confirmación por RT-qPCR, lo que permite una visualización y cuantificación robustas, rigurosas y reproducibles de la grasa intramuscular. En conjunto, la línea de análisis descrita aquí es el primer paso para mejorar nuestra comprensión de cómo los FAP se diferencian en grasa intramuscular, y proporciona un marco para validar nuevas intervenciones para prevenir la formación de grasa.
Introducción
La infiltración de tejido muscular sano con fibrosis grasa es una característica prominente de la distrofia muscular de Duchenne (DMD) y otras enfermedades neuromusculares, así como la sarcopenia, la obesidad y la diabetes 1,2,3,4,5,6,7,8,9,10 . Aunque el aumento de la infiltración de grasa en estas condiciones está fuertemente asociado con la disminución de la función muscular, nuestro conocimiento de por qué y cómo se forma la grasa intramuscular sigue siendo limitado. Los FAPs son una población multipotente de células del estroma mesenquimal presente en la mayoría de los órganos adultos, incluido el músculo esquelético11,12. Sin embargo, con la edad y en las enfermedades crónicas, los FAP producen tejido cicatricial fibrótico y se diferencian en adipocitos, que se encuentran entre las miofibras individuales y forman grasa intramuscular 13,14,15,16,17,18,19,20.
Para comenzar a combatir la formación de grasa intramuscular, es necesario definir los mecanismos de cómo los FAP se convierten en adipocitos. PDGFRα es el marcador "estándar de oro" en el campo para identificar FAPs dentro del músculo de múltiples especies 13,16,17,18,20,21,22,23,24,25,26,27. Como resultado, se han generado varias líneas de Cre inducibles con tamoxifeno murino, bajo el control del promotor Pdgfrα, lo que permite manipular genéticamente faPs in vivo utilizando el sistema Cre-LoxP 27,28,29. Por ejemplo, al combinar esta línea cre inducible con un reportero genético, se puede realizar el rastreo de linaje de FAPs, una estrategia que hemos aplicado con éxito al mapa de destino FAPs en músculo y tejido adiposo blanco 20,30. Además del rastreo de linaje, estas líneas cre proporcionan herramientas valiosas para estudiar la conversión de FAP a grasa.
Un obstáculo importante en la definición del mecanismo de la conversión adipogénica de los FAP en grasa intramuscular es la capacidad de cuantificar de manera rigurosa y reproducible la cantidad de grasa intramuscular que se ha formado en diferentes condiciones. La clave es equilibrar la preservación del tejido muscular y graso y hacer coincidir esto con los métodos de tinción disponibles para visualizar los adipocitos. Por ejemplo, el músculo esquelético a menudo se congela sin fijación previa, preservando las miofibras pero interrumpiendo la morfología de los adipocitos (Figura 1). Por el contrario, la fijación seguida de la incrustación de parafina, al tiempo que muestra la mejor histología tisular, incluidos los adipocitos, elimina todos los lípidos, lo que hace que la mayoría de los tintes lipofílicos, como el tinte oil red O comúnmente utilizado, sean inutilizables.
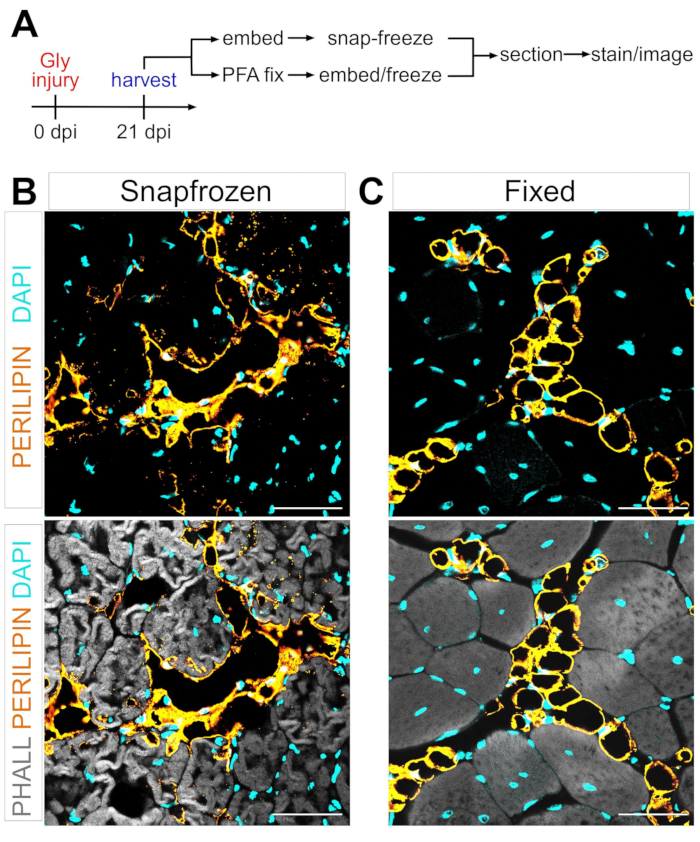
Figura 1: Imágenes representativas de la grasa intramuscular en tejidos musculares congelados frente a tejidos musculares fijos. (A) Descripción general esquemática de la configuración experimental. Imágenes inmunofluorescentes que muestran adipocitos (amarillo), miofibras (gris) y núcleos (cian) dentro de los TA (B) congelados al presión y (C) fijos a los 21 días después de la lesión por glicerol. Barras de escala: 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
El protocolo descrito aquí preserva la morfología de miofibra y adipocitos y permite la visualización y el análisis de múltiples tipos de células. Este enfoque se basa en la tinción por inmunofluorescencia de adipocitos en tejido muscular fijo de paraformaldehído (PFA), lo que permite la tinción conjunta con múltiples anticuerpos. También se puede adaptar fácilmente para mostrar espacialmente la grasa intramuscular en el tejido intacto utilizando imágenes de montaje completo, proporcionando así información sobre el microambiente celular de la grasa dentro del músculo. Además, este protocolo se puede combinar con nuestro enfoque recientemente publicado para determinar el área transversal de las miofiberes en tejidos musculares fijos31, una medida importante para evaluar la salud muscular. La combinación de este enfoque con el rastreo del linaje genético para mapear el destino, la diferenciación de los FAP en adipocitos también se describe aquí. Por lo tanto, el protocolo versátil descrito aquí permite una evaluación rigurosa y reproducible de los FAPs y su diferenciación en grasa intramuscular en secciones de tejido y tejidos intactos.
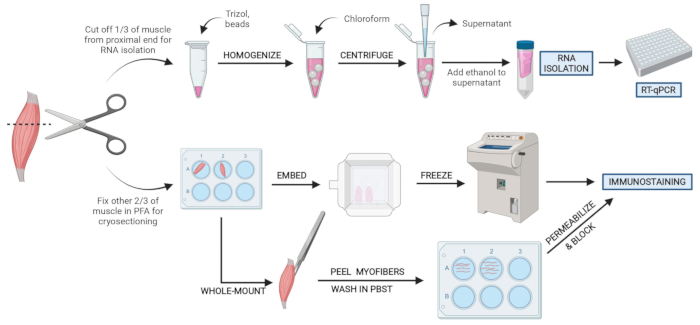
Figura 2: Descripción general del protocolo esquemático. Descripción general esquemática del procesamiento de tejidos en el que se extrae un tercio de la AT, se congela al instante y se homogeneiza para el posterior aislamiento de ARN y el análisis de transcripción a través de RT-qPCR. Los otros dos tercios de la AT se fijan con PFA y se procesan para inmunotinción en secciones congeladas o fibras de montaje completo. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
Todos los protocolos de animales fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) de la Universidad de Florida.
1. Rastreo genético del linaje de los FAPs
NOTA: Si no se desea el rastreo genético del linaje de los FAP, se puede omitir el paso 1.
- Para realizar el rastreo de linaje de FAPs, obtenga los alelos de ratón necesarios.
NOTA: Se han generado varias líneas de Cre inducibles por tamoxifeno, bajo el control del promotor Pdgfrα , para apuntar con éxito a los FAP, incluidos los laboratorios Hogan29, Rando27 y Bergles32 . Como reportero genético de la actividad de Cre, numerosos alelos reporteros Rosa26 están disponibles, como Rosa26EYFP33. Si bien se sugiere que cada laboratorio determine qué combinación cre-reportera es más efectiva, cruzando ratones PdgfrαCreERT2 (29 y Jax # 032770) al reportero Rosa26EYFP (33 y Jax # 006148), el PdgfrαCreERT2 resultante; Los ratonesRosa26 EYFPse pueden utilizar para marcar de manera eficiente y específica FAPs20. Para rastrear el destino de los FAP maduros, se recomienda esperar hasta que los ratones hayan alcanzado al menos ~ 10 semanas de edad antes de administrar tamoxifeno. Los experimentos de rastreo de linaje se pueden realizar tanto en machos como en hembras. - Administración de tamoxifeno a través de gavaging oral
- Prepare 40 mg / ml de tamoxifeno en aceite de maíz y vórtice bien para mezclar 1 día antes de la gavaging. Incubar O/N a 37 °C en un horno de hibridación giratorio.
PRECAUCIÓN: El tamoxifeno es un carcinógeno y debe manipularse con cuidado. Siempre use guantes cuando manipule y use una máscara cuando la pese como polvo, ya que existe el peligro de inhalación. - Limpie el área de acuerdo con el protocolo y conecte una aguja de gavaging a una jeringa de 1 ml. Extraiga 200 μL de tamoxifeno en la jeringa.
- Scruff PdgfrαCreERT2 ; RatonesRosa26 EYFP (10 semanas de edad; ambos sexos utilizados) colocándolos sobre una superficie plana y agarrando firmemente la base de la cola. Use una mano libre para agarrar el centro del mouse con el pulgar y el dedo índice, luego suavemente y con una ligera presión deslice el agarre hasta que pase los hombros.
- Pellizque la piel hacia atrás con el pulgar y el dedo índice, levante el mouse y voltee la mano para que el mouse esté mirando hacia el usuario, y coloque la cola entre el dedo meñique y anular de la mano que sostiene el mouse.
- En este punto, asegúrese de que el ratón esté bien inmovilizado y no pueda mover la cabeza o los brazos. Inserte la aguja de gavaging en la boca y úsela para inclinar ligeramente la cabeza del mouse hacia atrás; esto permite que el esófago sea más accesible.
- Inserte la aguja con cuidado y lentamente en el esófago. No fuerce la aguja si se encuentra alguna resistencia; la aguja debe deslizarse hacia abajo fácilmente. Inyecte lentamente el tamoxifeno. Monitoree a los ratones durante 15-20 minutos para asegurarse de que no ocurran problemas durante el gavaging.
NOTA: La administración de tamoxifeno en 2 días consecutivos generalmente resulta en ~ 75% -85% de eficiencia de recombinación de FAPs sin causar ningún efecto adverso. Se recomienda que el usuario espere 1-2 semanas antes de inducir la lesión, lo que permitirá que el tamoxifeno restante se elimine del sistema y que se entregue cualquier proteína restante.
- Prepare 40 mg / ml de tamoxifeno en aceite de maíz y vórtice bien para mezclar 1 día antes de la gavaging. Incubar O/N a 37 °C en un horno de hibridación giratorio.
2. Lesión del músculo tibial anterior (TA)
NOTA: Para estudiar la grasa intramuscular, se recomienda utilizar un modelo de lesión a base de glicerol (50% de glicerol en solución salina estéril), lo que resulta en la formación masiva de grasa intramuscular 34,35,36,37.
- Prepare la máquina anestésica agregando isoflurano y asegurándose de que los tubos tanto de la cámara del ratón como del cono de la nariz estén abiertos. Limpie la cámara y el área de trabajo con etanol al 70% o solución de peróxido (dependiendo de los protocolos).
- Ajuste el caudal de oxígeno a 2,5 L/min y la concentración de isoflurano al 2,5%. Coloque un ratón en la cámara de anestesia y espere ~ 5 minutos para que sea anestesiado.
- Coloque el ratón en decúbito supino sobre una almohadilla térmica limpia e inserte la nariz en el cono de la nariz. Aplique suavemente ungüento oftálmico veterinario en los ojos con un aplicador con punta de algodón para evitar la sequedad mientras está bajo anestesia. Controle continuamente la anestesia y realice un pellizco en el dedo del pie en el ratón antes de la lesión para asegurarse de que el ratón esté completamente anestesiado.
- Limpie la pierna para inyectarla con una toallita con alcohol fresco para desinfectar.
- Extraiga 30-50 μL de glicerol al 50% (dependiendo del tamaño de los ratones) en la jeringa de insulina. Cepille suavemente el cabello en la espinilla para exponer la ubicación de la AT.
NOTA: Es más fácil mover el cabello y lograr una mejor visualización cuando todavía está mojado por la toallita con alcohol. - Después de localizar la AT (justo lateral a la tibia, sobresale ligeramente a través de la piel y se puede sentir con una palpación suave), inserte la aguja en la TA distalmente, cerca del tobillo. Inserte completamente la aguja en el músculo e inyecte lentamente glicerol mientras retira gradualmente la aguja, lo que ayuda a lesionar la mayor parte del músculo.
NOTA: Es mejor insertar la aguja paralela a la pierna, con solo un ángulo ligeramente elevado. Una buena lesión generalmente causa dorsiflexión a medida que la AT se contrae después de retirar la aguja. Si los dedos de los pies del ratón se extendieron, es probable que se inyectara el músculo extensor digitorum longus (EDL). - Coloque el ratón de nuevo en la jaula y monitoree durante unos 15-20 minutos para garantizar la recuperación de la anestesia.
- Deseche la aguja en un recipiente para objetos punzantes. Nunca recapitule una aguja.
NOTA: La analgesia después de la inyección de glicerol debe proporcionarse según lo aprobado por el Comité Institucional de Cuidado y Uso de Animales. Los adipocitos se pueden observar tan pronto como 5 días después de la lesión (dpi). A los 7 dpi, todos los adipocitos se han formado, y a los 21 dpi, han madurado completamente.
3. Cosecha de tejidos
- Prepare 4% de PFA en 1x PBS y colóquelo en hielo antes de comenzar la cosecha.
- Coloque cualquier placa (12 o 24 pocillos) que se use para la fijación muscular en hielo y agregue 4% de PFA a cada pozo, asegurándose de que cada pozo tenga 10-20 veces más volumen de PFA que el tejido que se está fijando.
- Entre 7 y 21 días después de la lesión por glicerol, eutanasiar al ratón de acuerdo con las pautas institucionales (es decir, sobredosis de isoflurano seguida de dislocación cervical).
- Comience a cosechar cualquier tejido que se utilizará para la histología o el aislamiento de ARN.
NOTA: Los tejidos deben congelarse a presión o colocarse en PFA dentro de los 10-15 minutos posteriores al sacrificio (Figura 2). - Rocíe generosamente cualquier área del ratón que se corte con etanol al 70% para ayudar a mantener el cabello fuera del área de disección y los instrumentos.
- Use tijeras para cortar la piel alrededor de la parte superior de la pierna, cerca de la pelvis (Figura 3A).
- Tire suavemente de la piel de la pierna desde la parte superior hasta el tobillo (Figura 3B).
NOTA: El TA es un músculo en forma de lágrima con un tendón distal claramente definido que se une al hueso cuneiforme medial y al primer metatarsiano. Es lateral a la tibia y se extiende hasta la parte inferior de la rodilla. - Primero, retire la capa externa de tejido conectivo (epimisio) con pinzas de punta afilada antes de cosechar la TA (Figura 3C). Use un microscopio de disección para visualizar mejor el epimisio.
- Deslice las pinzas debajo de la TA desde la parte inferior del músculo, comenzando en el tendón distal, y tire suavemente hacia arriba hacia la rodilla (Figura 3D). Deténgase en el extremo del músculo; no empuje más allá de la resistencia que se siente en la parte inferior de la rodilla.
- Si hay una resistencia significativa antes de llegar a la parte inferior de la rodilla, deténgase y continúe eliminando las capas sobrantes de tejido conectivo.
NOTA: Hay otro tendón distal justo lateral al tendón TA que se une al EDL, que es un músculo delgado lateral al TA. Tener cuidado de deslizar solo las pinzas debajo del tendón TA evita la recolección accidental del EDL, pero también se puede quitar fácilmente después de la fijación. - Una vez que la AT se haya levantado parcialmente de la pierna con las pinzas, use el mismo movimiento con un bisturí para cortar la conexión de la TA a la parte inferior de la rodilla (Figura 3E). Corte el tendón en el tobillo con tijeras para eliminar completamente la AT. Solo maneje el músculo en el tendón para evitar dañar las fibras.
- Corte 1/3 de la TA en el extremo opuesto al tendón (Figura 3F), colóquela en un tubo de microcentrífuga y congele dejándola caer en nitrógeno líquido (Figura 3H).
- Sumergir los otros 2/3 del tejido en un pozo marcado con 4% de PFA para histología (Figura 3I). Asegúrese de realizar un seguimiento de cuándo se colocó el primer y último tejido en fijador. Colocar en una coctelera durante 2-2,5 h a 4 °C.
- La duración de la fijación depende del tejido y su tamaño. Determine la duración requerida para la fijación de los tejidos. La fijación de los AATT durante 2-2,5 h a 4 °C normalmente preserva bien la morfología de los adipocitos sin causar una fijación excesiva del tejido.
NOTA: Si planea usar TA para la tinción inmunofluorescente de montaje completo, omita el resto de este protocolo hasta llegar a la Sección 7: "Tinción inmunofluorescente de montaje completo". - Después de la fijación, retire el PFA de los pocillos, enjuague los tejidos con 1x PBS frío 2-3 veces, y luego lave 2-3 veces con 1x PBS frío durante 5 min por lavado.
- Retire el PBS de los pocillos y agregue suficiente sacarosa al 30% en 1x PBS para permitir que el tejido flote. Colocar en la coctelera a 4 °C durante la noche.
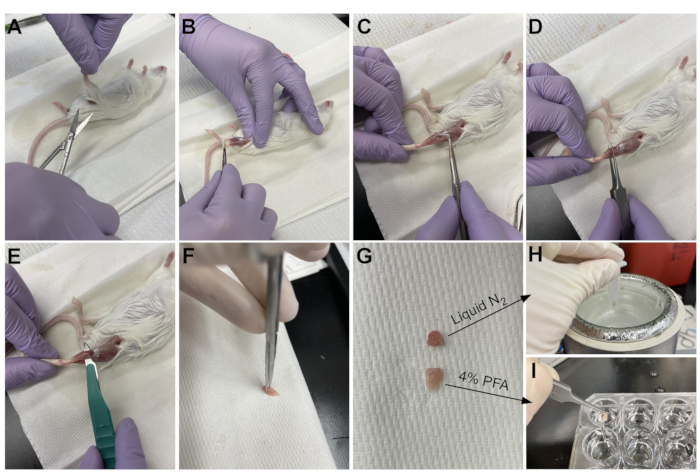
Figura 3: Resumen de la cosecha de tejidos. (A) La piel se corta en la base de la pierna y (B) los músculos de las extremidades posteriores están expuestos. (C) Una vez que se retira el epimisio de la AT, (D) se utilizan fórceps para separar parcialmente el músculo y garantizar que el epimisio se haya eliminado por completo. (E) La TA se corta de la pierna con un bisturí y se retira después de cortar el tendón. (G) Después de cortar el TA en una pieza de un tercio y dos tercios, (H) un tercio se congela a presión en nitrógeno líquido para el análisis RT-qPCR y (I) los otros dos tercios se fijan en PFA al 4% para histología. Haga clic aquí para ver una versión más grande de esta figura.
4. Incrustación
- Prepare los moldes de muestra que se utilizarán para incrustar etiquetando y llenando con suficiente medio de incrustación para sumergir completamente los tejidos.
- Retire los pañuelos de papel de los pozos, seque el exceso de sacarosa en una toalla de papel y muévase a los moldes de muestras llenos de medio de congelación.
NOTA: Es útil saber en qué orientación se seccionará el molde en el criostato. De esta manera, el usuario puede orientar los tejidos en el molde de una manera que permita que el área de interés sea fácilmente accesible. Para el TA, esto se lograría colocando el extremo más grueso (opuesto al lado del tendón) frente a la superficie que se seccionará. Esto permite que la AT se seccione fácilmente en su parte más gruesa (vientre) y permite el corte transversal de las fibras musculares. - Prepare una suspensión de isopentano sumergiendo parcialmente un recipiente que contenga isopentano en nitrógeno líquido. Asegúrese de que haya suficiente isopentano líquido en el recipiente para sumergir aproximadamente la mitad del molde de la muestra que se utilizará para incrustar los tejidos.
- Comience a congelar los moldes poniéndolos cuidadosamente en la suspensión de isopentano y asegurándose de que aproximadamente la mitad del molde esté sumergido. Además, asegúrese de que el moho se congele por igual desde los cuatro lados.
- Saque el molde del isopentano justo antes de que todo el molde se congele visiblemente desde la parte superior. La cantidad de tiempo que esto toma depende de los moldes que se utilizan.
- Mantenga los moldes congelados en un recipiente con hielo seco mientras congela el resto de los bloques, luego guárdelos a -80 ° C.
NOTA: El isopentano para congelación se puede reutilizar. Póngalo en una botella de vidrio, pero no apriete la tapa hasta que el isopentano alcance la temperatura ambiente (RT). De lo contrario, el cambio en la presión podría romper la botella.
5. Seccionamiento
- Ajuste el criostato a -22 a -24 °C, agregue moldes que contengan TA en el criostato y espere un mínimo de 30 minutos para la aclimatación a la temperatura. Mientras tanto, etiquete una serie de portaobjetos de microscopio cargados positivamente.
- Inserte una placa estabilizadora y alinee con el criostato de tal manera que haya cortes mínimos en la placa donde hace contacto con el bloque de muestra. Seguro en su lugar.
- Inserte una cuchilla de criostato fresca en el soporte de la cuchilla y asegúrela en su lugar.
PRECAUCIÓN: La cuchilla es afilada. Cubra la cuchilla cuando manipule otras partes del criostato o moldes congelados. - Retire el bloque congelado del molde. Agregue una capa uniforme de medio de incrustación al mandril de criostato y coloque el bloque en el medio. Déjelo reposar durante 1-3 minutos hasta que el medio de incrustación esté completamente congelado (blanco opaco).
NOTA: Para los TA, el área más gruesa (vientre) debe ser visible cuando está en el mandril. - Coloque el mandril del criostato con el bloque de tejido en el criostato. Destapa la cuchilla y avanza el criostato hacia adelante hasta que entre en contacto con la cuchilla. Sección a través del bloque a secciones de 25 μm hasta que el tejido ya no esté oscurecido por el medio de incrustación.
NOTA: Durante la sección, ajuste el ángulo del criostato y / o la posición de la etapa de tal manera que las secciones sean de espesor uniforme. Puede ser útil recolectar algunas secciones para garantizar la uniformidad en el grosor de la sección. Se recomienda que el usuario encuentre la posición adecuada de la placa antivuelco antes de seccionar a través de la región de interés dentro del TA (vientre), ya que esto permite al usuario probar varias posiciones de la placa antivuelco hasta que las secciones se desprendan rectas sin desperdiciar tejido. - Cambie el grosor de la sección a 10-12 μm y recoja las secciones en portaobjetos de microscopio etiquetados. Se recomienda la seccionamiento en serie mediante la recolección de secciones adyacentes en 6-10 diapositivas (etiquetadas 1-x), lo que permite la tinción para múltiples marcadores. Si es necesario, use un pincel delgado para desenroscar las secciones antes de recogerlas en la diapositiva.
NOTA: Si las secciones se están curvando, verifique que la temperatura se mantenga estable dentro del rango de -22 a -24 ° C. Si hay estrías verticales en las secciones, esto podría deberse a un corte en la placa estabilizadora o la cuchilla; esto se puede arreglar ajustando la posición de la placa estabilizadora y / o cambiando a una nueva cuchilla. - Después de recolectar secciones adyacentes del mismo plano de seccionamiento en cada diapositiva, ajuste el grosor a 25 μm para avanzar 150-200 μm a través del bloque, luego ajuste el grosor a 10-12 μm y comience a seccionar nuevamente.
NOTA: Esta sección en serie permite al usuario visualizar, visualizar y cuantificar a diferentes profundidades a través de la TA; tres o cuatro secciones en serie por diapositiva es suficiente. - Guarde los portaobjetos y los bloques de tejido a -80 °C.
6. Tinción inmunofluorescente (IF) de secciones de tejido
NOTA: Como las concentraciones de anticuerpos pueden variar entre lotes y fabricantes, se recomienda la optimización mediante la evaluación de varias concentraciones diferentes de los anticuerpos en las diapositivas de prueba antes de teñir las diapositivas de interés.
- Descongelar/secar los toboganes a RT o en una placa caliente a 37 °C durante 10-20 min.
- Use un bolígrafo hidrófobo para dibujar una línea en el borde de la superficie de papel de la diapositiva, donde se encuentra con el vidrio.
- Coloque las diapositivas en un frasco de Coplin y lave con 1x PBS + 0.1% Tween20 (PBST) 3-5x en una coctelera durante al menos 5 minutos por lavado para rehidratar las secciones de tejido.
NOTA: En este punto, es importante no dejar que los portaobjetos se asienten sin estar sumergidos en PBST (hasta la línea hidrofóbica), o las secciones de tejido se secarán. - Coloque los portaobjetos en el bastidor de una cámara humidificadora y superponga los portaobjetos con 310-350 μL de solución de bloqueo (5% de suero de burro y 0.3% de Tritón X-100 en 1x PBS) durante 1-2 h en RT.
NOTA: No se necesita ningún paso de permeabilización adicional, ya que la solución de bloqueo contiene 0.3% Triton X-100, lo que permite una permeabilización suficiente de las secciones de tejido. Cuando se utilizan anticuerpos primarios derivados de ratones (es decir, PAX7 y MYOD1 enumerados a continuación), se recomienda incluir un paso de bloqueo de ratón sobre ratón utilizando fragmentos Fab (1:50) en la solución de bloqueo para el paso de bloqueo. Esto ayudará a reducir el fondo debido a la unión inespecífica del anticuerpo secundario del ratón a anticuerpos distintos del primario. - Diluya los anticuerpos primarios que se utilizarán en la solución de bloqueo poco antes de pasar al siguiente paso de la siguiente manera:
- Anticuerpos primarios para la tinción de adipocitos e imágenes de sección completa: Diluir anti-perilipina de conejo a una relación de dilución de 1:1000.
- Anticuerpos primarios para el rastreo del linaje de los adipocitos: Diluir el pollo anti-GFP en una proporción de 1:1000 y el anti-perilipina de conejo en 1:1000.
- Anticuerpos primarios para el rastreo del linaje de FAPs: Diluir pollo anti-GFP en una proporción de 1:1000 y anti-PDGFRα de cabra en 1:250.
- Anticuerpos primarios para marcadores miogénicos: Diluir anti-PAX7 de ratón en una proporción de 1:25 o anti-MYOD1 de ratón en 1:250, y anti-LAMININA de conejo en 1:1000.
NOTA: Si bien los anticuerpos enumerados anteriormente se han evaluado con éxito con este protocolo, es probable que otros marcadores y anticuerpos para etiquetar FAPs, adipocitos y / u otros tipos de células también sean compatibles con este protocolo. Se recomienda encarecidamente cuando se usan anticuerpos primarios por primera vez que el usuario incluya una diapositiva de control negativa, en la que se omiten los anticuerpos primarios. Esto controlará la especificidad de los anticuerpos. Se siguen todos los demás pasos del protocolo, incluida la adición de anticuerpos secundarios, pero la solución de bloqueo se usa sola en el siguiente paso en lugar del anticuerpo primario en la solución de bloqueo.
- Vierta la solución de bloqueo de las diapositivas y colóquela con 310-350 μL de solución de bloqueo con anticuerpos primarios e incube durante la noche a 4 °C en la cámara humidificadora.
- Al día siguiente, vierta la solución de bloqueo / anticuerpos primarios de las diapositivas y colóquelos en un frasco de Coplin. Enjuague las diapositivas 2-3 veces con PBST y lave 3-5x con PBST en un agitador durante al menos 5 minutos por lavado.
- Durante el último lavado, prepare los anticuerpos secundarios o cualquier conjugado directo que se utilizará en la solución de bloqueo. Minimice la cantidad de tiempo que estos anticuerpos pasan a la luz para evitar el fotoblanqueo.
- Anticuerpos secundarios diluidos/conjugados directos: 488 nm burro anti-pollo (1:1000) o anti-conejo (1:1000) o anti-ratón (1:1000), burro de 568 nm anti-cabra (1:1000) o anti-conejo (1:1000) o faloidina (miofiberes; 1:100), tinción DAPI (núcleos; 1:500).
- Superponga las diapositivas con 310-350 μL de la solución de bloqueo con anticuerpos secundarios y/o conjugados directos en la cámara humidificadora. Incubar en RT durante 1-2 h. Proteja las muestras de la luz a partir de ahora.
- Vierta la solución de bloqueo/anticuerpos secundarios y colóquelos en un frasco de Coplin. Enjuague con PBST una vez y lave 3-5 veces con PBST en una coctelera durante al menos 5 minutos por lavado. Mantenga el frasco de Coplin cubierto para evitar la exposición a la luz.
- Seque los toboganes lo mejor posible golpeando los bordes y limpiando la espalda contra una toalla de papel, pero no deje que las secciones de tejido se sequen.
- Agregue tres o cuatro gotas de medio de montaje acuoso al borde horizontal superior de la diapositiva y agregue suavemente un deslizamiento. No presione hacia abajo ni se mueva si se forman burbujas de aire debajo de la cubierta; cualquier presión o movimiento puede distorsionar la frágil arquitectura celular de los adipocitos.
- Permita que el medio de montaje se ajuste en la oscuridad durante la noche antes de la toma de imágenes.
7. Tinción inmunofluorescente de montaje completo
- Después de ~ 1 h de fijación (consulte el paso 3.14), use pinzas de punta afilada para despegar las miofiberes de la TA fija.
- Coloque las fibras separadas en una placa de 24 pocillos y lave 3 veces durante 3 minutos cada una con PBST. Para todas las incubaciones posteriores, asegúrese de agregar la tapa para evitar la evaporación.
- Incubar durante 1 h en Tritón X-100 al 1% en 1x PBS a RT (200-300 μL) en un agitador para permitir una mejor penetración de anticuerpos.
- Después de enjuagar varias veces con PBST, superponga con solución de bloqueo (200-300 μL) y bloquee en un nutator o agitador durante la noche a 4 ° C.
- Diluir los anticuerpos primarios a la concentración deseada (duplicar la concentración tiende a ser un buen punto de partida) en la solución de bloqueo. Incubar las muestras (200-300 μL) en un nutator o agitador durante la noche a 4 °C.
- Lave las muestras rigurosamente con PBST durante todo el día con cambios frecuentes en RT en el agitador, aproximadamente 4-6x durante 30-60 min cada lavado.
- Diluir los anticuerpos secundarios en la solución de bloqueo a la concentración deseada (1:500 tiende a funcionar bien) más la tinción nuclear e incubar las muestras (200-300 μL) en un nutator o agitador durante la noche a 4 °C.
- Lave las muestras rigurosamente con PBST durante todo el día con cambios frecuentes en RT en el agitador, aproximadamente 4-6 veces durante 30-60 minutos cada lavado o lave durante la noche a 4 ° C.
- Para montar, seque suavemente el exceso de PBST y luego coloque las fibras en una o dos gotas de medio de montaje en un portaobjetos de vidrio (Figura 4A). Para elevar el lape de cubierta (18 mm x 18 mm), agregue pequeños pies de arcilla; esto evitará que las fibras se aplasten y asegurará la cubierta a la corredera. Los compuestos de modelado funcionan bien para esto. Una vez que el coverlip esté asegurado, agregue más medio al borde hasta que el área debajo del coverslip esté llena.
NOTA: En lugar de utilizar un medio de montaje que contenga agentes antidesvanecimiento, el tejido también se puede mover a través de una serie ascendente de glicerol (30% a 80% de glicerol en PBS). - Espere 1-2 días antes de la toma de imágenes para permitir el curado del medio de montaje.
8. Imágenes de grasa intramuscular
- Encienda el microscopio e inicie el software de imágenes. Asegure la diapositiva en el escenario.
NOTA: Para obtener imágenes de adipocitos en secciones musculares, un objetivo de 5x o 10x combinado con microscopía de campo ancho a menudo es suficiente. Para visualizar WM-IF, se requiere un microscopio confocal. - Utilice cualquier canal para identificar el área a la que se va a crear una imagen.
- En el software de imágenes, ajuste el tiempo de ganancia y exposición para cada canal.
- Tome imágenes de todo el tejido en cada canal (automático o manual de acuerdo con el microscopio y el software utilizado) y fusione mosaicos individuales para hacer un compuesto de la sección transversal completa de TA.
NOTA: Se recomienda tomar imágenes de dos o tres secciones diferentes de la misma AT a diferentes profundidades. Al cuantificar los adipocitos en cada sección y luego informar el promedio, se evitarán las diferencias localizadas en la cantidad de grasa intramuscular debido, por ejemplo, a errores de inyección.
9. Cuantificación de los adipocitos
- Si no está instalado previamente, agregue el complemento Cell Counter a ImageJ (https://imagej.nih.gov/ij/plugins/cell-counter.html).
- Importe las imágenes a ImageJ como archivos TIF o archivos de microscopio originales. Vea cada canal en ImageJ como un archivo TIF independiente.
NOTA: Si utiliza LIF o tipos de archivo de microscopio similares, en Opciones de importación de bioformatos , elija Hyperstack para Ver pila con y marque la casilla de Canales divididos. Haga clic en Aceptar para abrir el archivo. Además, asegúrese de que la casilla Escala automática no esté marcada. - Asegúrese de que las imágenes de cada canal estén en formato de 8 bits (y gris): > de imagen Tipo > 8 bits.
- Combinar imágenes DAPI (azul), GFP (verde), PERILIPIN (rojo) y PHALLOIDIN (gris): Imagen > Color > Combinar canales.
- Compruebe que la escala (Analizar > Establecer escala) está en micras. Usando la herramienta de selección a mano alzada, describa la parte lesionada y no lesionada de cada sección transversal, luego mida (Analizar > Medir) y registre el área lesionada vs. no lesionada en una hoja de cálculo.
NOTA: El músculo lesionado se puede identificar como áreas desprovistas de miofibras o áreas pobladas por miofibras que contienen núcleos ubicados centralmente. - Iniciar contador de celdas: plugins > CellCounter > inicializar.
- Seleccione un tipo de contador y, a continuación, cuente cada adipocito. Registre el número total de adipocitos en una hoja de cálculo, luego calcule el número de adipocitos por 1 mm2 del área lesionada.
10. Análisis de expresión génica adipogénica mediante RT-qPCR
- Aislamiento de ARN
- Antes de comenzar, precaliente el agua libre de RNasa a 45 °C y prepare EtOH fresco al 70% (350 μL por muestra).
- Añadir 1.000 μL de tiocianato de guanidio a cada tubo que contenga la muestra (ver paso 3.12.). Es importante que se utilicen tubos aprobados por batidores de cuentas.
PRECAUCIÓN: El tiocianato de guanidio es tóxico. Use el equipo de protección personal adecuado y el mango en una campana extractora de humos. - Agregue tres cuentas medianas o una cuenta grande y una pequeña a cada tubo.
- Homogeneizar el tejido a 50 Hz durante 2-4 min usando un batidor de cuentas. Dependiendo del tipo de tejido y el tamaño de la muestra, puede tardar hasta 10 minutos.
- Añadir 200 μL de cloroformo.
PRECAUCIÓN: El cloroformo es tóxico. Use equipo de protección personal y mango en una campana extractora. - Agitar las muestras durante 15 s. Incubar durante 2-3 min en RT.
- Centrifugadora durante 15 min a 12.000 x g. Pipetear 350 μL del sobrenadante transparente (capa superior que contiene el ARN) y agregar a un nuevo tubo de microcentrífuga que contiene 350 μL de etanol al 70%. Tenga cuidado de no aspirar las capas inferiores de proteína y/o ADN
- Transfiera hasta 700 μL de la mezcla a una mini columna de centrifugado colocada en un tubo de recolección de 2 ml. Continúe con el aislamiento de ARN siguiendo las instrucciones del fabricante.
- Elute con 30-50 μL de agua libre de RNasa, dependiendo del rendimiento esperado. Mantenga el ARN en hielo y mida el rendimiento con un espectrofotómetro. Mantenga el ARN almacenado a -80 °C
NOTA: Es posible omitir el paso de tratamiento de la DNasa, ya que quitar cuidadosamente solo los 350 μL superiores de la capa de ARN es suficiente para prevenir la contaminación del ADN. Además del análisis RT-qPCR, el ARN aislado también se puede utilizar para la secuenciación del ARN, en cuyo caso se recomienda encarecidamente un paso de tratamiento con DNasa.
- Síntesis de ADNc
- Utilice hasta 1 μg de ARN para sintetizar ADNc con un kit de síntesis de ADNc, siguiendo las instrucciones del fabricante.
- Una vez completada la ejecución, agregue 80 μL de agua libre de RNasa. Conservar las muestras a -20 °C.
- RT-qPCR de genes selectivos de adipocitos.
- Usando un formato de 384 pocillos, agregue 1 μL de imprimación (~1 μM de concentración final) al fondo de cada pozo. Las imprimaciones previas al secado dan como resultado réplicas técnicas más ajustadas. Deje cubrir hasta que las imprimaciones se hayan evaporado por completo (la placa se puede colocar en un bloque calefactor ajustado a 37 ° C para acelerar la evaporación).
- Configure reacciones de muestra con cuatro a ocho réplicas técnicas de la siguiente manera: 2,5 μL de mezcla maestra de RT-PCR a base de colorante, 2,1 μL de agua libre de RNasa y 0,4 μL de ADNc (~1 ng) con 5 μL de volumen total por pozo. Se utilizaron las siguientes condiciones de ciclo térmico: desnaturalización a 95 °C durante 15 s y anneal/extend a 60 °C durante 25 s durante 40 ciclos.
- Normalizar los valores brutos de CT (umbral de ciclo) a los niveles de genes de limpieza (es decir, Hprt y Pde12) calculando ΔΔCT como se describe aquí38. Véase20 para las secuencias de imprimación.
NOTA: Se debe seguir la práctica estándar para el análisis RT-qPCR, como el uso de un control de transcripción inversa (-RT) menos, la reacción de PCR y la validación de imprimación.
Resultados
Visualización inmunofluorescente de la grasa intramuscular
Siguiendo los pasos anteriores y viendo la Figura 1A, se recolectaron secciones de tejido de TA de una lesión posterior al glicerol de 21 días que se congelaron inmediatamente después de la recolección en isopentano enfriado con LN2 o se fijaron en PFA al 4% durante 2,5 h. Después de crioseccionar y teñir ambas muestras, se tomaron imágenes en la mitad del vientre, el área más grande de la AT. Los adipocitos PERILIPIN+ de las AATT no fijadas (Figura 1B) han alterado significativamente la morfología en comparación con las secciones fijas (Figura 1C), lo que hace que su identificación, visualización y posterior cuantificación sean mucho más difíciles y potencialmente inexactas. A tener en cuenta, las primeras gotas lipídicas de PERILIPIN+ se detectaron alrededor de los 5 días posteriores a la lesión, y la mayoría de los adipocitos se formaron en el día 7. A los 21 días después de la lesión, los adipocitos habían madurado completamente.
Como la cantidad de grasa por TA se correlaciona fuertemente con la gravedad de la lesión inducida, los TA deben lesionarse significativamente para observar y estudiar eficazmente la formación de grasa intramuscular. Practicar inyecciones con tinta en los AATT de cadáveres es una excelente manera de mejorar la gravedad de las lesiones. Las lesiones exitosas tienden a estar por encima del 50% del músculo. Para tener en cuenta, las áreas lesionadas del músculo representan áreas desprovistas de fibras musculares o áreas que están pobladas por fibras musculares que contienen al menos un núcleo ubicado centralmente, un sello distintivo conocido de una fibra muscular regeneradora.
Este protocolo se puede adaptar fácilmente para manchar para FAPs y grasa en 3D. Para esto, múltiples miofibras de la TA posterior a la fijación se separaron cuidadosamente, seguidas de inmunofluorescencia de montaje completo. La clave es asegurar adecuadamente las fibras al portaobjetos de vidrio y, al mismo tiempo, evitar la compresión excesiva del tejido. Mediante el uso de pies de arcilla moldeables, el usuario puede ajustar el grosor requerido y asegurar el deslizamiento a la corredera, incluso permitiendo el uso de un microscopio invertido (Figura 4A). Este método se utilizó con éxito para etiquetar PDGFRα+ FAPs, Fiberas de faloidina+ y adipocitos que expresan PERILIPIN (Figura 4B, Video Suplementario 1 y Video Suplementario 2). Después de obtener imágenes en múltiples planos z que abarcan hasta 150 μm de espesor, se utilizó el módulo de renderizado 3D dentro del software del microscopio para crear una reconstrucción 3D.
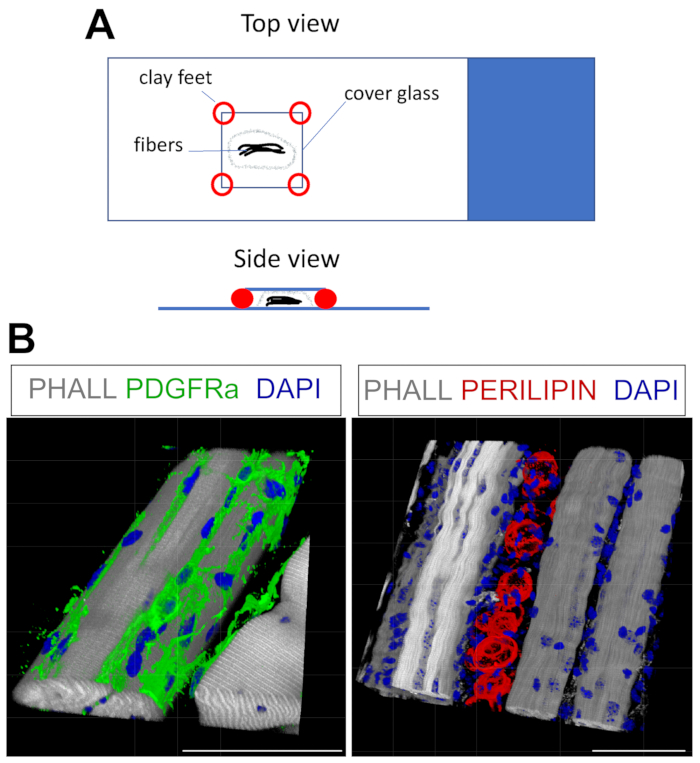
Figura 4: Tinción inmunofluorescente de montaje completo. (A) Vista superior y lateral de cómo montar la muestra y agregar una cubierta para la tinción de montaje completo. (B) Reconstrucciones 3D representativas de FAPs (verde; izquierda) y adipocitos (rojo; derecha) junto con miofibras (gris) y núcleos (azul). Barras de escala: 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
Cuantificación de la grasa intramuscular
Una vez que se han tomado imágenes de grasa intramuscular, se utilizó la función de contador celular en ImageJ/FIJI para contar manualmente el número de adipocitos PERLIPIN+ (Figura 5A). A continuación, se determinó el área total de la sección muscular, así como el área lesionada, definida por núcleos ubicados centralmente dentro de las miofiberes. Para controlar la gravedad de la lesión, el número total de adipocitos se dividió por el área lesionada, lo que resultó en el número de células grasas por 1 mm2 de músculo lesionado. Por lo general, las AATT que muestran un daño <30% se excluyen de las cuantificaciones. A tener en cuenta, aunque los adipocitos son raros sin lesión, oscilando entre cero y ocho por área transversal, el número total de adipocitos todavía está normalizado por área total. Como se destaca en la Figura 5B, una lesión por glicerol causa cantidades masivas de grasa intramuscular en comparación con un músculo TA no lesionado. Alternativamente, como la tinción de perilipina es muy limpia con una alta relación señal-ruido, también es posible utilizar la función Analizar partícula para determinar el área total ocupada por perilipina. Sin embargo, este método no podrá distinguir entre adipocitos más pequeños y menos. Se tomaron imágenes y cuantificaron hasta tres secciones de un mínimo de cuatro animales individuales, y se informó el número promedio de células grasas presentes por ratón.
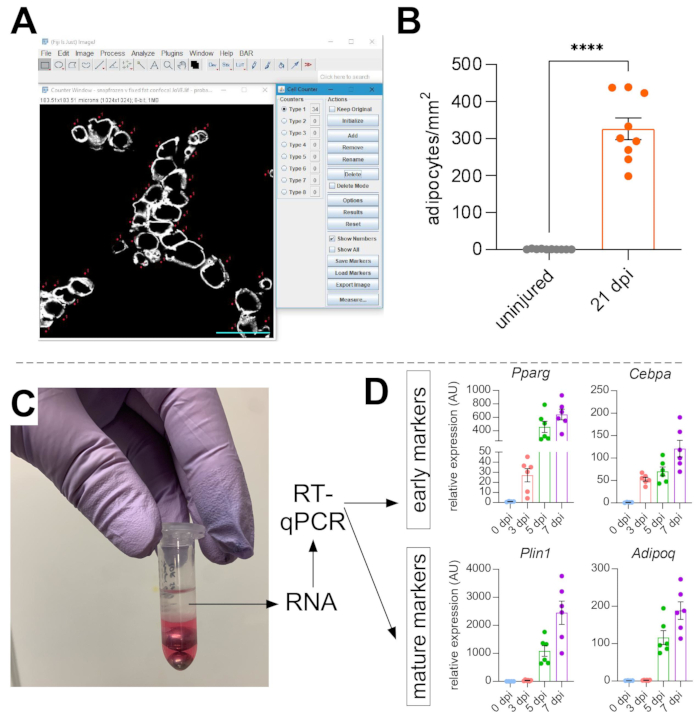
Figura 5: Cuantificaciones de la grasa intramuscular. (A) Imagen representativa de cómo contar los adipocitos PERILIPIN+ (blanco) utilizando la función Contador Celular en ImageJ. Barra de escala: 50 μm. (B) Cuantificaciones de adipocitos TA enteros 21 días después de la inyección de glicerol normalizadas a 1 mm2 del área lesionada. Cada punto representa el promedio de un ratón. Barras de error mostradas como SEM. **** = p < 0,0001. (C) La capa de ARN después de la homogeneización y la posterior separación de fases por cloroformo se está utilizando para el análisis RT-qPCR. (D) Cambios en los niveles de expresión de Pparg y Cepbα, genes adipogénicos tempranos, y Plin1 y Adipoq, dos marcadores de adipocitos maduros, en diferentes puntos de tiempo después de la lesión por glicerol. Cada punto representa el promedio de un ratón. Barras de error que se muestran como SEM. Haga clic aquí para ver una versión más grande de esta figura.
Para confirmar de forma independiente la cantidad de grasa intramuscular presente, se pueden determinar los niveles de expresión génica de varios marcadores adipogénicos. Para esto, el ARN se puede aislar de una porción del mismo músculo TA utilizado para la inmunofluorescencia (ver pasos arriba) en diferentes puntos después de la lesión. Se utilizó un batidor de cuentas en combinación con tiocianato de guanidio para homogeneizar el tejido. Después de agregar cloroformo seguido de centrifugación, la capa superior que contiene ARN se extrajo cuidadosamente y se utilizaron mini columnas de espín para la limpieza de ARN (Figura 5C). Este método produce rutinariamente alta calidad y cantidad de ARN adecuado para todos los análisis posteriores, como RT-qPCR y RNAseq. Para RT-qPCR, se determinaron los niveles de expresión relativos de los genes adipogénicos a los de limpieza, y se evaluaron los cambios relativos siguiendo el método ΔΔCT38. Como se describe en la Figura 5D, en comparación con el músculo TA no lesionado, la lesión por glicerol induce la expresión de marcadores adipogénicos tempranos como Pparg y Cebpα tan pronto como 3 días después de la lesión. Los marcadores maduros, como la adiponectina (Adipoq) y la perilipina (Plin1), se pueden detectar tan pronto como 5 días después de la lesión por glicerol.
Rastreo genético del linaje de los adipocitos
El protocolo de tinción de adipocitos presentado aquí se puede adaptar fácilmente para incluir el rastreo genético del linaje de los FAP para mapear y seguir su destino en adipocitos. Por ejemplo, hemos demostrado previamente que la recombinación podría inducirse mediante la administración de tamoxifeno en PdgfrαCreERT2; RatonesRosa26 EYFP 2 semanas antes de la lesión, eliminando efectivamente la codificación de parada floxed y activando indeleblemente la expresión de EYFP en FAPs (Figura 6A). Logramos altas eficiencias de recombinación con el régimen de tamoxifeno presentado aquí, con ~ 75% de PDGFRα + FAPs expresando EYFP20, similar a lo que otros laboratorios han reportado 27,39,40. Demostrando que los FAP son de hecho el origen celular de la grasa intramuscular, la mayoría de los FAP se han convertido en adipocitos que expresan EYFP + PERILIPIN 7 días después de la lesión por glicerol (Figura 6B).
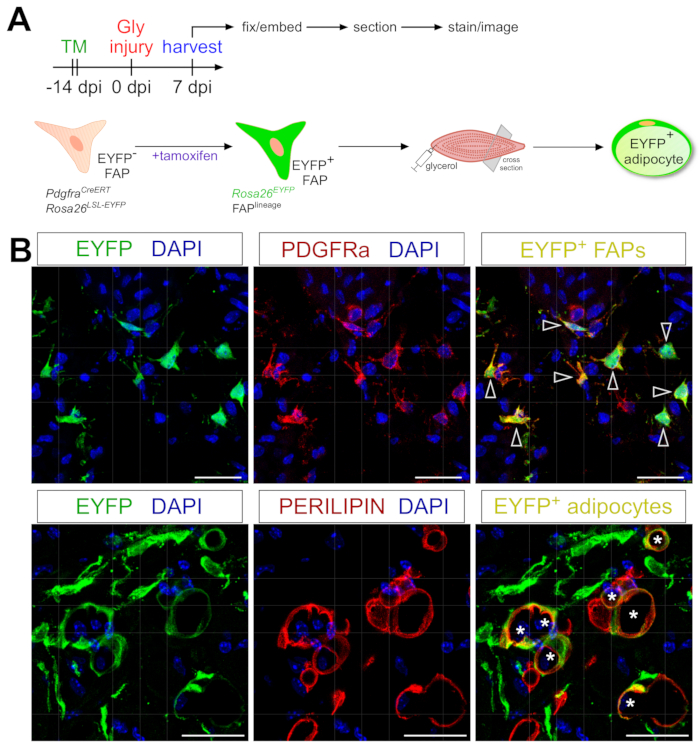
Figura 6: Trazado de linaje de FAPs. (A) Visión general esquemática de la configuración experimental. (B) Imágenes inmunofluorescentes representativas que muestran una recombinación y activación exitosas de EYFP (amarillo) dentro de los FAPs PDGFRα+ (rojo, puntas de flecha) y los adipocitos PERILIPIN+ (rojo, asteriscos). Barras de escala: 25 μm. Haga clic aquí para ver una versión más grande de esta figura.
Detección de múltiples tipos de células
Este protocolo también se puede utilizar para visualizar el compartimento miogénico. Usando anticuerpos contra PAX7 y MYOD1, las células madre musculares (MuSC) y los mioblastos, respectivamente, se pueden detectar fácilmente 5 días después de la lesión por glicerol incluso en la sección de tejido muscular fijado por PFA (Figura 7). Por lo tanto, el protocolo presentado es versátil y adaptable no solo a los adipocitos de etiqueta e imagen y a los FAPs, sino también a otros tipos de células del linaje miogénico.
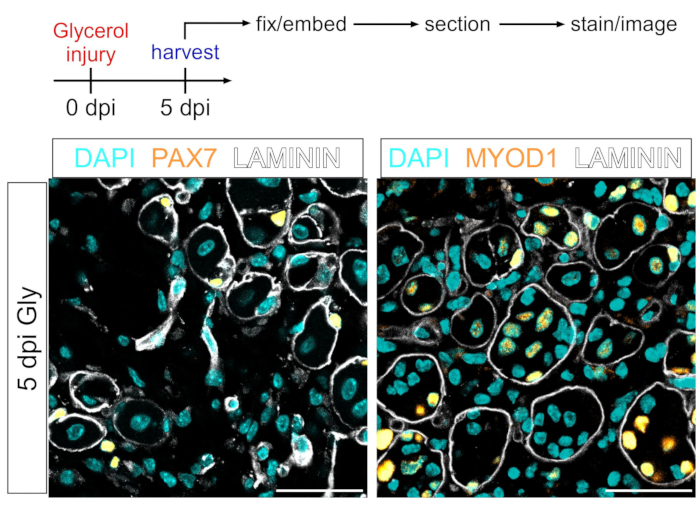
Figura 7: Tinción inmunofluorescente de células madre musculares y mioblastos. (A) Descripción general esquemática de la configuración experimental. (B) Imágenes inmunofluorescentes representativas que muestran una tinción exitosa de células madre musculares (MuSC) (amarillo, izquierda) con PAX7 y mioblastos (amarillo, derecha) con MYOD1. LAMININ delinea las miofibras (blancas), y los núcleos están en cian. Barras de escala: 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
Video suplementario 1: Renderizado 3D de FAPs. Reconstrucción tridimensional de miofibras, FAPs y núcleos teñidos para PHALLOIDIN (gris), PDGFRα (verde) y DAPI (azul), respectivamente, 21 días después de la lesión. Haga clic aquí para descargar este video.
Video suplementario 2: Representación 3D de grasa intramuscular. Representación volumétrica de haces de miofiber (gris, FALOIDINA) y grasa intramuscular (rojo, PERILIPINA), que ha reemplazado a una miofibra 21 días después de la lesión por glicerol. Haga clic aquí para descargar este video.
Discusión
Este protocolo describe un protocolo extenso y detallado que permite una visualización eficiente y una cuantificación rigurosa de la grasa intramuscular. Al dividir el mismo músculo en dos partes, una que se utiliza para la inmunofluorescencia y la otra para el análisis RT-qPCR, este protocolo también es muy versátil. También se puede combinar con el rastreo del linaje genético de los FAP para estudiar su conversión en adipocitos bajo ciertas condiciones y es altamente adaptable para etiquetar e imaginar múltiples tipos de células adicionales.
Las formas más utilizadas para visualizar la grasa intramuscular son las secciones de parafina seguidas de tinción de hematoxilina y eosina o las secciones congeladas teñidas para colorantes lipofílicos como Oil Red O (ORO). Sin embargo, mientras que los tejidos procesados con parafina mantienen la mejor histología, el mismo proceso también extrae todos los lípidos impidiendo el uso de colorantes lipofílicos. Aunque los métodos de tinción lipofílica funcionarán tanto en secciones de tejido fijas como no fijadas con PFA, las gotas de lípidos se desplazan fácilmente aplicando presión a la cubierta, distorsionando así la distribución espacial de la grasa intramuscular. Para evitar esto, un estudio reciente estableció un protocolo riguroso para visualizar los adipocitos ORO + utilizando un enfoque de montaje completo. Para ello, los autores descelularizaron la AT para visualizar la distribución espacial de la grasa intramuscular a lo largo de toda la AT41. Tan poderosa como es esta técnica, también evita el uso de otras co-manchas para marcar estructuras celulares adicionales. Todo el enfoque de inmunofluorescencia de montaje presentado aquí se puede utilizar para teñir conjuntamente los adipocitos con una variedad de marcadores que permiten un mapeo fino del entorno celular. Un desafío importante, sin embargo, es la penetración tisular de los anticuerpos. Cuantas más fibras se mantengan juntas, más difícil será para los anticuerpos penetrar y unirse por igual a todos los antígenos disponibles. Por lo tanto, este método es más efectivo cuando se observan pequeños grupos de fibras. Al mismo tiempo, esto también es una limitación, ya que la ubicación anatómica general de la grasa intramuscular se está perdiendo cuando se enfoca solo en pequeños haces de fibra pelados. Sin embargo, con el desarrollo actual de nuevos métodos de limpieza de tejidos más la nueva tecnología de imágenes, será posible una mayor penetración y visualización de tejidos en el futuro 42,43,44.
Si bien la fijación previa del tejido muscular preserva la morfología de los adipocitos, también crea un desafío para evaluar el tamaño de las miofiberes, una medida importante de la salud muscular. El tamaño de miofibra se determina midiendo el área de sección transversal de las miofiberes. Hemos informado previamente que la fijación previa del tejido muscular hará que la mayoría de los marcadores disponibles para delinear las miofibers fallen31. Para superar este obstáculo, hemos desarrollado una novedosa tubería de segmentación de imágenes, que permite la medición del tamaño de miofiber incluso en secciones musculares fijas31. Por lo tanto, hemos establecido una tubería de procesamiento de tejidos robusta y eficiente que, combinada con este protocolo, supera la mayoría de las desventajas causadas por la fijación previa del tejido muscular.
Otra ventaja importante de este enfoque es la versatilidad. Al dividir la AT en dos partes, se maximiza la cantidad de información que se puede obtener de un músculo. Esto no solo reduce el número de animales, sino que también agrega una capa adicional de control al confirmar la histología a través de la expresión génica y viceversa. Además, se pueden examinar muchos genes diferentes más allá de los genes adipogénicos. El ARN aislado también se puede utilizar para un experimento de RNAseq de músculo completo. Finalmente, la pieza muscular congelada al chasquido también se puede usar para el trabajo con proteínas. Una limitación de este protocolo es la posibilidad de que la lesión no sea consistente en toda la longitud de la AT. Esto podría conducir a un escenario en el que las dos partes musculares divergen en la cantidad de grasa intramuscular que contienen y puede justificar la exclusión de dicha muestra de cualquier análisis posterior. Por lo tanto, se recomienda no simplemente confiar en RT-qPCR para sacar conclusiones importantes sobre la cantidad de grasa intramuscular, sino más bien como datos de apoyo a las cuantificaciones histológicas.
Juntos, este protocolo describe una línea de procesamiento de tejidos robusta, eficiente y rigurosa que permitirá la visualización y cuantificación de la grasa intramuscular, el primer paso en el desarrollo de nuevas opciones de tratamiento para combatir la fibrosis grasa. Al mismo tiempo, es versátil y se puede adaptar a muchos tipos de células diferentes dentro del músculo, así como adipocitos en otros tejidos.
Divulgaciones
Los autores no declaran intereses contrapuestos.
Agradecimientos
Agradecemos a los miembros del laboratorio Kopinke por ayudar con la recopilación de datos y la lectura crítica del manuscrito. También agradecemos a los miembros del Instituto de Miología de la Universidad de Florida por su valiosa contribución sobre el manuscrito. El trabajo fue apoyado por la subvención de los NIH 1R01AR079449. La Figura 2 fue creada con Biorender.
Materiales
| Name | Company | Catalog Number | Comments |
| 16% PFA (Pack of 12, 10 mL bottles) | Electron Miscroscopy Sciences | 15710 | |
| 2.0 mL Microcentrifuge Tubes | Fisher Scientific | 05-408-138 | microcentrifuge tubes for snapfreezing/bead beating |
| 2-Methylbutane (4 L) | Fisher Chemical | O3551-4 | isopentane |
| Absolute Ethanol (200 proof) | ThermoFisher Scientific | BP2818100 | |
| AffiniPure Fab fragment donkey anti-mouse | Jackson ImmunoResearch | 715-007-003 | mouse-on-mouse blocking |
| Alexa Fluor 488 donkey anti-chicken secondary antibody | Jackson ImmunoResearch | 703-545-155 | |
| Alexa Fluor 488 donkey anti-mouse secondary antibody | Invitrogen | A21202 | |
| Alexa Fluor 488 donkey anti-rabbit secondary antibody | Invitrogen | A21206 | |
| Alexa Fluor 568 donkey anti-goat secondary antibody | Invitrogen | A11057 | |
| Alexa Fluor 568 donkey anti-rabbit secondary antibody | Invitrogen | A11037 | |
| Alexa Fluor 568 Phalloidin antibody | Invitrogen | A12380 | Dissolved in 1.5 mL methanol (~66 µM working solution) |
| BioLite 24-well Multidishes | ThermoFisher Scientific | 930186 | 24 well plate for PFA tissue incubation |
| Biometra TOne | analytikjena | 8462070301 | Thermal cycler |
| Chicken anti-GFP antibody | Aves Labs | GFP-1020 | |
| Chloroform/isoamyl alcohol 24:1(v/v) for molecular biology, DNAse, RNAse, and Protease free | ThermoFisher Scientific | AC327155000 | |
| Corn oil | Sigma Aldrich | C8267 | |
| DAPI stain | Invitrogen | D1306 | 150 µM working solution in dH2O |
| Donkey Serum (100 mL) | Millipore Sigma | 5058837 | for blocking solution |
| Dumont #5 Forceps | Fine Science Tools | 11251-20 | sharp-tipped tweezers |
| Fine Scissors Straight 9 cm | Fine Science Tools | 14060-09 | |
| Fluoromount-G | SouthernBiotech | 0100-01 | mounting medium |
| Glycerol, 99.5%, for molecular biology (500 mL) | Acros Organics | 327255000 | |
| Goat anti-PDGFRα antibody | R&D | AF1062 | |
| Hybridization Oven | VWR | 230301V | for Tamoxifen incubation |
| ImmEdge Hydrophobic Barrier PAP Pen | Vector Laboratories | H-4000 | hydrophobic pen |
| Insulin Syringe with Micro-Fine IV needle (28 G) | BD | 329461 | |
| Insulin Syringe with Slip Tip, 1 mL | BD | 329654 | Insulin syringe without needle, for oral gavaging |
| iScript cDNA Synthesis Kit | Bio-Rad | 1708890 | |
| Isoflurane | Patterson Veterinary | 78938441 | |
| Leica DMi8 inverted microscope | Leica | micrscope used for widefield IF and confocal imaging | |
| Micro Slides | VWR | 48311-703 | positively charged microscope slides |
| mouse anti-MYOD antibody | Invitrogen | MA1-41017 | |
| mouse anti-PAX7 antibody (supernatant) | DSHB | AB 428528 | |
| MX35 Premier+ Microtome blades | ThermoFisher Scientific | 3052835 | microtome blades |
| NanoDrop 2000 Spectrophotometer | ThermoFisher Scientific | ND2000 | spectrophotometer for RNA yield |
| Play-Doh | Hasbro | modeling compound | |
| PowerUp SYBR Green Master Mix | ThermoFisher Scientific | A25742 | green dye PCR master mix |
| Puralube Vet Ointment | Puralube | 17033-211-38 | vet ophthalmic ointment |
| QuantStudi 6 Flex Real-Time 384-well PCR System | Applied Biosystems | 4485694 | qPCR machine |
| Rabbit anti-perilipin antibody | Cell Signaling Technology | 9349S | |
| Red-Rotor Shaker | Hoefer Scientific | PR70-115V | shaker for IF staining |
| Richard-Allan Scientific Slip-Rite Cover Glass | ThermoFisher Scientific | 152460 | coverslips |
| RNeasy Mini Kit | QIAGEN | 74106 | contains mini spin columns |
| Safe-Lock Tubes 1.5 ml, natural | Eppendorf | 22363204 | |
| Sample Tubes RB (2 mL) | QIAGEN | 990381 | |
| Sodium azide | Alfa Aesar | 14314 | |
| Stainless Steel Beads, 2.8 mm | Precellys | KT03961-1-101.BK | small beads |
| Stainless Steel Beads, 5 mm | QIAGEN | 69989 | medium beads |
| Stainless Steel Beads, 7 mm | QIAGEN | 69990 | large beads |
| Stainless Steel Disposable Scalpels | Miltex | 327-4102 | scalpel |
| Stainless steel feeding tube, 20 G x 38 mm, straight | Instech Laboratories | FTSS-20S-3 | gavage needle |
| Tamoxifen | Toronto Research Chemicals | T006000 | |
| Tissue Plus O.C.T. Compound | Fisher HealthCare | 4585 | embedding medium |
| TissueLyser LT | QIAGEN | 85600 | bead beater |
| TissueLyser LT Adapter, 12-Tube | QIAGEN | 69980 | |
| Tissue-Tek Cryomold | Sakura | 4566 | specimen molds |
| Triton X-100 | Alfa Aesar | A16046 | |
| TRIzol Reagent | ThermoFisher Scientific | 15596026 | guanidium thiocyanate |
| Tween20 (500 mL) | Fisher BioReagents | BP337-500 | |
| VWR Micro Slides - Superfrost Plus | VWR | 48311703 | |
| Wheaton Coplin staining jars | Millipore Sigma | S6016 | Coplin jar |
Referencias
- Milad, N., et al. Increased plasma lipid levels exacerbate muscle pathology in the mdx mouse model of Duchenne muscular dystrophy. Skeletal Muscle. 7 (1), 19 (2017).
- Goodpaster, B. H., et al. Obesity, regional body fat distribution, and the metabolic syndrome in older men and women. Archives of Internal Medicine. 165 (7), 777-783 (2005).
- Goodpaster, B. H., et al. Association between regional adipose tissue distribution and both type 2 diabetes and impaired glucose tolerance in elderly men and women. Diabetes Care. 26 (2), 372-379 (2003).
- Goodpaster, B. H., et al. The loss of skeletal muscle strength, mass, and quality in older adults: the health, aging and body composition study. The Journals of Gerontology, Series A: Biological Sciences and Medical Sciences. 61 (10), 1059-1064 (2006).
- Goodpaster, B. H., Thaete, F. L., Kelley, D. E. Thigh adipose tissue distribution is associated with insulin resistance in obesity and in type 2 diabetes mellitus. American Journal of Clinical Nutrition. 71 (4), 885-892 (2000).
- Goodpaster, B. H., Theriault, R., Watkins, S. C., Kelley, D. E. Intramuscular lipid content is increased in obesity and decreased by weight loss. Metabolism. 49 (4), 467-472 (2000).
- Burakiewicz, J., et al. Quantifying fat replacement of muscle by quantitative MRI in muscular dystrophy. Journal of Neurology. 264 (10), 2053-2067 (2017).
- Murphy, W. A., Totty, W. G., Carroll, J. E. MRI of normal and pathologic skeletal muscle. American Journal of Roentgenology. 146 (3), 565-574 (1986).
- Willcocks, R. J., et al. Multicenter prospective longitudinal study of magnetic resonance biomarkers in a large duchenne muscular dystrophy cohort. Annals of Neurology. 79 (4), 535-547 (2016).
- Wokke, B. H., et al. Quantitative MRI and strength measurements in the assessment of muscle quality in Duchenne muscular dystrophy. Neuromuscular Disorders. 24 (5), 409-416 (2014).
- Contreras, O., Rossi, F. M. V., Theret, M. Origins, potency, and heterogeneity of skeletal muscle fibro-adipogenic progenitors-time for new definitions. Skeletal Muscle. 11 (1), 16 (2021).
- El Agha, E., et al. Mesenchymal stem cells in fibrotic disease. Cell Stem Cell. 21 (2), 166-177 (2017).
- Joe, A. W., et al. Muscle injury activates resident fibro/adipogenic progenitors that facilitate myogenesis. Nature Cell Biology. 12 (2), 153-163 (2010).
- Liu, W., Liu, Y., Lai, X., Kuang, S. Intramuscular adipose is derived from a non-Pax3 lineage and required for efficient regeneration of skeletal muscles. Developmental Biology. 361 (1), 27-38 (2012).
- Scott, R. W., Arostegui, M., Schweitzer, R., Rossi, F. M. V., Underhill, T. M. Hic1 defines quiescent mesenchymal progenitor subpopulations with distinct functions and fates in skeletal muscle regeneration. Cell Stem Cell. 25 (6), 797-813 (2019).
- Uezumi, A., et al. Fibrosis and adipogenesis originate from a common mesenchymal progenitor in skeletal muscle. Journal of Cell Science. 124, 3654-3664 (2011).
- Hogarth, M. W., et al. Fibroadipogenic progenitors are responsible for muscle loss in limb girdle muscular dystrophy 2B. Nature Communications. 10 (1), 2430 (2019).
- Uezumi, A., Fukada, S., Yamamoto, N., Takeda, S., Tsuchida, K. Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle. Nature Cell Biology. 12 (2), 143-152 (2010).
- Stumm, J., et al. Odd skipped-related 1 (Osr1) identifies muscle-interstitial fibro-adipogenic progenitors (FAPs) activated by acute injury. Stem Cell Research. 32, 8-16 (2018).
- Kopinke, D., Roberson, E. C., Reiter, J. F. Ciliary Hedgehog signaling restricts injury-induced adipogenesis. Cell. 170 (2), 340-351 (2017).
- Huang, Y., Das, A. K., Yang, Q. Y., Zhu, M. J., Du, M. Zfp423 promotes adipogenic differentiation of bovine stromal vascular cells. PLoS One. 7 (10), 47496 (2012).
- Sun, Y. -. M., et al. PDGFRα regulated by miR-34a and FoxO1 promotes adipogenesis in porcine intramuscular preadipocytes through Erk signaling pathway. International Journal of Molecular Sciences. 18 (11), 2424 (2017).
- Te, L. J. I., Doherty, C., Correa, J., Batt, J. Identification, isolation, and characterization of fibro-adipogenic progenitors (FAPs) and myogenic progenitors (MPs) in skeletal muscle in the rat. Journal of Visualized Experiments: JoVE. (172), e61750 (2021).
- Lukjanenko, L., et al. Aging disrupts muscle stem cell function by impairing matricellular WISP1 secretion from fibro-adipogenic progenitors. Cell Stem Cell. 24 (3), 433-446 (2019).
- Santini, M. P., et al. Tissue-resident PDGFRalpha(+) progenitor cells contribute to fibrosis versus healing in a context- and spatiotemporally dependent manner. Cell Reports. 30 (2), 555-570 (2020).
- Uezumi, A., et al. Identification and characterization of PDGFRalpha+ mesenchymal progenitors in human skeletal muscle. Cell Death & Disease. 5, 1186 (2014).
- Wosczyna, M. N., et al. Mesenchymal stromal cells are required for regeneration and homeostatic maintenance of skeletal muscle. Cell Reports. 27 (7), 2029-2035 (2019).
- Soliman, H., et al. Pathogenic potential of Hic1-expressing cardiac stromal progenitors. Cell Stem Cell. 26 (2), 205-220 (2020).
- Chung, M. I., Bujnis, M., Barkauskas, C. E., Kobayashi, Y., Hogan, B. L. M. Niche-mediated BMP/SMAD signaling regulates lung alveolar stem cell proliferation and differentiation. Development. 145 (9), (2018).
- Hilgendorf, K. I., et al. Omega-3 fatty acids activate ciliary FFAR4 to control adipogenesis. Cell. 179 (6), 1289-1305 (2019).
- Waisman, A., Norris, A. M., Elías Costa, M., Kopinke, D. Automatic and unbiased segmentation and quantification of myofibers in skeletal muscle. Scientific Reports. 11 (1), 11793 (2021).
- Kang, S. H., Fukaya, M., Yang, J. K., Rothstein, J. D., Bergles, D. E. NG2+ CNS glial progenitors remain committed to the oligodendrocyte lineage in postnatal life and following neurodegeneration. Neuron. 68 (4), 668-681 (2010).
- Srinivas, S., et al. Cre reporter strains produced by targeted insertion of EYFP and ECFP into the ROSA26 locus. BMC Developmental Biology. 1, 4 (2001).
- Lukjanenko, L., Brachat, S., Pierrel, E., Lach-Trifilieff, E., Feige, J. N. Genomic profiling reveals that transient adipogenic activation is a hallmark of mouse models of skeletal muscle regeneration. PLoS One. 8 (8), 71084 (2013).
- Mahdy, M. A., Lei, H. Y., Wakamatsu, J., Hosaka, Y. Z., Nishimura, T. Comparative study of muscle regeneration following cardiotoxin and glycerol injury. Annals of Anatomy = Anatomischer Anzeiger: Official Organ of the Anatomische Gesellscaft. 202, 18-27 (2015).
- Pisani, D. F., Bottema, C. D., Butori, C., Dani, C., Dechesne, C. A. Mouse model of skeletal muscle adiposity: a glycerol treatment approach. Biochemical and Biophysical Research Communications. 396 (3), 767-773 (2010).
- Kawai, H., et al. Experimental glycerol myopathy: a histological study. Acta Neuropathologica. 80 (2), 192-197 (1990).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative CT method. Nature Protocols. 3 (6), 1101-1108 (2008).
- Uezumi, A., et al. Mesenchymal Bmp3b expression maintains skeletal muscle integrity and decreases in age-related sarcopenia. The Journal of Clinical Investigation. 131 (1), 139617 (2021).
- Biferali, B., et al. Prdm16-mediated H3K9 methylation controls fibro-adipogenic progenitors identity during skeletal muscle repair. Science Advances. 7 (23), 9371 (2021).
- Biltz, N. K., Meyer, G. A. A novel method for the quantification of fatty infiltration in skeletal muscle. Skeletal Muscle. 7 (1), (2017).
- Vieites-Prado, A., Renier, N. Tissue clearing and 3D imaging in developmental biology. Development. 148 (18), (2021).
- Gómez-Gaviro, M. V., Sanderson, D., Ripoll, J., Desco, M. Biomedical applications of tissue clearing and three-dimensional imaging in health and disease. iScience. 23 (8), 101432 (2020).
- Ueda, H. R., et al. Tissue clearing and its applications in neuroscience. Nature Reviews Neuroscience. 21 (2), 61-79 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados