Method Article
Una guida per esaminare la formazione di grasso intramuscolare e la sua origine cellulare nel muscolo scheletrico
In questo articolo
Riepilogo
La sostituzione del tessuto muscolare sano con grasso intramuscolare è una caratteristica importante delle malattie e delle condizioni umane. Questo protocollo delinea come visualizzare, visualizzare e quantificare il grasso intramuscolare, consentendo lo studio rigoroso dei meccanismi alla base della formazione di grasso intramuscolare.
Abstract
I progenitori fibro-adipogeni (FAP) sono cellule stromali mesenchimali che svolgono un ruolo cruciale durante l'omeostasi e la rigenerazione del muscolo scheletrico. I FAP costruiscono e mantengono la matrice extracellulare che agisce come un'impalcatura di miofibra molecolare. Inoltre, i FAP sono indispensabili per la rigenerazione della miofibra in quanto secernono una moltitudine di fattori benefici percepiti dalle cellule staminali muscolari (MuSC). Negli stati malati, tuttavia, i FAP sono l'origine cellulare del grasso intramuscolare e del tessuto cicatriziale fibrotico. Questa fibrosi grassa è un segno distintivo della sarcopenia e delle malattie neuromuscolari, come la distrofia muscolare di Duchenne. Una barriera significativa nel determinare perché e come i FAP si differenziano in grasso intramuscolare è la conservazione efficace e la successiva visualizzazione degli adipociti, specialmente nelle sezioni di tessuto congelato. I metodi convenzionali di elaborazione del tessuto muscolare scheletrico, come il congelamento a scatto, non preservano adeguatamente la morfologia dei singoli adipociti, impedendo così una visualizzazione e una quantificazione accurate. Per superare questo ostacolo, è stato sviluppato un protocollo rigoroso che preserva la morfologia degli adipociti nelle sezioni del muscolo scheletrico consentendo la visualizzazione, l'imaging e la quantificazione del grasso intramuscolare. Il protocollo delinea anche come elaborare una porzione di tessuto muscolare per RT-qPCR, consentendo agli utenti di confermare i cambiamenti osservati nella formazione di grasso visualizzando le differenze nell'espressione dei geni adipogenici. Inoltre, può essere adattato per visualizzare gli adipociti mediante immunofluorescenza a monte intero di campioni muscolari. Infine, questo protocollo delinea come eseguire il tracciamento genetico del lignaggio dei FAP che esprimono Pdgfrα per studiare la conversione adipogenica dei FAP. Questo protocollo produce costantemente immagini immunofluorescenti ad alta risoluzione e morfologicamente accurate degli adipociti, insieme alla conferma da parte di RT-qPCR, consentendo una visualizzazione e una quantificazione robuste, rigorose e riproducibili del grasso intramuscolare. Insieme, la pipeline di analisi qui descritta è il primo passo per migliorare la nostra comprensione di come i FA si differenziano in grasso intramuscolare e fornisce un quadro per convalidare nuovi interventi per prevenire la formazione di grasso.
Introduzione
L'infiltrazione di tessuto muscolare sano con fibrosi grassa è una caratteristica importante della distrofia muscolare di Duchenne (DMD) e di altre malattie neuromuscolari, nonché sarcopenia, obesità e diabete 1,2,3,4,5,6,7,8,9,10 . Sebbene l'aumento dell'infiltrazione di grasso in queste condizioni sia fortemente associato a una diminuzione della funzione muscolare, la nostra conoscenza del perché e del come si forma il grasso intramuscolare è ancora limitata. Le FAP sono una popolazione di cellule stromali mesenchimali multipotenti presente nella maggior parte degli organi adulti, compreso il muscolo scheletrico11,12. Con l'età e nelle malattie croniche, tuttavia, i FAP producono tessuto cicatriziale fibrotico e si differenziano in adipociti, che si trovano tra le singole miofibre e formano grasso intramuscolare 13,14,15,16,17,18,19,20.
Per iniziare a combattere la formazione di grasso intramuscolare, è necessario definire i meccanismi di come i FAP si trasformano in adipociti. PDGFRα è il marcatore "gold standard" sul campo per identificare i FAP all'interno del muscolo di più specie 13,16,17,18,20,21,22,23,24,25,26,27. Di conseguenza, sono state generate diverse linee Cre murine inducibili dal tamoxifene, sotto il controllo del promotore Pdgfrα, consentendo di manipolare geneticamente i FAP in vivo utilizzando il sistema Cre-LoxP 27,28,29. Ad esempio, combinando questa linea Cre inducibile con un reporter genetico, è possibile eseguire il tracciamento del lignaggio dei FAP, una strategia che abbiamo applicato con successo ai FAP della mappa del destino nei muscoli e nel tessuto adiposo bianco20,30. Oltre al tracciamento del lignaggio, queste linee Cre forniscono strumenti preziosi per studiare la conversione FAP-grasso.
Uno dei principali ostacoli nella definizione del meccanismo di conversione adipogenica dei FAP in grasso intramuscolare è la capacità di quantificare in modo rigoroso e riproducibile la quantità di grasso intramuscolare che si è formata in condizioni diverse. La chiave è bilanciare la conservazione del tessuto muscolare e adiposo e abbinarlo ai metodi di colorazione disponibili per visualizzare gli adipociti. Ad esempio, il muscolo scheletrico è spesso congelato senza fissazione preventiva, preservando le miofibre ma interrompendo la morfologia degli adipociti (Figura 1). Al contrario, la fissazione seguita dall'incorporamento di paraffina, mentre mostra la migliore istologia tissutale, compresi gli adipociti, rimuove tutti i lipidi, rendendo così inutilizzabili la maggior parte dei coloranti lipofili, come il colorante comunemente usato Oil Red O.
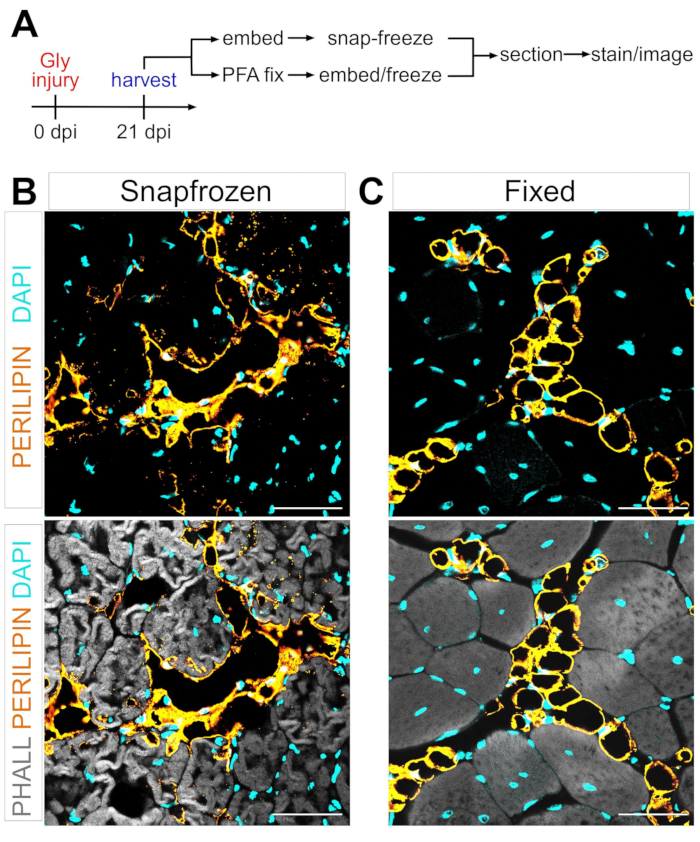
Figura 1: Immagini rappresentative del grasso intramuscolare nei tessuti muscolari congelati rispetto a quelli fissi. (A) Panoramica schematica della configurazione sperimentale. Immagini immunofluorescenti che mostrano adipociti (gialli), miofibre (grigio) e nuclei (ciano) all'interno di entrambi (B) snap-frozen e (C) fissi TA a 21 giorni dopo la lesione del glicerolo. Barre di scala: 50 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Il protocollo qui descritto preserva la morfologia della miofibra e degli adipociti e consente la visualizzazione e l'analisi di più tipi di cellule. Questo approccio si basa sulla colorazione immunofluorescenza degli adipociti nel tessuto muscolare fissato alla paraformaldeide (PFA), che consente la co-colorazione con anticorpi multipli. Può anche essere facilmente adattato per visualizzare spazialmente il grasso intramuscolare nel tessuto intatto utilizzando l'imaging a montaggio intero, fornendo così informazioni sul microambiente cellulare del grasso all'interno del muscolo. Inoltre, questo protocollo può essere combinato con il nostro approccio recentemente pubblicato per determinare l'area della sezione trasversale delle miofibre nei tessuti muscolari fissi31, una misura importante per valutare la salute muscolare. La combinazione di questo approccio con il tracciamento del lignaggio genetico per mappare il destino, la differenziazione dei FAP in adipociti è anche delineata qui. Pertanto, il protocollo versatile qui descritto consente una valutazione rigorosa e riproducibile dei FAP e della loro differenziazione in grasso intramuscolare in sezioni tissutali e tessuti intatti.
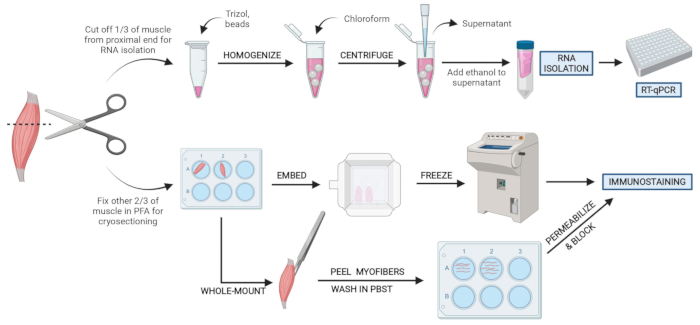
Figura 2: Cenni preliminari sul protocollo schematico. Panoramica schematica dell'elaborazione tissutale in cui un terzo del TA viene rimosso, congelato a scatto e omogeneizzato per il successivo isolamento dell'RNA e l'analisi della trascrizione tramite RT-qPCR. Gli altri due terzi del TA sono fissati con PFA ed elaborati per l'immunocolorazione su sezioni congelate o fibre a montaggio intero. Fare clic qui per visualizzare una versione più grande di questa figura.
Protocollo
Tutti i protocolli sugli animali sono stati approvati dall'Institutional Animal Care and Use Committee (IACUC) dell'Università della Florida.
1. Tracciamento del lignaggio genetico dei FAP
NOTA: se il tracciamento del lignaggio genetico dei FAP non è desiderato, il passaggio 1 può essere saltato.
- Per eseguire il tracciamento del lignaggio dei FAP, ottenere gli alleli di topo necessari.
NOTA: Diverse linee Cre inducibili dal tamoxifene, sotto il controllo del promotore Pdgfrα, sono state generate per colpire con successo i FAP, anche dai laboratori Hogan29, Rando27 e Bergles32. Come reporter genetico dell'attività cre, sono disponibili numerosi alleli reporter Rosa26 come Rosa26EYFP33. Mentre si suggerisce per ogni laboratorio di determinare quale combinazione Cre-Reporter è più efficace, incrociando i topi PdgfrαCreERT2 (29 e Jax # 032770) al reporter Rosa26EYFP (33 e Jax # 006148), il risultante PdgfrαCreERT2; I mouseEYFPRosa26possono essere utilizzati per contrassegnare in modo efficiente e specifico i FAP20. Per tracciare il destino dei FAP maturi, si raccomanda di attendere che i topi abbiano raggiunto almeno ~ 10 settimane di età prima di somministrare tamoxifene. Gli esperimenti di tracciamento del lignaggio possono essere eseguiti sia su maschi che su femmine. - Somministrazione di tamoxifene attraverso il gavaging orale
- Preparare 40 mg / mL di tamoxifene in olio di mais e vortice bene per mescolare 1 giorno prima di gavaging. Incubare O/N a 37 °C in un forno di ibridazione rotante.
ATTENZIONE: Il tamoxifene è cancerogeno e deve essere maneggiato con attenzione. Indossare sempre guanti durante la manipolazione e indossare una maschera quando si pesa come polvere, in quanto vi è il pericolo di inalazione. - Pulire l'area secondo il protocollo e attaccare un ago abrasivo a una siringa da 1 mL. Aspirare 200 μL di tamoxifene nella siringa.
- Scruff PdgfrαCreERT2 ; Topi Rosa26EYFP (10 settimane; entrambi i sessi utilizzati) posizionandoli su una superficie piana e afferrando saldamente la base della coda. Utilizzare una mano libera per afferrare il centro del mouse con il pollice e l'indice, quindi delicatamente e con una leggera pressione far scorrere l'impugnatura fino a poco oltre le spalle.
- Pizzica la pelle all'indietro con il pollice e l'indice, prendi il mouse e capovolgi la mano in modo che il mouse sia rivolto verso l'utente e infila la coda tra il mignolo e l'anulare della mano che tiene il mouse.
- A questo punto, assicurarsi che il mouse sia ben immobilizzato e incapace di muovere la testa o le braccia. Inserire l'ago abrasivo in bocca e usarlo per inclinare leggermente la testa del mouse all'indietro; questo permette all'esofago di essere meglio accessibile.
- Inserire con attenzione e lentamente l'ago nell'esofago. Non forzare l'ago se si incontra una resistenza; l'ago deve scivolare facilmente verso il basso. Iniettare lentamente il tamoxifene. Monitorare i mouse per 15-20 minuti per assicurarsi che non si verifichino problemi durante la gavaging.
NOTA: La somministrazione di tamoxifene per 2 giorni consecutivi in genere si traduce in un'efficienza di ricombinazione ~ 75% -85% dei FAP senza causare effetti avversi. Si raccomanda all'utente di attendere 1-2 settimane prima di indurre lesioni, il che consentirà di rimuovere il tamoxifene rimanente dal sistema e di capovolgere qualsiasi proteina rimanente.
- Preparare 40 mg / mL di tamoxifene in olio di mais e vortice bene per mescolare 1 giorno prima di gavaging. Incubare O/N a 37 °C in un forno di ibridazione rotante.
2. Lesione del muscolo tibiale anteriore (TA)
NOTA: Per studiare il grasso intramuscolare, si consiglia di utilizzare un modello di lesione a base di glicerolo (50% di glicerolo in soluzione salina sterile), che si traduce in una massiccia formazione di grasso intramuscolare 34,35,36,37.
- Preparare la macchina anestetica aggiungendo isoflurano e assicurandosi che i tubi sia nella camera del topo che nel cono del naso siano aperti. Pulire la camera e l'area di lavoro con una soluzione di etanolo o perossido al 70% (a seconda dei protocolli).
- Impostare la portata di ossigeno a 2,5 L/min e la concentrazione di isoflurano al 2,5%. Metti un mouse nella camera di anestesia e attendi ~ 5 minuti per essere anestetizzato.
- Posizionare il mouse supino su una piastra riscaldante pulita e inserire il naso nel cono del naso. Applicare delicatamente l'unguento oftalmico veterinario sugli occhi con un applicatore con punta di cotone per prevenire la secchezza durante l'anestesia. Monitorare continuamente l'anestesia ed eseguire un pizzicamento del dito del piede sul mouse prima della lesione per assicurarsi che il mouse sia completamente anestetizzato.
- Pulire la gamba da iniettare con una salvietta alcolica fresca per disinfettare.
- Aspirare 30-50 μL di glicerolo al 50% (a seconda delle dimensioni dei topi) nella siringa da insulina. Spazzolare delicatamente i capelli sullo stinco per esporre la posizione del TA.
NOTA: è più facile spostare i capelli e ottenere una migliore visualizzazione quando sono ancora bagnati dalla salvietta imbevuta di alcol. - Dopo aver localizzato l'AT (appena laterale alla tibia, sporge leggermente attraverso la pelle e può essere sentito con una palpazione delicata), inserire l'ago nel TA distalmente, vicino alla caviglia. Inserire completamente l'ago nel muscolo e iniettare lentamente glicerolo mentre si ritira gradualmente l'ago, che aiuta a ferire la maggior parte del muscolo.
NOTA: È meglio inserire l'ago parallelo alla gamba, con un angolo leggermente rialzato. Una buona lesione in genere causa dorsiflessione poiché il TA si contrae dopo aver ritirato l'ago. Se le dita dei piedi del topo si diffondono, è probabile che sia stato iniettato il muscolo estensore digitorum longus (EDL). - Riposizionare il mouse nella gabbia e monitorare per circa 15-20 minuti per garantire il recupero dell'anestesia.
- Scartare l'ago in un contenitore di taglienti. Non ricapitolare mai un ago.
NOTA: l'iniezione di analgesia post glicerolo deve essere fornita come approvato dal Comitato istituzionale per la cura e l'uso degli animali. Gli adipociti possono essere osservati non appena 5 giorni dopo la lesione (dpi). A 7 dpi, tutti gli adipociti si sono formati e, di 21 dpi, sono completamente maturati.
3. Raccolta dei tessuti
- Preparare il 4% di PFA in 1x PBS e metterlo sul ghiaccio prima di iniziare la raccolta.
- Posizionare eventuali piastre (12 o 24 pozzetti) utilizzate per la fissazione muscolare sul ghiaccio e aggiungere il 4% di PFA a ciascun pozzetto, assicurandosi che ogni pozzetto abbia un volume di PFA 10-20 volte superiore rispetto al tessuto da fissare.
- Tra 7 e 21 giorni dopo la lesione al glicerolo, l'eutanasia del topo secondo le linee guida istituzionali (cioè sovradosaggio di isoflurano seguito da lussazione cervicale).
- Iniziare a raccogliere tutti i tessuti da utilizzare per l'istologia o l'isolamento dell'RNA.
NOTA: i tessuti devono essere congelati a scatto o posti in PFA entro 10-15 minuti dal sacrificio (Figura 2). - Spruzzare liberamente tutte le aree del mouse da tagliare con etanolo al 70% per aiutare a tenere i capelli lontani dall'area di dissezione e dagli strumenti.
- Utilizzare le forbici per tagliare la pelle intorno alla parte superiore della gamba, vicino al bacino (Figura 3A).
- Tirare delicatamente la pelle della gamba dall'alto verso il basso fino alla caviglia (Figura 3B).
NOTA: Il TA è un muscolo a forma di goccia con un tendine distale chiaramente definito che si attacca al cuneiforme mediale e al primo osso metatarsale. È laterale alla tibia e si estende fino alla parte inferiore del ginocchio. - In primo luogo, rimuovere lo strato esterno del tessuto connettivo (epimisio) utilizzando pinzette a punta affilata prima di raccogliere l'AT (Figura 3C). Usa un microscopio di dissezione per visualizzare meglio l'epimisio.
- Far scorrere le pinzette sotto l'AT dalla parte inferiore del muscolo, a partire dal tendine distale, e tirare delicatamente verso l'alto verso il ginocchio (Figura 3D). Fermarsi alla fine del muscolo; non spingere oltre la resistenza avvertita nella parte inferiore del ginocchio.
- Se c'è una resistenza significativa prima di raggiungere il ginocchio inferiore, fermarsi e continuare a rimuovere gli strati rimanenti di tessuto connettivo.
NOTA: C'è un altro tendine distale appena laterale al tendine TA che si attacca all'EDL, che è un muscolo snello laterale al TA. Facendo attenzione a far scorrere solo le pinzette sotto il tendine TA impedisce la raccolta accidentale dell'EDL, ma può anche essere facilmente rimosso dopo la fissazione. - Una volta che il TA è stato parzialmente sollevato dalla gamba con le pinzette, utilizzare lo stesso movimento con un bisturi per interrompere la connessione del TA al ginocchio inferiore (Figura 3E). Tagliare il tendine alla caviglia con le forbici per rimuovere completamente l'AT. Maneggiare solo il muscolo al tendine per evitare di danneggiare le fibre.
- Tagliare 1/3 del TA all'estremità opposta al tendine (Figura 3F), metterlo in un tubo microcentrifuga e congelarlo a scatto facendolo cadere in azoto liquido (Figura 3H).
- Immergere gli altri 2/3 del tessuto in un pozzo etichettato con il 4% di PFA per l'istologia (Figura 3I). Assicurati di tenere traccia di quando il primo e l'ultimo tessuto sono stati posti in fissativo. Porre su uno shaker per 2-2,5 ore a 4 °C.
- La durata della fissazione dipende dal tessuto e dalle sue dimensioni. Determinare la durata necessaria per fissare i tessuti. Fissare i TA per 2-2,5 ore a 4 °C in genere preserva bene la morfologia degli adipociti senza causare una fissazione eccessiva del tessuto.
NOTA: Se si prevede di utilizzare TA per la colorazione immunofluorescente a montaggio intero, saltare il resto di questo protocollo fino a raggiungere la Sezione 7: "Colorazione immunofluorescente a monte intero". - Dopo la fissazione, rimuovere il PFA dai pozzetti, risciacquare i tessuti con 1x PBS freddo 2-3 volte, quindi lavare 2-3 volte con 1x PBS freddo per 5 minuti per lavaggio.
- Rimuovere il PBS dai pozzetti e aggiungere abbastanza 30% di saccarosio in 1x PBS per consentire al tessuto di galleggiare. Posizionare sullo shaker a 4 °C durante la notte.
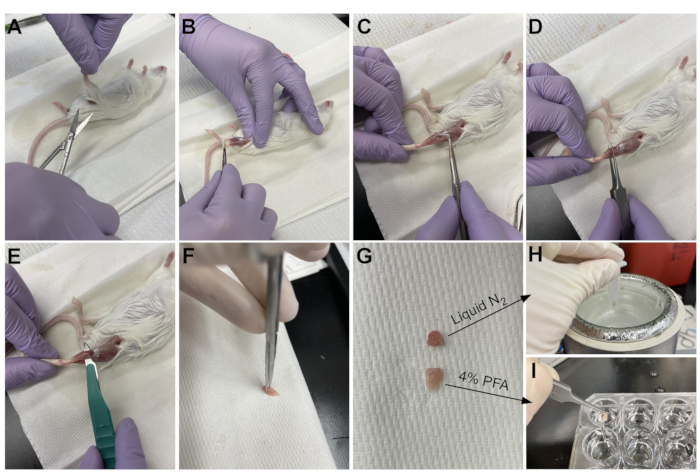
Figura 3: Riepilogo della raccolta dei tessuti. (A) La pelle viene tagliata alla base della gamba e (B) i muscoli degli arti posteriori sono esposti. (C) Una volta che l'epimisio viene rimosso dall'AT, (D) le pinze vengono utilizzate per separare parzialmente il muscolo e garantire che l'epimisio sia stato rimosso completamente. (E) L'AT viene tagliato dalla gamba con un bisturi e rimosso dopo aver tagliato il tendine. (G) Dopo aver tagliato l'AT in un terzo e due terzi, (H) un terzo viene congelato a scatto in azoto liquido per l'analisi RT-qPCR e (I) l'altro due terzi è fissato al 4% di PFA per l'istologia. Fare clic qui per visualizzare una versione più grande di questa figura.
4. Incorporamento
- Preparare gli stampi del campione da utilizzare per l'incorporamento etichettando e riempiendo con un mezzo di incorporamento sufficiente per immergere completamente i tessuti.
- Rimuovere i tessuti dai pozzetti, asciugare il saccarosio in eccesso su un tovagliolo di carta e passare agli stampi per campioni di media coltura.
NOTA: È utile sapere in quale orientamento lo stampo deve essere sezionato sul criostato. In questo modo, l'utente può orientare i tessuti nello stampo in modo da consentire l'area di interesse di essere facilmente accessibile. Per il TA, ciò si otterrebbe mettendo l'estremità più spessa (opposta al lato del tendine) rivolta verso la superficie che verrà sezionata. Ciò consente al TA di essere facilmente sezionato nella sua parte più spessa (pancia) e consente il taglio trasversale delle fibre muscolari. - Preparare un impasto di isopentano immergendo parzialmente un contenitore contenente isopentano in azoto liquido. Assicurarsi che ci sia abbastanza isopentano liquido nel contenitore per immergere circa la metà dello stampo del campione da utilizzare per incorporare i tessuti.
- Inizia a congelare gli stampi mettendoli con cura nel liquame isopentano e assicurandoti che circa la metà dello stampo sia sommersa. Inoltre, assicurati che lo stampo si congeli allo stesso modo da tutti e quattro i lati.
- Togliere lo stampo dall'isopentano poco prima che l'intero stampo sia visibilmente congelato dall'alto. La quantità di tempo necessaria dipende dagli stampi utilizzati.
- Conservare gli stampi congelati in un contenitore con ghiaccio secco mentre si congela il resto dei blocchi, quindi conservarli a -80 °C.
NOTA: l'isoptano per il congelamento può essere riutilizzato. Mettere in una bottiglia di vetro ma non stringere il coperchio fino a quando l'isopentano raggiunge la temperatura ambiente (RT). Altrimenti, il cambiamento di pressione potrebbe frantumare la bottiglia.
5. Sezionamento
- Impostare il criostato su -22 a -24 °C, aggiungere stampi contenenti TA nel criostato e attendere almeno 30 minuti per l'acclimatazione della temperatura. Nel frattempo, etichettare una serie di vetrini per microscopio caricati positivamente.
- Inserire una piastra antirollio e allinearla al criostato in modo tale che ci siano tagli minimi nella piastra in cui entra in contatto con il blocco del campione. Sicuro sul posto.
- Inserire una nuova lama criostatale nel supporto della lama e fissarla in posizione.
ATTENZIONE: la lama è affilata. Coprire la lama quando si manipolano altre parti del criostato o stampi congelati. - Rimuovere il blocco congelato dallo stampo. Aggiungere uno strato uniforme di mezzo incorporante al mandrino criostato e posizionare il blocco nel mezzo. Lasciare riposare per 1-3 minuti fino a quando il mezzo di incorporamento è completamente congelato (bianco opaco).
NOTA: per i TA, l'area più spessa (pancia) dovrebbe essere visibile quando si trova sul mandrino. - Posizionare il mandrino criostato con il blocco di tessuto nel criostato. Scopri la lama e fai avanzare il criostato in avanti fino a quando non entra in contatto con la lama. Sezione attraverso il blocco a sezioni da 25 μm fino a quando il tessuto non è più oscurato dal mezzo incorporante.
NOTA: durante il sezionamento, regolare l'angolo del criostato e/o la posizione dello stadio in modo che le sezioni siano di spessore uniforme. Può essere utile raccogliere alcune sezioni per garantire l'uniformità dello spessore della sezione. Si raccomanda all'utente di trovare la corretta posizione della piastra antirollio prima di sezionare fino alla regione di interesse all'interno del TA (pancia), in quanto ciò consente all'utente di provare diverse posizioni della piastra antirollio fino a quando le sezioni non si staccano dritte senza sprecare tessuto. - Modificare lo spessore della sezione a 10-12 μm e raccogliere le sezioni su vetrini per microscopio etichettati. Il sezionamento seriale è consigliato raccogliendo sezioni adiacenti su 6-10 diapositive (etichettate 1-x), che consente la colorazione per più marcatori. Se necessario, utilizzare un pennello sottile per srotolare le sezioni prima di raccoglierle sulla diapositiva.
NOTA: se le sezioni sono arricciate, verificare che la temperatura sia stabile nell'intervallo da -22 a -24 °C. Se ci sono striature verticali nelle sezioni, ciò potrebbe essere dovuto a un nick nella piastra antirollio o nella lama; questo può essere risolto regolando la posizione della piastra antirollio e/o passando ad una nuova lama. - Dopo aver raccolto sezioni adiacenti dello stesso piano di sezionamento su ciascuna diapositiva, regolare lo spessore a 25 μm per avanzare di 150-200 μm attraverso il blocco, quindi regolare lo spessore a 10-12 μm e ricominciare a sezionare.
NOTA: questo sezionamento seriale consente all'utente di visualizzare, visualizzare e quantificare a diverse profondità attraverso il TA; sono sufficienti da tre a quattro sezioni seriali per diapositiva. - Conservare i vetrini e i blocchi di tessuto a -80 °C.
6. Colorazione immunofluorescente (IF) di sezioni tissutali
NOTA: poiché le concentrazioni di anticorpi possono variare tra lotti e produttori, si consiglia l'ottimizzazione valutando diverse concentrazioni di anticorpi sui vetrini di prova prima di colorare i vetrini di interesse.
- Scongelare/asciugare i vetrini a RT o su una piastra calda a 37 °C per 10-20 min.
- Utilizzare una penna idrofoba per disegnare una linea sul bordo della superficie della carta della diapositiva, dove incontra il vetro.
- Mettere le diapositive in un barattolo Coplin e lavare con 1x PBS + 0,1% Tween20 (PBST) 3-5x su uno shaker per almeno 5 minuti per lavaggio per reidratare le sezioni di tessuto.
NOTA: A questo punto, è importante non lasciare che le diapositive si siedano senza essere immerse in PBST (fino alla linea idrofoba), altrimenti le sezioni di tessuto si asciugheranno. - Posizionare i vetrini sul rack di una camera umidificante e sovrapporre i vetrini con 310-350 μL di soluzione bloccante (5% siero d'asino e 0,3% Triton X-100 in 1x PBS) per 1-2 ore a RT.
NOTA: non è necessaria alcuna fase di permeabilizzazione aggiuntiva, poiché la soluzione di blocco contiene lo 0,3% di Triton X-100 che consente una sufficiente permeabilizzazione delle sezioni tissutali. Quando si utilizzano anticorpi primari derivati da topi (ad esempio, PAX7 e MYOD1 elencati di seguito), si consiglia di includere una fase di blocco mouse-on-mouse utilizzando frammenti Fab (1:50) nella soluzione di blocco per la fase di blocco. Ciò contribuirà a ridurre lo sfondo a causa del legame non specifico dell'anticorpo secondario del topo ad anticorpi diversi da quello primario. - Diluire gli anticorpi primari da utilizzare nella soluzione bloccante poco prima di procedere alla fase successiva come segue:
- Anticorpi primari per la colorazione degli adipociti e l'imaging dell'intera sezione: diluire l'anti-perilipina di coniglio ad un rapporto di diluizione di 1:1000.
- Anticorpi primari per il tracciamento del lignaggio degli adipociti: anti-GFP di pollo diluito con un rapporto di 1:1000 e anti-perilipina di coniglio a 1:1000.
- Anticorpi primari per il tracciamento del lignaggio dei FAP: anti-GFP di pollo diluito in un rapporto di 1:1000 e anti-PDGFRα di capra a 1:250.
- Anticorpi primari per marcatori miogenici: anti-PAX7 di topo diluito con un rapporto di 1:25 o anti-MYOD1 di topo a 1:250 e anti-LAMININA di coniglio a 1:1000.
NOTA: Mentre gli anticorpi sopra elencati sono stati valutati con successo con questo protocollo, è probabile che anche altri marcatori e anticorpi per etichettare FAP, adipociti e / o altri tipi di cellule siano compatibili con questo protocollo. Si raccomanda vivamente quando si utilizzano anticorpi primari per la prima volta che l'utente includa un vetrino di controllo negativo, in cui gli anticorpi primari vengono omessi. Questo controllerà la specificità degli anticorpi. Vengono seguiti tutti gli altri passaggi del protocollo, inclusa l'aggiunta di anticorpi secondari, ma la soluzione bloccante viene utilizzata da sola nella fase successiva anziché l'anticorpo primario nella soluzione bloccante.
- Scaricare la soluzione bloccante dai vetrini e sovrapporla con 310-350 μL di soluzione bloccante con anticorpi primari e incubare durante la notte a 4 °C nella camera di umidificazione.
- Il giorno dopo, scaricare la soluzione bloccante / anticorpi primari dai vetrini e metterli in un barattolo coplin. Risciacquare le diapositive 2-3 volte con PBST e lavare 3-5 volte con PBST su uno shaker per almeno 5 minuti per lavaggio.
- Durante l'ultimo lavaggio, preparare gli anticorpi secondari o eventuali coniugati diretti da utilizzare nella soluzione bloccante. Ridurre al minimo la quantità di tempo che questi anticorpi trascorrono nella luce per evitare il fotosbiancamento.
- Anticorpi secondari diluiti/coniugati diretti: 488 nm asino anti-pollo (1:1000) o anti-coniglio (1:1000) o anti-topo (1:1000), 568 nm asino anti-capra (1:1000) o anti-coniglio (1:1000) o Falloidina (miofibre; 1:100), colorazione DAPI (nuclei; 1:500).
- Sovrapporre i vetrini con 310-350 μL della soluzione bloccante con anticorpi secondari e/o coniugati diretti nella camera umidificante. Incubare a RT per 1-2 ore. Proteggi i campioni dalla luce d'ora in poi.
- Scaricare la soluzione bloccante/gli anticorpi secondari e metterli in un barattolo coplin. Risciacquare con PBST una volta e lavare 3-5 volte con PBST su uno shaker per almeno 5 minuti per lavaggio. Tenere il barattolo Coplin coperto per evitare l'esposizione alla luce.
- Asciugare le diapositive nel miglior modo possibile toccando i bordi e pulendo la parte posteriore contro un tovagliolo di carta, ma non lasciare asciugare le sezioni di tessuto.
- Aggiungere tre o quattro gocce di mezzo di montaggio acquoso sul bordo orizzontale superiore della diapositiva e aggiungere delicatamente una slitta. Non premere verso il basso o muoversi se si formano bolle d'aria sotto il coperchio; qualsiasi pressione o movimento può distorcere la fragile architettura cellulare degli adipociti.
- Consentire al supporto di montaggio di posizionarsi al buio durante la notte prima dell'imaging.
7. Colorazione immunofluorescente a tutto monte
- Dopo ~ 1 ora di fissazione (vedere il passaggio 3.14), utilizzare pinzette a punta affilata per rimuovere le miofibre dal TA fisso.
- Posizionare le fibre separate in una piastra a 24 pozzetti e lavare 3 volte per 3 minuti ciascuna con PBST. Per tutte le incubazioni successive, assicurarsi di aggiungere il coperchio per evitare l'evaporazione.
- Incubare per 1 ora in 1% Triton X-100 in 1x PBS a RT (200-300 μL) su uno shaker per consentire una migliore penetrazione degli anticorpi.
- Dopo aver risciacquato alcune volte con PBST, sovrapporre con soluzione bloccante (200-300 μL) e bloccare su un nutatore o shaker per una notte a 4 °C.
- Diluire gli anticorpi primari alla concentrazione desiderata (raddoppiare la concentrazione tende ad essere un buon punto di partenza) nella soluzione bloccante. Incubare i campioni (200-300 μL) su un nutatore o agitatore durante la notte a 4 °C.
- Lavare rigorosamente i campioni con PBST per tutto il giorno con frequenti cambi a RT sullo shaker, circa 4-6 volte per 30-60 minuti ogni lavaggio.
- Diluire gli anticorpi secondari nella soluzione bloccante alla concentrazione desiderata (1:500 tende a funzionare bene) più la colorazione nucleare e incubare i campioni (200-300 μL) su un nutatore o agitatore durante la notte a 4 °C.
- Lavare i campioni rigorosamente con PBST durante il giorno con frequenti cambi a RT sullo shaker, circa 4-6 volte per 30-60 minuti ogni lavaggio o lavaggio durante la notte a 4 ° C.
- Per montare, asciugare delicatamente il PBST in eccesso e quindi posizionare le fibre in una o due gocce di terreno di montaggio su una slitta di vetro (Figura 4A). Per sollevare il coperchio (18 mm x 18 mm), aggiungere piccoli piedini in argilla; questo impedirà che le fibre vengano schiacciate e fisserà il coperchio alla diapositiva. I composti di modellazione funzionano bene per questo. Una volta fissato il coverslip, aggiungere più medium al bordo fino a quando l'area sotto il coverslip è piena.
NOTA: Invece di utilizzare un mezzo di montaggio contenente agenti anti-sbiadimento, il tessuto può anche essere spostato attraverso una serie ascendente di glicerolo (dal 30% all'80% di glicerolo in PBS). - Attendere 1-2 giorni prima dell'imaging per consentire la polimerizzazione del mezzo di montaggio.
8. Imaging del grasso intramuscolare
- Accendere il microscopio e avviare il software di imaging. Fissare la diapositiva sullo stage.
NOTA: per l'imaging degli adipociti nelle sezioni muscolari, è spesso sufficiente un obiettivo 5x o 10x combinato con la microscopia a campo largo. Per visualizzare WM-IF, è necessario un microscopio confocale. - Utilizzare qualsiasi canale per identificare l'area da fotografare.
- Nel software di imaging, regolare il guadagno e il tempo di esposizione per ciascun canale.
- Scatta immagini dell'intero tessuto in ciascun canale (automatico o manuale in base al microscopio e al software utilizzato) e unisci le singole tessere per creare un composito dell'intera sezione trasversale TA.
NOTA: Si consiglia di scattare immagini di due o tre diverse sezioni dello stesso TA a profondità diverse. Quantificando gli adipociti in ogni sezione e quindi riportando le differenze medie localizzate nella quantità di grasso intramuscolare dovute, ad esempio, a errori di iniezione saranno evitate.
9. Quantificazione degli adipociti
- Se non è stato installato in precedenza, aggiungere il plug-in Cell Counter a ImageJ (https://imagej.nih.gov/ij/plugins/cell-counter.html).
- Importare le immagini in ImageJ come file TIF o file originali del microscopio. Visualizza ogni canale in ImageJ come file TIF separato.
NOTA: se si utilizzano LIF o tipi di file di microscopio simili, in Opzioni di importazione di bioformati scegliere Hyperstack per Visualizza stack con e selezionare la casella Dividi canali. Fare clic su OK per aprire il file. Assicurarsi inoltre che la casella Ridimensiona automatica sia deselezionata. - Assicurati che le immagini per ogni canale siano in formato a 8 bit (e grigio): > Tipo > 8 bit.
- Unisci immagini DAPI (blu), GFP (verde), PERILIPIN (rosso) e PHALLOIDIN (grigio): immagine > a colori > unisci canali.
- Verificare che la scala (Analizza > Imposta scala) sia in micron. Utilizzando lo strumento di selezione a mano libera, delineare la parte lesa e illesa di ciascuna sezione trasversale, quindi misurare (Analizza > misura) e registrare l'area lesa rispetto a quella non lesionata in un foglio di calcolo.
NOTA: il muscolo ferito può essere identificato come aree prive di miofibre o aree popolate da miofibre che contengono nuclei situati centralmente. - Launch Cell Counter: Plugin > CellCounter > Initialize.
- Selezionare un tipo di contatore, quindi contare ogni adipocita. Registrare il numero totale di adipociti in un foglio di calcolo, quindi calcolare il numero di adipociti per 1 mm2 dell'area lesa.
10. Analisi dell'espressione genica adipogena mediante RT-qPCR
- Isolamento dell'RNA
- Prima di iniziare, preriscaldare l'acqua priva di RNasi a 45 °C e preparare etOH fresco al 70% (350 μL per campione).
- Aggiungere 1.000 μL di tiocianato di guanidio a ciascuna provetta contenente il campione (vedere punto 3.12). È importante che vengano utilizzati tubi approvati dal battitore di perline.
ATTENZIONE: Il tiocianato di guanidio è tossico. Indossare adeguati dispositivi di protezione individuale e maneggiare in una cappa aspirante. - Aggiungere tre perline medie o una perla grande e una piccola perla a ciascun tubo.
- Omogeneizzare il tessuto a 50 Hz per 2-4 minuti utilizzando un battitore di perline. A seconda del tipo di tessuto e delle dimensioni del campione, potrebbero essere necessari fino a 10 minuti.
- Aggiungere 200 μL di cloroformio.
ATTENZIONE: il cloroformio è tossico. Indossare dispositivi di protezione individuale e maneggiare in una cappa aspirante. - Agitare i campioni per 15 s. Incubare per 2-3 minuti a RT.
- Centrifuga per 15 min a 12.000 x g. Pipettare 350 μL del surnatante trasparente (strato superiore contenente l'RNA) e aggiungere a un nuovo tubo microcentrifuga contenente 350 μL di etanolo al 70%. Fare attenzione a non aspirare gli strati inferiori di proteine e/o DNA
- Trasferire fino a 700 μL della miscela in una mini colonna di spin posta in un tubo di raccolta da 2 ml. Continuare con l'isolamento dell'RNA seguendo le istruzioni del produttore.
- Elute con 30-50 μL di acqua priva di RNasi, a seconda della resa prevista. Mantenere l'RNA sul ghiaccio e misurare la resa utilizzando uno spettrofotometro. Mantenere l'RNA immagazzinato a -80 °C
NOTA: È possibile omettere la fase di trattamento con DNasi, poiché togliere con cura solo i 350 μL superiori dello strato di RNA è sufficiente per prevenire la contaminazione del DNA. Oltre all'analisi RT-qPCR, l'RNA isolato può essere utilizzato anche per il sequenziamento dell'RNA, nel qual caso è altamente raccomandata una fase di trattamento con DNasi.
- Sintesi del cDNA
- Utilizzare fino a 1 μg di RNA per sintetizzare il cDNA con un kit di sintesi del cDNA, seguendo le istruzioni del produttore.
- Al termine della corsa, aggiungere 80 μL di acqua priva di RNasi. Conservare i campioni a -20 °C.
- RT-qPCR di geni selettivi degli adipociti.
- Utilizzando un formato a 384 pozzetti, aggiungere 1 μL di primer (~ 1 μM di concentrazione finale) sul fondo di ciascun pozzetto. I primer pre-essiccanti si traducono in repliche tecniche più strette. Lasciare coperto fino a quando i primer non sono completamente evaporati (la piastra può essere posizionata su un blocco riscaldante impostato a 37 °C per accelerare l'evaporazione).
- Impostare le reazioni del campione con quattro-otto repliche tecniche come segue: 2,5 μL di miscela master RT-PCR a base di colorante, 2,1 μL di acqua priva di RNasi e 0,4 μL di cDNA (~1 ng) con 5 μL di volume totale per pozzo. Sono state utilizzate le seguenti condizioni di ciclo termico: denatura a 95 °C per 15 s e ricottura/estensione a 60 °C per 25 s per 40 cicli.
- Normalizzare i valori grezzi di CT (soglia del ciclo) ai livelli di geni di pulizia (cioè Hprt e Pde12) calcolando ΔΔCT come descritto qui38. Vedere20 per le sequenze di primer.
NOTA: È necessario seguire la pratica standard per l'analisi RT-qPCR, come l'uso di un controllo meno trascrizione inversa (-RT), la reazione PCR e la convalida del primer.
Risultati
Visualizzazione immunofluorescente del grasso intramuscolare
Seguendo i passaggi precedenti e visualizzando la Figura 1A, le sezioni di tessuto TA sono state raccolte da una lesione post-glicerolo di 21 giorni che sono state congelate immediatamente dopo la raccolta in isoptano raffreddato con LN2 o sono state fissate in PFA al 4% per 2,5 ore. Dopo aver criosezionato e macchiato entrambi i campioni, le immagini sono state scattate a metà pancia, la più grande area del TA. Gli adipociti perilipina+ dei TA non fissi (Figura 1B) hanno alterato significativamente la morfologia rispetto alle sezioni fisse (Figura 1C), rendendo la loro identificazione, visualizzazione e successiva quantificazione molto più difficile e potenzialmente imprecisa. Da notare, le prime goccioline lipidiche di PERILIPIN+ sono state rilevate circa 5 giorni dopo l'infortunio, con la maggior parte degli adipociti che si sono formati entro il giorno 7. Entro 21 giorni dopo l'infortunio, gli adipociti erano completamente maturi.
Poiché la quantità di grasso per TA è fortemente correlata alla gravità della lesione indotta, i TA devono essere danneggiati in modo significativo per osservare e studiare efficacemente la formazione di grasso intramuscolare. Praticare iniezioni usando l'inchiostro nei TA cadavere è un ottimo modo per migliorare la gravità delle lesioni. Le lesioni di successo tendono ad essere superiori al 50% del muscolo. Da notare, le aree ferite del muscolo rappresentano aree prive di fibre muscolari o aree popolate da fibre muscolari che contengono almeno un nucleo situato in posizione centrale, un noto segno distintivo di una fibra muscolare rigenerante.
Questo protocollo può essere facilmente adattato per macchiare PER FAP e grasso in 3D. Per questo, le miofibre multiple della post-fissazione TA sono state accuratamente separate, seguite da immunofluorescenza a montaggio intero. La chiave è fissare correttamente le fibre al vetrino e, allo stesso tempo, evitare una sovracompressione del tessuto. Utilizzando piedini in argilla modellabili, l'utente può regolare lo spessore richiesto e fissare il coperchio al vetrino, consentendo anche l'uso di un microscopio invertito (Figura 4A). Questo metodo è stato utilizzato con successo per etichettare i FAP PDGFRα+ , le miofibre di falloidina+ e gli adipociti che esprimono PERILIPINa (Figura 4B, Video supplementare 1 e Video supplementare 2). Dopo aver ottenuto immagini su più piani z che si estendono fino a 150 μm di spessore, il modulo di rendering 3D all'interno del software del microscopio è stato utilizzato per creare una ricostruzione 3D.
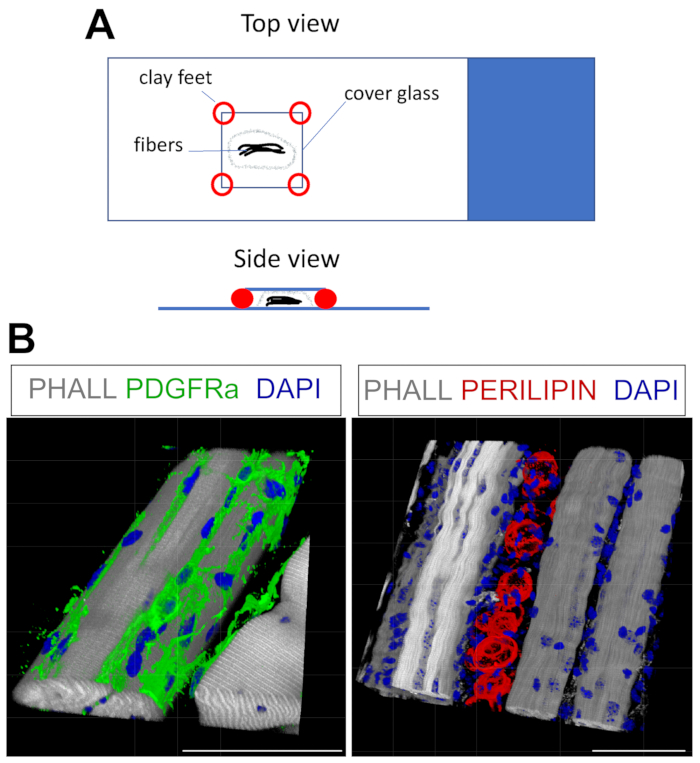
Figura 4: Colorazione immunofluorescente a montaggio intero. (A) Vista superiore e laterale su come montare il campione e aggiungere coverslip per la colorazione a montaggio intero. (B) Ricostruzioni 3D rappresentative di FAP (verde; sinistra) e adipociti (rosso; destra) insieme a miofibre (grigio) e nuclei (blu). Barre di scala: 50 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Quantificazione del grasso intramuscolare
Una volta che sono state prese immagini di grasso intramuscolare, la funzione Cell Counter in ImageJ/FIJI è stata utilizzata per contare manualmente il numero di adipociti PERLIPIN+ (Figura 5A). Successivamente, è stata determinata l'area totale della sezione muscolare e l'area lesa, definita da nuclei situati centralmente all'interno delle miofibre. Per controllare la gravità della lesione, il numero totale di adipociti è stato diviso per l'area lesa con conseguente numero di cellule adipose per 1 mm2 di muscolo ferito. Di solito, i TA che mostrano <30% di danno sono esclusi dalle quantificazioni. Da notare, sebbene gli adipociti siano rari senza lesioni, che vanno da zero a otto per area della sezione trasversale, il numero totale di adipociti è ancora normalizzato dall'area totale. Come evidenziato nella Figura 5B, una lesione del glicerolo provoca enormi quantità di grasso intramuscolare rispetto a un muscolo TA non ferito. In alternativa, poiché la colorazione della perilipina è molto pulita con un elevato rapporto segnale-rumore, è anche possibile utilizzare la funzione Analizza particella per determinare l'area totale occupata dalla perilipina. Tuttavia, questo metodo non sarà in grado di distinguere tra adipociti più piccoli e meno adipociti. Sono state fotografate e quantificate fino a tre sezioni di un minimo di quattro singoli animali ed è stato riportato il numero medio di cellule adipose presenti per topo.
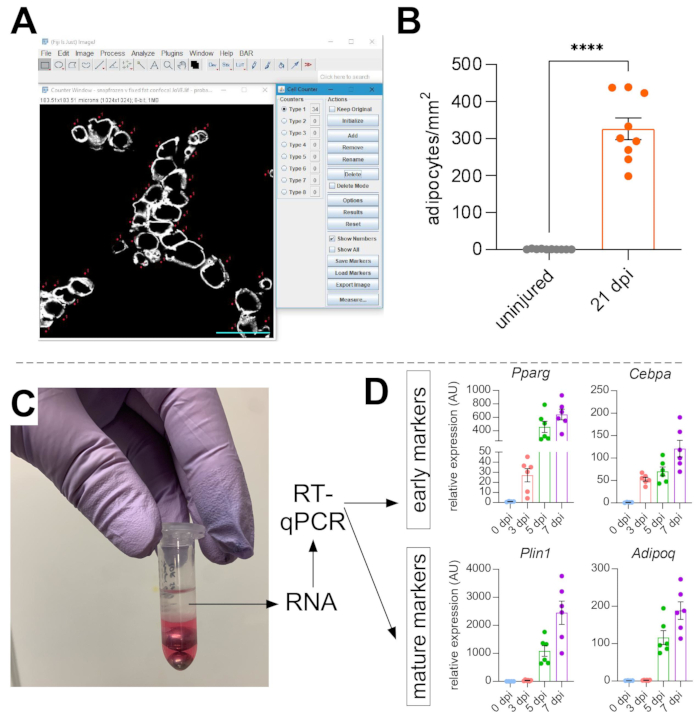
Figura 5: Quantificazioni del grasso intramuscolare. (A) Immagine rappresentativa di come contare gli adipociti PERILIPIN+ (bianco) utilizzando la funzione Cell Counter in ImageJ. Barra di scala: 50 μm. (B) Quantificazioni di adipociti TA interi 21 giorni dopo l'iniezione di glicerolo normalizzate a 1 mm2 dell'area lesa. Ogni punto rappresenta la media di un mouse. Barre di errore visualizzate come SEM. **** = p < 0,0001. (C) Lo strato di RNA dopo l'omogeneizzazione e la successiva separazione di fase mediante cloroformio viene utilizzato per l'analisi RT-qPCR. (D) Cambiamenti di piega nei livelli di espressione di Pparg e Cepbα, geni adipogenici precoci, e Plin1 e Adipoq, due marcatori adipocitari maturi, in diversi punti temporali dopo la lesione del glicerolo. Ogni punto rappresenta la media di un mouse. Barre di errore visualizzate come SEM. Fare clic qui per visualizzare una versione più grande di questa figura.
Per confermare in modo indipendente la quantità di grasso intramuscolare presente, è possibile determinare i livelli di espressione genica di vari marcatori adipogenici. Per questo, l'RNA può essere isolato da una porzione dello stesso muscolo TA utilizzato per l'immunofluorescenza (vedi passaggi sopra) in diversi punti post-lesione. Un battitore di perline è stato usato in combinazione con guanidio tiocianato per omogeneizzare il tessuto. Dopo aver aggiunto il cloroformio seguito dalla centrifugazione, lo strato superiore contenente RNA è stato accuratamente estratto e le mini colonne di spin sono state utilizzate per la pulizia dell'RNA (Figura 5C). Questo metodo produce abitualmente alta qualità e quantità di RNA adatto a tutte le analisi a valle come RT-qPCR e RNAseq. Per RT-qPCR, sono stati determinati i livelli di espressione relativa dei geni adipogenici rispetto a quelli di housekeeping e qualsiasi cambiamento relativo è stato valutato seguendo il metodo ΔΔCT38. Come descritto nella Figura 5D, rispetto al muscolo TA non ferito, la lesione del glicerolo induce l'espressione di marcatori adipogenici precoci come Pparg e Cebpα non appena 3 giorni dopo l'infortunio. I marcatori maturi, come l'adiponectina (Adipoq) e la perilipina (Plin1), possono essere rilevati già 5 giorni dopo la lesione del glicerolo.
Tracciatura genetica del lignaggio degli adipociti
Il protocollo di colorazione degli adipociti qui presentato può essere facilmente adattato per includere il tracciamento genetico del lignaggio dei FAP per mappare e seguire il loro destino negli adipociti. Ad esempio, abbiamo precedentemente dimostrato che la ricombinazione potrebbe essere indotta tramite la somministrazione di tamoxifene in PdgfrαCreERT2; I topi Rosa26EYFP 2 settimane prima della lesione, rimuovendo efficacemente la codifica di arresto floxed e attivando in modo indelebile l'espressione di EYFP nei FAP (Figura 6A). Abbiamo raggiunto elevate efficienze di ricombinazione con il regime di tamoxifene qui presentato, con ~ 75% di PDGFRα + FAP che esprimono EYFP20, simile a quello che altri laboratori hanno riportato 27,39,40. Dimostrando che i FAP sono effettivamente l'origine cellulare del grasso intramuscolare, la maggior parte dei FAP si è trasformata in adipociti che esprimono EYFP + PERILIPIN 7 giorni dopo il danno al glicerolo (Figura 6B).
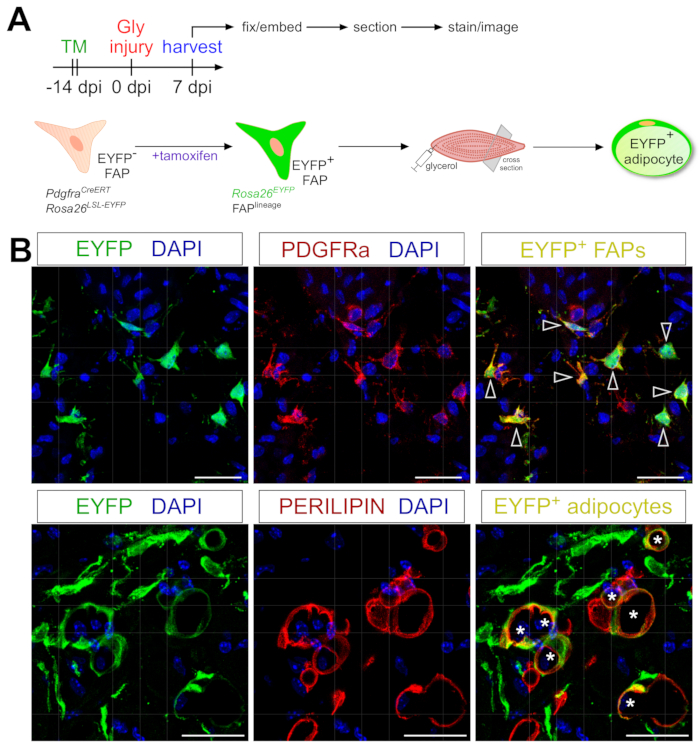
Figura 6: Tracciamento del lignaggio dei FAP. (A) Panoramica schematica della configurazione sperimentale. (B) Immagini immunofluorescenti rappresentative che mostrano il successo della ricombinazione e dell'attivazione di EYFP (giallo) all'interno di PDGFRα+ FAPs (rosso, punte di freccia) e adipociti PERILIPIN+ (rosso, asterischi). Barre di scala: 25 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Rilevamento di più tipi di cellule
Questo protocollo può anche essere utilizzato per visualizzare il compartimento miogenico. Utilizzando anticorpi contro PAX7 e MYOD1, le cellule staminali muscolari (MuSC) e i mioblasti, rispettivamente, possono essere prontamente rilevati 5 giorni dopo la lesione del glicerolo anche nella sezione del tessuto muscolare fissato con PFA (Figura 7). Pertanto, il protocollo presentato è versatile e adattabile non solo agli adipociti e ai FAP di etichetta e immagine, ma anche ad altri tipi di cellule del lignaggio miogenico.
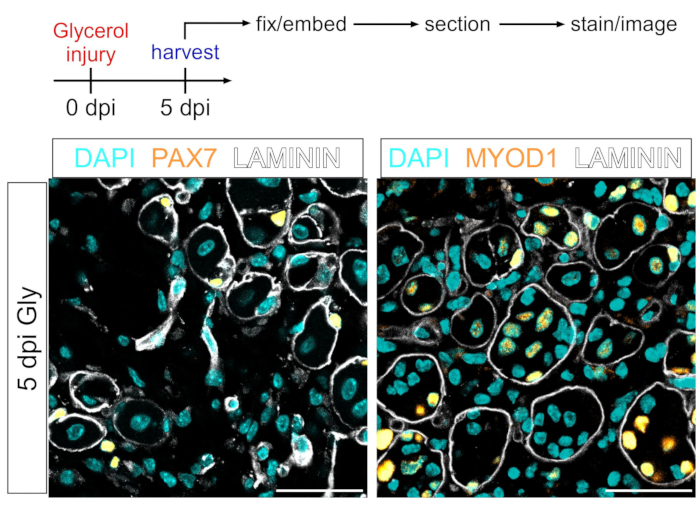
Figura 7: Colorazione immunofluorescente delle cellule staminali muscolari e dei mioblasti. (A) Panoramica schematica dell'impostazione sperimentale. (B) Immagini immunofluorescenti rappresentative che mostrano una colorazione riuscita delle cellule staminali muscolari (MuSC) (giallo, a sinistra) con PAX7 e mioblasti (giallo, a destra) con MYOD1. LAMININ delinea le miofibre (bianche) e i nuclei sono in ciano. Barre di scala: 50 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Video supplementare 1: rendering 3D dei FAP. Ricostruzione tridimensionale di miofibre, FAP e nuclei colorati per PHALLOIDIN (grigio), PDGFRα (verde) e DAPI (blu), rispettivamente, 21 giorni dopo la lesione. Clicca qui per scaricare questo video.
Video supplementare 2: rendering 3D del grasso intramuscolare. Rendering volumetrico di fasci di miofibre (grigio, PHALLOIDIN) e grasso intramuscolare (rosso, PERILIPIN), che ha sostituito una miofibra 21 giorni dopo la lesione del glicerolo. Clicca qui per scaricare questo video.
Discussione
Questo protocollo delinea un protocollo esteso e dettagliato che consente una visualizzazione efficiente e una quantificazione rigorosa del grasso intramuscolare. Dividendo lo stesso muscolo in due parti, una utilizzata per l'immunofluorescenza e l'altra per l'analisi RT-qPCR, questo protocollo è anche molto versatile. Può anche essere combinato con il tracciamento genetico del lignaggio dei FAP per studiare la loro conversione in adipociti in determinate condizioni ed è altamente adattabile per etichettare e visualizzare più tipi di cellule aggiuntive.
I modi più comunemente usati per visualizzare il grasso intramuscolare sono sezioni di paraffina seguite da colorazione di ematossilina ed eosina o sezioni congelate colorate per coloranti lipofili come Oil Red O (ORO). Tuttavia, mentre i tessuti trattati con paraffina mantengono la migliore istologia, lo stesso processo estrae anche tutti i lipidi impedendo l'uso di coloranti lipofili. Sebbene i metodi di colorazione lipofila funzionino sia su sezioni di tessuto fisse che non fisse di PFA, le goccioline lipidiche sono facilmente spostabili applicando pressione al coverslip, distorcendo così la distribuzione spaziale del grasso intramuscolare. Per aggirare questo problema, un recente studio ha stabilito un protocollo rigoroso per visualizzare gli adipociti ORO + utilizzando un approccio a montaggio intero. Per questo, gli autori hanno decellularizzato il TA per visualizzare la distribuzione spaziale del grasso intramuscolare in tutto il TA41. Per quanto potente sia questa tecnica, impedisce anche l'uso di altre co-macchie per contrassegnare ulteriori strutture cellulari. L'intero approccio di immunofluorescenza del monte qui presentato può essere utilizzato per co-macchiare gli adipociti con una varietà di marcatori che consentono una mappatura fine dell'ambiente cellulare. Una delle principali sfide, tuttavia, è la penetrazione tissutale degli anticorpi. Più fibre sono tenute insieme, più difficile sarà per gli anticorpi penetrare e legare equamente tutti gli antigeni disponibili. Pertanto, questo metodo è più efficace quando si guardano piccoli gruppi di fibre. Allo stesso tempo, questa è anche una limitazione in quanto la posizione anatomica complessiva del grasso intramuscolare viene persa quando ci si concentra solo su piccoli fasci di fibre staccati. Tuttavia, con l'attuale sviluppo di nuovi metodi di compensazione dei tessuti e nuove tecnologie di imaging, in futuro sarà possibile una maggiore penetrazione e visualizzazione dei tessuti 42,43,44.
Mentre la fissazione preventiva del tessuto muscolare preserva la morfologia degli adipociti, crea anche una sfida per valutare le dimensioni delle miofibre, un'importante misura della salute muscolare. La dimensione della miofibra viene determinata misurando l'area della sezione trasversale delle miofibre. Abbiamo precedentemente riferito che la precedente fissazione del tessuto muscolare farà sì che la maggior parte dei marcatori disponibili per delineare le miofibre fallisca31. Per superare questo ostacolo, abbiamo sviluppato una nuova pipeline di segmentazione delle immagini, che consente la misurazione delle dimensioni della miofibra anche nelle sezioni muscolari fisse31. Pertanto, abbiamo stabilito una pipeline di lavorazione dei tessuti robusta ed efficiente che, combinata con questo protocollo, supera la maggior parte degli svantaggi causati dalla precedente fissazione del tessuto muscolare.
Un altro grande vantaggio di questo approccio è la versatilità. Dividendo il TA in due parti, la quantità di informazioni che possono essere ottenute da un muscolo viene massimizzata. Questo non solo riduce il numero di animali, ma aggiunge anche un ulteriore livello di controllo confermando l'istologia attraverso l'espressione genica e viceversa. Inoltre, molti geni diversi possono essere esaminati oltre i geni adipogenici. L'RNA isolato può anche essere utilizzato per un esperimento di RNAseq a muscolo intero. Infine, il pezzo muscolare congelato a scatto può essere utilizzato anche per il lavoro proteico. Una limitazione di questo protocollo è la possibilità che la lesione non sia coerente per l'intera lunghezza dell'AT. Ciò potrebbe portare a uno scenario in cui le due parti muscolari divergono nella quantità di grasso intramuscolare che contengono e può giustificare l'esclusione di tale campione da qualsiasi analisi a valle. Si raccomanda, pertanto, di non fare semplicemente affidamento sulla RT-qPCR per trarre conclusioni importanti sulla quantità di grasso intramuscolare, ma piuttosto come dati di supporto alle quantificazioni istologiche.
Insieme, questo protocollo delinea una pipeline di elaborazione dei tessuti robusta, efficiente e rigorosa che consentirà la visualizzazione e la quantificazione del grasso intramuscolare, il primo passo nello sviluppo di nuove opzioni di trattamento per combattere la fibrosi grassa. Allo stesso tempo, è versatile e può essere adattato a molti diversi tipi di cellule all'interno del muscolo e agli adipociti in altri tessuti.
Divulgazioni
Gli autori non dichiarano interessi concorrenti.
Riconoscimenti
Ringraziamo i membri del laboratorio Kopinke per aver aiutato con la raccolta dei dati e la lettura critica del manoscritto. Ringraziamo anche i membri dell'Istituto di Teologia dell'Università della Florida per il loro prezioso contributo al manoscritto. Il lavoro è stato supportato dalla sovvenzione NIH 1R01AR079449. La Figura 2 è stata creata con Biorender.
Materiali
| Name | Company | Catalog Number | Comments |
| 16% PFA (Pack of 12, 10 mL bottles) | Electron Miscroscopy Sciences | 15710 | |
| 2.0 mL Microcentrifuge Tubes | Fisher Scientific | 05-408-138 | microcentrifuge tubes for snapfreezing/bead beating |
| 2-Methylbutane (4 L) | Fisher Chemical | O3551-4 | isopentane |
| Absolute Ethanol (200 proof) | ThermoFisher Scientific | BP2818100 | |
| AffiniPure Fab fragment donkey anti-mouse | Jackson ImmunoResearch | 715-007-003 | mouse-on-mouse blocking |
| Alexa Fluor 488 donkey anti-chicken secondary antibody | Jackson ImmunoResearch | 703-545-155 | |
| Alexa Fluor 488 donkey anti-mouse secondary antibody | Invitrogen | A21202 | |
| Alexa Fluor 488 donkey anti-rabbit secondary antibody | Invitrogen | A21206 | |
| Alexa Fluor 568 donkey anti-goat secondary antibody | Invitrogen | A11057 | |
| Alexa Fluor 568 donkey anti-rabbit secondary antibody | Invitrogen | A11037 | |
| Alexa Fluor 568 Phalloidin antibody | Invitrogen | A12380 | Dissolved in 1.5 mL methanol (~66 µM working solution) |
| BioLite 24-well Multidishes | ThermoFisher Scientific | 930186 | 24 well plate for PFA tissue incubation |
| Biometra TOne | analytikjena | 8462070301 | Thermal cycler |
| Chicken anti-GFP antibody | Aves Labs | GFP-1020 | |
| Chloroform/isoamyl alcohol 24:1(v/v) for molecular biology, DNAse, RNAse, and Protease free | ThermoFisher Scientific | AC327155000 | |
| Corn oil | Sigma Aldrich | C8267 | |
| DAPI stain | Invitrogen | D1306 | 150 µM working solution in dH2O |
| Donkey Serum (100 mL) | Millipore Sigma | 5058837 | for blocking solution |
| Dumont #5 Forceps | Fine Science Tools | 11251-20 | sharp-tipped tweezers |
| Fine Scissors Straight 9 cm | Fine Science Tools | 14060-09 | |
| Fluoromount-G | SouthernBiotech | 0100-01 | mounting medium |
| Glycerol, 99.5%, for molecular biology (500 mL) | Acros Organics | 327255000 | |
| Goat anti-PDGFRα antibody | R&D | AF1062 | |
| Hybridization Oven | VWR | 230301V | for Tamoxifen incubation |
| ImmEdge Hydrophobic Barrier PAP Pen | Vector Laboratories | H-4000 | hydrophobic pen |
| Insulin Syringe with Micro-Fine IV needle (28 G) | BD | 329461 | |
| Insulin Syringe with Slip Tip, 1 mL | BD | 329654 | Insulin syringe without needle, for oral gavaging |
| iScript cDNA Synthesis Kit | Bio-Rad | 1708890 | |
| Isoflurane | Patterson Veterinary | 78938441 | |
| Leica DMi8 inverted microscope | Leica | micrscope used for widefield IF and confocal imaging | |
| Micro Slides | VWR | 48311-703 | positively charged microscope slides |
| mouse anti-MYOD antibody | Invitrogen | MA1-41017 | |
| mouse anti-PAX7 antibody (supernatant) | DSHB | AB 428528 | |
| MX35 Premier+ Microtome blades | ThermoFisher Scientific | 3052835 | microtome blades |
| NanoDrop 2000 Spectrophotometer | ThermoFisher Scientific | ND2000 | spectrophotometer for RNA yield |
| Play-Doh | Hasbro | modeling compound | |
| PowerUp SYBR Green Master Mix | ThermoFisher Scientific | A25742 | green dye PCR master mix |
| Puralube Vet Ointment | Puralube | 17033-211-38 | vet ophthalmic ointment |
| QuantStudi 6 Flex Real-Time 384-well PCR System | Applied Biosystems | 4485694 | qPCR machine |
| Rabbit anti-perilipin antibody | Cell Signaling Technology | 9349S | |
| Red-Rotor Shaker | Hoefer Scientific | PR70-115V | shaker for IF staining |
| Richard-Allan Scientific Slip-Rite Cover Glass | ThermoFisher Scientific | 152460 | coverslips |
| RNeasy Mini Kit | QIAGEN | 74106 | contains mini spin columns |
| Safe-Lock Tubes 1.5 ml, natural | Eppendorf | 22363204 | |
| Sample Tubes RB (2 mL) | QIAGEN | 990381 | |
| Sodium azide | Alfa Aesar | 14314 | |
| Stainless Steel Beads, 2.8 mm | Precellys | KT03961-1-101.BK | small beads |
| Stainless Steel Beads, 5 mm | QIAGEN | 69989 | medium beads |
| Stainless Steel Beads, 7 mm | QIAGEN | 69990 | large beads |
| Stainless Steel Disposable Scalpels | Miltex | 327-4102 | scalpel |
| Stainless steel feeding tube, 20 G x 38 mm, straight | Instech Laboratories | FTSS-20S-3 | gavage needle |
| Tamoxifen | Toronto Research Chemicals | T006000 | |
| Tissue Plus O.C.T. Compound | Fisher HealthCare | 4585 | embedding medium |
| TissueLyser LT | QIAGEN | 85600 | bead beater |
| TissueLyser LT Adapter, 12-Tube | QIAGEN | 69980 | |
| Tissue-Tek Cryomold | Sakura | 4566 | specimen molds |
| Triton X-100 | Alfa Aesar | A16046 | |
| TRIzol Reagent | ThermoFisher Scientific | 15596026 | guanidium thiocyanate |
| Tween20 (500 mL) | Fisher BioReagents | BP337-500 | |
| VWR Micro Slides - Superfrost Plus | VWR | 48311703 | |
| Wheaton Coplin staining jars | Millipore Sigma | S6016 | Coplin jar |
Riferimenti
- Milad, N., et al. Increased plasma lipid levels exacerbate muscle pathology in the mdx mouse model of Duchenne muscular dystrophy. Skeletal Muscle. 7 (1), 19 (2017).
- Goodpaster, B. H., et al. Obesity, regional body fat distribution, and the metabolic syndrome in older men and women. Archives of Internal Medicine. 165 (7), 777-783 (2005).
- Goodpaster, B. H., et al. Association between regional adipose tissue distribution and both type 2 diabetes and impaired glucose tolerance in elderly men and women. Diabetes Care. 26 (2), 372-379 (2003).
- Goodpaster, B. H., et al. The loss of skeletal muscle strength, mass, and quality in older adults: the health, aging and body composition study. The Journals of Gerontology, Series A: Biological Sciences and Medical Sciences. 61 (10), 1059-1064 (2006).
- Goodpaster, B. H., Thaete, F. L., Kelley, D. E. Thigh adipose tissue distribution is associated with insulin resistance in obesity and in type 2 diabetes mellitus. American Journal of Clinical Nutrition. 71 (4), 885-892 (2000).
- Goodpaster, B. H., Theriault, R., Watkins, S. C., Kelley, D. E. Intramuscular lipid content is increased in obesity and decreased by weight loss. Metabolism. 49 (4), 467-472 (2000).
- Burakiewicz, J., et al. Quantifying fat replacement of muscle by quantitative MRI in muscular dystrophy. Journal of Neurology. 264 (10), 2053-2067 (2017).
- Murphy, W. A., Totty, W. G., Carroll, J. E. MRI of normal and pathologic skeletal muscle. American Journal of Roentgenology. 146 (3), 565-574 (1986).
- Willcocks, R. J., et al. Multicenter prospective longitudinal study of magnetic resonance biomarkers in a large duchenne muscular dystrophy cohort. Annals of Neurology. 79 (4), 535-547 (2016).
- Wokke, B. H., et al. Quantitative MRI and strength measurements in the assessment of muscle quality in Duchenne muscular dystrophy. Neuromuscular Disorders. 24 (5), 409-416 (2014).
- Contreras, O., Rossi, F. M. V., Theret, M. Origins, potency, and heterogeneity of skeletal muscle fibro-adipogenic progenitors-time for new definitions. Skeletal Muscle. 11 (1), 16 (2021).
- El Agha, E., et al. Mesenchymal stem cells in fibrotic disease. Cell Stem Cell. 21 (2), 166-177 (2017).
- Joe, A. W., et al. Muscle injury activates resident fibro/adipogenic progenitors that facilitate myogenesis. Nature Cell Biology. 12 (2), 153-163 (2010).
- Liu, W., Liu, Y., Lai, X., Kuang, S. Intramuscular adipose is derived from a non-Pax3 lineage and required for efficient regeneration of skeletal muscles. Developmental Biology. 361 (1), 27-38 (2012).
- Scott, R. W., Arostegui, M., Schweitzer, R., Rossi, F. M. V., Underhill, T. M. Hic1 defines quiescent mesenchymal progenitor subpopulations with distinct functions and fates in skeletal muscle regeneration. Cell Stem Cell. 25 (6), 797-813 (2019).
- Uezumi, A., et al. Fibrosis and adipogenesis originate from a common mesenchymal progenitor in skeletal muscle. Journal of Cell Science. 124, 3654-3664 (2011).
- Hogarth, M. W., et al. Fibroadipogenic progenitors are responsible for muscle loss in limb girdle muscular dystrophy 2B. Nature Communications. 10 (1), 2430 (2019).
- Uezumi, A., Fukada, S., Yamamoto, N., Takeda, S., Tsuchida, K. Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle. Nature Cell Biology. 12 (2), 143-152 (2010).
- Stumm, J., et al. Odd skipped-related 1 (Osr1) identifies muscle-interstitial fibro-adipogenic progenitors (FAPs) activated by acute injury. Stem Cell Research. 32, 8-16 (2018).
- Kopinke, D., Roberson, E. C., Reiter, J. F. Ciliary Hedgehog signaling restricts injury-induced adipogenesis. Cell. 170 (2), 340-351 (2017).
- Huang, Y., Das, A. K., Yang, Q. Y., Zhu, M. J., Du, M. Zfp423 promotes adipogenic differentiation of bovine stromal vascular cells. PLoS One. 7 (10), 47496 (2012).
- Sun, Y. -. M., et al. PDGFRα regulated by miR-34a and FoxO1 promotes adipogenesis in porcine intramuscular preadipocytes through Erk signaling pathway. International Journal of Molecular Sciences. 18 (11), 2424 (2017).
- Te, L. J. I., Doherty, C., Correa, J., Batt, J. Identification, isolation, and characterization of fibro-adipogenic progenitors (FAPs) and myogenic progenitors (MPs) in skeletal muscle in the rat. Journal of Visualized Experiments: JoVE. (172), e61750 (2021).
- Lukjanenko, L., et al. Aging disrupts muscle stem cell function by impairing matricellular WISP1 secretion from fibro-adipogenic progenitors. Cell Stem Cell. 24 (3), 433-446 (2019).
- Santini, M. P., et al. Tissue-resident PDGFRalpha(+) progenitor cells contribute to fibrosis versus healing in a context- and spatiotemporally dependent manner. Cell Reports. 30 (2), 555-570 (2020).
- Uezumi, A., et al. Identification and characterization of PDGFRalpha+ mesenchymal progenitors in human skeletal muscle. Cell Death & Disease. 5, 1186 (2014).
- Wosczyna, M. N., et al. Mesenchymal stromal cells are required for regeneration and homeostatic maintenance of skeletal muscle. Cell Reports. 27 (7), 2029-2035 (2019).
- Soliman, H., et al. Pathogenic potential of Hic1-expressing cardiac stromal progenitors. Cell Stem Cell. 26 (2), 205-220 (2020).
- Chung, M. I., Bujnis, M., Barkauskas, C. E., Kobayashi, Y., Hogan, B. L. M. Niche-mediated BMP/SMAD signaling regulates lung alveolar stem cell proliferation and differentiation. Development. 145 (9), (2018).
- Hilgendorf, K. I., et al. Omega-3 fatty acids activate ciliary FFAR4 to control adipogenesis. Cell. 179 (6), 1289-1305 (2019).
- Waisman, A., Norris, A. M., Elías Costa, M., Kopinke, D. Automatic and unbiased segmentation and quantification of myofibers in skeletal muscle. Scientific Reports. 11 (1), 11793 (2021).
- Kang, S. H., Fukaya, M., Yang, J. K., Rothstein, J. D., Bergles, D. E. NG2+ CNS glial progenitors remain committed to the oligodendrocyte lineage in postnatal life and following neurodegeneration. Neuron. 68 (4), 668-681 (2010).
- Srinivas, S., et al. Cre reporter strains produced by targeted insertion of EYFP and ECFP into the ROSA26 locus. BMC Developmental Biology. 1, 4 (2001).
- Lukjanenko, L., Brachat, S., Pierrel, E., Lach-Trifilieff, E., Feige, J. N. Genomic profiling reveals that transient adipogenic activation is a hallmark of mouse models of skeletal muscle regeneration. PLoS One. 8 (8), 71084 (2013).
- Mahdy, M. A., Lei, H. Y., Wakamatsu, J., Hosaka, Y. Z., Nishimura, T. Comparative study of muscle regeneration following cardiotoxin and glycerol injury. Annals of Anatomy = Anatomischer Anzeiger: Official Organ of the Anatomische Gesellscaft. 202, 18-27 (2015).
- Pisani, D. F., Bottema, C. D., Butori, C., Dani, C., Dechesne, C. A. Mouse model of skeletal muscle adiposity: a glycerol treatment approach. Biochemical and Biophysical Research Communications. 396 (3), 767-773 (2010).
- Kawai, H., et al. Experimental glycerol myopathy: a histological study. Acta Neuropathologica. 80 (2), 192-197 (1990).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative CT method. Nature Protocols. 3 (6), 1101-1108 (2008).
- Uezumi, A., et al. Mesenchymal Bmp3b expression maintains skeletal muscle integrity and decreases in age-related sarcopenia. The Journal of Clinical Investigation. 131 (1), 139617 (2021).
- Biferali, B., et al. Prdm16-mediated H3K9 methylation controls fibro-adipogenic progenitors identity during skeletal muscle repair. Science Advances. 7 (23), 9371 (2021).
- Biltz, N. K., Meyer, G. A. A novel method for the quantification of fatty infiltration in skeletal muscle. Skeletal Muscle. 7 (1), (2017).
- Vieites-Prado, A., Renier, N. Tissue clearing and 3D imaging in developmental biology. Development. 148 (18), (2021).
- Gómez-Gaviro, M. V., Sanderson, D., Ripoll, J., Desco, M. Biomedical applications of tissue clearing and three-dimensional imaging in health and disease. iScience. 23 (8), 101432 (2020).
- Ueda, H. R., et al. Tissue clearing and its applications in neuroscience. Nature Reviews Neuroscience. 21 (2), 61-79 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon