Method Article
Ein Leitfaden zur Untersuchung der intramuskulären Fettbildung und ihres zellulären Ursprungs in der Skelettmuskulatur
In diesem Artikel
Zusammenfassung
Der Ersatz von gesundem Muskelgewebe durch intramuskuläres Fett ist ein herausragendes Merkmal menschlicher Krankheiten und Zustände. Dieses Protokoll beschreibt, wie intramuskuläres Fett visualisiert, abgebildet und quantifiziert werden kann, und ermöglicht die rigorose Untersuchung der Mechanismen, die der intramuskulären Fettbildung zugrunde liegen.
Zusammenfassung
Fibro-adipogene Vorläuferzellen (FAPs) sind mesenchymale Stromazellen, die eine entscheidende Rolle bei der Homöostase und Regeneration der Skelettmuskulatur spielen. FAPs bauen und erhalten die extrazelluläre Matrix, die als molekulares Myofasergerüst fungiert. Darüber hinaus sind FAPs für die Myofaserregeneration unverzichtbar, da sie eine Vielzahl von positiven Faktoren absondern, die von den Muskelstammzellen (MuSCs) wahrgenommen werden. In erkrankten Zuständen sind FAPs jedoch der zelluläre Ursprung von intramuskulärem Fett und fibrotischem Narbengewebe. Diese Fettfibrose ist ein Kennzeichen von Sarkopenie und neuromuskulären Erkrankungen wie der Duchenne-Muskeldystrophie. Eine wesentliche Barriere bei der Bestimmung, warum und wie sich FAPs in intramuskuläres Fett differenzieren, ist die effektive Konservierung und anschließende Visualisierung von Adipozyten, insbesondere in gefrorenen Gewebeschnitten. Herkömmliche Methoden der Skelettmuskelgewebeverarbeitung, wie das Einfrieren von Schnappschüssen, bewahren die Morphologie einzelner Adipozyten nicht richtig und verhindern so eine genaue Visualisierung und Quantifizierung. Um diese Hürde zu überwinden, wurde ein strenges Protokoll entwickelt, das die Adipozytenmorphologie in Skelettmuskelabschnitten bewahrt und die Visualisierung, Bildgebung und Quantifizierung von intramuskulärem Fett ermöglicht. Das Protokoll beschreibt auch, wie ein Teil des Muskelgewebes für RT-qPCR verarbeitet werden kann, so dass Benutzer beobachtete Veränderungen in der Fettbildung bestätigen können, indem sie Unterschiede in der Expression adipogener Gene betrachten. Darüber hinaus kann es angepasst werden, um Adipozyten durch Ganzkörper-Immunfluoreszenz von Muskelproben sichtbar zu machen. Schließlich beschreibt dieses Protokoll, wie eine genetische Abstammungsverfolgung von Pdgfrα-exprimierenden FAPs durchgeführt werden kann, um die adipogene Umwandlung von FAPs zu untersuchen. Dieses Protokoll liefert konsistent hochauflösende und morphologisch genaue immunfluoreszierende Bilder von Adipozyten zusammen mit der Bestätigung durch RT-qPCR, was eine robuste, rigorose und reproduzierbare Visualisierung und Quantifizierung von intramuskulärem Fett ermöglicht. Zusammen ist die hier beschriebene Analysepipeline der erste Schritt, um unser Verständnis dafür zu verbessern, wie sich FAPs in intramuskuläres Fett differenzieren, und bietet einen Rahmen für die Validierung neuartiger Interventionen zur Verhinderung der Fettbildung.
Einleitung
Die Infiltration von gesundem Muskelgewebe mit Fettfibrose ist ein herausragendes Merkmal der Duchenne-Muskeldystrophie (DMD) und anderer neuromuskulärer Erkrankungen sowie Sarkopenie, Fettleibigkeit und Diabetes 1,2,3,4,5,6,7,8,9,10 . Obwohl eine erhöhte Fettinfiltration unter diesen Bedingungen stark mit einer verminderten Muskelfunktion verbunden ist, ist unser Wissen darüber, warum und wie sich intramuskuläres Fett bildet, immer noch begrenzt. FAPs sind eine multipotente mesenchymale Stromazellpopulation, die in den meisten erwachsenen Organen, einschließlich der Skelettmuskulatur,11,12 vorkommt. Mit zunehmendem Alter und bei chronischen Erkrankungen produzieren FAPs jedoch fibrotisches Narbengewebe und differenzieren sich in Adipozyten, die sich zwischen einzelnen Myofasern befinden und intramuskuläres Fett 13,14,15,16,17,18,19,20 bilden.
Um die intramuskuläre Fettbildung zu bekämpfen, müssen die Mechanismen definiert werden, wie FAPs zu Adipozyten werden. PDGFRα ist der "Goldstandard" -Marker im Feld, um FAPs innerhalb des Muskels mehrerer Arten 13,16,17,18,20,21,22,23,24,25,26,27 zu identifizieren. Infolgedessen wurden mehrere murine Tamoxifen-induzierbare Cre-Linien unter der Kontrolle des Pdgfrα-Promotors erzeugt, die eine genetische Manipulation von FAPs in vivo mit dem Cre-LoxP-System27,28,29 ermöglichen. Zum Beispiel kann durch die Kombination dieser induzierbaren Cre-Linie mit einem genetischen Reporter eine Linienverfolgung von FAPs durchgeführt werden, eine Strategie, die wir erfolgreich angewendet haben, um FAPs in Muskeln und weißem Fettgewebe abzubilden20,30. Neben der Linienverfolgung bieten diese Cre-Linien wertvolle Werkzeuge, um die FAP-zu-Fett-Umwandlung zu untersuchen.
Ein großes Hindernis bei der Definition des Mechanismus der adipogenen Umwandlung von FAPs in intramuskuläres Fett ist die Fähigkeit, die Menge an intramuskulärem Fett, die sich unter verschiedenen Bedingungen gebildet hat, rigoros und reproduzierbar zu quantifizieren. Der Schlüssel liegt darin, die Erhaltung von Muskel- und Fettgewebe auszugleichen und dies mit den verfügbaren Färbemethoden zur Visualisierung von Adipozyten abzustimmen. Zum Beispiel wird die Skelettmuskulatur oft ohne vorherige Fixierung eingefroren, wodurch Myofasern erhalten bleiben, aber die Morphologie der Adipozyten gestört wird (Abbildung 1). Im Gegensatz dazu entfernt die Fixierung gefolgt von der Paraffineinbettung, während die beste Gewebehistologie, einschließlich der Adipozyten, gezeigt wird, alle Lipide, wodurch die meisten lipophilen Farbstoffe, wie der häufig verwendete Farbstoff Oil Red O, unbrauchbar werden.
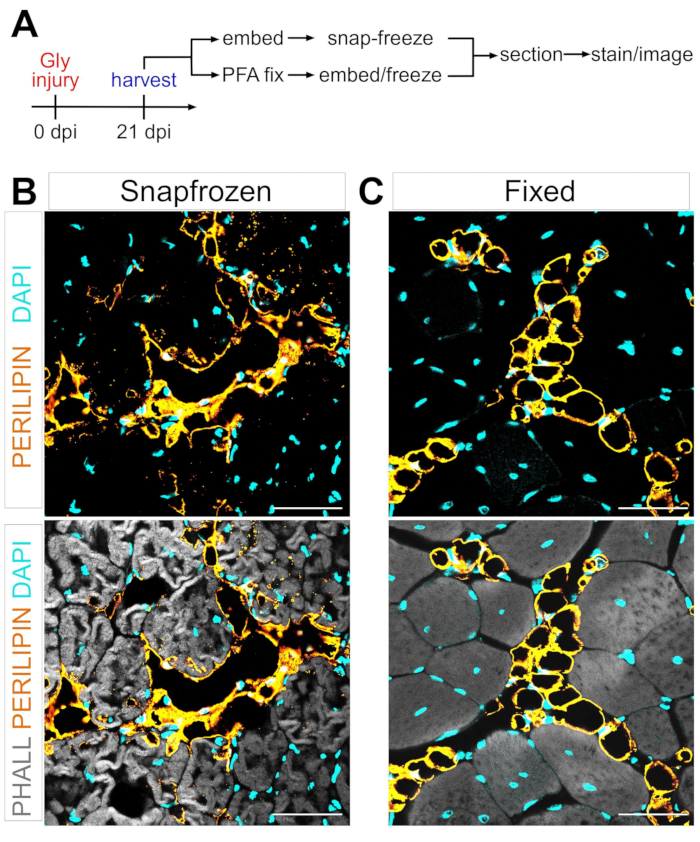
Abbildung 1: Repräsentative Bilder von intramuskulärem Fett in Snap-Frozen versus festsitzendem Muskelgewebe . (A) Schematische Übersicht über den Versuchsaufbau. Immunfluoreszierende Bilder, die Adipozyten (gelb), Myofasern (grau) und Kerne (Cyan) sowohl innerhalb von (B) schockgefrorenen als auch (C) fixierten TAs 21 Tage nach der Glycerinverletzung zeigen. Maßstabsstäbe: 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Das hier beschriebene Protokoll bewahrt die Myofaser- und Adipozytenmorphologie und ermöglicht die Visualisierung und Analyse mehrerer Zelltypen. Dieser Ansatz basiert auf der Immunfluoreszenzfärbung von Adipozyten in paraformaldehyd (PFA)-fixiertem Muskelgewebe, die eine Co-Färbung mit mehreren Antikörpern ermöglicht. Es kann auch leicht angepasst werden, um intramuskuläres Fett in intaktem Gewebe mittels Ganzkörper-Bildgebung räumlich darzustellen und so Informationen über die zelluläre Mikroumgebung von Fett im Muskel zu liefern. Darüber hinaus kann dieses Protokoll mit unserem kürzlich veröffentlichten Ansatz zur Bestimmung der Querschnittsfläche von Myofasern in festsitzendem Muskelgewebe31 kombiniert werden, einer wichtigen Messung zur Beurteilung der Muskelgesundheit. Die Kombination dieses Ansatzes mit der genetischen Abstammungsverfolgung, um die Differenzierung von FAPs in Adipozyten zu kartieren, wird hier ebenfalls beschrieben. Somit ermöglicht das hier beschriebene vielseitige Protokoll eine rigorose und reproduzierbare Beurteilung von FAPs und deren Differenzierung in intramuskuläres Fett in Gewebeschnitten und intakten Geweben.
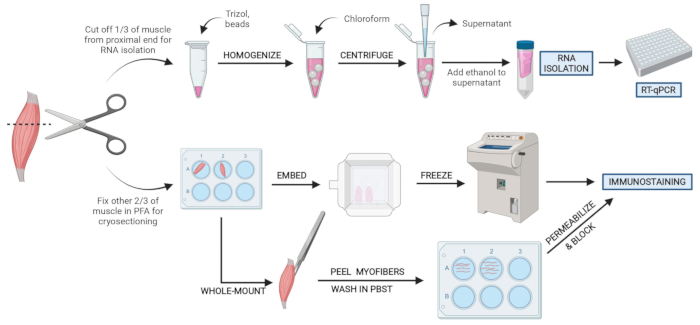
Abbildung 2: Übersicht über das schematische Protokoll Schematische Übersicht der Gewebeverarbeitung, bei der ein Drittel der TA entnommen, schockgefroren und für die anschließende RNA-Isolierung und Transkriptionsanalyse mittels RT-qPCR homogenisiert wird. Die anderen zwei Drittel der TA sind PFA-fixiert und werden zur Immunfärbung auf gefrorenen Abschnitten oder Whole-Mount-Fasern verarbeitet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Protokoll
Alle Tierprotokolle wurden vom Institutional Animal Care and Use Committee (IACUC) der University of Florida genehmigt.
1. Genetische Abstammungsverfolgung von FAPs
HINWEIS: Wenn die genetische Abstammungsverfolgung von FAPs nicht erwünscht ist, kann Schritt 1 übersprungen werden.
- Um die Abstammungsverfolgung von FAPs durchzuführen, erhalten Sie die erforderlichen Mausallele.
HINWEIS: Mehrere Tamoxifen-induzierbare Cre-Linien unter der Kontrolle des Pdgfrα-Promotors wurden generiert, um FAPs erfolgreich anzugreifen, darunter aus den Labors Hogan29, Rando27 und Bergles32. Als genetischer Reporter der Cre-Aktivität stehen zahlreiche Rosa26-Reporter-Allele wie Rosa26EYFP33 zur Verfügung. Während es für jedes Labor vorgeschlagen wird, zu bestimmen, welche Cre-Reporter-Kombination am effektivsten ist, durch Kreuzung von Pdgfrα CreERT2-Mäusen (29 und Jax # 032770) mit dem Rosa26EYFP (33 und Jax # 006148) Reporter, dem resultierenden PdgfrαCreERT2; Rosa26EYFP-Mäusekönnen verwendet werden, um FAPs20 effizient und spezifisch zu markieren. Um das Schicksal reifer FAPs zu verfolgen, wird empfohlen, zu warten, bis die Mäuse mindestens ~ 10 Wochen alt sind, bevor sie Tamoxifen verabreichen. Linienverfolgungsexperimente können sowohl an Männern als auch an Frauen durchgeführt werden. - Tamoxifen-Verabreichung durch orale Gavaging
- Bereiten Sie 40 mg / ml Tamoxifen in Maisöl und Vortex gut zu, um 1 Tag vor dem Gavieren zu mischen. Inkubieren Sie O/N bei 37 °C in einem rotierenden Hybridisierungsofen.
ACHTUNG: Tamoxifen ist ein Karzinogen und sollte vorsichtig behandelt werden. Tragen Sie beim Handling immer Handschuhe und tragen Sie beim Wiegen als Pulver eine Maske, da die Gefahr des Einatmens besteht. - Reinigen Sie den Bereich gemäß Protokoll und befestigen Sie eine Gavging-Nadel an einer 1-ml-Spritze. Ziehen Sie 200 μL Tamoxifen in die Spritze.
- Scruff PdgfrαCreERT2 ; Rosa26EYFP Mäuse (10 Wochen alt; beide Geschlechter verwendet), indem sie sie auf eine ebene Oberfläche legen und die Basis des Schwanzes fest greifen. Mit einer freien Hand die Mitte der Maus mit Daumen und Zeigefinger greifen, dann sanft und mit leichtem Druck den Griff bis knapp an den Schultern vorbei schieben.
- Kneifen Sie die Haut mit Daumen und Zeigefinger zurück, nehmen Sie die Maus und drehen Sie die Hand, so dass die Maus dem Benutzer zugewandt ist, und stecken Sie den Schwanz zwischen den kleinen und den Ringfinger der Hand, die die Maus hält.
- Stellen Sie an dieser Stelle sicher, dass die Maus gut immobilisiert ist und ihren Kopf oder ihre Arme nicht bewegen kann. Führen Sie die Gavging-Nadel in den Mund ein und neigen Sie damit den Kopf der Maus leicht nach hinten. Dadurch ist die Speiseröhre besser zugänglich.
- Führen Sie die Nadel vorsichtig und langsam in die Speiseröhre ein. Erzwingen Sie die Nadel nicht, wenn ein Widerstand auftritt; Die Nadel sollte leicht nach unten gleiten. Injizieren Sie langsam das Tamoxifen. Überwachen Sie die Mäuse für 15-20 Minuten, um sicherzustellen, dass beim Gavieren keine Probleme auftreten.
HINWEIS: Die Verabreichung von Tamoxifen an 2 aufeinanderfolgenden Tagen führt typischerweise zu einer Rekombinationseffizienz von FAPs von ~ 75% -85%, ohne dass Nebenwirkungen auftreten. Es wird empfohlen, dass der Benutzer 1-2 Wochen wartet, bevor er eine Verletzung auslöst, wodurch das verbleibende Tamoxifen aus dem System entfernt und das verbleibende Protein umgedreht werden kann.
- Bereiten Sie 40 mg / ml Tamoxifen in Maisöl und Vortex gut zu, um 1 Tag vor dem Gavieren zu mischen. Inkubieren Sie O/N bei 37 °C in einem rotierenden Hybridisierungsofen.
2. Verletzung des Musculus tibialis anterior (TA)
HINWEIS: Um intramuskuläres Fett zu untersuchen, wird empfohlen, ein Glycerin-basiertes Verletzungsmodell (50% Glycerin in steriler Kochsalzlösung) zu verwenden, was zu einer massiven intramuskulären Fettbildungführt 34,35,36,37.
- Bereiten Sie die Anästhesiemaschine vor, indem Sie Isofluran hinzufügen und sicherstellen, dass die Schläuche sowohl an der Mauskammer als auch am Nasenkegel offen sind. Reinigen Sie die Kammer und den Arbeitsbereich entweder mit 70% Ethanol oder Peroxidlösung (abhängig von den Protokollen).
- Stellen Sie den Sauerstoffdurchfluss auf 2,5 l/min und die Isoflurankonzentration auf 2,5% ein. Legen Sie eine Maus in die Anästhesiekammer und warten Sie ~ 5 Minuten, bis sie betäubt wird.
- Legen Sie die Maus in Rückenlage auf ein sauberes Heizkissen und führen Sie die Nase in den Nasenkegel ein. Tragen Sie die tierärztliche Augensalbe vorsichtig mit einem Applikator mit Baumwollspitze auf die Augen auf, um Trockenheit während der Narkose zu verhindern. Überwachen Sie kontinuierlich die Anästhesie und führen Sie vor der Verletzung eine Zehenklemme an der Maus durch, um sicherzustellen, dass die Maus vollständig betäubt wird.
- Reinigen Sie das zu injizierende Bein mit einem frischen Alkoholtuch, um es zu desinfizieren.
- Ziehen Sie 30-50 μL 50% Glycerin (abhängig von der Größe der Mäuse) in die Insulinspritze. Bürsten Sie vorsichtig die Haare am Schienbein auf, um die Position der TA freizulegen.
HINWEIS: Es ist einfacher, das Haar zu bewegen und eine bessere Visualisierung zu erreichen, wenn es noch nass vom Alkoholtuch ist. - Nachdem Sie die TA lokalisiert haben (nur seitlich zur Tibia, sie ragt leicht durch die Haut und kann mit sanfter Palpation gefühlt werden), führen Sie die Nadel in die TA distal in der Nähe des Knöchels ein. Führen Sie die Nadel vollständig in den Muskel ein und injizieren Sie langsam Glycerin, während Sie die Nadel allmählich zurückziehen, was dazu beiträgt, den größten Teil des Muskels zu verletzen.
HINWEIS: Es ist am besten, die Nadel parallel zum Bein einzuführen, mit nur einem leicht erhöhten Winkel. Eine gute Verletzung verursacht typischerweise Dorsalflexion, da sich die TA nach dem Zurückziehen der Nadel zusammenzieht. Wenn sich die Zehen der Maus ausbreiten, ist es wahrscheinlich, dass der Musculus extensor digitorum longus (EDL) injiziert wurde. - Legen Sie die Maus zurück in den Käfig und überwachen Sie sie für ca. 15-20 Minuten, um die Erholung der Anästhesie sicherzustellen.
- Entsorgen Sie die Nadel in einem Behälter für scharfe Gegenstände. Fassen Sie niemals eine Nadel zusammen.
HINWEIS: Die Analgesie-Postglycerin-Injektion sollte gemäß der Genehmigung des Institutional Animal Care and Use Committee erfolgen. Adipozyten können bereits 5 Tage nach der Verletzung (dpi) beobachtet werden. Mit 7 dpi haben sich alle Adipozyten gebildet, und um 21 dpi sind sie vollständig gereift.
3. Gewebeentnahme
- Bereiten Sie 4% PFA in 1x PBS zu und legen Sie es vor Beginn der Ernte auf Eis.
- Legen Sie alle Platten (12- oder 24-Well), die für die Muskelfixierung verwendet werden, auf Eis und fügen Sie jedem Brunnen 4% PFA hinzu, wobei Sie sicherstellen, dass jeder Brunnen 10-20-mal mehr PFA-Volumen aufweist als das zu fixierende Gewebe.
- Zwischen 7 und 21 Tagen nach der Glycerinverletzung die Maus gemäß den institutionellen Richtlinien einschläfern (d. H. Isofluran-Überdosierung gefolgt von Zervixdislokation).
- Beginnen Sie mit der Ernte von Geweben, die für die Histologie oder RNA-Isolierung verwendet werden sollen.
HINWEIS: Gewebe sollten innerhalb von 10-15 Minuten nach dem Opfern eingefroren oder in PFA gelegt werden (Abbildung 2). - Besprühen Sie großzügig alle Bereiche der Maus, in die geschnitten werden soll, mit 70% Ethanol, um das Haar von Sezierbereichen und Instrumenten fernzuhalten.
- Verwenden Sie eine Schere, um die Haut um die Oberseite des Beins in der Nähe des Beckens zu schneiden (Abbildung 3A).
- Ziehen Sie die Haut des Beines vorsichtig von oben bis zum Knöchel (Abbildung 3B).
HINWEIS: Der TA ist ein tropfenförmiger Muskel mit einer klar definierten distalen Sehne, die an der medialen Keilschrift und dem ersten Mittelfußknochen befestigt ist. Es ist seitlich zur Tibia und erstreckt sich bis zum unteren Knie. - Entfernen Sie zunächst die äußere Bindegewebsschicht (Epimysium) mit einer Pinzette mit scharfer Spitzspitze, bevor Sie die TA ernten (Abbildung 3C). Verwenden Sie ein Seziermikroskop, um das Epimysium besser sichtbar zu machen.
- Schieben Sie die Pinzette von der Unterseite des Muskels unter die TA, beginnend an der distalen Sehne, und ziehen Sie sie vorsichtig nach oben in Richtung Knie (Abbildung 3D). Stoppen Sie am Ende des Muskels; Drücken Sie nicht an dem Widerstand vorbei, der am unteren Knie zu spüren ist.
- Wenn es einen signifikanten Widerstand gibt, bevor Sie das untere Knie erreichen, stoppen Sie und entfernen Sie die verbleibenden Bindegewebeschichten.
HINWEIS: Es gibt eine weitere distale Sehne direkt seitlich an der TA-Sehne, die an der EDL befestigt ist, die ein schlanker Muskel seitlich zum TA ist. Wenn Sie darauf achten, die Pinzette nur unter die TA-Sehne zu schieben, wird eine versehentliche Ernte der EDL verhindert, sie kann aber auch nach der Fixierung leicht entfernt werden. - Sobald der TA teilweise mit der Pinzette vom Bein angehoben wurde, verwenden Sie die gleiche Bewegung mit einem Skalpell, um die Verbindung des TA zum unteren Knie zu trennen (Abbildung 3E). Schneiden Sie die Sehne am Knöchel mit einer Schere ab, um die TA vollständig zu entfernen. Behandeln Sie nur den Muskel an der Sehne, um eine Beschädigung der Fasern zu vermeiden.
- Schneiden Sie 1/3 der TA am Ende gegenüber der Sehne (Abbildung 3F), legen Sie sie in ein Mikrozentrifugenröhrchen und frieren Sie sie ein, indem Sie sie in flüssigen Stickstoff fallen lassen (Abbildung 3H).
- Tauchen Sie die anderen 2/3 des Gewebes in einen markierten Brunnen mit 4% PFA für die Histologie (Abbildung 3I). Achten Sie darauf, zu verfolgen, wann das erste und letzte Gewebe in Fixiermittel gegeben wurde. Auf einen Shaker für 2-2,5 h bei 4 °C legen.
- Die Dauer der Fixierung ist abhängig vom Gewebe und seiner Größe. Bestimmen Sie die Dauer, die für die Fixierung des Gewebes erforderlich ist. Die Fixierung von TAs für 2-2,5 h bei 4 ° C bewahrt typischerweise die Adipozytenmorphologie gut, ohne eine Überfixierung des Gewebes zu verursachen.
HINWEIS: Wenn Sie planen, TA für die Immunfluoreszenzfärbung im ganzen Montierungsbereich zu verwenden, überspringen Sie den Rest dieses Protokolls, bis Sie Abschnitt 7: "Whole Mount Immunofluorescent Staining" erreichen. - Entfernen Sie nach der Fixierung PFA aus den Vertiefungen, spülen Sie das Gewebe 2-3 Mal mit kaltem 1x PBS aus und waschen Sie es dann 2-3 Mal mit kaltem 1x PBS für 5 Minuten pro Waschgang.
- Entfernen Sie das PBS aus den Vertiefungen und fügen Sie genügend 30% Saccharose in 1x PBS hinzu, damit das Gewebe schwimmen kann. Über Nacht bei 4 °C auf den Shaker legen.
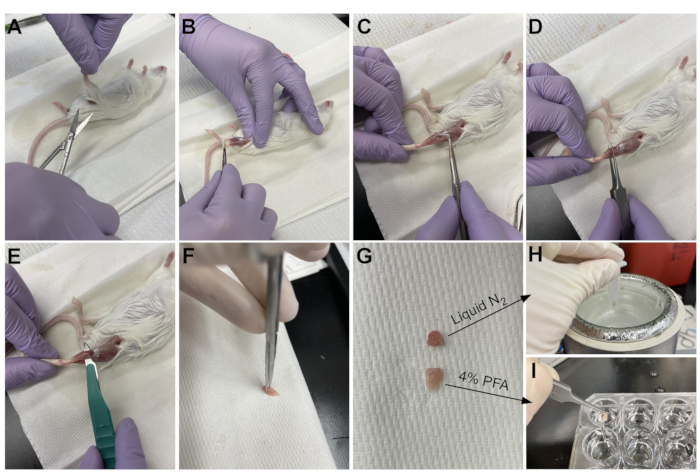
Abbildung 3: Zusammenfassung der Gewebeernte. (A) Die Haut wird an der Basis des Beines geschnitten und (B) die Hinterbeingriffsmuskulatur ist freigelegt. (C) Sobald das Epimysium aus der TA entfernt wurde, (D) werden Pinzetten verwendet, um den Muskel teilweise zu trennen und sicherzustellen, dass das Epimysium vollständig entfernt wurde. (E) Der TA wird mit einem Skalpell vom Bein geschnitten und nach dem Durchtrennen der Sehne entfernt. (G) Nach dem Schneiden der TA in ein Drittel und ein Zweidrittelstück wird (H) ein Drittel in flüssigem Stickstoff für die RT-qPCR-Analyse eingefroren und (I) das andere Drittel wird in 4% PFA für die Histologie fixiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
4. Einbettung
- Bereiten Sie die für die Einbettung zu verwendenden Musterformen vor, indem Sie sie beschriften und mit genügend Einbettungsmedium füllen, um das Gewebe vollständig zu tauchen.
- Entfernen Sie Gewebe aus den Vertiefungen, trocknen Sie überschüssige Saccharose auf einem Papiertuch ab und gehen Sie zu den gefrierenden, mit Medium gefüllten Probenformen.
HINWEIS: Es ist hilfreich zu wissen, in welcher Ausrichtung die Form auf dem Kryostaten geschnitten werden soll. Auf diese Weise kann der Benutzer das Gewebe in der Form so ausrichten, dass der Interessenbereich leicht zugänglich ist. Für die TA würde dies erreicht, indem das dickste Ende (gegenüber der Sehnenseite) der Oberfläche zugewandt wird, die geschnitten wird. Dadurch kann die TA an ihrer dicksten Stelle (Bauch) leicht geschnitten werden und ermöglicht das Querschnittsschneiden der Muskelfasern. - Bereiten Sie eine Isopentan-Aufschlämmung vor, indem Sie einen Behälter, der Isopentan enthält, teilweise in flüssigen Stickstoff tauchen. Stellen Sie sicher, dass sich genügend flüssiges Isopentan im Behälter befindet, um etwa die Hälfte der Probenform zu tauchen, die zum Einbetten der Gewebe verwendet werden soll.
- Beginnen Sie mit dem Einfrieren der Formen, indem Sie sie vorsichtig in die Isopentanaufschlämmung geben und sicherstellen, dass etwa die Hälfte der Form untergetaucht ist. Stellen Sie außerdem sicher, dass die Form von allen vier Seiten gleichmäßig gefriert.
- Nehmen Sie die Form aus dem Isopentan, kurz bevor die gesamte Form sichtbar von oben eingefroren ist. Wie lange dies dauert, hängt von den verwendeten Formen ab.
- Bewahren Sie die gefrorenen Formen in einem Behälter mit Trockeneis auf, während Sie die restlichen Blöcke einfrieren, und lagern Sie sie dann bei -80 ° C.
HINWEIS: Isopentan zum Einfrieren kann wiederverwendet werden. In eine Glasflasche geben, aber den Deckel nicht festziehen, bis Isopentan Raumtemperatur (RT) erreicht hat. Andernfalls könnte die Druckänderung die Flasche zerbrechen.
5. Schneiden
- Stellen Sie den Kryostaten auf -22 bis -24 ° C ein, fügen Sie Formen mit TAs in den Kryostaten hinzu und warten Sie mindestens 30 Minuten auf die Temperaturakklimatisierung. Beschriften Sie in der Zwischenzeit eine Reihe von positiv geladenen Objektträgern.
- Setzen Sie eine Anti-Roll-Platte ein und richten Sie sie an der Kryostat so aus, dass sich in der Platte nur minimale Kerben befinden, an denen sie mit dem Probenblock in Kontakt kommt. Sicher an Ort und Stelle.
- Setzen Sie eine frische Kryostat-Klinge in den Klingenhalter ein und befestigen Sie sie.
ACHTUNG: Die Klinge ist scharf. Decken Sie die Klinge ab, wenn Sie andere Teile des Kryostaten oder gefrorene Formen bearbeiten. - Entfernen Sie den eingefrorenen Block aus der Form. Fügen Sie dem Kryostatenfutter eine gleichmäßige Schicht Einbettungsmedium hinzu und positionieren Sie den Block im Medium. Lassen Sie es 1-3 min ruhen, bis das Einbettmedium vollständig eingefroren ist (opak weiß).
HINWEIS: Bei TAs sollte der dickste Bereich (Bauch) sichtbar sein, wenn er sich auf dem Spannfutter befindet. - Legen Sie das Kryostatenfutter mit dem Gewebeblock in den Kryostaten. Decken Sie die Klinge auf und bewegen Sie den Kryostaten nach vorne, bis er gerade mit der Klinge in Berührung kommt. Schnitt durch den Block bei 25 μm Abschnitten, bis das Gewebe nicht mehr durch das Einbettungsmedium verdeckt wird.
HINWEIS: Stellen Sie während des Schneidens den Winkel des Kryostaten und / oder die Position des Tisches so ein, dass die Abschnitte eine gleichmäßige Dicke haben. Es kann hilfreich sein, einige Abschnitte zu sammeln, um eine gleichmäßige Abschnittsdicke zu gewährleisten. Es wird empfohlen, dass der Benutzer die richtige Stabilisatorposition vor dem Durchschneiden in den interessierenden Bereich innerhalb der TA (Bauch) findet, da dies dem Benutzer ermöglicht, mehrere Positionen der Stabilisatorplatte auszuprobieren, bis sich die Abschnitte gerade lösen, ohne Gewebe zu verschwenden. - Ändern Sie die Schnittdicke auf 10-12 μm und sammeln Sie die Abschnitte auf beschrifteten Objektträgern. Das serielle Schneiden wird empfohlen, indem benachbarte Abschnitte auf 6-10 Dias (mit 1-x beschriftet) gesammelt werden, wodurch mehrere Markierungen gefärbt werden können. Verwenden Sie bei Bedarf eine dünne Bürste, um Abschnitte zu entrollen, bevor Sie sie auf dem Dia sammeln.
HINWEIS: Wenn sich die Abschnitte kräuseln, überprüfen Sie, ob die Temperatur im Bereich von -22 bis -24 ° C konstant bleibt. Wenn es vertikale Streifen in Abschnitten gibt, könnte dies auf einen Riss in der Stabilisatorplatte oder der Klinge zurückzuführen sein; Dies kann durch Einstellen der Position der Stabilisatorplatte und/oder Umschalten auf eine neue Klinge behoben werden. - Nachdem Sie benachbarte Abschnitte derselben Schnittebene auf jedem Objektträger gesammelt haben, stellen Sie die Dicke auf 25 μm zurück, um 150-200 μm durch den Block zu bewegen, passen Sie dann die Dicke wieder auf 10-12 μm an und beginnen Sie erneut mit dem Schneiden.
HINWEIS: Dieser serielle Schnitt ermöglicht es dem Benutzer, in verschiedenen Tiefen durch den TA zu visualisieren, abzubilden und zu quantifizieren. Drei bis vier serielle Abschnitte pro Dia sind ausreichend. - Lagern Sie die Objektträger und Gewebeblöcke bei -80 °C.
6. Immunfluoreszierende (IF) Färbung von Gewebeschnitten
HINWEIS: Da die Antikörperkonzentrationen zwischen Chargen und Herstellern variieren können, wird eine Optimierung empfohlen, indem mehrere verschiedene Konzentrationen der Antikörper auf Testobjektträgern bewertet werden, bevor die Objektträger von Interesse gefärbt werden.
- Tau-/Trockenrutschen entweder bei RT oder auf einer warmen Platte bei 37 °C für 10-20 min.
- Verwenden Sie einen hydrophoben Stift, um eine Linie am Rand der Papieroberfläche des Objektträgers zu zeichnen, wo sie auf das Glas trifft.
- Legen Sie die Objektträger in ein Coplin-Glas und waschen Sie sie mit 1x PBS + 0,1% Tween20 (PBST) 3-5x auf einem Shaker für mindestens 5 Minuten pro Wäsche, um die Gewebeabschnitte zu rehydrieren.
HINWEIS: An dieser Stelle ist es wichtig, die Objektträger nicht sitzen zu lassen, ohne in PBST (bis zur hydrophoben Linie) eingetaucht zu sein, da sonst die Gewebeabschnitte austrocknen. - Legen Sie die Objektträger auf das Rack einer Befeuchtungskammer und überlagern Sie die Objektträger mit 310-350 μL Blockierlösung (5% Eselserum und 0,3% Triton X-100 in 1x PBS) für 1-2 h bei RT.
HINWEIS: Es ist kein zusätzlicher Permeabilisierungsschritt erforderlich, da die blockierende Lösung 0,3% Triton X-100 enthält, was eine ausreichende Permeabilisierung der Gewebeabschnitte ermöglicht. Bei der Verwendung von primären Antikörpern, die von Mäusen abgeleitet werden (d. h. PAX7 und MYOD1, die unten aufgeführt sind), wird empfohlen, einen Maus-auf-Maus-Blockierungsschritt mit Fab-Fragmenten (1:50) in die Blockierungslösung für den blockierenden Schritt aufzunehmen. Dies wird dazu beitragen, den Hintergrund aufgrund der unspezifischen Bindung des sekundären Mausantikörpers an andere Antikörper als den primären zu reduzieren. - Verdünnen Sie die primären Antikörper, die in der blockierenden Lösung verwendet werden sollen, kurz bevor Sie mit dem nächsten Schritt wie folgt fortfahren:
- Primäre Antikörper für die Adipozytenfärbung und die Bildgebung ganzer Abschnitte: Verdünntes Kaninchen-Anti-Perilipin bei einem Verdünnungsverhältnis von 1:1000.
- Primäre Antikörper für die Linienverfolgung von Adipozyten: Verdünnen Sie Hühner-Anti-GFP in einem Verhältnis von 1:1000 und Kaninchen-Anti-Perilipin bei 1:1000.
- Primäre Antikörper für die Linienverfolgung von FAPs: Verdünnen Sie Hühner-Anti-GFP in einem Verhältnis von 1:1000 und Ziegen-Anti-PDGFRα bei 1:250.
- Primäre Antikörper für myogene Marker: Verdünnen Sie Maus-Anti-PAX7 in einem Verhältnis von 1:25 oder Maus-Anti-MYOD1 bei 1:250 und Kaninchen-Anti-LAMININ bei 1:1000.
HINWEIS: Während die oben aufgeführten Antikörper mit diesem Protokoll erfolgreich bewertet wurden, ist es wahrscheinlich, dass andere Marker und Antikörper zur Kennzeichnung von FAPs, Adipozyten und / oder anderen Zelltypen ebenfalls mit diesem Protokoll kompatibel sind. Es wird dringend empfohlen, wenn primäre Antikörper zum ersten Mal verwendet werden, dass der Benutzer einen Negativkontrollobjektträger beifügt, in dem primäre Antikörper weggelassen werden. Dies wird die Spezifität der Antikörper kontrollieren. Alle anderen Schritte im Protokoll werden befolgt, einschließlich der Zugabe von sekundären Antikörpern, aber die blockierende Lösung wird im nächsten Schritt allein anstelle des primären Antikörpers in der blockierenden Lösung verwendet.
- Die blockierende Lösung wird von den Objektträgern abgeladen und mit 310-350 μL Blockierlösung mit primären Antikörpern überlagert und über Nacht bei 4 °C in der Befeuchtungskammer inkubiert.
- Am nächsten Tag entsorgen Sie die blockierende Lösung / die primären Antikörper von den Objektträgern und legen Sie sie in ein Coplin-Glas. Spülen Sie die Dias 2-3 mal mit PBST und waschen Sie 3-5x mit PBST auf einem Shaker für mindestens 5 min pro Waschgang.
- Bereiten Sie während der letzten Wäsche die sekundären Antikörper oder direkte Konjugate vor, die in der Blockierungslösung verwendet werden sollen. Minimieren Sie die Zeit, die diese Antikörper im Licht verbringen, um Photobleichen zu vermeiden.
- Verdünnte sekundäre Antikörper/direkte Konjugate: 488 nm Esel Anti-Huhn (1:1000) oder Anti-Kaninchen (1:1000) oder Anti-Maus (1:1000), 568 nm Esel Anti-Ziege (1:1000) oder Anti-Kaninchen (1:1000) oder Phalloidin (Myofasern; 1:100), DAPI-Fleck (Kerne; 1:500).
- Überlagern Sie die Objektträger mit 310-350 μL der blockierenden Lösung mit sekundären Antikörpern und/oder direkten Konjugaten in der Befeuchtungskammer. Inkubieren Sie bei RT für 1-2 h. Schützen Sie Proben von nun an vor Licht.
- Die blockierende Lösung/die sekundären Antikörper entsorgen und in ein Coplin-Glas geben. Einmal mit PBST abspülen und 3-5x mit PBST auf einem Shaker für mindestens 5 min pro Waschgang waschen. Halten Sie das Coplin-Glas bedeckt, um Lichteinwirkung zu vermeiden.
- Trocknen Sie die Objektträger so gut wie möglich, indem Sie auf die Kanten klopfen und den Rücken gegen ein Papiertuch wischen, aber lassen Sie die Gewebeteile nicht austrocknen.
- Fügen Sie drei oder vier Tropfen wässriges Montagemedium zum oberen horizontalen Rand des Objektträgers hinzu und fügen Sie vorsichtig ein Deckglas hinzu. Drücken Sie nicht nach unten oder bewegen Sie sich nicht, wenn sich unter dem Deckglas Luftblasen bilden; Jeder Druck oder jede Bewegung kann die fragile Zellarchitektur von Adipozyten verzerren.
- Lassen Sie das Montagemedium vor der Bildgebung über Nacht im Dunkeln aushärten.
7. Immunfluoreszenz-Färbung für die gesamte Montage
- Verwenden Sie nach ~ 1 h Fixierung (siehe Schritt 3.14) eine Pinzette mit scharfer Spitze, um Myofasern von der festen TA abzuziehen.
- Legen Sie die getrennten Fasern in eine 24-Well-Platte und waschen Sie 3x für jeweils 3 Minuten mit PBST. Stellen Sie für alle nachfolgenden Inkubationen sicher, dass Sie den Deckel hinzufügen, um eine Verdunstung zu verhindern.
- Inkubieren Sie für 1 h in 1% Triton X-100 in 1x PBS bei RT (200-300 μL) auf einem Shaker, um eine bessere Penetration von Antikörpern zu ermöglichen.
- Nach einigen Spülungen mit PBST mit Blockierlösung (200-300 μL) überziehen und über Nacht bei 4 °C auf einem Nutator oder Shaker verstopfen.
- Verdünnen Sie die primären Antikörper in der gewünschten Konzentration (eine Verdoppelung der Konzentration ist tendenziell ein guter Ausgangspunkt) in der blockierenden Lösung. Die Proben (200-300 μL) auf einem Nutator oder Shaker über Nacht bei 4 °C inkubieren.
- Waschen Sie die Proben den ganzen Tag über rigoros mit PBST mit häufigen Änderungen bei RT auf dem Shaker, etwa 4-6x für 30-60 Minuten pro Waschgang.
- Verdünnen Sie die sekundären Antikörper in der blockierenden Lösung in der gewünschten Konzentration (1:500 neigt dazu, gut zu funktionieren) plus Kernfärbung und inkubieren Sie die Proben (200-300 μL) auf einem Nutator oder Shaker über Nacht bei 4 °C.
- Waschen Sie die Proben den ganzen Tag über rigoros mit PBST mit häufigen Änderungen bei RT auf dem Shaker, etwa 4-6x mal für 30-60 Minuten pro Wäsche oder waschen Sie über Nacht bei 4 ° C.
- Zur Montage trocknen Sie überschüssiges PBST vorsichtig ab und legen Sie die Fasern dann in ein oder zwei Tropfen Montagemedium auf einen Glasträger (Abbildung 4A). Um das Deckglas (18 mm x 18 mm) anzuheben, fügen Sie kleine Lehmfüße hinzu; Dadurch wird verhindert, dass die Fasern gequetscht werden und das Deckglas am Objektträger befestigt. Die Modellierung von Verbindungen funktioniert dafür gut. Sobald das Deckglas gesichert ist, fügen Sie dem Rand mehr Medium hinzu, bis der Bereich unter dem Deckglas voll ist.
HINWEIS: Anstatt ein Montagemedium zu verwenden, das Anti-Fading-Mittel enthält, kann das Gewebe auch durch eine aufsteigende Reihe von Glycerin (30% bis 80% Glycerin in PBS) bewegt werden. - Warten Sie 1-2 Tage vor der Bildgebung, um die Aushärtung des Montagemediums zu ermöglichen.
8. Bildgebung von intramuskulärem Fett
- Schalten Sie das Mikroskop ein und starten Sie die Bildgebungssoftware. Sichern Sie die Folie auf der Bühne.
HINWEIS: Für die Abbildung von Adipozyten in Muskelabschnitten ist oft ein 5- oder 10-faches Objektiv in Kombination mit einer Weitfeldmikroskopie ausreichend. Für die Visualisierung von WM-IF wird ein konfokales Mikroskop benötigt. - Verwenden Sie einen beliebigen Kanal, um den abzubildenden Bereich zu identifizieren.
- Passen Sie in der Bildgebungssoftware die Verstärkungs- und Belichtungszeit für jeden Kanal an.
- Machen Sie Bilder des gesamten Gewebes in jedem Kanal (automatisch oder manuell je nach Mikroskop und verwendeter Software) und fügen Sie einzelne Kacheln zusammen, um einen Verbund des gesamten TA-Querschnitts zu erstellen.
HINWEIS: Es wird empfohlen, Bilder von zwei oder drei verschiedenen Abschnitten desselben TA in unterschiedlichen Tiefen aufzunehmen. Durch die Quantifizierung der Adipozyten in jedem Abschnitt und die anschließende Angabe des Durchschnitts werden lokalisierte Unterschiede in der Menge an intramuskulärem Fett aufgrund von beispielsweise Injektionsfehlern vermieden.
9. Quantifizierung von Adipozyten
- Falls noch nicht installiert, fügen Sie ImageJ (https://imagej.nih.gov/ij/plugins/cell-counter.html) das Cell Counter-Plug-In hinzu.
- Importieren Sie die Bilder in ImageJ als TIF-Dateien oder Originalmikroskopdateien. Zeigen Sie jeden Kanal in ImageJ als separate TIF-Datei an.
HINWEIS: Wenn Sie LIF oder ähnliche Mikroskopdateitypen verwenden, wählen Sie unter Bio-Formate Importoptionen die Option Hyperstack für View Stack With und aktivieren Sie das Kontrollkästchen für Split Channels. Klicken Sie auf OK, um die Datei zu öffnen. Stellen Sie außerdem sicher, dass das Kontrollkästchen Automatische Skalierung deaktiviert ist. - Stellen Sie sicher, dass die Bilder für jeden Kanal im 8-Bit-Format (und grau) vorliegen: Bild > Geben Sie > 8-Bit ein.
- Zusammenführen von DAPI-Bildern (blau), GFP (grün), PERILIPIN (rot) und PHALLOIDIN (grau): Bild > Farbe > Zusammenführen von Kanälen.
- Überprüfen Sie, ob die Skala (Analyze > Set Scale) in Mikrometern angegeben ist. Skizzieren Sie mit dem Freihand-Auswahlwerkzeug den verletzten und unverletzten Teil jedes Querschnitts, messen Sie dann (Analyze > Measure) und zeichnen Sie den verletzten vs. unverletzten Bereich in einer Tabelle auf.
HINWEIS: Verletzte Muskeln können als Bereiche ohne Myofasern oder als Bereiche identifiziert werden, die von Myofasern bevölkert sind, die zentral gelegene Kerne enthalten. - Cell Counter starten: Plugins > CellCounter > initialisieren.
- Wählen Sie einen Zählertyp aus und zählen Sie dann jeden Adipozyten. Notieren Sie die Gesamtzahl der Adipozyten in einer Tabelle und berechnen Sie dann die Anzahl der Adipozyten pro 1 mm2 des verletzten Bereichs.
10. Adipogene Genexpressionsanalyse mittels RT-qPCR
- RNA-Isolierung
- Bevor Sie beginnen, heizen Sie RNase-freies Wasser auf 45 °C vor und bereiten Sie frische 70% EtOH (350 μL pro Probe) vor.
- Jedem Röhrchen, das die Probe enthält, werden 1.000 μL Guanidiumthiocyanat zugegeben (siehe Schritt 3.12.). Es ist wichtig, dass von Perlenschlägern zugelassene Rohre verwendet werden.
ACHTUNG: Guanidiumthiocyanat ist giftig. Tragen Sie eine geeignete persönliche Schutzausrüstung und einen Griff in einem Abzug. - Fügen Sie drei mittlere Perlen oder eine große und eine kleine Perle zu jeder Tube hinzu.
- Homogenisieren Sie das Gewebe bei 50 Hz für 2-4 min mit einem Perlenschläger. Je nach Gewebetyp und Probengröße kann es bis zu 10 Minuten dauern.
- 200 μL Chloroform hinzufügen.
ACHTUNG: Chloroform ist giftig. Tragen Sie persönliche Schutzausrüstung und Griff in einem Abzug. - Schütteln Sie die Proben für 15 s. Inkubiere für 2-3 min bei RT.
- Zentrifuge für 15 min bei 12.000 x g. 350 μL des klaren Überstands (obere Schicht, die die RNA enthält) herauspipettieren und in ein neues Mikrozentrifugenröhrchen mit 350 μL 70% Ethanol geben. Achten Sie darauf, die unteren Protein- und/oder DNA-Schichten nicht abzusaugen
- Übertragen Sie bis zu 700 μL der Mischung auf eine Mini-Spin-Säule, die in einem 2-ml-Auffangrohr platziert ist. Fahren Sie mit der RNA-Isolierung gemäß den Anweisungen des Herstellers fort.
- Eluieren mit 30-50 μL RNase-freiem Wasser, abhängig von der erwarteten Ausbeute. Halten Sie RNA auf Eis und messen Sie die Ausbeute mit einem Spektralphotometer. Bewahren Sie die RNA bei -80 °C auf
HINWEIS: Es ist möglich, den DNase-Behandlungsschritt wegzulassen, da das vorsichtige Abnehmen nur der oberen 350 μL der RNA-Schicht ausreicht, um eine DNA-Kontamination zu verhindern. Neben der RT-qPCR-Analyse kann die isolierte RNA auch für die RNA-Sequenzierung verwendet werden, wobei in diesem Fall ein DNase-Behandlungsschritt dringend empfohlen wird.
- cDNA-Synthese
- Verwenden Sie bis zu 1 μg RNA, um cDNA mit einem cDNA-Synthesekit gemäß den Anweisungen des Herstellers zu synthetisieren.
- Nachdem der Lauf abgeschlossen ist, fügen Sie 80 μL RNase-freies Wasser hinzu. Lagern Sie die Proben bei -20 °C.
- RT-qPCR von adipozytenselektiven Genen.
- Verwenden Sie ein 384-Well-Format, fügen Sie 1 μL Primer (~ 1 μM Endkonzentration) zum Boden jedes Bohrlochs hinzu. Das Vortrocknen von Grundierungen führt zu engeren technischen Replikaten. Abgedeckt lassen, bis die Primer vollständig verdampft sind (die Platte kann auf einen auf 37 °C eingestellten Heizblock gestellt werden, um die Verdunstung zu beschleunigen).
- Richten Sie Probenreaktionen mit vier bis acht technischen Replikaten wie folgt ein: 2,5 μL farbstoffbasierter RT-PCR-Mastermix, 2,1 μL RNase-freies Wasser und 0,4 μL cDNA (~1 ng) mit 5 μL Gesamtvolumen pro Well. Folgende thermische Zyklusbedingungen wurden verwendet: Denaturierung bei 95 °C für 15 s und Anneal/Extend bei 60 °C für 25 s für 40 Zyklen.
- Normalisieren Sie die rohen CT-Werte (Zyklusschwellenwerte) auf die Werte der Housekeeping-Gene (d. h. Hprt und Pde12), indem Sie ΔΔCT wie hier beschriebenberechnen 38. Siehe20 für Primersequenzen.
HINWEIS: Die Standardpraxis für die RT-qPCR-Analyse sollte befolgt werden, z. B. die Verwendung einer Minus-Reverse-Transkriptionskontrolle (-RT), der PCR-Reaktion und der Primer-Validierung.
Ergebnisse
Immunfluoreszenz-Visualisierung von intramuskulärem Fett
Nach den obigen Schritten und unter Betrachten von Abbildung 1A wurden TA-Gewebeschnitte aus einer 21-tägigen Glycerinverletzung entnommen, die entweder unmittelbar nach der Ernte in LN2-gekühltem Isopentan schockgefroren oder in 4% PFA für 2,5 h fixiert wurden. Nach der Kryosektion und Färbung beider Proben wurden Bilder in der Mitte des Bauches, dem größten Bereich der TA, aufgenommen. PERILIPIN+-Adipozyten aus den nicht fixierten TAs (Abbildung 1B) haben die Morphologie im Vergleich zu festen Schnitten signifikant verändert (Abbildung 1C), was ihre Identifizierung, Visualisierung und anschließende Quantifizierung viel schwieriger und möglicherweise ungenauer macht. Es ist zu beachten, dass die ersten PERILIPIN + -Lipidtröpfchen etwa 5 Tage nach der Verletzung nachgewiesen wurden, wobei sich die meisten Adipozyten bis zum Tag 7 gebildet hatten. 21 Tage nach der Verletzung waren die Adipozyten vollständig gereift.
Da die Fettmenge pro TA stark mit der Schwere der induzierten Verletzung korreliert, müssen die TAs signifikant verletzt werden, um die intramuskuläre Fettbildung effektiv zu beobachten und zu untersuchen. Das Üben von Injektionen mit Tinte in Leichen-TAs ist eine großartige Möglichkeit, die Schwere der Verletzung zu verbessern. Erfolgreiche Verletzungen neigen dazu, über 50% des Muskels zu liegen. Zu beachten ist, dass verletzte Bereiche des Muskels Bereiche ohne Muskelfasern darstellen oder Bereiche, die von Muskelfasern bevölkert sind, die mindestens einen zentral gelegenen Kern enthalten, ein bekanntes Kennzeichen einer regenerierenden Muskelfaser.
Dieses Protokoll kann leicht angepasst werden, um FAPs und Fett in 3D zu färben. Dazu wurden mehrere Myofasern aus der TA nach der Fixierung sorgfältig getrennt, gefolgt von einer Ganzkörper-Immunfluoreszenz. Der Schlüssel besteht darin, die Fasern ordnungsgemäß am Glasobjektträger zu befestigen und gleichzeitig eine Überkompression des Gewebes zu vermeiden. Durch die Verwendung von formbaren Tonfüßen kann der Benutzer die erforderliche Dicke einstellen und das Deckglas am Objektträger befestigen, wobei sogar die Verwendung eines invertierten Mikroskops möglich ist (Abbildung 4A). Diese Methode wurde erfolgreich zur Kennzeichnung von PDGFRα+ FAPs, Phalloidin+ Myofasern und PERILIPIN-exprimierenden Adipozyten eingesetzt (Abbildung 4B, Supplemental Video 1 und Supplemental Video 2). Nach der Aufnahme von Bildern auf mehreren Z-Ebenen mit einer Dicke von bis zu 150 μm wurde das 3D-Rendering-Modul innerhalb der Mikroskopsoftware verwendet, um eine 3D-Rekonstruktion zu erstellen.
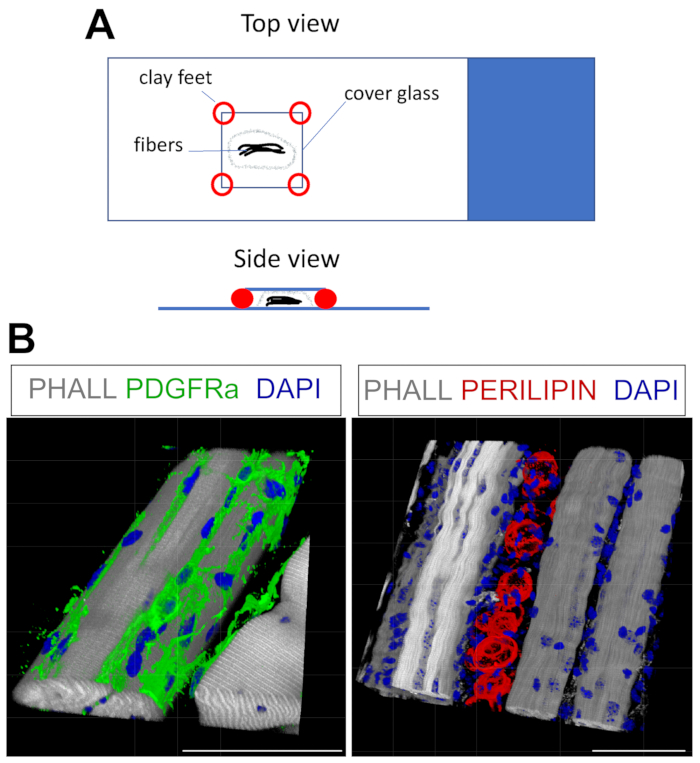
Abbildung 4: Immunfluoreszenzfärbung im ganzen Montement . (A) Ober- und Seitenansicht der Montage der Probe und des Hinzufügens von Deckglas für die Färbung in der gesamten Halterung. (B) Repräsentative 3D-Rekonstruktionen von FAPs (grün; links) und Adipozyten (rot; rechts) zusammen mit Myofasern (grau) und Kernen (blau). Maßstabsstäbe: 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Quantifizierung von intramuskulärem Fett
Nachdem Bilder von intramuskulärem Fett aufgenommen wurden, wurde die Zellzählerfunktion in ImageJ/FIJI verwendet, um die Anzahl der PERLIPIN+- Adipozyten manuell zu zählen (Abbildung 5A). Als nächstes wurde die Gesamtfläche des Muskelabschnitts sowie der verletzte Bereich, definiert durch zentral gelegene Kerne innerhalb von Myofasern, bestimmt. Um die Schwere der Verletzung zu kontrollieren, wurde die Gesamtzahl der Adipozyten durch den verletzten Bereich dividiert, was zu der Anzahl der Fettzellen pro 1 mm 2 des verletztenMuskels führte. In der Regel werden TAs, die eine <30%ige Schädigung aufweisen, von den Quantifizierungen ausgeschlossen. Obwohl Adipozyten selten ohne Verletzung sind, von null bis acht pro Querschnittsfläche, wird die Gesamtzahl der Adipozyten immer noch nach Gesamtfläche normalisiert. Wie in Abbildung 5B hervorgehoben, verursacht eine Glycerinverletzung im Vergleich zu einem unverletzten TA-Muskel massive Mengen an intramuskulärem Fett. Da die Perilipin-Färbung mit einem hohen Signal-Rausch-Verhältnis sehr sauber ist, ist es alternativ auch möglich, die Funktion Partikel analysieren zu verwenden, um die von Perilipin belegte Gesamtfläche zu bestimmen. Diese Methode wird jedoch nicht in der Lage sein, zwischen kleineren und weniger Adipozyten zu unterscheiden. Bis zu drei Abschnitte von mindestens vier einzelnen Tieren wurden abgebildet und quantifiziert, und die durchschnittliche Anzahl der pro Maus vorhandenen Fettzellen wurde berichtet.
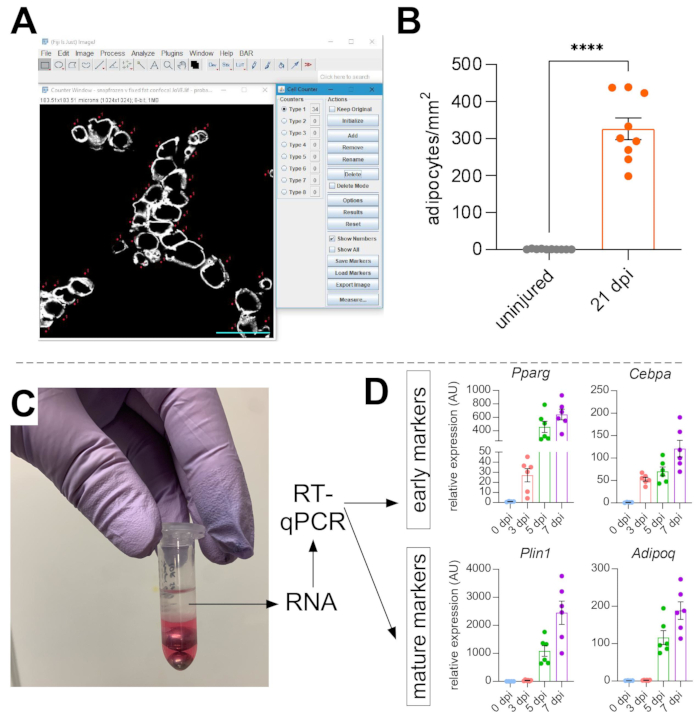
Abbildung 5: Quantifizierungen von intramuskulärem Fett . (A) Repräsentatives Bild der Zählung von PERILIPIN+ Adipozyten (weiß) mit der Zellzählerfunktion in ImageJ. Maßstab: 50 μm. (B) Gesamte TA-Adipozytenquantifizierungen 21 Tage nach der Glycerininjektion, normalisiert auf 1 mm2 des verletzten Bereichs. Jeder Punkt stellt den Durchschnitt einer Maus dar. Fehlerbalken werden als SEM angezeigt. **** = p < 0,0001. (C) Die RNA-Schicht nach der Homogenisierung und anschließender Phasentrennung durch Chloroform wird für die RT-qPCR-Analyse verwendet. (D) Faltenänderungen der Expressionsniveaus von Pparg und Cepbα, frühen adipogenen Genen, und Plin1 und Adipoq, zwei reifen Adipozytenmarkern, zu unterschiedlichen Zeitpunkten nach der Glycerinverletzung. Jeder Punkt stellt den Durchschnitt einer Maus dar. Fehlerindikatoren werden als SEM angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Um die Menge an intramuskulärem Fett unabhängig zu bestätigen, können Genexpression verschiedener adipogener Marker bestimmt werden. Dazu kann RNA aus einem Teil desselben TA-Muskels isoliert werden, der für die Immunfluoreszenz (siehe Schritte oben) an verschiedenen Stellen nach der Verletzung verwendet wird. Ein Perlenschläger wurde in Kombination mit Guanidiumthiocyanat verwendet, um das Gewebe zu homogenisieren. Nach der Zugabe von Chloroform gefolgt von einer Zentrifugation wurde die obere RNA-haltige Schicht sorgfältig extrahiert, und Mini-Spin-Säulen wurden für die RNA-Reinigung verwendet (Abbildung 5C). Diese Methode erzeugt routinemäßig eine hohe Qualität und Quantität von RNA, die für alle nachgelagerten Analysen wie RT-qPCR und RNAseq geeignet ist. Für die RT-qPCR wurden die relativen Expressionsniveaus von adipogenen zu Housekeeping-Genen bestimmt, und alle relativen Veränderungen wurden nach der ΔΔCT-Methode38 bewertet. Wie in Abbildung 5D beschrieben, induziert eine Glycerinverletzung im Vergleich zu unverletztem TA-Muskel die Expression von frühen adipogenen Markern wie Pparg und Cebpα bereits 3 Tage nach der Verletzung. Reife Marker wie Adiponectin (Adipoq) und Perilipin (Plin1) können bereits 5 Tage nach einer Glycerinverletzung nachgewiesen werden.
Genetische Abstammungsverfolgung von Adipozyten
Das hier vorgestellte Adipozytenfärbungsprotokoll kann leicht angepasst werden, um die genetische Abstammungsverfolgung von FAPs einzubeziehen, um ihr Schicksal in Adipozyten abzubilden und zu verfolgen. Wir haben zum Beispiel bereits gezeigt, dass eine Rekombination über die Verabreichung von Tamoxifen in PdgfrαCreERT2 induziert werden kann; Rosa26EYFP-Mäuse 2 Wochen vor der Verletzung, wodurch die floxierte Stoppcodierung effektiv entfernt und die EYFP-Expression in FAPs unauslöschlich aktiviert wird (Abbildung 6A). Wir erreichten hohe Rekombinationseffizienzen mit dem hier vorgestellten Tamoxifen-Regime, wobei ~ 75% der PDGFRα + FAPs EYFP 20 exprimierten, ähnlich dem, was andere Labors über27,39,40 berichtet haben. Um zu zeigen, dass FAPs tatsächlich der zelluläre Ursprung von intramuskulärem Fett sind, hat sich die Mehrheit der FAPs 7 Tage nach der Glycerinverletzung in EYFP+ PERILIPIN-exprimierende Adipozyten verwandelt (Abbildung 6B).
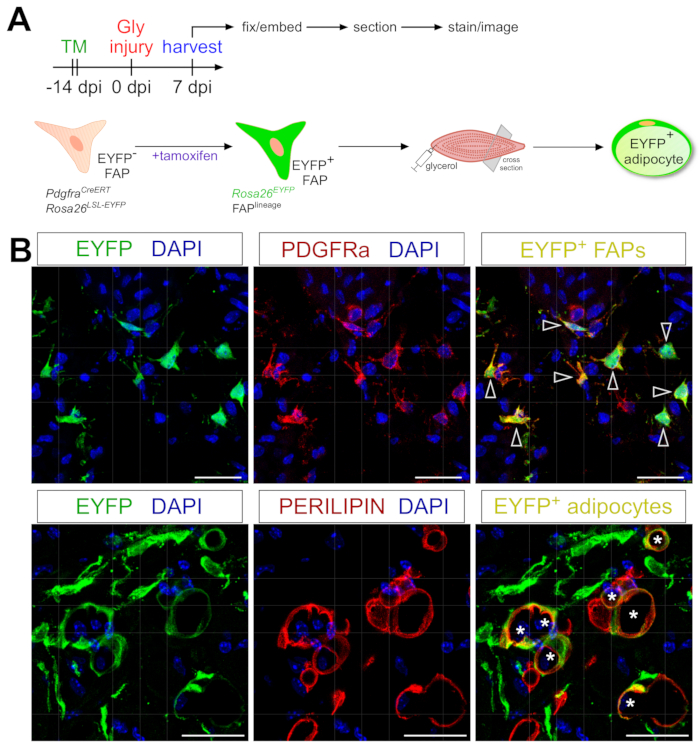
Abbildung 6: Abstammungsverfolgung von FAPs. (A) Schematischer Überblick über den Versuchsaufbau. (B) Repräsentative immunfluoreszierende Bilder, die eine erfolgreiche Rekombination und Aktivierung von EYFP (gelb) innerhalb von PDGFRα+ FAPs (rot, Pfeilspitzen) und PERILIPIN+ Adipozyten (rot, Sternchen) zeigen. Maßstabsstäbe: 25 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Nachweis mehrerer Zelltypen
Dieses Protokoll kann auch verwendet werden, um das myogene Kompartiment zu visualisieren. Mit Antikörpern gegen PAX7 und MYOD1 können Muskelstammzellen (MuSCs) bzw. Myoblasten 5 Tage nach der Glycerinverletzung auch im PFA-fixierten Muskelgewebeabschnitt leicht nachgewiesen werden (Abbildung 7). Somit ist das vorgestellte Protokoll vielseitig und anpassungsfähig, um nicht nur Adipozyten und FAPs, sondern auch andere Zelltypen der myogenen Linie zu markieren und abzubilden.
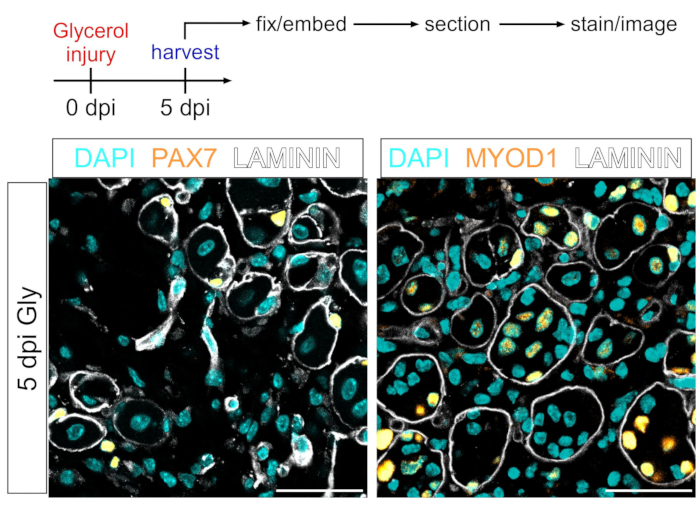
Abbildung 7: Immunfluoreszenzfärbung von Muskelstammzellen und Myoblasten . (A) Schematischer Überblick über den Versuchsaufbau. (B) Repräsentative immunfluoreszierende Bilder, die eine erfolgreiche Färbung von Muskelstammzellen (MuSC) (gelb, links) mit PAX7 und Myoblasten (gelb, rechts) mit MYOD1 zeigen. LAMININ umreißt die Myofasern (weiß), und die Kerne sind in Cyan. Maßstabsstäbe: 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergänzendes Video 1: 3D-Rendering von FAPs. Dreidimensionale Rekonstruktion von Myofasern, FAPs und Kernen, die für PHALLOIDIN (grau), PDGFRα (grün) bzw. DAPI (blau) gefärbt sind, 21 Tage nach der Verletzung. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Ergänzendes Video 2: 3D-Darstellung von intramuskulärem Fett. Volumetrische Darstellung von Myofaserbündeln (grau, PHALLOIDIN) und intramuskulärem Fett (rot, PERILIPIN), das eine Myofaser 21 Tage nach der Glycerinverletzung ersetzt hat. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Diskussion
Dieses Protokoll beschreibt ein umfangreiches und detailliertes Protokoll, das eine effiziente Visualisierung und rigorose Quantifizierung von intramuskulärem Fett ermöglicht. Durch die Aufteilung desselben Muskels in zwei Teile, von denen einer für die Immunfluoreszenz und der andere für die RT-qPCR-Analyse verwendet wird, ist dieses Protokoll auch sehr vielseitig. Es kann auch mit der genetischen Abstammungsverfolgung von FAPs kombiniert werden, um ihre Umwandlung in Adipozyten unter bestimmten Bedingungen zu untersuchen, und ist sehr anpassungsfähig, um mehrere zusätzliche Zelltypen zu markieren und abzubilden.
Die am häufigsten verwendeten Methoden zur Visualisierung von intramuskulärem Fett sind Paraffinabschnitte, gefolgt von Hämatoxylin- und Eosin-Färbungen oder gefrorenen Abschnitten, die für lipophile Farbstoffe wie Oil Red O (ORO) gefärbt sind. Während paraffinverarbeitete Gewebe jedoch die beste Histologie beibehalten, extrahiert derselbe Prozess auch alle Lipide, die die Verwendung von lipophilen Farbstoffen verhindern. Obwohl lipophile Färbemethoden sowohl an PFA-fixierten als auch an unfixierten Gewebeabschnitten funktionieren, werden Lipidtröpfchen leicht verdrängt, indem Druck auf das Deckglas ausgeübt wird, wodurch die räumliche Verteilung des intramuskulären Fettes verzerrt wird. Um dies zu umgehen, hat eine kürzlich durchgeführte Studie ein strenges Protokoll zur Visualisierung von ORO + -Adipozyten mit einem ganzheitlichen Ansatz erstellt. Dazu dezellularisierten die Autoren die TA, um die räumliche Verteilung von intramuskulärem Fett über die gesamte TA41 zu visualisieren. So mächtig diese Technik auch ist, sie verhindert auch die Verwendung anderer Co-Flecken, um zusätzliche Zellstrukturen zu markieren. Der hier vorgestellte Whole-Mount-Immunfluoreszenzansatz kann verwendet werden, um Adipozyten mit einer Vielzahl von Markern zu co-färben, was eine feine Kartierung der zellulären Umgebung ermöglicht. Eine große Herausforderung ist jedoch das Eindringen der Antikörper in das Gewebe. Je mehr Fasern zusammengehalten werden, desto schwieriger wird es für die Antikörper, alle verfügbaren Antigene gleichermaßen zu durchdringen und zu binden. Daher ist diese Methode am effektivsten, wenn man kleine Gruppen von Fasern betrachtet. Gleichzeitig ist dies auch eine Einschränkung, da die gesamte anatomische Lage von intramuskulärem Fett verloren geht, wenn man sich nur auf kleine, abgeschälte Faserbündel konzentriert. Mit der aktuellen Entwicklung neuartiger Gewebereinigungsverfahren und neuer Bildgebungstechnologie wird jedoch in Zukunft eine größere Gewebepenetration und Visualisierung möglich sein42,43,44.
Während die vorherige Fixierung des Muskelgewebes die Adipozytenmorphologie bewahrt, stellt es auch eine Herausforderung dar, die Größe der Myofasern zu beurteilen, eine wichtige Messung der Muskelgesundheit. Die Myofasergröße wird durch Messung der Querschnittsfläche von Myofasern bestimmt. Wir haben bereits berichtet, dass eine vorherige Fixierung von Muskelgewebe dazu führt, dass die meisten Marker, die für die Umrisse von Myofasern verfügbar sind, versagen31. Um diese Hürde zu überwinden, haben wir eine neuartige Bildsegmentierungspipeline entwickelt, die die Messung der Myofasergröße auch in festen Muskelabschnitten31 ermöglicht. So haben wir eine robuste und effiziente Gewebeverarbeitungspipeline etabliert, die in Kombination mit diesem Protokoll die meisten Nachteile überwindet, die durch die vorherige Fixierung von Muskelgewebe verursacht werden.
Ein weiterer großer Vorteil dieses Ansatzes ist die Vielseitigkeit. Durch die Aufteilung der TA in zwei Teile wird die Menge an Informationen, die von einem Muskel erhalten werden können, maximiert. Dies reduziert nicht nur die Anzahl der Tiere, sondern fügt auch eine zusätzliche Kontrollschicht hinzu, indem die Histologie durch Genexpression bestätigt wird und umgekehrt. Darüber hinaus können viele verschiedene Gene über adipogene Gene hinaus untersucht werden. Die isolierte RNA kann auch für ein RNAseq-Experiment des ganzen Muskels verwendet werden. Schließlich kann das schockgefrorene Muskelstück auch für die Proteinarbeit verwendet werden. Eine Einschränkung dieses Protokolls ist die Möglichkeit, dass die Verletzung nicht über die gesamte Länge der TA konsistent ist. Dies könnte zu einem Szenario führen, in dem die beiden Muskelteile in der Menge an intramuskulärem Fett, die sie enthalten, divergieren, und kann den Ausschluss einer solchen Probe von jeder nachgelagerten Analyse rechtfertigen. Es wird daher empfohlen, sich nicht nur auf die RT-qPCR zu verlassen, um wichtige Rückschlüsse auf die Menge an intramuskulärem Fett zu ziehen, sondern als unterstützende Daten zu den histologischen Quantifizierungen.
Zusammen skizziert dieses Protokoll eine robuste, effiziente und rigorose Gewebeverarbeitungspipeline, die die Visualisierung und Quantifizierung von intramuskulärem Fett ermöglicht, dem ersten Schritt bei der Entwicklung neuartiger Behandlungsoptionen zur Bekämpfung von Fettfibrose. Gleichzeitig ist es vielseitig einsetzbar und kann an viele verschiedene Zelltypen innerhalb des Muskels sowie an Adipozyten in anderen Geweben angepasst werden.
Offenlegungen
Die Autoren erklären keine konkurrierenden Interessen.
Danksagungen
Wir danken den Mitgliedern des Kopinke-Labors für ihre Hilfe bei der Datensammlung und der kritischen Lektüre des Manuskripts. Wir danken auch den Mitgliedern des Myology Institute an der University of Florida für ihren wertvollen Beitrag zum Manuskript. Die Arbeit wurde durch den NIH-Zuschuss 1R01AR079449 unterstützt. Abbildung 2 wurde mit Biorender erstellt.
Materialien
| Name | Company | Catalog Number | Comments |
| 16% PFA (Pack of 12, 10 mL bottles) | Electron Miscroscopy Sciences | 15710 | |
| 2.0 mL Microcentrifuge Tubes | Fisher Scientific | 05-408-138 | microcentrifuge tubes for snapfreezing/bead beating |
| 2-Methylbutane (4 L) | Fisher Chemical | O3551-4 | isopentane |
| Absolute Ethanol (200 proof) | ThermoFisher Scientific | BP2818100 | |
| AffiniPure Fab fragment donkey anti-mouse | Jackson ImmunoResearch | 715-007-003 | mouse-on-mouse blocking |
| Alexa Fluor 488 donkey anti-chicken secondary antibody | Jackson ImmunoResearch | 703-545-155 | |
| Alexa Fluor 488 donkey anti-mouse secondary antibody | Invitrogen | A21202 | |
| Alexa Fluor 488 donkey anti-rabbit secondary antibody | Invitrogen | A21206 | |
| Alexa Fluor 568 donkey anti-goat secondary antibody | Invitrogen | A11057 | |
| Alexa Fluor 568 donkey anti-rabbit secondary antibody | Invitrogen | A11037 | |
| Alexa Fluor 568 Phalloidin antibody | Invitrogen | A12380 | Dissolved in 1.5 mL methanol (~66 µM working solution) |
| BioLite 24-well Multidishes | ThermoFisher Scientific | 930186 | 24 well plate for PFA tissue incubation |
| Biometra TOne | analytikjena | 8462070301 | Thermal cycler |
| Chicken anti-GFP antibody | Aves Labs | GFP-1020 | |
| Chloroform/isoamyl alcohol 24:1(v/v) for molecular biology, DNAse, RNAse, and Protease free | ThermoFisher Scientific | AC327155000 | |
| Corn oil | Sigma Aldrich | C8267 | |
| DAPI stain | Invitrogen | D1306 | 150 µM working solution in dH2O |
| Donkey Serum (100 mL) | Millipore Sigma | 5058837 | for blocking solution |
| Dumont #5 Forceps | Fine Science Tools | 11251-20 | sharp-tipped tweezers |
| Fine Scissors Straight 9 cm | Fine Science Tools | 14060-09 | |
| Fluoromount-G | SouthernBiotech | 0100-01 | mounting medium |
| Glycerol, 99.5%, for molecular biology (500 mL) | Acros Organics | 327255000 | |
| Goat anti-PDGFRα antibody | R&D | AF1062 | |
| Hybridization Oven | VWR | 230301V | for Tamoxifen incubation |
| ImmEdge Hydrophobic Barrier PAP Pen | Vector Laboratories | H-4000 | hydrophobic pen |
| Insulin Syringe with Micro-Fine IV needle (28 G) | BD | 329461 | |
| Insulin Syringe with Slip Tip, 1 mL | BD | 329654 | Insulin syringe without needle, for oral gavaging |
| iScript cDNA Synthesis Kit | Bio-Rad | 1708890 | |
| Isoflurane | Patterson Veterinary | 78938441 | |
| Leica DMi8 inverted microscope | Leica | micrscope used for widefield IF and confocal imaging | |
| Micro Slides | VWR | 48311-703 | positively charged microscope slides |
| mouse anti-MYOD antibody | Invitrogen | MA1-41017 | |
| mouse anti-PAX7 antibody (supernatant) | DSHB | AB 428528 | |
| MX35 Premier+ Microtome blades | ThermoFisher Scientific | 3052835 | microtome blades |
| NanoDrop 2000 Spectrophotometer | ThermoFisher Scientific | ND2000 | spectrophotometer for RNA yield |
| Play-Doh | Hasbro | modeling compound | |
| PowerUp SYBR Green Master Mix | ThermoFisher Scientific | A25742 | green dye PCR master mix |
| Puralube Vet Ointment | Puralube | 17033-211-38 | vet ophthalmic ointment |
| QuantStudi 6 Flex Real-Time 384-well PCR System | Applied Biosystems | 4485694 | qPCR machine |
| Rabbit anti-perilipin antibody | Cell Signaling Technology | 9349S | |
| Red-Rotor Shaker | Hoefer Scientific | PR70-115V | shaker for IF staining |
| Richard-Allan Scientific Slip-Rite Cover Glass | ThermoFisher Scientific | 152460 | coverslips |
| RNeasy Mini Kit | QIAGEN | 74106 | contains mini spin columns |
| Safe-Lock Tubes 1.5 ml, natural | Eppendorf | 22363204 | |
| Sample Tubes RB (2 mL) | QIAGEN | 990381 | |
| Sodium azide | Alfa Aesar | 14314 | |
| Stainless Steel Beads, 2.8 mm | Precellys | KT03961-1-101.BK | small beads |
| Stainless Steel Beads, 5 mm | QIAGEN | 69989 | medium beads |
| Stainless Steel Beads, 7 mm | QIAGEN | 69990 | large beads |
| Stainless Steel Disposable Scalpels | Miltex | 327-4102 | scalpel |
| Stainless steel feeding tube, 20 G x 38 mm, straight | Instech Laboratories | FTSS-20S-3 | gavage needle |
| Tamoxifen | Toronto Research Chemicals | T006000 | |
| Tissue Plus O.C.T. Compound | Fisher HealthCare | 4585 | embedding medium |
| TissueLyser LT | QIAGEN | 85600 | bead beater |
| TissueLyser LT Adapter, 12-Tube | QIAGEN | 69980 | |
| Tissue-Tek Cryomold | Sakura | 4566 | specimen molds |
| Triton X-100 | Alfa Aesar | A16046 | |
| TRIzol Reagent | ThermoFisher Scientific | 15596026 | guanidium thiocyanate |
| Tween20 (500 mL) | Fisher BioReagents | BP337-500 | |
| VWR Micro Slides - Superfrost Plus | VWR | 48311703 | |
| Wheaton Coplin staining jars | Millipore Sigma | S6016 | Coplin jar |
Referenzen
- Milad, N., et al. Increased plasma lipid levels exacerbate muscle pathology in the mdx mouse model of Duchenne muscular dystrophy. Skeletal Muscle. 7 (1), 19 (2017).
- Goodpaster, B. H., et al. Obesity, regional body fat distribution, and the metabolic syndrome in older men and women. Archives of Internal Medicine. 165 (7), 777-783 (2005).
- Goodpaster, B. H., et al. Association between regional adipose tissue distribution and both type 2 diabetes and impaired glucose tolerance in elderly men and women. Diabetes Care. 26 (2), 372-379 (2003).
- Goodpaster, B. H., et al. The loss of skeletal muscle strength, mass, and quality in older adults: the health, aging and body composition study. The Journals of Gerontology, Series A: Biological Sciences and Medical Sciences. 61 (10), 1059-1064 (2006).
- Goodpaster, B. H., Thaete, F. L., Kelley, D. E. Thigh adipose tissue distribution is associated with insulin resistance in obesity and in type 2 diabetes mellitus. American Journal of Clinical Nutrition. 71 (4), 885-892 (2000).
- Goodpaster, B. H., Theriault, R., Watkins, S. C., Kelley, D. E. Intramuscular lipid content is increased in obesity and decreased by weight loss. Metabolism. 49 (4), 467-472 (2000).
- Burakiewicz, J., et al. Quantifying fat replacement of muscle by quantitative MRI in muscular dystrophy. Journal of Neurology. 264 (10), 2053-2067 (2017).
- Murphy, W. A., Totty, W. G., Carroll, J. E. MRI of normal and pathologic skeletal muscle. American Journal of Roentgenology. 146 (3), 565-574 (1986).
- Willcocks, R. J., et al. Multicenter prospective longitudinal study of magnetic resonance biomarkers in a large duchenne muscular dystrophy cohort. Annals of Neurology. 79 (4), 535-547 (2016).
- Wokke, B. H., et al. Quantitative MRI and strength measurements in the assessment of muscle quality in Duchenne muscular dystrophy. Neuromuscular Disorders. 24 (5), 409-416 (2014).
- Contreras, O., Rossi, F. M. V., Theret, M. Origins, potency, and heterogeneity of skeletal muscle fibro-adipogenic progenitors-time for new definitions. Skeletal Muscle. 11 (1), 16 (2021).
- El Agha, E., et al. Mesenchymal stem cells in fibrotic disease. Cell Stem Cell. 21 (2), 166-177 (2017).
- Joe, A. W., et al. Muscle injury activates resident fibro/adipogenic progenitors that facilitate myogenesis. Nature Cell Biology. 12 (2), 153-163 (2010).
- Liu, W., Liu, Y., Lai, X., Kuang, S. Intramuscular adipose is derived from a non-Pax3 lineage and required for efficient regeneration of skeletal muscles. Developmental Biology. 361 (1), 27-38 (2012).
- Scott, R. W., Arostegui, M., Schweitzer, R., Rossi, F. M. V., Underhill, T. M. Hic1 defines quiescent mesenchymal progenitor subpopulations with distinct functions and fates in skeletal muscle regeneration. Cell Stem Cell. 25 (6), 797-813 (2019).
- Uezumi, A., et al. Fibrosis and adipogenesis originate from a common mesenchymal progenitor in skeletal muscle. Journal of Cell Science. 124, 3654-3664 (2011).
- Hogarth, M. W., et al. Fibroadipogenic progenitors are responsible for muscle loss in limb girdle muscular dystrophy 2B. Nature Communications. 10 (1), 2430 (2019).
- Uezumi, A., Fukada, S., Yamamoto, N., Takeda, S., Tsuchida, K. Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle. Nature Cell Biology. 12 (2), 143-152 (2010).
- Stumm, J., et al. Odd skipped-related 1 (Osr1) identifies muscle-interstitial fibro-adipogenic progenitors (FAPs) activated by acute injury. Stem Cell Research. 32, 8-16 (2018).
- Kopinke, D., Roberson, E. C., Reiter, J. F. Ciliary Hedgehog signaling restricts injury-induced adipogenesis. Cell. 170 (2), 340-351 (2017).
- Huang, Y., Das, A. K., Yang, Q. Y., Zhu, M. J., Du, M. Zfp423 promotes adipogenic differentiation of bovine stromal vascular cells. PLoS One. 7 (10), 47496 (2012).
- Sun, Y. -. M., et al. PDGFRα regulated by miR-34a and FoxO1 promotes adipogenesis in porcine intramuscular preadipocytes through Erk signaling pathway. International Journal of Molecular Sciences. 18 (11), 2424 (2017).
- Te, L. J. I., Doherty, C., Correa, J., Batt, J. Identification, isolation, and characterization of fibro-adipogenic progenitors (FAPs) and myogenic progenitors (MPs) in skeletal muscle in the rat. Journal of Visualized Experiments: JoVE. (172), e61750 (2021).
- Lukjanenko, L., et al. Aging disrupts muscle stem cell function by impairing matricellular WISP1 secretion from fibro-adipogenic progenitors. Cell Stem Cell. 24 (3), 433-446 (2019).
- Santini, M. P., et al. Tissue-resident PDGFRalpha(+) progenitor cells contribute to fibrosis versus healing in a context- and spatiotemporally dependent manner. Cell Reports. 30 (2), 555-570 (2020).
- Uezumi, A., et al. Identification and characterization of PDGFRalpha+ mesenchymal progenitors in human skeletal muscle. Cell Death & Disease. 5, 1186 (2014).
- Wosczyna, M. N., et al. Mesenchymal stromal cells are required for regeneration and homeostatic maintenance of skeletal muscle. Cell Reports. 27 (7), 2029-2035 (2019).
- Soliman, H., et al. Pathogenic potential of Hic1-expressing cardiac stromal progenitors. Cell Stem Cell. 26 (2), 205-220 (2020).
- Chung, M. I., Bujnis, M., Barkauskas, C. E., Kobayashi, Y., Hogan, B. L. M. Niche-mediated BMP/SMAD signaling regulates lung alveolar stem cell proliferation and differentiation. Development. 145 (9), (2018).
- Hilgendorf, K. I., et al. Omega-3 fatty acids activate ciliary FFAR4 to control adipogenesis. Cell. 179 (6), 1289-1305 (2019).
- Waisman, A., Norris, A. M., Elías Costa, M., Kopinke, D. Automatic and unbiased segmentation and quantification of myofibers in skeletal muscle. Scientific Reports. 11 (1), 11793 (2021).
- Kang, S. H., Fukaya, M., Yang, J. K., Rothstein, J. D., Bergles, D. E. NG2+ CNS glial progenitors remain committed to the oligodendrocyte lineage in postnatal life and following neurodegeneration. Neuron. 68 (4), 668-681 (2010).
- Srinivas, S., et al. Cre reporter strains produced by targeted insertion of EYFP and ECFP into the ROSA26 locus. BMC Developmental Biology. 1, 4 (2001).
- Lukjanenko, L., Brachat, S., Pierrel, E., Lach-Trifilieff, E., Feige, J. N. Genomic profiling reveals that transient adipogenic activation is a hallmark of mouse models of skeletal muscle regeneration. PLoS One. 8 (8), 71084 (2013).
- Mahdy, M. A., Lei, H. Y., Wakamatsu, J., Hosaka, Y. Z., Nishimura, T. Comparative study of muscle regeneration following cardiotoxin and glycerol injury. Annals of Anatomy = Anatomischer Anzeiger: Official Organ of the Anatomische Gesellscaft. 202, 18-27 (2015).
- Pisani, D. F., Bottema, C. D., Butori, C., Dani, C., Dechesne, C. A. Mouse model of skeletal muscle adiposity: a glycerol treatment approach. Biochemical and Biophysical Research Communications. 396 (3), 767-773 (2010).
- Kawai, H., et al. Experimental glycerol myopathy: a histological study. Acta Neuropathologica. 80 (2), 192-197 (1990).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative CT method. Nature Protocols. 3 (6), 1101-1108 (2008).
- Uezumi, A., et al. Mesenchymal Bmp3b expression maintains skeletal muscle integrity and decreases in age-related sarcopenia. The Journal of Clinical Investigation. 131 (1), 139617 (2021).
- Biferali, B., et al. Prdm16-mediated H3K9 methylation controls fibro-adipogenic progenitors identity during skeletal muscle repair. Science Advances. 7 (23), 9371 (2021).
- Biltz, N. K., Meyer, G. A. A novel method for the quantification of fatty infiltration in skeletal muscle. Skeletal Muscle. 7 (1), (2017).
- Vieites-Prado, A., Renier, N. Tissue clearing and 3D imaging in developmental biology. Development. 148 (18), (2021).
- Gómez-Gaviro, M. V., Sanderson, D., Ripoll, J., Desco, M. Biomedical applications of tissue clearing and three-dimensional imaging in health and disease. iScience. 23 (8), 101432 (2020).
- Ueda, H. R., et al. Tissue clearing and its applications in neuroscience. Nature Reviews Neuroscience. 21 (2), 61-79 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten