Method Article
근육 내 지방 형성과 골격근의 세포 기원을 조사하는 가이드
요약
건강한 근육 조직을 근육 내 지방으로 대체하는 것은 인간의 질병과 상태의 두드러진 특징입니다. 이 프로토콜은 근육 내 지방을 시각화, 이미지 및 정량화하는 방법을 간략하게 설명하여 근육 내 지방 형성의 기초가되는 메커니즘에 대한 엄격한 연구를 가능하게합니다.
초록
섬유-아디포겐 전구세포(FAPs)는 골격근 항상성 및 재생 중에 중요한 역할을 하는 중간엽 기질 세포입니다. FAPs는 분자 근섬유 스캐폴드로서 작용하는 세포외 매트릭스를 구축하고 유지한다. 또한, FAPs는 근육 줄기 세포 (MuSCs)에 의해 감지되는 많은 유익한 인자를 분비하기 때문에 근섬유 재생에 없어서는 안될 필수 요소입니다. 그러나 병든 상태에서 FAP는 근육 내 지방 및 섬유성 흉터 조직의 세포 기원입니다. 이 지방 섬유증은 유육종증과 Duchenne 근이영양증과 같은 신경 근육 질환의 특징입니다. FAP가 근육 내 지방으로 분화되는 이유와 방법을 결정하는 데 중요한 장벽 중 하나는 특히 동결 조직 절편에서 지방 세포의 효과적인 보존 및 후속 시각화입니다. 스냅 냉동과 같은 골격근 조직 처리의 전통적인 방법은 개별 지방세포의 형태를 적절하게 보존하지 못하여 정확한 시각화 및 정량화를 방지합니다. 이러한 장애물을 극복하기 위해 골격근 절편에서 지방세포 형태를 보존하여 근육 내 지방의 시각화, 이미징 및 정량화를 허용하는 엄격한 프로토콜이 개발되었습니다. 이 프로토콜은 또한 RT-qPCR을 위해 근육 조직의 일부를 처리하는 방법을 간략하게 설명하여 사용자가 아디포겐 유전자의 발현 차이를 관찰하여 지방 형성의 관찰 된 변화를 확인할 수있게합니다. 추가적으로, 근육 샘플의 전체 마운트 면역형광에 의해 지방세포를 가시화하도록 적응될 수 있다. 마지막으로,이 프로토콜은 FAP의 아디포겐 전환을 연구하기 위해 Pdgfrα 발현 FAP의 유전 적 계보 추적을 수행하는 방법을 설명합니다. 이 프로토콜은 RT-qPCR의 확인과 함께 지방세포의 고해상도 및 형태학적으로 정확한 면역형광 이미지를 일관되게 산출하여 근육내 지방의 견고하고 엄격하며 재현 가능한 시각화 및 정량화를 가능하게 합니다. 여기에 설명 된 분석 파이프 라인은 FAP가 근육 내 지방으로 어떻게 차별화되는지에 대한 이해를 향상시키는 첫 번째 단계이며 지방 형성을 예방하기위한 새로운 개입을 검증하는 프레임 워크를 제공합니다.
서문
지방 섬유증으로 건강한 근육 조직의 침윤은 Duchenne 근이영양증 (DMD) 및 기타 신경 근육 질환뿐만 아니라 유육종증, 비만 및 당뇨병 1,2,3,4,5,6,7,8,9,10의 두드러진 특징입니다. . 이러한 조건에서 지방 침투가 증가하면 근육 기능 감소와 밀접한 관련이 있지만 근육 내 지방 형태가 왜 그리고 어떻게 형성되는지에 대한 우리의 지식은 여전히 제한적입니다. FAPs는 골격근11,12를 포함한 대부분의 성인 장기에 존재하는 다능성 중간엽 기질 세포 집단이다. 그러나 나이가 들어감에 따라 만성 질환에서 FAP는 섬유성 흉터 조직을 생성하고 지방세포로 분화되며, 지방세포는 개별 근섬유 사이에 위치하여 근육 내 지방 13,14,15,16,17,18,19,20을 형성합니다.
근육 내 지방 형성과 싸우기 시작하려면 FAP가 지방 세포로 변하는 메커니즘에 대한 메커니즘을 정의해야합니다. PDGFRα는 여러 종의 근육 내 FAP를 확인하기 위한 현장의 "금 표준" 마커입니다 13,16,17,18,20,21,22,23,24,25,26,27. 그 결과, Pdgfrα 전구모터의 제어 하에 여러 뮤린 타목시펜-유도성 Cre 라인이 생성되어, Cre-LoxP 시스템27,28,29를 사용하여 생체 내에서 FAP를 유전적으로 조작할 수 있게 되었다. 예를 들어, 이 유도성 Cre 라인을 유전자 리포터와 조합함으로써, FAPs의 계보 추적이 수행될 수 있으며, 이는 우리가 성공적으로 근육 및 백색 지방 조직20,30에서 FAPs의 운명 맵에 적용한 전략이다. 혈통 추적 외에도이 Cre 라인은 FAP에서 지방으로의 전환을 연구하는 데 유용한 도구를 제공합니다.
FAPs의 아디포제닉 근육 내 지방으로의 전환 메커니즘을 정의하는 데있어 한 가지 주요 장애물은 다른 조건에서 형성된 근육 내 지방의 양을 엄격하고 재현 가능하게 정량화하는 능력입니다. 핵심은 근육과 지방 조직의 보존의 균형을 맞추고이를 지방 세포를 시각화하기 위해 사용 가능한 염색 방법과 일치시키는 것입니다. 예를 들어, 골격근은 종종 사전 고정 없이 스냅-얼어서 근섬유는 보존하지만 지방세포 형태를 방해한다(그림 1). 대조적으로, 파라핀 포매에 뒤따르는 고정은, 지방세포를 포함한 최상의 조직 조직학을 표시하면서, 모든 지질을 제거하고, 이로써 일반적으로 사용되는 염료인 Oil Red O와 같은 대부분의 친유성 염료를 사용할 수 없게 만든다.
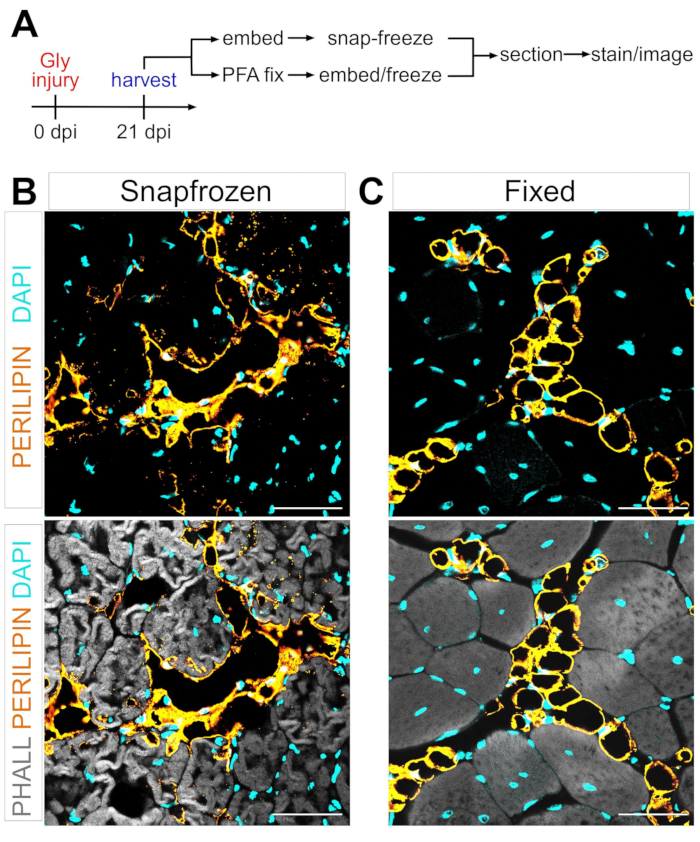
그림 1: 스냅 냉동 대 고정 근육 조직에서 근육 내 지방의 대표적인 이미지 . (A) 실험 설정의 개략적인 개요. 글리세롤 손상 후 21일째에 지방세포(노란색), 근섬유(회색) 및 핵(시안) 내 (B) 스냅-냉동 및 (C) 고정된 TAs를 보여주는 면역형광 이미지. 배율 막대: 50μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
여기에 설명 된 프로토콜은 근섬유 및 지방 세포 형태를 보존하고 여러 세포 유형의 시각화 및 분석을 가능하게합니다. 이 접근법은 파라포름알데히드 (PFA) 고정 근육 조직에서 지방세포의 면역 형광 염색을 기반으로하며, 이는 다중 항체와의 공동 염색을 허용합니다. 또한 전체 마운트 이미징을 사용하여 손상되지 않은 조직에서 근육 내 지방을 공간적으로 표시하도록 쉽게 조정할 수 있으므로 근육 내 지방의 세포 미세 환경에 대한 정보를 제공합니다. 또한, 이 프로토콜은 근육 건강을 평가하기 위한 중요한 측정인 고정된 근육 조직(31)에서 근섬유의 단면 면적을 결정하기 위해 최근에 발표된 접근법과 조합될 수 있다. 이 접근법을 유전 적 계보 추적과 결합하여 FAPs를 지방세포로의 분화를 운명지도화하는 것도 여기에 요약되어 있습니다. 따라서, 여기에 설명된 다목적 프로토콜은 FAP의 엄격하고 재현 가능한 평가와 조직 절편 및 무손상 조직에서 근육 내 지방으로의 분화를 가능하게 한다.
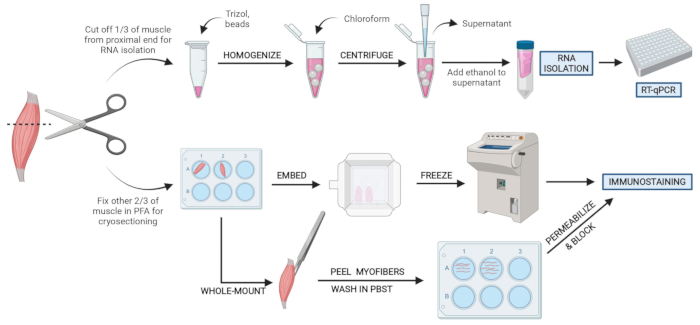
그림 2: 회로도 프로토콜 개요. RT-qPCR을 통한 후속 RNA 분리 및 전사 분석을 위해 TA의 삼분의 일이 제거, 스냅-냉동 및 균질화되는 조직 처리의 개략적인 개요. TA의 다른 삼분의 일은 PFA 고정이며 냉동 절편 또는 전체 마운트 섬유에서 면역 염색을 위해 처리됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
모든 동물 프로토콜은 플로리다 대학의 IACUC (Institutional Animal Care and Use Committee)의 승인을 받았습니다.
1. FAP의 유전 적 혈통 추적
참고: FAP의 유전자 계보 추적이 필요하지 않은 경우 1단계를 건너뛸 수 있습니다.
- FAP의 계보 추적을 수행하려면 필요한 마우스 대립 유전자를 구하십시오.
참고: Pdgfrα 프로모터의 제어 하에 있는 여러 타목시펜 유도성 Cre 라인이 생성되어 Hogan29, Rando27 및 Bergles32 실험실을 포함하여 FAP를 성공적으로 표적으로 삼았습니다. Cre 활성의 유전 리포터로서, Rosa26EYFP33과 같은 수많은 Rosa26 리포터 대립유전자가 이용가능하다. 어떤 Cre-Reporter 조합이 가장 효과적인지 결정하기 위해 각 실험실에 대해 제안되지만, Pdgfrα CreERT2 마우스 (29 및 Jax # 032770)를 Rosa26EYFP (33 및 Jax # 006148) 리포터로 교차시킴으로써 생성 된 PdgfrαCreERT2; Rosa26EYFP마우스는 FAPs20을 효율적이고 구체적으로 표시하는데 사용될 수 있다. 성숙한 FAP의 운명을 추적하려면 타목시펜을 투여하기 전에 마우스가 적어도 ~ 10 주령에 도달 할 때까지 기다리는 것이 좋습니다. 계보 추적 실험은 남성과 여성 모두에서 수행 할 수 있습니다. - 경구 위증을 통한 타목시펜 투여
- 옥수수 기름과 와류에 40 mg / mL의 타목시펜을 준비하여 gavaging 1 일 전에 혼합하십시오. 회전하는 혼성화 오븐에서 37°C에서 O/N을 인큐베이션한다.
주의: 타목시펜은 발암 물질이므로 조심스럽게 취급해야 합니다. 취급 할 때는 항상 장갑을 착용하고 흡입의 위험이 있으므로 분말로 칭량 할 때 마스크를 착용하십시오. - 프로토콜에 따라 영역을 청소하고 1 mL 주사기에 가빙 바늘을 부착하십시오. 타목시펜 200 μL를 주사기에 넣는다.
- 스크러프 PdgfrαCreERT2 ; Rosa26EYFP 마우스 (10 주령; 남녀 모두 사용됨)는 평평한 표면에 놓고 꼬리 바닥을 단단히 잡습니다. 자유로운 손을 사용하여 엄지와 검지 손가락으로 마우스 가운데를 잡은 다음 어깨를 지나칠 때까지 부드럽게 약간의 압력으로 그립을 밀어 넣습니다.
- 엄지 손가락과 검지 손가락으로 피부를 뒤로 꼬집고 마우스를 들고 손을 뒤집어 마우스가 사용자를 향하게하고 마우스를 잡고있는 손의 분홍색과 반지 손가락 사이에 꼬리를 집어 넣습니다.
- 이 시점에서 마우스가 잘 고정되어 있고 머리나 팔을 움직일 수 없는지 확인하십시오. gavaging 바늘을 입에 넣고 마우스의 머리를 약간 뒤로 기울이는 데 사용하십시오. 이것은 식도가 더 잘 접근 할 수있게 해줍니다.
- 조심스럽게 천천히 바늘을 식도에 삽입하십시오. 저항이 충족되면 바늘을 강요하지 마십시오. 바늘이 쉽게 아래로 미끄러 져 내려야합니다. 천천히 타목시펜을 주입하십시오. 마우스를 15-20 분 동안 모니터링하여 gavaging하는 동안 문제가 발생하지 않도록하십시오.
참고: 2일 연속으로 타목시펜을 투여하면 일반적으로 부작용 없이 FAP의 재결합 효율이 ~75%-85%에 이릅니다. 사용자는 부상을 유발하기 전에 1-2 주 동안 기다리는 것이 좋으며, 이로 인해 나머지 타목시펜이 시스템에서 제거되고 나머지 단백질이 뒤집힐 수 있습니다.
- 옥수수 기름과 와류에 40 mg / mL의 타목시펜을 준비하여 gavaging 1 일 전에 혼합하십시오. 회전하는 혼성화 오븐에서 37°C에서 O/N을 인큐베이션한다.
2. 경골 전방 (TA) 근육의 손상
참고 : 근육 내 지방을 연구하려면 글리세롤 기반 손상 모델 (멸균 식염수의 50 % 글리세롤)을 사용하는 것이 좋습니다.이 모델은 근육 내 지방 형성 34,35,36,37을 초래합니다.
- 이소플루란을 첨가하고 마우스 챔버와 코콘 모두에 튜브가 개방되도록 함으로써 마취기를 준비한다. 챔버와 작업 영역을 70 % 에탄올 또는 과산화물 용액 (프로토콜에 따라 다름)으로 청소하십시오.
- 산소 유량을 2.5L/min으로, 이소플루란 농도를 2.5%로 설정합니다. 마우스를 마취실에 넣고 마취 될 때까지 ~ 5 분 정도 기다리십시오.
- 마우스를 깨끗한 가열 패드에 수핀을 내려 놓고 코를 코 콘에 넣으십시오. 마취 상태에서 건조를 방지하기 위해 면으로 장식 된 어플리케이터로 수의사 안과 연고를 눈에 부드럽게 바르십시오. 지속적으로 마취를 모니터링하고 부상 전에 마우스에 발가락 꼬집음을 수행하여 마우스가 완전히 마취되었는지 확인하십시오.
- 소독을 위해 신선한 알코올 닦음으로 주입 할 다리를 청소하십시오.
- 30-50 μL의 50% 글리세롤(마우스의 크기에 따라 다름)을 인슐린 주사기에 그립니다. 정강이에 머리카락을 부드럽게 닦아 TA의 위치를 노출시킵니다.
참고 : 머리카락을 움직이고 알코올 닦아서 젖었을 때 더 나은 시각화를 달성하는 것이 더 쉽습니다. - TA를 찾은 후 (경골에 바로 옆으로, 피부를 통해 약간 튀어 나와 부드러운 촉진으로 느낄 수 있음), 바늘을 발목 근처의 원위 방향으로 TA에 삽입하십시오. 바늘을 근육에 완전히 삽입하고 천천히 글리세롤을 주입하면서 바늘을 점차적으로 빼내면 대부분의 근육을 손상시키는 데 도움이됩니다.
참고 : 바늘을 다리와 평행하게 삽입하는 것이 가장 좋으며 약간 높은 각도로 삽입하는 것이 가장 좋습니다. 좋은 부상은 일반적으로 바늘을 뽑은 후 TA가 수축함에 따라 등굴곡을 일으 킵니다. 마우스의 발가락이 펼쳐지면 신근 디지토럼 롱 (EDL) 근육이 주입되었을 가능성이 큽니다. - 마우스를 케이지에 다시 넣고 마취 회복을 보장하기 위해 약 15-20 분 동안 모니터링하십시오.
- 날카로운 용기에 바늘을 버리십시오. 바늘을 결코 요약하지 마십시오.
참고 : 진통 후 글리세롤 주사는 기관 동물 관리 및 사용위원회의 승인에 따라 제공되어야합니다. 지방세포는 손상 후 5일 이내(dpi)에 관찰될 수 있다. 7dpi에 의해, 모든 지방세포가 형성되었고, 21dpi에 의해, 그들은 완전히 성숙했다.
3. 조직 수확
- 1x PBS에서 4% PFA를 준비하고 수확을 시작하기 전에 얼음 위에 놓으십시오.
- 얼음 위에 근육 고정에 사용되는 플레이트 (12 또는 24 웰)를 놓고 각 웰에 4 % PFA를 추가하여 각 웰에 고정되는 조직보다 10-20 배 더 많은 PFA 부피가 있는지 확인하십시오.
- 글리세롤 손상 후 7 일에서 21 일 사이에, 기관 지침 (즉, 이소플루란 과다 복용 후 자궁 경부 탈구)에 따라 마우스를 안락사시킵니다.
- 조직학 또는 RNA 분리에 사용할 조직을 수확하기 시작하십시오.
참고: 조직은 희생 후 10-15분 이내에 스냅 냉동 또는 PFA에 넣어야 합니다(그림 2). - 70 % 에탄올로 자르는 마우스의 모든 부위를 자유롭게 스프레이하여 머리카락을 해부 부위와 악기에서 떼어 낼 수 있도록하십시오.
- 가위를 사용하여 골반 근처의 다리 위쪽 주위의 피부를 자릅니다(그림 3A).
- 다리의 피부를 위에서 발목까지 부드럽게 당깁니다(그림 3B).
참고 : TA는 내측 설형 및 첫 번째 중족골에 명확하게 정의 된 원위 힘줄이 부착 된 눈물 방울 모양의 근육입니다. 그것은 경골에 측면이며 아래쪽 무릎까지 확장됩니다. - 먼저, TA를 수확하기 전에 날카로운 핀셋을 사용하여 외부 결합 조직층(epimysium)을 제거한다(도 3C). 해부 현미경을 사용하여 에피미슘을 더 잘 시각화하십시오.
- 원위 힘줄에서 시작하여 근육 바닥에서 TA 아래의 핀셋을 밀고 무릎을 향해 부드럽게 위쪽으로 당깁니다(그림 3D). 근육의 끝에서 중지; 아래 무릎에서 느낀 저항을 지나치지 마십시오.
- 무릎 아래에 도달하기 전에 상당한 저항이있는 경우, 결합 조직의 남은 층을 멈추고 계속 제거하십시오.
참고 : EDL에 부착되는 TA 힘줄의 바로 옆에있는 또 다른 원위 힘줄이 있습니다.이 힘은 TA에 측면으로 가느 다란 근육입니다. 족집게를 TA 힘줄 아래로 밀어 넣기 만하면 EDL의 우발적 인 수확을 방지하지만 고정 후 쉽게 제거 할 수도 있습니다. - 핀셋으로 다리에서 TA를 부분적으로 들어 올린 후에는 메스와 동일한 동작을 사용하여 TA와 하부 무릎의 연결을 끊습니다(그림 3E). TA를 완전히 제거하기 위해 가위로 발목의 힘줄을 자르십시오. 섬유의 손상을 피하기 위해 힘줄의 근육 만 다루십시오.
- 힘줄 반대쪽 끝에서 TA의 1/3을 절단하고(그림 3F), 마이크로 원심분리 튜브에 넣고, 액체 질소에 떨어뜨려 스냅-동결시킨다(그림 3H).
- 조직의 다른 2/3을 조직학을 위해 4% PFA로 표지된 웰에 잠급니다(도 3I). 첫 번째와 마지막 조직이 고정에 배치 된 시점을 추적하십시오. 4°C에서 2-2.5 h 동안 쉐이커 상에 놓는다.
- 고정 기간은 조직과 크기에 따라 다릅니다. 조직 고정에 필요한 기간을 결정하십시오. 4°C에서 2-2.5 h 동안 TAs를 고정시키는 것은 전형적으로 조직의 과고정을 유발하지 않으면서 지방세포 형태를 잘 보존한다.
참고: 전체 마운트 면역형광 염색을 위해 TA를 사용할 계획이라면, 섹션 7: "전체 마운트 면역형광 염색"에 도달할 때까지 이 프로토콜의 나머지 부분을 건너뜁니다. - 고정 후, 웰로부터 PFA를 제거하고, 조직을 차가운 1x PBS로 2-3회 헹구고, 이어서 세척당 5분 동안 차가운 1x PBS로 2-3회 세척하였다.
- 웰로부터 PBS를 제거하고, 조직이 부유할 수 있도록 1x PBS에 충분한 30% 수크로스를 첨가한다. 4°C에서 하룻밤 동안 진탕기 위에 놓는다.
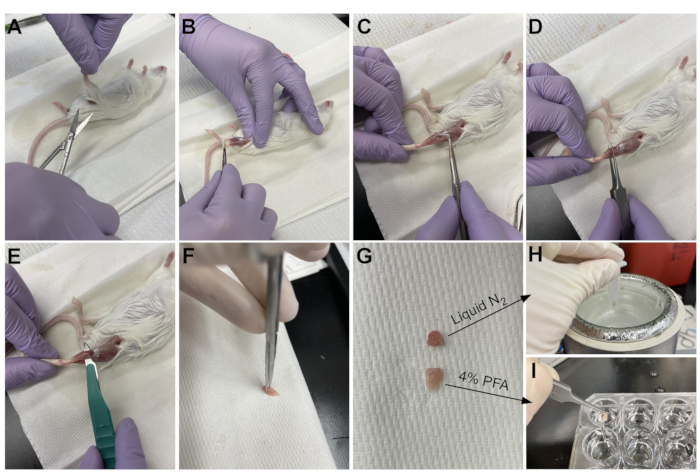
그림 3 : 조직 수확 요약. (A) 피부는 다리 밑에서 절단되고 (B) 뒷다리 근육이 노출됩니다. (C) 일단 에피미슘이 TA로부터 제거되면, (D) 포셉은 근육을 부분적으로 분리하고 에피미슘이 완전히 제거되었는지 확인하기 위해 사용된다. (E) TA는 메스로 다리에서 절단되고 힘줄을 절단 한 후 제거됩니다. (g) TA를 삼분의 일 및 삼분의 일 조각으로 절단한 후, (H) 삼분의 일은 RT-qPCR 분석을 위해 액체 질소에서 스냅-냉동되고, (I) 다른 두 삼분의 일은 조직학을 위해 4% PFA에 고정된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 임베딩
- 조직을 완전히 잠수시키기에 충분한 매립 매체로 라벨링하고 채우는 것으로 매립에 사용할 시편 몰드를 준비하십시오.
- 우물에서 조직을 제거하고, 종이 타월에 과도한 자당을 말리고, 냉동 매체가 채워진 표본 몰드로 이동하십시오.
참고 : 금형이 냉동 스탯에 어떤 방향으로 단면화되어 있는지 아는 것이 도움이됩니다. 이러한 방식으로, 사용자는 관심 영역이 쉽게 접근할 수 있도록 하는 방식으로 주형 내의 조직을 배향시킬 수 있다. TA의 경우, 이것은 단면화 될 표면을 향한 가장 두꺼운 끝 (힘줄 쪽과 반대쪽)을 놓음으로써 달성 될 것입니다. 이것은 TA가 가장 두꺼운 부분 (배꼽)에서 쉽게 절개되고 근육 섬유의 단면 절단을 허용합니다. - 이소펜탄을 보유하는 용기를 액체 질소에 부분적으로 침수시켜 이소펜탄 슬러리를 제조하였다. 용기에 충분한 액체 이소펜탄이 있는지 확인하여 조직을 내장하는 데 사용할 시편 금형의 약 절반을 잠수시킵니다.
- 조심스럽게 이소펜탄 슬러리에 넣고 주형의 약 절반이 잠겨 있는지 확인하여 금형을 동결하십시오. 또한 금형이 사방에서 똑같이 얼어 붙고 있는지 확인하십시오.
- 전체 몰드가 상단에서 눈에 띄게 얼기 직전에 이소펜탄에서 몰드를 꺼내십시오. 이 작업에 걸리는 시간은 사용되는 금형에 따라 다릅니다.
- 냉동 된 몰드를 드라이 아이스가있는 용기에 보관하고 나머지 블록을 동결 한 다음 -80 °C에 보관하십시오.
참고: 동결용 이소펜탄은 재사용할 수 있습니다. 유리 병에 넣었지만 이소펜탄이 실온(RT)에 도달할 때까지 뚜껑을 조이지 마십시오. 그렇지 않으면 압력의 변화가 병을 산산조각 낼 수 있습니다.
5. 단면화
- 냉동 장치를 -22 ~ -24 °C로 설정하고 TA를 함유 한 금형을 냉동 스탯에 추가하고 온도 순응을 위해 최소 30 분 동안 기다립니다. 그 동안 일련의 양전하를 띤 현미경 슬라이드에 라벨을 붙입니다.
- 안티 롤 플레이트를 삽입하고 시편 블록과 접촉하는 플레이트에 최소한의 닉이 있도록 냉동 장치에 정렬하십시오. 제자리에 고정하십시오.
- 신선한 냉동 노즐을 블레이드 홀더에 삽입하고 제자리에 고정하십시오.
주의: 칼날이 날카롭다. 냉동 또는 냉동 금형의 다른 부분을 조작 할 때 블레이드를 덮으십시오. - 금형에서 동결된 블록을 제거합니다. cryostat 척에 매립 매체의 균일 한 층을 추가하고 블록을 매체에 위치시킵니다. 임베딩 배지가 완전히 얼어 붙을 때까지 1-3 분 동안 그대로 두십시오 (불투명 한 흰색).
참고: TA의 경우 척에 있을 때 가장 두꺼운 영역(배)이 표시되어야 합니다. - 조직 블록이있는 냉동 척을 냉동 스탯에 넣으십시오. 블레이드를 풀고 블레이드에 닿을 때까지 냉동 장치를 앞으로 전진시킵니다. 조직이 매립 매질에 의해 더 이상 가려지지 않을 때까지 25 μm 절편에서 블록을 통해 절편한다.
참고: 단면화하는 동안 단면이 균일 한 두께가되도록 스테이지의 냉동 및 / 또는 위치를 조정하십시오. 단면 두께의 균일성을 보장하기 위해 몇 개의 섹션을 수집하는 것이 도움이 될 수 있습니다. 사용자는 TA(배꼽) 내의 관심 영역까지 단면화하기 전에 적절한 안티롤 플레이트 위치를 찾는 것이 좋습니다, 이는 사용자가 조직이 낭비되지 않고 섹션이 똑바로 떨어질 때까지 안티롤 플레이트의 여러 위치를 시도할 수 있게 하기 때문입니다. - 섹션 두께를 10-12 μm로 변경하고 표지된 현미경 슬라이드 상에서 절편을 수집한다. 직렬 단면화는 6-10 슬라이드 (1-x 레이블이 지정됨)에서 인접한 섹션을 수집하여 여러 마커에 대한 염색을 허용하는 것이 좋습니다. 필요한 경우 슬라이드에서 섹션을 수집하기 전에 얇은 브러시를 사용하여 부분을 컬링합니다.
참고: 단면이 말리는 경우 온도가 -22 ~ -24°C 범위 내에서 일정하게 유지되는지 확인하십시오. 섹션에 수직 줄무늬가있는 경우, 이것은 안티 롤 플레이트 또는 블레이드의 닉 때문일 수 있습니다. 이것은 안티 롤 플레이트의 위치를 조정하거나 새로운 블레이드로 전환하여 고정 할 수 있습니다. - 각 슬라이드에 동일한 단면화 평면의 인접한 단면을 수집 한 후 두께를 다시 25 μm로 조정하여 블록을 통해 150-200 μm로 전진 한 다음 두께를 다시 10-12 μm로 조정하고 다시 단면화를 시작하십시오.
참고: 이 직렬 단면화를 통해 사용자는 TA를 통해 서로 다른 깊이에서 시각화, 이미지 및 정량화할 수 있습니다. 슬라이드 당 세 개에서 네 개의 직렬 섹션으로 충분합니다. - 슬라이드 및 조직 블록을 -80°C에서 보관한다.
6. 조직 절편의 면역형광(IF) 염색
참고: 항체 농도는 로트와 제조업체마다 다를 수 있으므로 관심 있는 슬라이드를 염색하기 전에 테스트 슬라이드에서 항체의 여러 가지 농도를 평가하여 최적화를 수행하는 것이 좋습니다.
- RT 또는 37 ° C의 따뜻한 접시에서 10-20 분 동안 해동 / 건식 슬라이드.
- 소수성 펜을 사용하여 슬라이드의 용지 표면 가장자리에 유리와 만나는 선을 그립니다.
- 슬라이드를 코플린 병에 넣고 세척 당 적어도 5분 동안 진탕기에서 1x PBS + 0.1% Tween20 (PBST) 3-5x로 세척하여 조직 절편을 재수화시킨다.
참고 :이 시점에서 슬라이드가 PBST (소수성 선까지)에 잠기지 않고 앉지 않도록하거나 조직 섹션이 말라 버리지 않도록하는 것이 중요합니다. - 슬라이드를 가습 챔버의 랙에 놓고 RT에서 1-2 시간 동안 310-350 μL의 블로킹 용액 (1x PBS의 5 % 당나귀 혈청 및 0.3 % 트리톤 X-100)으로 슬라이드를 오버레이하십시오.
참고: 블로킹 용액에 0.3% Triton X-100이 포함되어 있어 조직 절편의 충분한 투과를 허용하므로 추가적인 투과 단계가 필요하지 않습니다. 마우스로부터 유래된 1차 항체(즉, 아래에 열거된 PAX7 및 MYOD1)를 사용하는 경우, 블로킹 단계를 위한 블로킹 용액에서 Fab 단편(1:50)을 사용하는 마우스 온 마우스 블로킹 단계를 포함하는 것이 좋다. 이는 일차 이외의 항체에 대한 마우스 이차 항체의 비특이적 결합으로 인한 배경을 감소시키는데 도움이 될 것이다. - 다음 단계로 진행하기 직전에 블로킹 용액에 사용되는 일차 항체를 다음과 같이 희석한다.
- 지방세포 염색 및 전체 섹션 영상화에 대한 1차 항체: 토끼 항-페리리핀을 1:1000의 희석비로 희석한다.
- 지방세포의 혈통 추적을 위한 1차 항체: 닭 항-GFP를 1:1000의 비율로 희석하고 토끼 항페리리핀을 1:1000에 희석한다.
- FAPs의 혈통 추적을 위한 1차 항체: 닭 항-GFP를 1:1000의 비율로 희석하고 염소 항-PDGFRα를 1:250에 희석한다.
- 근인성 마커에 대한 1차 항체: 마우스 항-PAX7을 1:25의 비율로 희석하거나 마우스 항-MYOD1을 1:250에, 토끼 항-LAMININ을 1:1000에 희석한다.
참고: 위에 나열된 항체가 이 프로토콜로 성공적으로 평가되었지만, FAP, 지방세포 및/또는 다른 세포 유형을 표지하는 다른 마커 및 항체도 이 프로토콜과 호환될 가능성이 높습니다. 일차 항체를 처음 사용하는 경우 사용자가 일차 항체를 생략하는 음성 대조군 슬라이드를 포함하는 것이 좋습니다. 이것은 항체의 특이성을 조절할 것이다. 프로토콜의 모든 다른 단계들은 이차 항체의 첨가를 포함하여, 뒤따르지만, 블로킹 용액은 블로킹 용액 내의 일차 항체 대신에 다음 단계에서 단독으로 사용된다.
- 블로킹 용액을 슬라이드에서 덤프하고 일차 항체로 310-350 μL의 블로킹 용액으로 오버레이하고 가습 챔버에서 4°C에서 밤새 인큐베이션한다.
- 다음날 블로킹 용액 / 일차 항체를 슬라이드에서 버리고 코플린 병에 넣으십시오. 슬라이드를 PBST로 2-3회 헹구고 세척 당 적어도 5분 동안 쉐이커에서 PBST로 3-5x 세척한다.
- 마지막 세척 동안, 블로킹 용액에 사용될 이차 항체 또는 임의의 직접 접합체를 준비한다. 이러한 항체가 광표백을 피하기 위해 빛에 소비하는 시간을 최소화하십시오.
- 희석 이차 항체/직접 접합체: 488nm 당나귀 항닭(1:1000) 또는 토끼 항(1:1000) 또는 안티마우스(1:1000), 568nm 당나귀 항염소(1:1000) 또는 항토끼(1:1000) 또는 팔로이드인(근섬유; 1:100), DAPI 염색(핵; 1:500).
- 310-350 μL의 블로킹 용액으로 슬라이드를 가습 챔버에 이차 항체 및/또는 직접 컨쥬게이트로 오버레이합니다. RT에서 1-2시간 동안 인큐베이션한다. 지금부터 빛으로부터 샘플을 보호하십시오.
- 차단 용액 / 보조 항체를 덤프하고 코플린 병에 넣으십시오. PBST로 한 번 헹구고 세척 당 적어도 5 분 동안 쉐이커에서 PBST로 3-5x 세척하십시오. 빛에 노출되지 않도록 코플린 항아리를 덮어 두십시오.
- 가장자리를 두드리고 종이 타월에 등을 닦아 가능한 한 슬라이드를 말리지 만 조직 부분이 마르지 않도록하십시오.
- 슬라이드의 상단 수평 가장자리에 수계 장착 매체의 서너 방울을 추가하고 커버슬립을 부드럽게 추가합니다. 커버슬립 아래에 기포가 형성되면 아래로 누르거나 움직이지 마십시오. 어떤 압력 또는 움직임도 지방세포의 깨지기 쉬운 세포 구조를 왜곡시킬 수 있습니다.
- 이미징 전에 장착 매체가 어둠 속에서 하룻밤 사이에 놓이도록 허용하십시오.
7. 전체 마운트 면역 형광 염색
- ~1 시간의 고정 후 (단계 3.14 참조), 날카로운 핀셋을 사용하여 고정 된 TA에서 근섬유를 떼어냅니다.
- 분리된 섬유를 24-웰 플레이트에 넣고 PBST로 각각 3분 동안 3x 세척한다. 모든 후속 인큐베이션의 경우 증발을 방지하기 위해 뚜껑을 추가하십시오.
- 항체의 더 나은 침투를 허용하도록 진탕기 상에서 RT (200-300 μL)에서 1x PBS 중의 1% 트리톤 X-100 중의 1시간 동안 인큐베이션한다.
- PBST로 몇 번 헹구어 낸 후, 블로킹 용액 (200-300 μL)으로 오버레이하고 4°C에서 밤새 너트레이터 또는 진탕기 상에서 차단한다.
- 일차 항체를 블로킹 용액 내에 원하는 농도(두 배가 농도가 좋은 시작점이 되는 경향이 있음)로 희석한다. 샘플(200-300 μL)을 4°C에서 밤새 너트레이터 또는 진탕기 상에서 인큐베이션한다.
- 셰이커의 RT에서 빈번한 변화로 하루 종일 PBST로 샘플을 엄격하게 세척하고, 각 세척 당 30-60 분 동안 약 4-6x로 세척하십시오.
- 블로킹 용액 중의 2차 항체를 원하는 농도 (1:500 잘 작동하는 경향이 있음)로 희석하고 핵 염색을 더한 후 샘플 (200-300 μL)을 4°C에서 밤새 너트레이터 또는 진탕기 상에서 인큐베이션한다.
- 진탕기 상에서 RT에서 빈번한 변화로 하루 종일 PBST로 샘플을 엄격하게 세척하고, 4°C에서 밤새 세척하거나 세척할 때마다 30-60분 동안 약 4-6x 번 세척한다.
- 장착하려면 과도한 PBST를 부드럽게 말린 다음 유리 슬라이드의 장착 매체 하나 또는 두 방울에 섬유를 놓습니다(그림 4A). 커버 슬립 (18mm x 18mm)을 올리려면 작은 점토 발을 추가하십시오. 이렇게하면 섬유가 찌그러지는 것을 방지하고 커버 슬립을 슬라이드에 고정시킵니다. 모델링 화합물이이를 위해 잘 작동합니다. 커버슬립이 고정되면 커버슬립 아래 영역이 꽉 찰 때까지 가장자리에 중간 정도를 더 추가합니다.
주: 퇴색 방지제를 함유하는 장착 매질을 사용하는 대신에, 조직은 또한 일련의 글리세롤 (PBS 중 30% 내지 80% 글리세롤)의 오름차순을 통해 이동될 수 있다. - 장착 매체의 경화를 허용하기 위해 이미징하기 전에 1-2 일 동안 기다리십시오.
8. 근육 내 지방의 이미징
- 현미경을 켜고 이미징 소프트웨어를 시작하십시오. 슬라이드를 스테이지에 고정합니다.
참고: 근육 절편의 지방세포를 영상화하는 경우, 광역 현미경 검사와 결합된 5x 또는 10x 대물렌즈로 충분할 수 있습니다. WM-IF를 시각화하려면 공초점 현미경이 필요합니다. - 모든 채널을 사용하여 이미지화할 영역을 식별합니다.
- 이미징 소프트웨어에서 각 채널의 게인 및 노출 시간을 조정합니다.
- 각 채널에서 전체 조직의 이미지 (현미경 및 사용 된 소프트웨어에 따라 자동 또는 수동)를 찍고 개별 타일을 병합하여 전체 TA 단면의 복합체를 만듭니다.
참고: 동일한 TA의 두 개 또는 세 개의 서로 다른 섹션의 이미지를 서로 다른 깊이에서 촬영하는 것이 좋습니다. 각 절편에서 지방세포를 정량화한 다음, 평균을 보고함으로써, 예를 들어 주사 오류로 인한 근육내 지방의 양의 국부적인 차이를 피할 수 있을 것이다.
9. 지방세포 정량화
- 이전에 설치되지 않은 경우 셀 카운터 플러그인을 ImageJ(https://imagej.nih.gov/ij/plugins/cell-counter.html)에 추가합니다.
- 이미지를 ImageJ로 TIF 파일 또는 원본 현미경 파일로 가져옵니다. ImageJ의 각 채널을 별도의 TIF 파일로 봅니다.
참고: LIF 또는 유사한 현미경 파일 형식을 사용하는 경우 바이오 형식 가져오기 옵션에서 스택 보기용 하이퍼스택을 선택하고 채널 분할 확인란을 선택합니다. 확인을 클릭하여 파일을 엽니다. 또한 자동 크기 조정 상자가 선택 취소되어 있는지 확인합니다. - 각 채널의 이미지가 8비트 형식(및 회색)인지 확인: 이미지 > 유형> 8비트입니다.
- DAPI(파란색), GFP(녹색), 페리리핀(빨간색) 및 팔로이드인(회색) 이미지를 병합: 색상 > 채널 병합> 이미지.
- 배율(분석 > 배율 설정)이 미크론 단위인지 확인합니다. 자유형 선택 도구를 사용하여 각 단면의 부상 및 부상 부위를 윤곽을 그린 다음 측정 (분석 > 측정)하고 부상당한 부위와 부상 당하지 않은 부분을 스프레드 시트에 기록하십시오.
참고: 손상된 근육은 근섬유가 없는 부위 또는 중앙에 위치한 핵을 포함하는 근섬유가 서식하는 영역으로 확인될 수 있습니다. - 셀 카운터 시작: CellCounter> 플러그인이 초기화>니다.
- 카운터 유형을 선택한 다음 각 지방세포를 계산하십시오. 스프레드 시트에 지방세포의 총 수를 기록 한 다음 부상당한 부위의 1mm2 당 지방 세포 수를 계산하십시오.
10. RT-qPCR을 이용한 아디포겐 유전자 발현 분석
- RNA 분리
- 시작하기 전에 RNase가 없는 물을 45°C로 예열하고 신선한 70% EtOH(샘플 당 350μL)를 제조하였다.
- 1,000 μL의 구아니듐 티오시아네이트를 샘플이 들어있는 각 튜브에 첨가한다(단계 3.12 참조). 비드 비터 승인 튜브를 사용하는 것이 중요합니다.
주의: 구아니듐 티오시아네이트는 독성이 있습니다. 적절한 개인 보호 장비를 착용하고 흄 후드에 손잡이를 착용하십시오. - 세 개의 중간 비드 또는 하나의 크고 하나의 작은 비드를 각 튜브에 추가하십시오.
- 비드 비터를 사용하여 2-4분 동안 50 Hz에서 조직을 균질화한다. 조직 유형과 샘플 크기에 따라 최대 10분이 소요될 수 있습니다.
- 클로로포름 200μL를 첨가한다.
주의: 클로로포름은 독성이 있습니다. 개인 보호 장비를 착용하고 흄 후드에 손잡이를 착용하십시오. - 샘플을 15초 동안 흔들어 줍니다. RT에서 2-3분 동안 배양한다.
- 12,000 x g에서 15분 동안 원심분리한다. 350 μL의 투명한 상층액(RNA를 함유하는 상층)을 피펫팅하고, 350 μL의 70% 에탄올을 함유하는 새로운 마이크로원심분리 튜브에 첨가한다. 하부 단백질 및/또는 DNA 층을 흡인하지 않도록 주의하십시오.
- 최대 700 μL의 혼합물을 2 mL 수집 튜브에 넣은 미니 스핀 컬럼으로 옮긴다. 제조업체의 지침에 따라 RNA 분리를 계속하십시오.
- 예상 수율에 따라 30-50 μL의 RNase-free 물로 희석하십시오. RNA를 얼음 위에 보관하고 분광 광도계를 사용하여 수율을 측정하십시오. 보관된 RNA를 -80°C에서 유지하십시오.
참고: RNA 층의 상부 350 μL만을 조심스럽게 떼어내는 것이 DNA 오염을 방지하기에 충분하기 때문에 DNase 처리 단계를 생략할 수 있다. RT-qPCR 분석 외에도 분리된 RNA를 RNA 시퀀싱에 사용할 수 있으며, 이 경우 DNase 처리 단계를 적극 권장합니다.
- cDNA 합성
- 최대 1μg의 RNA를 사용하여 cDNA를 cDNA 합성 키트로 합성하고 제조업체의 지침에 따라 cDNA를 합성합니다.
- 실행이 완료된 후, RNase-free 물 80 μL를 첨가한다. 샘플을 -20°C에서 보관한다.
- 지방세포-선택적 유전자의 RT-qPCR이다.
- 384-웰 포맷을 사용하여, 1 μL의 프라이머 (∼1 μM 최종 농도)를 각 웰의 바닥에 첨가한다. 프라이머 사전 건조는 더 엄격한 기술적 반복실험을 초래합니다. 프라이머가 완전히 증발할 때까지 덮어 둡니다(플레이트는 증발 속도를 높이기 위해 37°C로 설정된 가열 블록 상에 놓일 수 있음).
- 다음과 같이 4 ~ 8 개의 기술적 반복실험으로 샘플 반응을 설정하십시오 : 염료 기반 RT-PCR 마스터 믹스 2.5 μL, RNase가없는 물 2.1 μL, 웰 당 총 부피 5 μL의 cDNA (~ 1 ng) 0.4 μL. 다음과 같은 열 사이클링 조건이 사용되었습니다 : 95 °C에서 15 초 동안 변성하고 60 °C에서 40 사이클 동안 25 초 동안 어닐링 / 연장.
- 여기에 기술된 바와 같이 ΔΔCT를 계산함으로써 하우스 키핑 유전자 (즉, Hprt 및 Pde12) 수준에 대한 원시 CT (주기 역치) 값을 정규화한다38. 프라이머 서열에 대해서는20 을 참조한다.
참고: RT-qPCR 분석을 위한 표준 관행은 마이너스 역전사(-RT) 대조군의 사용, PCR 반응 및 프라이머 검증과 같은 준수되어야 합니다.
결과
근육 내 지방의 면역 형광 시각화
상기 단계 및 도 1A를 관찰한 후, TA 조직 절편을 글리세롤 손상 후 21일째로부터 수집하였고, 이는 LN2-냉각된 이소펜탄에서 수확 직후에 스냅-냉동되거나 또는 2.5시간 동안 4% PFA에 고정되었다. 두 샘플을 동결절제하고 염색한 후, TA의 가장 큰 영역인 중간 배에서 이미지를 촬영하였다. 고정되지 않은 TAs로부터의 PERILIPIN+ 지방세포(그림 1B)는 고정된 절편(그림 1C)에 비해 형태학을 상당히 변화시켰기 때문에, 이들의 식별, 시각화 및 후속 정량화가 훨씬 더 어렵고 잠재적으로 부정확하다. 참고로, 첫 번째 PERILIPIN+ 지질 방울은 손상 후 약 5일 후에 검출되었으며, 대부분의 지방세포는 7일째까지 형성되었다. 부상 후 21 일까지 지방세포는 완전히 성숙했습니다.
TA 당 지방의 양은 유도 된 손상의 중증도와 강하게 상관 관계가 있기 때문에 TA는 근육 내 지방 형성을 효과적으로 관찰하고 연구하기 위해 크게 부상 당해야합니다. 사체 TA에 잉크를 사용하여 주사를 연습하는 것은 부상의 심각성을 향상시키는 좋은 방법입니다. 성공적인 부상은 근육의 50 % 이상인 경향이 있습니다. 참고로, 근육의 부상당한 영역은 근육 섬유가 없는 영역 또는 재생 근육 섬유의 알려진 특징인 적어도 하나의 중앙에 위치한 핵을 포함하는 근육 섬유에 의해 채워지는 영역을 나타낸다.
이 프로토콜은 3D에서 FAP와 지방에 대한 염색에 쉽게 적응할 수 있습니다. 이를 위해, TA 후-고정으로부터 다중 근섬유를 조심스럽게 분리하고, 이어서 전체 마운트 면역형광을 수득하였다. 핵심은 섬유를 유리 슬라이드에 적절하게 고정시키고 동시에 조직의 과도한 압축을 피하는 것입니다. 성형 가능한 점토 발을 사용하여 사용자는 필요한 두께를 조정하고 커버 슬립을 슬라이드에 고정시킬 수 있으며 거꾸로 된 현미경을 사용할 수도 있습니다 (그림 4A). 이 방법은 PDGFRα+ FAPs, Phalloidin+ 근섬유, 및 PERILIPIN-발현 지방세포를 표지하는데 성공적으로 사용되었다(도 4B, 보충 비디오 1 및 보충 비디오 2). 두께가 최대 150μm에 달하는 여러 z-평면에서 이미지를 얻은 후 현미경 소프트웨어 내의 3D 렌더링 모듈을 사용하여 3D 재구성을 만들었습니다.
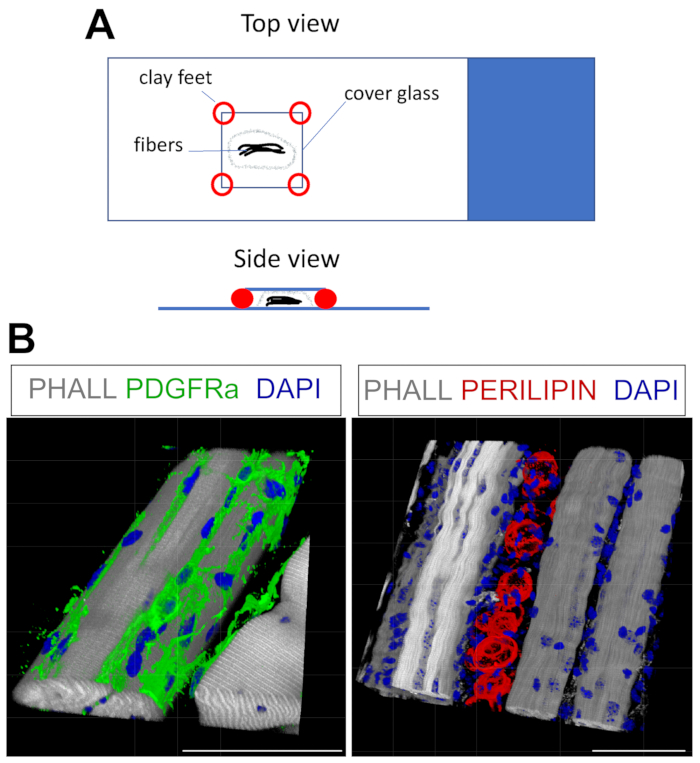
도 4: 전체 마운트 면역형광 염색. (A) 샘플을 장착하고 전체 마운트 염색을 위한 커버슬립을 추가하는 방법에 대한 상단 및 측면도. (B) FAP (녹색; 왼쪽) 및 지방 세포 (빨간색, 오른쪽)와 근섬유 (회색) 및 핵 (파란색)의 대표적인 3D 재구성. 배율 막대: 50μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
근육 내 지방의 정량화
근육내 지방의 이미지를 촬영한 후, ImageJ/FIJI의 세포 카운터 기능을 사용하여 PERLIPIN+ 지방세포의 수를 수동으로 계산했습니다(그림 5A). 다음으로, 근섬유 내의 중앙에 위치하는 핵에 의해 정의된 손상 부위뿐만 아니라 근육 절편의 전체 면적을 결정하였다. 손상 중증도를 조절하기 위해, 지방세포의 총 수를 부상당한 부위로 나누어 부상당한 근육의 1mm2 당 지방 세포의 수를 초래하였다. 일반적으로 <30 % 부상을 나타내는 TA는 정량화에서 제외됩니다. 참고로, 지방세포는 횡단면적 당 0에서 여덟 개에 이르는 손상없이 드물지만 지방세포의 총 수는 여전히 전체 면적에 의해 정상화됩니다. 도 5B에서 강조된 바와 같이, 글리세롤 손상은 손상되지 않은 TA 근육에 비해 엄청난 양의 근육내 지방을 유발한다. 대안으로, 페리리핀 염색은 높은 신호 대 잡음비로 매우 깨끗하기 때문에, 입자 분석 기능을 사용하여 페리핀이 차지하는 전체 면적을 결정할 수도 있다. 그러나, 이 방법은 더 작은 대 더 적은 지방세포를 구별할 수 없을 것이다. 최소 네 마리의 개별 동물로부터 최대 세 개의 절편을 영상화하고 정량화하였으며, 마우스당 존재하는 지방 세포의 평균 수가 보고되었다.
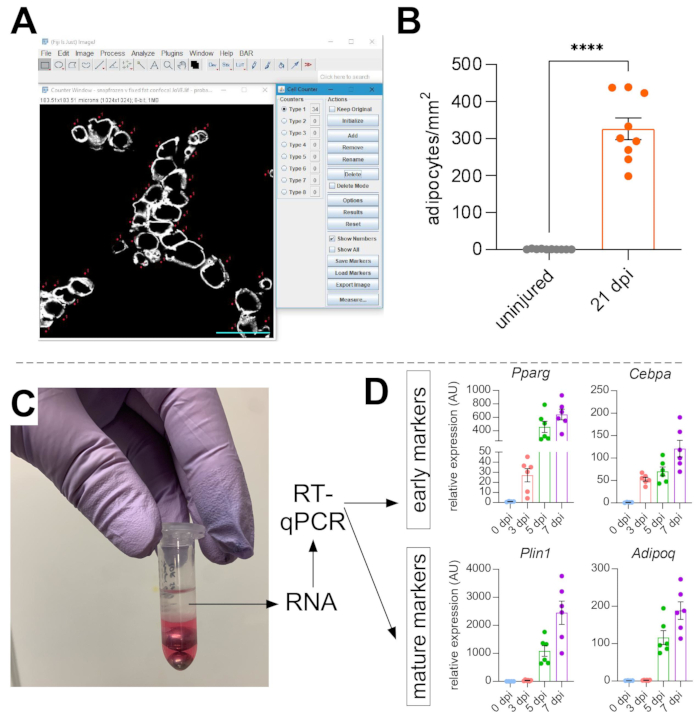
그림 5: 근육내 지방의 정량화 . (A) ImageJ에서 Cell Counter 기능을 사용하여 PERILIPIN+ 지방세포(흰색)를 계수하는 방법의 대표적인 이미지. 스케일 바: 50 μm. (B) 글리세롤 주사 후 21일간 전체 TA 지방세포 정량화는 손상된 부위의 1mm2 로 정규화되었다. 각 점은 한 마우스의 평균을 나타냅니다. SEM으로 표시된 오류 막대. **** = p < 0.0001입니다. (c) 클로로포름에 의한 균질화 및 후속 상분리 후의 RNA 층은 RT-qPCR 분석에 사용되고 있다. (d) 초기 아디포제닉 유전자인 Pparg 및 Cepbα, 및 글리세롤 손상 후 상이한 시점에서 두 개의 성숙한 지방세포 마커인 Plin1 및 Adipoq 의 발현 수준의 변화를 폴드한다. 각 점은 한 마우스의 평균을 나타냅니다. 오류 막대가 SEM으로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
독립적으로 존재하는 근육내 지방의 양을 확인하기 위해, 다양한 아디포제닉 마커의 유전자 발현 수준이 결정될 수 있다. 이를 위해, RNA는 손상 후 상이한 지점에서 면역형광에 사용되는 동일한 TA 근육의 일부로부터 단리될 수 있다(상기 단계 참조). 비드 비터는 조직을 균질화하기 위해 구아니듐 티오시아네이트와 조합하여 사용되었다. 클로로포름을 첨가한 후 원심분리한 후, 상부 RNA 함유층을 조심스럽게 추출하고, 미니 스핀 컬럼을 RNA 클린업에 사용하였다(도 5C). 이 방법은 RT-qPCR 및 RNAseq와 같은 모든 다운스트림 분석에 적합한 고품질의 RNA를 일상적으로 생산합니다. RT-qPCR의 경우, 하우스키핑 유전자에 대한 아디포제닉의 상대적 발현 수준을 결정하고, 임의의 상대적 변화를 ΔΔCT 방법38에 따라 평가하였다. 도 5D에 기재된 바와 같이, 손상되지 않은 TA 근육과 비교하여, 글리세롤 손상은 손상 후 3일 이내에 Pparg 및 Cebpα와 같은 초기 아디포제닉 마커의 발현을 유도한다. 성숙 마커, 예컨대 아디포넥틴 (Adipoq) 및 페리리핀 (Plin1)은 글리세롤 손상 후 5일 이내에 검출될 수 있다.
지방세포의 유전 혈통 추적
여기에 제시된 지방세포 염색 프로토콜은 FAP의 유전적 혈통 추적을 포함하도록 쉽게 적응될 수 있으며, 그들의 운명을 지방세포로 지도화하고 따라갈 수 있다. 우리는 예를 들어, 재조합이 PdgfrαCreERT2에서 타목시펜 투여를 통해 유도될 수 있다는 것을 이전에 입증하였다; Rosa26 EYFP 마우스는 손상 2주 전에, 플록스 정지 코딩을 효과적으로 제거하고 FAPs에서 EYFP 발현을 불가분하게 활성화시켰다(도 6A). 우리는 여기에 제시된 타목시펜 요법으로 높은 재결합 효율을 달성했으며, PDGFRα + FAP의 ~ 75 %가 EYFP20을 발현하며 다른 실험실에서 27,39,40을보고한 것과 유사합니다. FAP가 실제로 근육 내 지방의 세포 기원임을 입증하면서, 대부분의 FAP는 글리세롤 손상 후 7 일 후에 EYFP+ PERILIPIN을 발현하는 지방세포로 변했습니다 (그림 6B).
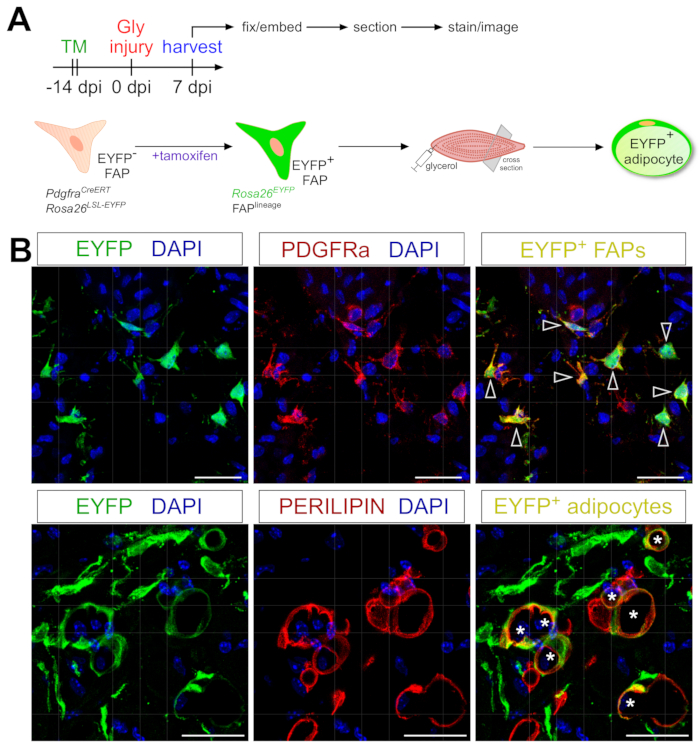
그림 6: FAP의 계보 추적. (A) 실험 설정의 개략적인 개요. (B) PDGFRα+ FAP(적색, 화살촉) 및 PERILIPIN+ 지방세포(적색, 별표) 내에서 EYFP(황색)의 성공적인 재조합 및 활성화를 보여주는 대표적인 면역형광 이미지. 스케일 바: 25 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
여러 세포 유형의 검출
이 프로토콜은 또한 근인성 구획을 시각화하는데 사용될 수 있다. PAX7 및 MYOD1에 대한 항체를 사용하여, 근육 줄기 세포 (MuSCs) 및 근모세포는 각각 PFA 고정 근육 조직 절편에서도 글리세롤 손상 후 5일 후에 쉽게 검출될 수 있다(도 7). 따라서, 제시된 프로토콜은 다재다능하고 표지 및 이미지 지방세포 및 FAPs뿐만 아니라 근인성 혈통의 다른 세포 유형에도 적응할 수 있다.
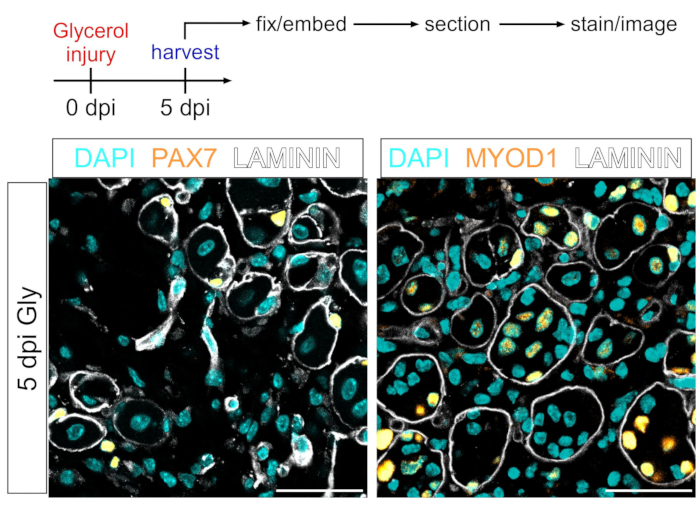
도 7: 근육줄기세포 및 근원세포 면역형광 염색 . (A) 실험 설정의 개략적인 개요. (b) 근육 줄기세포(MuSC)를 PAX7로 염색하고 근모세포(노란색, 오른쪽)를 MYOD1로 성공적으로 염색한 것을 보여주는 대표적인 면역형광 이미지. LAMININ은 근섬유 (흰색)를 윤곽을 그리며 핵은 시안색입니다. 배율 막대: 50μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 비디오 1 : FAP의 3D 렌더링. 근섬유, FAPs 및 핵의 입체 재구성은 각각 손상 후 21일째에 PHALLOIDIN(회색), PDGFRα(녹색) 및 DAPI(파란색)에 대해 염색하였다. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
보충 비디오 2 : 근육 내 지방의 3D 렌더링. 글리세롤 손상 후 21 일 동안 근섬유를 대체 한 근섬유 다발 (회색, PHALLOIDIN)과 근육 내 지방 (적색, PERILIPIN)의 체적 렌더링. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
토론
이 프로토콜은 근육 내 지방의 효율적인 시각화와 엄격한 정량화를 가능하게하는 광범위하고 상세한 프로토콜을 설명합니다. 동일한 근육을 두 부분으로 나눠서 하나는 면역 형광에 사용하고 다른 하나는 RT-qPCR 분석에 사용되는이 프로토콜은 매우 다양합니다. 또한 FAP의 유전 적 계보 추적과 결합하여 특정 조건 하에서 지방세포로의 전환을 연구 할 수 있으며 여러 추가 세포 유형을 표지하고 이미지화하는 데 매우 적응할 수 있습니다.
근육 내 지방을 시각화하는 가장 일반적으로 사용되는 방법은 파라핀 절편에 이어 헤마톡실린 및 에오신 염색 또는 Oil Red O (ORO)와 같은 친유성 염료에 대해 염색 된 냉동 섹션입니다. 그러나, 파라핀 처리 조직은 최상의 조직학을 유지하지만, 동일한 과정은 또한 친유성 염료의 사용을 막는 모든 지질을 추출한다. 친유성 염색 방법이 PFA 고정 및 고정되지 않은 조직 절편 모두에서 작동하지만, 지질 방울은 커버 슬립에 압력을 가하여 쉽게 변위되어 근육 내 지방의 공간 분포를 왜곡시킵니다. 이를 피하기 위해 최근 연구는 전체 마운트 접근법을 사용하여 ORO + 지방세포를 시각화하기위한 엄격한 프로토콜을 수립했습니다. 이를 위해, 저자들은 TA를 탈세포화하여 전체TA41에 걸친 근육내 지방의 공간적 분포를 시각화하였다. 이 기술이 강력한만큼, 그것은 또한 추가적인 세포 구조를 표시하기 위해 다른 공동 염색의 사용을 방지합니다. 여기에 제시된 전체 마운트 면역형광 접근법은 세포 환경의 미세 매핑을 허용하는 다양한 마커와 함께 지방세포를 공동염색하는데 사용될 수 있다. 그러나 한 가지 주요 과제는 항체의 조직 침투입니다. 섬유가 함께 유지될수록, 항체가 이용가능한 모든 항원에 동등하게 침투하고 결합하는 것이 더 어려워질 것이다. 따라서이 방법은 작은 섬유 그룹을 볼 때 가장 효과적입니다. 동시에, 이것은 또한 작고 벗겨진 섬유 다발에만 초점을 맞출 때 근육 내 지방의 전반적인 해부학 적 위치가 손실되기 때문에 한계가 있습니다. 그러나 새로운 조직 제거 방법과 새로운 이미징 기술의 현재 개발로 인해 향후42,43,44에서 더 큰 조직 침투 및 시각화가 가능할 것입니다.
근육 조직의 사전 고정은 지방 세포 형태를 보존하지만, 근육 건강의 중요한 측정 인 근섬유의 크기를 평가하는 도전 과제를 만듭니다. Myofiber 크기는 근섬유의 단면적을 측정함으로써 결정된다. 우리는 이전에 근육 조직의 사전 고정으로 인해 근섬유를 윤곽을 그리는 데 사용할 수있는 대부분의 마커가 실패하게된다고보고했습니다 31. 이러한 장애물을 극복하기 위해, 우리는 고정된 근육 섹션(31)에서도 근섬유 크기를 측정할 수 있는 새로운 이미지 세분화 파이프라인을 개발했습니다. 따라서 우리는이 프로토콜과 결합하여 근육 조직의 사전 고정으로 인한 대부분의 단점을 극복하는 강력하고 효율적인 조직 처리 파이프 라인을 구축했습니다.
이 접근법의 또 다른 주요 장점은 다재다능성입니다. TA를 두 부분으로 나눔으로써 하나의 근육으로부터 얻을 수 있는 정보의 양이 최대화된다. 이것은 동물 수를 줄일뿐만 아니라 유전자 발현을 통해 조직학을 확인함으로써 추가 제어 층을 추가하고 그 반대의 경우도 마찬가지입니다. 또한, 많은 다른 유전자가 아디포겐 유전자를 넘어 검사 될 수 있습니다. 단리된 RNA는 또한 전체 근육 RNAseq 실험에 사용될 수 있다. 마지막으로, 스냅 냉동 근육 조각은 단백질 작업에도 사용할 수 있습니다. 이 프로토콜의 한 가지 한계는 부상이 TA의 전체 길이에 걸쳐 일관되지 않을 가능성입니다. 이것은 두 근육 부분이 포함 된 근육 내 지방의 양에서 분기하는 시나리오로 이어질 수 있으며 하류 분석에서 그러한 샘플을 제외 할 수 있습니다. 따라서 RT-qPCR에 의존하여 근육 내 지방의 양에 대한 주요 결론을 도출하는 것이 아니라 조직 학적 정량화를지지하는 데이터로 사용하는 것이 좋습니다.
함께,이 프로토콜은 지방 섬유증과 싸우기위한 새로운 치료 옵션을 개발하는 첫 번째 단계 인 근육 내 지방의 시각화 및 정량화를 가능하게하는 강력하고 효율적이며 엄격한 조직 처리 파이프 라인을 설명합니다. 동시에, 그것은 다재다능하며 근육 내의 많은 다른 세포 유형뿐만 아니라 다른 조직의 지방세포에 적응할 수 있습니다.
공개
저자는 경쟁 이익이 없다고 선언합니다.
감사의 말
데이터 수집과 원고의 비판적 읽기를 도와 주신 Kopinke 연구소 회원들에게 감사드립니다. 우리는 또한 원고에 대한 귀중한 의견을 주신 플로리다 대학의 Myology Institute 회원들에게 감사드립니다. 이 작업은 NIH 보조금 1R01AR079449에 의해 지원되었습니다. 도 2는 바이오렌더로 작성하였다.
자료
| Name | Company | Catalog Number | Comments |
| 16% PFA (Pack of 12, 10 mL bottles) | Electron Miscroscopy Sciences | 15710 | |
| 2.0 mL Microcentrifuge Tubes | Fisher Scientific | 05-408-138 | microcentrifuge tubes for snapfreezing/bead beating |
| 2-Methylbutane (4 L) | Fisher Chemical | O3551-4 | isopentane |
| Absolute Ethanol (200 proof) | ThermoFisher Scientific | BP2818100 | |
| AffiniPure Fab fragment donkey anti-mouse | Jackson ImmunoResearch | 715-007-003 | mouse-on-mouse blocking |
| Alexa Fluor 488 donkey anti-chicken secondary antibody | Jackson ImmunoResearch | 703-545-155 | |
| Alexa Fluor 488 donkey anti-mouse secondary antibody | Invitrogen | A21202 | |
| Alexa Fluor 488 donkey anti-rabbit secondary antibody | Invitrogen | A21206 | |
| Alexa Fluor 568 donkey anti-goat secondary antibody | Invitrogen | A11057 | |
| Alexa Fluor 568 donkey anti-rabbit secondary antibody | Invitrogen | A11037 | |
| Alexa Fluor 568 Phalloidin antibody | Invitrogen | A12380 | Dissolved in 1.5 mL methanol (~66 µM working solution) |
| BioLite 24-well Multidishes | ThermoFisher Scientific | 930186 | 24 well plate for PFA tissue incubation |
| Biometra TOne | analytikjena | 8462070301 | Thermal cycler |
| Chicken anti-GFP antibody | Aves Labs | GFP-1020 | |
| Chloroform/isoamyl alcohol 24:1(v/v) for molecular biology, DNAse, RNAse, and Protease free | ThermoFisher Scientific | AC327155000 | |
| Corn oil | Sigma Aldrich | C8267 | |
| DAPI stain | Invitrogen | D1306 | 150 µM working solution in dH2O |
| Donkey Serum (100 mL) | Millipore Sigma | 5058837 | for blocking solution |
| Dumont #5 Forceps | Fine Science Tools | 11251-20 | sharp-tipped tweezers |
| Fine Scissors Straight 9 cm | Fine Science Tools | 14060-09 | |
| Fluoromount-G | SouthernBiotech | 0100-01 | mounting medium |
| Glycerol, 99.5%, for molecular biology (500 mL) | Acros Organics | 327255000 | |
| Goat anti-PDGFRα antibody | R&D | AF1062 | |
| Hybridization Oven | VWR | 230301V | for Tamoxifen incubation |
| ImmEdge Hydrophobic Barrier PAP Pen | Vector Laboratories | H-4000 | hydrophobic pen |
| Insulin Syringe with Micro-Fine IV needle (28 G) | BD | 329461 | |
| Insulin Syringe with Slip Tip, 1 mL | BD | 329654 | Insulin syringe without needle, for oral gavaging |
| iScript cDNA Synthesis Kit | Bio-Rad | 1708890 | |
| Isoflurane | Patterson Veterinary | 78938441 | |
| Leica DMi8 inverted microscope | Leica | micrscope used for widefield IF and confocal imaging | |
| Micro Slides | VWR | 48311-703 | positively charged microscope slides |
| mouse anti-MYOD antibody | Invitrogen | MA1-41017 | |
| mouse anti-PAX7 antibody (supernatant) | DSHB | AB 428528 | |
| MX35 Premier+ Microtome blades | ThermoFisher Scientific | 3052835 | microtome blades |
| NanoDrop 2000 Spectrophotometer | ThermoFisher Scientific | ND2000 | spectrophotometer for RNA yield |
| Play-Doh | Hasbro | modeling compound | |
| PowerUp SYBR Green Master Mix | ThermoFisher Scientific | A25742 | green dye PCR master mix |
| Puralube Vet Ointment | Puralube | 17033-211-38 | vet ophthalmic ointment |
| QuantStudi 6 Flex Real-Time 384-well PCR System | Applied Biosystems | 4485694 | qPCR machine |
| Rabbit anti-perilipin antibody | Cell Signaling Technology | 9349S | |
| Red-Rotor Shaker | Hoefer Scientific | PR70-115V | shaker for IF staining |
| Richard-Allan Scientific Slip-Rite Cover Glass | ThermoFisher Scientific | 152460 | coverslips |
| RNeasy Mini Kit | QIAGEN | 74106 | contains mini spin columns |
| Safe-Lock Tubes 1.5 ml, natural | Eppendorf | 22363204 | |
| Sample Tubes RB (2 mL) | QIAGEN | 990381 | |
| Sodium azide | Alfa Aesar | 14314 | |
| Stainless Steel Beads, 2.8 mm | Precellys | KT03961-1-101.BK | small beads |
| Stainless Steel Beads, 5 mm | QIAGEN | 69989 | medium beads |
| Stainless Steel Beads, 7 mm | QIAGEN | 69990 | large beads |
| Stainless Steel Disposable Scalpels | Miltex | 327-4102 | scalpel |
| Stainless steel feeding tube, 20 G x 38 mm, straight | Instech Laboratories | FTSS-20S-3 | gavage needle |
| Tamoxifen | Toronto Research Chemicals | T006000 | |
| Tissue Plus O.C.T. Compound | Fisher HealthCare | 4585 | embedding medium |
| TissueLyser LT | QIAGEN | 85600 | bead beater |
| TissueLyser LT Adapter, 12-Tube | QIAGEN | 69980 | |
| Tissue-Tek Cryomold | Sakura | 4566 | specimen molds |
| Triton X-100 | Alfa Aesar | A16046 | |
| TRIzol Reagent | ThermoFisher Scientific | 15596026 | guanidium thiocyanate |
| Tween20 (500 mL) | Fisher BioReagents | BP337-500 | |
| VWR Micro Slides - Superfrost Plus | VWR | 48311703 | |
| Wheaton Coplin staining jars | Millipore Sigma | S6016 | Coplin jar |
참고문헌
- Milad, N., et al. Increased plasma lipid levels exacerbate muscle pathology in the mdx mouse model of Duchenne muscular dystrophy. Skeletal Muscle. 7 (1), 19 (2017).
- Goodpaster, B. H., et al. Obesity, regional body fat distribution, and the metabolic syndrome in older men and women. Archives of Internal Medicine. 165 (7), 777-783 (2005).
- Goodpaster, B. H., et al. Association between regional adipose tissue distribution and both type 2 diabetes and impaired glucose tolerance in elderly men and women. Diabetes Care. 26 (2), 372-379 (2003).
- Goodpaster, B. H., et al. The loss of skeletal muscle strength, mass, and quality in older adults: the health, aging and body composition study. The Journals of Gerontology, Series A: Biological Sciences and Medical Sciences. 61 (10), 1059-1064 (2006).
- Goodpaster, B. H., Thaete, F. L., Kelley, D. E. Thigh adipose tissue distribution is associated with insulin resistance in obesity and in type 2 diabetes mellitus. American Journal of Clinical Nutrition. 71 (4), 885-892 (2000).
- Goodpaster, B. H., Theriault, R., Watkins, S. C., Kelley, D. E. Intramuscular lipid content is increased in obesity and decreased by weight loss. Metabolism. 49 (4), 467-472 (2000).
- Burakiewicz, J., et al. Quantifying fat replacement of muscle by quantitative MRI in muscular dystrophy. Journal of Neurology. 264 (10), 2053-2067 (2017).
- Murphy, W. A., Totty, W. G., Carroll, J. E. MRI of normal and pathologic skeletal muscle. American Journal of Roentgenology. 146 (3), 565-574 (1986).
- Willcocks, R. J., et al. Multicenter prospective longitudinal study of magnetic resonance biomarkers in a large duchenne muscular dystrophy cohort. Annals of Neurology. 79 (4), 535-547 (2016).
- Wokke, B. H., et al. Quantitative MRI and strength measurements in the assessment of muscle quality in Duchenne muscular dystrophy. Neuromuscular Disorders. 24 (5), 409-416 (2014).
- Contreras, O., Rossi, F. M. V., Theret, M. Origins, potency, and heterogeneity of skeletal muscle fibro-adipogenic progenitors-time for new definitions. Skeletal Muscle. 11 (1), 16 (2021).
- El Agha, E., et al. Mesenchymal stem cells in fibrotic disease. Cell Stem Cell. 21 (2), 166-177 (2017).
- Joe, A. W., et al. Muscle injury activates resident fibro/adipogenic progenitors that facilitate myogenesis. Nature Cell Biology. 12 (2), 153-163 (2010).
- Liu, W., Liu, Y., Lai, X., Kuang, S. Intramuscular adipose is derived from a non-Pax3 lineage and required for efficient regeneration of skeletal muscles. Developmental Biology. 361 (1), 27-38 (2012).
- Scott, R. W., Arostegui, M., Schweitzer, R., Rossi, F. M. V., Underhill, T. M. Hic1 defines quiescent mesenchymal progenitor subpopulations with distinct functions and fates in skeletal muscle regeneration. Cell Stem Cell. 25 (6), 797-813 (2019).
- Uezumi, A., et al. Fibrosis and adipogenesis originate from a common mesenchymal progenitor in skeletal muscle. Journal of Cell Science. 124, 3654-3664 (2011).
- Hogarth, M. W., et al. Fibroadipogenic progenitors are responsible for muscle loss in limb girdle muscular dystrophy 2B. Nature Communications. 10 (1), 2430 (2019).
- Uezumi, A., Fukada, S., Yamamoto, N., Takeda, S., Tsuchida, K. Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle. Nature Cell Biology. 12 (2), 143-152 (2010).
- Stumm, J., et al. Odd skipped-related 1 (Osr1) identifies muscle-interstitial fibro-adipogenic progenitors (FAPs) activated by acute injury. Stem Cell Research. 32, 8-16 (2018).
- Kopinke, D., Roberson, E. C., Reiter, J. F. Ciliary Hedgehog signaling restricts injury-induced adipogenesis. Cell. 170 (2), 340-351 (2017).
- Huang, Y., Das, A. K., Yang, Q. Y., Zhu, M. J., Du, M. Zfp423 promotes adipogenic differentiation of bovine stromal vascular cells. PLoS One. 7 (10), 47496 (2012).
- Sun, Y. -. M., et al. PDGFRα regulated by miR-34a and FoxO1 promotes adipogenesis in porcine intramuscular preadipocytes through Erk signaling pathway. International Journal of Molecular Sciences. 18 (11), 2424 (2017).
- Te, L. J. I., Doherty, C., Correa, J., Batt, J. Identification, isolation, and characterization of fibro-adipogenic progenitors (FAPs) and myogenic progenitors (MPs) in skeletal muscle in the rat. Journal of Visualized Experiments: JoVE. (172), e61750 (2021).
- Lukjanenko, L., et al. Aging disrupts muscle stem cell function by impairing matricellular WISP1 secretion from fibro-adipogenic progenitors. Cell Stem Cell. 24 (3), 433-446 (2019).
- Santini, M. P., et al. Tissue-resident PDGFRalpha(+) progenitor cells contribute to fibrosis versus healing in a context- and spatiotemporally dependent manner. Cell Reports. 30 (2), 555-570 (2020).
- Uezumi, A., et al. Identification and characterization of PDGFRalpha+ mesenchymal progenitors in human skeletal muscle. Cell Death & Disease. 5, 1186 (2014).
- Wosczyna, M. N., et al. Mesenchymal stromal cells are required for regeneration and homeostatic maintenance of skeletal muscle. Cell Reports. 27 (7), 2029-2035 (2019).
- Soliman, H., et al. Pathogenic potential of Hic1-expressing cardiac stromal progenitors. Cell Stem Cell. 26 (2), 205-220 (2020).
- Chung, M. I., Bujnis, M., Barkauskas, C. E., Kobayashi, Y., Hogan, B. L. M. Niche-mediated BMP/SMAD signaling regulates lung alveolar stem cell proliferation and differentiation. Development. 145 (9), (2018).
- Hilgendorf, K. I., et al. Omega-3 fatty acids activate ciliary FFAR4 to control adipogenesis. Cell. 179 (6), 1289-1305 (2019).
- Waisman, A., Norris, A. M., Elías Costa, M., Kopinke, D. Automatic and unbiased segmentation and quantification of myofibers in skeletal muscle. Scientific Reports. 11 (1), 11793 (2021).
- Kang, S. H., Fukaya, M., Yang, J. K., Rothstein, J. D., Bergles, D. E. NG2+ CNS glial progenitors remain committed to the oligodendrocyte lineage in postnatal life and following neurodegeneration. Neuron. 68 (4), 668-681 (2010).
- Srinivas, S., et al. Cre reporter strains produced by targeted insertion of EYFP and ECFP into the ROSA26 locus. BMC Developmental Biology. 1, 4 (2001).
- Lukjanenko, L., Brachat, S., Pierrel, E., Lach-Trifilieff, E., Feige, J. N. Genomic profiling reveals that transient adipogenic activation is a hallmark of mouse models of skeletal muscle regeneration. PLoS One. 8 (8), 71084 (2013).
- Mahdy, M. A., Lei, H. Y., Wakamatsu, J., Hosaka, Y. Z., Nishimura, T. Comparative study of muscle regeneration following cardiotoxin and glycerol injury. Annals of Anatomy = Anatomischer Anzeiger: Official Organ of the Anatomische Gesellscaft. 202, 18-27 (2015).
- Pisani, D. F., Bottema, C. D., Butori, C., Dani, C., Dechesne, C. A. Mouse model of skeletal muscle adiposity: a glycerol treatment approach. Biochemical and Biophysical Research Communications. 396 (3), 767-773 (2010).
- Kawai, H., et al. Experimental glycerol myopathy: a histological study. Acta Neuropathologica. 80 (2), 192-197 (1990).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative CT method. Nature Protocols. 3 (6), 1101-1108 (2008).
- Uezumi, A., et al. Mesenchymal Bmp3b expression maintains skeletal muscle integrity and decreases in age-related sarcopenia. The Journal of Clinical Investigation. 131 (1), 139617 (2021).
- Biferali, B., et al. Prdm16-mediated H3K9 methylation controls fibro-adipogenic progenitors identity during skeletal muscle repair. Science Advances. 7 (23), 9371 (2021).
- Biltz, N. K., Meyer, G. A. A novel method for the quantification of fatty infiltration in skeletal muscle. Skeletal Muscle. 7 (1), (2017).
- Vieites-Prado, A., Renier, N. Tissue clearing and 3D imaging in developmental biology. Development. 148 (18), (2021).
- Gómez-Gaviro, M. V., Sanderson, D., Ripoll, J., Desco, M. Biomedical applications of tissue clearing and three-dimensional imaging in health and disease. iScience. 23 (8), 101432 (2020).
- Ueda, H. R., et al. Tissue clearing and its applications in neuroscience. Nature Reviews Neuroscience. 21 (2), 61-79 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유