Method Article
骨格筋における筋肉内脂肪形成とその細胞起源を調べるためのガイド
要約
健康な筋肉組織を筋肉内脂肪で置き換えることは、ヒトの疾患および状態の顕著な特徴である。このプロトコルは、筋肉内脂肪を視覚化、画像化、定量化する方法を概説し、筋肉内脂肪形成の根底にあるメカニズムの厳密な研究を可能にします。
要約
線維脂肪原性前駆細胞(FAP)は、骨格筋の恒常性および再生中に重要な役割を果たす間葉間質細胞である。FAPは、分子筋繊維足場として作用する細胞外マトリックスを構築し、維持する。さらに、FAPは筋幹細胞(MuSC)によって感知される多数の有益な因子を分泌するため、筋線維再生に不可欠です。しかし、罹患状態では、FAPは筋肉内脂肪および線維性瘢痕組織の細胞起源である。この脂肪線維症は、サルコペニアおよびデュシェンヌ型筋ジストロフィーなどの神経筋疾患の特徴である。FAPが筋肉内脂肪に分化する理由と方法を決定する際の重要な障壁の1つは、特に凍結組織切片における脂肪細胞の効果的な保存とその後の視覚化です。スナップ凍結などの骨格筋組織処理の従来の方法は、個々の脂肪細胞の形態を適切に保存せず、それによって正確な視覚化および定量化を妨げる。このハードルを克服するために、骨格筋切片の脂肪細胞形態を保存し、筋肉内脂肪の視覚化、イメージング、定量化を可能にする厳格なプロトコルが開発されました。このプロトコルはまた、RT-qPCRのために筋肉組織の一部を処理する方法を概説し、脂肪生成遺伝子の発現の違いを見ることによって、観察された脂肪形成の変化を確認することを可能にする。さらに、筋肉サンプルの全マウント免疫蛍光によって脂肪細胞を視覚化するように適合させることができる。最後に、このプロトコルは、FAPの脂肪生成変換を研究するために 、Pdgfrα発現FAPの遺伝的系統追跡を実行する方法を概説する。このプロトコルは、RT-qPCRによる確認とともに、脂肪細胞の高解像度で形態学的に正確な免疫蛍光画像を一貫して生成し、筋肉内脂肪の堅牢で厳密で再現性のある視覚化と定量を可能にします。ここで説明する分析パイプラインは、FAPが筋肉内脂肪にどのように分化するかについての理解を深めるための最初のステップであり、脂肪形成を防ぐための新しい介入を検証するためのフレームワークを提供します。
概要
脂肪線維症を伴う健康な筋肉組織の浸潤は、デュシェンヌ型筋ジストロフィー(DMD)および他の神経筋疾患、ならびにサルコペニア、肥満、および糖尿病の顕著な特徴である1,2,3,4,5,6,7,8,9,10 .これらの状態における脂肪浸潤の増加は筋肉機能の低下と強く関連していますが、筋肉内脂肪が形成される理由と方法に関する私たちの知識はまだ限られています。FAPsは、骨格筋を含むほとんどの成人器官に存在する多能性間葉間質細胞集団である11、12。しかし、加齢および慢性疾患において、FAPは線維性瘢痕組織を産生し、脂肪細胞に分化し、個々の筋線維の間に位置し、筋肉内脂肪を形成する13、14、15、16、17、18、19、20を形成する。
筋肉内脂肪形成との戦いを開始するには、FAPが脂肪細胞にどのように変化するかのメカニズムを定義する必要があります。PDGFRαは、複数の種13、16、17、18、20、21、22、23、24、25、26、27の筋肉内のFAPを同定するための分野における「ゴールドスタンダード」マーカーである。その結果、Pdgfrαプロモーターの制御下で、いくつかのマウスタモキシフェン誘導性Cre系統が生成され、Cre-LoxP系を用いてインビボでFAPを遺伝的に操作することが可能になった27、28、29。例えば、この誘導性Cre系統を遺伝子レポーターと組み合わせることにより、FAPsの系統追跡を行うことができ、この戦略を筋肉および白色脂肪組織におけるFAPsの運命マップに適用することに成功した20,30。リネージュトレースに加えて、これらのCreラインはFAPから脂肪への変換を研究するための貴重なツールを提供します。
FAPの筋肉内脂肪への脂肪生成変換のメカニズムを定義する際の1つの大きな障害は、異なる条件下で形成された筋肉内脂肪の量を厳密かつ再現性よく定量する能力である。重要なのは、筋肉と脂肪組織の保存のバランスを取り、これを脂肪細胞を視覚化するための利用可能な染色方法と一致させることです。例えば、骨格筋はしばしば事前の固定なしにスナップ凍結され、筋線維は保存されるが脂肪細胞の形態を破壊する(図1)。対照的に、固定に続いてパラフィン包埋を行うと、脂肪細胞を含む最良の組織組織学を表示しながら、すべての脂質を除去し、それによって一般的に使用される色素オイルレッドOなどのほとんどの親油性色素を使用不能にする。
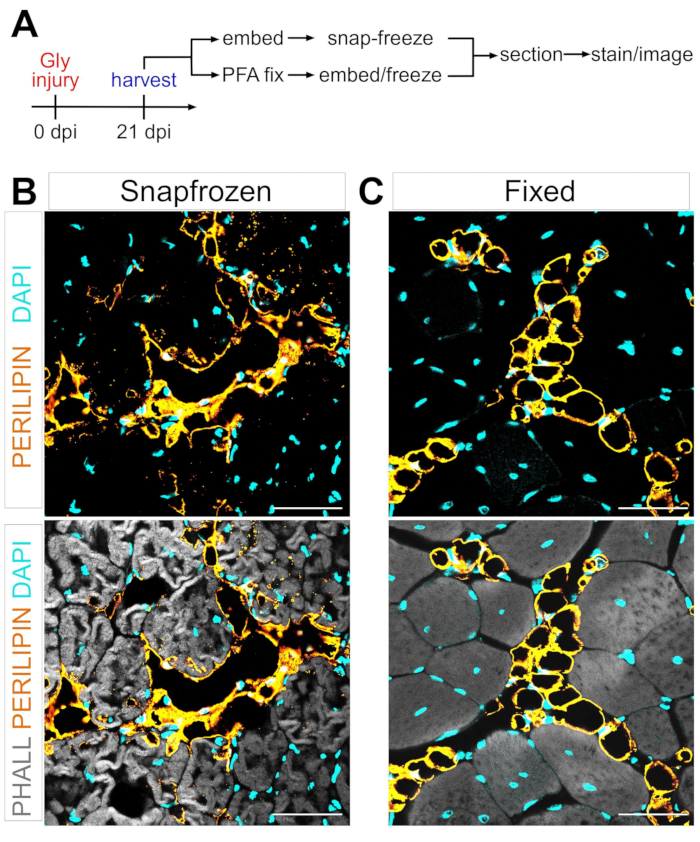
図1:スナップ凍結した筋肉組織と固定された筋肉組織における筋肉内脂肪の代表的な画像。グリセロール損傷後21日目に脂肪細胞(黄色)、筋線維(灰色)、および核(シアン)内の(B)スナップフリーズおよび(C)固定TAsの両方を示す免疫蛍光画像。スケール バー: 50 μm。この図の拡大版を表示するには、ここをクリックしてください。
ここで説明するプロトコルは、筋線維および脂肪細胞の形態を保持し、複数の細胞型の視覚化および分析を可能にする。このアプローチは、パラホルムアルデヒド(PFA)固定筋肉組織における脂肪細胞の免疫蛍光染色に基づいており、複数の抗体との共染色を可能にします。また、ホールマウントイメージングを使用して、無傷の組織中の筋肉内脂肪を空間的に表示するように容易に適合させることができ、それによって筋肉内の脂肪の細胞微小環境に関する情報を提供する。加えて、このプロトコルは、筋肉の健康状態を評価するための重要な測定値である固定筋肉組織31における筋線維の断面積を決定するために、最近公表された我々のアプローチと組み合わせることができる。このアプローチを遺伝的系統追跡と組み合わせて、脂肪細胞へのFAPの分化を運命マップすることもここで概説されています。したがって、ここで説明する汎用性の高いプロトコルは、組織切片および無傷の組織におけるFAPおよび筋肉内脂肪へのそれらの分化の厳密かつ再現性のある評価を可能にする。
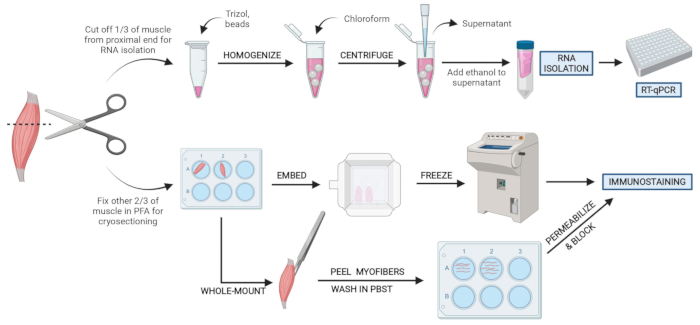
図2:概略プロトコルの概要 TAの3分の1を除去し、スナップフリーズし、ホモジナイズして、その後のRNA単離およびRT-qPCR を介した 転写解析を行う組織処理の概略概要。TAの他の3分の2はPFA固定され、凍結切片または全マウント繊維の免疫染色のために処理されます。 この図の拡大版を表示するには、ここをクリックしてください。
プロトコル
すべての動物プロトコルは、フロリダ大学の施設動物ケアおよび使用委員会(IACUC)によって承認されました。
1. FAPの遺伝的系統追跡
注: FAP の遺伝的系統トレースが望ましくない場合は、ステップ 1 をスキップできます。
- FAPの系統追跡を行うには、必要なマウス対立遺伝子を得る。
注:Pdgfrαプロモータの制御下で、ホーガン29、ランド27、およびベルグルズ32研究所を含むFAPを首尾よく標的にするために、いくつかのタモキシフェン誘導性Creラインが生成されました。Cre活性の遺伝子レポーターとして、Rosa26 EYFP33などの多数のRosa26レポーター対立遺伝子が利用可能である。各研究室では、どのCre-Reporterの組み合わせが最も効果的であるかを判断することが推奨されていますが、Pdgfrα CreERT2マウス(29およびJax#032770)をRosa26EYFP(33およびJax#006148)レポーターに交配することによって、PdgfrαCreERT2が得られます。Rosa26EYFPマウスは、FAPs20を効率的かつ特異的にマーキングするために使用することができる。成熟FAPの運命をたどるためには、タモキシフェンを投与する前に、マウスが少なくとも〜10週齢に達するまで待つことが推奨される。系統追跡実験は、男性と女性の両方に対して行うことができる。 - 経口経管栄養によるタモキシフェン投与
- 40mg/mLのタモキシフェンをコーンオイルとボルテックスによく調製し、経管栄養の1日前に混合する。回転ハイブリダイゼーションオーブン中で37°CでO / Nをインキュベートします。
注意:タモキシフェンは発がん性物質であり、慎重に取り扱う必要があります。取り扱い時には必ず手袋を着用し、粉末として計量する場合は吸入の危険性があるためマスクを着用してください。 - プロトコルに従って領域を清掃し、経管栄養針を1mLシリンジに取り付けます。200μLのタモキシフェンをシリンジに引き込む。
- Scruff PdgfrαCreERT2 ;Rosa26EYFPマウス(生後10週;両性使用)を平らな面に置き、尾の付け根をしっかりとつかむ。空いている手で親指と人差し指でマウスの中央をつかみ、軽く少しの圧力でグリップを肩のすぐそばまでスライドさせます。
- 親指と人差し指で皮膚をつまみ返し、マウスを拾い上げてマウスがユーザーの方を向くように手をひっくり返し、マウスを持つ手のピンキー指と薬指の間に尾を挟みます。
- この時点で、マウスがしっかりと固定されていて、頭や腕を動かすことができないことを確認してください。経管栄養針を口に挿入し、マウスの頭をわずかに後ろに傾けるためにそれを使用します。これにより、食道へのアクセス性が向上します。
- 慎重にゆっくりと針を食道に挿入します。抵抗が満たされた場合、針を強制しないでください。針は簡単に滑り落ちるはずです。ゆっくりとタモキシフェンを注入する。マウスを15〜20分間監視して、経管栄養中に問題が発生していないことを確認します。
注:タモキシフェンを2日間連続して投与すると、典型的には、有害作用を引き起こすことなく、FAPの〜75%〜85%の組換え効率が得られる。ユーザーは、残りのタモキシフェンを系から除去し、残りのタンパク質をひっくり返すことを可能にする傷害を誘発する前に1〜2週間待つことが推奨される。
- 40mg/mLのタモキシフェンをコーンオイルとボルテックスによく調製し、経管栄養の1日前に混合する。回転ハイブリダイゼーションオーブン中で37°CでO / Nをインキュベートします。
2.前脛骨筋(TA)の損傷
注:筋肉内脂肪を研究するには、大量の筋肉内脂肪形成をもたらすグリセロールベースの傷害モデル(滅菌生理食塩水中の50%グリセロール)を使用することが推奨される34,35,36,37。
- イソフルランを添加し、マウスチャンバーとノーズコーンの両方にチューブが開いていることを確認することによって麻酔機を準備します。チャンバーと作業領域を70%エタノールまたは過酸化物溶液(プロトコルに応じて)で洗浄します。
- 酸素流量を2.5L/min、イソフルラン濃度を2.5%に設定した。マウスを麻酔室に入れ、麻酔をかけるまで〜5分間待ちます。
- マウスを清潔な加熱パッドの上に仰臥位に置き、ノーズをノーズコーンに挿入します。麻酔下での乾燥を防ぐために、綿の先端のアプリケーターで獣医の眼軟膏を目に優しく塗布します。麻酔を継続的に監視し、怪我をする前にマウスのつま先ピンチを実行して、マウスが完全に麻酔されていることを確認します。
- 消毒するために新鮮なアルコールワイプで注入する脚をきれいにします。
- 30〜50μLの50%グリセロール(マウスのサイズに応じて)をインスリンシリンジに引き込む。すねの毛をそっとブラッシングして、TAの位置を露出させます。
注:髪を動かし、アルコールワイプからまだ濡れているときにより良い視覚化を達成する方が簡単です。 - TAの位置を特定した後(脛骨のすぐ外側にあり、皮膚からわずかに突き出ており、穏やかな触診で感じることができます)、足首の近くの遠位でTAに針を挿入します。針を筋肉に完全に挿入し、徐々に針を引っ込めながらゆっくりとグリセロールを注入すると、筋肉の大部分を傷つけるのに役立ちます。
注:針を脚に平行に挿入し、角度を少し上げるのが最善です。良好な傷害は、典型的には、針を抜いた後にTAが収縮するにつれて背屈を引き起こす。マウスのつま先が広がった場合は、伸筋桁ロンガス(EDL)筋肉が注入された可能性があります。 - マウスをケージに戻して約15〜20分間監視し、麻酔回復を確実にします。
- 針を鋭利な容器に捨てます。針をふさいではいけません。
注:グリセロール注射後の鎮痛は、施設動物ケアおよび使用委員会の承認に従って提供する必要があります。脂肪細胞は、傷害後5日(dpi)に直ちに観察することができる。7 dpiまでに、すべての脂肪細胞が形成され、21 dpiによって、それらは完全に成熟した。
3. ティッシュハーベスト
- 1x PBSで4%PFAを準備し、収穫を開始する前に氷の上に置きます。
- 筋肉固定に使用するプレート(12ウェルまたは24ウェル)を氷の上に置き、各ウェルに4%PFAを加え、各ウェルに固定されている組織よりも10〜20倍のPFA容量があることを確認します。
- グリセロール傷害後7〜21日の間に、施設ガイドラインに従ってマウスを安楽死させる(すなわち、イソフルラン過剰摂取に続いて子宮頸部脱臼)。
- 組織学またはRNA単離に使用する組織の採取を開始します。
メモ:組織は、犠牲を払ってから10~15分以内にスナップフリーズするかPFAに入れる必要があります(図2)。 - 切断するマウスの任意の領域に70%エタノールを自由にスプレーして、髪を解剖領域や器具から遠ざけます。
- はさみを使用して、骨盤の近くの脚の上部付近の皮膚を切断します(図3A)。
- 脚の皮膚を上から足首までゆっくりと引き出します(図3B)。
注:TAは涙滴型の筋肉で、内側楔形文字と第1中足骨に付着した明確に定義された遠位腱を有する。それは脛骨の側方にあり、下膝まで伸びています。 - まず、TAを採取する前に、先端の鋭いピンセットを用いて外側結合組織層(エピミシウム)を除去する(図3C)。解剖顕微鏡を使用して、エピミシウムをよりよく視覚化します。
- 遠位腱から始めて、筋肉の下からTAの下にあるピンセットをスライドさせ、膝に向かってゆっくりと上向きに引っ張ります(図3D)。筋肉の端で停止します;下膝で感じた抵抗を押しのけないでください。
- 下膝に達する前に大きな抵抗がある場合は、停止して、結合組織の残りの層を除去し続けます。
注:EDLに付着するTA腱のすぐ外側に別の遠位腱があり、これはTAの外側の細い筋肉である。TA腱の下にピンセットだけをスライドさせるように注意することで、EDLの偶発的な収穫を防ぐことができますが、固定後に簡単に取り外すこともできます。 - ピンセットでTAを脚から部分的に持ち上げたら、メスで同じ動きをして、TAと下膝の接続を切断します(図3E)。足首の腱をはさみで切ってTAを完全に外します。繊維を傷つけないように、腱の筋肉だけを扱います。
- 腱の反対側の端でTAの1/3をカットし(図3F)、微量遠心管に入れ、液体窒素に滴下してスナップフリーズします(図3H)。
- 組織の他の2/3を組織学のために4%PFAで標識されたウェルに沈める(図3I)。最初と最後の組織が固定液に入れられた時期を必ず追跡してください。シェーカーの上に4°Cで2〜2.5時間置きます。
- 固定の持続時間は、組織およびそのサイズに依存する。組織の固定に必要な期間を決定します。TAを4°Cで2〜2.5時間固定すると、通常、組織の過剰固定を引き起こすことなく脂肪細胞の形態が良好に維持されます。
注:ホールマウント免疫蛍光染色にTAを使用することを計画している場合は、セクション7:「ホールマウント免疫蛍光染色」に到達するまで、このプロトコルの残りの部分をスキップしてください。 - 固定後、PFAをウェルから取り出し、冷たい1x PBSで組織を2〜3回すすぎ、次いで冷たい1x PBSで2〜3回、洗浄あたり5分間洗浄する。
- PBSをウェルから取り出し、組織が浮遊できるように1x PBSに十分な30%スクロースを加える。シェーカーの上に置き、4°Cで一晩置きます。
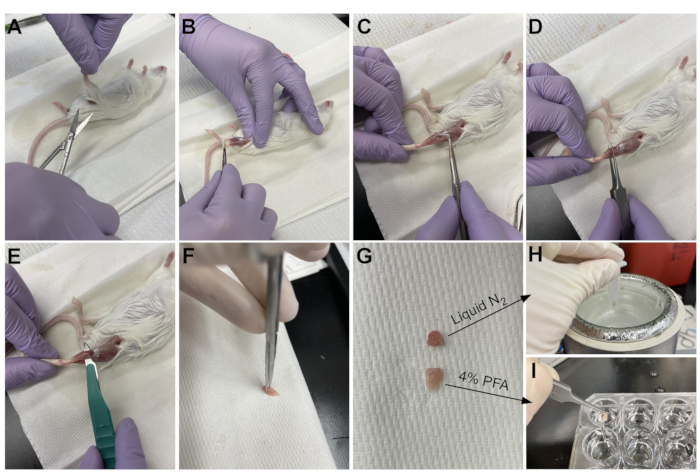
(A)皮膚は脚の付け根で切断され、(B)後肢の筋肉は露出している。(C)エピミシウムがTAから除去されると、(D)鉗子を使用して筋肉を部分的に分離し、エピミシウムが完全に除去されたことを確認する。(E)TAをメスで脚から切断し、腱を切断した後に除去する。(G)TAを3分の1と3分の2のピースに切断した後、(H)3分の1をRT-qPCR分析のために液体窒素中でスナップフリーズし、(I)残りの3分の2を組織学のために4%PFAに固定する。この図の拡大版を表示するには、ここをクリックしてください。
4. 埋め込み
- 組織を完全に沈めるのに十分な包埋媒体で標識し、充填することによって、包埋に使用する試料型を準備する。
- ウェルから組織を取り出し、ペーパータオルで余分なスクロースを乾燥させ、凍結培地で満たされた試料型に移動します。
注: 金型がクライオスタット上でどの向きで切断されているかを知っておくと便利です。このようにして、ユーザは、関心領域が容易にアクセス可能となるような方法で、鋳型内の組織を配向させることができる。TAの場合、これは、最も厚い端(腱側とは反対側)を切片化する表面を向くことによって達成されるであろう。これにより、TAを最も厚い部分(腹部)で容易に切断することができ、筋線維の断面切断が可能になる。 - イソペンタンを保持した容器を液体窒素に部分的に浸漬することによりイソペンタンスラリーを調製する。組織を埋め込むために使用する標本型の約半分を沈めるのに十分な液体イソペンタンが容器内にあることを確認してください。
- イソペンタンスラリーに慎重に入れ、金型の約半分が水没していることを確認することによって、金型を凍結し始めます。また、金型が 4 つの側面すべてから均等に凍結していることを確認してください。
- 金型全体が上から目に見えて凍結する直前に、イソペンタンから金型を取り出します。この処理にかかる時間は、使用する金型によって異なります。
- 残りのブロックを凍結させながら、ドライアイスを入れた容器に凍結した金型を保管し、-80 °C で保管します。
注:凍結用のイソペンタンは再利用できます。ガラス瓶に入れますが、イソペンタンが室温(RT)に達するまで蓋を締めないでください。さもなければ、圧力の変化はボトルを粉砕する可能性がある。
5. セクショニング
- クライオスタットを-22~-24°Cに設定し、TAを含む型をクライオスタットに加え、温度順応のために最低30分間待ちます。その間、一連の正に帯電した顕微鏡スライドにラベルを付けます。
- アンチロールプレートを挿入し、試料ブロックと接触するプレートに最小限のニックがあるようにクライオスタットに合わせます。所定の位置に固定します。
- 新しいクライオスタットブレードをブレードホルダーに挿入し、所定の位置に固定します。
警告: 刃は鋭くなっています。クライオスタットまたは凍結金型の他の部分を操作するときは、ブレードを覆います。 - 凍結したブロックを金型から取り出します。クライオスタットチャックに均一な包埋剤の層を追加し、培地にブロックを配置します。包埋剤が完全に凍結(不透明な白)になるまで1〜3分間放置します。
メモ:TAの場合、チャックを装着すると最も厚い領域(腹)が見えるようにします。 - 組織ブロック付きのクライオスタットチャックをクライオスタットに入れます。ブレードを覆い、ブレードに接触するまでクライオスタットを前方に進めます。組織が包埋媒体によって覆い隠されなくなるまで、25μm切片でブロックを通る切片。
メモ: 断面の厚さが均一になるように、クライオスタットの角度やステージの位置を調整してください。断面の厚さの均一性を確保するために、いくつかの断面を収集すると役立つ場合があります。TA内の関心領域(腹部)まで切片化する前に適切なアンチロールプレートの位置を見つけることをお勧めします。 - 断面の厚さを10-12 μmに変更し、ラベル付けされた顕微鏡スライドに切片を収集します。シリアルセクショニングは、6〜10枚のスライド(1〜xとラベル付けされた)に隣接するセクションを収集することによって推奨され、複数のマーカーの染色を可能にする。必要に応じて、薄いブラシを使用してセクションをカール解除してから、スライド上に集めます。
メモ: 断面がカールしている場合は、温度が -22 ~ -24 °C の範囲で安定していることを確認します。セクションに垂直な縞模様がある場合は、アンチロールプレートまたはブレードの傷が原因である可能性があります。これは、アンチロールプレートの位置を調整したり、新しいブレードに切り替えたりすることで固定できます。 - 同じ断面平面の隣接する切片を各スライドに集めた後、厚さを25 μmに戻してブロックを通って150〜200 μm前進させ、厚さを10〜12 μmに調整して再び切片化を開始します。
メモ: このシリアル セクショニングにより、ユーザーは TA を介してさまざまな深さで視覚化、イメージ化、定量化できます。スライドごとに3~4つのシリアルセクションで十分です。 - スライドおよび組織ブロックを-80°Cで保存する。
6. 組織切片の免疫蛍光(IF)染色
注:抗体濃度はロットとメーカーによって異なる可能性があるため、目的のスライドを染色する前に、テストスライド上の抗体の濃度をいくつか評価して最適化することをお勧めします。
- RTまたは37°Cのウォームプレート上で10〜20分間、スライドを解凍/乾燥させます。
- 疎水性ペンを使用して、スライドの紙面の端に線を引き、ガラスと接します。
- スライドをコプリン瓶に入れ、1x PBS + 0.1% Tween20 (PBST) 3-5xでシェーカーで洗浄し、洗浄あたり少なくとも5分間洗浄して組織切片を再水和させます。
注:この時点では、スライドをPBSTに沈めずに(疎水性ラインまで)座らせないことが重要です。 - スライドを加湿チャンバーのラックに置き、スライドに310-350 μLのブロッキング溶液(5%ロバ血清と0.3%Triton X-100 in 1x PBS)をRTで1〜2時間重ねます。
注:ブロッキング溶液には0.3%のTriton X-100が含まれており、組織切片の十分な透過処理を可能にするため、追加の透過処理ステップは必要ありません。マウス由来の一次抗体(すなわち、以下に列挙するPAX7およびMYOD1)を使用する場合、ブロッキングステップのためのブロッキング溶液中にFabフラグメント(1:50)を使用するマウスオンマウスブロッキングステップを含めることが推奨される。これは、一次抗体以外の抗体に対するマウス二次抗体の非特異的結合によるバックグラウンドを低減するのに役立つであろう。 - ブロッキング溶液中で使用する一次抗体を、次のステップに進む直前に次のように希釈する:
- 脂肪細胞染色および全切片イメージングのための一次抗体:ウサギ抗ペリリピンを1:1000の希釈比で希釈する。
- 脂肪細胞の系統追跡のための一次抗体:ニワトリ抗GFPを1:1000の比率で希釈し、ウサギ抗ペリリピンを1:1000で希釈する。
- FAPの系統追跡のための一次抗体:ニワトリ抗GFPを1:1000の比率で希釈し、ヤギ抗PDGFRαを1:250の比率で希釈する。
- 筋原性マーカーに対する一次抗体:マウス抗PAX7を1:25の比率で、またはマウス抗MYOD1を1:250で、ウサギ抗ラミニンを1:1000の比率で希釈する。
注:上記の抗体はこのプロトコルで正常に評価されていますが、FAP、脂肪細胞および/または他の細胞型を標識するための他のマーカーおよび抗体もこのプロトコルと適合している可能性があります。一次抗体を初めて使用する場合は、一次抗体が省略されたネガティブコントロールスライドを含めることを強くお勧めします。これは、抗体の特異性について制御するであろう。プロトコルの他のすべてのステップ(二次抗体の添加を含む)に従いますが、ブロッキング溶液中の一次抗体の代わりに、次のステップではブロッキング溶液が単独で使用されます。
- ブロッキング溶液をスライドからダンプし、一次抗体を含む310〜350μLのブロッキング溶液を重ね、加湿チャンバ内で4°Cで一晩インキュベートする。
- 翌日、ブロッキング溶液/一次抗体をスライドから取り出し、コプリン瓶に入れます。スライドをPBSTで2〜3回すすぎ、シェーカーでPBSTで3〜5倍を洗濯あたり少なくとも5分間洗浄します。
- 最後の洗浄中に、ブロッキング溶液に使用する二次抗体または任意の直接コンジュゲートを調製する。これらの抗体が光の中で過ごす時間を最小限に抑えて、フォトブリーチングを回避します。
- 希釈二次抗体/直接コンジュゲート:488nmロバ抗ニワトリ(1:1000)または抗ウサギ(1:1000)または抗マウス(1:1000)、568nmロバ抗ヤギ(1:1000)または抗ウサギ(1:1000)またはファロイジン(筋繊維;1:100)、DAPI染色(核;1:500)。
- 加湿チャンバー内で、二次抗体および/または直接コンジュゲートを含む310〜350μLのブロッキング溶液でスライドを重ねる。RTで1〜2時間インキュベートする。これからもサンプルを光から守ります。
- ブロッキング溶液/二次抗体をダンプし、コプリン瓶に入れます。PBSTで1回すすぎ、シェーカーでPBSTで3〜5倍を洗濯あたり少なくとも5分間洗浄します。光が当たらないように、コプリンの瓶を覆ったままにしておきます。
- スライドの端を叩き、ペーパータオルで背中を拭いてできるだけ乾かしますが、組織切片を乾燥させないでください。
- スライドの上端の水平端に水性マウント媒体を3〜4滴加え、カバースリップをそっと追加します。カバースリップの下に気泡が形成されている場合は、押し下げたり動かしたりしないでください。圧力や動きは、脂肪細胞の脆弱な細胞構造を歪める可能性があります。
- イメージングの前に、マウント媒体を一晩暗闇にセットしてください。
7. ホールマウント免疫蛍光染色
- 約1時間の固定後(ステップ3.14を参照)、先端の鋭いピンセットを使用して、固定されたTAから筋線維を剥離する。
- 分離した繊維を24ウェルプレートに入れ、PBSTでそれぞれ3xを3分間洗浄する。その後のすべてのインキュベーションでは、蒸発を防ぐために蓋を追加するようにしてください。
- シェーカー上のRT(200-300 μL)で1% Triton X-100 in 1x PBS中で1時間インキュベートし、抗体のより良い浸透を可能にします。
- PBSTで数回リンスした後、ブロッキング溶液(200-300μL)で重ね、4°Cで一晩、ヌーテーターまたはシェーカーでブロックします。
- 一次抗体を所望の濃度に希釈する(濃度を2倍にすることが良好な出発点となりやすい)ブロッキング溶液中で。サンプル(200-300 μL)をヌーテーターまたはシェーカーで4°Cで一晩インキュベートします。
- シェーカーのRTで頻繁に交換し、各洗浄を30〜60分間約4〜6倍にして、1日を通してPBSTでサンプルを厳密に洗浄します。
- ブロッキング溶液中の二次抗体を所望の濃度(1:500がうまく機能する傾向がある)に希釈し、核染色を加え、サンプル(200-300 μL)をヌーテーターまたはシェーカーで4°Cで一晩インキュベートします。
- シェーカーのRTで頻繁に変化させ、各洗浄または4°Cで一晩洗浄するたびに30〜60分間約4〜6倍の回数で、1日を通してPBSTでサンプルを厳密に洗浄します。
- 取り付けるには、余分なPBSTを静かに乾かしてから、スライドガラス上の1〜2滴の取り付け媒体に繊維を置きます(図4A)。カバースリップ(18 mm x 18 mm)を上げるには、粘土の足を少し加えます。これにより、繊維が押しつぶされるのを防ぎ、カバースリップをスライドに固定します。コンパウンドのモデリングは、このためにうまく機能します。カバースリップが固定されたら、カバースリップの下の領域がいっぱいになるまで、端にミディアムを追加します。
注:退色防止剤を含むマウント媒体を使用する代わりに、組織を上昇系列のグリセロール(PBS中の30%〜80%グリセロール)を通して移動させることもできる。 - マウント媒体の硬化を可能にするためにイメージングする前に1〜2日間待ってください。
8. 筋肉内脂肪のイメージング
- 顕微鏡の電源を入れ、イメージングソフトウェアを起動します。スライドをステージに固定します。
注:筋肉切片の脂肪細胞をイメージングするには、広視野顕微鏡と組み合わせた5倍または10倍の対物レンズで十分です。WM-IFを可視化するためには、共焦点顕微鏡が必要です。 - 任意のチャンネルを使用して、画像化する領域を識別します。
- イメージングソフトウェアで、各チャンネルのゲインと露光時間を調整します。
- 各チャンネルの組織全体の画像(顕微鏡と使用されるソフトウェアに応じて自動または手動)を撮影し、個々のタイルをマージして完全なTA断面を合成します。
メモ: 同じ TA の 2 つまたは 3 つの異なるセクションの画像を異なる深さで撮影することをお勧めします。各セクションの脂肪細胞を定量化し、その平均を報告することにより、例えば注射エラーによる筋肉内脂肪の量の局所的な差異が回避される。
9. 脂肪細胞の定量化
- 以前にインストールされていない場合は、 セルカウンター プラグインをImageJに追加します(https://imagej.nih.gov/ij/plugins/cell-counter.html)。
- 画像を TIF ファイルまたは元の顕微鏡ファイルとして ImageJ にインポートします。ImageJ の各チャンネルを個別の TIF ファイルとして表示します。
メモ: LIF または同様の顕微鏡ファイルタイプを使用している場合は、[Bio-Formats のインポートオプション] で [スタックの表示] で [ハイパースタック] を選択し、[チャンネルの分割] チェックボックスをオンにします。「OK」をクリックしてファイルを開きます。また、[自動スケール] ボックスがオフになっていることを確認します。 - 各チャンネルの画像が 8 ビット形式 (およびグレー) であることを確認します: 画像> タイプ > 8 ビット。
- DAPI(青)、GFP(緑)、ペリリピン(赤)、およびファロイジン(グレー)画像をマージする: 画像>カラー>チャンネルをマージします。
- スケール (分析>セットスケール) がミクロン単位であることを確認します。フリーハンド選択ツールを使用して、各断面の負傷部分と負傷していない部分を概説し、測定(>測定の分析)し、負傷領域と負傷していない領域をスプレッドシートに記録します。
注:損傷した筋肉は、筋線維のない領域、または中央に位置する核を含む筋線維が生息する領域として識別することができる。 - セルカウンターの起動: プラグイン>セルカウンター>初期化します。
- カウンタータイプを選択し、各脂肪細胞を数えます。脂肪細胞の総数をスプレッドシートに記録し、傷害領域の1mm2 あたりの脂肪細胞数を計算する。
10. RT-qPCRを用いたアジポジェニック遺伝子発現解析
- RNA アイソレーション
- 開始する前に、RNaseフリーの水を45°Cに予熱し、新鮮な70%EtOH(サンプルあたり350μL)を調製する。
- 1,000 μL のチオシアン酸グアニジウムをサンプルの入った各チューブに加えます (ステップ 3.12 を参照)。ビーズビーター承認のチューブが使用されていることが重要です。
注意:チオシアン酸グアニジウムは有毒です。適切な個人用保護具を着用し、ヒュームフードで取り扱います。 - 3つのミディアムビーズまたは1つの大きなビーズと1つの小さなビーズを各チューブに追加します。
- ビーズビーターを用いて組織を50Hzで2〜4分間均質化する。組織の種類とサンプルサイズによっては、最大10分かかる場合があります。
- 200μLのクロロホルムを加える。
警告: クロロホルムは有毒です。個人用保護具を着用し、ヒュームフードで取り扱います。 - サンプルを15秒間振る。RTで2〜3分間インキュベートする。
- 12,000 x gで15分間遠心分離機。350 μLの透明な上清(RNAを含む上層)をピペットアウトし、350 μLの70%エタノールを含む新しい微量遠心チューブに加える。下部のタンパク質および/またはDNA層を吸引しないように注意してください
- 最大 700 μL の混合物を 2 mL の収集管に入れたミニスピンカラムに移します。製造元の指示に従って RNA 単離を続行します。
- 30-50 μLのRNaseフリー水で、期待される収量に応じて溶出します。RNAを氷上に保ち、分光光度計を使用して収率を測定します。RNAを-80°Cで保存する
注:DNA汚染防止にはRNA層の上部350 μLだけを慎重に取り除くだけで十分であるため、DNase処理工程を省略することも可能です。RT-qPCR 解析に加えて、単離された RNA を RNA シーケンシングにも使用でき、その場合は DNase 処理ステップを強くお勧めします。
- cDNA合成
- 製造元の指示に従って、cDNA 合成キットで cDNA を合成するには、最大 1 μg の RNA を使用します。
- 実行が完了したら、RNaseを含まない水を80μL加えます。サンプルを-20°Cで保存します。
- 脂肪細胞選択的遺伝子のRT-qPCR。
- 384ウェルフォーマットを使用して、1 μLのプライマー(〜1 μM最終濃度)を各ウェルの底に加えます。プライマーを予備乾燥すると、よりタイトな技術的複製が得られます。プライマーが完全に蒸発するまで覆いを被ったままにします(蒸発をスピードアップするために、プレートを37°Cに設定した加熱ブロックの上に置くことができます)。
- 2.5 μL の色素ベースの RT-PCR マスターミックス、2.1 μL の RNase フリー水、および 0.4 μL の cDNA (~1 ng) (ウェルあたり 5 μL の全容量) で、4 ~ 8 回のテクニカルレプリケートでサンプル反応を設定します。次の熱サイクル条件を使用しました:95°Cで15秒間変性し、60°Cで25秒間40サイクルでアニール/延長します。
- ここで説明するようにΔΔCTを計算することによって、生のCT(サイクル閾値)値をハウスキーピング遺伝子(すなわち 、Hprt および Pde12)レベルに正規化する38。プライマー配列については20 を参照されたい。
注: マイナス逆転写(-RT)コントロール、PCR 反応、プライマーバリデーションの使用など、RT-qPCR 分析の標準的な方法に従う必要があります。
結果
筋肉内脂肪の免疫蛍光可視化
上記のステップおよび図1Aの観察に続いて、グリセロール傷害後21日目から、LN2冷却イソペンタン中で収穫直後にスナップ凍結するか、または4%PFA中で2.5時間固定したTA組織切片を採取した。両方のサンプルを凍結切除および染色した後、TAの最大面積である中腹部で画像を撮影した。非固定TAからのペリリピン+脂肪細胞(図1B)は、固定切片(図1C)と比較して形態を有意に変化させており、それらの同定、可視化、およびその後の定量化をはるかに困難にし、潜在的に不正確である。注目すべきことに、最初のPERILIPIN+脂肪滴は傷害後約5日目に検出され、ほとんどの脂肪細胞は7日目までに形成された。傷害後21日目までに、脂肪細胞は完全に成熟していた。
TAあたりの脂肪量は誘発された傷害の重症度と強く相関するため、筋肉内脂肪形成を効果的に観察および研究するためには、TAを有意に損傷しなければならない。死体TAにインクを使用して注射を練習することは、怪我の重症度を改善するための素晴らしい方法です。成功した怪我は筋肉の50%を超える傾向があります。注意すべきことに、筋肉の損傷領域は、筋線維を欠いている領域、または再生筋線維の既知の特徴である少なくとも1つの中心に位置する核を含む筋線維によって移入される領域を表す。
このプロトコルは、3DにおけるFAPおよび脂肪の染色に容易に適合させることができる。このために、固定後のTAから複数の筋線維を注意深く分離し、続いてホールマウント免疫蛍光を行った。重要なのは、繊維をスライドガラスに適切に固定すると同時に、組織の過圧を避けることです。成形可能な粘土の足を使用することで、ユーザーは必要な厚さを調整し、カバースリップをスライドに固定することができ、倒立顕微鏡の使用も可能になります(図4A)。この方法は、PDGFRα+ FAP、ファロイジン+ 筋線維、およびペリリピン発現脂肪細胞を標識するために首尾よく使用されました(図4B、補足ビデオ1および補足ビデオ2)。厚さが最大150μmの複数のz平面で画像を取得した後、顕微鏡ソフトウェア内の3Dレンダリングモジュールを使用して3D再構成を作成しました。
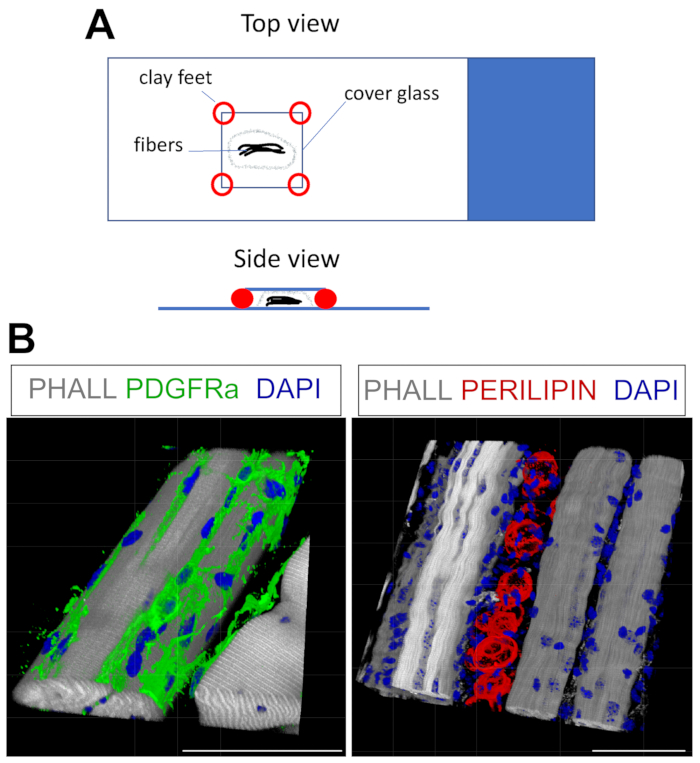
図4:ホールマウント免疫蛍光染色。(A)サンプルのマウント方法と、ホールマウント染色用のカバースリップの追加方法の上面図と側面図。(B)筋線維(灰色)および核(青)とともに、FAPs(緑色;左)および脂肪細胞(赤色;右)の代表的な3D再構成。スケール バー: 50 μm。この図の拡大版を表示するには、ここをクリックしてください。
筋肉内脂肪の定量化
筋肉内脂肪の画像が撮影されると、ImageJ/FIJIのセルカウンター機能を使用して、PERLIPIN+ 脂肪細胞の数を手動でカウントしました(図5A)。次に、筋線維内の中央に位置する核によって定義される筋肉部および損傷領域の総面積を決定した。傷害重症度を制御するために、脂肪細胞の総数を損傷領域で割って、損傷した筋肉の1mm2 あたりの脂肪細胞の数をもたらした。通常、<30%の傷害を示すTAは定量化から除外されます。脂肪細胞は傷害のない稀であり、断面積当たり0〜8個の範囲であるが、脂肪細胞の総数は依然として総面積によって正常化される。 図5Bで強調されているように、グリセロール損傷は、損傷を受けていないTA筋肉と比較して大量の筋肉内脂肪を引き起こす。あるいは、ペリリピン染色は非常にクリーンで、高い信号対雑音比であるため、 Analyze Particle 関数を使用してペリリピンが占める総面積を決定することもできます。しかしながら、この方法は、より小さい脂肪細胞とより少ない脂肪細胞とを区別することができないであろう。最小4個体の動物から最大3つの切片を画像化および定量化し、マウスあたりに存在する脂肪細胞の平均数を報告した。
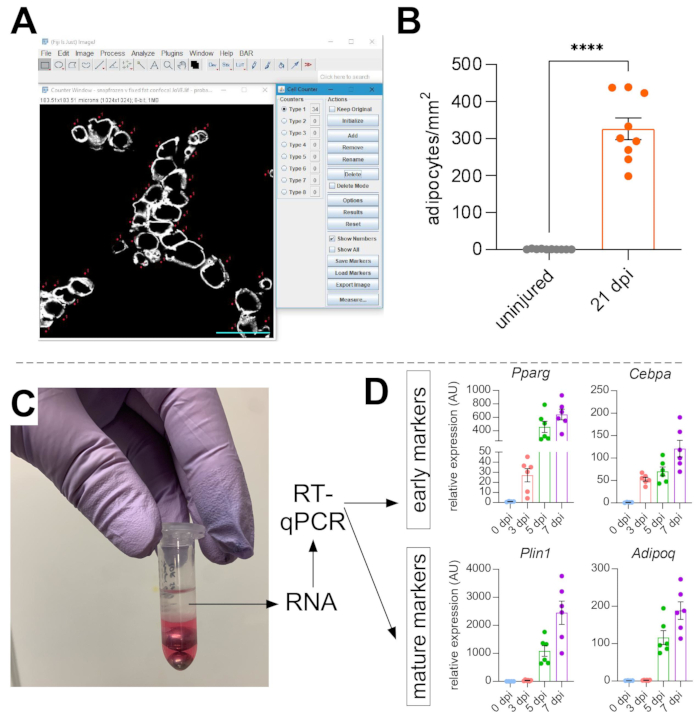
図5:筋肉内脂肪の定量化 (A)ImageJのセルカウンター機能を用いたペリリピン+ 脂肪細胞(白色)の計数方法の代表画像。スケールバー:50 μm. (B)グリセロール注射後21日目の全TA脂肪細胞定量を、損傷領域の1mm2 に正規化した。各ドットは、1 匹のマウスの平均を表します。エラー バーは SEM として表示されます。**** = p < 0.0001。(c)クロロホルムによるホモジナイゼーションおよびその後の相分離後のRNA層がRT-qPCR分析に使用されている。(d)グリセロール損傷後の異なる時点で、 Pparg および Cepbα、初期脂肪生成遺伝子、ならびに2つの成熟脂肪細胞マーカーである Plin1 および Adipoq の発現レベルのフォールド変化。各ドットは、1 匹のマウスの平均を表します。エラー バーは SEM と表示されます。 この図の拡大版を表示するには、ここをクリックしてください。
存在する筋肉内脂肪の量を独立して確認するために、種々の脂肪生成マーカーの遺伝子発現レベルを決定することができる。このために、RNAは、損傷後の異なる点で免疫蛍光に使用される同じTA筋肉の一部(上記のステップを参照)から単離することができる。ビーズビーターをチオシアン酸グアニジウムと組み合わせて使用して、組織を均質化した。クロロホルムを加えた後、遠心分離を行い、上部のRNA含有層を注意深く抽出し、RNAクリーンアップにミニスピンカラムを使用した(図5C)。この方法は、RT-qPCRやRNAseqなどのすべての下流分析に適した高品質および量のRNAを日常的に生成します。RT-qPCRについて、ハウスキーピング遺伝子に対する脂肪生成の相対発現レベルを決定し、ΔΔCT法38に従って任意の相対的変化を評価した。 図5Dに記載されるように、損傷を受けていないTA筋肉と比較して、グリセロール傷害は、損傷後3日目に Pparg および Cebpα などの初期の脂肪生成マーカーの発現を誘導する。 アディポネクチン (Adipoq)および ペリリピン (Plin1)などの成熟マーカーは、 グリセロール損傷の5日後という早い時期に検出することができる。
脂肪細胞の遺伝的系統追跡
ここで紹介する脂肪細胞染色プロトコルは、脂肪細胞にマッピングしてその運命をたどるFAPの遺伝的系統追跡を含むように容易に適応させることができる。我々は、例えば、PdgfrαCreERT2におけるタモキシフェン投与を介して組換えが誘導され得ることを以前に実証した。Rosa26EYFPマウスは、損傷の2週間前に、FAPsにおけるEYFP発現のコードおよび不滅に活性化するフロックス停止を効果的に除去した(図6A)。我々は、ここで提示したタモキシフェンレジメンを用いて高い組換え効率を達成し、PDGFRα+ FAPの約75%がEYFP 20を発現し、他の研究室が報告したもの27、39、40と同様である。FAPが実際に筋肉内脂肪の細胞起源であることを実証し、FAPの大部分はグリセロール損傷の7日後にEYFP+ペリリピン発現脂肪細胞に変わった(図6B)。
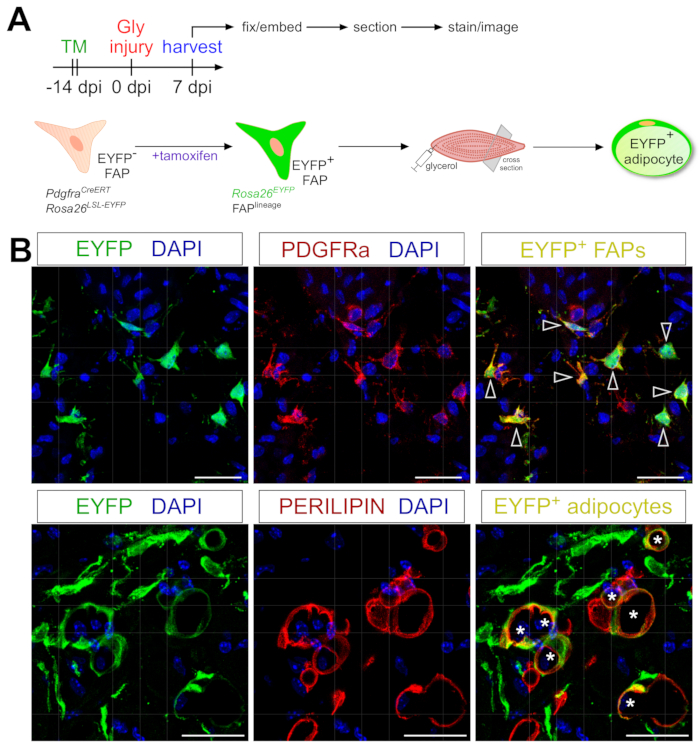
図6:FAPの系統追跡(A)実験セットアップの概略概要。(B)PDGFRα+ FAP(赤、矢印)およびペリリピン+脂肪細胞(赤、アスタリスク)内のEYFP(黄色)の組換えおよび活性化の成功を示す代表的な免疫蛍光画像。スケール バー: 25 μm。この図の拡大版を表示するには、ここをクリックしてください。
複数の細胞型の検出
このプロトコルはまた、筋原性コンパートメントを視覚化するために使用され得る。PAX7およびMYOD1に対する抗体を用いると、筋幹細胞(MuSC)および筋芽細胞は、それぞれ、PFA固定筋組織切片においてもグリセロール損傷後5日目に容易に検出することができる(図7)。したがって、提示されたプロトコルは、脂肪細胞およびFAPの標識および画像化だけでなく、筋原性系統の他の細胞型にも汎用性および適応可能である。
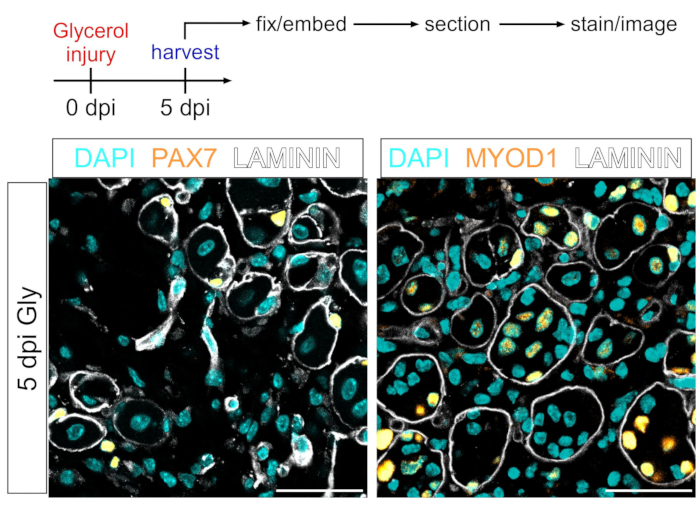
図7:筋幹細胞および筋芽細胞免疫蛍光染色(A)実験セットアップの概略概要。(B)PAX7による筋幹細胞(MuSC)(黄色、左)およびMYOD1による筋芽細胞(黄色、右)の染色の成功を示す代表的な免疫蛍光画像。ラミニンは筋線維(白色)を輪郭を描き、核はシアン色である。スケール バー: 50 μm。この図の拡大版を表示するには、ここをクリックしてください。
補足ビデオ 1: FAP の 3D レンダリング。 損傷後21日目に、それぞれファロイジン(灰色)、PDGFRα(緑色)、およびDAPI(青色)について染色された筋線維、FAP、および核の3次元再構成。 このビデオをダウンロードするには、ここをクリックしてください。
補足ビデオ2:筋肉内脂肪の3Dレンダリング。 筋線維束(灰色、ファロイジン)および筋肉内脂肪(赤色、ペリリピン)の体積レンダリングは、グリセロール損傷の21日後に筋線維を置換した。 このビデオをダウンロードするには、ここをクリックしてください。
ディスカッション
このプロトコルは、筋肉内脂肪の効率的な視覚化と厳密な定量化を可能にする広範で詳細なプロトコルの概要を示しています。同じ筋肉を2つの部分に分割し、1つは免疫蛍光に、もう1つはRT-qPCR分析に使用することで、このプロトコルも非常に汎用性があります。また、FAPの遺伝的系統追跡と組み合わせて、特定の条件下で脂肪細胞への変換を研究することもでき、複数の追加の細胞型を標識および画像化するために高度に適応可能である。
筋肉内脂肪を視覚化するために最も一般的に使用される方法は、パラフィン切片に続いてヘマトキシリンおよびエオジン染色、またはオイルレッドO(ORO)などの親油性染料で染色された凍結切片である。しかし、パラフィン処理された組織は最高の組織学を維持する一方で、同じプロセスはまた、親油性染料の使用を妨げるすべての脂質を抽出する。親油性染色法はPFA固定組織切片と非固定組織切片の両方に作用するが、脂肪滴はカバースリップに圧力を加えることによって容易に変位し、それによって筋肉内脂肪の空間分布を歪める。これを回避するために、最近の研究では、ホールマウントアプローチを使用してORO+脂肪細胞を視覚化するための厳格なプロトコルが確立されました。このために、著者らはTAを脱細胞化し、TA41全体にわたる筋肉内脂肪の空間分布を視覚化した。この技術と同じくらい強力ですが、それはまた、追加の細胞構造をマークするために他の共染色剤の使用を防ぎます。ここで紹介するホールマウント免疫蛍光アプローチは、脂肪細胞をさまざまなマーカーと共染色するために使用でき、細胞環境の微細なマッピングを可能にします。しかし、1つの大きな課題は、抗体の組織浸透である。より多くの繊維が一緒に保たれるほど、抗体が均等に浸透し、利用可能なすべての抗原に結合することがより困難になります。したがって、この方法は、繊維の小さなグループを見るときに最も効果的です。同時に、筋肉内脂肪の全体的な解剖学的位置は、小さな剥離した繊維束のみに焦点を当てると失われているため、これも制限です。しかし、新しい組織クリアリング方法と新しいイメージング技術の現在の開発により、将来的には組織の浸透と視覚化が可能になります42,43,44。
筋肉組織の事前固定は脂肪細胞の形態を維持する一方で、筋肉の健康の重要な測定値である筋線維のサイズを評価するという課題も生み出します。ミオファイバーサイズは、ミオファイバーの断面積を測定することにより求められる。我々は以前、筋肉組織の事前固定により、筋線維の輪郭を描くために利用可能なほとんどのマーカーが失敗することを報告した31。このハードルを克服するために、我々は、固定筋肉切片31においても筋線維サイズの測定を可能にする新規な画像セグメンテーションパイプラインを開発した。したがって、このプロトコルと組み合わせて、筋肉組織の事前固定によって引き起こされるほとんどの欠点を克服する堅牢で効率的な組織処理パイプラインを確立しました。
このアプローチのもう1つの大きな利点は、汎用性です。TAを2つの部分に分割することで、1つの筋肉から得られる情報量が最大化されます。これは動物の数を減らすだけでなく、遺伝子発現を通して組織学を確認することによって、そしてその逆もまた然りであることによって、制御の余分な層を追加します。さらに、脂肪生成遺伝子を超えて多くの異なる遺伝子を調べることができる。単離されたRNAは、筋肉全体のRNAseq実験にも使用することができる。最後に、スナップ凍結筋肉片は、タンパク質作業にも使用できます。このプロトコルの1つの制限は、傷害がTAの全長にわたって一貫していない可能性である。これは、2つの筋肉部分がそれらに含まれる筋肉内脂肪の量で発散するシナリオにつながる可能性があり、下流の分析からそのようなサンプルを除外することを正当化する可能性がある。したがって、筋肉内脂肪の量に関する主要な結論を引き出すために単にRT-qPCRに頼るのではなく、むしろ組織学的定量化を支持するデータとして行うことが推奨される。
一緒に、このプロトコルは、脂肪線維症と戦うための新しい治療選択肢を開発するための最初のステップである筋肉内脂肪の視覚化と定量化を可能にする、堅牢で効率的で厳格な組織処理パイプラインを概説します。同時に、それは汎用性があり、筋肉内の多くの異なる細胞型ならびに他の組織の脂肪細胞に適応させることができる。
開示事項
著者らは、競合する利益を宣言していない。
謝辞
コピンケ研究所のメンバーには、データ収集と原稿の批判的読解を手伝ってくれたことに感謝します。また、フロリダ大学の筋学研究所のメンバーにも、原稿に関する貴重な意見に感謝します。この作業は、NIH助成金1R01AR079449によって支援されました。図 2 は Biorender で作成したものです。
資料
| Name | Company | Catalog Number | Comments |
| 16% PFA (Pack of 12, 10 mL bottles) | Electron Miscroscopy Sciences | 15710 | |
| 2.0 mL Microcentrifuge Tubes | Fisher Scientific | 05-408-138 | microcentrifuge tubes for snapfreezing/bead beating |
| 2-Methylbutane (4 L) | Fisher Chemical | O3551-4 | isopentane |
| Absolute Ethanol (200 proof) | ThermoFisher Scientific | BP2818100 | |
| AffiniPure Fab fragment donkey anti-mouse | Jackson ImmunoResearch | 715-007-003 | mouse-on-mouse blocking |
| Alexa Fluor 488 donkey anti-chicken secondary antibody | Jackson ImmunoResearch | 703-545-155 | |
| Alexa Fluor 488 donkey anti-mouse secondary antibody | Invitrogen | A21202 | |
| Alexa Fluor 488 donkey anti-rabbit secondary antibody | Invitrogen | A21206 | |
| Alexa Fluor 568 donkey anti-goat secondary antibody | Invitrogen | A11057 | |
| Alexa Fluor 568 donkey anti-rabbit secondary antibody | Invitrogen | A11037 | |
| Alexa Fluor 568 Phalloidin antibody | Invitrogen | A12380 | Dissolved in 1.5 mL methanol (~66 µM working solution) |
| BioLite 24-well Multidishes | ThermoFisher Scientific | 930186 | 24 well plate for PFA tissue incubation |
| Biometra TOne | analytikjena | 8462070301 | Thermal cycler |
| Chicken anti-GFP antibody | Aves Labs | GFP-1020 | |
| Chloroform/isoamyl alcohol 24:1(v/v) for molecular biology, DNAse, RNAse, and Protease free | ThermoFisher Scientific | AC327155000 | |
| Corn oil | Sigma Aldrich | C8267 | |
| DAPI stain | Invitrogen | D1306 | 150 µM working solution in dH2O |
| Donkey Serum (100 mL) | Millipore Sigma | 5058837 | for blocking solution |
| Dumont #5 Forceps | Fine Science Tools | 11251-20 | sharp-tipped tweezers |
| Fine Scissors Straight 9 cm | Fine Science Tools | 14060-09 | |
| Fluoromount-G | SouthernBiotech | 0100-01 | mounting medium |
| Glycerol, 99.5%, for molecular biology (500 mL) | Acros Organics | 327255000 | |
| Goat anti-PDGFRα antibody | R&D | AF1062 | |
| Hybridization Oven | VWR | 230301V | for Tamoxifen incubation |
| ImmEdge Hydrophobic Barrier PAP Pen | Vector Laboratories | H-4000 | hydrophobic pen |
| Insulin Syringe with Micro-Fine IV needle (28 G) | BD | 329461 | |
| Insulin Syringe with Slip Tip, 1 mL | BD | 329654 | Insulin syringe without needle, for oral gavaging |
| iScript cDNA Synthesis Kit | Bio-Rad | 1708890 | |
| Isoflurane | Patterson Veterinary | 78938441 | |
| Leica DMi8 inverted microscope | Leica | micrscope used for widefield IF and confocal imaging | |
| Micro Slides | VWR | 48311-703 | positively charged microscope slides |
| mouse anti-MYOD antibody | Invitrogen | MA1-41017 | |
| mouse anti-PAX7 antibody (supernatant) | DSHB | AB 428528 | |
| MX35 Premier+ Microtome blades | ThermoFisher Scientific | 3052835 | microtome blades |
| NanoDrop 2000 Spectrophotometer | ThermoFisher Scientific | ND2000 | spectrophotometer for RNA yield |
| Play-Doh | Hasbro | modeling compound | |
| PowerUp SYBR Green Master Mix | ThermoFisher Scientific | A25742 | green dye PCR master mix |
| Puralube Vet Ointment | Puralube | 17033-211-38 | vet ophthalmic ointment |
| QuantStudi 6 Flex Real-Time 384-well PCR System | Applied Biosystems | 4485694 | qPCR machine |
| Rabbit anti-perilipin antibody | Cell Signaling Technology | 9349S | |
| Red-Rotor Shaker | Hoefer Scientific | PR70-115V | shaker for IF staining |
| Richard-Allan Scientific Slip-Rite Cover Glass | ThermoFisher Scientific | 152460 | coverslips |
| RNeasy Mini Kit | QIAGEN | 74106 | contains mini spin columns |
| Safe-Lock Tubes 1.5 ml, natural | Eppendorf | 22363204 | |
| Sample Tubes RB (2 mL) | QIAGEN | 990381 | |
| Sodium azide | Alfa Aesar | 14314 | |
| Stainless Steel Beads, 2.8 mm | Precellys | KT03961-1-101.BK | small beads |
| Stainless Steel Beads, 5 mm | QIAGEN | 69989 | medium beads |
| Stainless Steel Beads, 7 mm | QIAGEN | 69990 | large beads |
| Stainless Steel Disposable Scalpels | Miltex | 327-4102 | scalpel |
| Stainless steel feeding tube, 20 G x 38 mm, straight | Instech Laboratories | FTSS-20S-3 | gavage needle |
| Tamoxifen | Toronto Research Chemicals | T006000 | |
| Tissue Plus O.C.T. Compound | Fisher HealthCare | 4585 | embedding medium |
| TissueLyser LT | QIAGEN | 85600 | bead beater |
| TissueLyser LT Adapter, 12-Tube | QIAGEN | 69980 | |
| Tissue-Tek Cryomold | Sakura | 4566 | specimen molds |
| Triton X-100 | Alfa Aesar | A16046 | |
| TRIzol Reagent | ThermoFisher Scientific | 15596026 | guanidium thiocyanate |
| Tween20 (500 mL) | Fisher BioReagents | BP337-500 | |
| VWR Micro Slides - Superfrost Plus | VWR | 48311703 | |
| Wheaton Coplin staining jars | Millipore Sigma | S6016 | Coplin jar |
参考文献
- Milad, N., et al. Increased plasma lipid levels exacerbate muscle pathology in the mdx mouse model of Duchenne muscular dystrophy. Skeletal Muscle. 7 (1), 19(2017).
- Goodpaster, B. H., et al. Obesity, regional body fat distribution, and the metabolic syndrome in older men and women. Archives of Internal Medicine. 165 (7), 777-783 (2005).
- Goodpaster, B. H., et al. Association between regional adipose tissue distribution and both type 2 diabetes and impaired glucose tolerance in elderly men and women. Diabetes Care. 26 (2), 372-379 (2003).
- Goodpaster, B. H., et al. The loss of skeletal muscle strength, mass, and quality in older adults: the health, aging and body composition study. The Journals of Gerontology, Series A: Biological Sciences and Medical Sciences. 61 (10), 1059-1064 (2006).
- Goodpaster, B. H., Thaete, F. L., Kelley, D. E. Thigh adipose tissue distribution is associated with insulin resistance in obesity and in type 2 diabetes mellitus. American Journal of Clinical Nutrition. 71 (4), 885-892 (2000).
- Goodpaster, B. H., Theriault, R., Watkins, S. C., Kelley, D. E. Intramuscular lipid content is increased in obesity and decreased by weight loss. Metabolism. 49 (4), 467-472 (2000).
- Burakiewicz, J., et al. Quantifying fat replacement of muscle by quantitative MRI in muscular dystrophy. Journal of Neurology. 264 (10), 2053-2067 (2017).
- Murphy, W. A., Totty, W. G., Carroll, J. E. MRI of normal and pathologic skeletal muscle. American Journal of Roentgenology. 146 (3), 565-574 (1986).
- Willcocks, R. J., et al. Multicenter prospective longitudinal study of magnetic resonance biomarkers in a large duchenne muscular dystrophy cohort. Annals of Neurology. 79 (4), 535-547 (2016).
- Wokke, B. H., et al. Quantitative MRI and strength measurements in the assessment of muscle quality in Duchenne muscular dystrophy. Neuromuscular Disorders. 24 (5), 409-416 (2014).
- Contreras, O., Rossi, F. M. V., Theret, M. Origins, potency, and heterogeneity of skeletal muscle fibro-adipogenic progenitors-time for new definitions. Skeletal Muscle. 11 (1), 16(2021).
- El Agha, E., et al. Mesenchymal stem cells in fibrotic disease. Cell Stem Cell. 21 (2), 166-177 (2017).
- Joe, A. W., et al. Muscle injury activates resident fibro/adipogenic progenitors that facilitate myogenesis. Nature Cell Biology. 12 (2), 153-163 (2010).
- Liu, W., Liu, Y., Lai, X., Kuang, S. Intramuscular adipose is derived from a non-Pax3 lineage and required for efficient regeneration of skeletal muscles. Developmental Biology. 361 (1), 27-38 (2012).
- Scott, R. W., Arostegui, M., Schweitzer, R., Rossi, F. M. V., Underhill, T. M. Hic1 defines quiescent mesenchymal progenitor subpopulations with distinct functions and fates in skeletal muscle regeneration. Cell Stem Cell. 25 (6), 797-813 (2019).
- Uezumi, A., et al. Fibrosis and adipogenesis originate from a common mesenchymal progenitor in skeletal muscle. Journal of Cell Science. 124, Pt 21 3654-3664 (2011).
- Hogarth, M. W., et al. Fibroadipogenic progenitors are responsible for muscle loss in limb girdle muscular dystrophy 2B. Nature Communications. 10 (1), 2430(2019).
- Uezumi, A., Fukada, S., Yamamoto, N., Takeda, S., Tsuchida, K. Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle. Nature Cell Biology. 12 (2), 143-152 (2010).
- Stumm, J., et al. Odd skipped-related 1 (Osr1) identifies muscle-interstitial fibro-adipogenic progenitors (FAPs) activated by acute injury. Stem Cell Research. 32, 8-16 (2018).
- Kopinke, D., Roberson, E. C., Reiter, J. F. Ciliary Hedgehog signaling restricts injury-induced adipogenesis. Cell. 170 (2), 340-351 (2017).
- Huang, Y., Das, A. K., Yang, Q. Y., Zhu, M. J., Du, M. Zfp423 promotes adipogenic differentiation of bovine stromal vascular cells. PLoS One. 7 (10), 47496(2012).
- Sun, Y. -M., et al. PDGFRα regulated by miR-34a and FoxO1 promotes adipogenesis in porcine intramuscular preadipocytes through Erk signaling pathway. International Journal of Molecular Sciences. 18 (11), 2424(2017).
- Te, L. J. I., Doherty, C., Correa, J., Batt, J. Identification, isolation, and characterization of fibro-adipogenic progenitors (FAPs) and myogenic progenitors (MPs) in skeletal muscle in the rat. Journal of Visualized Experiments: JoVE. (172), e61750(2021).
- Lukjanenko, L., et al. Aging disrupts muscle stem cell function by impairing matricellular WISP1 secretion from fibro-adipogenic progenitors. Cell Stem Cell. 24 (3), 433-446 (2019).
- Santini, M. P., et al. Tissue-resident PDGFRalpha(+) progenitor cells contribute to fibrosis versus healing in a context- and spatiotemporally dependent manner. Cell Reports. 30 (2), 555-570 (2020).
- Uezumi, A., et al. Identification and characterization of PDGFRalpha+ mesenchymal progenitors in human skeletal muscle. Cell Death & Disease. 5, 1186(2014).
- Wosczyna, M. N., et al. Mesenchymal stromal cells are required for regeneration and homeostatic maintenance of skeletal muscle. Cell Reports. 27 (7), 2029-2035 (2019).
- Soliman, H., et al. Pathogenic potential of Hic1-expressing cardiac stromal progenitors. Cell Stem Cell. 26 (2), 205-220 (2020).
- Chung, M. I., Bujnis, M., Barkauskas, C. E., Kobayashi, Y., Hogan, B. L. M. Niche-mediated BMP/SMAD signaling regulates lung alveolar stem cell proliferation and differentiation. Development. 145 (9), Cambridge, England. (2018).
- Hilgendorf, K. I., et al. Omega-3 fatty acids activate ciliary FFAR4 to control adipogenesis. Cell. 179 (6), 1289-1305 (2019).
- Waisman, A., Norris, A. M., Elías Costa, M., Kopinke, D. Automatic and unbiased segmentation and quantification of myofibers in skeletal muscle. Scientific Reports. 11 (1), 11793(2021).
- Kang, S. H., Fukaya, M., Yang, J. K., Rothstein, J. D., Bergles, D. E. NG2+ CNS glial progenitors remain committed to the oligodendrocyte lineage in postnatal life and following neurodegeneration. Neuron. 68 (4), 668-681 (2010).
- Srinivas, S., et al. Cre reporter strains produced by targeted insertion of EYFP and ECFP into the ROSA26 locus. BMC Developmental Biology. 1, 4(2001).
- Lukjanenko, L., Brachat, S., Pierrel, E., Lach-Trifilieff, E., Feige, J. N. Genomic profiling reveals that transient adipogenic activation is a hallmark of mouse models of skeletal muscle regeneration. PLoS One. 8 (8), 71084(2013).
- Mahdy, M. A., Lei, H. Y., Wakamatsu, J., Hosaka, Y. Z., Nishimura, T. Comparative study of muscle regeneration following cardiotoxin and glycerol injury. Annals of Anatomy = Anatomischer Anzeiger: Official Organ of the Anatomische Gesellscaft. 202, 18-27 (2015).
- Pisani, D. F., Bottema, C. D., Butori, C., Dani, C., Dechesne, C. A. Mouse model of skeletal muscle adiposity: a glycerol treatment approach. Biochemical and Biophysical Research Communications. 396 (3), 767-773 (2010).
- Kawai, H., et al. Experimental glycerol myopathy: a histological study. Acta Neuropathologica. 80 (2), 192-197 (1990).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative CT method. Nature Protocols. 3 (6), 1101-1108 (2008).
- Uezumi, A., et al. Mesenchymal Bmp3b expression maintains skeletal muscle integrity and decreases in age-related sarcopenia. The Journal of Clinical Investigation. 131 (1), 139617(2021).
- Biferali, B., et al. Prdm16-mediated H3K9 methylation controls fibro-adipogenic progenitors identity during skeletal muscle repair. Science Advances. 7 (23), 9371(2021).
- Biltz, N. K., Meyer, G. A. A novel method for the quantification of fatty infiltration in skeletal muscle. Skeletal Muscle. 7 (1), (2017).
- Vieites-Prado, A., Renier, N. Tissue clearing and 3D imaging in developmental biology. Development. 148 (18), Cambridge, England. (2021).
- Gómez-Gaviro, M. V., Sanderson, D., Ripoll, J., Desco, M. Biomedical applications of tissue clearing and three-dimensional imaging in health and disease. iScience. 23 (8), 101432(2020).
- Ueda, H. R., et al. Tissue clearing and its applications in neuroscience. Nature Reviews Neuroscience. 21 (2), 61-79 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved