Method Article
מדריך לבחינת היווצרות שומן תוך שרירי ומקורו התאי בשרירי השלד
In This Article
Summary
החלפת רקמת שריר בריאה בשומן תוך שרירי היא מאפיין בולט של מחלות ומצבים אנושיים. פרוטוקול זה מתווה כיצד לדמיין, לדמות ולכמת שומן תוך שרירי, ומאפשר מחקר קפדני של המנגנונים העומדים בבסיס היווצרות שומן תוך שרירי.
Abstract
אבות פיברו-אדיפוגניים (FAPs) הם תאים סטרומליים מזנכימליים הממלאים תפקיד מכריע במהלך הומאוסטזיס והתחדשות של שרירי השלד. FAPs בונים ומתחזקים את המטריצה החוץ-תאית הפועלת כפיגום מיופייבר מולקולרי. בנוסף, FAPs הם הכרחיים להתחדשות מיופייבר מכיוון שהם מפרישים מספר רב של גורמים מועילים שחשים תאי גזע השריר (MuSCs). במצבים חולים, לעומת זאת, FAPs הם המקור התאי של שומן תוך שרירי ורקמת צלקת פיברוטית. פיברוזיס שומני זה הוא סימן ההיכר של סרקופניה ומחלות נוירומוסקולריות, כגון ניוון שרירים דושן. אחד המחסומים המשמעותיים בקביעת הסיבה והאופן שבו FAPs מתמיינים לשומן תוך שרירי הוא שימור יעיל והדמיה לאחר מכן של אדיפוציטים, במיוחד בקטעי רקמות קפואות. שיטות קונבנציונליות של עיבוד רקמת שריר השלד, כגון הצמדה-הקפאה, אינן משמרות כראוי את המורפולוגיה של אדיפוציטים בודדים, ובכך מונעות הדמיה וכימות מדויקים. כדי להתגבר על מכשול זה, פותח פרוטוקול קפדני המשמר את המורפולוגיה האדיפוציטים בחתכי שרירי השלד ומאפשר הדמיה, הדמיה וכימות של שומן תוך שרירי. הפרוטוקול גם מתאר כיצד לעבד חלק מרקמת השריר עבור RT-qPCR, ומאפשר למשתמשים לאשר שינויים שנצפו ביצירת שומן על ידי צפייה בהבדלים בביטוי של גנים אדיפוגניים. בנוסף, ניתן להתאים אותו כדי לדמיין אדיפוציטים על ידי אימונופלואורסצנציה מלאה של דגימות שרירים. לבסוף, פרוטוקול זה מתאר כיצד לבצע מעקב אחר שושלת גנטית של FAPs המבטאים Pdgfrα כדי לחקור את ההמרה האדיפוגנית של FAPs. פרוטוקול זה מניב באופן עקבי תמונות אימונופלואורסצנטיות ברזולוציה גבוהה ומדויקת מבחינה מורפולוגית של אדיפוציטים, יחד עם אישור על ידי RT-qPCR, ומאפשר הדמיה וכימות חזקים, קפדניים וניתנים לשחזור של שומן תוך שרירי. יחד, צינור הניתוח המתואר כאן הוא הצעד הראשון לשיפור ההבנה שלנו לגבי האופן שבו FAPs מבדילים לשומן תוך שרירי, ומספק מסגרת לאימות התערבויות חדשניות למניעת היווצרות שומן.
Introduction
חדירת רקמת שריר בריאה עם פיברוזיס שומני היא תכונה בולטת של ניוון שרירים דושן (DMD) ומחלות נוירומוסקולריות אחרות, כמו גם סרקופניה, השמנת יתר וסוכרת 1,2,3,4,5,6,7,8,9,10 . למרות שחדירת שומן מוגברת במצבים אלה קשורה מאוד לירידה בתפקוד השרירים, הידע שלנו מדוע וכיצד נוצר שומן תוך שרירי עדיין מוגבל. FAPs הם אוכלוסיית תאים סטרומליים מזנכימליים רב-תכליתיים הנמצאת ברוב האיברים הבוגרים, כולל שרירי השלד11,12. עם הגיל ובמחלות כרוניות, לעומת זאת, FAPs מייצרים רקמת צלקת פיברוטית ומבדילים לתוך אדיפוציטים, אשר ממוקמים בין myofibers בודדים ויוצרים שומן תוך שרירי 13,14,15,16,17,18,19,20.
כדי להתחיל להילחם ביצירת שומן תוך שרירי, יש להגדיר את המנגנונים של האופן שבו FAPs הופכים לאדיפוציטים. PDFGFRα הוא הסמן "תקן הזהב" בתחום לזיהוי FAPs בתוך השריר של מספר מינים 13,16,17,18,20,21,22,23,24,25,26,27. כתוצאה מכך, נוצרו מספר קווי Cre שאינם ניתנים להשראה של מורין טמוקסיפן, תחת שליטתו של מקדם Pdgfrα, המאפשרים מניפולציה גנטית של FAPs in vivo באמצעות מערכת Cre-LoxP 27,28,29. לדוגמה, על ידי שילוב של קו Cre אינדוקטיבי זה עם כתב גנטי, ניתן לבצע מעקב אחר שושלת של FAPs, אסטרטגיה שיישמנו בהצלחה על מפת גורל FAPs בשרירים ורקמת שומן לבנה20,30. מלבד מעקב אחר שושלת, קווי Cre אלה מספקים כלים חשובים לחקר המרת FAP לשומן.
אחד המכשולים העיקריים בהגדרת המנגנון של ההמרה האדיפוגנית של FAPs לשומן תוך שרירי הוא היכולת לכמת בקפדנות ובשכפול את כמות השומן התוך שרירי שנוצרה בתנאים שונים. המפתח הוא לאזן את השימור של רקמת השריר והשומן ולהתאים זאת לשיטות ההכתמה הזמינות כדי לדמיין אדיפוציטים. לדוגמה, שרירי השלד מוקפאים לעתים קרובות ללא קיבוע מוקדם, מה שמשמר את המיופיברים אך משבש את המורפולוגיה של האדיפוציטים (איור 1). לעומת זאת, קיבוע ואחריו הטבעת פרפין, תוך הצגת היסטולוגיית הרקמות הטובה ביותר, כולל אדיפוציטים, מסירה את כל השומנים, ובכך הופכת את רוב הצבעים הליפופיליים, כגון הצבע הנפוץ שמן אדום O, לבלתי שמישים.
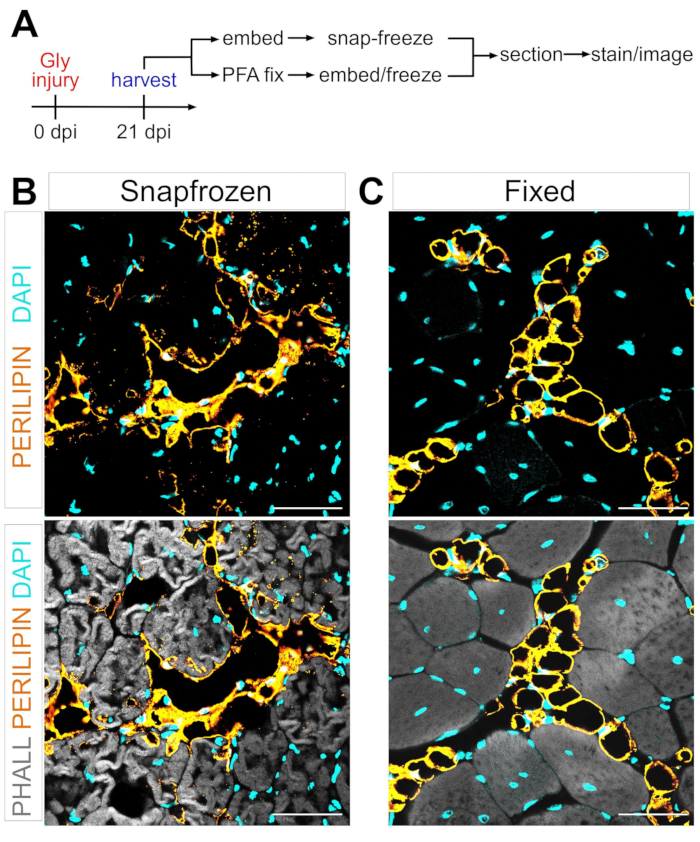
איור 1: תמונות מייצגות של שומן תוך שרירי ברקמות שריר קפואות לעומת קבועות. תמונות אימונופלואורסצנטיות המציגות אדיפוציטים (צהוב), מיופיברים (אפורים) וגרעינים (ציאן) בתוך TAs (B) מוקפאים ו-(C) קבועים ב-(C) לאחר 21 יום לאחר פגיעה בגליצרול. סרגלי קנה מידה: 50 μm. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
הפרוטוקול המתואר כאן משמר את המורפולוגיה של מיופייבר ואדיפוציטים ומאפשר הדמיה, וניתוח, של סוגי תאים מרובים. גישה זו מבוססת על צביעה אימונופלואורסצנטית של אדיפוציטים ברקמת שריר קבועה של פרפורמלדהיד (PFA), המאפשרת צביעה משותפת עם נוגדנים מרובים. ניתן גם להתאים אותו בקלות לתצוגה מרחבית של שומן תוך שרירי ברקמה שלמה באמצעות הדמיה בהרכבה מלאה, ובכך לספק מידע על המיקרו-סביבה התאית של השומן בתוך השריר. בנוסף, ניתן לשלב פרוטוקול זה עם הגישה שלנו שפורסמה לאחרונה כדי לקבוע את אזור החתך של myofibers ברקמות שריר קבועות31, מדידה חשובה להערכת בריאות השרירים. שילוב גישה זו עם מעקב אחר שושלת גנטית כדי למפות את ההבחנה של FAPs לתוך אדיפוציטים מתואר גם כאן. לפיכך, הפרוטוקול הרב-תכליתי המתואר כאן מאפשר הערכה קפדנית וניתנת לשחזור של FAPs והתמיינותם לשומן תוך שרירי בחתכי רקמות ורקמות שלמות.
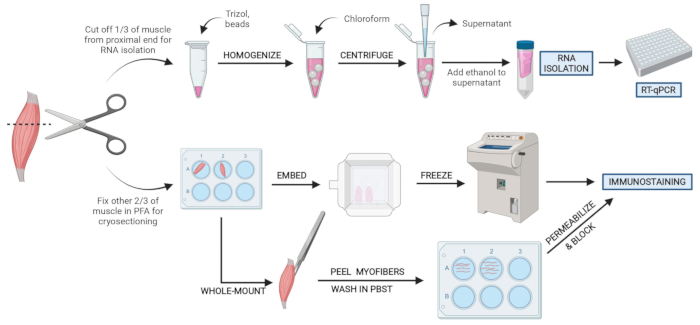
איור 2: סקירה כללית של פרוטוקול סכמטי. סקירה סכמטית של עיבוד רקמות שבו שליש מה- TA מוסר, מוקפא ומוזן והומוגני לצורך בידוד RNA וניתוח שעתוק לאחר מכן באמצעות RT-qPCR. שני השלישים האחרים של ה-TA הם קבועים ב-PFA ומעובדים לצורך שמירה חיסונית על חלקים קפואים או סיבים בהרכבה מלאה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Protocol
כל הפרוטוקולים של בעלי חיים אושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC) של אוניברסיטת פלורידה.
1. מעקב אחר שושלת גנטית של FAPs
הערה: אם לא רצוי מעקב אחר שושלת גנטית של FAPs, ניתן לדלג על שלב 1.
- כדי לבצע מעקב אחר שושלת של FAPs, השג את אללי העכבר הדרושים.
הערה: מספר קווי Cre הניתנים להשראה בטמוקסיפן, בשליטת מקדם Pdgfrα , נוצרו כדי להתמקד בהצלחה ב-FAPs, כולל ממעבדות הוגאן29, רנדו27 וברגלס32 . ככתב גנטי של פעילות Cre, אללים רבים של כתבים Rosa26 זמינים כגון Rosa26EYFP33. בעוד שכל מעבדה מציעה לכל מעבדה לקבוע איזה שילוב Cre-Reporter הוא היעיל ביותר, על ידי חציית עכברי PdgfrαCreERT2 (29 ו- Jax# 032770) לכתב Rosa26EYFP (33 ו- Jax# 006148), הכתב PdgfrαCreERT2 שנוצר; ניתן להשתמש בעכברי Rosa26EYFPכדי לסמן ביעילות ובאופן ספציפי FAPs20. כדי להתחקות אחר גורלם של FAPs בוגרים, מומלץ להמתין עד שהעכברים יגיעו לגיל של כ-10 שבועות לפחות לפני מתן טמוקסיפן. ניסויי מעקב אחר שושלת יכולים להתבצע הן על זכרים והן על נקבות. - מתן טמוקסיפן באמצעות גאבינג אוראלי
- מכינים 40 מ"ג/מ"ל טמוקסיפן בשמן תירס ומערבולת היטב כדי לערבב יום אחד לפני הגאבינג. הדגירה O/N בטמפרטורה של 37 מעלות צלזיוס בתנור היברידי מסתובב.
אזהרה: טמוקסיפן הוא חומר מסרטן ויש לטפל בו בזהירות. יש ללבוש תמיד כפפות בעת הטיפול וללבוש מסכה כאשר שוקלים אותה כאבקה, שכן קיימת סכנה של שאיפה. - נקו את השטח על פי הפרוטוקול והצמידו מחט גאבינג למזרק של 1 מ"ל. ציירו 200 μL של טמוקסיפן לתוך המזרק.
- Scruff PdgfrαCreERT2 ; עכברי Rosa26EYFP (בני 10 שבועות; שני המינים בשימוש) על ידי הנחתם על משטח שטוח ואחיזה חזקה בבסיס הזנב. השתמש ביד חופשית כדי לתפוס את מרכז העכבר עם האגודל והאצבע המורה, ואז בעדינות ובלחץ קל להחליק את האחיזה עד ממש מעבר לכתפיים.
- צבוט את העור בחזרה עם האגודל והאצבע המורה, הרם את העכבר והפוך את היד כך שהעכבר פונה אל המשתמש, ותחב את הזנב בין האצבע הוורודה לאצבע הטבעתית של היד המחזיקה את העכבר.
- בשלב זה, ודא שהעכבר משותק היטב ואינו מסוגל להזיז את ראשו או את זרועותיו. הכנס את מחט הגאבינג לתוך הפה והשתמש בה כדי להטות מעט את ראש העכבר לאחור; זה מאפשר לוושט להיות נגיש יותר.
- בזהירות ובאיטיות להכניס את המחט לתוך הוושט. אין לכפות את המחט אם מתקיימת התנגדות כלשהי; המחט צריכה להחליק למטה בקלות. לאט לאט להזריק את הטמוקסיפן. עקוב אחר העכברים במשך 15-20 דקות כדי לוודא שלא מתרחשות בעיות בזמן ההדבקה.
הערה: מתן טמוקסיפן במשך יומיים רצופים גורם בדרך כלל ליעילות רקומבינציה של כ-75%-85% של FAPs מבלי לגרום לתופעות לוואי כלשהן. מומלץ שהמשתמש ימתין 1-2 שבועות לפני שיגרום לפציעה, מה שיאפשר להסיר את הטמוקסיפן הנותר מהמערכת ולהפוך את כל החלבון שנותר.
- מכינים 40 מ"ג/מ"ל טמוקסיפן בשמן תירס ומערבולת היטב כדי לערבב יום אחד לפני הגאבינג. הדגירה O/N בטמפרטורה של 37 מעלות צלזיוס בתנור היברידי מסתובב.
2. פציעה בשריר הקדמי של טיביאליס (TA)
הערה: כדי לחקור שומן תוך שרירי, מומלץ להשתמש במודל פציעה מבוסס גליצרול (50% גליצרול במי מלח סטריליים), מה שמביא להיווצרות שומן תוך שרירית מסיבית 34,35,36,37.
- הכן את מכונת ההרדמה על ידי הוספת איזופלורן והבטחת הצינורות הן לתא העכבר והן לחרוט האף פתוחים. נקו את התא ואת אזור העבודה עם תמיסת אתנול או מי חמצן של 70% (בהתאם לפרוטוקולים).
- הגדר את קצב זרימת החמצן ל-2.5 ליטר לדקה ואת ריכוז האיזופלורן ל-2.5%. הכניסו עכבר לתא ההרדמה והמתינו כ-5 דקות עד שירדימו אותו.
- מניחים את העכבר על כרית חימום נקייה ומחדירים את האף לתוך חרוט האף. יש למרוח בעדינות משחת עיניים וטרינרית לעיניים עם אפליקטור עם קצה כותנה כדי למנוע יובש בזמן הרדמה. עקוב באופן רציף אחר ההרדמה ובצע צביטה בבוהן על העכבר לפני הפציעה כדי להבטיח שהעכבר מורדם לחלוטין.
- נקו את הרגל כדי שיוזרקו לה מגבון אלכוהול טרי לחיטוי.
- ציירו 30-50 μL של 50% גליצרול (תלוי בגודל העכברים) לתוך מזרק האינסולין. יש להבריש בעדינות את השיער שעל השוק כדי לחשוף את מיקום ה-TA.
הערה: קל יותר להזיז את השיער ולהשיג הדמיה טובה יותר כאשר הוא עדיין רטוב ממגוב האלכוהול. - לאחר איתור ה- TA (רק לרוחב השוקה, הוא בולט מעט דרך העור וניתן להרגיש אותו עם מישוש עדין), הכנס את המחט לתוך TA באופן דיסטלי, ליד הקרסול. החדרה מלאה של המחט לתוך השריר ולאט לאט הזרקת גליצרול תוך כדי משיכת המחט בהדרגה, מה שעוזר לפצוע את רוב השריר.
הערה: עדיף להכניס את המחט במקביל לרגל, עם זווית מעט מוגבהת. פציעה טובה גורמת בדרך כלל לדורסיביות כאשר הת"א מתכווץ לאחר משיכת המחט. אם אצבעות הרגליים של העכבר התפזרו, סביר להניח שהשריר extensor digitorum longus (EDL) הוזרק. - מניחים את העכבר בחזרה בכלוב ומנטרים במשך כ-15-20 דקות כדי להבטיח התאוששות בהרדמה.
- השליכו את המחט למיכל חדים. לעולם אל תסכם מחט.
הערה: יש לספק הזרקת משככי כאבים לאחר גליצרול כפי שאושר על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים. ניתן לצפות באדיפוציטים כבר 5 ימים לאחר הפציעה (dpi). על ידי 7 dpi, כל אדיפוציטים נוצרו, ועל ידי 21 dpi, הם הבשילו לחלוטין.
3. קצירת רקמות
- הכינו 4% PFA ב-1x PBS והניחו על קרח לפני תחילת הקטיף.
- הניחו את כל הצלחות (12 או 24-well) המשמשות לקיבוע שרירים על קרח והוסיפו 4% PFA לכל באר, תוך וודאו שלכל באר יש פי 10-20 יותר נפח PFA מאשר הרקמה המקובעת.
- בין 7 ל-21 יום לאחר פציעת הגליצרול, המתים את העכבר על פי הנחיות המוסד (כלומר, מנת יתר של איזופלורן ואחריה נקע צוואר הרחם).
- התחילו לקצור רקמות שישמשו להיסטולוגיה או לבידוד רנ"א.
הערה: יש להקפיא רקמות או להניח אותן ב-PFA תוך 10-15 דקות מההקרבה (איור 2). - יש לרסס בנדיבות את כל אזורי העכבר שיש לחתוך לתוכם ב-70% אתנול כדי לסייע בשמירה על שיער מחוץ לאזור הניתוח ולמכשירים.
- השתמשו במספריים כדי לחתוך את העור סביב החלק העליון של הרגל, ליד האגן (איור 3A).
- משכו בעדינות את עור הרגל מלמעלה למטה ועד הקרסול (איור 3B).
הערה: ה- TA הוא שריר בצורת דמעה עם גיד דיסטלי מוגדר בבירור המתחבר לכתב היתדות המדיאלי ולעצם המטטרסלית הראשונה. הוא רוחבי לטיביה ומשתרע עד הברך התחתונה. - ראשית, הסר את שכבת רקמת החיבור החיצונית (אפימיסיום) באמצעות פינצטה חדה לפני קצירת ה-TA (איור 3C). השתמש במיקרוסקופ ניתוח כדי לדמיין את האפימיסיום טוב יותר.
- החליקו את הפינצטה מתחת ל-TA מתחתית השריר, החל מהגיד הדיסטלי, ומשכו בעדינות כלפי מעלה לכיוון הברך (איור 3D). עצור בקצה השריר; אין לדחוף מעבר להתנגדות שהורגשה בברך התחתונה.
- אם יש התנגדות משמעותית לפני ההגעה לברך התחתונה, עצרו והמשיכו להסיר שאריות של שכבות של רקמת חיבור.
הערה: יש גיד דיסטלי נוסף רק לרוחב לגיד TA שמתחבר ל- EDL, שהוא שריר דק לרוחב ל- TA. הקפדה רק על החלקת הפינצטה מתחת לגיד TA מונעת קצירה בשוגג של ה-EDL, אך ניתן גם להסיר אותה בקלות לאחר הקיבוע. - לאחר שהת"א הוסר חלקית מהרגל עם הפינצטה, השתמש באותה תנועה עם אזמל כדי לנתק את החיבור של ה-TA לברך התחתונה (איור 3E). חותכים את הגיד בקרסול עם מספריים כדי להסיר את ה- TA במלואו. לטפל רק בשריר בגיד כדי למנוע פגיעה בסיבים.
- חותכים 1/3 מה-TA בקצה שמול הגיד (איור 3F), מכניסים אותו לצינור מיקרו-סנטריפוג' ומקפאים על-ידי הטלתו לחנקן נוזלי (איור 3H).
- הטביעו את 2/3 האחרים של הרקמה בבאר המסומנת ב-4% PFA להיסטולוגיה (איור 3I). הקפד לעקוב אחר מתי הרקמה הראשונה והאחרונה הונחה בקיבוע. מניחים על שייקר במשך 2-2.5 שעות בטמפרטורה של 4 מעלות צלזיוס.
- משך הקיבוע תלוי ברקמה ובגודלה. קבע את משך הזמן הנדרש לתיקון הרקמות. תיקון TAs במשך 2-2.5 שעות ב 4 °C בדרך כלל משמר את המורפולוגיה אדיפוציטים היטב מבלי לגרום לקיבוע יתר של הרקמה.
הערה: אם אתם מתכננים להשתמש ב-TA לצביעה אימונופלואורסצנטית בהרכבה מלאה, דלגו על שאר הפרוטוקול עד שתגיעו לסעיף 7: "צביעה אימונופלואורסצנטית של הר שלם". - לאחר הקיבוע, הסר PFA מהבארות, שטפו את הרקמות עם PBS קר 1x 2-3 פעמים, ולאחר מכן לשטוף 2-3 פעמים עם PBS קר 1x למשך 5 דקות לכל שטיפה.
- הסר את ה- PBS מהבארות והוסף מספיק 30% סוכרוז ב- 1x PBS כדי לאפשר לרקמה לצוף. מניחים על השייקר בטמפרטורה של 4 מעלות צלזיוס למשך הלילה.
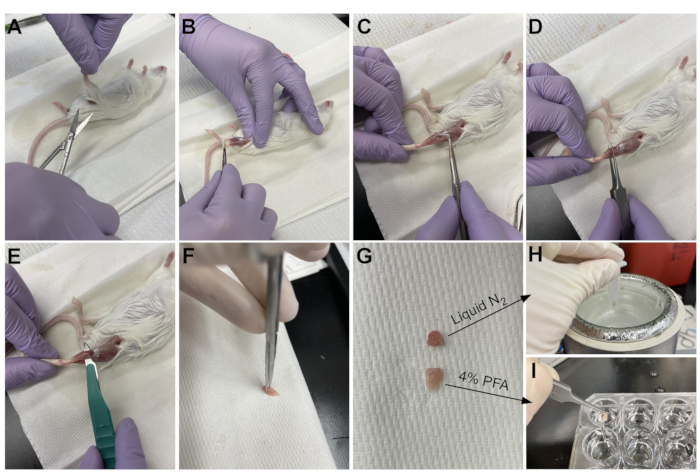
איור 3: סיכום קציר רקמות. (A) העור נחתך בבסיס הרגל ו-(B) שרירי הגפיים האחוריות חשופים. (C) לאחר הסרת האפימיסיום מהת"א, (D) נעשה שימוש במלקחיים כדי להפריד חלקית את השריר ולוודא שהאפימיסיום הוסר לחלוטין. (E) ה-TA נחתך מהרגל באמצעות אזמל ומוסר לאחר חיתוך הגיד. (G) לאחר חיתוך ה-TA לחתיכה של שליש ושני שלישים, (H) שליש אחד קפוא בחנקן נוזלי לצורך ניתוח RT-qPCR ו-(I) שני השלישים האחרים קבועים ב-4% PFA להיסטולוגיה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
4. הטמעה
- הכינו את תבניות הדגימה שישמשו להטבעה על ידי תיוג ומילוי עם מספיק מדיום הטבעה כדי להטביע את הרקמות במלואן.
- מוציאים את הרקמות מהבארות, מייבשים את עודפי הסוכרוז על מגבת נייר, ועוברים לתבניות הדגימה המקפיאות המלאות בבינוניות.
הערה: כדאי לדעת באיזה כיוון התבנית עם להיות חתך על cryostat. בדרך זו, המשתמש יכול לכוון את הרקמות בתבנית באופן המאפשר לאזור העניין להיות נגיש בקלות. עבור ה- TA, זה יושג על ידי הצבת הקצה העבה ביותר (הפוך מצד הגיד) מול המשטח שיחתוך. זה מאפשר לחתוך את ה- TA בקלות בחלק העבה ביותר שלו (הבטן) ומאפשר חיתוך חתך של סיבי השריר. - מכינים איזופנטן על ידי טבילה חלקית של מיכל המחזיק איזופנטן לחנקן נוזלי. ודא שיש מספיק איזופנטן נוזלי במיכל כדי להטביע כמחצית מתבנית הדגימה כדי לשמש להטמעת הרקמות.
- התחילו להקפיא את התבניות על ידי הכנסתן בזהירות לתוך ההמולה האיזופנטנית וודאו שכמחצית מהעובש שקועה. כמו כן, וודאו שהתבנית קופאת באופן שווה מכל ארבעת הצדדים.
- מוציאים את התבנית מהאיזופנטן רגע לפני שהתבנית כולה מוקפאת בעליל מלמעלה. משך הזמן שזה לוקח תלוי בתבניות שבהן נעשה שימוש.
- שמור את התבניות הקפואות במיכל עם קרח יבש תוך הקפאת שאר הבלוקים, ולאחר מכן אחסן אותם בטמפרטורה של -80 מעלות צלזיוס.
הערה: ניתן לעשות שימוש חוזר באיזופנטן להקפאה. מכניסים לבקבוק זכוכית אך לא מהדקים את המכסה עד שהזופנטן מגיע לטמפרטורת החדר (RT). אחרת, השינוי בלחץ עלול לנפץ את הבקבוק.
5. חתך
- הגדר את cryostat ל -22 עד -24 °C (74 °F), הוסף תבניות המכילות TAs לתוך cryostat, והמתן מינימום של 30 דקות להתאקלמות הטמפרטורה. בינתיים, סמן סדרה של שקופיות מיקרוסקופ טעונות חיובית.
- הכניסו צלחת נגד גלגול והתיישרו לקריוסטט כך שיהיו ניקים מינימליים בצלחת שבהם היא יוצרת מגע עם בלוק הדגימה. מאובטח במקום.
- הכניסו להב קריוסטאט טרי למחזיק הלהב והצמידו אותו למקומו.
אזהרה: הלהב חד. מכסים את הלהב בעת מניפולציה של חלקים אחרים של הקריוסטאט או תבניות קפואות. - הסר את הגוש הקפוא מהתבנית. הוסיפו שכבה אחידה של מדיום הטבעה לצ'אק הקריוסטט והניחו את הבלוק בתווך. תנו לו לשבת במשך 1-3 דקות עד שמדיום ההטבעה יוקפא לחלוטין (לבן אטום).
הערה: עבור TAs, האזור העבה ביותר (בטן) צריך להיות גלוי כאשר על הצ'אק. - מניחים את צ'אק הקריוסטט עם בלוק הרקמה לתוך הקריוסטט. חשפו את הלהב והקדמו את הקריוסטט קדימה עד שפשוט בא במגע עם הלהב. חותכים דרך הבלוק בקטעים של 25 מיקרומטר עד שהרקמה כבר לא מוסתרת על ידי מדיום ההטבעה.
הערה: בעת החתך, התאם את זווית הקריוסטאט ו/או מיקום הבמה כך שהמקטעים יהיו בעובי אחיד. זה עשוי להיות מועיל לאסוף כמה קטעים כדי להבטיח אחידות בעובי המקטע. מומלץ שהמשתמש ימצא את מיקום הלוחית נגד גלילה מתאים לפני שהוא חותך לאזור העניין בתוך ה- TA (בטן), שכן הדבר מאפשר למשתמש לנסות מספר מיקומים של צלחת האנטי-רול עד שהקטעים יורדים ישר מבלי לבזבז רקמה. - שנה את עובי המקטע ל-10-12 מיקרומטר ואסוף את החלקים על שקופיות מיקרוסקופ מסומנות. חתך טורי מומלץ על ידי איסוף קטעים סמוכים על 6-10 שקופיות (שכותרתן 1-x), מה שמאפשר צביעה עבור סמנים מרובים. במידת הצורך, השתמש במברשת דקה כדי לפתוח מקטעים לפני שתאסוף אותם בשקופית.
הערה: אם המקטעים מסתלסלים, בדקו שהטמפרטורה יציבה בטווח של -22 עד -24 מעלות צלזיוס. אם יש חתכים אנכיים בקטעים, זה יכול להיות בגלל ניק בלוחית האנטי-רול או בלהב; ניתן לתקן זאת על ידי התאמת המיקום של לוחית האנטי-גלגול ו/או מעבר ללהב חדש. - לאחר איסוף מקטעים סמוכים של אותו מישור חתך על כל שקופית, התאימו את העובי בחזרה ל-25 מיקרומטר כדי להתקדם ב-150-200 מיקרומטר דרך הבלוק, ואז התאימו את העובי בחזרה ל-10-12 מיקרומטר והתחילו לחתוך שוב.
הערה: חתך טורי זה מאפשר למשתמש להמחיש, לצלם ולכמת בעומקים שונים באמצעות TA; שלושה עד ארבעה מקטעים טוריים לכל שקופית מספיקים. - אחסן את השקופיות ואת בלוקי הרקמות בטמפרטורה של -80 מעלות צלזיוס.
6. צביעה אימונופלואורסצנטית (IF) של חלקי רקמות
הערה: מכיוון שריכוזי הנוגדנים יכולים להשתנות בין הרבה ליצרנים, מומלץ לבצע אופטימיזציה על ידי הערכת מספר ריכוזים שונים של הנוגדנים בשקופיות הבדיקה לפני הכתמת שקופיות העניין.
- להפשיר / להחליק יבש או ב RT או על צלחת חמה ב 37 ° C במשך 10 - 20 דקות.
- השתמש בעט הידרופובי כדי לצייר קו בקצה משטח הנייר של המגלשה, שם הוא פוגש את הזכוכית.
- שים את המגלשות בצנצנת Coplin ושטוף עם 1x PBS + 0.1% Tween20 (PBST) 3-5x על שייקר לפחות 5 דקות לכל שטיפה כדי לייבש מחדש את חלקי הרקמות.
הערה: בשלב זה, חשוב לא לתת לשקופיות לשבת מבלי להיות שקועות ב- PBST (עד לקו ההידרופובי), אחרת חלקי הרקמות יתייבשו. - הניחו את המגלשות על המדף של תא לחות והוסיפו את המגלשות עם תמיסת חסימה של 310-350 μL (5% סרום חמורים ו-0.3% Triton X-100 ב-1x PBS) למשך 1-2 שעות ב-RT.
הערה: אין צורך בשלב חדירה נוסף, שכן תמיסת החסימה מכילה 0.3% טריטון X-100 המאפשר חדירה מספקת של חלקי הרקמה. בעת שימוש בנוגדנים ראשוניים שמקורם בעכברים (כלומר, PAX7 ו- MYOD1 המפורטים להלן), מומלץ לכלול שלב חסימה של עכבר על עכבר באמצעות שברי Fab (1:50) בתמיסת החסימה לשלב החסימה. זה יעזור להפחית את הרקע עקב קשירת לא ספציפית של הנוגדן המשני של העכבר לנוגדנים שאינם הראשוניים. - דיללו את הנוגדנים העיקריים שישמשו בתמיסת החסימה זמן קצר לפני שתמשיכו לשלב הבא כדלקמן:
- נוגדנים ראשוניים להכתמת אדיפוציטים והדמיית חתך שלם: דילול ארנב אנטי-פרילפין ביחס דילול של 1:1000.
- נוגדנים ראשוניים למעקב אחר שושלת של אדיפוציטים: אנטי-GFP עוף מדולל ביחס של 1:1000 ואנטי-פריליפין ארנב בשעה 1:1000.
- נוגדנים ראשוניים למעקב אחר שושלת של FAPs: מדולל עוף נגד GFP ביחס של 1:1000 ועזים נגד PDGFRα בשעה 1:250.
- נוגדנים ראשוניים לסמנים מיוגניים: עכבר מדולל נגד PAX7 ביחס של 1:25 או אנטי-MYOD1 של עכבר בשעה 1:250, ואנטי-LAMININ ארנב בשעה 1:1000.
הערה: בעוד שהנוגדנים המפורטים לעיל הוערכו בהצלחה עם פרוטוקול זה, סביר להניח כי סמנים ונוגדנים אחרים לסימון FAPs, אדיפוציטים ו / או סוגי תאים אחרים תואמים גם הם לפרוטוקול זה. מומלץ מאוד בעת שימוש בנוגדנים ראשוניים בפעם הראשונה כי המשתמש יכלול שקופית בקרה שלילית, שבה מושמטים נוגדנים ראשוניים. זה ישלוט על הספציפיות של הנוגדנים. כל שאר השלבים בפרוטוקול מתבצעים, כולל הוספת נוגדנים משניים, אך פתרון החסימה משמש לבדו בשלב הבא במקום הנוגדן העיקרי בתמיסת החסימה.
- השליכו את תמיסת החסימה מהשקופיות והכיסוי עם תמיסת חסימה של 310-350 μL עם נוגדנים ראשוניים ודגירה למשך הלילה בטמפרטורה של 4 מעלות צלזיוס בתא הלחות.
- למחרת, השליכו את תמיסת החסימה/נוגדנים ראשוניים מהשקופיות והניחו אותם בצנצנת קופלין. שטפו את המגלשות 2-3 פעמים עם PBST ושטפו 3-5x עם PBST על שייקר למשך 5 דקות לפחות לכל שטיפה.
- במהלך הכביסה האחרונה, הכינו את הנוגדנים המשניים או כל צמד ישיר שישמשו בתמיסת החסימה. מזער את משך הזמן שנוגדנים אלה מבלים באור כדי למנוע הלבנת תמונות.
- דילול נוגדנים משניים/מצומדים ישירים: 488 ננומטר חמור אנטי-עוף (1:1000) או אנטי-ארנב (1:1000) או אנטי-עכבר (1:1000), 568 ננומטר חמור אנטי-עז (1:1000) או אנטי-ארנב (1:1000) או פלואידין (מיופיברים; 1:100), כתם DAPI (גרעינים; 1:500).
- יש לכסות את השקופיות ב-310-350 μL של תמיסת החסימה עם נוגדנים משניים ו/או מצומדים ישירים בתא הלחות. דגירה ב- RT למשך 1-2 שעות. הגן על דגימות מפני אור מעתה והלאה.
- השליכו את תמיסת החסימה/נוגדנים משניים והניחו אותם בצנצנת קופלין. יש לשטוף עם PBST פעם אחת ולשטוף 3-5x עם PBST על שייקר למשך 5 דקות לפחות לכל שטיפה. שמרו על צנצנת קופלין מכוסה כדי למנוע חשיפה לאור.
- יבשו את המגלשות בצורה טובה ככל האפשר על ידי הקשה על הקצוות וניגוב הגב על מגבת נייר, אך אל תתנו לחלקי הרקמות להתייבש.
- הוסף שלוש או ארבע טיפות של אמצעי הרכבה מימי לקצה האופקי העליון של המגלשה והוסף בעדינות כיסוי. אין ללחוץ כלפי מטה או לזוז אם נוצרות בועות אוויר מתחת למכסה; כל לחץ או תנועה יכולים לעוות את הארכיטקטורה התאית השברירית של אדיפוציטים.
- אפשרו למדיום ההרכבה להתמקם בחושך במשך הלילה לפני ההדמיה.
7. צביעה אימונופלואורסצנטית בהרכבה מלאה
- לאחר כשעה אחת של קיבוע (ראה שלב 3.14), השתמש בפינצטה חדת קצה כדי לקלף את myofibers מה- TA הקבוע.
- מניחים את הסיבים המופרדים בצלחת של 24 בארות ושוטפים 3x למשך 3 דקות כל אחד עם PBST. עבור כל הדגירות הבאות, הקפד להוסיף את המכסה כדי למנוע אידוי.
- דגירה במשך שעה אחת ב-1% Triton X-100 ב-1x PBS ב-RT (200-300 μL) על שייקר כדי לאפשר חדירה טובה יותר של נוגדנים.
- לאחר שטיפה מספר פעמים עם PBST, שכבה עם תמיסת חסימה (200-300 μL) וחוסם על nutator או שייקר לילה ב 4 °C (66 °F).
- דילול הנוגדנים העיקריים בריכוז הרצוי (הכפלת הריכוז נוטה להיות נקודת התחלה טובה) בתמיסה החוסמת. הדגירה של הדגימות (200-300 μL) על מחט או שייקר לילה בטמפרטורה של 4 מעלות צלזיוס.
- שטפו את הדגימות בקפדנות עם PBST לאורך כל היום עם שינויים תכופים ב- RT על השייקר, בערך פי 4-6 במשך 30-60 דקות כל שטיפה.
- דיללו את הנוגדנים המשניים בתמיסה החוסמת בריכוז הרצוי (1:500 נוטה לעבוד היטב) בתוספת צביעה גרעינית ודגמו את הדגימות (200-300 μL) על מחט או שייקר לילה בטמפרטורה של 4 מעלות צלזיוס.
- דגימות שטיפה קפדניות עם PBST לאורך כל היום עם שינויים תכופים ב- RT על השייקר, בערך פי 4-6 פעמים במשך 30-60 דקות כל שטיפה או שטיפה לילה ב 4 °C (74 °F).
- כדי להרכיב, יש לייבש בעדינות את עודפי ה-PBST ולאחר מכן להניח את הסיבים בטיפה אחת או שתיים של מדיום הרכבה על מגלשת זכוכית (איור 4A). כדי להעלות את מכסה הכיסוי (18 מ"מ x 18 מ"מ), להוסיף רגלי חימר קטנות; פעולה זו תמנע את מעיכת הסיבים ותאבטח את הכיסוי למגלשה. תרכובות מידול עובדות היטב עבור זה. לאחר אבטחת הכיסוי, יש להוסיף עוד מדיום לקצה עד שהאזור שמתחת לכיסוי מתמלא.
הערה: במקום להשתמש במדיום הרכבה המכיל חומרים אנטי-דהויים, ניתן גם להעביר את הרקמה דרך סדרה עולה של גליצרול (30% עד 80% גליצרול ב-PBS). - המתן יום-יומיים לפני ההדמיה כדי לאפשר ריפוי של מדיום הרכבה.
8. הדמיה של שומן תוך שרירי
- הפעל את המיקרוסקופ והפעל את תוכנת ההדמיה. אבטח את השקופית על הבמה.
הערה: להדמיית אדיפוציטים בחתכי שרירים, מטרה של פי 5 או 10x בשילוב עם מיקרוסקופיה בשדה רחב מספיקה לעתים קרובות. להדמיית WM-IF, נדרש מיקרוסקופ קונפוקלי. - השתמש בכל ערוץ כדי לזהות את האזור שיש להצטלם.
- בתוכנת ההדמיה, התאימו את זמן הרווח והחשיפה עבור כל ערוץ.
- צלם תמונות של כל הרקמה בכל ערוץ (אוטומטי או ידני על פי מיקרוסקופ ותוכנה בשימוש) ומזג אריחים בודדים כדי ליצור קומפוזיט של חתך TA מלא.
הערה: מומלץ לצלם תמונות של שניים או שלושה חלקים שונים של אותו TA בעומקים שונים. על ידי כימות האדיפוציטים בכל סעיף ולאחר מכן דיווח על הממוצע, הבדלים מקומיים בכמות השומן התוך שרירי עקב, למשל, טעויות הזרקה יימנעו.
9. כימות אדיפוציטים
- אם לא הותקן בעבר, הוסף את התוסף Cell Counter ל- ImageJ (https://imagej.nih.gov/ij/plugins/cell-counter.html).
- יבא את התמונות לתוך ImageJ כקבצי TIF או קבצי מיקרוסקופ מקוריים. הצג כל ערוץ ב- ImageJ כקובץ TIF נפרד.
הערה: אם אתה משתמש ב- LIF או בסוגי קבצים דומים של מיקרוסקופ, תחת אפשרויות ייבוא פורמטים ביולוגיים , בחר Hyperstack עבור תצוגה מחסנית עם וסמן את התיבה עבור ערוצים מפוצלים. לחץ על אישור כדי לפתוח את הקובץ. כמו כן, ודא שהתיבה 'שינוי גודל אוטומטי' אינה מסומנת. - ודא שהתמונות עבור כל ערוץ הן בתבנית של 8 סיביות (ואפור): > תמונה הקלד > 8 סיביות.
- מיזוג DAPI (כחול), GFP (ירוק), PERILIPIN (אדום) ו- PHALLOIDIN (אפור) תמונות: תמונה > צבע > ערוצי מיזוג.
- בדוק כי קנה המידה (נתח > קנה מידה מוגדר) הוא במיקרונים. באמצעות כלי הבחירה ביד חופשית, תאר את החלק הפצוע והלא-פגוע של כל חתך רוחב, ולאחר מכן מדוד (נתח > מדידה) ותעד את האזור הפגוע לעומת הלא-פגוע בגיליון אלקטרוני.
הערה: ניתן לזהות שריר פגוע כאזורים נטולי מיופיבר או אזורים המאוכלסים על ידי מיופיברים המכילים גרעינים הממוקמים במרכז. - הפעל מונה תאים: תוספים > CellCounter > אתחול.
- בחר סוג מונה, ולאחר מכן ספר כל אדיפוציט. רשום את המספר הכולל של אדיפוציטים בגיליון אלקטרוני, ולאחר מכן חשב את מספר האדיפוציטים לכל 1 מ"מ2 של האזור הפצוע.
10. ניתוח ביטוי גנים אדיפוגני באמצעות RT-qPCR
- בידוד RNA
- לפני ההתחלה, מחממים מראש מים ללא RNase ל-45 מעלות צלזיוס ומכינים 70% EtOH טריים (350 μL לכל דגימה).
- הוסף 1,000 μL של guanidium thiocyanate לכל צינור המכיל את הדגימה (ראה שלב 3.12.). חשוב כי נעשה שימוש בצינורות המאושרים על ידי מקציף חרוזים.
אזהרה: גואנידיום תיוציאנט רעיל. לבשו ציוד מגן אישי מתאים והחזיקו ידית במכסה אדים. - מוסיפים שלושה חרוזים בינוניים או חרוז אחד גדול וחרוז אחד קטן לכל צינור.
- הומוגניזציה של הרקמה ב-50 הרץ למשך 2-4 דקות באמצעות מכת חרוזים. בהתאם לסוג הרקמה ולגודל המדגם, זה עשוי להימשך עד 10 דקות.
- מוסיפים 200 μL של כלורופורם.
אזהרה: כלורופורם רעיל. לבשו ציוד מגן אישי וידית במכסה אדים. - לנער את הדגימות במשך 15 שניות. דגירה למשך 2-3 דקות ב- RT.
- צנטריפוגה במשך 15 דקות ב 12,000 x g. פיפטו 350 μL של הסופרנאטנט השקוף (השכבה העליונה המכילה את הרנ"א) והוסיפו לצינור מיקרוצנטריפוג' חדש המכיל 350 μL של 70% אתנול. היזהרו שלא לשאוף לשכבות החלבון ו/או הדנ"א הנמוכות יותר
- מעבירים עד 700 μL של התערובת לעמוד ספין קטן הממוקם בצינור איסוף של 2 מ"ל. המשך עם בידוד RNA בהתאם להוראות היצרן.
- Elute עם 30-50 μL של מים ללא RNase, בהתאם לתפוקה הצפויה. שמור RNA על קרח ומדוד את התשואה באמצעות ספקטרופוטומטר. שמור על ה- RNA מאוחסן בטמפרטורה של -80 °C (80 °F)
הערה: ניתן להשמיט את שלב הטיפול ב- DNase, שכן הורדה זהירה של 350 μL רק של שכבת ה- RNA העליונה מספיקה כדי למנוע זיהום DNA. בנוסף לניתוח RT-qPCR, הרנ"א המבודד יכול לשמש גם לריצוף RNA, ובמקרה זה מומלץ מאוד לשלב טיפול ב- DNase.
- סינתזת cDNA
- השתמש בעד 1 מיקרוגרם של RNA כדי לסנתז cDNA עם ערכת סינתזה של cDNA, בהתאם להוראות היצרן.
- לאחר השלמת הריצה, הוסיפו 80 μL של מים ללא RNase. אחסן את הדוגמאות בטמפרטורה של -20 מעלות צלזיוס.
- RT-qPCR של גנים סלקטיביים אדיפוציטים.
- באמצעות פורמט של 384 באר, הוסף 1 μL של פריימר (~ 1 μM ריכוז סופי) לתחתית כל באר. פריימרים לפני ייבוש גורמים לשכפולים טכניים הדוקים יותר. השאירו מכוסים עד שהפריימרים התאדו לחלוטין (ניתן להניח את הצלחת על גוש חימום המוגדר ל-37 מעלות צלזיוס כדי להאיץ את האידוי).
- הגדר תגובות לדוגמה עם ארבעה עד שמונה שכפולים טכניים באופן הבא: 2.5 μL של תערובת מאסטר RT-PCR מבוססת צבע, 2.1 μL של מים ללא RNase, ו- 0.4 μL של cDNA (~ 1 ng) עם נפח כולל של 5 μL לכל באר. נעשה שימוש בתנאי המחזור התרמי הבאים: דנטורציה בטמפרטורה של 95 מעלות צלזיוס למשך 15 שניות וחישול/הרחבה ב-60 מעלות צלזיוס למשך 25 שניות למשך 40 מחזורים.
- נרמל ערכי CT גולמיים (סף מחזור) לרמות של גנים של משק בית (כלומר, Hprt ו-Pde12) על ידי חישוב ΔΔCT כמתואר כאן38. ראה20 עבור רצפי פריימרים.
הערה: יש לעקוב אחר הנוהג הסטנדרטי לניתוח RT-qPCR, כגון שימוש בבקרת תמלול הפוך (-RT) מינוס, תגובת PCR ואימות פריימר.
תוצאות
הדמיה אימונופלואורסצנטית של שומן תוך שרירי
בעקבות השלבים לעיל וצפייה באיור 1A, נתחי רקמות TA נאספו מפציעה שלאחר הגליצרול במשך 21 יום, אשר הוקפאו מיד לאחר הקטיף באיזופנטן מקורר LN2 או תוקנו ב-4% PFA למשך 2.5 שעות. לאחר ההקפאה והכתמת שתי הדגימות, צולמו תמונות באמצע הבטן, האזור הגדול ביותר של ה-TA. אדיפוציטים PERILIPIN+ מה-TAs הלא מזוהים (איור 1B) שינו באופן משמעותי את המורפולוגיה בהשוואה למקטעים קבועים (איור 1C), מה שהופך את הזיהוי, ההדמיה והכימות שלאחר מכן להרבה יותר קשים ובלתי מדויקים. יש לציין כי טיפות השומנים הראשונות של PERILIPIN+ זוהו בסביבות 5 ימים לאחר הפציעה, כאשר רוב האדיפוציטים נוצרו עד יום 7. עד 21 יום לאחר הפציעה, האדיפוציטים הבשילו לחלוטין.
מכיוון שכמות השומן לכל TA מתואמת מאוד עם חומרת הפציעה המושרה, יש לפצוע את ה- TAs באופן משמעותי כדי לצפות ולחקור ביעילות היווצרות שומן תוך שרירית. תרגול זריקות באמצעות דיו לתוך TAs cadaver הוא דרך מצוינת לשפר את חומרת הפציעה. פציעות מוצלחות נוטות להיות מעל 50% מהשריר. שימו לב, אזורים פצועים בשריר מייצגים אזורים נטולי סיבי שריר או אזורים המאוכלסים על ידי סיבי שריר המכילים לפחות גרעין אחד במיקום מרכזי, סימן היכר ידוע של סיב שריר מתחדש.
פרוטוקול זה יכול להיות מותאם בקלות לכתם עבור FAPs ושומן בתלת-ממד. לשם כך הופרדו בקפידה מספר מיופיברים מהת"א לאחר הקיבעון, ואחריהם אימונופלואורסצנציה שלם. המפתח הוא לאבטח כראוי את הסיבים למגלשת הזכוכית, ובמקביל, כדי למנוע דחיסת יתר של הרקמה. על-ידי שימוש בכפות חרסיתיות הניתנות לתבנית, המשתמש יכול להתאים את העובי הנדרש ולהדק את הכיסוי למגלשה, ואף לאפשר שימוש במיקרוסקופ הפוך (איור 4A). שיטה זו שימשה בהצלחה לסימון PDGFRα+ FAPs, פלואידין+ מיופיברים ואדיפוציטים המבטאים PERILIPIN (איור 4B, סרטון משלים 1 ווידאו משלים 2). לאחר קבלת תמונות במישורי z מרובים בעובי של עד 150 מיקרומטר, מודול העיבוד התלת-ממדי בתוך תוכנת המיקרוסקופ שימש ליצירת שחזור תלת-ממדי.
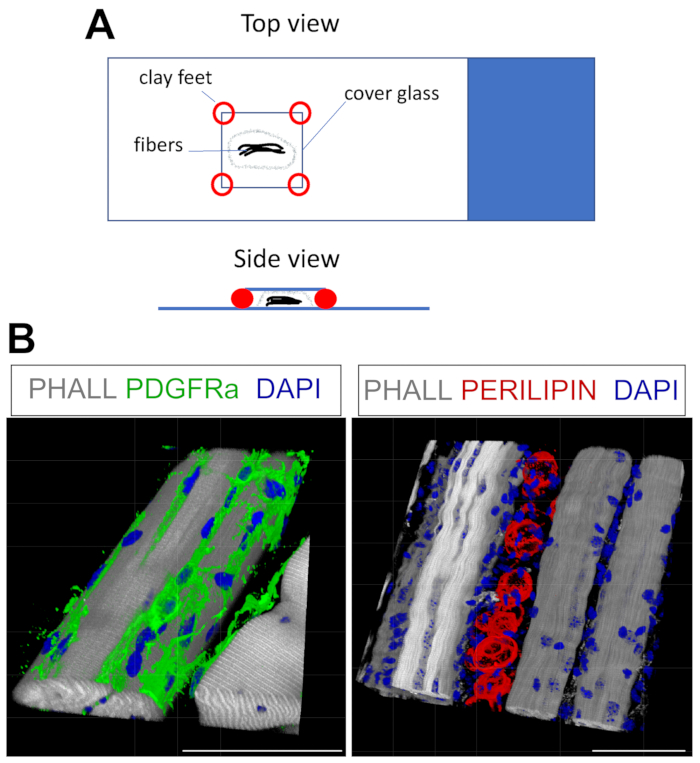
איור 4: צביעה אימונופלואורסנטית בהרכבה מלאה. (A) מבט עליון וצידי על אופן ההרכבה של הדגימה והוספת כיסוי לצביעה בהרכבה מלאה. (B) שחזורים תלת-ממדיים מייצגים של FAPs (ירוק; שמאל) ואדיפוציטים (אדום; מימין) יחד עם מיופיבר (אפור) וגרעינים (כחולים). סרגלי קנה מידה: 50 μm. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
כימות של שומן תוך שרירי
לאחר שצולמו תמונות של שומן תוך שרירי, פונקציית ה-Cell Counter ב-ImageJ/FIJI שימשה לספירה ידנית של מספר האדיפוציטים של PERLIPIN+ (איור 5A). לאחר מכן, נקבע השטח הכולל של חלק השרירים, כמו גם האזור הפגוע, המוגדר על ידי גרעינים הממוקמים במיקום מרכזי בתוך myofibers. כדי לשלוט בחומרת הפציעה, המספר הכולל של אדיפוציטים חולק באזור הפגוע וכתוצאה מכך מספר תאי השומן לכל 1 מ"מ2 של שריר פצוע. בדרך כלל, TAs המציגים <30% פגיעה אינם נכללים בכימותים. יש לציין, למרות שאדיפוציטים הם נדירים ללא פגיעה, הנעים בין אפס לשמונה לכל אזור חתך, המספר הכולל של אדיפוציטים עדיין מנורמל לפי שטח כולל. כפי שהודגש באיור 5B, פגיעה בגליצרול גורמת לכמויות אדירות של שומן תוך שרירי בהשוואה לשריר TA לא פגום. לחלופין, מכיוון שצביעת פריליפין נקייה מאוד עם יחס אות לרעש גבוה, ניתן גם להשתמש בפונקציית Analyze Particle כדי לקבוע את השטח הכולל שנכבש על ידי פריליפין. עם זאת, שיטה זו לא תוכל להבחין בין אדיפוציטים קטנים יותר לעומת פחות אדיפוציטים. עד שלושה קטעים מתוך לפחות ארבעה בעלי חיים בודדים צולמו וכימתו, והמספר הממוצע של תאי השומן הקיימים בכל עכבר דווח.
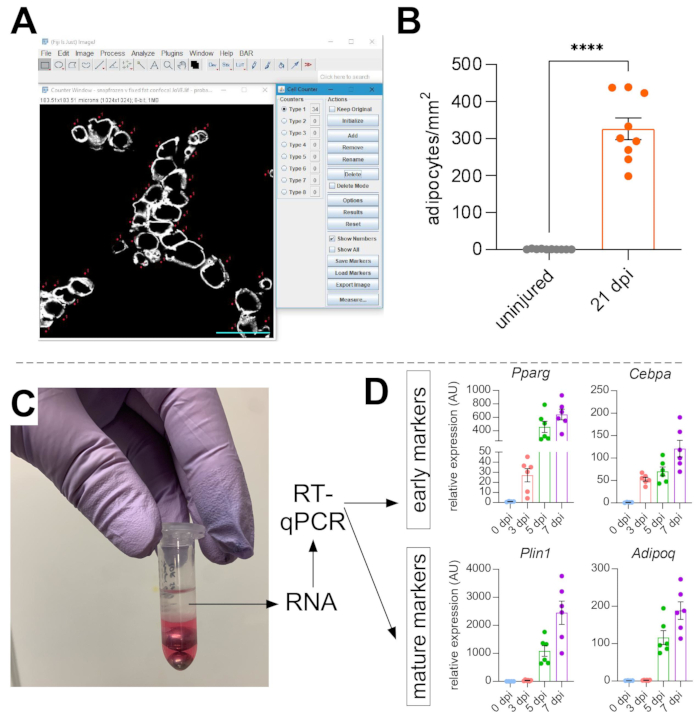
איור 5: כימותים של שומן תוך שרירי. (A) תמונה מייצגת של אופן ספירת אדיפוציטים PERILIPIN+ (לבן) באמצעות פונקציית מונה התאים ב-ImageJ. סרגל קנה מידה: 50 μm. (B) כימות אדיפוציטים שלם של TA 21 יום לאחר הזרקת גליצרול מנורמל ל -1 מ"מ2 של האזור הפצוע. כל נקודה מייצגת את הממוצע של עכבר אחד. פסי שגיאה המוצגים כ- SEM. **** = p < 0.0001. (C) שכבת RNA לאחר הומוגניזציה והפרדת פאזות עוקבת על ידי כלורופורם משמשת לניתוח RT-qPCR. (D) קיפול שינויים ברמות הביטוי של Pparg ו-Cepbα, גנים אדיפוגניים מוקדמים, ו-Plin1 ו-Adipoq, שני סמנים אדיפוציטים בוגרים, בנקודות זמן שונות לאחר פגיעה בגליצרול. כל נקודה מייצגת את הממוצע של עכבר אחד. פסי שגיאה המוצגים כ- SEM. לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
כדי לאשר באופן עצמאי את כמות השומן התוך שרירי הקיים, ניתן לקבוע רמות ביטוי גנים של סמנים אדיפוגניים שונים. לשם כך, ניתן לבודד RNA מחלק מאותו שריר ת"א המשמש לאימונופלואורסצנציה (ראו שלבים למעלה) בנקודות שונות לאחר הפציעה. מקציף חרוזים שימש בשילוב עם guanidium thiocyanate כדי הומוגניזציה של הרקמה. לאחר הוספת כלורופורם ואחריו צנטריפוגה, השכבה העליונה המכילה RNA חולצה בקפידה, ועמודי ספין קטנים שימשו לניקוי RNA (איור 5C). שיטה זו מייצרת באופן שגרתי איכות וכמות גבוהה של RNA המתאים לכל הניתוחים במורד הזרם כגון RT-qPCR ו- RNAseq. עבור RT-qPCR נקבעו רמות הביטוי היחסיות של גנים אדיפוגניים לגנים של משק בית, וכל השינויים היחסיים הוערכו בעקבות שיטת ΔΔCT38. כפי שמתואר באיור 5D, בהשוואה לשרירי TA לא פגועים, פגיעה בגליצרול גורמת לביטוי של סמנים אדיפוגניים מוקדמים כמו Pparg ו-Cebpα כבר 3 ימים לאחר הפציעה. סמנים בוגרים, כגון אדיפונקטין (Adipoq) ופריליפין (Plin1), ניתן לזהות כבר 5 ימים לאחר פציעת גליצרול.
מעקב אחר שושלת גנטית של אדיפוציטים
ניתן להתאים בקלות את פרוטוקול צביעת האדיפוציטים המוצג כאן כך שיכלול מעקב אחר שושלת גנטית של FAPs כדי למפות ולעקוב אחר גורלם לתוך אדיפוציטים. לדוגמה, הוכחנו בעבר כי רקומבינציה יכולה להיות מושרית באמצעות מתן טמוקסיפן ב- PdgfrαCreERT2; עכברי Rosa26EYFP שבועיים לפני הפציעה, מסירים למעשה את קידוד העצירה של floxed ומפעילים באופן בלתי נמנע ביטוי EYFP ב-FAPs (איור 6A). השגנו יעילות רקומבינציה גבוהה עם משטר הטמוקסיפן שהוצג כאן, כאשר כ-75% מה-PDGFRα+ FAPs מבטאים את EYFP20, בדומה למה שמעבדות אחרות דיווחו על 27,39,40. כדי להוכיח ש-FAPs הם אכן המקור התאי של שומן תוך שרירי, רוב ה-FAPs הפכו לאדיפוציטים המבטאים EYFP+ PERILIPIN 7 ימים לאחר פגיעה בגליצרול (איור 6B).
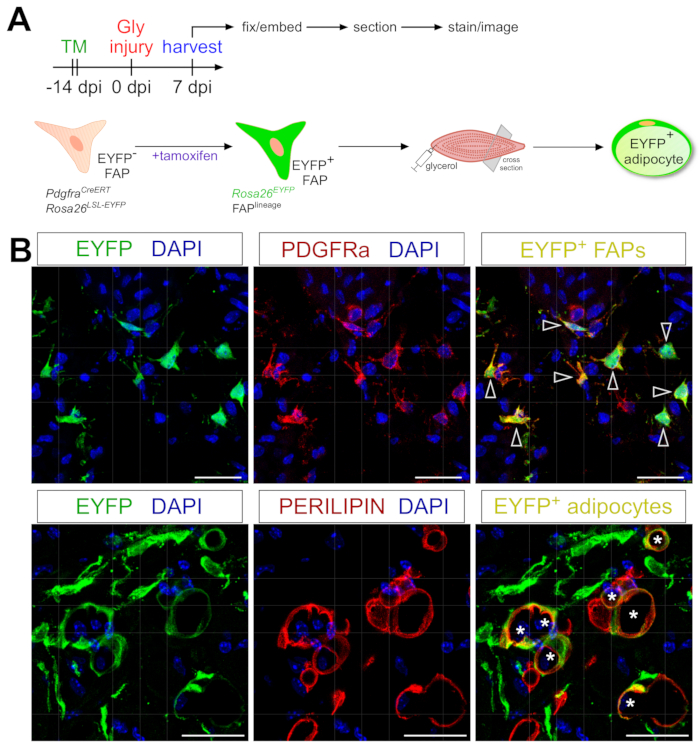
איור 6: מעקב אחר שושלת של FAPs. (A) סקירה סכמטית של מערך הניסוי. (B) תמונות אימונופלואורסצנטיות מייצגות המציגות רקומבינציה והפעלה מוצלחת של EYFP (צהוב) בתוך PDGFRα+ FAPs (אדום, ראשי חץ) ואדיפוציטים PERILIPIN+ (אדום, כוכביות). סרגלי קנה מידה: 25 μm. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
זיהוי של סוגי תאים מרובים
פרוטוקול זה יכול לשמש גם כדי לדמיין את התא המיוגני. באמצעות נוגדנים נגד PAX7 ו-MYOD1, תאי גזע שריריים (MuSCs) ומיובלסטים, בהתאמה, יכולים להיות מזוהים בקלות 5 ימים לאחר פגיעה בגליצרול אפילו בקטע רקמת שריר קבוע PFA (איור 7). לפיכך, הפרוטוקול המוצג הוא רב-תכליתי וניתן להתאמה לא רק לתווית ותמונה של אדיפוציטים ו- FAPs אלא גם לסוגי תאים אחרים של השושלת המיוגנית.
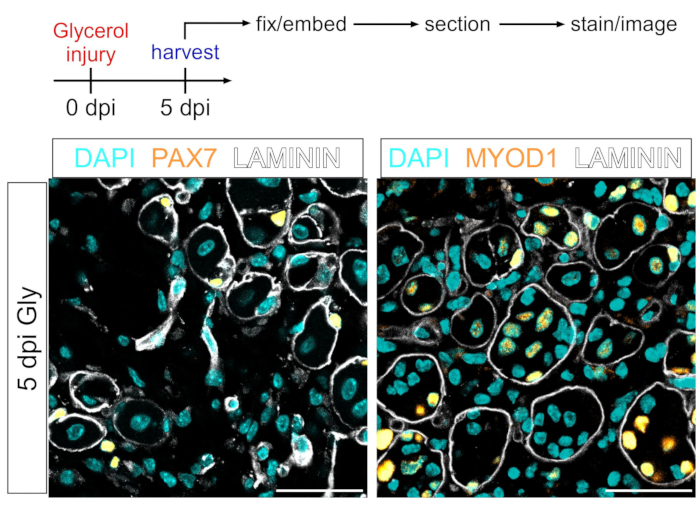
איור 7: תאי גזע שריריים וכתמים אימונופלואורסצנטיים של מיובלסט. (B) תמונות אימונופלואורסצנטיות מייצגות המציגות צביעה מוצלחת של תאי גזע שריריים (MuSC) (צהוב, שמאל) עם PAX7 ומיובלסטים (צהובים, מימין) עם MYOD1. LAMININ מתאר את המיופיברים (לבן), וגרעינים נמצאים בציאן. סרגלי קנה מידה: 50 μm. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
וידאו משלים 1: עיבוד תלת-ממדי של FAPs. שחזור תלת-ממדי של מיופיבר, FAPs וגרעינים מוכתמים עבור PHALLOIDIN (אפור), PDGFRα (ירוק) ו-DAPI (כחול), בהתאמה, 21 יום לאחר הפציעה. אנא לחץ כאן כדי להוריד את הסרטון הזה.
סרטון משלים 2: עיבוד תלת-ממדי של שומן תוך שרירי. עיבוד נפחי של צרורות מיופייבר (אפור, PHALLOIDIN) ושומן תוך שרירי (אדום, PERILIPIN), שהחליף מיופייבר 21 יום לאחר פגיעה בגליצרול. אנא לחץ כאן כדי להוריד את הסרטון הזה.
Discussion
פרוטוקול זה מתווה פרוטוקול נרחב ומפורט המאפשר הדמיה יעילה וכימות קפדני של שומן תוך שרירי. על ידי פיצול אותו שריר לשני חלקים, אחד משמש לאימונופלואורסצנציה והשני לניתוח RT-qPCR, פרוטוקול זה הוא גם מאוד תכליתי. ניתן גם לשלב אותו עם מעקב אחר שושלות גנטיות של FAPs כדי לחקור את ההמרה שלהם לאדיפוציטים בתנאים מסוימים, והוא מתאים מאוד לסימון ולתמונה של סוגי תאים נוספים מרובים.
הדרכים הנפוצות ביותר לדמיין שומן תוך שרירי הן מקטעי פרפין ואחריהם צביעת המטוקסילין ואאוזין או חלקים קפואים המוכתמים עבור צבעים ליפופיליים כגון שמן אדום O (ORO). עם זאת, בעוד שרקמות מעובדות פרפין שומרות על ההיסטולוגיה הטובה ביותר, אותו תהליך גם מחלץ את כל השומנים ומונע שימוש בצבעים ליפופיליים. אף על פי ששיטות צביעה ליפופיליות יעבדו הן על מקטעי רקמה קבועים ב-PFA והן על מקטעי רקמה לא מזוקקים, טיפות שומנים נעקרות בקלות על ידי הפעלת לחץ על הכיסוי, ובכך מעוותות את ההתפלגות המרחבית של השומן התוך שרירי. כדי לעקוף זאת, מחקר שנערך לאחרונה קבע פרוטוקול קפדני כדי לדמיין אדיפוציטים של ORO+ באמצעות גישה של הרכבה שלמה. לשם כך, המחברים עשו דה-תאיזציה של ה-TA כדי לדמיין את ההתפלגות המרחבית של השומן התוך-שרירי לאורך כל ה-TA41. עד כמה שטכניקה זו חזקה, היא גם מונעת שימוש בכתמים משותפים אחרים כדי לסמן מבנים תאיים נוספים. ניתן להשתמש בכל הגישה האימונופלואורסצנטית המוצגת כאן כדי להכתים יחד אדיפוציטים במגוון סמנים המאפשרים מיפוי עדין של הסביבה התאית. עם זאת, אחד האתגרים הגדולים הוא חדירת הרקמות של הנוגדנים. ככל שיותר סיבים נשמרים יחד, כך יהיה קשה יותר לנוגדנים לחדור באופן שווה ולקשור את כל האנטיגנים הזמינים. לכן, שיטה זו היא היעילה ביותר כאשר מסתכלים על קבוצות קטנות של סיבים. יחד עם זאת, זוהי גם מגבלה שכן המיקום האנטומי הכולל של שומן תוך שרירי הולך לאיבוד כאשר מתמקדים רק בחבילות סיבים קטנות וקלופים. עם זאת, עם הפיתוח הנוכחי של שיטות ניקוי רקמות חדשניות בתוספת טכנולוגיית הדמיה חדשה, חדירה והדמיה גדולות יותר של רקמות יתאפשרו בעתיד 42,43,44.
בעוד שקיבוע מוקדם של רקמת שריר משמר את המורפולוגיה של האדיפוציטים, הוא גם יוצר אתגר להעריך את גודל המיופיברים, מדידה חשובה של בריאות השריר. גודל מיופייבר נקבע על ידי מדידת שטח החתך של המיופיברים. דיווחנו בעבר כי קיבוע מוקדם של רקמת השריר יגרום לרוב הסמנים הזמינים לתאר מיופיברים להיכשל31. כדי להתגבר על מכשול זה, פיתחנו צינור סגמנטציה חדשני של תמונות, המאפשר מדידה של גודל מיופייבר אפילו בקטעי שרירים קבועים31. לפיכך, הקמנו צינור עיבוד רקמות חזק ויעיל, אשר בשילוב עם פרוטוקול זה, מתגבר על רוב החסרונות הנגרמים על ידי קיבוע קודם של רקמת שריר.
יתרון מרכזי נוסף של גישה זו הוא ורסטיליות. על ידי פיצול ה- TA לשני חלקים, כמות המידע שניתן לקבל משריר אחד היא מקסימלית. זה לא רק מקטין את מספר בעלי החיים, אלא גם מוסיף שכבה נוספת של שליטה על ידי אישור היסטולוגיה באמצעות ביטוי גנים ולהיפך. בנוסף, ניתן לבחון גנים רבים ושונים מעבר לגנים אדיפוגניים. הרנ"א המבודד יכול לשמש גם לניסוי RNAseq של שריר שלם. לבסוף, חתיכת השריר הקפואה יכולה לשמש גם לעבודת חלבון. מגבלה אחת של פרוטוקול זה היא האפשרות שהפציעה לא תהיה עקבית לכל אורכו של הת"א. זה עלול להוביל לתרחיש שבו שני חלקי השרירים מתפצלים בכמות השומן התוך שרירי שהם מכילים ועשויים להצדיק הרחקה של דגימה כזו מכל ניתוח במורד הזרם. לכן, מומלץ לא להסתמך רק על RT-qPCR כדי להסיק מסקנות עיקריות לגבי כמות השומן התוך שרירי, אלא כנתונים תומכים לכימות ההיסטולוגי.
יחד, פרוטוקול זה מתווה צינור עיבוד רקמות חזק, יעיל וקפדני שיאפשר הדמיה וכימות של שומן תוך שרירי, הצעד הראשון בפיתוח אפשרויות טיפול חדשניות למאבק בפיברוזיס שומני. יחד עם זאת, הוא רב תכליתי וניתן להתאים אותו לסוגי תאים רבים ושונים בתוך השריר, כמו גם אדיפוציטים ברקמות אחרות.
Disclosures
המחברים מצהירים שאין להם אינטרסים מתחרים.
Acknowledgements
אנו מודים לחברי מעבדת קופנקה על שסייעו באיסוף נתונים ובקריאה ביקורתית של כתב היד. אנו מודים גם לחברי המכון למיולוגיה באוניברסיטת פלורידה על התשומות החשובות שלהם על כתב היד. העבודה נתמכה על ידי מענק NIH 1R01AR079449. איור 2 נוצר עם Biorender.
Materials
| Name | Company | Catalog Number | Comments |
| 16% PFA (Pack of 12, 10 mL bottles) | Electron Miscroscopy Sciences | 15710 | |
| 2.0 mL Microcentrifuge Tubes | Fisher Scientific | 05-408-138 | microcentrifuge tubes for snapfreezing/bead beating |
| 2-Methylbutane (4 L) | Fisher Chemical | O3551-4 | isopentane |
| Absolute Ethanol (200 proof) | ThermoFisher Scientific | BP2818100 | |
| AffiniPure Fab fragment donkey anti-mouse | Jackson ImmunoResearch | 715-007-003 | mouse-on-mouse blocking |
| Alexa Fluor 488 donkey anti-chicken secondary antibody | Jackson ImmunoResearch | 703-545-155 | |
| Alexa Fluor 488 donkey anti-mouse secondary antibody | Invitrogen | A21202 | |
| Alexa Fluor 488 donkey anti-rabbit secondary antibody | Invitrogen | A21206 | |
| Alexa Fluor 568 donkey anti-goat secondary antibody | Invitrogen | A11057 | |
| Alexa Fluor 568 donkey anti-rabbit secondary antibody | Invitrogen | A11037 | |
| Alexa Fluor 568 Phalloidin antibody | Invitrogen | A12380 | Dissolved in 1.5 mL methanol (~66 µM working solution) |
| BioLite 24-well Multidishes | ThermoFisher Scientific | 930186 | 24 well plate for PFA tissue incubation |
| Biometra TOne | analytikjena | 8462070301 | Thermal cycler |
| Chicken anti-GFP antibody | Aves Labs | GFP-1020 | |
| Chloroform/isoamyl alcohol 24:1(v/v) for molecular biology, DNAse, RNAse, and Protease free | ThermoFisher Scientific | AC327155000 | |
| Corn oil | Sigma Aldrich | C8267 | |
| DAPI stain | Invitrogen | D1306 | 150 µM working solution in dH2O |
| Donkey Serum (100 mL) | Millipore Sigma | 5058837 | for blocking solution |
| Dumont #5 Forceps | Fine Science Tools | 11251-20 | sharp-tipped tweezers |
| Fine Scissors Straight 9 cm | Fine Science Tools | 14060-09 | |
| Fluoromount-G | SouthernBiotech | 0100-01 | mounting medium |
| Glycerol, 99.5%, for molecular biology (500 mL) | Acros Organics | 327255000 | |
| Goat anti-PDGFRα antibody | R&D | AF1062 | |
| Hybridization Oven | VWR | 230301V | for Tamoxifen incubation |
| ImmEdge Hydrophobic Barrier PAP Pen | Vector Laboratories | H-4000 | hydrophobic pen |
| Insulin Syringe with Micro-Fine IV needle (28 G) | BD | 329461 | |
| Insulin Syringe with Slip Tip, 1 mL | BD | 329654 | Insulin syringe without needle, for oral gavaging |
| iScript cDNA Synthesis Kit | Bio-Rad | 1708890 | |
| Isoflurane | Patterson Veterinary | 78938441 | |
| Leica DMi8 inverted microscope | Leica | micrscope used for widefield IF and confocal imaging | |
| Micro Slides | VWR | 48311-703 | positively charged microscope slides |
| mouse anti-MYOD antibody | Invitrogen | MA1-41017 | |
| mouse anti-PAX7 antibody (supernatant) | DSHB | AB 428528 | |
| MX35 Premier+ Microtome blades | ThermoFisher Scientific | 3052835 | microtome blades |
| NanoDrop 2000 Spectrophotometer | ThermoFisher Scientific | ND2000 | spectrophotometer for RNA yield |
| Play-Doh | Hasbro | modeling compound | |
| PowerUp SYBR Green Master Mix | ThermoFisher Scientific | A25742 | green dye PCR master mix |
| Puralube Vet Ointment | Puralube | 17033-211-38 | vet ophthalmic ointment |
| QuantStudi 6 Flex Real-Time 384-well PCR System | Applied Biosystems | 4485694 | qPCR machine |
| Rabbit anti-perilipin antibody | Cell Signaling Technology | 9349S | |
| Red-Rotor Shaker | Hoefer Scientific | PR70-115V | shaker for IF staining |
| Richard-Allan Scientific Slip-Rite Cover Glass | ThermoFisher Scientific | 152460 | coverslips |
| RNeasy Mini Kit | QIAGEN | 74106 | contains mini spin columns |
| Safe-Lock Tubes 1.5 ml, natural | Eppendorf | 22363204 | |
| Sample Tubes RB (2 mL) | QIAGEN | 990381 | |
| Sodium azide | Alfa Aesar | 14314 | |
| Stainless Steel Beads, 2.8 mm | Precellys | KT03961-1-101.BK | small beads |
| Stainless Steel Beads, 5 mm | QIAGEN | 69989 | medium beads |
| Stainless Steel Beads, 7 mm | QIAGEN | 69990 | large beads |
| Stainless Steel Disposable Scalpels | Miltex | 327-4102 | scalpel |
| Stainless steel feeding tube, 20 G x 38 mm, straight | Instech Laboratories | FTSS-20S-3 | gavage needle |
| Tamoxifen | Toronto Research Chemicals | T006000 | |
| Tissue Plus O.C.T. Compound | Fisher HealthCare | 4585 | embedding medium |
| TissueLyser LT | QIAGEN | 85600 | bead beater |
| TissueLyser LT Adapter, 12-Tube | QIAGEN | 69980 | |
| Tissue-Tek Cryomold | Sakura | 4566 | specimen molds |
| Triton X-100 | Alfa Aesar | A16046 | |
| TRIzol Reagent | ThermoFisher Scientific | 15596026 | guanidium thiocyanate |
| Tween20 (500 mL) | Fisher BioReagents | BP337-500 | |
| VWR Micro Slides - Superfrost Plus | VWR | 48311703 | |
| Wheaton Coplin staining jars | Millipore Sigma | S6016 | Coplin jar |
References
- Milad, N., et al. Increased plasma lipid levels exacerbate muscle pathology in the mdx mouse model of Duchenne muscular dystrophy. Skeletal Muscle. 7 (1), 19 (2017).
- Goodpaster, B. H., et al. Obesity, regional body fat distribution, and the metabolic syndrome in older men and women. Archives of Internal Medicine. 165 (7), 777-783 (2005).
- Goodpaster, B. H., et al. Association between regional adipose tissue distribution and both type 2 diabetes and impaired glucose tolerance in elderly men and women. Diabetes Care. 26 (2), 372-379 (2003).
- Goodpaster, B. H., et al. The loss of skeletal muscle strength, mass, and quality in older adults: the health, aging and body composition study. The Journals of Gerontology, Series A: Biological Sciences and Medical Sciences. 61 (10), 1059-1064 (2006).
- Goodpaster, B. H., Thaete, F. L., Kelley, D. E. Thigh adipose tissue distribution is associated with insulin resistance in obesity and in type 2 diabetes mellitus. American Journal of Clinical Nutrition. 71 (4), 885-892 (2000).
- Goodpaster, B. H., Theriault, R., Watkins, S. C., Kelley, D. E. Intramuscular lipid content is increased in obesity and decreased by weight loss. Metabolism. 49 (4), 467-472 (2000).
- Burakiewicz, J., et al. Quantifying fat replacement of muscle by quantitative MRI in muscular dystrophy. Journal of Neurology. 264 (10), 2053-2067 (2017).
- Murphy, W. A., Totty, W. G., Carroll, J. E. MRI of normal and pathologic skeletal muscle. American Journal of Roentgenology. 146 (3), 565-574 (1986).
- Willcocks, R. J., et al. Multicenter prospective longitudinal study of magnetic resonance biomarkers in a large duchenne muscular dystrophy cohort. Annals of Neurology. 79 (4), 535-547 (2016).
- Wokke, B. H., et al. Quantitative MRI and strength measurements in the assessment of muscle quality in Duchenne muscular dystrophy. Neuromuscular Disorders. 24 (5), 409-416 (2014).
- Contreras, O., Rossi, F. M. V., Theret, M. Origins, potency, and heterogeneity of skeletal muscle fibro-adipogenic progenitors-time for new definitions. Skeletal Muscle. 11 (1), 16 (2021).
- El Agha, E., et al. Mesenchymal stem cells in fibrotic disease. Cell Stem Cell. 21 (2), 166-177 (2017).
- Joe, A. W., et al. Muscle injury activates resident fibro/adipogenic progenitors that facilitate myogenesis. Nature Cell Biology. 12 (2), 153-163 (2010).
- Liu, W., Liu, Y., Lai, X., Kuang, S. Intramuscular adipose is derived from a non-Pax3 lineage and required for efficient regeneration of skeletal muscles. Developmental Biology. 361 (1), 27-38 (2012).
- Scott, R. W., Arostegui, M., Schweitzer, R., Rossi, F. M. V., Underhill, T. M. Hic1 defines quiescent mesenchymal progenitor subpopulations with distinct functions and fates in skeletal muscle regeneration. Cell Stem Cell. 25 (6), 797-813 (2019).
- Uezumi, A., et al. Fibrosis and adipogenesis originate from a common mesenchymal progenitor in skeletal muscle. Journal of Cell Science. 124, 3654-3664 (2011).
- Hogarth, M. W., et al. Fibroadipogenic progenitors are responsible for muscle loss in limb girdle muscular dystrophy 2B. Nature Communications. 10 (1), 2430 (2019).
- Uezumi, A., Fukada, S., Yamamoto, N., Takeda, S., Tsuchida, K. Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle. Nature Cell Biology. 12 (2), 143-152 (2010).
- Stumm, J., et al. Odd skipped-related 1 (Osr1) identifies muscle-interstitial fibro-adipogenic progenitors (FAPs) activated by acute injury. Stem Cell Research. 32, 8-16 (2018).
- Kopinke, D., Roberson, E. C., Reiter, J. F. Ciliary Hedgehog signaling restricts injury-induced adipogenesis. Cell. 170 (2), 340-351 (2017).
- Huang, Y., Das, A. K., Yang, Q. Y., Zhu, M. J., Du, M. Zfp423 promotes adipogenic differentiation of bovine stromal vascular cells. PLoS One. 7 (10), 47496 (2012).
- Sun, Y. -. M., et al. PDGFRα regulated by miR-34a and FoxO1 promotes adipogenesis in porcine intramuscular preadipocytes through Erk signaling pathway. International Journal of Molecular Sciences. 18 (11), 2424 (2017).
- Te, L. J. I., Doherty, C., Correa, J., Batt, J. Identification, isolation, and characterization of fibro-adipogenic progenitors (FAPs) and myogenic progenitors (MPs) in skeletal muscle in the rat. Journal of Visualized Experiments: JoVE. (172), e61750 (2021).
- Lukjanenko, L., et al. Aging disrupts muscle stem cell function by impairing matricellular WISP1 secretion from fibro-adipogenic progenitors. Cell Stem Cell. 24 (3), 433-446 (2019).
- Santini, M. P., et al. Tissue-resident PDGFRalpha(+) progenitor cells contribute to fibrosis versus healing in a context- and spatiotemporally dependent manner. Cell Reports. 30 (2), 555-570 (2020).
- Uezumi, A., et al. Identification and characterization of PDGFRalpha+ mesenchymal progenitors in human skeletal muscle. Cell Death & Disease. 5, 1186 (2014).
- Wosczyna, M. N., et al. Mesenchymal stromal cells are required for regeneration and homeostatic maintenance of skeletal muscle. Cell Reports. 27 (7), 2029-2035 (2019).
- Soliman, H., et al. Pathogenic potential of Hic1-expressing cardiac stromal progenitors. Cell Stem Cell. 26 (2), 205-220 (2020).
- Chung, M. I., Bujnis, M., Barkauskas, C. E., Kobayashi, Y., Hogan, B. L. M. Niche-mediated BMP/SMAD signaling regulates lung alveolar stem cell proliferation and differentiation. Development. 145 (9), (2018).
- Hilgendorf, K. I., et al. Omega-3 fatty acids activate ciliary FFAR4 to control adipogenesis. Cell. 179 (6), 1289-1305 (2019).
- Waisman, A., Norris, A. M., Elías Costa, M., Kopinke, D. Automatic and unbiased segmentation and quantification of myofibers in skeletal muscle. Scientific Reports. 11 (1), 11793 (2021).
- Kang, S. H., Fukaya, M., Yang, J. K., Rothstein, J. D., Bergles, D. E. NG2+ CNS glial progenitors remain committed to the oligodendrocyte lineage in postnatal life and following neurodegeneration. Neuron. 68 (4), 668-681 (2010).
- Srinivas, S., et al. Cre reporter strains produced by targeted insertion of EYFP and ECFP into the ROSA26 locus. BMC Developmental Biology. 1, 4 (2001).
- Lukjanenko, L., Brachat, S., Pierrel, E., Lach-Trifilieff, E., Feige, J. N. Genomic profiling reveals that transient adipogenic activation is a hallmark of mouse models of skeletal muscle regeneration. PLoS One. 8 (8), 71084 (2013).
- Mahdy, M. A., Lei, H. Y., Wakamatsu, J., Hosaka, Y. Z., Nishimura, T. Comparative study of muscle regeneration following cardiotoxin and glycerol injury. Annals of Anatomy = Anatomischer Anzeiger: Official Organ of the Anatomische Gesellscaft. 202, 18-27 (2015).
- Pisani, D. F., Bottema, C. D., Butori, C., Dani, C., Dechesne, C. A. Mouse model of skeletal muscle adiposity: a glycerol treatment approach. Biochemical and Biophysical Research Communications. 396 (3), 767-773 (2010).
- Kawai, H., et al. Experimental glycerol myopathy: a histological study. Acta Neuropathologica. 80 (2), 192-197 (1990).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative CT method. Nature Protocols. 3 (6), 1101-1108 (2008).
- Uezumi, A., et al. Mesenchymal Bmp3b expression maintains skeletal muscle integrity and decreases in age-related sarcopenia. The Journal of Clinical Investigation. 131 (1), 139617 (2021).
- Biferali, B., et al. Prdm16-mediated H3K9 methylation controls fibro-adipogenic progenitors identity during skeletal muscle repair. Science Advances. 7 (23), 9371 (2021).
- Biltz, N. K., Meyer, G. A. A novel method for the quantification of fatty infiltration in skeletal muscle. Skeletal Muscle. 7 (1), (2017).
- Vieites-Prado, A., Renier, N. Tissue clearing and 3D imaging in developmental biology. Development. 148 (18), (2021).
- Gómez-Gaviro, M. V., Sanderson, D., Ripoll, J., Desco, M. Biomedical applications of tissue clearing and three-dimensional imaging in health and disease. iScience. 23 (8), 101432 (2020).
- Ueda, H. R., et al. Tissue clearing and its applications in neuroscience. Nature Reviews Neuroscience. 21 (2), 61-79 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved