Method Article
Руководство по изучению внутримышечного жирообразования и его клеточного происхождения в скелетных мышцах
В этой статье
Резюме
Замена здоровой мышечной ткани внутримышечным жиром является характерной чертой заболеваний и состояний человека. Этот протокол описывает, как визуализировать, изображать и количественно оценивать внутримышечный жир, что позволяет тщательно изучать механизмы, лежащие в основе внутримышечного образования жира.
Аннотация
Фибро-адипогенные предшественники (FAP) представляют собой мезенхимальные стромальные клетки, которые играют решающую роль во время гомеостаза и регенерации скелетных мышц. FAP строят и поддерживают внеклеточный матрикс, который действует как молекулярный каркас миофибры. Кроме того, FAP незаменимы для регенерации миофибры, поскольку они выделяют множество полезных факторов, ощущаемых мышечными стволовыми клетками (MuSC). В больных состояниях, однако, FAP являются клеточным происхождением внутримышечного жира и фиброзной рубцовой ткани. Этот жировой фиброз является отличительной чертой саркопении и нервно-мышечных заболеваний, таких как мышечная дистрофия Дюшенна. Одним из существенных препятствий в определении того, почему и как ФАП дифференцируются во внутримышечный жир, является эффективное сохранение и последующая визуализация адипоцитов, особенно в замороженных участках тканей. Традиционные методы обработки скелетной мышечной ткани, такие как snap-freezing, не сохраняют должным образом морфологию отдельных адипоцитов, тем самым препятствуя точной визуализации и количественной оценке. Чтобы преодолеть это препятствие, был разработан строгий протокол, который сохраняет морфологию адипоцитов в отделах скелетных мышц, позволяя визуализировать, визуализировать и количественно оценивать внутримышечный жир. Протокол также описывает, как обрабатывать часть мышечной ткани для RT-qPCR, позволяя пользователям подтверждать наблюдаемые изменения в образовании жира, просматривая различия в экспрессии адипогенных генов. Кроме того, он может быть адаптирован для визуализации адипоцитов путем полной иммунофлуоресценции мышечных образцов. Наконец, в этом протоколе описывается, как выполнять отслеживание генетической линии Pdgfrα-экспрессирующих FAP для изучения адипогенного преобразования FAP. Этот протокол последовательно дает высокочастотные и морфологически точные иммунофлуоресцентные изображения адипоцитов, а также подтверждение с помощью RT-qPCR, что позволяет обеспечить надежную, строгую и воспроизводимую визуализацию и количественную оценку внутримышечного жира. Вместе описанный здесь конвейер анализа является первым шагом к улучшению нашего понимания того, как FAP дифференцируются во внутримышечный жир, и обеспечивает основу для проверки новых вмешательств по предотвращению образования жира.
Введение
Инфильтрация здоровой мышечной ткани жировым фиброзом является характерной чертой мышечной дистрофии Дюшенна (МДД) и других нервно-мышечных заболеваний, а также саркопении, ожирения и диабета 1,2,3,4,5,6,7,8,9,10 . Хотя повышенная инфильтрация жира в этих условиях тесно связана со снижением мышечной функции, наши знания о том, почему и как образуется внутримышечный жир, все еще ограничены. FAP представляют собой мультипотентную мезенхимальную популяцию стромальных клеток, присутствующую в большинстве взрослых органов, включая скелетные мышцы11,12. Однако с возрастом и при хронических заболеваниях ФАП продуцируют фиброзную рубцовую ткань и дифференцируются в адипоциты, которые расположены между отдельными миофибрами и образуют внутримышечный жир 13,14,15,16,17,18,19,20.
Чтобы начать борьбу с внутримышечным жирообразованием, необходимо определить механизмы превращения ФАП в адипоциты. PDGFRα является маркером «золотого стандарта» в этой области для идентификации FAP в мышцах нескольких видов 13,16,17,18,20,21,22,23,24,25,26,27. В результате было сгенерировано несколько мышиных тамоксифен-индуцируемых Cre линий под контролем промотора Pdgfrα, что позволяет генетически манипулировать FAP in vivo с использованием системы Cre-LoxP 27,28,29. Например, комбинируя эту индуцируемую линию Cre с генетическим репортером, можно выполнить отслеживание линии FAP, стратегию, которую мы успешно применили к фапам карты судьбы в мышечной и белой жировой ткани20,30. Помимо отслеживания родословной, эти линии Cre предоставляют ценные инструменты для изучения преобразования FAP в жир.
Одним из основных препятствий в определении механизма адипогенного превращения ФАП во внутримышечный жир является способность строго и воспроизводимо количественно оценивать количество внутримышечного жира, который сформировался в разных условиях. Ключ заключается в том, чтобы сбалансировать сохранение мышечной и жировой ткани и сопоставить это с доступными методами окрашивания для визуализации адипоцитов. Например, скелетные мышцы часто замораживаются без предварительной фиксации, сохраняя миофибры, но нарушая морфологию адипоцитов (рисунок 1). Напротив, фиксация с последующим встраиванием парафина, демонстрируя при этом лучшую гистологию тканей, включая адипоциты, удаляет все липиды, тем самым делая большинство липофильных красителей, таких как обычно используемый краситель Oil Red O, непригодными для использования.
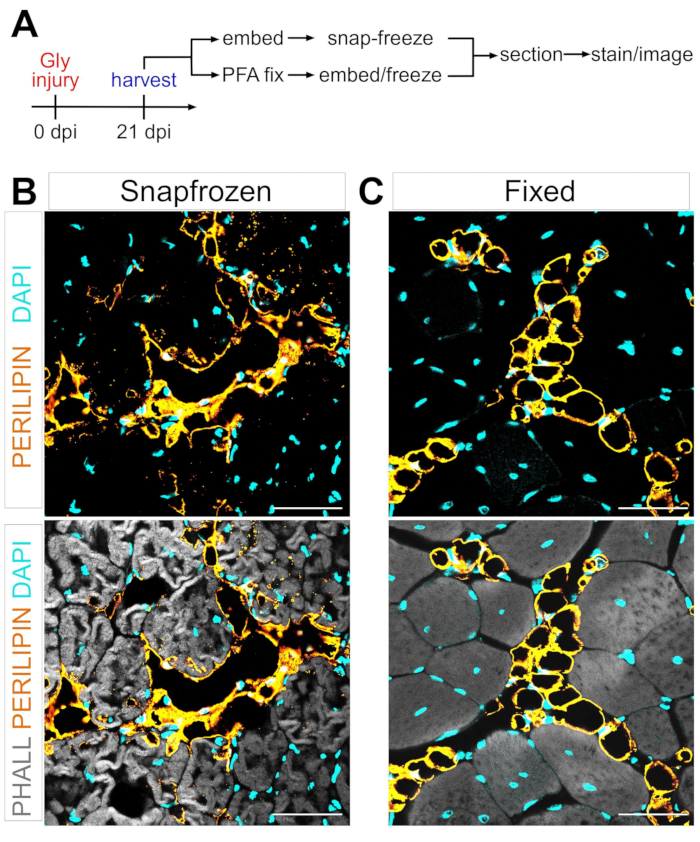
Рисунок 1: Репрезентативные изображения внутримышечного жира в замороженных и фиксированных мышечных тканях. (A) Схематический обзор экспериментальной установки. Иммунофлуоресцентные изображения, показывающие адипоциты (желтый), миофибры (серый) и ядра (голубой) в обоих (B) замороженных и (C) фиксированных TA через 21 день после повреждения глицерина. Шкала: 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Протокол, описанный здесь, сохраняет морфологию миофибры и адипоцитов и позволяет визуализировать и анализировать несколько типов клеток. Этот подход основан на иммунофлуоресцентном окрашивании адипоцитов в параформальдегидной (PFA) фиксированной мышечной ткани, что позволяет проводить совместное окрашивание несколькими антителами. Он также может быть легко адаптирован для пространственного отображения внутримышечного жира в неповрежденной ткани с использованием визуализации цельного крепления, тем самым предоставляя информацию о клеточном микроокружении жира в мышце. Кроме того, этот протокол может быть объединен с нашим недавно опубликованным подходом к определению области поперечного сечения миофиберов в фиксированных мышечных тканях31, что является важным измерением для оценки здоровья мышц. Сочетая этот подход с прослеживанием генетической линии до карты судьбы, дифференциация ФАПов в адипоциты также изложена здесь. Таким образом, универсальный протокол, описанный здесь, позволяет проводить строгую и воспроизводимую оценку ФАПов и их дифференцировку во внутримышечный жир в тканевых срезах и интактных тканях.
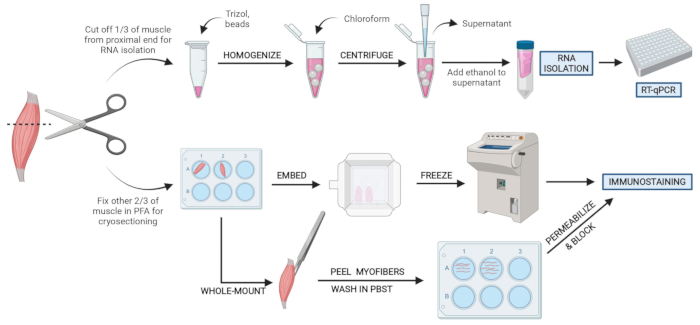
Рисунок 2: Обзор схематических протоколов. Схематический обзор обработки тканей, при которой одна треть ТА удаляется, замораживается и гомогенизируется для последующей изоляции РНК и анализа транскрипции с помощью RT-qPCR. Остальные две трети ТА фиксируются PFA и обрабатываются для иммуноокрашения на замороженных участках или волокнах цельного крепления. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
протокол
Все протоколы для животных были одобрены Институциональным комитетом по уходу за животными и их использованию (IACUC) Университета Флориды.
1. Отслеживание генетической линии ФАПов
ПРИМЕЧАНИЕ: Если отслеживание генетической линии FAP нежелательно, шаг 1 может быть пропущен.
- Чтобы выполнить трассировку линии ФАПов, получите необходимые аллели мышей.
ПРИМЕЧАНИЕ: Несколько тамоксифен-индуцируемых cre линий под контролем промотора Pdgfrα были сгенерированы для успешного нацеливания на FAP, в том числе из лабораторий Hogan29, Rando27 и Bergles32 . В качестве генетического репортера активности Cre доступны многочисленные аллели репортеров Rosa26, такие как Rosa26EYFP33. Хотя для каждой лаборатории предлагается определить, какая комбинация Cre-Reporter является наиболее эффективной, путем скрещивания мышей PdgfrαCreERT2 (29 и Jax# 032770) с репортером Rosa26EYFP (33 и Jax# 006148), полученный PdgfrαCreERT2; Мыши Rosa26EYFPмогут быть использованы для эффективной и конкретной маркировки FAPs20. Чтобы проследить судьбу зрелых ФАПов, рекомендуется подождать, пока мыши не достигнут по крайней мере ~ 10-недельного возраста, прежде чем вводить тамоксифен. Эксперименты по отслеживанию родословной могут проводиться как на самцах, так и на самках. - Введение Тамоксифена путем перорального приема
- Приготовьте 40 мг/мл тамоксифена в кукурузном масле и хорошо перемешайте за 1 день до забора. Инкубировать O/N при 37 °C во вращающейся гибридизационной печи.
ВНИМАНИЕ: Тамоксифен является канцерогеном и с ним следует обращаться осторожно. Всегда надевайте перчатки при обращении и носите маску при взвешивании ее в виде порошка, так как существует опасность вдыхания. - Очистите область в соответствии с протоколом и прикрепите иглу к шприцу объемом 1 мл. Втяните в шприц 200 мкл тамоксифена.
- Скрафф PdgfrαCreERT2 ; Мыши Rosa26EYFP (10 недель; оба пола используются), поместив их на плоскую поверхность и крепко захватив основание хвоста. Используйте свободную руку, чтобы схватить середину мыши большим и указательным пальцами, затем осторожно и с небольшим давлением сдвиньте захват до тех пор, пока не пройдете мимо плеч.
- Зажмите кожу назад большим и указательным пальцами, возьмите мышь и переверните руку так, чтобы мышь была обращена к пользователю, и засуньте хвост между мизинцем и безымянным пальцем руки, держащей мышь.
- В этот момент убедитесь, что мышь хорошо обездвижена и не может двигать головой или руками. Вставьте иглу в рот и используйте ее, чтобы слегка наклонить головку мыши назад; это позволяет пищеводу быть более доступным.
- Осторожно и медленно введите иглу в пищевод. Не форсируйте иглу при наличии сопротивления; игла должна легко скользить вниз. Медленно вводят тамоксифен. Следите за мышами в течение 15-20 минут, чтобы убедиться, что при измерении не возникает проблем.
ПРИМЕЧАНИЕ: Введение тамоксифена в течение 2 последовательных дней обычно приводит к ~75%-85% эффективности рекомбинации ФАПов, не вызывая каких-либо побочных эффектов. Рекомендуется, чтобы пользователь подождал 1-2 недели, прежде чем вызвать травму, что позволит удалить оставшийся тамоксифен из системы и перевернуть любой оставшийся белок.
- Приготовьте 40 мг/мл тамоксифена в кукурузном масле и хорошо перемешайте за 1 день до забора. Инкубировать O/N при 37 °C во вращающейся гибридизационной печи.
2. Травма передней (ТА) мышцы большеберцовой кости
ПРИМЕЧАНИЕ: Для изучения внутримышечного жира рекомендуется использовать модель повреждения на основе глицерина (50% глицерина в стерильном физиологическом растворе), что приводит к массивному внутримышечному образованию жира 34,35,36,37.
- Подготовьте анестезирующую машину, добавив изофлуран и убедившись, что трубки как в мышиной камере, так и в носовом конусе открыты. Очистите камеру и рабочую зону 70% раствором этанола или перекиси (в зависимости от протоколов).
- Установите расход кислорода на уровне 2,5 л/мин, а концентрацию изофлурана на уровне 2,5%. Поместите мышь в анестезиологическую камеру и подождите ~ 5 минут, пока она будет обезболена.
- Положите мышь лежа на спине на чистую грелку и вставьте нос в носовой конус. Аккуратно нанесите ветеринарную офтальмологическую мазь на глаза с помощью аппликатора с ватным наконечником, чтобы предотвратить сухость под наркозом. Постоянно контролируйте анестезию и выполняйте ущемление пальца ноги мыши до травмы, чтобы убедиться, что мышь полностью обезболена.
- Очистите ногу, чтобы ввести свежую спиртовую салфетку для дезинфекции.
- Втягивайте 30-50 мкл 50% глицерина (в зависимости от размера мышей) в инсулиновый шприц. Аккуратно расчесайте волосы на голени, чтобы обнажить расположение ТА.
ПРИМЕЧАНИЕ: Легче перемещать волосы и достигать лучшей визуализации, когда они еще влажные от спиртовой салфетки. - После расположения ТА (только сбоку от большеберцовой кости, она слегка выступает через кожу и может ощущаться при мягкой пальпации), вставьте иглу в ТА дистально, около лодыжки. Полностью вставьте иглу в мышцу и медленно вводите глицерин, постепенно снимая иглу, которая помогает травмировать большую часть мышцы.
ПРИМЕЧАНИЕ: Лучше всего вставлять иглу параллельно ножке, с немного приподнятым углом. Хорошая травма обычно вызывает дорсифлексию, поскольку ТА сжимается после снятия иглы. Если пальцы ног мыши раздвинулись, вполне вероятно, что была введена мышца-разгибатель digitorum longus (EDL). - Поместите мышь обратно в клетку и контролируйте в течение примерно 15-20 минут, чтобы обеспечить восстановление анестезии.
- Выбросьте иглу в контейнер для острых предметов. Никогда не вспоминайте иглу.
ПРИМЕЧАНИЕ: Инъекция анальгезии после глицерина должна быть предоставлена в соответствии с одобрением Институционального комитета по уходу за животными и их использованию. Адипоциты могут наблюдаться уже через 5 дней после травмы (dpi). К 7 dpi сформировались все адипоциты, а к 21 dpi они полностью созрели.
3. Сбор ткани
- Подготовьте 4% PFA в 1x PBS и поместите на лед перед началом сбора урожая.
- Поместите любые пластины (12- или 24-лунки), используемые для фиксации мышц, на лед и добавьте 4% PFA к каждой лунке, убедившись, что каждая лунка имеет в 10-20 раз больший объем PFA, чем фиксируемая ткань.
- Между 7 и 21 днем после травмы глицерина усыпляют мышь в соответствии с институциональными рекомендациями (т. Е. Передозировка изофлурана с последующим вывихом шейки матки).
- Начните сбор любых тканей, которые будут использоваться для гистологии или выделения РНК.
ПРИМЕЧАНИЕ: Ткани должны быть заморожены или помещены в PFA в течение 10-15 минут после жертвоприношения (рисунок 2). - Обильно распылите любые участки мыши, которые будут разрезаны 70% этанолом, чтобы помочь волосам не рассекать область и инструменты.
- Используйте ножницы, чтобы разрезать кожу вокруг верхней части ноги, около таза (рисунок 3A).
- Аккуратно потяните кожу ноги сверху вниз к лодыжке (рисунок 3B).
ПРИМЕЧАНИЕ: ТА представляет собой каплевидную мышцу с четко очерченным дистальным сухожилием, прикрепляющимся к медиальной клинописи и первой плюсневой кости. Она латеральна к голени и простирается до нижнего колена. - Во-первых, удалите внешний слой соединительной ткани (эпимизий) с помощью пинцета с острым наконечником перед сбором ТА (рисунок 3C). Используйте рассекающий микроскоп, чтобы лучше визуализировать эпимизиум.
- Сдвиньте пинцет под ТА от нижней части мышцы, начиная с дистального сухожилия, и осторожно потяните вверх к колену (рисунок 3D). Остановка в конце мышцы; не проталкивайтесь мимо сопротивления, ощущаемого в нижней части колена.
- Если есть значительное сопротивление до достижения нижнего колена, остановитесь и продолжайте удаление оставшихся слоев соединительной ткани.
ПРИМЕЧАНИЕ: Существует еще одно дистальное сухожилие, только латеральное к сухожилию TA, которое прикрепляется к EDL, которое представляет собой тонкую боковую мышцу к TA. Осторожность при скольжении пинцета только под сухожилием TA предотвращает случайный сбор EDL, но его также можно легко удалить после фиксации. - После того, как ТА был частично поднят с ноги пинцетом, используйте то же движение скальпелем, чтобы разорвать соединение ТА с нижним коленом (рисунок 3E). Отрежьте сухожилие на лодыжке ножницами, чтобы полностью удалить ТА. Обрабатывайте мышцу только на сухожилии, чтобы избежать повреждения волокон.
- Отрежьте 1/3 ТА на конце, противоположном сухожилию (рисунок 3F), поместите его в микроцентрифужную трубку и заморозьте, сбросив его в жидкий азот (рисунок 3H).
- Погрузите остальные 2/3 ткани в меченый колодец с 4% PFA для гистологии (рисунок 3I). Обязательно следите за тем, когда первая и последняя ткань были помещены в фиксатор. Поставить на шейкер на 2-2,5 ч при 4 °С.
- Длительность фиксации зависит от ткани и ее размеров. Определите продолжительность, необходимую для фиксации тканей. Фиксация ТА в течение 2-2,5 ч при 4 °C обычно хорошо сохраняет морфологию адипоцитов, не вызывая чрезмерной фиксации ткани.
ПРИМЕЧАНИЕ: Если вы планируете использовать TA для полноразмерного иммунофлуоресцентного окрашивания, пропустите остальную часть этого протокола до достижения раздела 7: «Иммунофлуоресцентное окрашивание whole Mount». - После фиксации удаляют ПФА из лунок, промывают ткани холодом 1x PBS 2-3 раза, а затем промывают 2-3 раза холодным 1x PBS в течение 5 мин за одну стирку.
- Удалите PBS из лунок и добавьте достаточное количество 30% сахарозы в 1x PBS, чтобы позволить ткани плавать. Поставить на шейкер при температуре 4 °C на ночь.
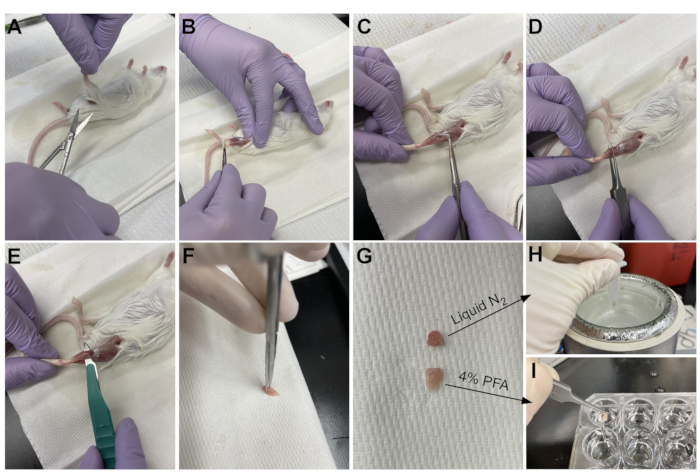
Рисунок 3: Резюме сбора ткани. (А) Кожа разрезается у основания ноги и (Б) мышцы задних конечностей обнажаются. (C) Как только эпимизий удаляется из ТА, (D) щипцы используются для частичного разделения мышцы и обеспечения полного удаления эпимизиума. (E) ТА отрезается от ножки скальпелем и удаляется после разрезания сухожилия. (G) После разрезания ТА на одну треть и две трети куска (Н) одна треть замораживается в жидком азоте для анализа RT-qPCR и (I) другая две трети фиксируется в 4% PFA для гистологии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Встраивание
- Подготовьте образцы форм для использования для встраивания путем маркировки и заполнения достаточной средой для встраивания, чтобы полностью погрузить ткани.
- Извлеките салфетки из колодцев, высушите излишки сахарозы на бумажном полотенце и перейдите к замерзающим формам образцов, заполненным средой.
ПРИМЕЧАНИЕ: Полезно знать, в какой ориентации форма должна быть разделена на криостате. Таким образом, пользователь может сориентировать ткани в пресс-форме таким образом, чтобы обеспечить легкий доступ к интересующей области. Для ТА это будет достигнуто путем размещения самого толстого конца (противоположного стороне сухожилия) лицом к поверхности, которая будет разделена. Это позволяет легко срезать ТА в самой толстой части (животе) и позволяет разрезать мышечные волокна поперечно. - Приготовьте изопентановую суспензию, частично погружая контейнер с изопентаном в жидкий азот. Убедитесь, что в контейнере достаточно жидкого изопентана, чтобы погрузить около половины образца плесени, которая будет использоваться для встраивания тканей.
- Начните замораживание форм, осторожно положив их в изопентановую суспензию и убедившись, что около половины формы погружено в воду. Кроме того, убедитесь, что форма замерзает одинаково со всех четырех сторон.
- Извлеките форму из изопентана непосредственно перед тем, как вся форма заметно замерзнет сверху. Количество времени, которое это занимает, зависит от используемых форм.
- Храните замороженные формы в контейнере с сухим льдом, замораживая остальные блоки, затем храните их при -80 °C.
ПРИМЕЧАНИЕ: Изопентан для замораживания может быть использован повторно. Положите в стеклянную бутылку, но не затягивайте крышку, пока изопентан не достигнет комнатной температуры (RT). В противном случае изменение давления может разбить бутылку.
5. Секционирование
- Установите криостат на -22---24 °C, добавьте в криостат формы, содержащие ТА, и подождите минимум 30 минут для температурной акклиматизации. А пока маркируйте серию положительно заряженных слайдов микроскопа.
- Вставьте противокатаную пластину и выровняйте криостат таким образом, чтобы в пластине было минимальное количество царапин, где она соприкасается с блоком образца. Безопасность на месте.
- Вставьте свежее лезвие криостата в держатель лезвия и закрепите его на месте.
ВНИМАНИЕ: Лезвие острое. Накройте лезвие при манипулировании другими частями криостата или замороженными формами. - Извлеките замороженный блок из формы. Добавьте однородный слой встраиваемой среды к криостатному патрону и поместите блок в среду. Оставьте на 1-3 мин до полного замораживания (непрозрачный белый).
ПРИМЕЧАНИЕ: Для ТА самая толстая область (брюхо) должна быть видна, когда она находится на патроне. - Поместите криостатный патрон с тканевым блоком в криостат. Раскройте лезвие и продвигайте криостат вперед, пока не вступит в контакт с лезвием. Сечение через блок на участках 25 мкм до тех пор, пока ткань больше не будет скрыта встраивающей средой.
ПРИМЕЧАНИЕ: Во время сечения отрегулируйте угол криостата и/или положение ступени таким образом, чтобы секции имели одинаковую толщину. Может быть полезно собрать несколько секций, чтобы обеспечить однородность толщины сечения. Рекомендуется, чтобы пользователь находил правильное положение стабилизатора перед секционированием до интересующей области в ТА (брюхо), так как это позволяет пользователю попробовать несколько положений стабилизатора поперечной устойчивости до тех пор, пока секции не отойдут прямо, не тратя ткань. - Измените толщину сечения до 10-12 мкм и соберите срезы на маркированных предметных стеклах микроскопа. Последовательное секционирование рекомендуется путем сбора смежных секций на 6-10 слайдах (помеченных 1-х), что позволяет окрашивать несколько маркеров. При необходимости используйте тонкую кисть, чтобы развернуть секции, прежде чем собирать их на слайде.
ПРИМЕЧАНИЕ: Если секции закручены, убедитесь, что температура держится стабильно в диапазоне от -22 до -24 °C. Если есть вертикальные полосы в секциях, это может быть связано с ником в противокатной пластине или лезвии; это может быть исправлено путем регулировки положения стабилизатора поперечной устойчивости и/или переключения на новое лезвие. - После сбора соседних секций одной и той же плоскости сечения на каждом слайде отрегулируйте толщину обратно до 25 мкм, чтобы продвинуться на 150-200 мкм через блок, затем отрегулируйте толщину обратно до 10-12 мкм и начните сечение снова.
ПРИМЕЧАНИЕ: Это последовательное секционирование позволяет пользователю визуализировать, изображать и количественно оценивать на разных глубинах через TA; достаточно трех-четырех последовательных секций на слайд. - Храните слайды и тканевые блоки при температуре -80 °C.
6. Иммунофлуоресцентное (ИФ) окрашивание срезов тканей
ПРИМЕЧАНИЕ: Поскольку концентрации антител могут варьироваться между партиями и производителями, рекомендуется оптимизация путем оценки нескольких различных концентраций антител на тестовых слайдах перед окрашиванием интересующих слайдов.
- Оттаивать/сушить горки либо на RT, либо на теплой тарелке при 37 °C в течение 10-20 мин.
- С помощью гидрофобного пера проведите линию на краю бумажной поверхности слайда, где она встречается со стеклом.
- Поместите слайды в банку Coplin и вымойте 1x PBS + 0,1% Tween20 (PBST) 3-5x на шейкере не менее 5 минут на стирку для регидратации участков ткани.
ПРИМЕЧАНИЕ: На этом этапе важно не позволять слайдам сидеть без погружения в PBST (до гидрофобной линии), иначе участки ткани высохнут. - Поместите слайды на стойку увлажняющей камеры и наложите на них 310-350 мкл блокирующего раствора (5% ослиная сыворотка и 0,3% Тритон Х-100 в 1x PBS) в течение 1-2 ч при РТ.
ПРИМЕЧАНИЕ: Дополнительная стадия пермеабилизации не требуется, так как блокирующий раствор содержит 0,3% Triton X-100, что обеспечивает достаточную пермеабилизацию участков ткани. При использовании первичных антител, полученных от мышей (т.е. PAX7 и MYOD1, перечисленных ниже), рекомендуется включать шаг блокировки мыши на мыши с использованием фрагментов Fab (1:50) в блокирующий раствор для блока. Это поможет снизить фон за счет неспецифического связывания мышиного вторичного антитела с антителами, отличными от первичных. - Разбавьте первичные антитела, которые будут использоваться в блокирующем растворе незадолго до перехода к следующему шагу следующим образом:
- Первичные антитела для окрашивания адипоцитов и визуализации всего участка: Разбавляют антиперилипин кролика при соотношении разведения 1:1000.
- Первичные антитела для отслеживания линии адипоцитов: разбавляют куриный анти-GFP в соотношении 1:1000 и кролик антиперилипин в 1:1000.
- Первичные антитела для отслеживания линии ФАП: разбавляют куриный анти-GFP в соотношении 1:1000 и козий анти-PDGFRα в 1:250.
- Первичные антитела к миогенным маркерам: разбавляют мышиный анти-PAX7 в соотношении 1:25 или мышиный анти-MYOD1 при 1:250 и кролик против ЛАМИНИНА в 1:1000.
ПРИМЕЧАНИЕ: Хотя перечисленные выше антитела были успешно оценены с помощью этого протокола, вполне вероятно, что другие маркеры и антитела для маркировки FAP, адипоцитов и / или других типов клеток также совместимы с этим протоколом. При первом использовании первичных антител настоятельно рекомендуется, чтобы пользователь включал отрицательный контрольный слайд, в котором первичные антитела опущены. Это будет контролировать специфичность антител. Все остальные шаги в протоколе соблюдаются, включая добавление вторичных антител, но блокирующий раствор используется отдельно на следующем этапе вместо первичного антитела в блокирующем растворе.
- Сбросьте блокирующий раствор с слайдов и наложите 310-350 мкл блокирующего раствора с первичными антителами и инкубируйте ночью при 4 °C в увлажняющей камере.
- На следующий день сбросьте блокирующий раствор / первичные антитела со слайдов и поместите их в банку Коплина. Промойте слайды 2-3 раза ПБСТ и промывайте 3-5 раз ПБСТ на шейкере не менее 5 минут за одну стирку.
- Во время последней промывки подготовьте вторичные антитела или любые прямые конъюгаты для использования в блокирующем растворе. Минимизируйте количество времени, которое эти антитела проводят на свету, чтобы избежать фотоотбеливания.
- Разбавленные вторичные антитела /прямые конъюгаты: 488 нм ослик против курицы (1:1000) или против кролика (1:1000) или против мыши (1:1000), 568 нм ослик против козы (1:1000) или против кролика (1:1000) или фаллоидин (миофибры; 1:100), окрашивание DAPI (ядра; 1:500).
- Накладываем слайды 310-350 мкл блокирующего раствора вторичными антителами и/или прямыми конъюгатами в увлажняющей камере. Инкубировать на РТ в течение 1-2 ч. С этого момента защитите образцы от света.
- Сбросьте блокирующий раствор/вторичные антитела и поместите их в банку Коплина. Промыть PBST один раз и промыть 3-5x PBST на шейкере не менее 5 минут на одну стирку. Держите банку Coplin закрытой, чтобы предотвратить воздействие света.
- Высушите горки как можно лучше, постукивая по краям и вытирая спину о бумажное полотенце, но не дайте слоям ткани высохнуть.
- Добавьте три или четыре капли водной монтажной среды к верхнему горизонтальному краю слайда и аккуратно добавьте крышку. Не надавливайте и не двигайтесь, если под крышкой образуются пузырьки воздуха; любое давление или движение может исказить хрупкую клеточную архитектуру адипоцитов.
- Позвольте монтажной среде установить в темноте на ночь перед визуализацией.
7. Цельное иммунофлуоресцентное окрашивание
- После ~1 ч фиксации (см. шаг 3.14) используйте пинцет с острым наконечником, чтобы отклеить миофибры от фиксированного ТА.
- Поместите отделенные волокна в 24-луночную пластину и промывайте 3 раза в течение 3 минут каждый с PBST. Для всех последующих инкубаций обязательно добавляйте крышку, чтобы предотвратить испарение.
- Инкубировать в течение 1 ч в 1% Triton X-100 в 1x PBS при RT (200-300 мкл) на шейкере, чтобы обеспечить лучшее проникновение антител.
- После промывки несколько раз ПБСТ накладывают блокирующим раствором (200-300 мкл) и блокируют на нутаторе или шейкере на ночь при 4 °С.
- Разбавьте первичные антитела в нужной концентрации (удвоение концентрации, как правило, является хорошей отправной точкой) в блокирующем растворе. Инкубировать образцы (200-300 мкл) на нутаторе или шейкере в течение ночи при 4 °C.
- Тщательно промывайте образцы ПБСТ в течение дня с частыми изменениями при РТ на шейкере, примерно по 4-6 раз в течение 30-60 мин каждая стирка.
- Разбавляют вторичные антитела в блокирующем растворе в желаемой концентрации (1:500 имеет тенденцию хорошо работать) плюс ядерное окрашивание и инкубируют образцы (200-300 мкл) на нутаторе или шейкере в течение ночи при 4 °C.
- Тщательно промывайте образцы PBST в течение дня с частыми изменениями при RT на шейкере, примерно 4-6 раз в течение 30-60 минут каждую стирку или стирку на ночь при 4 °C.
- Для монтажа аккуратно высушите излишки PBST, а затем поместите волокна в одну или две капли монтажной среды на стеклянную горку (рисунок 4A). Чтобы поднять обшивку (18 мм х 18 мм), добавьте маленькие глиняные ножки; это предотвратит сдавливание волокон и закрепит крышку на слайде. Для этого хорошо работают моделирующие составы. После того, как крышка закреплена, добавьте больше среды к краю, пока область под крышкой не будет заполнена.
ПРИМЕЧАНИЕ: Вместо использования монтажной среды, содержащей антивядающие агенты, ткань также может перемещаться через восходящую серию глицерина (от 30% до 80% глицерина в PBS). - Подождите 1-2 дня перед визуализацией, чтобы обеспечить отверждение монтажной среды.
8. Визуализация внутримышечного жира
- Включите микроскоп и запустите программное обеспечение для обработки изображений. Закрепите слайд на сцене.
ПРИМЕЧАНИЕ: Для визуализации адипоцитов в мышечных участках часто достаточно 5-кратного или 10-кратного объектива в сочетании с широкоугольной микроскопией. Для визуализации WM-IF требуется конфокальный микроскоп. - Используйте любой канал для определения области, которую необходимо визуализировать.
- В программном обеспечении для обработки изображений отрегулируйте коэффициент усиления и время экспозиции для каждого канала.
- Сделайте снимки всей ткани в каждом канале (автоматическом или ручном в соответствии с используемым микроскопом и программным обеспечением) и объедините отдельные плитки, чтобы получить композит полного поперечного сечения TA.
ПРИМЕЧАНИЕ: Рекомендуется делать снимки двух или трех разных участков одного и того же ТА на разных глубинах. Путем количественной оценки адипоцитов в каждом участке, а затем сообщения о средних, локализованных различиях в количестве внутримышечного жира из-за, например, ошибок инъекций можно избежать.
9. Количественная оценка адипоцитов
- Если он не был установлен ранее, добавьте подключаемый модуль счетчика ячеек в ImageJ (https://imagej.nih.gov/ij/plugins/cell-counter.html).
- Импортируйте изображения в ImageJ в виде файлов TIF или оригинальных файлов микроскопа. Просматривайте каждый канал в ImageJ как отдельный TIF-файл.
ПРИМЕЧАНИЕ: Если используется LIF или аналогичные типы файлов микроскопа, в разделе Параметры импорта биоформатов выберите Гиперстек для просмотра стека с и установите флажок Разделенные каналы. Нажмите кнопку ОК , чтобы открыть файл. Кроме того, убедитесь, что флажок Автомасштабирование снят. - Убедитесь, что изображения для каждого канала имеют 8-битный формат (серый): Image > Type > 8-bit.
- Объединение изображений DAPI (синий), GFP (зеленый), PERILIPIN (красный) и PHALLOIDIN (серый): > изображения цветов > каналов слияния.
- Убедитесь, что шкала (Analyze > Set Scale) находится в микронах. Используя инструмент выбора от руки, наметьте поврежденную и неповрежденную часть каждого поперечного сечения, затем измерьте (анализируйте > меру) и запишите поврежденную и неповрежденную область в электронную таблицу.
ПРИМЕЧАНИЕ: Поврежденные мышцы могут быть идентифицированы как области, лишенные миофиберов, или области, населенные миофибрами, которые содержат центрально расположенные ядра. - Запустите счетчик ячеек: плагины > CellCounter > инициализировать.
- Выберите тип счетчика, затем подсчитайте каждый адипоцит. Запишите общее количество адипоцитов в электронную таблицу, затем рассчитайте количество адипоцитов на 1мм2 травмированной области.
10. Анализ экспрессии адипогенных генов с использованием RT-qPCR
- Изоляция РНК
- Перед началом работы разогрейте воду без РНК до 45 °C и приготовьте свежий 70% EtOH (350 мкл на образец).
- Добавьте 1000 мкл тиоцианата гуанидия в каждую пробирку, содержащую образец (см. этап 3.12.). Важно, чтобы использовались трубы, одобренные бисером.
ВНИМАНИЕ: Гуанидия тиоцианат токсичен. Носите соответствующие средства индивидуальной защиты и ручку в вытяжном капюшоне. - Добавьте три средних бусины или одну большую и одну маленькую бусину в каждый тюбик.
- Гомогенизировать ткань при 50 Гц в течение 2-4 мин с помощью бисерного взбивателя. В зависимости от типа ткани и размера выборки это может занять до 10 минут.
- Добавьте 200 мкл хлороформа.
ВНИМАНИЕ: Хлороформ токсичен. Носите средства индивидуальной защиты и рультесь в вытяжном капюшоне. - Встряхните образцы в течение 15 с. Инкубировать в течение 2-3 мин при РТ.
- Центрифуга в течение 15 мин при 12 000 х г. Пипетку выводят 350 мкл прозрачного супернатанта (верхний слой, содержащий РНК) и добавляют в новую микроцентрифужную трубку, содержащую 350 мкл 70% этанола. Будьте осторожны, чтобы не аспирировать нижние слои белка и / или ДНК
- Перенесите до 700 мкл смеси в мини-отжимную колонну, помещенную в трубку для сбора 2 мл. Продолжайте выделение РНК в соответствии с инструкциями производителя.
- Элюют с 30-50 мкл воды без РНКазы, в зависимости от ожидаемого выхода. Держите РНК на льду и измеряйте выход с помощью спектрофотометра. Храните РНК при -80 °C
ПРИМЕЧАНИЕ: Можно опустить этап обработки ДНКазы, так как тщательного снятия только верхних 350 мкл слоя РНК достаточно для предотвращения загрязнения ДНК. В дополнение к анализу RT-qPCR, изолированная РНК также может быть использована для секвенирования РНК, и в этом случае настоятельно рекомендуется этап лечения ДНКазой.
- Синтез кДНК
- Используйте до 1 мкг РНК для синтеза кДНК с помощью набора для синтеза кДНК в соответствии с инструкциями производителя.
- После завершения пробега добавьте 80 мкл воды без РНКазы. Храните образцы при температуре -20 °C.
- RT-qPCR адипоцит-селективных генов.
- Используя формат 384 скважины, добавьте 1 мкл грунтовки (~ 1 мкМ конечной концентрации) на дно каждой скважины. Грунтовки предварительной сушки приводят к более плотным техническим репликам. Оставьте покрытыми до полного испарения грунтовок (пластину можно поместить на нагревательный блок, установленный на 37 °C для ускорения испарения).
- Настройте реакции образцов с четырьмя-восемью техническими репликами следующим образом: 2,5 мкл мастер-смеси ОТ-ПЦР на основе красителя, 2,1 мкл воды без РНКазы и 0,4 мкл кДНК (~1 нг) с общим объемом 5 мкл на скважину. Использовались следующие условия теплового цикла: денатура при 95 °C в течение 15 с и отжиг/расширение при 60 °C в течение 25 с в течение 40 циклов.
- Нормализуйте необработанные значения КТ (порог цикла) до уровней генов ведения хозяйства (т.е. Hprt и Pde12) путем расчета ΔΔCT, как описано здесь38. Последовательности праймеров см. вразделе 20 .
ПРИМЕЧАНИЕ: Следует следовать стандартной практике анализа ОТ-qPCR, такой как использование контроля обратной транскрипции (-RT), реакция ПЦР и валидация праймера.
Результаты
Иммунофлуоресцентная визуализация внутримышечного жира
Следуя приведенным выше шагам и рассматривая Рисунок 1А, участки ткани ТА были собраны из 21-дневной травмы после глицерина, которые были либо заморожены сразу после сбора урожая в LN2-охлаждаемом изопентане, либо были зафиксированы в 4% PFA в течение 2,5 ч. После криосекции и окрашивания обоих образцов изображения были сделаны в середине живота, самой большой области ТА. АДИПОЦИТЫ PERILIPIN+ из нефиксированных ТА (рисунок 1B) значительно изменили морфологию по сравнению с фиксированными срезами (рисунок 1C), что делает их идентификацию, визуализацию и последующую количественную оценку гораздо более сложной и потенциально неточной. Следует отметить, что первые липидные капли PERILIPIN+ были обнаружены примерно через 5 дней после травмы, причем большинство адипоцитов сформировались к 7-му дню. К 21 дню после травмы адипоциты полностью созрели.
Поскольку количество жира на ТА сильно коррелирует с тяжестью индуцированной травмы, ТА должны быть значительно повреждены, чтобы эффективно наблюдать и изучать внутримышечное образование жира. Практика инъекций с использованием чернил в трупные ТА - отличный способ улучшить тяжесть травм. Успешные травмы, как правило, превышают 50% мышц. Следует отметить, что поврежденные области мышцы представляют собой области, лишенные мышечных волокон или области, которые населены мышечными волокнами, которые содержат, по меньшей мере, одно центрально расположенное ядро, известное отличительное признак регенерирующего мышечного волокна.
Этот протокол может быть легко адаптирован к окрашиванию для FAP и жира в 3D. Для этого несколько миофиберов из постфиксации ТА были тщательно отделены с последующей иммунофлуоресценцией целиком. Ключ заключается в том, чтобы правильно закрепить волокна на стеклянной горке и, в то же время, избежать чрезмерного сжатия ткани. Используя формуемые глиняные ножки, пользователь может отрегулировать необходимую толщину и закрепить крышку на слайде, даже позволяя использовать инвертированный микроскоп (рисунок 4A). Этот метод был успешно использован для маркировки PDGFRα+ FAPs, фаллоидин+ миофиберов и ПЕРИЛИПИН-экспрессирующих адипоцитов (рисунок 4B, дополнительное видео 1 и дополнительное видео 2). После получения изображений на нескольких z-плоскостях толщиной до 150 мкм для создания 3D-реконструкции использовался модуль 3D-рендеринга в программном обеспечении микроскопа.
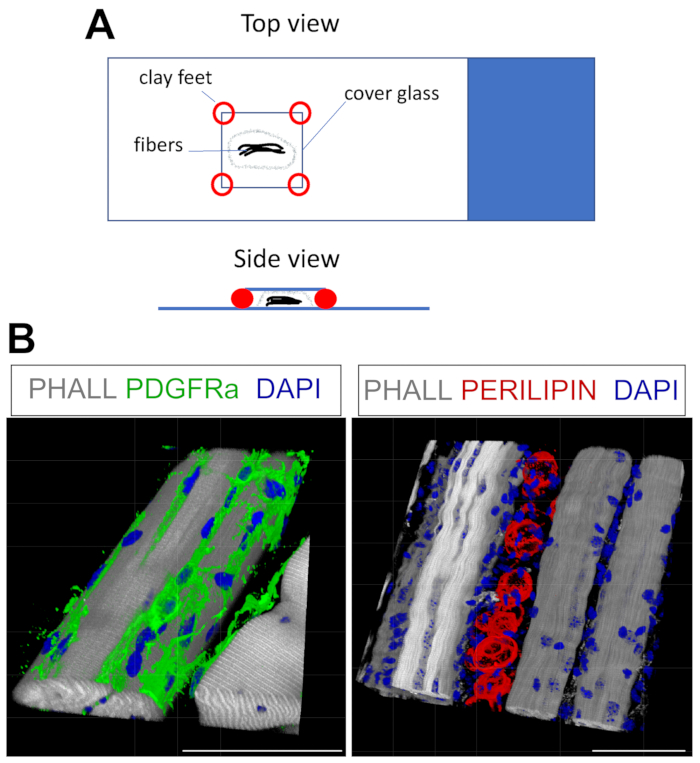
Рисунок 4: Полноразмерное иммунофлуоресцентное окрашивание. (A) Вид сверху и сбоку о том, как установить образец и добавить крышку для окрашивания целиком. (B) Репрезентативные 3D-реконструкции ФАПов (зеленый; левый) и адипоцитов (красный; правый) вместе с миофибрами (серый) и ядрами (синий). Шкала: 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Количественная оценка внутримышечного жира
После того, как были сделаны изображения внутримышечного жира, функция клеточного счетчика в ImageJ / FIJI была использована для ручного подсчета количества адипоцитов PERLIPIN+ (рисунок 5A). Далее определяли общую площадь мышечного отдела, а также травмированную область, определяемую центрально расположенными ядрами в миофибрах. Чтобы контролировать тяжесть травмы, общее количество адипоцитов делили на поврежденную область, в результате чего количество жировых клеток на 1 мм2 поврежденной мышцы. Обычно ТА, которые показывают травму <30%, исключаются из количественных оценок. Отметим, что хотя адипоциты встречаются редко без травм, в диапазоне от нуля до восьми на площадь поперечного сечения, общее количество адипоцитов все же нормализуется общей площадью. Как показано на рисунке 5B, повреждение глицерином вызывает огромное количество внутримышечного жира по сравнению с неповрежденной мышцей ТА. В качестве альтернативы, поскольку окрашивание Перилипином очень чистое с высоким отношением сигнал/шум, также можно использовать функцию анализа частиц для определения общей площади, занимаемой Перилипином. Однако этот метод не сможет отличить меньшие адипоциты от меньшего количества. До трех секций от как минимум четырех отдельных животных были изображены и количественно определены, и сообщалось о среднем количестве жировых клеток, присутствующих на мышь.
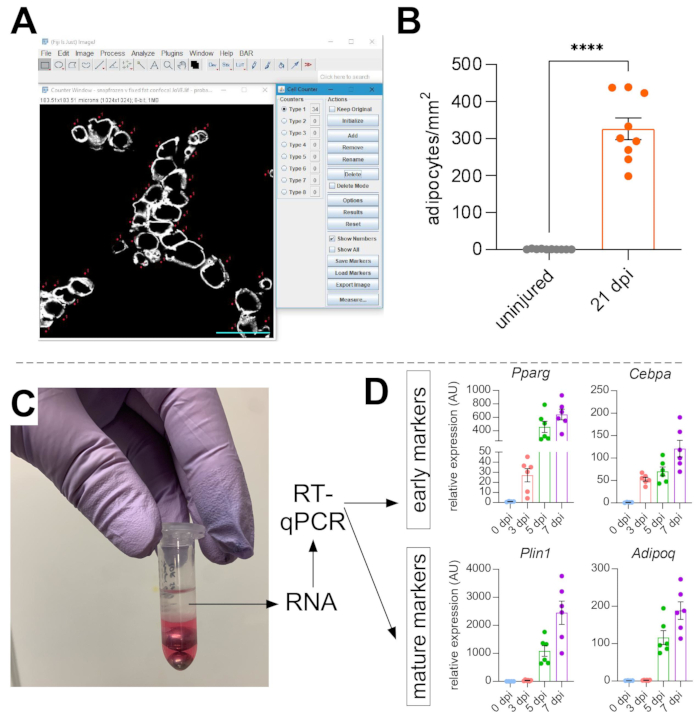
Рисунок 5: Количественная оценка внутримышечного жира. (A) Репрезентативное изображение того, как считать PERILIPIN+ адипоциты (белые) с помощью функции клеточного счетчика в ImageJ. Шкала бара: 50 мкм. (B) Количественные показатели адипоцитов всего ТА через 21 день после инъекции глицерина нормализуются до 1 мм2 поврежденной области. Каждая точка представляет собой среднее значение одной мыши. Полосы ошибок отображаются как SEM. **** = p < 0,0001. (C) Слой РНК после гомогенизации и последующего разделения фаз хлороформом используется для анализа RT-qPCR. (D) Сворачивает изменения в уровнях экспрессии Pparg и Cepbα, ранних адипогенных генов, а также Plin1 и Adipoq, двух зрелых маркеров адипоцитов, в разные моменты времени после повреждения глицерином. Каждая точка представляет собой среднее значение одной мыши. Панели ошибок, показанные как SEM. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Для самостоятельного подтверждения количества присутствующего внутримышечного жира могут быть определены уровни экспрессии генов различных адипогенных маркеров. Для этого РНК может быть выделена из части той же мышцы ТА, используемой для иммунофлуоресценции (см. шаги выше) в разных точках после травмы. Бисерный колотушитель использовался в сочетании с тиоцианатом гуанидия для гомогенизации ткани. После добавления хлороформа с последующим центрифугированием верхний РНК-содержащий слой тщательно экстрагировали, а для очистки РНК использовали мини-спиновые колонки (рисунок 5С). Этот метод обычно производит высокое качество и количество РНК, подходящих для всех последующих анализов, таких как RT-qPCR и RNAseq. Для RT-qPCR были определены относительные уровни экспрессии адипогенных генов к домашним хозяйствам, и любые относительные изменения оценивались в соответствии с методом ΔΔCT38. Как описано на рисунке 5D, по сравнению с неповрежденной мышцей ТА, повреждение глицерином вызывает экспрессию ранних адипогенных маркеров, таких как Pparg и Cebpα, уже через 3 дня после травмы. Зрелые маркеры, такие как адипонектин (Adipoq) и перилипин (Plin1), могут быть обнаружены уже через 5 дней после повреждения глицерином.
Отслеживание генетической линии адипоцитов
Протокол окрашивания адипоцитов, представленный здесь, может быть легко адаптирован для включения генетической линии отслеживания FAP для отображения и отслеживания их судьбы в адипоцитах. Например, ранее мы продемонстрировали, что рекомбинация может быть индуцирована путем введения тамоксифена в PdgfrαCreERT2; Мышей Rosa26EYFP за 2 недели до травмы, эффективно удаляя флоксированную стоп-кодировку и неизгладимо активируя экспрессию EYFP в FAP (рисунок 6A). Мы достигли высокой эффективности рекомбинации с помощью режима тамоксифена, представленного здесь, причем ~ 75% PDGFRα+ FAP экспрессируют EYFP20, аналогично тому, что другие лаборатории сообщили о 27,39,40. Демонстрируя, что FAP действительно являются клеточным происхождением внутримышечного жира, большинство FAP превратились в EYFP + PERILIPIN-экспрессирующие адипоциты через 7 дней после повреждения глицерином (рисунок 6B).
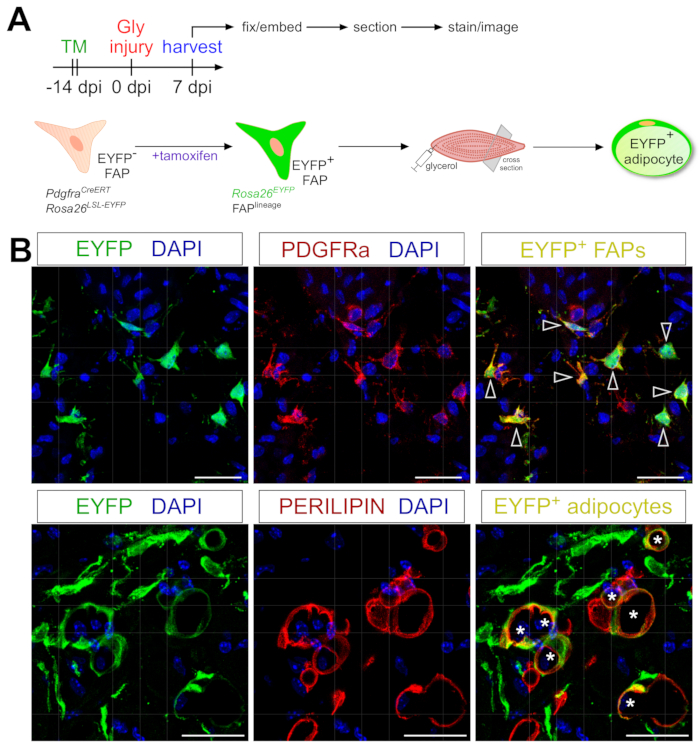
Рисунок 6: Трассировка родословной FAPs. (A) Схематический обзор экспериментальной установки. (B) Репрезентативные иммунофлуоресцентные изображения, показывающие успешную рекомбинацию и активацию EYFP (желтый) в PDGFRα+ FAPs (красный, наконечники стрелок) и АДИПОЦИТЫ PERILIPIN+ (красный, звездочки). Шкала: 25 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обнаружение нескольких типов клеток
Этот протокол также может быть использован для визуализации миогенного компартмента. Используя антитела против PAX7 и MYOD1, мышечные стволовые клетки (MuSCs) и миобласты, соответственно, могут быть легко обнаружены через 5 дней после повреждения глицерином даже в участке мышечной ткани, зафиксированном PFA (рисунок 7). Таким образом, представленный протокол является универсальным и адаптируемым не только к маркировке и изображению адипоцитов и ФАПов, но и к другим типам клеток миогенной линии.
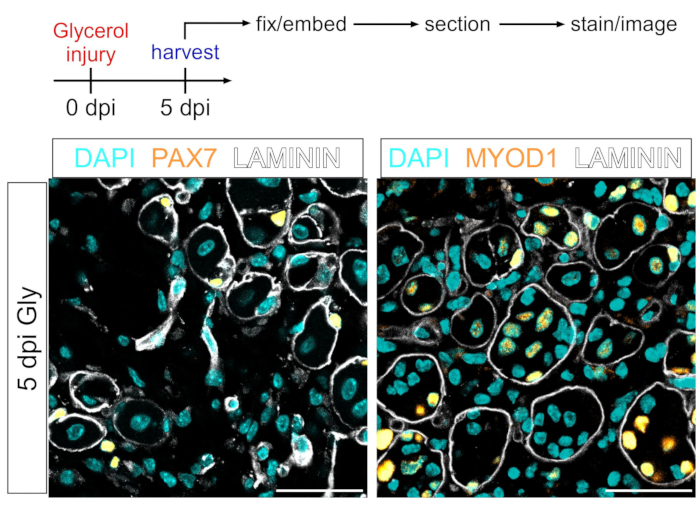
Рисунок 7: Иммунофлуоресцентное окрашивание мышечных стволовых клеток и миобластов. (А) Схематический обзор экспериментальной установки. (B) Репрезентативные иммунофлуоресцентные изображения, показывающие успешное окрашивание мышечных стволовых клеток (MuSC) (желтый, слева) с PAX7 и миобластов (желтый, справа) с MYOD1. LAMININ очерчивает миофибры (белые), а ядра находятся в голубом цвете. Шкала: 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительное видео 1: 3D-рендеринг FAP. Трехмерная реконструкция миофиберов, ФАПов и ядер, окрашенных для ФАЛЛОИДИНА (серый), PDGFRα (зеленый) и DAPI (синий), соответственно, через 21 день после травмы. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Дополнительное видео 2: 3D-рендеринг внутримышечного жира. Объемная визуализация пучков миофибры (серый, ФАЛЛОИДИН) и внутримышечного жира (красный, PERILIPIN), который заменил миофибер через 21 день после повреждения глицерином. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Обсуждение
Этот протокол описывает обширный и подробный протокол, который позволяет эффективно визуализировать и строгую количественную оценку внутримышечного жира. Расщепляя одну и ту же мышцу на две части, одна из которых используется для иммунофлуоресценции, а другая для анализа RT-qPCR, этот протокол также очень универсален. Он также может быть объединен с отслеживанием генетической линии FAP для изучения их превращения в адипоциты при определенных условиях и легко адаптируется к маркировке и изображению нескольких дополнительных типов клеток.
Наиболее часто используемыми способами визуализации внутримышечного жира являются парафиновые срезы, за которыми следует окрашивание гематоксилином и эозином или замороженные участки, окрашенные для липофильных красителей, таких как Oil Red O (ORO). Однако, в то время как ткани, обработанные парафином, сохраняют лучшую гистологию, тот же процесс также извлекает все липиды, предотвращая использование липофильных красителей. Хотя методы липофильного окрашивания будут работать как на фиксированных, так и на нефиксированных участках ткани, липидные капли легко вытесняются при надавливании на покров, тем самым искажая пространственное распределение внутримышечного жира. Чтобы обойти это, недавнее исследование установило строгий протокол для визуализации АДИПОЦИТОВ ORO+ с использованием подхода whole-mount. Для этого авторы децеллюляризировали ТА для визуализации пространственного распределения внутримышечного жира по всему ТА41. Каким бы мощным ни был этот метод, он также предотвращает использование других сопутствующих пятен для маркировки дополнительных клеточных структур. Представленный здесь подход иммунофлуоресценции может быть использован для совместного окрашивания адипоцитов различными маркерами, позволяющими точно отображать клеточную среду. Однако одной из основных проблем является проникновение антител в ткани. Чем больше волокон удерживается вместе, тем сложнее будет антителам одинаково проникать и связывать все доступные антигены. Таким образом, этот метод наиболее эффективен при взгляде на небольшие группы волокон. В то же время это также является ограничением, поскольку общее анатомическое расположение внутримышечного жира теряется при сосредоточении внимания только на небольших, отслаивающихся пучках волокон. Тем не менее, с текущим развитием новых методов очистки тканей плюс новая технология визуализации, в будущем будет возможно большее проникновение и визуализациятканей 42,43,44.
В то время как предварительная фиксация мышечной ткани сохраняет морфологию адипоцитов, она также создает проблему для оценки размера миофибров, что является важным измерением здоровья мышц. Размер миофибры определяется путем измерения площади поперечного сечения миофибр. Ранее мы сообщали, что предварительная фиксация мышечной ткани приведет к тому, что большинство маркеров, доступных для обозначения миофибров, потерпят неудачу31. Чтобы преодолеть это препятствие, мы разработали новый конвейер сегментации изображений, который позволяет измерять размер миофибры даже в фиксированных мышечных участках31. Таким образом, мы создали надежный и эффективный конвейер обработки тканей, который в сочетании с этим протоколом преодолевает большинство недостатков, вызванных предварительной фиксацией мышечной ткани.
Еще одним важным преимуществом такого подхода является универсальность. Разбивая ТА на две части, количество информации, которую можно получить от одной мышцы, максимизируется. Это не только уменьшает численность животных, но и добавляет дополнительный уровень контроля, подтверждая гистологию через экспрессию генов и наоборот. Кроме того, многие различные гены могут быть исследованы за пределами адипогенных генов. Изолированная РНК также может быть использована для эксперимента с целым мышечным RNAseq. Наконец, замороженная мышечная часть также может быть использована для белковой работы. Одним из ограничений этого протокола является возможность того, что травма не будет последовательной по всей длине ТА. Это может привести к сценарию, когда две мышечные части расходятся в количестве внутримышечного жира, который они содержат, и может потребовать исключения такого образца из любого последующего анализа. Поэтому рекомендуется не просто полагаться на RT-qPCR, чтобы сделать основные выводы о количестве внутримышечного жира, а скорее в качестве подтверждающих данных для гистологических количественных показателей.
Вместе этот протокол описывает надежный, эффективный и строгий конвейер обработки тканей, который позволит визуализировать и количественно оценить внутримышечный жир, что является первым шагом в разработке новых вариантов лечения для борьбы с жировым фиброзом. В то же время он универсален и может быть адаптирован ко многим различным типам клеток в мышцах, а также к адипоцитам в других тканях.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Мы благодарим сотрудников лаборатории Копинке за помощь в сборе данных и критическом прочтении рукописи. Мы также благодарим членов Института миологии при Университете Флориды за их ценный вклад в рукопись. Работа была поддержана грантом NIH 1R01AR079449. Рисунок 2 был создан с помощью Biorender.
Материалы
| Name | Company | Catalog Number | Comments |
| 16% PFA (Pack of 12, 10 mL bottles) | Electron Miscroscopy Sciences | 15710 | |
| 2.0 mL Microcentrifuge Tubes | Fisher Scientific | 05-408-138 | microcentrifuge tubes for snapfreezing/bead beating |
| 2-Methylbutane (4 L) | Fisher Chemical | O3551-4 | isopentane |
| Absolute Ethanol (200 proof) | ThermoFisher Scientific | BP2818100 | |
| AffiniPure Fab fragment donkey anti-mouse | Jackson ImmunoResearch | 715-007-003 | mouse-on-mouse blocking |
| Alexa Fluor 488 donkey anti-chicken secondary antibody | Jackson ImmunoResearch | 703-545-155 | |
| Alexa Fluor 488 donkey anti-mouse secondary antibody | Invitrogen | A21202 | |
| Alexa Fluor 488 donkey anti-rabbit secondary antibody | Invitrogen | A21206 | |
| Alexa Fluor 568 donkey anti-goat secondary antibody | Invitrogen | A11057 | |
| Alexa Fluor 568 donkey anti-rabbit secondary antibody | Invitrogen | A11037 | |
| Alexa Fluor 568 Phalloidin antibody | Invitrogen | A12380 | Dissolved in 1.5 mL methanol (~66 µM working solution) |
| BioLite 24-well Multidishes | ThermoFisher Scientific | 930186 | 24 well plate for PFA tissue incubation |
| Biometra TOne | analytikjena | 8462070301 | Thermal cycler |
| Chicken anti-GFP antibody | Aves Labs | GFP-1020 | |
| Chloroform/isoamyl alcohol 24:1(v/v) for molecular biology, DNAse, RNAse, and Protease free | ThermoFisher Scientific | AC327155000 | |
| Corn oil | Sigma Aldrich | C8267 | |
| DAPI stain | Invitrogen | D1306 | 150 µM working solution in dH2O |
| Donkey Serum (100 mL) | Millipore Sigma | 5058837 | for blocking solution |
| Dumont #5 Forceps | Fine Science Tools | 11251-20 | sharp-tipped tweezers |
| Fine Scissors Straight 9 cm | Fine Science Tools | 14060-09 | |
| Fluoromount-G | SouthernBiotech | 0100-01 | mounting medium |
| Glycerol, 99.5%, for molecular biology (500 mL) | Acros Organics | 327255000 | |
| Goat anti-PDGFRα antibody | R&D | AF1062 | |
| Hybridization Oven | VWR | 230301V | for Tamoxifen incubation |
| ImmEdge Hydrophobic Barrier PAP Pen | Vector Laboratories | H-4000 | hydrophobic pen |
| Insulin Syringe with Micro-Fine IV needle (28 G) | BD | 329461 | |
| Insulin Syringe with Slip Tip, 1 mL | BD | 329654 | Insulin syringe without needle, for oral gavaging |
| iScript cDNA Synthesis Kit | Bio-Rad | 1708890 | |
| Isoflurane | Patterson Veterinary | 78938441 | |
| Leica DMi8 inverted microscope | Leica | micrscope used for widefield IF and confocal imaging | |
| Micro Slides | VWR | 48311-703 | positively charged microscope slides |
| mouse anti-MYOD antibody | Invitrogen | MA1-41017 | |
| mouse anti-PAX7 antibody (supernatant) | DSHB | AB 428528 | |
| MX35 Premier+ Microtome blades | ThermoFisher Scientific | 3052835 | microtome blades |
| NanoDrop 2000 Spectrophotometer | ThermoFisher Scientific | ND2000 | spectrophotometer for RNA yield |
| Play-Doh | Hasbro | modeling compound | |
| PowerUp SYBR Green Master Mix | ThermoFisher Scientific | A25742 | green dye PCR master mix |
| Puralube Vet Ointment | Puralube | 17033-211-38 | vet ophthalmic ointment |
| QuantStudi 6 Flex Real-Time 384-well PCR System | Applied Biosystems | 4485694 | qPCR machine |
| Rabbit anti-perilipin antibody | Cell Signaling Technology | 9349S | |
| Red-Rotor Shaker | Hoefer Scientific | PR70-115V | shaker for IF staining |
| Richard-Allan Scientific Slip-Rite Cover Glass | ThermoFisher Scientific | 152460 | coverslips |
| RNeasy Mini Kit | QIAGEN | 74106 | contains mini spin columns |
| Safe-Lock Tubes 1.5 ml, natural | Eppendorf | 22363204 | |
| Sample Tubes RB (2 mL) | QIAGEN | 990381 | |
| Sodium azide | Alfa Aesar | 14314 | |
| Stainless Steel Beads, 2.8 mm | Precellys | KT03961-1-101.BK | small beads |
| Stainless Steel Beads, 5 mm | QIAGEN | 69989 | medium beads |
| Stainless Steel Beads, 7 mm | QIAGEN | 69990 | large beads |
| Stainless Steel Disposable Scalpels | Miltex | 327-4102 | scalpel |
| Stainless steel feeding tube, 20 G x 38 mm, straight | Instech Laboratories | FTSS-20S-3 | gavage needle |
| Tamoxifen | Toronto Research Chemicals | T006000 | |
| Tissue Plus O.C.T. Compound | Fisher HealthCare | 4585 | embedding medium |
| TissueLyser LT | QIAGEN | 85600 | bead beater |
| TissueLyser LT Adapter, 12-Tube | QIAGEN | 69980 | |
| Tissue-Tek Cryomold | Sakura | 4566 | specimen molds |
| Triton X-100 | Alfa Aesar | A16046 | |
| TRIzol Reagent | ThermoFisher Scientific | 15596026 | guanidium thiocyanate |
| Tween20 (500 mL) | Fisher BioReagents | BP337-500 | |
| VWR Micro Slides - Superfrost Plus | VWR | 48311703 | |
| Wheaton Coplin staining jars | Millipore Sigma | S6016 | Coplin jar |
Ссылки
- Milad, N., et al. Increased plasma lipid levels exacerbate muscle pathology in the mdx mouse model of Duchenne muscular dystrophy. Skeletal Muscle. 7 (1), 19(2017).
- Goodpaster, B. H., et al. Obesity, regional body fat distribution, and the metabolic syndrome in older men and women. Archives of Internal Medicine. 165 (7), 777-783 (2005).
- Goodpaster, B. H., et al. Association between regional adipose tissue distribution and both type 2 diabetes and impaired glucose tolerance in elderly men and women. Diabetes Care. 26 (2), 372-379 (2003).
- Goodpaster, B. H., et al. The loss of skeletal muscle strength, mass, and quality in older adults: the health, aging and body composition study. The Journals of Gerontology, Series A: Biological Sciences and Medical Sciences. 61 (10), 1059-1064 (2006).
- Goodpaster, B. H., Thaete, F. L., Kelley, D. E. Thigh adipose tissue distribution is associated with insulin resistance in obesity and in type 2 diabetes mellitus. American Journal of Clinical Nutrition. 71 (4), 885-892 (2000).
- Goodpaster, B. H., Theriault, R., Watkins, S. C., Kelley, D. E. Intramuscular lipid content is increased in obesity and decreased by weight loss. Metabolism. 49 (4), 467-472 (2000).
- Burakiewicz, J., et al. Quantifying fat replacement of muscle by quantitative MRI in muscular dystrophy. Journal of Neurology. 264 (10), 2053-2067 (2017).
- Murphy, W. A., Totty, W. G., Carroll, J. E. MRI of normal and pathologic skeletal muscle. American Journal of Roentgenology. 146 (3), 565-574 (1986).
- Willcocks, R. J., et al. Multicenter prospective longitudinal study of magnetic resonance biomarkers in a large duchenne muscular dystrophy cohort. Annals of Neurology. 79 (4), 535-547 (2016).
- Wokke, B. H., et al. Quantitative MRI and strength measurements in the assessment of muscle quality in Duchenne muscular dystrophy. Neuromuscular Disorders. 24 (5), 409-416 (2014).
- Contreras, O., Rossi, F. M. V., Theret, M. Origins, potency, and heterogeneity of skeletal muscle fibro-adipogenic progenitors-time for new definitions. Skeletal Muscle. 11 (1), 16(2021).
- El Agha, E., et al. Mesenchymal stem cells in fibrotic disease. Cell Stem Cell. 21 (2), 166-177 (2017).
- Joe, A. W., et al. Muscle injury activates resident fibro/adipogenic progenitors that facilitate myogenesis. Nature Cell Biology. 12 (2), 153-163 (2010).
- Liu, W., Liu, Y., Lai, X., Kuang, S. Intramuscular adipose is derived from a non-Pax3 lineage and required for efficient regeneration of skeletal muscles. Developmental Biology. 361 (1), 27-38 (2012).
- Scott, R. W., Arostegui, M., Schweitzer, R., Rossi, F. M. V., Underhill, T. M. Hic1 defines quiescent mesenchymal progenitor subpopulations with distinct functions and fates in skeletal muscle regeneration. Cell Stem Cell. 25 (6), 797-813 (2019).
- Uezumi, A., et al. Fibrosis and adipogenesis originate from a common mesenchymal progenitor in skeletal muscle. Journal of Cell Science. 124, Pt 21 3654-3664 (2011).
- Hogarth, M. W., et al. Fibroadipogenic progenitors are responsible for muscle loss in limb girdle muscular dystrophy 2B. Nature Communications. 10 (1), 2430(2019).
- Uezumi, A., Fukada, S., Yamamoto, N., Takeda, S., Tsuchida, K. Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle. Nature Cell Biology. 12 (2), 143-152 (2010).
- Stumm, J., et al. Odd skipped-related 1 (Osr1) identifies muscle-interstitial fibro-adipogenic progenitors (FAPs) activated by acute injury. Stem Cell Research. 32, 8-16 (2018).
- Kopinke, D., Roberson, E. C., Reiter, J. F. Ciliary Hedgehog signaling restricts injury-induced adipogenesis. Cell. 170 (2), 340-351 (2017).
- Huang, Y., Das, A. K., Yang, Q. Y., Zhu, M. J., Du, M. Zfp423 promotes adipogenic differentiation of bovine stromal vascular cells. PLoS One. 7 (10), 47496(2012).
- Sun, Y. -M., et al. PDGFRα regulated by miR-34a and FoxO1 promotes adipogenesis in porcine intramuscular preadipocytes through Erk signaling pathway. International Journal of Molecular Sciences. 18 (11), 2424(2017).
- Te, L. J. I., Doherty, C., Correa, J., Batt, J. Identification, isolation, and characterization of fibro-adipogenic progenitors (FAPs) and myogenic progenitors (MPs) in skeletal muscle in the rat. Journal of Visualized Experiments: JoVE. (172), e61750(2021).
- Lukjanenko, L., et al. Aging disrupts muscle stem cell function by impairing matricellular WISP1 secretion from fibro-adipogenic progenitors. Cell Stem Cell. 24 (3), 433-446 (2019).
- Santini, M. P., et al. Tissue-resident PDGFRalpha(+) progenitor cells contribute to fibrosis versus healing in a context- and spatiotemporally dependent manner. Cell Reports. 30 (2), 555-570 (2020).
- Uezumi, A., et al. Identification and characterization of PDGFRalpha+ mesenchymal progenitors in human skeletal muscle. Cell Death & Disease. 5, 1186(2014).
- Wosczyna, M. N., et al. Mesenchymal stromal cells are required for regeneration and homeostatic maintenance of skeletal muscle. Cell Reports. 27 (7), 2029-2035 (2019).
- Soliman, H., et al. Pathogenic potential of Hic1-expressing cardiac stromal progenitors. Cell Stem Cell. 26 (2), 205-220 (2020).
- Chung, M. I., Bujnis, M., Barkauskas, C. E., Kobayashi, Y., Hogan, B. L. M. Niche-mediated BMP/SMAD signaling regulates lung alveolar stem cell proliferation and differentiation. Development. 145 (9), Cambridge, England. (2018).
- Hilgendorf, K. I., et al. Omega-3 fatty acids activate ciliary FFAR4 to control adipogenesis. Cell. 179 (6), 1289-1305 (2019).
- Waisman, A., Norris, A. M., Elías Costa, M., Kopinke, D. Automatic and unbiased segmentation and quantification of myofibers in skeletal muscle. Scientific Reports. 11 (1), 11793(2021).
- Kang, S. H., Fukaya, M., Yang, J. K., Rothstein, J. D., Bergles, D. E. NG2+ CNS glial progenitors remain committed to the oligodendrocyte lineage in postnatal life and following neurodegeneration. Neuron. 68 (4), 668-681 (2010).
- Srinivas, S., et al. Cre reporter strains produced by targeted insertion of EYFP and ECFP into the ROSA26 locus. BMC Developmental Biology. 1, 4(2001).
- Lukjanenko, L., Brachat, S., Pierrel, E., Lach-Trifilieff, E., Feige, J. N. Genomic profiling reveals that transient adipogenic activation is a hallmark of mouse models of skeletal muscle regeneration. PLoS One. 8 (8), 71084(2013).
- Mahdy, M. A., Lei, H. Y., Wakamatsu, J., Hosaka, Y. Z., Nishimura, T. Comparative study of muscle regeneration following cardiotoxin and glycerol injury. Annals of Anatomy = Anatomischer Anzeiger: Official Organ of the Anatomische Gesellscaft. 202, 18-27 (2015).
- Pisani, D. F., Bottema, C. D., Butori, C., Dani, C., Dechesne, C. A. Mouse model of skeletal muscle adiposity: a glycerol treatment approach. Biochemical and Biophysical Research Communications. 396 (3), 767-773 (2010).
- Kawai, H., et al. Experimental glycerol myopathy: a histological study. Acta Neuropathologica. 80 (2), 192-197 (1990).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative CT method. Nature Protocols. 3 (6), 1101-1108 (2008).
- Uezumi, A., et al. Mesenchymal Bmp3b expression maintains skeletal muscle integrity and decreases in age-related sarcopenia. The Journal of Clinical Investigation. 131 (1), 139617(2021).
- Biferali, B., et al. Prdm16-mediated H3K9 methylation controls fibro-adipogenic progenitors identity during skeletal muscle repair. Science Advances. 7 (23), 9371(2021).
- Biltz, N. K., Meyer, G. A. A novel method for the quantification of fatty infiltration in skeletal muscle. Skeletal Muscle. 7 (1), (2017).
- Vieites-Prado, A., Renier, N. Tissue clearing and 3D imaging in developmental biology. Development. 148 (18), Cambridge, England. (2021).
- Gómez-Gaviro, M. V., Sanderson, D., Ripoll, J., Desco, M. Biomedical applications of tissue clearing and three-dimensional imaging in health and disease. iScience. 23 (8), 101432(2020).
- Ueda, H. R., et al. Tissue clearing and its applications in neuroscience. Nature Reviews Neuroscience. 21 (2), 61-79 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены