Method Article
Um Guia para Examinar a Formação de Gordura Intramuscular e sua Origem Celular no Músculo Esquelético
Neste Artigo
Resumo
A substituição do tecido muscular saudável por gordura intramuscular é uma característica proeminente das doenças e condições humanas. Este protocolo descreve como visualizar, imagem e quantificar a gordura intramuscular, permitindo o estudo rigoroso dos mecanismos subjacentes à formação de gordura intramuscular.
Resumo
Progenitores fibro-adipogênicos (FAPs) são células mesenquimais estromicas que desempenham um papel crucial durante a homeostase e regeneração muscular esquelética. As FAPs constroem e mantêm a matriz extracelular que age como um andaime molecular de miofibra. Além disso, os FAPs são indispensáveis para a regeneração da miofibra, pois secretam uma infinidade de fatores benéficos sentidos pelas células-tronco musculares (MuSCs). Em estados doentes, no entanto, as FAPs são a origem celular da gordura intramuscular e do tecido cicatricial. Esta fibrose gordurosa é uma marca registrada de sarcopenia e doenças neuromusculares, como distrofia muscular de Duchenne. Uma barreira significativa na determinação do porquê e como as FAPs se diferenciam em gordura intramuscular é a preservação efetiva e posterior visualização de adipócitos, especialmente em seções de tecido congelado. Métodos convencionais de processamento do tecido muscular esquelético, como o congelamento de snaps, não preservam adequadamente a morfologia dos adipócitos individuais, impedindo assim a visualização e quantificação precisas. Para superar esse obstáculo, foi desenvolvido um protocolo rigoroso que preserva a morfologia adipócito em seções musculares esqueléticas que permitem visualização, imagem e quantificação de gordura intramuscular. O protocolo também descreve como processar uma porção de tecido muscular para RT-qPCR, permitindo que os usuários confirmem alterações observadas na formação de gordura, visualizando diferenças na expressão de genes adipogênicos. Além disso, pode ser adaptado para visualizar adipócitos por imunofluorescência de montagem total de amostras musculares. Finalmente, este protocolo descreve como realizar o rastreamento de linhagem genética de FAPs que expressam Pdgfrα para estudar a conversão adipogênica de FAPs. Este protocolo produz consistentemente imagens imunofluorescentes de alta resolução e morfologicamente precisas de adipócitos, juntamente com a confirmação pelo RT-qPCR, permitindo uma visualização e quantificação robusta, rigorosa e reprodutível de gordura intramuscular. Juntos, o pipeline de análise descrito aqui é o primeiro passo para melhorar nossa compreensão de como as FAPs se diferenciam em gordura intramuscular, e fornece uma estrutura para validar novas intervenções para prevenir a formação de gordura.
Introdução
A infiltração de tecido muscular saudável com fibrose gordurosa é uma característica proeminente da Distrofia Muscular de Duchenne (DMD) e outras doenças neuromusculares, bem como sarcopenia, obesidade e diabetes 1,2,3,4,5,6,7,8,9,10 . Embora o aumento da infiltração de gordura nessas condições esteja fortemente associado à diminuição da função muscular, nosso conhecimento sobre o porquê e como as formas de gordura intramuscular ainda são limitadas. Os FAPs são uma população multipotente de células estromal mesenquimais presentes na maioria dos órgãos adultos, incluindo músculo esquelético11,12. Com a idade e as doenças crônicas, no entanto, as FAPs produzem tecido cicatricial fibroso e diferenciam-se em adipócitos, que estão localizados entre os miofibers individuais e formam gordura intramuscular 13,14,15,16,17,18,19,20.
Para começar a combater a formação de gordura intramuscular, os mecanismos de como as FAPs se transformam em adipócitos precisam ser definidos. PDGFRα é o marcador "padrão-ouro" no campo para identificar FAPs dentro do músculo de múltiplas espécies 13,16,17,18,20,21,22,23,24,25,26,27. Como resultado, várias linhas cre indutíveis de tamoxifeno murine, sob o controle do promotor Pdgfrα, foram geradas, permitindo a manipulação genética de FAPs in vivo usando o sistema Cre-LoxP 27,28,29. Por exemplo, combinando esta linha de Cre indutível com um repórter genético, o rastreamento de linhagem de FAPs pode ser realizado, uma estratégia que aplicamos com sucesso ao mapa do destino FAPs em tecido adiposo muscular e branco20,30. Além do rastreamento de linhagem, essas linhas Cre fornecem ferramentas valiosas para estudar a conversão FAP-para-gordura.
Um grande obstáculo na definição do mecanismo da conversão adipogênica das FAPs em gordura intramuscular é a capacidade de quantificar rigorosamente e reprodutivelmente a quantidade de gordura intramuscular que se formou em diferentes condições. A chave é equilibrar a preservação do tecido muscular e adiposo e combinar isso com os métodos de coloração disponíveis para visualizar adipócitos. Por exemplo, o músculo esquelético é muitas vezes congelado sem fixação prévia, preservando miofibers, mas interrompendo a morfologia adipócito (Figura 1). Em contraste, a fixação seguida de incorporação de parafina, enquanto exibe a melhor histologia tecidual, incluindo adipócitos, remove todos os lipídios, tornando assim a maioria dos corantes lipofílicos, como o corante comumente usado Oil Red O, inutilizável.
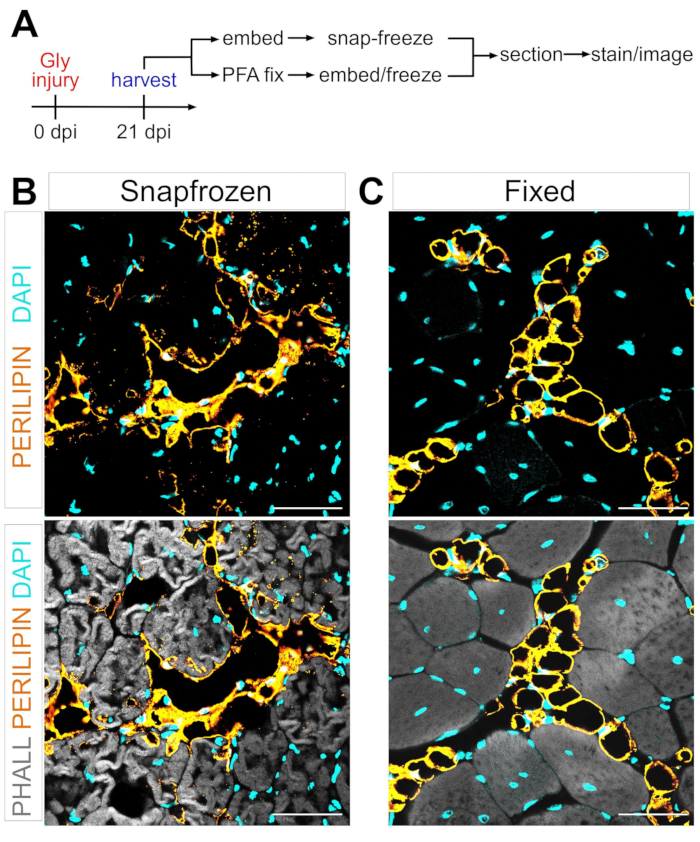
Figura 1: Imagens representativas de gordura intramuscular em tecidos musculares congelados e fixos. (A) Visão geral esquemática da configuração experimental. Imagens imunofluorescentes que mostram adipócitos (amarelo), miofibers (cinza) e núcleos (ciano) dentro de ambos (B) snap-frozen e (C) fixaram TAs em 21 dias após lesão glicerol. Barras de escala: 50 μm. Clique aqui para ver uma versão maior desta figura.
O protocolo aqui descrito preserva a morfologia da miofibra e adipócito e permite a visualização e análise de múltiplos tipos de células. Esta abordagem baseia-se na coloração de imunofluorescência de adipócitos em tecido muscular fixo paraformaldeído (PFA), que permite a co-coloração com múltiplos anticorpos. Também pode ser facilmente adaptado para exibir espacialmente gordura intramuscular em tecido intacto usando imagens de montagem total, fornecendo assim informações sobre o microambiente celular de gordura dentro do músculo. Além disso, este protocolo pode ser combinado com nossa abordagem recentemente publicada para determinar a área transversal de miofibers em tecidos musculares fixos31, uma medida importante para avaliar a saúde muscular. Combinando essa abordagem com o rastreamento de linhagem genética ao mapa do destino, a diferenciação das FAPs em adipócitos também é descrita aqui. Assim, o protocolo versátil aqui descrito permite uma avaliação rigorosa e reprodutível das FAPs e sua diferenciação em gordura intramuscular em seções teciduais e tecidos intactos.
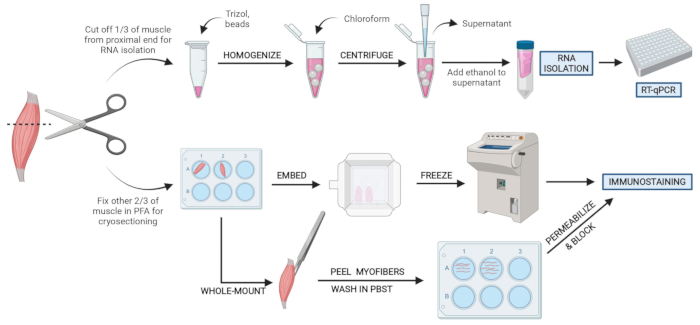
Figura 2: Visão geral do protocolo esquemático. Visão geral esquemática do processamento de tecidos em que um terço do TA é removido, congelado por snap e homogeneizado para análise subsequente de isolamento e transcrição do RNA via RT-qPCR. Os outros dois terços do TA são fixos e processados por PFA para imunossuagem em seções congeladas ou fibras de montagem inteira. Clique aqui para ver uma versão maior desta figura.
Protocolo
Todos os protocolos animais foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais (IACUC) da Universidade da Flórida.
1. Rastreamento de linhagem genética de FAPs
NOTA: Se o rastreamento de linhagem genética de FAPs não for desejado, o passo 1 pode ser ignorado.
- Para realizar o rastreamento de linhagem de FAPs, obtenha os alelos necessários ao mouse.
NOTA: Várias linhas cre indutíveis de tamoxifen, sob o controle do promotor Pdgfrα , foram geradas para atingir com sucesso os FAPs, incluindo os laboratórios Hogan29, Rando27 e Bergles32 . Como repórter genético da atividade cre, inúmeros alelos repórteres Rosa26 estão disponíveis, como Rosa26EYFP33. Embora seja sugerido para cada laboratório determinar qual combinação Cre-Reporter é mais eficaz, cruzando ratos PdgfrαCreERT2 (29 e Jax# 032770) para o repórter Rosa26EYFP (33 e Jax# 006148), o PdgfrαCreERT2 resultante; Os camundongosRosa26 EYFPpodem ser usados para marcar de forma eficiente e especificamente os FAPs20. Para traçar o destino das FAPs maduras, recomenda-se esperar até que os ratos tenham atingido pelo menos ~10 semanas de idade antes de administrar o tamoxifen. Experimentos de rastreamento de linhagem podem ser realizados em machos e fêmeas. - Administração de tamoxifen através de gavaging oral
- Prepare 40 mg/mL de tamoxifeno em óleo de milho e vórtice bem para misturar 1 dia antes do gavaging. Incubar O/N a 37 °C em um forno de hibridização rotativo.
ATENÇÃO: O tamoxifen é um cancerígeno e deve ser manuseado com cuidado. Use sempre luvas ao manusear e usar uma máscara ao pesá-la como pó, pois há perigo de inalação. - Limpe a área de acordo com o protocolo e conecte uma agulha de gavaging a uma seringa de 1 mL. Desenhe 200 μL de tamoxifen na seringa.
- Scruff PdgfrαCreERT2 ; Camundongos Rosa26EYFP (10 semanas de idade; ambos os sexos usados) colocando-os em uma superfície plana e segurando firmemente a base da cauda. Use uma mão livre para agarrar o meio do mouse com o polegar e o dedo indicador, em seguida, suavemente e com leve pressão deslize a aderência até apenas passar pelos ombros.
- Aperte a pele para trás com o polegar e o dedo indicador, pegue o mouse e vire a mão para que o mouse fique de frente para o usuário, e coloque a cauda entre o dedo mindinho e o dedo anelar da mão segurando o mouse.
- Neste ponto, certifique-se de que o rato está bem imobilizado e incapaz de mover sua cabeça ou braços. Insira a agulha de gavaging na boca e use-a para inclinar ligeiramente a cabeça do mouse para trás; isso permite que o esôfago seja melhor acessível.
- Insira cuidadosamente e lentamente a agulha no esôfago. Não force a agulha se alguma resistência for atingida; a agulha deve deslizar facilmente para baixo. Injete lentamente o tamoxifeno. Monitore os camundongos por 15-20 min para garantir que não ocorram problemas durante a gavaging.
NOTA: A administração do tamoxifen em 2 dias consecutivos normalmente resulta em ~75%-85% de eficiência de recombinação de FAPs sem causar quaisquer efeitos adversos. Recomenda-se que o usuário espere de 1 a 2 semanas antes de induzir a lesão, o que permitirá que o restante do tamoxifeno seja removido do sistema e qualquer proteína restante seja entregue.
- Prepare 40 mg/mL de tamoxifeno em óleo de milho e vórtice bem para misturar 1 dia antes do gavaging. Incubar O/N a 37 °C em um forno de hibridização rotativo.
2. Lesão do músculo tibialis anterior (TA)
NOTA: Para estudar a gordura intramuscular, recomenda-se o uso de um modelo de lesão à base de glicerol (50% de glicerol em soro fisiológico estéril), o que resulta em formação maciça de gordura intramuscular 34,35,36,37.
- Prepare a máquina anestésico adicionando isoflurane e garantindo que os tubos na câmara do rato e no cone do nariz estejam abertos. Limpe a câmara e a área de trabalho com 70% de etanol ou solução de peróxido (dependendo dos protocolos).
- Defina a vazão de oxigênio para 2,5 L/min e a concentração de isoflurane para 2,5%. Coloque um rato na câmara de anestesia e espere ~5 minutos para que ele seja anestesiado.
- Coloque o mouse no supino em uma almofada de aquecimento limpa e insira o nariz no cone do nariz. Aplique delicadamente pomada oftalmica veterinária nos olhos com um aplicador de ponta de algodão para evitar o ressecamento enquanto estiver sob anestesia. Monitore continuamente a anestesia e execute uma pitada no dedo do pé no mouse antes da lesão para garantir que o mouse esteja totalmente anestesiado.
- Limpe a perna para ser injetada com uma limpeza fresca de álcool para desinfetar.
- Desenhe 30-50 μL de 50% de glicerol (dependendo do tamanho dos camundongos) na seringa de insulina. Escove suavemente o cabelo na canela para expor a localização do TA.
NOTA: É mais fácil mover o cabelo e obter melhor visualização quando ainda está molhado do lenço de álcool. - Depois de localizar o TA (apenas lateral à tíbia, ele se projeta ligeiramente através da pele e pode ser sentido com palpação suave), insira a agulha no TA distally, perto do tornozelo. Insira totalmente a agulha no músculo e injete lentamente glicerol enquanto retira gradualmente a agulha, o que ajuda a ferir a maior parte do músculo.
NOTA: É melhor inserir a agulha paralela à perna, com apenas um ângulo ligeiramente elevado. Uma boa lesão normalmente causa dorsiflexão à medida que o TA contrai depois de retirar a agulha. Se os dedos do rato se espalharem, é provável que o músculo extensor digitorum longus (EDL) tenha sido injetado. - Coloque o mouse de volta na gaiola e monitore por cerca de 15-20 minutos para garantir a recuperação da anestesia.
- Descarte a agulha em um recipiente afiado. Nunca recapitula uma agulha.
NOTA: A injeção pós glicerol de analgesia deve ser fornecida conforme aprovado pelo Comitê Institucional de Cuidados e Uso de Animais. Os adipócitos podem ser observados logo após 5 dias de lesão (dpi). Por 7 dpi, todos os adipócitos se formaram, e por 21 dpi, eles amadureceram totalmente.
3. Colheita de tecidos
- Prepare 4% de PFA em 1x PBS e coloque no gelo antes de começar a colheita.
- Coloque todas as placas (12 ou 24-bem) sendo usadas para fixação muscular no gelo e adicione 4% de PFA a cada poço, certificando-se de que cada poço tenha 10-20 vezes mais volume de PFA do que o tecido que está sendo fixado.
- Entre 7 e 21 dias após a lesão do glicerol, eutanize o camundongo de acordo com as diretrizes institucionais (ou seja, overdose de isoflurane seguido de luxação cervical).
- Comece a colher quaisquer tecidos a serem usados para histologia ou isolamento de RNA.
NOTA: Os tecidos devem ser congelados ou colocados em PFA dentro de 10-15 minutos de sacrifício (Figura 2). - Pulverizar liberalmente todas as áreas do mouse para serem cortadas com 70% de etanol para ajudar a manter o cabelo fora da área de dissecação e instrumentos.
- Use uma tesoura para cortar a pele ao redor da parte superior da perna, perto da pelve (Figura 3A).
- Puxe suavemente a pele da perna de cima para baixo até o tornozelo (Figura 3B).
NOTA: O TA é um músculo em forma de lágrima com um tendão distal claramente definido ligado ao cuneiforme medial e primeiro osso metatarso. É lateral à tíbia e se estende até o joelho inferior. - Primeiro, remova a camada externa do tecido conjuntivo (epimísio) usando pinças de ponta afiada antes da colheita do TA (Figura 3C). Use um microscópio de dissecação para visualizar melhor o epimísio.
- Deslize a pinça por baixo do TA a partir da parte inferior do músculo, começando no tendão distal, e puxe suavemente para cima em direção ao joelho (Figura 3D). Pare no final do músculo; não empurre além da resistência sentida no joelho inferior.
- Se houver resistência significativa antes de atingir o joelho inferior, pare e continue removendo as camadas restantes do tecido conjuntivo.
NOTA: Há outro tendão distal apenas lateral ao tendão ta que se prende ao EDL, que é um músculo esguio lateral para o TA. Ter o cuidado de deslizar apenas as pinças sob o tendão ta evita a colheita acidental do EDL, mas também pode ser facilmente removido após a fixação. - Uma vez que o TA tenha sido parcialmente levantado da perna com a pinça, use o mesmo movimento com um bisturi para cortar a conexão do TA ao joelho inferior (Figura 3E). Corte o tendão do tornozelo com uma tesoura para remover totalmente o TA. Só manuseie o músculo no tendão para evitar danificar as fibras.
- Corte 1/3 do TA na extremidade oposta ao tendão (Figura 3F), coloque-o em um tubo de microcentrifusagem e congele-o soltando-o em nitrogênio líquido (Figura 3H).
- Submergir os outros 2/3 do tecido em um poço rotulado com 4% de PFA para histologia (Figura 3I). Certifique-se de acompanhar quando o primeiro e último tecido foi colocado em fixação. Coloque em um agitador para 2-2,5 h a 4 °C.
- A duração da fixação depende do tecido e do seu tamanho. Determine a duração necessária para a fixação dos tecidos. Fixação de TAs para 2-2,5 h a 4 °C normalmente preserva bem a morfologia adipócito sem causar super-fixação do tecido.
NOTA: Se planeja usar TA para coloração imunofluorescente de montagem total, pule o resto deste protocolo até chegar à Seção 7: "Coloração Imunofluorescente do Monte Inteiro". - Após a fixação, remova o PFA dos poços, enxágue os tecidos com pbs frio 2-3 vezes e depois lave 2-3 vezes com PBS frio por 5 min por lavagem.
- Retire o PBS dos poços e adicione sacarose suficiente de 30% em 1x PBS para permitir que o tecido flutue. Coloque no shaker a 4 °C durante a noite.
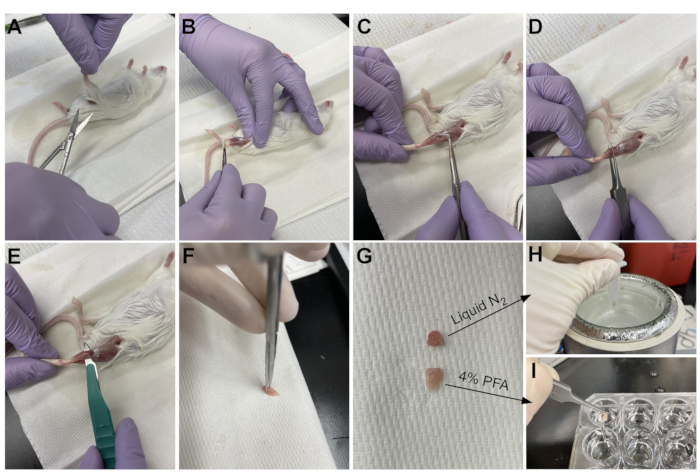
Figura 3: Resumo da colheita de tecidos. (A) A pele é cortada na base da perna e (B) os músculos do membro traseiro estão expostos. (C) Uma vez que o epimísio é removido do TA, (D) fórceps são usados para separar parcialmente o músculo e garantir que o epimísio tenha sido removido completamente. (E) O TA é cortado da perna com um bisturi e removido após cortar o tendão. (G) Depois de cortar o TA em uma peça de um terço e dois terços, (H) um terço é snap-congelado em nitrogênio líquido para análise rt-qPCR e (I) o outro dois terços é fixado em 4% PFA para histologia. Clique aqui para ver uma versão maior desta figura.
4. Incorporação
- Prepare os moldes da amostra para serem usados para incorporar, rotulando e preenchendo com meio de incorporação suficiente para submergir totalmente os tecidos.
- Remova os tecidos dos poços, seque o excesso de sacarose em uma toalha de papel e passe para os moldes de espécimes de preenchimento médio congelante.
NOTA: É útil saber em que orientação o molde com ser seccionado no criostat. Dessa forma, o usuário pode orientar os tecidos no molde de forma que permita que a área de interesse seja facilmente acessível. Para o TA, isso seria conseguido colocando a extremidade mais grossa (oposta do lado do tendão) voltada para a superfície que será seccionada. Isso permite que o TA seja facilmente seccionado em sua parte mais grossa (barriga) e permite o corte transversal das fibras musculares. - Prepare um chorume de isopentano submergindo parcialmente um recipiente que retém isopentane em nitrogênio líquido. Certifique-se de que há isopentane líquida suficiente no recipiente para submergir cerca de metade do molde da amostra a ser usado para incorporar os tecidos.
- Comece a congelar os moldes colocando-os cuidadosamente no chorume isopentane e certificando-se de que cerca de metade do molde está submerso. Além disso, certifique-se de que o molde está congelando igualmente dos quatro lados.
- Tire o molde da isopentane pouco antes de todo o molde ficar visivelmente congelado por cima. A quantidade de tempo que isso leva depende dos moldes que estão sendo usados.
- Mantenha os moldes congelados em um recipiente com gelo seco enquanto congela o resto dos blocos, em seguida, armazene-os a -80 °C.
NOTA: Isopentane para congelamento pode ser reutilizada. Coloque em uma garrafa de vidro, mas não aperte a tampa até que a isopentane atinja a temperatura ambiente (RT). Caso contrário, a mudança de pressão poderia quebrar a garrafa.
5. Secção
- Defina o criostat para -22 a -24 °C, adicione moldes contendo TAs no criostat e espere um mínimo de 30 minutos para aclimatação de temperatura. Enquanto isso, rotule uma série de slides de microscópio carregados positivamente.
- Insira uma placa anti-rolo e alinhe-se ao criostat, de tal forma que haja cortes mínimos na placa onde ela faz contato com o bloco de espécimes. Seguro no lugar.
- Insira uma lâmina criostatal fresca no suporte da lâmina e fixe-a no lugar.
ATENÇÃO: A lâmina está afiada. Cubra a lâmina ao manipular outras partes do criostat ou moldes congelados. - Remova o bloco congelado do molde. Adicione uma camada uniforme de meio de incorporação ao mandril criostat e posicione o bloco no meio. Deixe descansar por 1-3 min até que o meio de incorporação esteja completamente congelado (branco opaco).
NOTA: Para os TAs, a área mais grossa (barriga) deve ser visível quando no mandril. - Coloque o mandril criostat com o bloco de tecido no criostat. Descubra a lâmina e avance o criostat para a frente até entrar em contato com a lâmina. Seção através do bloco em seções de 25 μm até que o tecido não seja mais obscurecido pelo meio de incorporação.
NOTA: Durante a secção, ajuste o ângulo do criostat e/ou posição do palco de modo que as seções sejam de espessura uniforme. Pode ser útil coletar algumas seções para garantir a uniformidade na espessura da seção. Recomenda-se que o usuário encontre a posição adequada da placa anti-rolo antes de se seccionar até a região de interesse dentro do TA (barriga), pois isso permite ao usuário tentar várias posições da placa anti-rolo até que as seções estejam saindo em linha reta sem desperdiçar tecido. - Altere a espessura da seção para 10-12 μm e colete as seções em slides de microscópio rotulados. A seção serial é recomendada coletando seções adjacentes em slides de 6 a 10 (rotulados 1 x), o que permite coloração para marcadores múltiplos. Se necessário, use um pincel fino para descorar seções antes de colecioná-las no slide.
NOTA: Se as seções estiverem enrolando, verifique se a temperatura está estável dentro da faixa de -22 a -24 °C. Se houver estrias verticais nas seções, isso pode ser devido a um corte na placa anti-rolo ou na lâmina; isso pode ser corrigido ajustando a posição da placa anti-rolo e/ou mudando para uma nova lâmina. - Depois de coletar seções adjacentes do mesmo plano de seção em cada slide, ajuste a espessura de volta para 25 μm para avançar 150-200 μm através do bloco, em seguida, ajuste a espessura de volta para 10-12 μm e comece a seção novamente.
NOTA: Esta seção serial permite que o usuário visualize, imagem e quantifique em diferentes profundidades através do TA; três a quatro seções seriais por slide é suficiente. - Armazene os slides e blocos de tecido a -80 °C.
6. Mancha imunofluorescente (IF) de seções teciduais
NOTA: Como as concentrações de anticorpos podem variar entre lotes e fabricantes, a otimização é recomendada avaliando várias concentrações diferentes dos anticorpos em lâminas de teste antes de colorer os slides de interesse.
- Degelo/lâminas secas na RT ou em uma placa quente a 37 °C por 10-20 min.
- Use uma caneta hidrofóbica para desenhar uma linha na borda da superfície de papel do slide, onde ela encontra o vidro.
- Coloque os slides em um frasco de Coplin e lave com 1x PBS + 0,1% Tween20 (PBST) 3-5x em um shaker por pelo menos 5 minutos por lavagem para reidratar as seções teciduais.
NOTA: Neste ponto, é importante não deixar os slides sentarem sem ficar submersos no PBST (até a linha hidrofóbica), ou as seções teciduais secarão. - Coloque os slides no rack de uma câmara umidificante e sobreponha os slides com 310-350 μL de solução de bloqueio (5% de soro de burro e 0,3% Triton X-100 em 1x PBS) por 1-2 h na RT.
NOTA: Não é necessária uma etapa extra de permeabilização, pois a solução de bloqueio contém 0,3% Triton X-100 permitindo a permeabilização suficiente das seções teciduais. Ao usar anticorpos primários derivados de camundongos (ou seja, PAX7 e MYOD1 listados abaixo), recomenda-se incluir uma etapa de bloqueio mouse-on-mouse usando fragmentos Fab (1:50) na solução de bloqueio para a etapa de bloqueio. Isso ajudará a reduzir o fundo devido à ligação inespecífica do anticorpo secundário do rato a anticorpos diferentes dos primários. - Diluir os anticorpos primários a serem usados na solução de bloqueio pouco antes de prosseguir para o próximo passo da seguinte forma:
- Anticorpos primários para coloração de adipócito e imagem de seção inteira: Diluir o anti-perilito do coelho a uma razão de diluição de 1:1000.
- Anticorpos primários para rastreamento de linhagem de adipócitos: Anti-GFP de frango diluído a uma proporção de 1:1000 e anti-perilipina coelho em 1:1000.
- Anticorpos primários para rastreamento de linhagem de FAPs: Anti-GFP de frango diluído a uma proporção de 1:1000 e anti-PDGFRα de cabra em 1:250.
- Anticorpos primários para marcadores miogênicos: Camundongo diluído anti-PAX7 a uma proporção de 1:25 ou camundongo anti-MYOD1 em 1:250, e coelho anti-LAMININ em 1:1000.
NOTA: Embora os anticorpos listados acima tenham sido avaliados com sucesso com este protocolo, é provável que outros marcadores e anticorpos para rotular FAPs, adipócitos e/ou outros tipos de células também sejam compatíveis com este protocolo. É fortemente recomendado ao usar anticorpos primários pela primeira vez que o usuário inclua um slide de controle negativo, no qual anticorpos primários são omitidos. Isso controlará a especificidade dos anticorpos. Todas as outras etapas do protocolo são seguidas, incluindo a adição de anticorpos secundários, mas a solução de bloqueio é usada sozinha na próxima etapa em vez do anticorpo primário na solução de bloqueio.
- Despeje a solução de bloqueio dos slides e sobreposição com 310-350 μL de solução de bloqueio com anticorpos primários e incubar durante a noite a 4 °C na câmara umidificante.
- No dia seguinte, despeje a solução de bloqueio/anticorpos primários dos slides e coloque-os em um frasco de Coplin. Enxágüe os slides 2-3 vezes com PBST e lave 3-5x com PBST em um shaker por pelo menos 5 minutos por lavagem.
- Durante a última lavagem, prepare os anticorpos secundários ou quaisquer conjugados diretos a serem usados na solução de bloqueio. Minimize a quantidade de tempo que esses anticorpos passam na luz para evitar fotobleaching.
- Anticorpos secundários diluídos/conjugados diretos: 488 nm burro anti-frango (1:1000) ou anti-coelho (1:1000) ou anti-rato (1:1000), 568 nm de anti-cabra de burro (1:1000) ou anti-coelho (1:1000) ou falo de póide (myofibers; 13h100), mancha de DAPI (núcleos; 1:500).
- Sobreponha os slides com 310-350 μL da solução de bloqueio com anticorpos secundários e/ou conjugados diretos na câmara umidificante. Incubar na RT por 1-2 h. Proteja amostras da luz de agora em diante.
- Despeje a solução de bloqueio/anticorpos secundários e coloque-os em um frasco de Coplin. Enxágüe com PBST uma vez e lave 3-5x com PBST em um shaker por pelo menos 5 minutos por lavagem. Mantenha o frasco de Coplin coberto para evitar a exposição à luz.
- Seque as lâminas da melhor maneira possível, tocando as bordas e limpando as costas contra uma toalha de papel, mas não deixe as seções de tecido secarem.
- Adicione três ou quatro gotas de meio aquoso de montagem à borda horizontal superior do slide e adicione suavemente um deslizamento de tampa. Não pressione para baixo ou mova se bolhas de ar se formarem sob o deslizamento de cobertura; qualquer pressão ou movimento pode distorcer a frágil arquitetura celular dos adipócitos.
- Permita que o meio de montagem seja definido no escuro durante a noite antes da imagem.
7. Coloração imunofluorescente de montagem inteira
- Após ~1h de fixação (ver passo 3.14), use pinças de ponta afiada para retirar miofibers do TA fixo.
- Coloque as fibras separadas em uma placa de 24 poços e lave 3x por 3 min cada com PBST. Para todas as incubações subsequentes, certifique-se de adicionar a tampa para evitar a evaporação.
- Incubar por 1 h em 1% Triton X-100 em 1x PBS em RT (200-300 μL) em um agitador para permitir uma melhor penetração de anticorpos.
- Depois de enxaguar algumas vezes com PBST, sobreponha com solução de bloqueio (200-300 μL) e bloqueie um nutador ou shaker durante a noite a 4 °C.
- Diluir os anticorpos primários na concentração desejada (dobrar a concentração tende a ser um bom ponto de partida) na solução de bloqueio. Incubar as amostras (200-300 μL) em um nutador ou shaker durante a noite a 4 °C.
- Lave as amostras rigorosamente com PBST durante todo o dia com mudanças frequentes no RT no shaker, cerca de 4-6x por 30-60 min cada lavagem.
- Diluir os anticorpos secundários na solução de bloqueio na concentração desejada (1:500 tende a funcionar bem) mais a coloração nuclear e incubar as amostras (200-300 μL) em um nutador ou shaker durante a noite a 4 °C.
- Lave as amostras rigorosamente com PBST durante todo o dia com alterações frequentes no RT no shaker, cerca de 4-6x vezes por 30-60 min cada lavagem ou lavagem durante a noite a 4 °C.
- Para montar, seque suavemente o excesso de PBST e, em seguida, coloque as fibras em uma ou duas gotas de meio de montagem em uma lâmina de vidro (Figura 4A). Para elevar o deslizamento (18 mm x 18 mm), adicione pequenos pés de argila; isso evitará que as fibras sejam esmagadas e fixem a mancha de cobertura no slide. Modelos de compostos funcionam bem para isso. Uma vez que o deslizamento de cobertura esteja protegido, adicione mais médio à borda até que a área sob o deslizamento esteja cheia.
NOTA: Em vez de usar um meio de montagem contendo agentes anti-desbotamento, o tecido também pode ser movido através de uma série ascendente de glicerol (30% a 80% de glicerol em PBS). - Aguarde de 1 a 2 dias antes da imagem permitir a cura do meio de montagem.
8. Imagem de gordura intramuscular
- Ligue o microscópio e inicie o software de imagem. Segure o slide no palco.
NOTA: Para adipócitos de imagem em seções musculares, um objetivo de 5x ou 10x combinado com microscopia de campo largo é muitas vezes suficiente. Para visualizar O WM-IF, é necessário um microscópio confocal. - Use qualquer canal para identificar a área a ser imagen.
- No software de imagem, ajuste o tempo de ganho e exposição de cada canal.
- Pegue imagens de todo o tecido em cada canal (automático ou manual de acordo com microscópio e software utilizado) e mescle telhas individuais para fazer um composto da seção transversal TA completa.
NOTA: Recomenda-se tirar imagens de duas ou três seções diferentes do mesmo TA em profundidades diferentes. Quantificando os adipócitos em cada seção e, em seguida, relatando a média, diferenças localizadas na quantidade de gordura intramuscular devido, por exemplo, erros de injeção serão evitados.
9. Quantificando adipócitos
- Se não estiver instalado anteriormente, adicione o plug-in cell counter ao ImageJ (https://imagej.nih.gov/ij/plugins/cell-counter.html).
- Importe as imagens para ImageJ como arquivos TIF ou arquivos de microscópio originais. Veja cada canal no ImageJ como um arquivo TIF separado.
NOTA: Se usar lif ou tipos de arquivos de microscópio similares, em opções de importação de bioformitos , escolha Hyperstack para View Stack With e verifique a caixa para Canais Divididos. Clique em OK para abrir o arquivo. Além disso, certifique-se de que a caixa Autoscale não está controlada. - Certifique-se de que as imagens de cada canal estão em formato de 8 bits (e cinza): Imagem > Tipo > 8 bits.
- Mescle imagens DAPI (azul), GFP (verde), PERILIPIN (vermelho) e PHALLOIDIN (cinza): Imagem > Color > Merge Channels.
- Verifique se a escala (Analisar > Escala definida) está em mícrons. Usando a ferramenta de seleção à mão livre, delineie a parte lesionada e não ferida de cada seção transversal e, em seguida, meça (Analisar > Medida) e regise a área lesionada vs. não ferida em uma planilha.
NOTA: O músculo ferido pode ser identificado como áreas desprovidas de miofibers ou áreas povoadas por miofibers que contêm núcleos localizados centralmente. - Contador de células de lançamento: Plugins > CellCounter > Initialize.
- Selecione um tipo de contador e conte cada adipócito. Regisce o número total de adipócitos em uma planilha e, em seguida, calcule o número de adipócitos por 1 mm2 da área ferida.
10. Análise da expressão genética adipogênica usando RT-qPCR
- Isolamento do RNA
- Antes de começar, pré-aqueça a água sem RNase a 45 °C e prepare o EtOH fresco de 70% (350 μL por amostra).
- Adicione 1.000 μL de tiocianato de guanidium a cada tubo contendo a amostra (ver passo 3.12.). É importante que os tubos aprovados pelo batedor de contas estejam sendo usados.
ATENÇÃO: O tiocianato de guanidium é tóxico. Use equipamentos de proteção individual adequados e manuseie em um capô de fumaça. - Adicione três contas médias ou uma grande e uma pequena pérola a cada tubo.
- Homogeneize o tecido a 50 Hz por 2-4 min usando um batedor de contas. Dependendo do tipo de tecido e tamanho da amostra, pode levar até 10 minutos.
- Adicione 200 μL de clorofórmio.
ATENÇÃO: O clorofórmio é tóxico. Use equipamento de proteção pessoal e manuseie em um capô de fumaça. - Agite as amostras por 15 s. Incubar por 2-3 min na RT.
- Centrifugar por 15 min a 12.000 x g. Pipeta fora 350 μL do supernanato claro (camada superior contendo o RNA) e adicionar a um novo tubo de microcentrífuga contendo 350 μL de 70% de etanol. Tenha cuidado para não aspirar as camadas inferiores de proteína e/ou DNA
- Transfira até 700 μL da mistura para uma coluna de mini spin colocada em um tubo de coleta de 2 mL. Continue com o isolamento do RNA seguindo as instruções do fabricante.
- Elute com 30-50 μL de água sem RNase, dependendo do rendimento esperado. Mantenha o RNA no gelo e meça o rendimento usando um espectrofotômetro. Mantenha o RNA armazenado a -80 °C
NOTA: É possível omitir a etapa de tratamento DNase, pois tirar cuidadosamente apenas os 350 μL superiores da camada de RNA é suficiente para evitar a contaminação do DNA. Além da análise rt-qPCR, o RNA isolado também pode ser usado para sequenciamento de RNA, nesse caso uma etapa de tratamento DNase é altamente recomendada.
- Síntese cDNA
- Use até 1 μg de RNA para sintetizar o CDNA com um kit de síntese cDNA, seguindo as instruções do fabricante.
- Após a execução ser concluída, adicione 80 μL de água sem RNase. Armazene as amostras a -20 °C.
- RT-qPCR de genes seletivos adipócitos.
- Usando um formato de 384 poços, adicione 1 μL de primer (~1 μM de concentração final) à parte inferior de cada poço. Os primers pré-secagem resultam em réplicas técnicas mais apertadas. Deixe coberto até que os primers tenham evaporado completamente (a placa pode ser colocada em um bloco de aquecimento definido a 37 °C para acelerar a evaporação).
- Configure reações amostrais com quatro a oito réplicas técnicas da seguinte forma: 2,5 μL de mix mestre RT-PCR baseado em corante, 2,1 μL de água sem RNase e 0,4 μL de cDNA (~1 ng) com volume total de 5 μL por poço. Foram utilizadas as seguintes condições de ciclismo térmico: desnaturação a 95 °C para 15 s e anneal/extend a 60 °C para 25 s para 40 ciclos.
- Normalizar os valores de TC (limiar de ciclo) brutos para os genes de limpeza (ou seja, hprt e Pde12) calculando os níveis de ΔΔ (limiar de ciclo) conforme descrito aqui38. Consulte20 para obter sequências de primer.
NOTA: A prática padrão para análise de RT-qPCR deve ser seguida, como o uso de um controle de transcrição reversa (-RT) menos, reação de PCR e validação do primer.
Resultados
Visualização imunofluorescente de gordura intramuscular
Seguindo os passos acima e vendo a Figura 1A, as seções de tecido TA foram coletadas a partir de uma lesão pós glicerol de 21 dias que foram congeladas imediatamente após a colheita em isopentane resfriada em LN2 ou foram fixadas em 4% pfa por 2,5 h. Após a crioseção e coloração de ambas as amostras, as imagens foram tiradas no meio da barriga, a maior área do TA. Os adipócitos PERILIPIN+ dos TAs não fixados (Figura 1B) alteraram significativamente a morfologia em comparação com as seções fixas (Figura 1C), tornando sua identificação, visualização e quantificação subsequente muito mais difíceis e potencialmente imprecisas. Para notar, as primeiras gotículas lipídicas PERILIPIN+ foram detectadas em torno de 5 dias após a lesão, com a maioria dos adipócitos tendo se formado até o dia 7. Por 21 dias após a lesão, os adipócitos tinham amadurecido completamente.
Como a quantidade de gordura por TA se correlaciona fortemente com a gravidade da lesão induzida, os TAs devem ser feridos significativamente para observar e estudar efetivamente a formação de gordura intramuscular. Praticar injeções usando tinta em TAs de cadáver é uma ótima maneira de melhorar a gravidade da lesão. Lesões bem sucedidas tendem a ser acima de 50% do músculo. Note-se que as áreas lesionadas do músculo representam áreas desprovidas de fibras musculares ou áreas que são povoadas por fibras musculares que contêm pelo menos um núcleo localizado centralmente, uma marca conhecida de uma fibra muscular regeneradora.
Este protocolo pode ser prontamente adaptado à mancha para FAPs e gordura em 3D. Para isso, vários miofibers da pós-fixação do TA foram cuidadosamente separados, seguidos por imunofluorescência de montagem total. A chave é fixar adequadamente as fibras na lâmina de vidro e, ao mesmo tempo, evitar a super-compressão do tecido. Usando pés de argila moldáveis, o usuário pode ajustar a espessura necessária e fixar a mancha de cobertura no slide, permitindo até mesmo o uso de um microscópio invertido (Figura 4A). Este método foi usado com sucesso para rotular FAPs PDGFRα+ , myofibers de Phalloidin+ e adipócitos expressos perilipin (Figura 4B, Vídeo Suplementar 1 e Vídeo Suplementar 2). Depois de obter imagens em vários z-planes que abrangem até 150 μm de espessura, o módulo de renderização 3D dentro do software de microscópio foi usado para criar uma reconstrução 3D.
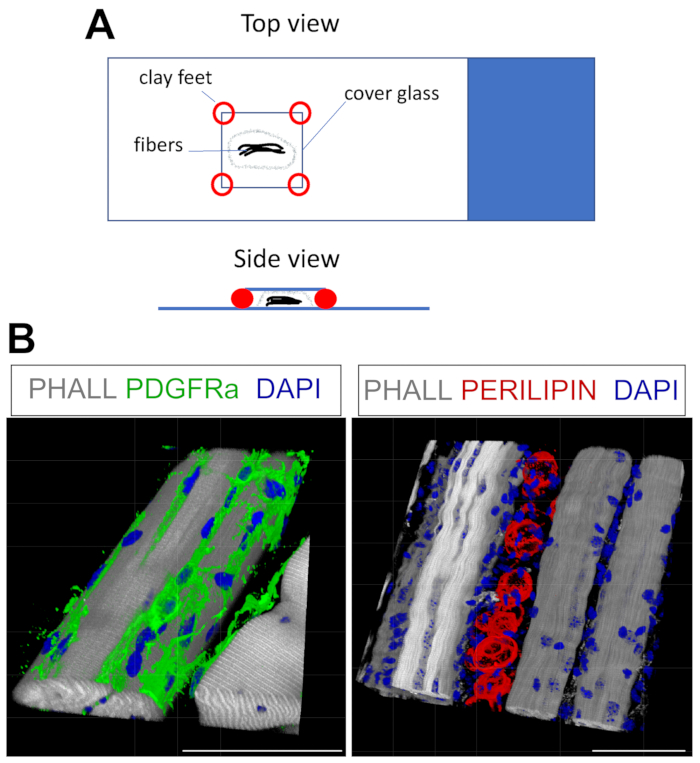
Figura 4: Coloração imunofluorescente de montagem total. (A) Visão superior e lateral de como montar a amostra e adicionar tampas para coloração de montagem inteira. (B) Reconstruções 3D representativas de FAPs (verde; esquerda) e adipócitos (vermelho; direita) juntamente com miofibers (cinza) e núcleos (azul). Barras de escala: 50 μm. Clique aqui para ver uma versão maior desta figura.
Quantificação da gordura intramuscular
Uma vez que as imagens foram tiradas de gordura intramuscular, a função Cell Counter em ImageJ/FIJI foi usada para contar manualmente o número de adipócitos PERLIPIN+ (Figura 5A). Em seguida, foi determinada a área total da seção muscular, bem como a área lesionada, definida por núcleos localizados centralmente dentro dos myofibers. Para controlar a gravidade da lesão, o número total de adipócitos foi dividido pela área lesionada, resultando no número de células de gordura por 1 mm2 de músculo ferido. Normalmente, os TAs que exibem < 30% de lesão são excluídos das quantificações. Note-se que, embora os adipócitos sejam raros sem ferimentos, variando de zero a oito por área transversal, o número total de adipócitos ainda é normalizado pela área total. Como destacado na Figura 5B, uma lesão de glicerol causa grandes quantidades de gordura intramuscular em comparação com um músculo TA ileso. Alternativamente, como a coloração de Perilipin é muito limpa com uma alta relação sinal-ruído, também é possível usar a função Analisar partícula para determinar a área total ocupada por Perilipin. No entanto, este método não será capaz de distinguir entre adipócitos menores versus menos. Até três seções de um mínimo de quatro animais individuais foram imagens e quantificadas, e o número médio de células de gordura presentes por camundongo foi relatado.
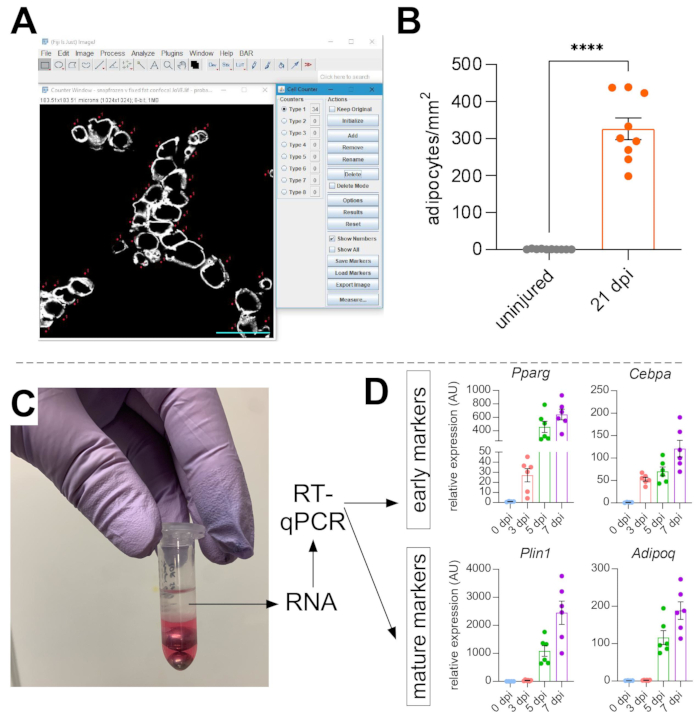
Figura 5: Quantificações de gordura intramuscular. (A) Imagem representativa de como contar adipócitos PERILIPIN+ (branco) utilizando a função Contador de Células no ImageJ. Barra de escala: 50 μm. (B) Quantificações completas de adipócitos ta 21 dias após injeção de glicerol normalizada para 1 mm2 da área ferida. Cada ponto representa a média de um mouse. Barras de erro mostradas como SEM. **** = p < 0,0001. (C) camada de RNA após homogeneização e posterior separação de fase por clorofórmio está sendo usada para análise de RT-qPCR. (D) Dobra as mudanças nos níveis de expressão de Pparg e Cepbα, genes adipogênicos precoces, e Plin1 e Adipoq, dois marcadores adipócitos maduros, em diferentes pontos de tempo após lesão glicerol. Cada ponto representa a média de um mouse. Barras de erro mostradas como SEM. Clique aqui para ver uma versão maior desta figura.
Para confirmar independentemente a quantidade de gordura intramuscular presente, podem ser determinados níveis de expressão genética de vários marcadores adipogênicos. Para isso, o RNA pode ser isolado de uma porção do mesmo músculo TA usado para imunofluorescência (ver passos acima) em diferentes pontos pós-lesão. Um batedor de contas foi usado em combinação com tiocianato de guanidium para homogeneizar o tecido. Após a adição de clorofórmio seguido de centrifugação, a camada superior contendo RNA foi cuidadosamente extraída, e mini colunas de spin foram usadas para limpeza de RNA (Figura 5C). Este método produz rotineiramente alta qualidade e quantidade de RNA adequado para todas as análises a jusante, como RT-qPCR e RNAseq. Para o RT-qPCR, os níveis relativos de expressão dos genes adipogênicos à limpeza foram determinados, e quaisquer alterações relativas foram avaliadas após o método ΔΔCT38. Como descrito na Figura 5D, em comparação com o músculo TA não ferido, a lesão do glicerol induz a expressão de marcadores adipogênicos precoces, como Pparg e Cebpα , logo após 3 dias de lesão. Marcadores maduros, como Adiponectin (Adipoq) e Perilipin (Plin1), podem ser detectados logo após a lesão do glicerol.
Rastreamento de linhagem genética de adipócitos
O protocolo de coloração adipócito apresentado aqui pode ser facilmente adaptado para incluir o rastreamento de linhagem genética de FAPs para mapear e seguir seu destino em adipócitos. Demonstramos, por exemplo, anteriormente que a recombinação poderia ser induzida via administração de tamoxifen em PdgfrαCreERT2; CamundongosRosa26 EYFP 2 semanas antes da lesão, removendo efetivamente a codificação de parada floxed e ativando indelibavelmente a expressão EYFP em FAPs (Figura 6A). Conseguimos altas eficiências de recombinação com o regime de tamoxifeno aqui apresentado, com ~75% das FAPs PDGFRα+ expressando EYFP20, semelhante ao que outros laboratórios relataram 27,39,40. Demonstrando que as FAPs são de fato a origem celular da gordura intramuscular, a maioria dos FAPs se transformaram em adipócitos expressos de PERILIPIN 7 dias após lesão glicerol (Figura 6B).
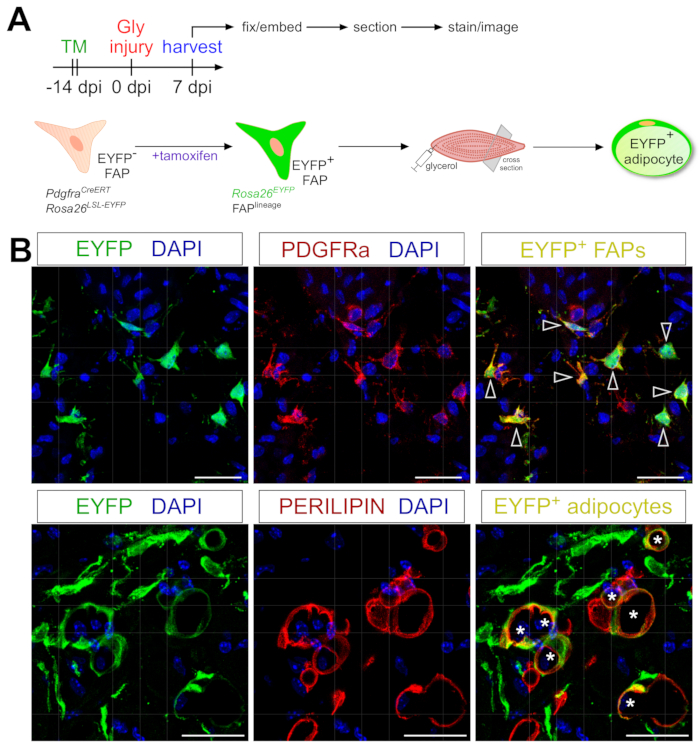
Figura 6: Rastreamento de linhagem de FAPs. (A) Visão geral esquemática da configuração experimental. (B) Imagens imunofluorescentes representativas que mostram recombinação e ativação bem-sucedidas de EYFP (amarelo) dentro de FAPs PDGFRα+ (vermelho, pontas de flecha) e adipócitos PERILIPIN+ (vermelho, asteriscos). Barras de escala: 25 μm. Clique aqui para ver uma versão maior desta figura.
Detecção de vários tipos de células
Este protocolo também pode ser usado para visualizar o compartimento miogênico. Usando anticorpos contra PAX7 e MYOD1, células-tronco musculares (MuSCs) e míferas, respectivamente, podem ser prontamente detectadas 5 dias após lesão de glicerol mesmo na seção de tecido muscular fixo pfa (Figura 7). Assim, o protocolo apresentado é versátil e adaptável não só para adipócitos de etiqueta e imagem e FAPs, mas também outros tipos celulares da linhagem miogênica.
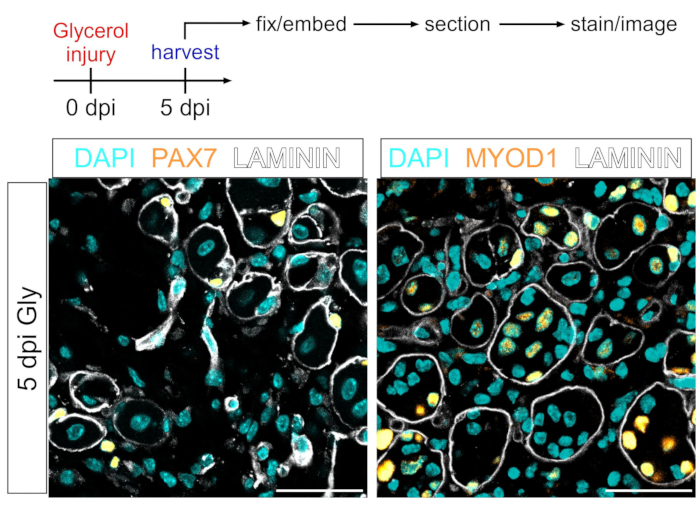
Figura 7: Célula-tronco muscular e coloração imunofluorescente myoblast. (A) Visão geral esquemática da configuração experimental. (B) Imagens imunofluorescentes representativas mostrando a coloração bem sucedida de células-tronco musculares (MuSC) (amarelo, esquerda) com PAX7 e myoblasts (amarelo, direita) com MYOD1. LAMININ descreve os miofibers (branco), e os núcleos estão em ciano. Barras de escala: 50 μm. Clique aqui para ver uma versão maior desta figura.
Vídeo suplementar 1: renderização 3D de FAPs. Reconstrução tridimensional de miofibers, FAPs e núcleos manchados para PHALLOIDIN (cinza), PDGFRα (verde) e DAPI (azul), respectivamente, 21 dias após lesão. Clique aqui para baixar este vídeo.
Vídeo suplementar 2: renderização 3D de gordura intramuscular. Renderização volumosa de pacotes de miofibra (cinza, PHALLOIDIN) e gordura intramuscular (vermelho, PERILIPIN), que substituiu uma lesão de miofibra 21 dias após a lesão de glicerol. Clique aqui para baixar este vídeo.
Discussão
Este protocolo descreve um protocolo extenso e detalhado que permite uma visualização eficiente e uma quantificação rigorosa da gordura intramuscular. Ao dividir o mesmo músculo em duas partes, sendo uma sendo usada para imunofluorescência e outra para análise rt-qPCR, este protocolo também é muito versátil. Também pode ser combinado com o rastreamento de linhagem genética de FAPs para estudar sua conversão em adipócitos sob certas condições e é altamente adaptável ao rótulo e imagem de vários tipos de células adicionais.
As formas mais utilizadas para visualizar a gordura intramuscular são seções de parafina seguidas de manchas de hematoxilina e eosina ou seções congeladas manchadas para corantes lipofílicos, como o Óleo Vermelho O (ORO). No entanto, enquanto os tecidos processados por parafina mantêm a melhor histologia, o mesmo processo também extrai todos os lipídios impedindo o uso de corantes lipofílicos. Embora os métodos de coloração lipofílica funcionem em seções de tecidos fixos e nãofixados da PFA, as gotículas lipídicas são facilmente deslocadas aplicando pressão ao deslizamento de cobertura, distorcendo assim a distribuição espacial da gordura intramuscular. Para contornar isso, um estudo recente estabeleceu um protocolo rigoroso para visualizar adipócitos ORO+ usando uma abordagem de montagem inteira. Para isso, os autores descelularizaram o TA para visualizar a distribuição espacial da gordura intramuscular em toda a TA41. Por mais poderosa que essa técnica seja, também impede o uso de outras co-manchas para marcar estruturas celulares adicionais. Toda a abordagem de imunofluorescência de montagem apresentada aqui pode ser usada para co-manchar adipócitos com uma variedade de marcadores que permitem um mapeamento fino do ambiente celular. Um grande desafio, no entanto, é a penetração tecidual dos anticorpos. Quanto mais fibras forem mantidas juntas, mais difícil será para os anticorpos penetrarem igualmente e amarrarem todos os antígenos disponíveis. Assim, este método é mais eficaz quando se olha para pequenos grupos de fibras. Ao mesmo tempo, esta também é uma limitação, pois a localização anatômica geral da gordura intramuscular está sendo perdida quando se concentra apenas em pequenos feixes de fibras descascados. No entanto, com o desenvolvimento atual de novos métodos de limpeza de tecidos mais novas tecnologias de imagem, maior penetração e visualização de tecidos serão possíveis no futuro 42,43,44.
Embora a fixação prévia do tecido muscular preserve a morfologia adipócito, também cria um desafio para avaliar o tamanho dos miofibers, uma medida importante da saúde muscular. O tamanho da miofibra é determinado medindo a área transversal dos miofibers. Já noticiamos anteriormente que a fixação prévia do tecido muscular fará com que a maioria dos marcadores disponíveis para delinear myofibersfalhem 31. Para superar esse obstáculo, desenvolvemos um novo pipeline de segmentação de imagens, que permite a medição do tamanho da miofibra mesmo nas seções musculares fixas31. Assim, estabelecemos um robusto e eficiente pipeline de processamento de tecidos que, combinado com este protocolo, supera a maioria das desvantagens causadas pela fixação prévia do tecido muscular.
Outra grande vantagem dessa abordagem é a versatilidade. Ao dividir o TA em duas partes, a quantidade de informações que podem ser obtidas de um músculo é maximizada. Isso não só reduz o número de animais, mas também adiciona uma camada extra de controle, confirmando a histologia através da expressão genética e vice-versa. Além disso, muitos genes diferentes podem ser examinados além de genes adipogênicos. O RNA isolado também pode ser usado para um experimento rnaseq muscular inteiro. Finalmente, a peça muscular congelada também pode ser usada para o trabalho proteico. Uma limitação deste protocolo é a possibilidade de a lesão não ser consistente em toda a extensão do TA. Isso pode levar a um cenário em que as duas partes musculares divergem na quantidade de gordura intramuscular que contêm e podem justificar a exclusão de tal amostra de qualquer análise a jusante. Recomenda-se, portanto, não simplesmente confiar no RT-qPCR para tirar grandes conclusões sobre a quantidade de gordura intramuscular, mas sim como dados de apoio às quantificações histológicas.
Em conjunto, este protocolo descreve um robusto, eficiente e rigoroso pipeline de processamento de tecidos que permitirá a visualização e quantificação da gordura intramuscular, o primeiro passo no desenvolvimento de novas opções de tratamento para combater a fibrose gordurosa. Ao mesmo tempo, é versátil e pode ser adaptado a muitos tipos de células diferentes dentro do músculo, bem como adipócitos em outros tecidos.
Divulgações
Os autores não declaram interesses concorrentes.
Agradecimentos
Agradecemos aos membros do laboratório Kopinke por ajudarem na coleta de dados e na leitura crítica do manuscrito. Agradecemos também aos membros do Instituto de Myology da Universidade da Flórida por sua valiosa contribuição sobre o manuscrito. O trabalho foi apoiado pela subvenção do NIH 1R01AR079449. A Figura 2 foi criada com o Biorender.
Materiais
| Name | Company | Catalog Number | Comments |
| 16% PFA (Pack of 12, 10 mL bottles) | Electron Miscroscopy Sciences | 15710 | |
| 2.0 mL Microcentrifuge Tubes | Fisher Scientific | 05-408-138 | microcentrifuge tubes for snapfreezing/bead beating |
| 2-Methylbutane (4 L) | Fisher Chemical | O3551-4 | isopentane |
| Absolute Ethanol (200 proof) | ThermoFisher Scientific | BP2818100 | |
| AffiniPure Fab fragment donkey anti-mouse | Jackson ImmunoResearch | 715-007-003 | mouse-on-mouse blocking |
| Alexa Fluor 488 donkey anti-chicken secondary antibody | Jackson ImmunoResearch | 703-545-155 | |
| Alexa Fluor 488 donkey anti-mouse secondary antibody | Invitrogen | A21202 | |
| Alexa Fluor 488 donkey anti-rabbit secondary antibody | Invitrogen | A21206 | |
| Alexa Fluor 568 donkey anti-goat secondary antibody | Invitrogen | A11057 | |
| Alexa Fluor 568 donkey anti-rabbit secondary antibody | Invitrogen | A11037 | |
| Alexa Fluor 568 Phalloidin antibody | Invitrogen | A12380 | Dissolved in 1.5 mL methanol (~66 µM working solution) |
| BioLite 24-well Multidishes | ThermoFisher Scientific | 930186 | 24 well plate for PFA tissue incubation |
| Biometra TOne | analytikjena | 8462070301 | Thermal cycler |
| Chicken anti-GFP antibody | Aves Labs | GFP-1020 | |
| Chloroform/isoamyl alcohol 24:1(v/v) for molecular biology, DNAse, RNAse, and Protease free | ThermoFisher Scientific | AC327155000 | |
| Corn oil | Sigma Aldrich | C8267 | |
| DAPI stain | Invitrogen | D1306 | 150 µM working solution in dH2O |
| Donkey Serum (100 mL) | Millipore Sigma | 5058837 | for blocking solution |
| Dumont #5 Forceps | Fine Science Tools | 11251-20 | sharp-tipped tweezers |
| Fine Scissors Straight 9 cm | Fine Science Tools | 14060-09 | |
| Fluoromount-G | SouthernBiotech | 0100-01 | mounting medium |
| Glycerol, 99.5%, for molecular biology (500 mL) | Acros Organics | 327255000 | |
| Goat anti-PDGFRα antibody | R&D | AF1062 | |
| Hybridization Oven | VWR | 230301V | for Tamoxifen incubation |
| ImmEdge Hydrophobic Barrier PAP Pen | Vector Laboratories | H-4000 | hydrophobic pen |
| Insulin Syringe with Micro-Fine IV needle (28 G) | BD | 329461 | |
| Insulin Syringe with Slip Tip, 1 mL | BD | 329654 | Insulin syringe without needle, for oral gavaging |
| iScript cDNA Synthesis Kit | Bio-Rad | 1708890 | |
| Isoflurane | Patterson Veterinary | 78938441 | |
| Leica DMi8 inverted microscope | Leica | micrscope used for widefield IF and confocal imaging | |
| Micro Slides | VWR | 48311-703 | positively charged microscope slides |
| mouse anti-MYOD antibody | Invitrogen | MA1-41017 | |
| mouse anti-PAX7 antibody (supernatant) | DSHB | AB 428528 | |
| MX35 Premier+ Microtome blades | ThermoFisher Scientific | 3052835 | microtome blades |
| NanoDrop 2000 Spectrophotometer | ThermoFisher Scientific | ND2000 | spectrophotometer for RNA yield |
| Play-Doh | Hasbro | modeling compound | |
| PowerUp SYBR Green Master Mix | ThermoFisher Scientific | A25742 | green dye PCR master mix |
| Puralube Vet Ointment | Puralube | 17033-211-38 | vet ophthalmic ointment |
| QuantStudi 6 Flex Real-Time 384-well PCR System | Applied Biosystems | 4485694 | qPCR machine |
| Rabbit anti-perilipin antibody | Cell Signaling Technology | 9349S | |
| Red-Rotor Shaker | Hoefer Scientific | PR70-115V | shaker for IF staining |
| Richard-Allan Scientific Slip-Rite Cover Glass | ThermoFisher Scientific | 152460 | coverslips |
| RNeasy Mini Kit | QIAGEN | 74106 | contains mini spin columns |
| Safe-Lock Tubes 1.5 ml, natural | Eppendorf | 22363204 | |
| Sample Tubes RB (2 mL) | QIAGEN | 990381 | |
| Sodium azide | Alfa Aesar | 14314 | |
| Stainless Steel Beads, 2.8 mm | Precellys | KT03961-1-101.BK | small beads |
| Stainless Steel Beads, 5 mm | QIAGEN | 69989 | medium beads |
| Stainless Steel Beads, 7 mm | QIAGEN | 69990 | large beads |
| Stainless Steel Disposable Scalpels | Miltex | 327-4102 | scalpel |
| Stainless steel feeding tube, 20 G x 38 mm, straight | Instech Laboratories | FTSS-20S-3 | gavage needle |
| Tamoxifen | Toronto Research Chemicals | T006000 | |
| Tissue Plus O.C.T. Compound | Fisher HealthCare | 4585 | embedding medium |
| TissueLyser LT | QIAGEN | 85600 | bead beater |
| TissueLyser LT Adapter, 12-Tube | QIAGEN | 69980 | |
| Tissue-Tek Cryomold | Sakura | 4566 | specimen molds |
| Triton X-100 | Alfa Aesar | A16046 | |
| TRIzol Reagent | ThermoFisher Scientific | 15596026 | guanidium thiocyanate |
| Tween20 (500 mL) | Fisher BioReagents | BP337-500 | |
| VWR Micro Slides - Superfrost Plus | VWR | 48311703 | |
| Wheaton Coplin staining jars | Millipore Sigma | S6016 | Coplin jar |
Referências
- Milad, N., et al. Increased plasma lipid levels exacerbate muscle pathology in the mdx mouse model of Duchenne muscular dystrophy. Skeletal Muscle. 7 (1), 19(2017).
- Goodpaster, B. H., et al. Obesity, regional body fat distribution, and the metabolic syndrome in older men and women. Archives of Internal Medicine. 165 (7), 777-783 (2005).
- Goodpaster, B. H., et al. Association between regional adipose tissue distribution and both type 2 diabetes and impaired glucose tolerance in elderly men and women. Diabetes Care. 26 (2), 372-379 (2003).
- Goodpaster, B. H., et al. The loss of skeletal muscle strength, mass, and quality in older adults: the health, aging and body composition study. The Journals of Gerontology, Series A: Biological Sciences and Medical Sciences. 61 (10), 1059-1064 (2006).
- Goodpaster, B. H., Thaete, F. L., Kelley, D. E. Thigh adipose tissue distribution is associated with insulin resistance in obesity and in type 2 diabetes mellitus. American Journal of Clinical Nutrition. 71 (4), 885-892 (2000).
- Goodpaster, B. H., Theriault, R., Watkins, S. C., Kelley, D. E. Intramuscular lipid content is increased in obesity and decreased by weight loss. Metabolism. 49 (4), 467-472 (2000).
- Burakiewicz, J., et al. Quantifying fat replacement of muscle by quantitative MRI in muscular dystrophy. Journal of Neurology. 264 (10), 2053-2067 (2017).
- Murphy, W. A., Totty, W. G., Carroll, J. E. MRI of normal and pathologic skeletal muscle. American Journal of Roentgenology. 146 (3), 565-574 (1986).
- Willcocks, R. J., et al. Multicenter prospective longitudinal study of magnetic resonance biomarkers in a large duchenne muscular dystrophy cohort. Annals of Neurology. 79 (4), 535-547 (2016).
- Wokke, B. H., et al. Quantitative MRI and strength measurements in the assessment of muscle quality in Duchenne muscular dystrophy. Neuromuscular Disorders. 24 (5), 409-416 (2014).
- Contreras, O., Rossi, F. M. V., Theret, M. Origins, potency, and heterogeneity of skeletal muscle fibro-adipogenic progenitors-time for new definitions. Skeletal Muscle. 11 (1), 16(2021).
- El Agha, E., et al. Mesenchymal stem cells in fibrotic disease. Cell Stem Cell. 21 (2), 166-177 (2017).
- Joe, A. W., et al. Muscle injury activates resident fibro/adipogenic progenitors that facilitate myogenesis. Nature Cell Biology. 12 (2), 153-163 (2010).
- Liu, W., Liu, Y., Lai, X., Kuang, S. Intramuscular adipose is derived from a non-Pax3 lineage and required for efficient regeneration of skeletal muscles. Developmental Biology. 361 (1), 27-38 (2012).
- Scott, R. W., Arostegui, M., Schweitzer, R., Rossi, F. M. V., Underhill, T. M. Hic1 defines quiescent mesenchymal progenitor subpopulations with distinct functions and fates in skeletal muscle regeneration. Cell Stem Cell. 25 (6), 797-813 (2019).
- Uezumi, A., et al. Fibrosis and adipogenesis originate from a common mesenchymal progenitor in skeletal muscle. Journal of Cell Science. 124, Pt 21 3654-3664 (2011).
- Hogarth, M. W., et al. Fibroadipogenic progenitors are responsible for muscle loss in limb girdle muscular dystrophy 2B. Nature Communications. 10 (1), 2430(2019).
- Uezumi, A., Fukada, S., Yamamoto, N., Takeda, S., Tsuchida, K. Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle. Nature Cell Biology. 12 (2), 143-152 (2010).
- Stumm, J., et al. Odd skipped-related 1 (Osr1) identifies muscle-interstitial fibro-adipogenic progenitors (FAPs) activated by acute injury. Stem Cell Research. 32, 8-16 (2018).
- Kopinke, D., Roberson, E. C., Reiter, J. F. Ciliary Hedgehog signaling restricts injury-induced adipogenesis. Cell. 170 (2), 340-351 (2017).
- Huang, Y., Das, A. K., Yang, Q. Y., Zhu, M. J., Du, M. Zfp423 promotes adipogenic differentiation of bovine stromal vascular cells. PLoS One. 7 (10), 47496(2012).
- Sun, Y. -M., et al. PDGFRα regulated by miR-34a and FoxO1 promotes adipogenesis in porcine intramuscular preadipocytes through Erk signaling pathway. International Journal of Molecular Sciences. 18 (11), 2424(2017).
- Te, L. J. I., Doherty, C., Correa, J., Batt, J. Identification, isolation, and characterization of fibro-adipogenic progenitors (FAPs) and myogenic progenitors (MPs) in skeletal muscle in the rat. Journal of Visualized Experiments: JoVE. (172), e61750(2021).
- Lukjanenko, L., et al. Aging disrupts muscle stem cell function by impairing matricellular WISP1 secretion from fibro-adipogenic progenitors. Cell Stem Cell. 24 (3), 433-446 (2019).
- Santini, M. P., et al. Tissue-resident PDGFRalpha(+) progenitor cells contribute to fibrosis versus healing in a context- and spatiotemporally dependent manner. Cell Reports. 30 (2), 555-570 (2020).
- Uezumi, A., et al. Identification and characterization of PDGFRalpha+ mesenchymal progenitors in human skeletal muscle. Cell Death & Disease. 5, 1186(2014).
- Wosczyna, M. N., et al. Mesenchymal stromal cells are required for regeneration and homeostatic maintenance of skeletal muscle. Cell Reports. 27 (7), 2029-2035 (2019).
- Soliman, H., et al. Pathogenic potential of Hic1-expressing cardiac stromal progenitors. Cell Stem Cell. 26 (2), 205-220 (2020).
- Chung, M. I., Bujnis, M., Barkauskas, C. E., Kobayashi, Y., Hogan, B. L. M. Niche-mediated BMP/SMAD signaling regulates lung alveolar stem cell proliferation and differentiation. Development. 145 (9), Cambridge, England. (2018).
- Hilgendorf, K. I., et al. Omega-3 fatty acids activate ciliary FFAR4 to control adipogenesis. Cell. 179 (6), 1289-1305 (2019).
- Waisman, A., Norris, A. M., Elías Costa, M., Kopinke, D. Automatic and unbiased segmentation and quantification of myofibers in skeletal muscle. Scientific Reports. 11 (1), 11793(2021).
- Kang, S. H., Fukaya, M., Yang, J. K., Rothstein, J. D., Bergles, D. E. NG2+ CNS glial progenitors remain committed to the oligodendrocyte lineage in postnatal life and following neurodegeneration. Neuron. 68 (4), 668-681 (2010).
- Srinivas, S., et al. Cre reporter strains produced by targeted insertion of EYFP and ECFP into the ROSA26 locus. BMC Developmental Biology. 1, 4(2001).
- Lukjanenko, L., Brachat, S., Pierrel, E., Lach-Trifilieff, E., Feige, J. N. Genomic profiling reveals that transient adipogenic activation is a hallmark of mouse models of skeletal muscle regeneration. PLoS One. 8 (8), 71084(2013).
- Mahdy, M. A., Lei, H. Y., Wakamatsu, J., Hosaka, Y. Z., Nishimura, T. Comparative study of muscle regeneration following cardiotoxin and glycerol injury. Annals of Anatomy = Anatomischer Anzeiger: Official Organ of the Anatomische Gesellscaft. 202, 18-27 (2015).
- Pisani, D. F., Bottema, C. D., Butori, C., Dani, C., Dechesne, C. A. Mouse model of skeletal muscle adiposity: a glycerol treatment approach. Biochemical and Biophysical Research Communications. 396 (3), 767-773 (2010).
- Kawai, H., et al. Experimental glycerol myopathy: a histological study. Acta Neuropathologica. 80 (2), 192-197 (1990).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative CT method. Nature Protocols. 3 (6), 1101-1108 (2008).
- Uezumi, A., et al. Mesenchymal Bmp3b expression maintains skeletal muscle integrity and decreases in age-related sarcopenia. The Journal of Clinical Investigation. 131 (1), 139617(2021).
- Biferali, B., et al. Prdm16-mediated H3K9 methylation controls fibro-adipogenic progenitors identity during skeletal muscle repair. Science Advances. 7 (23), 9371(2021).
- Biltz, N. K., Meyer, G. A. A novel method for the quantification of fatty infiltration in skeletal muscle. Skeletal Muscle. 7 (1), (2017).
- Vieites-Prado, A., Renier, N. Tissue clearing and 3D imaging in developmental biology. Development. 148 (18), Cambridge, England. (2021).
- Gómez-Gaviro, M. V., Sanderson, D., Ripoll, J., Desco, M. Biomedical applications of tissue clearing and three-dimensional imaging in health and disease. iScience. 23 (8), 101432(2020).
- Ueda, H. R., et al. Tissue clearing and its applications in neuroscience. Nature Reviews Neuroscience. 21 (2), 61-79 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados