Method Article
Guide d’examen de la formation de graisse intramusculaire et de son origine cellulaire dans le muscle squelettique
Dans cet article
Résumé
Le remplacement du tissu musculaire sain par de la graisse intramusculaire est une caractéristique importante des maladies et affections humaines. Ce protocole décrit comment visualiser, imager et quantifier la graisse intramusculaire, permettant l’étude rigoureuse des mécanismes sous-jacents à la formation de graisse intramusculaire.
Résumé
Les progéniteurs fibro-adipogènes (PAF) sont des cellules stromales mésenchymateuses qui jouent un rôle crucial lors de l’homéostasie et de la régénération des muscles squelettiques. Les PAF construisent et maintiennent la matrice extracellulaire qui agit comme un échafaudage de myofibre moléculaire. De plus, les PAF sont indispensables à la régénération des myofibres car ils sécrètent une multitude de facteurs bénéfiques détectés par les cellules souches musculaires (MuSC). Dans les états malades, cependant, les FAP sont l’origine cellulaire de la graisse intramusculaire et du tissu cicatriciel fibrotique. Cette fibrose graisseuse est une caractéristique de la sarcopénie et des maladies neuromusculaires, telles que la dystrophie musculaire de Duchenne. Une barrière importante pour déterminer pourquoi et comment les PAF se différencient en graisse intramusculaire est la préservation efficace et la visualisation ultérieure des adipocytes, en particulier dans les sections de tissus congelés. Les méthodes conventionnelles de traitement des tissus musculaires squelettiques, telles que la congélation instantanée, ne préservent pas correctement la morphologie des adipocytes individuels, empêchant ainsi une visualisation et une quantification précises. Pour surmonter cet obstacle, un protocole rigoureux a été développé qui préserve la morphologie des adipocytes dans les sections musculaires squelettiques permettant la visualisation, l’imagerie et la quantification de la graisse intramusculaire. Le protocole décrit également comment traiter une partie du tissu musculaire pour la RT-qPCR, permettant aux utilisateurs de confirmer les changements observés dans la formation de graisse en observant les différences dans l’expression des gènes adipogènes. De plus, il peut être adapté pour visualiser les adipocytes par immunofluorescence de montage entier d’échantillons musculaires. Enfin, ce protocole décrit comment effectuer un traçage génétique de la lignée des FAP exprimant Pdgfrα pour étudier la conversion adipogénique des FAP. Ce protocole produit systématiquement des images immunofluorescentes à haute résolution et morphologiquement précises des adipocytes, ainsi qu’une confirmation par RT-qPCR, permettant une visualisation et une quantification robustes, rigoureuses et reproductibles de la graisse intramusculaire. Ensemble, le pipeline d’analyse décrit ici est la première étape pour améliorer notre compréhension de la façon dont les PAF se différencient en graisse intramusculaire et fournit un cadre pour valider de nouvelles interventions visant à prévenir la formation de graisse.
Introduction
L’infiltration de tissus musculaires sains avec fibrose graisseuse est une caractéristique importante de la dystrophie musculaire de Duchenne (DMD) et d’autres maladies neuromusculaires, ainsi que de la sarcopénie, de l’obésité et du diabète 1,2,3,4,5,6,7,8,9,10 . Bien que l’augmentation de l’infiltration de graisse dans ces conditions soit fortement associée à une diminution de la fonction musculaire, notre connaissance du pourquoi et de la façon dont la graisse intramusculaire se forme est encore limitée. Les FAP sont une population de cellules stromales mésenchymateuses multipotentes présentes dans la plupart des organes adultes, y compris le muscle squelettique11,12. Avec l’âge et dans les maladies chroniques, cependant, les FAP produisent du tissu cicatriciel fibrotique et se différencient en adipocytes, qui sont situés entre les myofibres individuels et forment de la graisse intramusculaire 13,14,15,16,17,18,19,20.
Pour commencer à lutter contre la formation de graisse intramusculaire, les mécanismes de transformation des PAF en adipocytes doivent être définis. PDGFRα est le marqueur « de référence » dans le domaine pour identifier les FAP dans le muscle de plusieurs espèces 13,16,17,18,20,21,22,23,24,25,26,27. En conséquence, plusieurs lignées Cre murines inductibles au tamoxifène, sous le contrôle du promoteur Pdgfrα, ont été générées, permettant de manipuler génétiquement les PAF in vivo à l’aide du système Cre-LoxP 27,28,29. Par exemple, en combinant cette lignée Cre inductible avec un rapporteur génétique, le traçage de la lignée des PAF peut être effectué, une stratégie que nous avons appliquée avec succès à la carte du destin des PAP dans le tissu adipeux musculaire et blanc20,30. Outre le traçage de la lignée, ces lignes Cre fournissent des outils précieux pour étudier la conversion FAP en graisse.
Un obstacle majeur dans la définition du mécanisme de conversion adipogénique des FAP en graisse intramusculaire est la capacité de quantifier rigoureusement et de manière reproductible la quantité de graisse intramusculaire qui s’est formée dans différentes conditions. La clé est d’équilibrer la préservation des tissus musculaires et adipeux et de l’associer aux méthodes de coloration disponibles pour visualiser les adipocytes. Par exemple, le muscle squelettique est souvent congelé sans fixation préalable, préservant les myofibres mais perturbant la morphologie des adipocytes (Figure 1). En revanche, la fixation suivie de l’incorporation de paraffine, tout en affichant la meilleure histologie tissulaire, y compris les adipocytes, élimine tous les lipides, rendant ainsi la plupart des colorants lipophiles, tels que le colorant couramment utilisé Oil Red O, inutilisables.
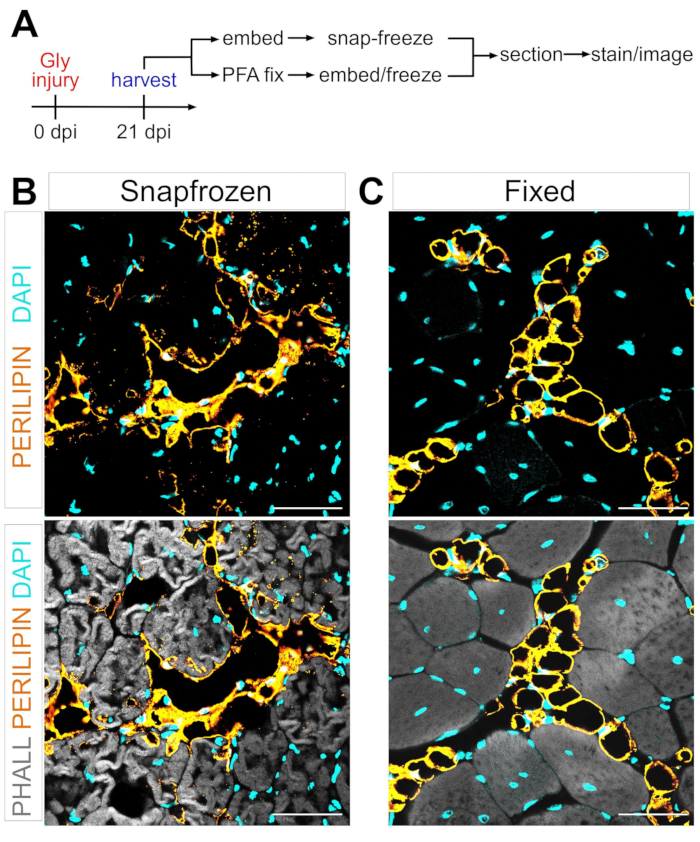
Figure 1 : Images représentatives de la graisse intramusculaire dans les tissus musculaires congelés par rapport aux tissus musculaires fixes. (A) Aperçu schématique de la configuration expérimentale. Images immunofluorescentes montrant des adipocytes (jaunes), des myofibres (gris) et des noyaux (cyan) dans les AT (B) congelés et (C) fixes 21 jours après une lésion au glycérol. Barres d’échelle : 50 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Le protocole décrit ici préserve la morphologie des myofibres et des adipocytaires et permet la visualisation et l’analyse de plusieurs types de cellules. Cette approche est basée sur la coloration par immunofluorescence des adipocytes dans le tissu musculaire fixé au paraformaldéhyde (PFA), ce qui permet une co-coloration avec plusieurs anticorps. Il peut également être facilement adapté pour afficher spatialement la graisse intramusculaire dans les tissus intacts en utilisant l’imagerie à montage entier, fournissant ainsi des informations sur le microenvironnement cellulaire de la graisse dans le muscle. De plus, ce protocole peut être combiné avec notre approche récemment publiée pour déterminer la section transversale des myofibres dans les tissus musculaires fixes31, une mesure importante pour évaluer la santé musculaire. La combinaison de cette approche avec le traçage de la lignée génétique pour cartographier le destin de la différenciation des FAP en adipocytes est également décrite ici. Ainsi, le protocole polyvalent décrit ici permet une évaluation rigoureuse et reproductible des PAF et de leur différenciation en graisse intramusculaire dans les coupes de tissus et les tissus intacts.
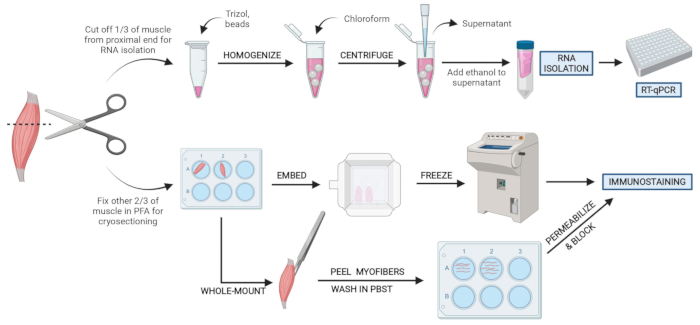
Figure 2 : Vue d’ensemble du protocole schématique. Vue d’ensemble schématique du traitement tissulaire dans lequel un tiers de l’AT est retiré, congelé et homogénéisé pour l’isolement ultérieur de l’ARN et l’analyse de transcription via RT-qPCR. Les deux autres tiers de l’AT sont fixés par PFA et traités pour l’immunocoloration sur des sections congelées ou des fibres à montage entier. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocole
Tous les protocoles pour animaux ont été approuvés par l’Institutional Animal Care and Use Committee (IACUC) de l’Université de Floride.
1. Traçage génétique de la lignée des PAF
REMARQUE: Si le traçage de la lignée génétique des PAF n’est pas souhaité, l’étape 1 peut être ignorée.
- Pour effectuer le traçage de la lignée des PAF, procurez-vous les allèles de souris nécessaires.
REMARQUE: Plusieurs lignées cre inductibles au tamoxifène, sous le contrôle du promoteur Pdgfrα, ont été générées pour cibler avec succès les PAF, notamment à partir des laboratoires Hogan29, Rando27 et Bergles32. En tant que rapporteur génétique de l’activité cre, de nombreux allèles rapporteurs Rosa26 sont disponibles tels que Rosa26EYFP33. Bien qu’il soit suggéré à chaque laboratoire de déterminer quelle combinaison Cre-Reporter est la plus efficace, en croisant des souris PdgfrαCreERT2 (29 et Jax # 032770) avec le rapporteur Rosa26EYFP (33 et Jax # 006148), le PdgfrαCreERT2 résultant; Les souris EyFPRosa26peuvent être utilisées pour marquer efficacement et spécifiquement lesPAF 20. Pour retracer le sort des PAP matures, il est recommandé d’attendre que les souris aient atteint au moins ~ 10 semaines avant d’administrer du tamoxifène. Des expériences de traçage de lignée peuvent être effectuées sur des mâles et des femelles. - Administration de tamoxifène par gavaging oral
- Préparer 40 mg/mL de tamoxifène dans de l’huile de maïs et du vortex bien pour mélanger 1 jour avant le gavaging. Incuber O/N à 37 °C dans un four d’hybridation rotatif.
ATTENTION : Le tamoxifène est cancérigène et doit être manipulé avec précaution. Portez toujours des gants lors de la manipulation et portez un masque lorsque vous le pesez sous forme de poudre, car il existe un risque d’inhalation. - Nettoyez la zone conformément au protocole et fixez une aiguille à gicler à une seringue de 1 mL. Aspirer 200 μL de tamoxifène dans la seringue.
- Scruff PdgfrαCreERT2 ; Rosa26souris EYFP (âgées de 10 semaines; les deux sexes utilisés) en les plaçant sur une surface plane et en saisissant fermement la base de la queue. Utilisez une main libre pour saisir le milieu de la souris avec le pouce et l’index, puis faites glisser doucement et avec une légère pression la poignée jusqu’à juste après les épaules.
- Pincez la peau en arrière avec le pouce et l’index, ramassez la souris et retournez la main pour que la souris soit face à l’utilisateur, et placez la queue entre le petit doigt et l’annulaire de la main qui tient la souris.
- À ce stade, assurez-vous que la souris est bien immobilisée et incapable de bouger la tête ou les bras. Insérez l’aiguille de gavaging dans la bouche et utilisez-la pour incliner légèrement la tête de la souris vers l’arrière; cela permet à l’œsophage d’être mieux accessible.
- Insérez soigneusement et lentement l’aiguille dans l’œsophage. Ne forcez pas l’aiguille si une résistance est rencontrée; l’aiguille devrait glisser facilement vers le bas. Injecter lentement le tamoxifène. Surveillez les souris pendant 15 à 20 minutes pour vous assurer qu’aucun problème ne se produit pendant la gavage.
REMARQUE: L’administration de tamoxifène pendant 2 jours consécutifs entraîne généralement une efficacité de recombinaison d’environ 75% à 85% des PAF sans causer d’effets indésirables. Il est recommandé à l’utilisateur d’attendre 1 à 2 semaines avant d’induire une blessure, ce qui permettra d’éliminer le tamoxifène restant du système et de retourner toute protéine restante.
- Préparer 40 mg/mL de tamoxifène dans de l’huile de maïs et du vortex bien pour mélanger 1 jour avant le gavaging. Incuber O/N à 37 °C dans un four d’hybridation rotatif.
2. Lésion du muscle tibialis antérieur (TA)
REMARQUE: Pour étudier la graisse intramusculaire, il est recommandé d’utiliser un modèle de blessure à base de glycérol (50% de glycérol dans une solution saline stérile), ce qui entraîne une formation massive de graisse intramusculaire 34,35,36,37.
- Préparez l’appareil d’anesthésie en ajoutant de l’isoflurane et en vous assurant que les tubes de la chambre de la souris et du cône du nez sont ouverts. Nettoyez la chambre et la zone de travail avec une solution d’éthanol ou de peroxyde à 70% (selon les protocoles).
- Réglez le débit d’oxygène à 2,5 L/min et la concentration d’isoflurane à 2,5 %. Placez une souris dans la chambre d’anesthésie et attendez environ 5 minutes pour qu’elle soit anesthésiée.
- Placez la souris en décubitus dorsal sur un coussin chauffant propre et insérez le nez dans le cône du nez. Appliquez doucement une pommade ophtalmique vétérinaire sur les yeux avec un applicateur à pointe de coton pour prévenir la sécheresse sous anesthésie. Surveillez en permanence l’anesthésie et effectuez un pincement des orteils sur la souris avant la blessure pour vous assurer que la souris est complètement anesthésiée.
- Nettoyez la jambe à injecter avec une lingette d’alcool frais pour désinfecter.
- Prélever 30 à 50 μL de glycérol à 50 % (selon la taille des souris) dans la seringue à insuline. Brossez doucement les cheveux sur le tibia pour exposer l’emplacement de l’AT.
REMARQUE: Il est plus facile de déplacer les cheveux et d’obtenir une meilleure visualisation lorsqu’ils sont encore mouillés par la lingette alcoolisée. - Après avoir localisé l’AT (juste latéralement au tibia, il dépasse légèrement à travers la peau et peut être ressenti avec une légère palpation), insérez l’aiguille dans l’AT distalement, près de la cheville. Insérez complètement l’aiguille dans le muscle et injectez lentement du glycérol tout en retirant progressivement l’aiguille, ce qui aide à blesser la majeure partie du muscle.
REMARQUE: Il est préférable d’insérer l’aiguille parallèlement à la jambe, avec juste un angle légèrement surélevé. Une bonne blessure provoque généralement une dorsiflexion lorsque l’AT se contracte après le retrait de l’aiguille. Si les orteils de la souris se sont écartés, il est probable que le muscle extenseur digitorum longus (EDL) ait été injecté. - Replacez la souris dans la cage et surveillez pendant environ 15 à 20 minutes pour assurer la récupération de l’anesthésie.
- Jeter l’aiguille dans un récipient pour objets tranchants. Ne récapitulez jamais une aiguille.
REMARQUE: L’analgésie après l’injection de glycérol doit être fournie comme approuvé par le Comité de soins et d’utilisation des animaux en établissement. Les adipocytes peuvent être observés dès 5 jours après la blessure (dpi). À 7 dpi, tous les adipocytes se sont formés et à 21 dpi, ils ont complètement mûri.
3. Prélèvement de tissus
- Préparer 4 % de PFA dans 1x PBS et placer sur la glace avant de commencer la récolte.
- Placez toutes les plaques (12 ou 24 puits) utilisées pour la fixation musculaire sur la glace et ajoutez 4% de PFA à chaque puits, en vous assurant que chaque puits a 10 à 20 fois plus de volume de PFA que le tissu fixé.
- Entre 7 et 21 jours après une lésion au glycérol, euthanasier la souris selon les directives institutionnelles (c.-à-d. surdosage d’isoflurane suivi d’une luxation cervicale).
- Commencez à prélever tous les tissus à utiliser pour l’histologie ou l’isolement de l’ARN.
REMARQUE : Les tissus doivent être congelés ou placés dans du PFA dans les 10 à 15 minutes suivant le sacrifice (Figure 2). - Vaporisez généreusement toutes les zones de la souris à couper avec de l’éthanol à 70% pour aider à empêcher les cheveux de disséquer la zone et les instruments.
- Utilisez des ciseaux pour couper la peau autour du haut de la jambe, près du bassin (Figure 3A).
- Tirez doucement la peau de la jambe du haut vers le bas jusqu’à la cheville (Figure 3B).
REMARQUE: Le TA est un muscle en forme de larme avec un tendon distal clairement défini se fixant au cunéiforme médian et au premier os métatarsien. Il est latéral au tibia et s’étend jusqu’au bas du genou. - Tout d’abord, retirez la couche externe de tissu conjonctif (épimysium) à l’aide d’une pince à pointe pointue avant de prélever l’AT (figure 3C). Utilisez un microscope à dissection pour mieux visualiser l’épimysium.
- Faites glisser la pince à épiler sous le TA à partir du bas du muscle, en commençant par le tendon distal, et tirez doucement vers le haut vers le genou (Figure 3D). Arrêtez-vous à la fin du muscle; ne poussez pas au-delà de la résistance ressentie au niveau du genou inférieur.
- S’il y a une résistance importante avant d’atteindre le bas du genou, arrêtez et continuez à enlever les couches restantes de tissu conjonctif.
REMARQUE: Il y a un autre tendon distal juste latéral au tendon TA qui se fixe à l’EDL, qui est un muscle mince latéral à l’TA. En prenant soin de ne glisser que la pince à épiler sous le tendon TA, on évite la récolte accidentelle de l’EDL, mais elle peut également être facilement retirée après fixation. - Une fois que l’AT a été partiellement soulevée de la jambe avec la pince à épiler, utilisez le même mouvement avec un scalpel pour couper la connexion de l’AT au genou inférieur (Figure 3E). Coupez le tendon à la cheville avec des ciseaux pour retirer complètement le TA. Ne manipulez le muscle qu’au niveau du tendon pour éviter d’endommager les fibres.
- Coupez 1/3 de l’AT à l’extrémité opposée au tendon (Figure 3F), mettez-le dans un tube de microcentrifugation et congelez-le en le déposant dans de l’azote liquide (Figure 3H).
- Immerger les 2/3 restants du tissu dans un puits marqué avec 4 % de PFA pour l’histologie (Figure 3I). Assurez-vous de garder une trace du moment où le premier et le dernier tissu ont été placés en fixateur. Placer sur un agitateur pendant 2-2,5 h à 4 °C.
- La durée de la fixation dépend du tissu et de sa taille. Déterminez la durée nécessaire à la fixation des tissus. La fixation des AT pendant 2-2,5 h à 4 °C préserve généralement bien la morphologie des adipocytes sans provoquer de surfixation du tissu.
REMARQUE: Si vous prévoyez d’utiliser TA pour la coloration immunofluorescente à montage entier, sautez le reste de ce protocole jusqu’à ce que vous atteigniez la section 7: « Coloration immunofluorescente à montage entier ». - Après la fixation, retirez le PFA des puits, rincez les tissus avec 1x PBS froid 2-3 fois, puis lavez 2-3 fois avec 1x PBS froid pendant 5 min par lavage.
- Retirez le PBS des puits et ajoutez suffisamment de saccharose à 30% dans 1x PBS pour permettre au tissu de flotter. Placer sur le shaker à 4 °C pendant la nuit.
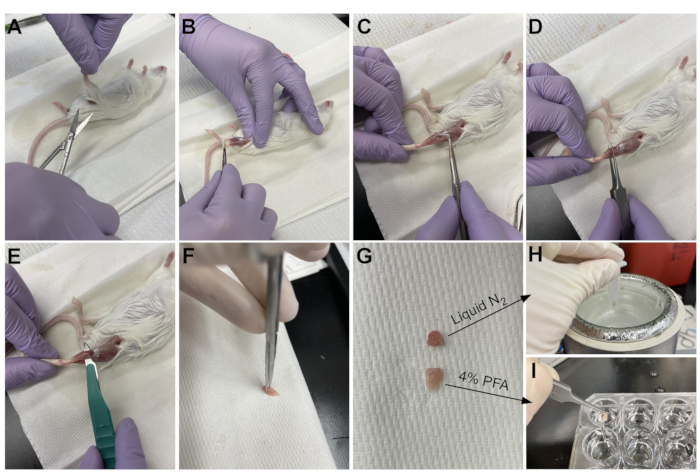
Figure 3: Résumé de la récolte de tissus. (A) La peau est coupée à la base de la jambe et (B) les muscles des membres postérieurs sont exposés. (C) Une fois que l’épimysium est retiré de l’AT, des pinces (D) sont utilisées pour séparer partiellement le muscle et s’assurer que l’épimysium a été complètement retiré. (E) L’AT est coupé de la jambe avec un scalpel et retiré après avoir coupé le tendon. (G) Après avoir coupé l’AT en un tiers et deux tiers, (H) un tiers est congelé dans de l’azote liquide pour l’analyse RT-qPCR et (I) l’autre tiers est fixé dans 4% de PFA pour l’histologie. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Intégration
- Préparez les moules d’échantillon à utiliser pour l’encastrement en les étiquetant et en les remplissant avec suffisamment de milieu d’incorporation pour immerger complètement les tissus.
- Retirez les tissus des puits, séchez l’excès de saccharose sur une serviette en papier et passez aux moules d’échantillons remplis de milieu de congélation.
REMARQUE: Il est utile de savoir dans quelle direction le moule doit être sectionné sur le cryostat. De cette façon, l’utilisateur peut orienter les tissus dans le moule de manière à permettre à la zone d’intérêt d’être facilement accessible. Pour l’AT, cela serait réalisé en plaçant l’extrémité la plus épaisse (opposée au côté du tendon) face à la surface qui sera sectionnée. Cela permet au TA d’être facilement sectionné à sa partie la plus épaisse (ventre) et permet une coupe transversale des fibres musculaires. - Préparer une boue d’isopentane en immergeant partiellement un récipient contenant de l’isopentane dans de l’azote liquide. Assurez-vous qu’il y a suffisamment d’isopentane liquide dans le récipient pour immerger environ la moitié du moule de l’échantillon à utiliser pour intégrer les tissus.
- Commencez à congeler les moules en les mettant soigneusement dans la boue d’isopentane et en vous assurant qu’environ la moitié de la moisissure est submergée. Assurez-vous également que le moule gèle également des quatre côtés.
- Retirez la moisissure de l’isopentane juste avant que la moisissure entière ne soit visiblement gelée par le haut. Le temps que cela prend dépend des moules utilisés.
- Conservez les moules congelés dans un récipient avec de la glace carbonique tout en congelant le reste des blocs, puis conservez-les à -80 °C.
REMARQUE: Isopentane pour la congélation peut être réutilisé. Mettez dans une bouteille en verre mais ne serrez pas le couvercle jusqu’à ce que l’isopentane atteigne la température ambiante (RT). Sinon, le changement de pression pourrait briser la bouteille.
5. Sectionnement
- Réglez le cryostat sur -22 à -24 °C, ajoutez des moules contenant des AT dans le cryostat et attendez au moins 30 minutes pour l’acclimatation à la température. En attendant, étiquetez une série de lames de microscope chargées positivement.
- Insérez une plaque anti-roulis et alignez-la sur le cryostat de manière à ce qu’il y ait un minimum d’entailles dans la plaque où elle entre en contact avec le bloc d’échantillon. Sécurisez sur place.
- Insérez une lame de cryostat fraîche dans le porte-lame et fixez-la en place.
ATTENTION : La lame est tranchante. Couvrez la lame lorsque vous manipulez d’autres parties du cryostat ou des moules congelés. - Retirez le bloc congelé du moule. Ajoutez une couche uniforme de milieu d’incorporation au mandrin du cryostat et positionnez le bloc dans le milieu. Laissez reposer pendant 1 à 3 minutes jusqu’à ce que le support d’enrobage soit complètement congelé (blanc opaque).
REMARQUE: Pour les AT, la zone la plus épaisse (ventre) doit être visible sur le mandrin. - Placez le mandrin de cryostat avec le bloc de tissu dans le cryostat. Découvrez la lame et avancez le cryostat jusqu’à ce qu’il entre en contact avec la lame. Section à travers le bloc à des sections de 25 μm jusqu’à ce que le tissu ne soit plus obscurci par le milieu d’incorporation.
REMARQUE: Lors du sectionnement, ajustez l’angle du cryostat et / ou la position de la scène de manière à ce que les sections soient d’épaisseur uniforme. Il peut être utile de rassembler quelques sections pour assurer l’uniformité de l’épaisseur de la section. Il est recommandé que l’utilisateur trouve la position appropriée de la plaque anti-roulis avant de sectionner la région d’intérêt dans le TA (ventre), car cela permet à l’utilisateur d’essayer plusieurs positions de la plaque anti-roulis jusqu’à ce que les sections se détachent directement sans gaspiller de tissu. - Modifiez l’épaisseur de la section à 10-12 μm et collectez les sections sur des lames de microscope étiquetées. La section en série est recommandée en collectant les sections adjacentes sur 6 à 10 diapositives (étiquetées 1-x), ce qui permet de tacher plusieurs marqueurs. Si nécessaire, utilisez un pinceau fin pour dérouler les sections avant de les collecter sur la diapositive.
REMARQUE: Si les sections sont enroulées, vérifiez que la température se maintient dans la plage de -22 à -24 ° C. S’il y a des stries verticales dans les sections, cela pourrait être dû à une entaille dans la plaque anti-roulis ou la lame; cela peut être corrigé en ajustant la position de la plaque anti-roulis et / ou en passant à une nouvelle lame. - Après avoir collecté les sections adjacentes du même plan de sectionnement sur chaque diapositive, ajustez l’épaisseur à 25 μm pour avancer de 150 à 200 μm à travers le bloc, puis ajustez l’épaisseur à 10-12 μm et recommencez la section.
REMARQUE: Cette section série permet à l’utilisateur de visualiser, d’imager et de quantifier à différentes profondeurs via le TA; trois à quatre sections série par diapositive suffisent. - Conservez les lames et les blocs de tissus à -80 °C.
6. Coloration immunofluorescente (FI) des coupes tissulaires
REMARQUE: Comme les concentrations d’anticorps peuvent varier entre les lots et les fabricants, l’optimisation est recommandée en évaluant plusieurs concentrations différentes des anticorps sur les lames d’essai avant de colorer les lames d’intérêt.
- Décongélation/lames sèches soit à RT, soit sur une plaque chaude à 37 °C pendant 10-20 min.
- Utilisez un stylo hydrophobe pour tracer une ligne au bord de la surface de papier de la diapositive, où elle rencontre le verre.
- Mettez les lames dans un pot Coplin et lavez avec 1x PBS + 0,1% Tween20 (PBST) 3-5x sur un shaker pendant au moins 5 min par lavage pour réhydrater les sections de tissu.
REMARQUE: À ce stade, il est important de ne pas laisser les lames reposer sans être immergées dans le PBST (jusqu’à la ligne hydrophobe), sinon les sections de tissus se dessècheront. - Placez les lames sur le support d’une chambre d’humidification et superposez les lames avec 310-350 μL de solution bloquante (sérum d’âne à 5% et Triton X-100 à 0,3% dans 1x PBS) pendant 1-2 h à TA.
REMARQUE: Aucune étape de perméabilisation supplémentaire n’est nécessaire, car la solution bloquante contient 0,3% de Triton X-100 permettant une perméabilisation suffisante des sections tissulaires. Lors de l’utilisation d’anticorps primaires dérivés de souris (c’est-à-dire PAX7 et MYOD1 énumérés ci-dessous), il est recommandé d’inclure une étape de blocage souris sur souris à l’aide de fragments Fab (1:50) dans la solution de blocage pour l’étape de blocage. Cela aidera à réduire le fond dû à la liaison non spécifique de l’anticorps secondaire de la souris à des anticorps autres que le primaire. - Diluer les anticorps primaires à utiliser dans la solution bloquante peu de temps avant de passer à l’étape suivante comme suit:
- Anticorps primaires pour la coloration des adipocytes et l’imagerie de section entière: Diluer l’anti-périlamine de lapin à un taux de dilution de 1:1000.
- Anticorps primaires pour le traçage de la lignée des adipocytes: Diluer l’anti-GFP du poulet dans un rapport de 1:1000 et l’anti-périlipine du lapin à 1:1000.
- Anticorps primaires pour le traçage de la lignée des PAF : Anti-GFP dilué du poulet dans un rapport de 1:1000 et anti-PDGFRα de chèvre à 1:250.
- Anticorps primaires pour marqueurs myogéniques : Diluer l’anti-PAX7 de la souris dans un rapport de 1:25 ou l’anti-MYOD1 de la souris à 1:250, et l’anti-LAMININ du lapin à 1:1000.
REMARQUE: Bien que les anticorps énumérés ci-dessus aient été évalués avec succès avec ce protocole, il est probable que d’autres marqueurs et anticorps pour marquer les FAP, les adipocytes et / ou d’autres types de cellules sont également compatibles avec ce protocole. Il est fortement recommandé lors de l’utilisation d’anticorps primaires pour la première fois que l’utilisateur inclue une lame de contrôle négative, dans laquelle les anticorps primaires sont omis. Cela permettra de contrôler la spécificité des anticorps. Toutes les autres étapes du protocole sont suivies, y compris l’ajout d’anticorps secondaires, mais la solution bloquante est utilisée seule à l’étape suivante au lieu de l’anticorps primaire dans la solution bloquante.
- Déposer la solution bloquante des lames et la superposer avec 310-350 μL de solution bloquante avec des anticorps primaires et incuber pendant la nuit à 4 °C dans la chambre d’humidification.
- Le lendemain, jetez la solution bloquante / les anticorps primaires des lames et placez-les dans un pot Coplin. Rincez les lames 2-3 fois avec PBST et lavez 3-5x avec PBST sur un shaker pendant au moins 5 min par lavage.
- Lors du dernier lavage, préparer les anticorps secondaires ou tout conjugué direct à utiliser dans la solution bloquante. Minimisez le temps que ces anticorps passent dans la lumière pour éviter le photoblanchiment.
- Anticorps secondaires dilués/conjugués directs : 488 nm âne anti-poulet (1:1000) ou anti-lapin (1:1000) ou anti-souris (1:1000), 568 nm âne anti-chèvre (1:1000) ou anti-lapin (1:1000) ou phalloïdine (myofibres; 1:100), coloration DAPI (noyaux; 1:500).
- Superposer les lames avec 310-350 μL de la solution bloquante avec des anticorps secondaires et/ou des conjugués directs dans la chambre d’humidification. Incuber à RT pendant 1-2 h. Protégez les échantillons de la lumière à partir de maintenant.
- Jetez la solution bloquante / les anticorps secondaires et placez-les dans un pot Coplin. Rincez avec PBST une fois et lavez 3-5x avec PBST sur un shaker pendant au moins 5 min par lavage. Gardez le pot Coplin couvert pour éviter toute exposition à la lumière.
- Séchez les lames aussi bien que possible en tapotant les bords et en essuyant le dos contre une serviette en papier, mais ne laissez pas les sections de tissu sécher.
- Ajouter trois ou quatre gouttes de support de montage aqueux sur le bord horizontal supérieur de la glissière et ajouter doucement un couvercle. N’appuyez pas vers le bas et ne bougez pas si des bulles d’air se forment sous le couvercle; toute pression ou tout mouvement peut déformer l’architecture cellulaire fragile des adipocytes.
- Laissez le support de montage se mettre dans l’obscurité pendant la nuit avant l’imagerie.
7. Coloration immunofluorescente de montage entier
- Après environ 1 h de fixation (voir étape 3.14), utilisez une pince à épiler à pointe pointue pour décoller les myofibres de l’AT fixe.
- Placez les fibres séparées dans une plaque de 24 puits et lavez 3x pendant 3 minutes chacune avec PBST. Pour toutes les incubations ultérieures, assurez-vous d’ajouter le couvercle pour éviter l’évaporation.
- Incuber pendant 1 h dans 1% de Triton X-100 dans 1x PBS à RT (200-300 μL) sur un agitateur pour permettre une meilleure pénétration des anticorps.
- Après rinçage plusieurs fois avec du PBST, superposer avec une solution bloquante (200-300 μL) et bloquer sur un nutateur ou un agitateur pendant la nuit à 4 °C.
- Diluer les anticorps primaires à la concentration souhaitée (doubler la concentration tend à être un bon point de départ) dans la solution bloquante. Incuber les échantillons (200-300 μL) sur un nutateur ou un agitateur pendant la nuit à 4 °C.
- Lavez rigoureusement les échantillons avec PBST tout au long de la journée avec des changements fréquents à RT sur le shaker, environ 4-6x pendant 30-60 min chaque lavage.
- Diluer les anticorps secondaires dans la solution bloquante à la concentration souhaitée (1:500 a tendance à bien fonctionner) plus la coloration nucléaire et incuber les échantillons (200-300 μL) sur un nutateur ou un agitateur pendant la nuit à 4 °C.
- Lavez rigoureusement les échantillons avec pbST tout au long de la journée avec des changements fréquents à TA sur le shaker, environ 4 à 6 fois pendant 30 à 60 minutes chaque lavage ou lavage pendant la nuit à 4 ° C.
- Pour monter, séchez doucement l’excès de PBST, puis placez les fibres dans une ou deux gouttes de support de montage sur une lame de verre (Figure 4A). Pour soulever le couvercle (18 mm x 18 mm), ajoutez de petits pieds en argile; cela empêchera les fibres d’être écrasées et fixera le couvercle à la glissière. Les composés de modélisation fonctionnent bien pour cela. Une fois le couvercle fixé, ajoutez plus de médium au bord jusqu’à ce que la zone sous le couvercle soit pleine.
REMARQUE: Au lieu d’utiliser un milieu de montage contenant des agents anti-décoloration, le tissu peut également être déplacé à travers une série ascendante de glycérol (30% à 80% de glycérol dans pbS). - Attendez 1-2 jours avant l’imagerie pour permettre le durcissement du support de montage.
8. Imagerie de la graisse intramusculaire
- Allumez le microscope et lancez le logiciel d’imagerie. Fixez la diapositive sur la scène.
REMARQUE: Pour l’imagerie des adipocytes dans les sections musculaires, un objectif 5x ou 10x combiné à la microscopie à grand champ est souvent suffisant. Pour visualiser WM-IF, un microscope confocal est nécessaire. - Utilisez n’importe quel canal pour identifier la zone à imager.
- Dans le logiciel d’imagerie, ajustez le gain et le temps d’exposition pour chaque canal.
- Prenez des images de l’ensemble du tissu dans chaque canal (automatique ou manuel selon le microscope et le logiciel utilisé) et fusionnez des carreaux individuels pour former un composite de la section transversale TA complète.
REMARQUE: Il est recommandé de prendre des images de deux ou trois sections différentes de la même AT à différentes profondeurs. En quantifiant les adipocytes dans chaque section, puis en rapportant la moyenne, les différences localisées dans la quantité de graisse intramusculaire dues, par exemple, à des erreurs d’injection seront évitées.
9. Quantifier les adipocytes
- S’il n’est pas installé précédemment, ajoutez le plug-in Compteur de cellules à ImageJ (https://imagej.nih.gov/ij/plugins/cell-counter.html).
- Importez les images dans ImageJ sous forme de fichiers TIF ou de fichiers de microscope d’origine. Affichez chaque canal dans ImageJ sous la forme d’un fichier TIF distinct.
REMARQUE: Si vous utilisez LIF ou des types de fichiers de microscope similaires, sous Options d’importation de bioformats , choisissez Hyperstack pour Afficher la pile avec et cochez la case Diviser les canaux. Cliquez sur OK pour ouvrir le fichier. Assurez-vous également que la case Mise à l’échelle automatique est décochée. - Assurez-vous que les images de chaque canal sont au format 8 bits (et gris) : Image > Type > 8 bits.
- Fusionner les images DAPI (bleu), GFP (vert), PERILIPIN (rouge) et PHALLOIDIN (gris) : image > couleur > fusionner les couches.
- Vérifiez que l’échelle (Analyser > Définir l’échelle) est en microns. À l’aide de l’outil de sélection à main levée, décrivez la partie blessée et non blessée de chaque coupe transversale, puis mesurez (Analyser > Mesure) et enregistrez la zone blessée par rapport à la zone non blessée dans une feuille de calcul.
REMARQUE: Les muscles blessés peuvent être identifiés comme des zones dépourvues de myofibres ou des zones peuplées de myofibres contenant des noyaux situés au centre. - Lancer le compteur de cellules: Plugins > CellCounter > Initialize.
- Sélectionnez un type de compteur, puis comptez chaque adipocyte. Enregistrez le nombre total d’adipocytes dans une feuille de calcul, puis calculez le nombre d’adipocytes par 1 mm2 de la zone blessée.
10. Analyse de l’expression génique adipogène à l’aide de la RT-qPCR
- Isolement de l’ARN
- Avant de commencer, préchauffer l’eau sans RNase à 45 °C et préparer de l’EtOH frais à 70 % (350 μL par échantillon).
- Ajouter 1 000 μL de thiocyanate de guanidium dans chaque tube contenant l’échantillon (voir étape 3.12.). Il est important que des tubes approuvés pour les batteurs de perles soient utilisés.
ATTENTION : Le thiocyanate de guanidium est toxique. Portez un équipement de protection individuelle approprié et manipulez-le dans une hotte aspirante. - Ajoutez trois perles moyennes ou une grande et une petite perle à chaque tube.
- Homogénéiser le tissu à 50 Hz pendant 2 à 4 min à l’aide d’un batteur de perles. Selon le type de tissu et la taille de l’échantillon, cela peut prendre jusqu’à 10 minutes.
- Ajouter 200 μL de chloroforme.
ATTENTION : Le chloroforme est toxique. Portez un équipement de protection individuelle et manipulez une hotte aspirante. - Agiter les échantillons pendant 15 s. Incuber pendant 2-3 min à RT.
- Centrifugeuse pendant 15 min à 12 000 x g. Pipeter 350 μL du surnageant clair (couche supérieure contenant l’ARN) et ajouter à un nouveau tube de microcentrifugation contenant 350 μL d’éthanol à 70%. Veillez à ne pas aspirer les couches inférieures de protéines et/ou d’ADN
- Transférer jusqu’à 700 μL du mélange dans une mini colonne de spin placée dans un tube collecteur de 2 mL. Poursuivez avec l’isolement de l’ARN en suivant les instructions du fabricant.
- Éluez avec 30 à 50 μL d’eau sans RNase, selon le rendement attendu. Gardez l’ARN sur la glace et mesurez le rendement à l’aide d’un spectrophotomètre. Conserver l’ARN stocké à -80 °C
REMARQUE: Il est possible d’omettre l’étape de traitement par DNase, car il suffit de retirer soigneusement les 350 μL supérieurs de la couche d’ARN pour prévenir la contamination de l’ADN. En plus de l’analyse RT-qPCR, l’ARN isolé peut également être utilisé pour le séquençage de l’ARN, auquel cas une étape de traitement par DNase est fortement recommandée.
- Synthèse de l’ADNc
- Utilisez jusqu’à 1 μg d’ARN pour synthétiser l’ADNc avec un kit de synthèse d’ADNc, en suivant les instructions du fabricant.
- Une fois la course terminée, ajoutez 80 μL d’eau sans RNase. Conserver les échantillons à -20 °C.
- RT-qPCR des gènes sélectifs des adipocytes.
- À l’aide d’un format de 384 puits, ajouter 1 μL d’amorce (~1 μM de concentration finale) au fond de chaque puits. Les apprêts de pré-séchage se traduisent par des répliques techniques plus serrées. Laisser couvert jusqu’à ce que les amorces se soient complètement évaporées (la plaque peut être placée sur un bloc chauffant réglé à 37 °C pour accélérer l’évaporation).
- Mettre en place des réactions d’échantillon avec quatre à huit répétitions techniques comme suit : 2,5 μL de mélange maître RT-PCR à base de colorant, 2,1 μL d’eau sans RNase et 0,4 μL d’ADNc (~1 ng) avec un volume total de 5 μL par puits. Les conditions de cycle thermique suivantes ont été utilisées : dénaturer à 95 °C pendant 15 s et recuit/étendre à 60 °C pendant 25 s pendant 40 cycles.
- Normaliser les valeurs brutes de CT (seuil de cycle) aux niveaux de gènes d’entretien (c.-à-d. Hprt et Pde12) en calculant ΔΔCT comme décrit ici38. Voir20 pour les séquences d’amorce.
REMARQUE: Les pratiques standard pour l’analyse RT-qPCR doivent être suivies, telles que l’utilisation d’un contrôle de transcription inverse (-RT) moins, la réaction PCR et la validation de l’amorce.
Résultats
Visualisation immunofluorescente de la graisse intramusculaire
En suivant les étapes ci-dessus et en regardant la figure 1A, des coupes de tissu TA ont été prélevées à partir d’une blessure au glycérol de 21 jours après avoir été congelées immédiatement après la récolte dans de l’isopentane refroidi par LN2 ou ont été fixées dans du PFA à 4 % pendant 2,5 h. Après cryosection et coloration des deux échantillons, des images ont été prises à mi-ventre, la plus grande zone de l’AT. Les adipocytes PERILIPIN+ des AT non fixés (Figure 1B) ont une morphologie significativement modifiée par rapport aux sections fixes (Figure 1C), ce qui rend leur identification, leur visualisation et leur quantification ultérieure beaucoup plus difficiles et potentiellement inexactes. À noter, les premières gouttelettes lipidiques PERILIPIN+ ont été détectées environ 5 jours après la blessure, la plupart des adipocytes s’étant formés au jour 7. 21 jours après la blessure, les adipocytes avaient complètement mûri.
Comme la quantité de graisse par AT est fortement corrélée à la gravité de la blessure induite, les AT doivent être blessés de manière significative pour observer et étudier efficacement la formation de graisse intramusculaire. Pratiquer des injections d’encre dans des TAs de cadavre est un excellent moyen d’améliorer la gravité des blessures. Les blessures réussies ont tendance à être supérieures à 50% du muscle. À noter, les zones blessées du muscle représentent des zones dépourvues de fibres musculaires ou des zones peuplées de fibres musculaires contenant au moins un noyau situé au centre, une caractéristique connue d’une fibre musculaire régénérante.
Ce protocole peut être facilement adapté à la coloration des FAP et des graisses en 3D. Pour cela, plusieurs myofibres de la post-fixation de l’AT ont été soigneusement séparés, suivis d’une immunofluorescence de montage entier. La clé est de fixer correctement les fibres à la lame de verre et, en même temps, d’éviter la surcompression du tissu. En utilisant des pieds en argile moulables, l’utilisateur peut ajuster l’épaisseur requise et fixer le couvercle à la glissière, permettant même l’utilisation d’un microscope inversé (Figure 4A). Cette méthode a été utilisée avec succès pour étiqueter les PAP PDGFRα+ , les myofibers phalloïdine+ et les adipocytes exprimant la PERILIPINE (Figure 4B, Vidéo supplémentaire 1 et Vidéo supplémentaire 2). Après avoir obtenu des images à plusieurs plans Z s’étendant jusqu’à 150 μm d’épaisseur, le module de rendu 3D du logiciel de microscope a été utilisé pour créer une reconstruction 3D.
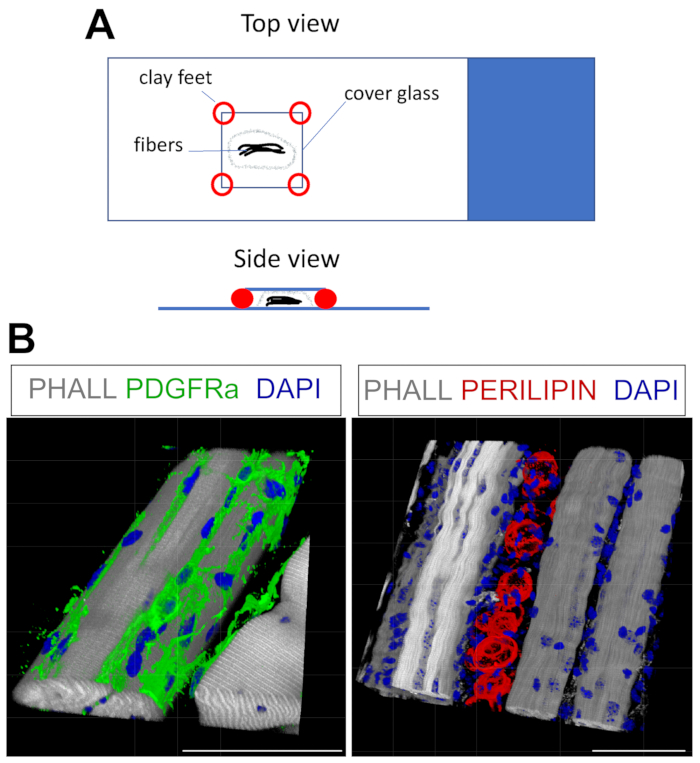
Figure 4 : Coloration immunofluorescente à montage entier. (A) Vue de dessus et de côté de la façon de monter l’échantillon et d’ajouter une lèvre de couverture pour la coloration à montage entier. (B) Reconstructions 3D représentatives des FAP (vert; à gauche) et des adipocytes (rouge; à droite) ainsi que des myofibres (gris) et des noyaux (bleu). Barres d’échelle : 50 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Quantification de la graisse intramusculaire
Une fois que des images ont été prises de graisse intramusculaire, la fonction Compteur cellulaire dans ImageJ/FIJI a été utilisée pour compter manuellement le nombre d’adipocytes PERLIPIN+ (Figure 5A). Ensuite, la surface totale de la section musculaire ainsi que la zone blessée, définie par des noyaux situés au centre dans les myofibres, ont été déterminées. Pour contrôler la gravité de la blessure, le nombre total d’adipocytes a été divisé par la zone blessée, ce qui a entraîné le nombre de cellules graisseuses pour 1 mm2 de muscle blessé. Habituellement, les AT qui présentent <30 % de blessures sont exclus des quantifications. À noter, bien que les adipocytes soient rares sans blessure, allant de zéro à huit par section transversale, le nombre total d’adipocytes est toujours normalisé par zone totale. Comme le montre la figure 5B, une blessure au glycérol provoque des quantités massives de graisse intramusculaire par rapport à un muscle TA non blessé. Alternativement, comme la coloration à la perilipine est très propre avec un rapport signal/bruit élevé, il est également possible d’utiliser la fonction Analyser les particules pour déterminer la surface totale occupée par la perilipine. Cependant, cette méthode ne sera pas en mesure de faire la distinction entre les adipocytes plus petits et moins nombreux. Jusqu’à trois sections d’un minimum de quatre animaux individuels ont été imagées et quantifiées, et le nombre moyen de cellules graisseuses présentes par souris a été rapporté.
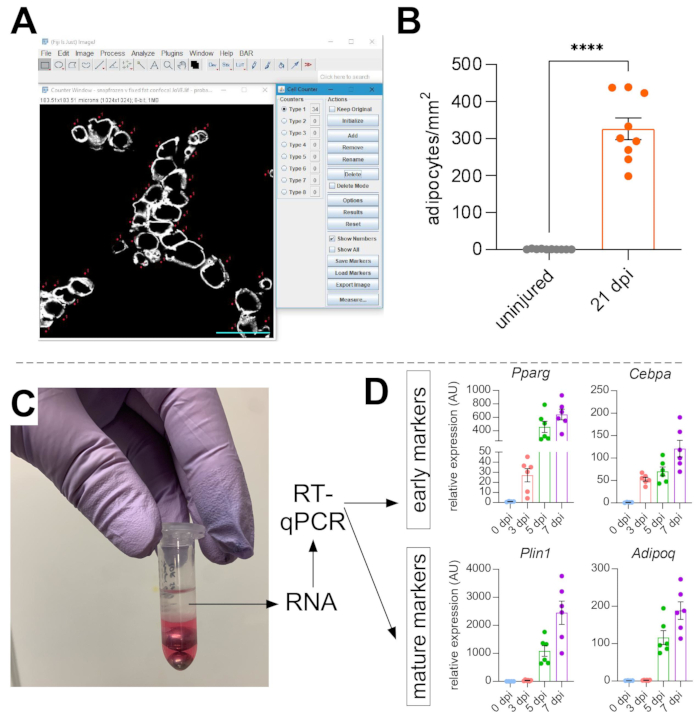
Figure 5: Quantifications de la graisse intramusculaire. (A) Image représentative de la façon de compter les adipocytes PERILIPIN+ (blanc) à l’aide de la fonction Compteur de cellules dans ImageJ. Barre d’échelle: 50 μm. (B) Quantifications des adipocytes TA entiers 21 jours après l’injection de glycérol normalisée à 1 mm2 de la zone lésée. Chaque point représente la moyenne d’une souris. Barres d’erreur affichées comme SEM. **** = p < 0,0001. (C) La couche d’ARN après homogénéisation et séparation de phase subséquente par chloroforme est utilisée pour l’analyse RT-qPCR. (D) Replier les changements dans les niveaux d’expression de Pparg et Cepbα, gènes adipogéniques précoces, et Plin1 et Adipoq, deux marqueurs adipocytaires matures, à différents moments après une lésion du glycérol. Chaque point représente la moyenne d’une souris. Barres d’erreur affichées sous la forme SEM. Veuillez cliquer ici pour afficher une version agrandie de cette figure.
Pour confirmer indépendamment la quantité de graisse intramusculaire présente, les niveaux d’expression génique de divers marqueurs adipogéniques peuvent être déterminés. Pour cela, l’ARN peut être isolé d’une partie du même muscle TA utilisé pour l’immunofluorescence (voir les étapes ci-dessus) à différents points après la blessure. Un batteur de billes a été utilisé en combinaison avec le thiocyanate de guanidium pour homogénéiser le tissu. Après l’ajout de chloroforme suivi d’une centrifugation, la couche supérieure contenant de l’ARN a été soigneusement extraite et des mini-colonnes de spin ont été utilisées pour le nettoyage de l’ARN (figure 5C). Cette méthode produit régulièrement une qualité et une quantité élevées d’ARN adaptées à toutes les analyses en aval telles que la RT-qPCR et l’ARNiq. Pour la RT-qPCR, les niveaux d’expression relatifs des gènes adipogéniques à l’entretien ménager ont été déterminés, et tout changement relatif a été évalué selon la méthode ΔΔCT38. Comme décrit à la figure 5D, par rapport au muscle TA non blessé, la lésion au glycérol induit l’expression de marqueurs adipogènes précoces tels que Pparg et Cebpα dès 3 jours après la blessure. Les marqueurs matures, tels que l’adiponectine (Adipoq) et la perilipine (Plin1), peuvent être détectés dès 5 jours après une lésion au glycérol.
Traçage génétique de la lignée des adipocytes
Le protocole de coloration des adipocytes présenté ici peut être facilement adapté pour inclure le traçage génétique de la lignée des FAP afin de cartographier et de suivre leur destin en adipocytes. Nous avons, par exemple, déjà démontré que la recombinaison pouvait être induite par l’administration de tamoxifène dans PdgfrαCreERT2; Rosa26souris EYFP 2 semaines avant la blessure, éliminant efficacement le codage d’arrêt floxé et activant de manière indélébile l’expression de l’EYFP dans les FAPs (Figure 6A). Nous avons atteint des rendements de recombinaison élevés avec le régime de tamoxifène présenté ici, avec environ 75% des PAP PDGFRα+ exprimant EYFP20, similaire à ce que d’autres laboratoires ont rapporté 27,39,40. Démontrant que les PAF sont bien l’origine cellulaire de la graisse intramusculaire, la majorité des PAP se sont transformées en adipocytes exprimant l’EYFP+ PERILIPINE 7 jours après une lésion du glycérol (Figure 6B).
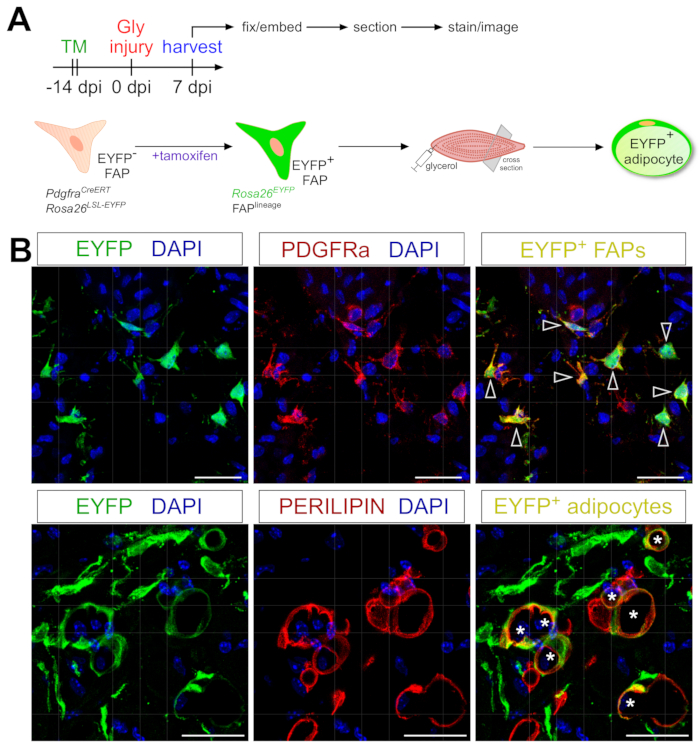
Figure 6 : Traçage de la lignée des PAF. (A) Vue d’ensemble schématique de la configuration expérimentale. (B) Images immunofluorescentes représentatives montrant une recombinaison et une activation réussies de l’EYFP (jaune) dans les FAP PDGFRα+ (rouges, pointes de flèche) et les adipocytes PERILIPIN+ (rouges, astérisques). Barres d’échelle : 25 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Détection de plusieurs types de cellules
Ce protocole peut également être utilisé pour visualiser le compartiment myogénique. En utilisant des anticorps contre PAX7 et MYOD1, les cellules souches musculaires (MuSC) et les myoblastes, respectivement, peuvent être facilement détectés 5 jours après une lésion au glycérol, même dans une section de tissu musculaire fixée par PFA (Figure 7). Ainsi, le protocole présenté est polyvalent et adaptable non seulement pour étiqueter et imager les adipocytes et les PAF, mais aussi pour d’autres types de cellules de la lignée myogénique.
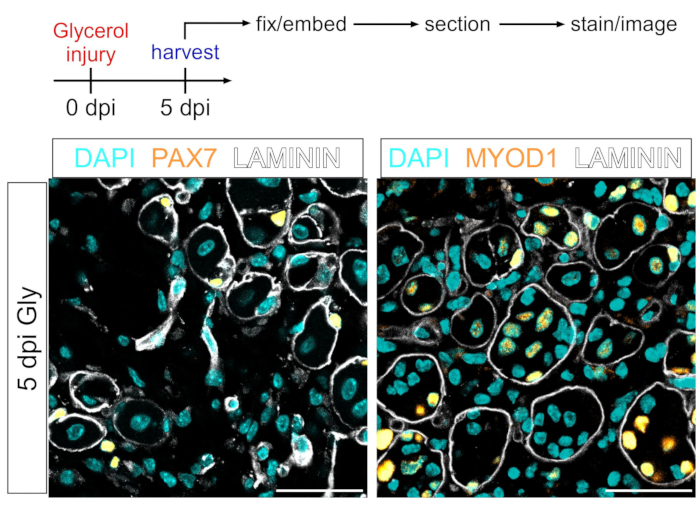
Figure 7 : Coloration immunofluorescente des cellules souches musculaires et des myoblastes. (A) Aperçu schématique de la configuration expérimentale. (B) Images immunofluorescentes représentatives montrant une coloration réussie des cellules souches musculaires (MuSC) (jaune, à gauche) avec PAX7 et des myoblastes (jaune, à droite) avec MYOD1. LAMININ décrit les myofibres (blancs) et les noyaux sont en cyan. Barres d’échelle : 50 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Vidéo supplémentaire 1: rendu 3D des FAP. Reconstruction tridimensionnelle des myofibres, des PAP et des noyaux colorés pour la PHALLOIDIN (grise), la PDGFRα (verte) et la DAPI (bleue), respectivement, 21 jours après la blessure. Veuillez cliquer ici pour télécharger cette vidéo.
Vidéo supplémentaire 2: Rendu 3D de la graisse intramusculaire. Rendu volumétrique des faisceaux de myofibères (gris, PHALLOIDIN) et de la graisse intramusculaire (rouge, PERILIPIN), qui a remplacé un myofiber 21 jours après une lésion au glycérol. Veuillez cliquer ici pour télécharger cette vidéo.
Discussion
Ce protocole décrit un protocole complet et détaillé qui permet une visualisation efficace et une quantification rigoureuse de la graisse intramusculaire. En divisant le même muscle en deux parties, l’une utilisée pour l’immunofluorescence et l’autre pour l’analyse RT-qPCR, ce protocole est également très polyvalent. Il peut également être combiné avec le traçage génétique de la lignée des FAP pour étudier leur conversion en adipocytes dans certaines conditions et est très adaptable pour étiqueter et imager plusieurs types de cellules supplémentaires.
Les moyens les plus couramment utilisés pour visualiser la graisse intramusculaire sont les sections de paraffine suivies de la coloration à l’hématoxyline et à l’éosine ou des sections congelées colorées pour les colorants lipophiles tels que l’huile rouge O (ORO). Cependant, alors que les tissus traités à la paraffine conservent la meilleure histologie, le même processus extrait également tous les lipides empêchant l’utilisation de colorants lipophiles. Bien que les méthodes de coloration lipophile fonctionnent à la fois sur les sections de tissus fixes et non fixées par PFA, les gouttelettes lipidiques sont facilement déplacées en appliquant une pression sur le couvercle, déformant ainsi la distribution spatiale de la graisse intramusculaire. Pour contourner ce problème, une étude récente a établi un protocole rigoureux pour visualiser les adipocytes ORO+ en utilisant une approche globale. Pour cela, les auteurs ont décellularisé l’AT pour visualiser la distribution spatiale de la graisse intramusculaire dans l’ensemble du TA41. Aussi puissante que soit cette technique, elle empêche également l’utilisation d’autres co-taches pour marquer des structures cellulaires supplémentaires. L’approche d’immunofluorescence globale présentée ici peut être utilisée pour co-colorer les adipocytes avec une variété de marqueurs permettant une cartographie fine de l’environnement cellulaire. Un défi majeur, cependant, est la pénétration tissulaire des anticorps. Plus les fibres sont maintenues ensemble, plus il sera difficile pour les anticorps de pénétrer et de lier également tous les antigènes disponibles. Ainsi, cette méthode est plus efficace lorsque l’on regarde de petits groupes de fibres. Dans le même temps, il s’agit également d’une limitation car l’emplacement anatomique global de la graisse intramusculaire est perdu en se concentrant uniquement sur de petits faisceaux de fibres décollées. Cependant, avec le développement actuel de nouvelles méthodes de nettoyage des tissus et de nouvelles technologies d’imagerie, une plus grande pénétration et visualisation des tissus sera possible à l’avenir 42,43,44.
Bien que la fixation préalable du tissu musculaire préserve la morphologie des adipocytes, il est également difficile d’évaluer la taille des myofibres, une mesure importante de la santé musculaire. La taille des myofibers est déterminée en mesurant la section transversale des myofibres. Nous avons déjà signalé qu’une fixation antérieure du tissu musculaire entraînera l’échec de la plupart des marqueurs disponibles pour décrire les myofibres31. Pour surmonter cet obstacle, nous avons développé un nouveau pipeline de segmentation d’image, qui permet de mesurer la taille du myofibre même dans les sections musculaires fixes31. Ainsi, nous avons établi un pipeline de traitement des tissus robuste et efficace qui, combiné à ce protocole, surmonte la plupart des inconvénients causés par la fixation préalable du tissu musculaire.
Un autre avantage majeur de cette approche est la polyvalence. En divisant l’AT en deux parties, la quantité d’informations pouvant être obtenues à partir d’un muscle est maximisée. Cela réduit non seulement le nombre d’animaux, mais ajoute également une couche supplémentaire de contrôle en confirmant l’histologie par l’expression des gènes et vice versa. En outre, de nombreux gènes différents peuvent être examinés au-delà des gènes adipogéniques. L’ARN isolé peut également être utilisé pour une expérience RNAseq musculaire entière. Enfin, le morceau musculaire surgelé peut également être utilisé pour le travail des protéines. L’une des limites de ce protocole est la possibilité que la blessure ne soit pas uniforme sur toute la longueur de l’AT. Cela pourrait conduire à un scénario où les deux parties musculaires divergent dans la quantité de graisse intramusculaire qu’elles contiennent et peut justifier l’exclusion d’un tel échantillon de toute analyse en aval. Il est donc recommandé de ne pas simplement s’appuyer sur la RT-qPCR pour tirer des conclusions majeures sur la quantité de graisse intramusculaire, mais plutôt comme données de soutien aux quantifications histologiques.
Ensemble, ce protocole décrit un pipeline de traitement tissulaire robuste, efficace et rigoureux qui permettra la visualisation et la quantification de la graisse intramusculaire, la première étape dans le développement de nouvelles options de traitement pour lutter contre la fibrose graisseuse. En même temps, il est polyvalent et peut être adapté à de nombreux types de cellules différentes dans le muscle ainsi que les adipocytes dans d’autres tissus.
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt concurrent.
Remerciements
Nous remercions les membres du laboratoire Kopinke d’avoir aidé à la collecte de données et à la lecture critique du manuscrit. Nous remercions également les membres de l’Institut de myologie de l’Université de Floride pour leur précieuse contribution au manuscrit. Le travail a été soutenu par la subvention NIH 1R01AR079449. La figure 2 a été créée avec Biorender.
matériels
| Name | Company | Catalog Number | Comments |
| 16% PFA (Pack of 12, 10 mL bottles) | Electron Miscroscopy Sciences | 15710 | |
| 2.0 mL Microcentrifuge Tubes | Fisher Scientific | 05-408-138 | microcentrifuge tubes for snapfreezing/bead beating |
| 2-Methylbutane (4 L) | Fisher Chemical | O3551-4 | isopentane |
| Absolute Ethanol (200 proof) | ThermoFisher Scientific | BP2818100 | |
| AffiniPure Fab fragment donkey anti-mouse | Jackson ImmunoResearch | 715-007-003 | mouse-on-mouse blocking |
| Alexa Fluor 488 donkey anti-chicken secondary antibody | Jackson ImmunoResearch | 703-545-155 | |
| Alexa Fluor 488 donkey anti-mouse secondary antibody | Invitrogen | A21202 | |
| Alexa Fluor 488 donkey anti-rabbit secondary antibody | Invitrogen | A21206 | |
| Alexa Fluor 568 donkey anti-goat secondary antibody | Invitrogen | A11057 | |
| Alexa Fluor 568 donkey anti-rabbit secondary antibody | Invitrogen | A11037 | |
| Alexa Fluor 568 Phalloidin antibody | Invitrogen | A12380 | Dissolved in 1.5 mL methanol (~66 µM working solution) |
| BioLite 24-well Multidishes | ThermoFisher Scientific | 930186 | 24 well plate for PFA tissue incubation |
| Biometra TOne | analytikjena | 8462070301 | Thermal cycler |
| Chicken anti-GFP antibody | Aves Labs | GFP-1020 | |
| Chloroform/isoamyl alcohol 24:1(v/v) for molecular biology, DNAse, RNAse, and Protease free | ThermoFisher Scientific | AC327155000 | |
| Corn oil | Sigma Aldrich | C8267 | |
| DAPI stain | Invitrogen | D1306 | 150 µM working solution in dH2O |
| Donkey Serum (100 mL) | Millipore Sigma | 5058837 | for blocking solution |
| Dumont #5 Forceps | Fine Science Tools | 11251-20 | sharp-tipped tweezers |
| Fine Scissors Straight 9 cm | Fine Science Tools | 14060-09 | |
| Fluoromount-G | SouthernBiotech | 0100-01 | mounting medium |
| Glycerol, 99.5%, for molecular biology (500 mL) | Acros Organics | 327255000 | |
| Goat anti-PDGFRα antibody | R&D | AF1062 | |
| Hybridization Oven | VWR | 230301V | for Tamoxifen incubation |
| ImmEdge Hydrophobic Barrier PAP Pen | Vector Laboratories | H-4000 | hydrophobic pen |
| Insulin Syringe with Micro-Fine IV needle (28 G) | BD | 329461 | |
| Insulin Syringe with Slip Tip, 1 mL | BD | 329654 | Insulin syringe without needle, for oral gavaging |
| iScript cDNA Synthesis Kit | Bio-Rad | 1708890 | |
| Isoflurane | Patterson Veterinary | 78938441 | |
| Leica DMi8 inverted microscope | Leica | micrscope used for widefield IF and confocal imaging | |
| Micro Slides | VWR | 48311-703 | positively charged microscope slides |
| mouse anti-MYOD antibody | Invitrogen | MA1-41017 | |
| mouse anti-PAX7 antibody (supernatant) | DSHB | AB 428528 | |
| MX35 Premier+ Microtome blades | ThermoFisher Scientific | 3052835 | microtome blades |
| NanoDrop 2000 Spectrophotometer | ThermoFisher Scientific | ND2000 | spectrophotometer for RNA yield |
| Play-Doh | Hasbro | modeling compound | |
| PowerUp SYBR Green Master Mix | ThermoFisher Scientific | A25742 | green dye PCR master mix |
| Puralube Vet Ointment | Puralube | 17033-211-38 | vet ophthalmic ointment |
| QuantStudi 6 Flex Real-Time 384-well PCR System | Applied Biosystems | 4485694 | qPCR machine |
| Rabbit anti-perilipin antibody | Cell Signaling Technology | 9349S | |
| Red-Rotor Shaker | Hoefer Scientific | PR70-115V | shaker for IF staining |
| Richard-Allan Scientific Slip-Rite Cover Glass | ThermoFisher Scientific | 152460 | coverslips |
| RNeasy Mini Kit | QIAGEN | 74106 | contains mini spin columns |
| Safe-Lock Tubes 1.5 ml, natural | Eppendorf | 22363204 | |
| Sample Tubes RB (2 mL) | QIAGEN | 990381 | |
| Sodium azide | Alfa Aesar | 14314 | |
| Stainless Steel Beads, 2.8 mm | Precellys | KT03961-1-101.BK | small beads |
| Stainless Steel Beads, 5 mm | QIAGEN | 69989 | medium beads |
| Stainless Steel Beads, 7 mm | QIAGEN | 69990 | large beads |
| Stainless Steel Disposable Scalpels | Miltex | 327-4102 | scalpel |
| Stainless steel feeding tube, 20 G x 38 mm, straight | Instech Laboratories | FTSS-20S-3 | gavage needle |
| Tamoxifen | Toronto Research Chemicals | T006000 | |
| Tissue Plus O.C.T. Compound | Fisher HealthCare | 4585 | embedding medium |
| TissueLyser LT | QIAGEN | 85600 | bead beater |
| TissueLyser LT Adapter, 12-Tube | QIAGEN | 69980 | |
| Tissue-Tek Cryomold | Sakura | 4566 | specimen molds |
| Triton X-100 | Alfa Aesar | A16046 | |
| TRIzol Reagent | ThermoFisher Scientific | 15596026 | guanidium thiocyanate |
| Tween20 (500 mL) | Fisher BioReagents | BP337-500 | |
| VWR Micro Slides - Superfrost Plus | VWR | 48311703 | |
| Wheaton Coplin staining jars | Millipore Sigma | S6016 | Coplin jar |
Références
- Milad, N., et al. Increased plasma lipid levels exacerbate muscle pathology in the mdx mouse model of Duchenne muscular dystrophy. Skeletal Muscle. 7 (1), 19 (2017).
- Goodpaster, B. H., et al. Obesity, regional body fat distribution, and the metabolic syndrome in older men and women. Archives of Internal Medicine. 165 (7), 777-783 (2005).
- Goodpaster, B. H., et al. Association between regional adipose tissue distribution and both type 2 diabetes and impaired glucose tolerance in elderly men and women. Diabetes Care. 26 (2), 372-379 (2003).
- Goodpaster, B. H., et al. The loss of skeletal muscle strength, mass, and quality in older adults: the health, aging and body composition study. The Journals of Gerontology, Series A: Biological Sciences and Medical Sciences. 61 (10), 1059-1064 (2006).
- Goodpaster, B. H., Thaete, F. L., Kelley, D. E. Thigh adipose tissue distribution is associated with insulin resistance in obesity and in type 2 diabetes mellitus. American Journal of Clinical Nutrition. 71 (4), 885-892 (2000).
- Goodpaster, B. H., Theriault, R., Watkins, S. C., Kelley, D. E. Intramuscular lipid content is increased in obesity and decreased by weight loss. Metabolism. 49 (4), 467-472 (2000).
- Burakiewicz, J., et al. Quantifying fat replacement of muscle by quantitative MRI in muscular dystrophy. Journal of Neurology. 264 (10), 2053-2067 (2017).
- Murphy, W. A., Totty, W. G., Carroll, J. E. MRI of normal and pathologic skeletal muscle. American Journal of Roentgenology. 146 (3), 565-574 (1986).
- Willcocks, R. J., et al. Multicenter prospective longitudinal study of magnetic resonance biomarkers in a large duchenne muscular dystrophy cohort. Annals of Neurology. 79 (4), 535-547 (2016).
- Wokke, B. H., et al. Quantitative MRI and strength measurements in the assessment of muscle quality in Duchenne muscular dystrophy. Neuromuscular Disorders. 24 (5), 409-416 (2014).
- Contreras, O., Rossi, F. M. V., Theret, M. Origins, potency, and heterogeneity of skeletal muscle fibro-adipogenic progenitors-time for new definitions. Skeletal Muscle. 11 (1), 16 (2021).
- El Agha, E., et al. Mesenchymal stem cells in fibrotic disease. Cell Stem Cell. 21 (2), 166-177 (2017).
- Joe, A. W., et al. Muscle injury activates resident fibro/adipogenic progenitors that facilitate myogenesis. Nature Cell Biology. 12 (2), 153-163 (2010).
- Liu, W., Liu, Y., Lai, X., Kuang, S. Intramuscular adipose is derived from a non-Pax3 lineage and required for efficient regeneration of skeletal muscles. Developmental Biology. 361 (1), 27-38 (2012).
- Scott, R. W., Arostegui, M., Schweitzer, R., Rossi, F. M. V., Underhill, T. M. Hic1 defines quiescent mesenchymal progenitor subpopulations with distinct functions and fates in skeletal muscle regeneration. Cell Stem Cell. 25 (6), 797-813 (2019).
- Uezumi, A., et al. Fibrosis and adipogenesis originate from a common mesenchymal progenitor in skeletal muscle. Journal of Cell Science. 124, 3654-3664 (2011).
- Hogarth, M. W., et al. Fibroadipogenic progenitors are responsible for muscle loss in limb girdle muscular dystrophy 2B. Nature Communications. 10 (1), 2430 (2019).
- Uezumi, A., Fukada, S., Yamamoto, N., Takeda, S., Tsuchida, K. Mesenchymal progenitors distinct from satellite cells contribute to ectopic fat cell formation in skeletal muscle. Nature Cell Biology. 12 (2), 143-152 (2010).
- Stumm, J., et al. Odd skipped-related 1 (Osr1) identifies muscle-interstitial fibro-adipogenic progenitors (FAPs) activated by acute injury. Stem Cell Research. 32, 8-16 (2018).
- Kopinke, D., Roberson, E. C., Reiter, J. F. Ciliary Hedgehog signaling restricts injury-induced adipogenesis. Cell. 170 (2), 340-351 (2017).
- Huang, Y., Das, A. K., Yang, Q. Y., Zhu, M. J., Du, M. Zfp423 promotes adipogenic differentiation of bovine stromal vascular cells. PLoS One. 7 (10), 47496 (2012).
- Sun, Y. -. M., et al. PDGFRα regulated by miR-34a and FoxO1 promotes adipogenesis in porcine intramuscular preadipocytes through Erk signaling pathway. International Journal of Molecular Sciences. 18 (11), 2424 (2017).
- Te, L. J. I., Doherty, C., Correa, J., Batt, J. Identification, isolation, and characterization of fibro-adipogenic progenitors (FAPs) and myogenic progenitors (MPs) in skeletal muscle in the rat. Journal of Visualized Experiments: JoVE. (172), e61750 (2021).
- Lukjanenko, L., et al. Aging disrupts muscle stem cell function by impairing matricellular WISP1 secretion from fibro-adipogenic progenitors. Cell Stem Cell. 24 (3), 433-446 (2019).
- Santini, M. P., et al. Tissue-resident PDGFRalpha(+) progenitor cells contribute to fibrosis versus healing in a context- and spatiotemporally dependent manner. Cell Reports. 30 (2), 555-570 (2020).
- Uezumi, A., et al. Identification and characterization of PDGFRalpha+ mesenchymal progenitors in human skeletal muscle. Cell Death & Disease. 5, 1186 (2014).
- Wosczyna, M. N., et al. Mesenchymal stromal cells are required for regeneration and homeostatic maintenance of skeletal muscle. Cell Reports. 27 (7), 2029-2035 (2019).
- Soliman, H., et al. Pathogenic potential of Hic1-expressing cardiac stromal progenitors. Cell Stem Cell. 26 (2), 205-220 (2020).
- Chung, M. I., Bujnis, M., Barkauskas, C. E., Kobayashi, Y., Hogan, B. L. M. Niche-mediated BMP/SMAD signaling regulates lung alveolar stem cell proliferation and differentiation. Development. 145 (9), (2018).
- Hilgendorf, K. I., et al. Omega-3 fatty acids activate ciliary FFAR4 to control adipogenesis. Cell. 179 (6), 1289-1305 (2019).
- Waisman, A., Norris, A. M., Elías Costa, M., Kopinke, D. Automatic and unbiased segmentation and quantification of myofibers in skeletal muscle. Scientific Reports. 11 (1), 11793 (2021).
- Kang, S. H., Fukaya, M., Yang, J. K., Rothstein, J. D., Bergles, D. E. NG2+ CNS glial progenitors remain committed to the oligodendrocyte lineage in postnatal life and following neurodegeneration. Neuron. 68 (4), 668-681 (2010).
- Srinivas, S., et al. Cre reporter strains produced by targeted insertion of EYFP and ECFP into the ROSA26 locus. BMC Developmental Biology. 1, 4 (2001).
- Lukjanenko, L., Brachat, S., Pierrel, E., Lach-Trifilieff, E., Feige, J. N. Genomic profiling reveals that transient adipogenic activation is a hallmark of mouse models of skeletal muscle regeneration. PLoS One. 8 (8), 71084 (2013).
- Mahdy, M. A., Lei, H. Y., Wakamatsu, J., Hosaka, Y. Z., Nishimura, T. Comparative study of muscle regeneration following cardiotoxin and glycerol injury. Annals of Anatomy = Anatomischer Anzeiger: Official Organ of the Anatomische Gesellscaft. 202, 18-27 (2015).
- Pisani, D. F., Bottema, C. D., Butori, C., Dani, C., Dechesne, C. A. Mouse model of skeletal muscle adiposity: a glycerol treatment approach. Biochemical and Biophysical Research Communications. 396 (3), 767-773 (2010).
- Kawai, H., et al. Experimental glycerol myopathy: a histological study. Acta Neuropathologica. 80 (2), 192-197 (1990).
- Schmittgen, T. D., Livak, K. J. Analyzing real-time PCR data by the comparative CT method. Nature Protocols. 3 (6), 1101-1108 (2008).
- Uezumi, A., et al. Mesenchymal Bmp3b expression maintains skeletal muscle integrity and decreases in age-related sarcopenia. The Journal of Clinical Investigation. 131 (1), 139617 (2021).
- Biferali, B., et al. Prdm16-mediated H3K9 methylation controls fibro-adipogenic progenitors identity during skeletal muscle repair. Science Advances. 7 (23), 9371 (2021).
- Biltz, N. K., Meyer, G. A. A novel method for the quantification of fatty infiltration in skeletal muscle. Skeletal Muscle. 7 (1), (2017).
- Vieites-Prado, A., Renier, N. Tissue clearing and 3D imaging in developmental biology. Development. 148 (18), (2021).
- Gómez-Gaviro, M. V., Sanderson, D., Ripoll, J., Desco, M. Biomedical applications of tissue clearing and three-dimensional imaging in health and disease. iScience. 23 (8), 101432 (2020).
- Ueda, H. R., et al. Tissue clearing and its applications in neuroscience. Nature Reviews Neuroscience. 21 (2), 61-79 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon