A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
إنشاء مفصل الركبة على رقاقة لنمذجة أمراض المفاصل واختبار الأدوية
In This Article
Summary
نحن نقدم طرقا مفصلة لتوليد أربعة أنواع من الأنسجة من الخلايا الجذعية الوسيطة البشرية ، والتي تستخدم لتلخيص الغضروف والعظام ووسادة الدهون والغشاء الزليلي في مفصل الركبة البشري. يتم دمج هذه الأنسجة الأربعة في مفاعل حيوي مخصص وتوصيلها من خلال الموائع الدقيقة ، وبالتالي توليد مفصل الركبة على رقاقة.
Abstract
يشكل ارتفاع معدل انتشار أمراض المفاصل المنهكة مثل هشاشة العظام (OA) عبئا اجتماعيا واقتصاديا كبيرا. حاليا ، الأدوية المتاحة التي تستهدف اضطرابات المفاصل هي في الغالب ملطفة. إن الحاجة غير الملباة إلى أدوية OA الفعالة المعدلة للمرض (DMOADs) ناتجة في المقام الأول عن عدم وجود نماذج مناسبة لدراسة آليات المرض واختبار DMOADs المحتملة. هنا ، نصف إنشاء نظام فسيولوجي دقيق يحاكي المفصل الزليلي المصغر (miniJoint) يتألف من مكونات الأنسجة الدهنية والليفية والعظمية الغضروفية المشتقة من الخلايا الجذعية الوسيطة البشرية (MSCs). للحصول على الأنسجة الدقيقة ثلاثية الأبعاد (3D) ، تم تغليف MSCs في الجيلاتين الميثكريليت القابل للربط الضوئي قبل أو بعد التمايز. ثم تم دمج تركيبات الأنسجة المحملة بالخلايا في مفاعل حيوي مطبوع 3D ، لتشكيل miniJoint. تم إدخال تدفقات منفصلة من الوسائط العظمية والليفية المنشأ والشحمية للحفاظ على الأنماط الظاهرية للأنسجة المعنية. تم اختراق تيار مشترك بشكل شائع من خلال الغضروف والأنسجة الزليلية والدهنية لتمكين تداخل الأنسجة. يسمح نمط التدفق هذا بتحريض الاضطرابات في واحد أو أكثر من مكونات الأنسجة للدراسات الآلية. علاوة على ذلك ، يمكن اختبار DMOADs المحتملة إما عن طريق "الإدارة الجهازية" من خلال جميع التيارات المتوسطة أو "الإدارة داخل المفصل" عن طريق إضافة الأدوية إلى تدفق محاكاة "السائل الزليلي" المشترك فقط. وبالتالي ، يمكن أن يكون miniJoint بمثابة منصة متعددة الاستخدامات في المختبر لدراسة آليات المرض بكفاءة واختبار الأدوية في الطب الشخصي.
Introduction
أمراض المفاصل مثل هشاشة العظام (OA) منتشرة للغاية وموهنة وتمثل سببا رئيسيا للإعاقة في جميع أنحاء العالم1. تشير التقديرات إلى أنه في الولايات المتحدة وحدها ، يؤثر OA على 27 مليون مريض ويحدث في 12.1٪ من البالغين الذين تتراوح أعمارهم بين 60 وما فوق2. لسوء الحظ ، فإن معظم الأدوية المستخدمة حاليا لإدارة أمراض المفاصل ملطفة ، ولا تتوفر أدوية OA فعالة لتعديل المرض (DMOADs)3. تنبع هذه الحاجة الطبية غير الملباة في المقام الأول من عدم وجود نموذج فعال لدراسة آليات المرض وتطوير DMOADs المحتملة. لا تعكس زراعة الخلايا التقليدية ثنائية الأبعاد (2D) الطبيعة ثلاثية الأبعاد لأنسجة المفاصل ، وغالبا ما يتم إعاقة زراعة الأنسجة من خلال موت الخلايا الكبير وعادة ما تفشل في تكرار الترابط الديناميكي للأنسجة4. بالإضافة إلى ذلك ، تقلل الاختلافات الجينية والتشريحية بشكل كبير من الأهمية الفسيولوجية للنماذج الحيوانية4.
تعد الأجهزة على الرقائق (OoCs) ، أو الأنظمة الفيزيولوجية الدقيقة ، مجالا بحثيا واعدا في واجهة الهندسة والبيولوجيا والطب. هذه المنصات في المختبر هي الحد الأدنى من الوحدات الوظيفية التي تكرر السمات الصحية أو المرضية المحددة لنظيراتها في الجسم الحي 5. علاوة على ذلك ، يمكن لهذه الأنظمة المصغرة استضافة خلايا ومصفوفات متنوعة ومحاكاة التفاعلات الفيزيائية الحيوية والكيميائية الحيوية بين الأنسجة المختلفة. لذلك ، فإن النظام الفسيولوجي الدقيق الذي يمكنه تلخيص المفصل الزليلي الأصلي بأمانة يعد بتقديم منصة فعالة لنمذجة أمراض المفاصل وتطوير DMOADs المحتملة.
يمكن عزل الخلايا الجذعية الوسيطة البشرية (MSCs) من العديد من الأنسجة في جميع أنحاء الجسم وتمييزها إلى سلالات عظمية المنشأ ، غضروفية ، وأديبوجينية6. تم استخدام MSCs بنجاح لهندسة الأنسجة المختلفة ، بما في ذلك العظام والغضاريف والأنسجة الدهنية6 ، مما يعني أنها تمثل مصدرا واعدا للخلايا لهندسة مكونات الأنسجة في مفصل الركبة. لقد طورنا مؤخرا نظاما مصغرا يحاكي المفاصل ، يسمى miniJoint ، والذي يشتمل على أنسجة العظام والغضاريف والأنسجة الليفية والدهنية المشتقة من MSC7. على وجه الخصوص ، يتيح التصميم الجديد الحديث المتبادل للأنسجة عن طريق تدفق الموائع الدقيقة أو التغلغل (الشكل 1). هنا ، نقدم بروتوكولات تصنيع مكونات الرقاقة ، وهندسة مكونات الأنسجة ، وزراعة الأنسجة المهندسة في الرقاقة ، وجمع الأنسجة للتحليلات النهائية.
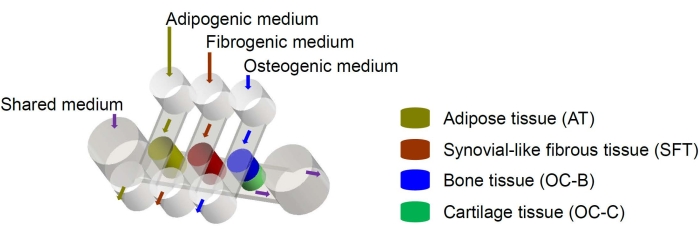
الشكل 1: رسم تخطيطي لشريحة miniJoint يوضح ترتيب مكونات الأنسجة المختلفة والتدفقات المتوسطة. OC = الأنسجة العظمية الغضروفية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Access restricted. Please log in or start a trial to view this content.
Protocol
يتبع البروتوكول التالي المبادئ التوجيهية الأخلاقية لجامعة بيتسبرغ ولجنة أخلاقيات البحوث البشرية بجامعة بيتسبرغ. يتم سرد المعلومات حول المواد المستخدمة في هذه الدراسة في جدول المواد.
1. تصنيع المفاعلات الحيوية المطبوعة 3D
- استخدم برنامج كمبيوتر لتصميم المفاعلات الحيوية العظمية الغضروفية (الشكل 2 أ) والمفاعلات الحيوية الصغيرة (الشكل 2 ب) التي تتضمن حجرات وإدخالات وأغطية. يتم عرض معلومات الأبعاد لكل جزء في الشكل S1.
- انقل التصميم إلى طابعة 3D ، واطبع باستخدام حبر فوتوبوليمر.
- شطف الأجزاء المطبوعة 3D (الشكل 2C-F) مع 15 مل من الإيثانول 95 ٪ ثلاث مرات. بعد ذلك ، قم بربط القطع المطبوعة بالكامل لمدة 200 ثانية في جهاز بلمرة مصباح يدوي.
- أضف حلقات O إلى الإدخالات والأغطية (الشكل 2C ، D) ، واختبر ما إذا كانت الأجزاء مناسبة (الشكل 2G ، H).

الشكل 2: تصنيع المكونات المختلفة لصنع المفاعل الحيوي miniJoint (A ، B) ، نماذج 3D للمفاعلات الحيوية لإنشاء (A) هشاشة العظام و (B) رقائق miniJoint . (C ، D) 3D مطبوعة (C) الأغطية و (D) إدراج مع تثبيت الحلقة O. (E ، F) غرف مطبوعة 3D ل (E) العظم الغضروفي و (F) زراعة الأنسجة المصغرة. (ز ، ح) تجميع (G) رقائق العظم الغضروفي و (H) miniJoint . يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. هندسة مكونات الأنسجة
ملاحظة: تم وصف عمليات تصنيع الليثيوم فينيل -2،4،6-ثلاثي ميثيل بنزويل فوسفينات (LAP) والجيلاتين الميثيل (GelMA) في الدراسات السابقة8،9.
- لإنشاء GelMA، اتبع الخطوات أدناه.
- أضف 17 جم من الجيلاتين من النوع B إلى 500 مل من الماء المقطر ، ثم اخلطه على شاكر لمدة 30 دقيقة عند 37 درجة مئوية.
- ثم أضف 13 مل من أنهيدريد الميثاكريليك ، وضعه مرة أخرى على شاكر 37 درجة مئوية ، واتركه يهتز طوال الليل.
- في اليوم التالي ، قم بقسمة GelMA في أكياس غسيل الكلى الفردية ، مع ~ 60 مل في كل كيس.
- ضع جميع أكياس غسيل الكلى في الماء المقطر بقضيب تقليب ، واتركها لمدة 7 أيام من غسيل الكلى. قم بتغيير الماء عدة مرات في اليوم ، واترك الأكياس عند 4 درجات مئوية طوال الليل.
- في اليوم 7 ، قم بتجميد GelMA عند -80 درجة مئوية. بمجرد تجميدها تماما ، انتقل إلى التجفيد.
- ضع GelMA في طبق في غرفة التفريغ في مجفف التجميد ، واتركه يجف بالتجميد. تأكد من تجفيف GelMA تماما قبل إزالته من مجفف التجميد.
- قم بإذابة GelMA في محلول ملح هانك المتوازن (HBSS مع Ca 2+ و Mg2+) عند 15٪ (وزن / حجم). للتأكد من أن الرقم الهيدروجيني عند 7.4 ، أضف هيدروكسيد الصوديوم بكميات صغيرة حتى يصل الرقم الهيدروجيني إلى 7.4. استكمل المحلول ب 1x مضاد حيوي مضاد حيوي و 0.15٪ (وزن / حجم) LAP بناء على الحجم المكتسب. قم بتخزين محلول GelMA بنسبة 15٪ في درجة حرارة -20 درجة مئوية حتى الاستخدام ، وقم بحمايته من الضوء.
- ضع غرف المفاعل الحيوي ثنائي التدفق المطبوعة 3D ، والأغطية ، وإدراج في أكياس الأوتوكلاف ، والأوتوكلاف في 121 درجة مئوية لمدة 20 دقيقة مع البخار ثم لمدة 20 دقيقة مع الحرارة الجافة.
- داخل خزانة السلامة البيولوجية ، انقع غرف المفاعل الحيوي والأغطية والإدخالات في 15 مل من المحلول الملحي المعقم المخزن بالفوسفات طوال الليل ، وبعد ذلك اتركها حتى تجف.
- عزل MSCs المشتقة من نخاع العظم البشري من إجمالي النفايات الجراحية لرأب المفاصل بموافقة IRB (جامعة بيتسبرغ وجامعة واشنطن).
- على وجه التحديد ، اطرد نخاع العظم من العظم التربيقي لعنق الفخذ ورأسه ، وأعد تعليقه في وسط النسر المعدل في Dulbecco (DMEM).
- قم بتصفية التعليق من خلال مصفاة 40 ميكرومتر ، وطرد مركزي التدفق عند 300 × جم لمدة 5 دقائق.
- قم بإزالة المادة الطافية ، وأعد تعليق الكريات باستخدام وسط النمو [DMEM ، مصل بقري جنيني 10٪ (FBS) ، و 1x مضاد حيوي مضاد للفطريات] ، ثم ضعه في قوارير زراعة الأنسجة.
- قم بتغيير وسط الثقافة كل 3 أيام إلى 4 أيام. تأكد من الوصول إلى التقاء 70٪ إلى 80٪ قبل المضي قدما.
- فصل الخلايا عن طريق الحضانة مع التربسين-EDTA لمدة 2-3 دقائق ، والمرور بمعدل 1 مليون خلية لكل قارورة T150.
- قم بتوسيع الخلايا إلى P5. بعد التربسين ، قم بتعليق الخلايا ، وعدها ، ثم الحبيبات عن طريق الطرد المركزي عند 300× جم لمدة 5 دقائق.
- باستخدام ماصة 1000 ميكرولتر ، أعد تعليق الخلايا عند 20 × 106 خلايا / مل في محلول GelMA بنسبة 15٪.
ملاحظة: أطفئ ضوء خزانة السلامة البيولوجية. - باستخدام قفازات معقمة ، اضغط على قالب سيليكون معقم وجاف على طبق بتري. بعد ذلك ، ضع ملحقا واحدا في كل فتحة من قالب السيليكون بالملقط ، بحيث يكون جانب فتحة الملحق متجها لأسفل.
- باستخدام ماصة 200 ميكرولتر ، أضف تعليق الخلية لملء الملحق (~ 50 ميكرولتر لكل إدخال).
- استخدم مصباح يدوي للأشعة فوق البنفسجية (ضوء LED بطول موجي 395 نانومتر) لربط الجزء العلوي من الجل / الإدراج لمدة 1.5 دقيقة. ثم أضيء الجانب الآخر لمدة 30 ثانية. يحدث التشابك عندما يتعرض البادئ الضوئي LAP لضوء الأشعة فوق البنفسجية.
ملاحظة: يمكن الاحتفاظ بتعليق الخلية في الحاضنة خلال هذه الفترة أو حمايته من الضوء. - باستخدام ملقط معقم ، انقل الحشوات على الفور إلى 8 مل من وسط النمو في لوحة غير أنسجية ذات 6 آبار (DMEM مكمل ب 10٪ [v / v] FBS و 1x مضاد حيوي مضاد للفطريات) للسماح للخلايا بالتعافي بين عشية وضحاها.
- فرق الخلايا نحو أربع سلالات.
- لهندسة الأنسجة الدهنية (AT) ، انقل الحشوات إلى 8 مل من الوسط الدهني (AM ؛ ألفا-ميم، 10٪ FBS، 0.2 مللي متر إندوميتاسين، 1x أنسولين-ترانسفيرين-سيلينيوم (ITS)، 0.45 مللي متر 3-إيزوبوتيل-1-ميثيل زانثين، 0.1 ميكرومتر ديكساميثازون، و 1x مضاد حيوي مضاد للفطريات) لبدء التمايز. من الناحية المثالية ، يتم وضع أربعة إدخالات في بئر واحد من صفيحة بئر غير الأنسجة مع 8 مل من الوسط الشحمي. استزرع الخلايا في ألواح البئر لمدة 28 يوما ، مع تغييرات متوسطة كل يوم.
- لهندسة الوحدات العظمية الغضروفية (OC) ، ضع الإدخالات في غرف مفاعل حيوي مزدوج التدفق ، وقم بتغطية الآبار ، وغرس التيارين بشكل منفصل بمعدل تدفق 5 ميكرولتر / دقيقة مع 35 مل من الوسط العظمي (OM; DMEM, 10٪ FBS, 1x مضاد حيوي مضاد للفطريات, 0.1 ميكرومتر ديكساميثازون, 0.01 M β-glycerophosphate, 100 نانوغرام/مل بروتين مورفوجينيك عظمي 7 (BMP7), 50 ميكروغرام/مل حمض الأسكوربيك, و10 نانومتر فيتامين D3) و35 مل من وسط غضروفي (CM; DMEM ، 1x مضاد حيوي مضاد حيوي ، 1x ITS ، 0.1 ميكرومتر ديكساميثازون ، 40 ميكروغرام / مل برولين ، 50 ميكروغرام / مل حمض الأسكوربيك ، و 10 نانوغرام / مل تحويل عامل النمو β3) 10. الحفاظ على تمايز الخلايا لمدة 28 يوما عن طريق إجراء تغييرات متوسطة كل أسبوعين.
- لاشتقاق الخلايا الليفية ، قم بتمييز MSCs في ثقافة ثنائية الأبعاد على مدار 21 يوما في دورق زراعة الأنسجة T150 سم2 باستخدام 20 مل من الوسط الليفي (FM ؛ DMEM المتقدم ، 5٪ FBS ، 1x GlutaMAX ، 1x مضاد حيوي مضاد حيوي ، و 50 ميكروغرام / مل حمض الأسكوربيك). تغيير الوسيط كل أسبوع. استخدم 4 مل من التربسين لفصل الخلايا ، وتغليف المواد الهلامية ثلاثية الأبعاد داخل الإدخالات ، باتباع البروتوكول الموضح أعلاه ، للحصول على الأنسجة الليفية الزليلية (SFT).
ملاحظة: يمكن العثور على تركيبات جميع وسائط التمايز في الجدول 1.
3. إنشاء شريحة miniJoint
- الأوتوكلاف غرف المفاعل الحيوي 3D miniJoint ، أنابيب السيليكون بقطر داخلي 0.062 بوصة وقطر خارجي 0.125 بوصة ، وموصلات F 1/16 Luer-lock. قم بتوصيل أنبوب السيليكون بشوكة المفاعل الحيوي miniJoint في أحد طرفيه ، وقم بتوصيل قفل Luer في الطرف الآخر.
- قم بإعداد AM و OM (إزالة BMP7) وFMCM المذكورة في الخطوة 2.11. بالإضافة إلى ذلك ، قم بإعداد الوسط المشترك المشترك (SM ؛ DMEM الخالي من الفينول الأحمر ، 1x مضاد حيوي مضاد حيوي ، 1x Na-pyruvate ، 1x ITS ، 40 ميكروغرام / مل برولين ، 50 ميكروغرام / مل حمض الأسكوربيك ، و 0.5 نانوغرام / مل عامل النمو المحول β3) لاستخدامها في ثقافة miniJoint . قم بتحميل 35 مل من كل وسط في الخزانات المتوسطة.
- استخدم ملقط مستقيم لنقل الوحدة العظمية الغضروفية من المفاعل الحيوي ثنائي التدفق إلى البئر الأيمن للمفاعل الحيوي miniJoint . نقل إدراج الأنسجة الدهنية وإدخال الأنسجة الليفية في الآبار اليسرى والوسطى ، على التوالي. قم بتغطية جميع الآبار بأغطية معقمة.
- قم بتوصيل مداخل رقاقة miniJoint بالخزانات المتوسطة والمنافذ بالمحاقن (الشكل 3A-C).
- قم بتركيب المحاقن على مضخة حقنة (الشكل 3C) ، وانقل المضخة والرقائق إلى حاضنة. يتم الاحتفاظ بالخزانات المتوسطة على الجليد خارج الحاضنة.
- قم بتشغيل المضخة في وضع السحب ، وسحب الوسط من الخزان المتوسط إلى غرفة المفاعل الحيوي miniJoint . تستمر عملية الاستزراع المشتركة المصغرة هذه 28 يوما.
- لنمذجة التهاب المفاصل وتنكس الغضروف ، أضف إنترلوكين 1β (IL-1β) إلى التيار المتوسط الليفي المنشأ عند 10 نانوغرام / مل. استبدل المحاقن في اليوم الثالث من علاج IL-1β ، وقدم IL-1β طازجا للوسط الليفي المنشأ. يستمر العلاج لمدة 7 أيام.
- أثناء خطوة اختبار الدواء ، بعد 3 أيام من علاج IL-1β ، قم بإعطاء الدواء إما في الوسط المشترك ، ومحاكاة "الإدارة داخل المفصل" (الشكل 3D) عند استخدام الدواء محليا في مفصل الركبة ، أو في جميع الأنواع المتوسطة ، محاكاة "الإدارة الجهازية" (الشكل 3E) عندما يعمل الدواء على مفصل الركبة من خلال الدورة الدموية.
- جمع الأنسجة الفردية لتحليلها بعد 7 أيام من العلاج IL-1β سواء خضعت العينات للعلاج الدوائي لمدة 4 أيام السابقة أم لا.
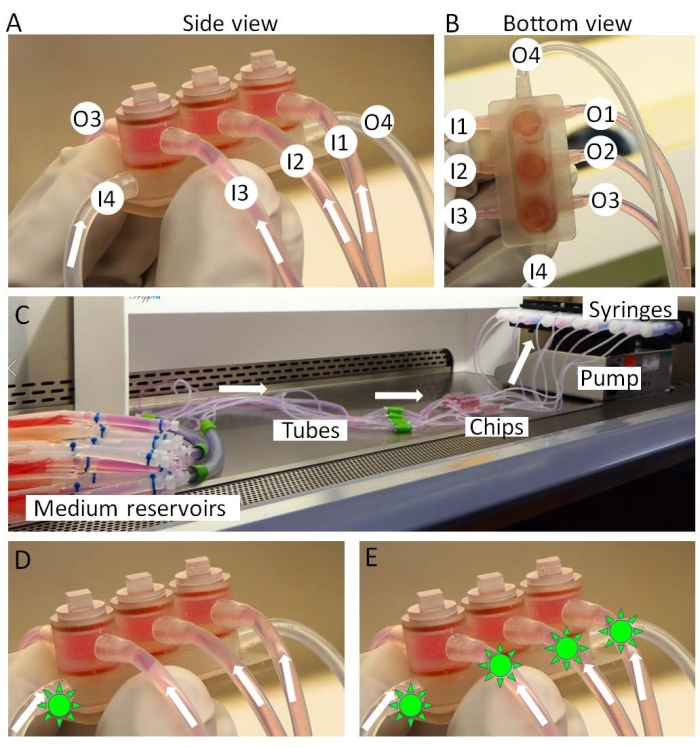
الشكل 3: تجميع المفصل الصغير. (أ ، ب) يتم إدخال الوسائط الخاصة بالأنسجة من المداخل 1-3 (I1-3) ونقلها من المنافذ 1-3 (O1-3). يتم توزيع الوسيط المشترك من I4 إلى O4. (ج) الإعداد الكامل للثقافة المشتركة المصغرة. يمكن إدخال الأدوية (الأشكال الشبيهة بالشمس الخضراء) في (د) الوسط المشترك فقط أو (ه) جميع الوسائط لمحاكاة "الإدارة داخل المفصل" أو "الإدارة الجهازية" على التوالي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. جمع الأنسجة الفردية
- استخدم ملقط منحني معقم لإزالة الحشوات.
- ادفع لكمة خزعة من خلال مركز الملحق لإزالة الجل ، ووضع الجل في برنامج تلفزيوني.
- قطع المواد الهلامية العظمية الغضروفية إلى النصف عند تقييم التعبير الجيني.
ملاحظة: بما أن الجل العظمي الغضروفي يتكون من نوعين من الأنسجة ، فمن المهم فصل الخلايا العظمية والخلايا الغضروفية. - جمع الوسائط والأنسجة المشروطة لإجراء تجارب مختلفة.
- اجمع حوالي 1.5 مل من كل مصدر وسيط.
- قم بتجميد الوسائط المكيفة في النيتروجين السائل بعد الطرد المركزي عند 14000 × جم لمدة 10 دقائق والتخلص من الرواسب.
- بالنسبة للتلطيخ النسيجي والمناعة ، قم أولا بإصلاح عينات OC و SFT في الفورمالين المخزن بنسبة 10٪ ، وقم بتجفيفها في الإيثانول بتركيزات تصاعدية ، وقم بإزالتها في الزيلين ، وقم بتضمينها في البارافين ، وأخيرا قسمها بسمك 6 ميكرومتر.
- بالنسبة للأنسجة الدقيقة AT ، قم بتثبيت العينات في 10٪ من الفورمالين المخزن ، وقم بتلطيخها مباشرة بمحلول Oil Red O أو BODIPY.
Access restricted. Please log in or start a trial to view this content.
النتائج
تم جمع جميع أنسجة المفصل الصغير لتحليل أنماطها الظاهرية بعد 28 يوما من الثقافة في المفصل الصغير (الشكل 4 أ). تم تفصيل ذلك في منشورنا السابق7.
من خلال استخدام RT-qPCR ، والتلوين المناعي ، والتلوين النسيجي ، تم التأكيد على أن الأنماط الظاهرية الخاصة بال?...
Access restricted. Please log in or start a trial to view this content.
Discussion
في هذه المقالة ، نقدم بروتوكولا لإنشاء نظام مفصل الركبة على رقاقة ، حيث يتم تشكيل العظام والغضاريف والأنسجة الدهنية والأنسجة الشبيهة بالغشاء الزليلي من MSCs ويتم استزراعها بشكل مشترك داخل مفاعل حيوي مخصص. يمثل هذا النظام متعدد المكونات المشتق من الخلايا البشرية مع ميزات التوصيل والتشغيل أ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
يعلن المؤلفون عدم وجود مصالح متنافسة.
Acknowledgements
تم دعم هذا البحث في المقام الأول بتمويل من المعاهد الوطنية للصحة (UG3 / UH3TR002136 ، UG3 / UH3TR003090). بالإضافة إلى ذلك ، نشكر الدكتور بول مانر (جامعة واشنطن) على توفير عينات الأنسجة البشرية والدكتور جيان تان لمساعدتهم في عزل MSCs وإنشاء تجمع الخلايا.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 3-isobutyl-1-methylxanthine | Sigma -Aldrich | I17018-1G | |
| 6 well non-tissue culture plate | Corning Falcon® Plates | 351146 | |
| 24 well non-tissue culture plate | Corning Falcon® Plates | 351147 | |
| 30 mL syringes | BD Syringe Luer Lock Cascade Health | 302832 | |
| Alcian blue stain | EK Industries | 1198 | 1% w/v, pH 1.0 |
| Advanced DMEM | Gibco | 12491-015 | |
| αMEM | Gibco | 12571-063 | |
| Antibiotic-antimycotic | Gibco | 15240-062 | |
| Biopsy punch | Integra Miltex | 12-460-407 | |
| BODIPY® fluorophore | Molecular Probes | ||
| Bone morphogenic protein 7 (BMP7) | Peprotech | ||
| Curved forceps | Fisher Brand | 16100110 | |
| DMEM | Gibco | 11995-065 | Dulbecco’s Modified Eagle Medium |
| Dexmethasome | Sigma -Aldrich | 02-05-2002 | |
| E-Shell 450 photopolymer in | EnvisionTec | RES-01-4022 | |
| Fetal Bovine Serum | Gemini-Bio Products | 900-208 | |
| GlutaMAX | Gibco | 3505-061 | |
| gelatin from bovine skin | Hyclone | 1003372809 | |
| Hank’s Balanced Salt Solution | Sigma -Aldrich | SH30588.02 | |
| indomethacin | Sigma -Aldrich | I7378-56 | |
| Insulin-Transferrin-Selenium-Ethanolamine (ITS) | Gibco | 51500-056 | |
| interleukin 1β | Peprotech | 200-01B | |
| Leur-loc connectors | Cole-Parmer Instruments | 45508-50 | |
| L-proline | Sigma -Aldrich | 115388-93-7 | |
| β-glycerophosphate | Sigma -Aldrich | 1003129352 | |
| Medium bags | KiYATEC | FC045 | |
| Methacrylic Anhydride | Sigma -Aldrich | 102378580 | |
| Phosphate buffered Saline | Corning | 21-040-CM | |
| Pointed forceps | Fisher Brand | 12000122 | |
| Silicon mold | McMaster-Carr | RC00114P | |
| Silicon o-rings | McMaster-Carr | ZMCCs1X5 | 1mm x 5mm |
| SolidWorks | Dassault Systèmes SE, Vélizy-Villacoublay, France | ||
| Surgical Blades | Integra Miltex | 4-122 | |
| Syringe pump | Lagato210P, KD Scientific | Z569631 | 10 syringe racks |
| T-182 tissue culture flasks | Fisher Brand | FB012939 | |
| Tissue Culture Dish 150 mm | Fisher Brand | FB012925 | |
| Transforming Growth Factor Beta (TGF-β3) | Peprotech | 100-36E | |
| Trypsin | Gibco | 25200-056 | |
| UV Flashlight | KBS | KB70109 | 395 nm |
| Vida Desktop 3D Printer | EnvisionTec | ||
| Vitamin D3 | Sigma -Aldrich | 32222-06-3 | 1,25-dihydroxyvitamin D3 |
References
- Safiri, S., et al. Global, regional and national burden of osteoarthritis 1990-2017: A systematic analysis of the Global Burden of Disease Study 2017. Annals of the Rheumatic Diseases. 79 (6), 819-828 (2020).
- Lawrence, R. C., et al. Estimates of the prevalence of arthritis and other rheumatic conditions in the United States: Part II. Arthritis and Rheumatism. 58 (1), 26-35 (2008).
- Makarczyk, M. J., et al. Current models for development of disease-modifying osteoarthritis drugs. Tissue Engineering. Part C, Methods. 27 (2), 124-138 (2021).
- He, Y., et al. Pathogenesis of osteoarthritis: risk factors, regulatory pathways in chondrocytes, and experimental models. Biology. 9 (8), 194(2020).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Lin, H., Sohn, J., Shen, H., Langhans, M. T., Tuan, R. S. Bone marrow mesenchymal stem cells: aging and tissue engineering applications to enhance bone healing. Biomaterials. 203, 96-110 (2019).
- Li, Z., et al. Human mesenchymal stem cell-derived miniature joint system for disease modeling and drug testing. Advanced Science. 9 (21), 2105909(2022).
- Lin, H., Cheng, A. W., Alexander, P. G., Beck, A. M., Tuan, R. S. Cartilage tissue engineering application of injectable gelatin hydrogel with in situ visible-light-activated gelation capability in both air and aqueous solution. Tissue Engineering. Part A. 20 (17-18), 2402-2411 (2014).
- Fairbanks, B. D., Schwartz, M. P., Bowman, C. N., Anseth, K. S. Photoinitiated polymerization of PEG-diacrylate with lithium phenyl-2,4,6-trimethylbenzoylphosphinate: polymerization rate and cytocompatibility. Biomaterials. 30 (35), 6702-6707 (2009).
- Lin, H., Lozito, T. P., Alexander, P. G., Gottardi, R., Tuan, R. S. Stem cell-based microphysiological osteochondral system to model tissue response to interleukin-1β. Molecular Pharmaceutics. 11 (7), 2203-2212 (2014).
- Yin, B., et al. Hybrid macro-porous titanium ornamented by degradable 3D gel/nHA micro-scaffolds for bone tissue regeneration. International Journal of Molecular Sciences. 17 (4), 575(2016).
- Lin, Z., et al. Osteochondral tissue chip derived from iPSCs: Modeling OA pathologies and testing drugs. Frontiers in Bioengineering and Biotechnology. 7, 411(2019).
- Atukorala, I., et al. Synovitis in knee osteoarthritis: A precursor of disease. Annals of the Rheumatic Diseases. 75 (2), 390-395 (2016).
- Occhetta, P., et al. Hyperphysiological compression of articular cartilage induces an osteoarthritic phenotype in a cartilage-on-a-chip model. Nature Biomedical Engineering. 3 (7), 545-557 (2019).
- He, C., et al. Modeling early changes associated with cartilage trauma using human-cell-laden hydrogel cartilage models. Stem Cell Research and Therapy. 13 (1), 400(2022).
- Elsissy, J. G., et al. Bacterial septic arthritis of the adult native knee joint: A review. JBJS Reviews. 8 (1), 0059(2020).
- Romero-Lopez, M., et al. Macrophage effects on mesenchymal stem cell osteogenesis in a three-dimensional in vitro bone model. Tissue Engineering. Part A. 26 (19-20), 1099-1111 (2020).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved