Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Creación de una articulación de rodilla en un chip para modelar enfermedades articulares y probar medicamentos
En este artículo
Resumen
Proporcionamos métodos detallados para generar cuatro tipos de tejidos a partir de células madre mesenquimales humanas, que se utilizan para recapitular el cartílago, el hueso, la almohadilla de grasa y la membrana sinovial en la articulación de la rodilla humana. Estos cuatro tejidos se integran en un biorreactor personalizado y se conectan a través de microfluídica, generando así una articulación de rodilla en un chip.
Resumen
La alta prevalencia de enfermedades articulares debilitantes como la osteoartritis (OA) plantea una alta carga socioeconómica. Actualmente, los medicamentos disponibles que se dirigen a los trastornos articulares son en su mayoría paliativos. La necesidad insatisfecha de fármacos eficaces modificadores de la enfermedad (DMOAD) ha sido causada principalmente por la ausencia de modelos apropiados para estudiar los mecanismos de la enfermedad y probar los DMOAD potenciales. Aquí, describimos el establecimiento de un sistema microfisiológico en miniatura que imita la articulación sinovial (miniJoint) que comprende componentes de tejido adiposo, fibroso y osteocondral derivados de células madre mesenquimales humanas (MSC). Para obtener los microtejidos tridimensionales (3D), las MSC se encapsularon en gelatina metacrilatada fotoreticulable antes o después de la diferenciación. Las construcciones de tejido cargadas de células se integraron en un biorreactor impreso en 3D, formando el miniJoint. Se introdujeron flujos separados de medios osteogénicos, fibrogénicos y adipogénicos para mantener los fenotipos tisulares respectivos. Se perfundió una corriente comúnmente compartida a través del cartílago, los tejidos sinoviales y adiposos para permitir la diafonía del tejido. Este patrón de flujo permite la inducción de perturbaciones en uno o más de los componentes del tejido para estudios mecanicistas. Además, los DMOAD potenciales pueden probarse a través de la "administración sistémica" a través de todos los flujos del medio o la "administración intraarticular" agregando los medicamentos solo al flujo compartido de simulación de "líquido sinovial". Por lo tanto, el miniJoint puede servir como una plataforma in vitro versátil para estudiar de manera eficiente los mecanismos de la enfermedad y probar medicamentos en medicina personalizada.
Introducción
Las enfermedades articulares como la osteoartritis (OA) son altamente prevalentes y debilitantes y representan una de las principales causas de discapacidad en todo el mundo1. Se estima que solo en los Estados Unidos, la OA afecta a 27 millones de pacientes y ocurre en el 12.1% de los adultos de 60 años o más de2. Desafortunadamente, la mayoría de los medicamentos utilizados actualmente para controlar las enfermedades articulares son paliativos, y no hay medicamentos eficaces modificadores de la enfermedad (DMOA) disponibles3. Esta necesidad médica no satisfecha se deriva principalmente de la ausencia de un modelo eficaz para estudiar los mecanismos de la enfermedad y desarrollar posibles DMOAD. El cultivo celular bidimensional convencional (2D) no refleja la naturaleza 3D de los tejidos articulares, y el cultivo de explantes tisulares a menudo se ve obstaculizado por una muerte celular significativa y generalmente no logra replicar las interconexiones tisulares dinámicas4. Además, las diferencias genéticas y anatómicas reducen significativamente la relevancia fisiológica de los modelos animales4.
Los órganos en chips (OoC), o sistemas microfisiológicos, son un campo de investigación prometedor en la interfaz de la ingeniería, la biología y la medicina. Estas plataformas in vitro son unidades funcionales mínimas que replican características sanas o patológicas definidas de sus contrapartes in vivo 5. Además, estos sistemas miniaturizados pueden albergar diversas células y matrices y simular las interacciones biofísicas y bioquímicas entre diferentes tejidos. Por lo tanto, un sistema microfisiológico que pueda recapitular fielmente la articulación sinovial nativa promete ofrecer una plataforma efectiva para modelar enfermedades articulares y desarrollar posibles DMOAD.
Las células madre mesenquimales humanas (MSC) pueden aislarse de muchos tejidos en todo el cuerpo y diferenciarse en linajes osteogénicos, condrogénicos y adipogénicos6. Las MSC se han utilizado con éxito para diseñar diversos tejidos, incluidos el hueso, el cartílago y el tejido adiposo6, lo que significa que representan una fuente celular prometedora para la ingeniería de los componentes tisulares de la articulación de la rodilla. Recientemente desarrollamos un sistema microfisiológico en miniatura que imita las articulaciones, llamado miniJoint, que comprende hueso, cartílago, fibroso y tejido adiposo derivado de MSC7. En particular, el novedoso diseño permite la diafonía del tejido por flujo microfluídico o permeación (Figura 1). Aquí, presentamos los protocolos para la fabricación de los componentes del chip, la ingeniería de los componentes del tejido, el cultivo de los tejidos diseñados en el chip y la colección de tejidos para análisis posteriores.
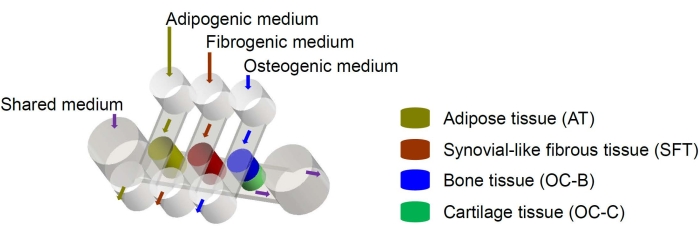
Figura 1: Esquema del chip miniJoint que muestra la disposición de los diferentes componentes tisulares y flujos del medio. OC = tejido osteocondral. Haga clic aquí para ver una versión más grande de esta figura.
Access restricted. Please log in or start a trial to view this content.
Protocolo
El siguiente protocolo sigue las pautas éticas de la Universidad de Pittsburgh y el comité de ética de investigación humana de la Universidad de Pittsburgh. La información sobre los materiales utilizados en este estudio se enumera en la Tabla de materiales.
1. Fabricación de biorreactores impresos en 3D
- Utilice un software informático para diseñar biorreactores osteocondrales (Figura 2A) y miniJoint (Figura 2B) que incluyan cámaras, insertos y tapas. La información de dimensión de cada pieza se muestra en la figura S1.
- Transfiera el diseño a una impresora 3D e imprima con una tinta de fotopolímero.
- Enjuague las piezas impresas en 3D (Figura 2C-F) con 15 ml de etanol al 95% tres veces. Luego, entrecruza completamente las piezas impresas durante 200 s en un dispositivo de polimerización de linterna.
- Agregue juntas tóricas a los insertos y tapas (Figura 2C, D) y compruebe si las piezas encajan (Figura 2G, H).

Figura 2: Fabricación de los diferentes componentes para hacer el biorreactor miniJoint. (A,B), modelos 3D de biorreactores para crear chips (A) osteocondrales y (B) miniJoint. (C,D) tapas (C) impresas en 3D (C) e insertos (D) con la junta tórica instalada. (E,F) cámaras impresas en 3D para (E) cultivo de tejido osteocondral y (F) minijoint. (G,H) Montaje de chips (G) osteocondrales y (H) miniJoint chips. Haga clic aquí para ver una versión más grande de esta figura.
2. Ingeniería de los componentes del tejido
NOTA: Los procesos para la fabricación de fenil-2,4,6-trimetilbenzoilofinato de litio (LAP) y gelatina metacrilada (GelMA) están descritos en estudios previos 8,9.
- Para crear GelMA, siga los pasos a continuación.
- Añadir 17 g de gelatina tipo B a 500 ml de agua destilada, y luego mezclar en una coctelera durante 30 minutos a 37 °C.
- A continuación, añadir 13 ml de anhídrido metacrílico, colocar de nuevo en el agitador a 37 °C y dejar agitar durante la noche.
- Al día siguiente, alícuota el GelMA en bolsas de diálisis individuales, con ~60 ml en cada bolsa.
- Coloque todas las bolsas de diálisis en agua destilada con una barra de agitación y espere 7 días de diálisis. Cambie el agua varias veces al día y deje las bolsas a 4 °C durante la noche.
- El día 7, congelar el GelMA a -80 °C. Una vez completamente congelado, proceder a la liofilización.
- Coloque el GelMA en un plato en la cámara de vacío de un liofilizador y permita la liofilización. Asegúrese de que el GelMA esté completamente seco antes de retirarlo del liofilizador.
- Disuelva el GelMA en la solución salina equilibrada de Hank (HBSS con Ca 2+ y Mg2+) al 15% (p/v). Para asegurarse de que el pH esté en 7.4, agregue NaOH en pequeñas cantidades hasta que el pH alcance 7.4. Complementar la solución con 1x antibiótico-antimicótico y LAP al 0,15% (p/v) en función del volumen adquirido. Guarde la solución de GelMA al 15% a -20 °C hasta su uso y protéjala de la luz.
- Coloque las cámaras, tapas e inserciones de biorreactores de doble flujo impresas en 3D en bolsas de autoclave, y autoclave a 121 °C durante 20 min con vapor y luego durante 20 min con calor seco.
- Dentro del gabinete de seguridad biológica, remoje las cámaras, tapas e insertos del biorreactor en 15 ml de solución salina estéril tamponada con fosfato durante la noche, después de lo cual deje que se sequen.
- Aislar las MSC derivadas de la médula ósea humana de los desechos quirúrgicos totales de artroplastia articular con la aprobación del IRB (Universidad de Pittsburgh y Universidad de Washington).
- Específicamente, elimine la médula ósea del hueso trabecular del cuello y la cabeza femoral, y vuelva a suspenderla en el Medio de Águila Modificada de Dulbecco (DMEM).
- Filtrar la suspensión a través de un filtro de 40 μm y centrifugar el flujo a 300 x g durante 5 min.
- Retire el sobrenadante, resuspenda los gránulos utilizando un medio de crecimiento [DMEM, suero bovino fetal al 10% (FBS) y 1x antibiótico-antimicótico], y luego colóquelos en matraces de cultivo de tejidos.
- Cambie el medio de cultivo cada 3 días a 4 días. Asegúrese de que se alcance una confluencia del 70% al 80% antes de continuar.
- Separar las células incubando con tripsina-EDTA durante 2-3 min, y pasar en una proporción de 1 millón de células por matraz T150.
- Expanda las celdas a P5. Después de la tripsinización, suspender las células, contarlas y luego granular centrifugando a 300x g durante 5 min.
- Con una pipeta de 1.000 μL, resuspender las células a 20 x 106 células/ml en una solución de GelMA al 15%.
NOTA: Apague la luz del armario de seguridad biológica. - Con guantes estériles, presione un molde de silicona estéril y seco contra una placa de Petri. Luego, coloque un inserto en cada orificio del molde de silicona con pinzas, con el lado del orificio del inserto hacia abajo.
- Con una pipeta de 200 μL, agregue la suspensión celular para llenar el inserto (~ 50 μL por inserto).
- Utilice una linterna UV (luz LED con una longitud de onda de 395 nm) para entrecruzar la parte superior del gel/inserto durante 1,5 min. Luego, ilumine el otro lado durante 30 s. La reticulación ocurre cuando el fotoiniciador LAP se expone a la luz UV.
NOTA: La suspensión celular puede mantenerse en la incubadora durante este período o protegida de la luz. - Con fórceps estériles, transfiera inmediatamente los insertos a 8 ml de medio de crecimiento en una placa de 6 pocillos sin cultivo tisular (DMEM suplementado con 10% [v / v] FBS y 1x antibiótico-antimicótico) para permitir que las células se recuperen durante la noche.
- Diferenciar las células hacia cuatro linajes.
- Para diseñar tejido adiposo (AT), transfiera los insertos a 8 mL de medio adipogénico (AM; Alfa-MEM, 10% FBS, 0,2 mM de indometacina, 1x insulina-transferrina-selenio (ITS), 0,45 mM 3-isobutil-1-metilxantina, 0,1 μM dexametasona y 1x antibiótico-antimicótico) para iniciar la diferenciación. Idealmente, se colocan cuatro insertos en un solo pocillo de una placa de pozo de cultivo no tisular con 8 mL de medio adipogénico. Cultive las células en las placas del pozo durante 28 días, con cambios medios cada dos días.
- Para diseñar las unidades osteocondrales (OC), coloque los insertos en cámaras de biorreactores de doble flujo, tape los pocillos e infunda las dos corrientes por separado a un caudal de 5 μL / min con 35 ml de medio osteogénico (OM; DMEM, 10% FBS, 1x antibiótico-antimicótico, 0.1 μM dexametasona, 0.01 M β-glicerofosfato, 100 ng/mL proteína morfogénica ósea 7 (BMP7), 50 μg/mL de ácido ascórbico y 10 nM vitamina D3) y 35 mL de medio condrogénico (CM; DMEM, 1x antibiótico-antimicótico, 1x ITS, 0,1 μM dexametasona, 40 μg/ml de prolina, 50 μg/ml de ácido ascórbico y 10 ng/ml de factor de crecimiento transformante β3)10. Mantener la diferenciación celular durante 28 días realizando cambios quincenales de medio.
- Para derivar los fibroblastos, diferenciar las MSC en cultivo 2D durante 21 días en un matraz de cultivo tisular T150 cm2 utilizando 20 mL de medio fibrogénico (FM; DMEM avanzado, 5% FBS, 1x GlutaMAX, 1x antibiótico-antimicótico y 50 μg/mL de ácido ascórbico). Cambia el medio cada semana. Use 4 ml de tripsina para separar las células y encapsule los geles 3D dentro de los insertos, siguiendo el protocolo descrito anteriormente, para obtener tejido fibroso similar sinovial (SFT).
NOTA: Las composiciones de todos los medios de diferenciación se pueden encontrar en la Tabla 1.
3. Establecimiento del chip miniJoint
- Autoclave las cámaras de biorreactor 3D miniJoint, tubos de silicona con un diámetro interior de 0.062 pulgadas y un diámetro exterior de 0.125 pulgadas, y conectores Luer-lock F 1/16. Conecte el tubo de silicona a la púa del biorreactor miniJoint en un extremo y conecte el bloqueo Luer en el otro extremo.
- Prepare el AM, OM (eliminando BMP7) y FMCM mencionados en el paso 2.11. Además, prepare el medio común compartido (SM; DMEM libre de rojo de fenol, 1x antibiótico-antimicótico, 1x Na-piruvato, 1x ITS, 40 μg/ml de prolina, 50 μg/ml de ácido ascórbico y 0,5 ng/ml de factor de crecimiento transformante β3) que se utilizará para el cultivo de miniJoint. Cargue 35 mL de cada medio en los reservorios medianos.
- Utilice pinzas rectas para transferir la unidad osteocondral del biorreactor de doble flujo al pocillo derecho del biorreactor miniJoint. Transfiera el inserto de tejido adiposo y el inserto de tejido fibroso a los pocillos izquierdo y medio, respectivamente. Tapa todos los pozos con tapas esterilizadas.
- Conecte las entradas del chip miniJoint a los depósitos medianos y las salidas a las jeringas (Figura 3A-C).
- Monte las jeringas en una bomba de jeringa (Figura 3C) y transfiera la bomba y los chips a una incubadora. Los depósitos medianos se mantienen en hielo fuera de la incubadora.
- Opere la bomba en el modo de extracción, extrayendo el medio del depósito del medio a la cámara del biorreactor miniJoint. Este proceso de cultivo miniJoint dura 28 días.
- Para modelar la inflamación articular y la degeneración del cartílago, agregue interleucina 1β (IL-1β) a la corriente del medio fibrogénico a 10 ng / ml. Reemplace las jeringas al tercer día de tratamiento con IL-1β y proporcione IL-1β fresca al medio fibrogénico. El tratamiento dura 7 días.
- Durante la etapa de prueba de drogas, después de 3 días de tratamiento con IL-1β, administrar el medicamento en el medio compartido, simulando una "administración intraarticular" (Figura 3D) cuando el medicamento se usa localmente en la articulación de la rodilla, o en todos los tipos de medios, simulando una "administración sistémica" (Figura 3E) cuando el medicamento actúa sobre la articulación de la rodilla a través de la circulación.
- Recolectar tejidos individuales para su análisis después de 7 días de tratamiento con IL-1β, independientemente de si las muestras se sometieron o no a tratamiento farmacológico durante los 4 días anteriores.
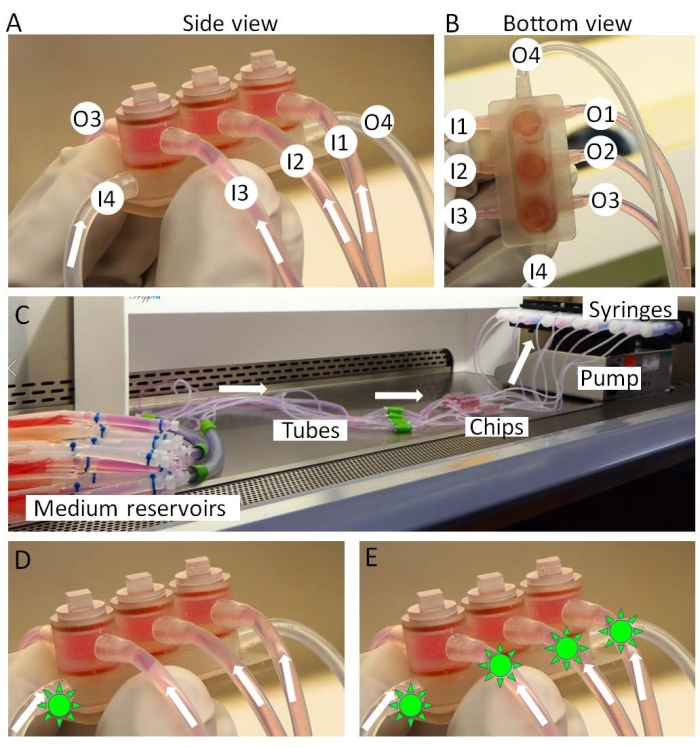
Figura 3: Montaje de la miniJoint. (A,B) Los medios específicos de tejido se introducen desde las entradas 1-3 (I1-3) y se mueven desde las salidas 1-3 (O1-3). El medio compartido se perfunde de I4 a O4. (C) La configuración completa de la cultura miniJoint. Los fármacos (formas verdes parecidas al sol) pueden introducirse en (D) el medio compartido solamente o (E) todos los medios para simular respectivamente "administración intraarticular" o "administración sistémica". Haga clic aquí para ver una versión más grande de esta figura.
4. Recolección individual de tejidos
- Use pinzas curvas estériles para retirar los insertos.
- Empuje un punzón de biopsia a través del centro del inserto para extraer el gel y coloque el gel en PBS.
- Cortar los geles osteocondrales por la mitad al evaluar la expresión génica.
NOTA: Dado que el gel osteocondral consta de dos tipos de tejidos, es importante separar las células osteogénicas y condrogénicas. - Recolectar los medios y tejidos acondicionados para varios experimentos.
- Recoja alrededor de 1,5 ml de cada fuente mediana.
- Congelar rápidamente el medio acondicionado en nitrógeno líquido después de centrifugar a 14.000 x g durante 10 minutos y desechar el sedimento.
- Para la tinción histológica y la inmunotinción, primero fijar las muestras de AO y SFT en formalina tamponada al 10%, deshidratarlas en etanol de concentraciones ascendentes, limpiarlas en xileno, incrustarlas en parafina y, finalmente, seccionarlas a un espesor de 6 μm.
- Para los microtejidos AT, fijar las muestras en formalina tamponada al 10% y teñirlas directamente con solución Oil Red O o BODIPY.
Access restricted. Please log in or start a trial to view this content.
Resultados
Todos los tejidos de la miniJoint fueron recolectados para analizar sus fenotipos después de 28 días de cultivo en la miniJoint (Figura 4A). Esto se ha detallado en nuestra publicación anterior7.
Mediante el uso de RT-qPCR, inmunotinción y tinción histológica, se confirmó que los fenotipos específicos de tejido estaban bien mantenidos para los microtejidos individuales (Figura 4). Por ejemplo, el compon...
Access restricted. Please log in or start a trial to view this content.
Discusión
En este artículo, presentamos un protocolo para crear un sistema de articulación de rodilla en un chip, en el que el hueso, el cartílago, el tejido adiposo y los tejidos similares a la membrana sinovial se forman a partir de MSC y se cocultivan dentro de un biorreactor personalizado. Este sistema multicomponente derivado de células humanas con características plug-and-play representa una nueva herramienta para estudiar la patogénesis de las enfermedades articulares y desarrollar fármacos.
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores declaran que no hay intereses contrapuestos.
Agradecimientos
Esta investigación fue apoyada principalmente por fondos de los Institutos Nacionales de Salud (UG3 / UH3TR002136, UG3 / UH3TR003090). Además, agradecemos al Dr. Paul Manner (Universidad de Washington) por proporcionar las muestras de tejido humano y al Dr. Jian Tan por su ayuda para aislar las MSC y crear el grupo celular.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| 3-isobutyl-1-methylxanthine | Sigma -Aldrich | I17018-1G | |
| 6 well non-tissue culture plate | Corning Falcon® Plates | 351146 | |
| 24 well non-tissue culture plate | Corning Falcon® Plates | 351147 | |
| 30 mL syringes | BD Syringe Luer Lock Cascade Health | 302832 | |
| Alcian blue stain | EK Industries | 1198 | 1% w/v, pH 1.0 |
| Advanced DMEM | Gibco | 12491-015 | |
| αMEM | Gibco | 12571-063 | |
| Antibiotic-antimycotic | Gibco | 15240-062 | |
| Biopsy punch | Integra Miltex | 12-460-407 | |
| BODIPY® fluorophore | Molecular Probes | ||
| Bone morphogenic protein 7 (BMP7) | Peprotech | ||
| Curved forceps | Fisher Brand | 16100110 | |
| DMEM | Gibco | 11995-065 | Dulbecco’s Modified Eagle Medium |
| Dexmethasome | Sigma -Aldrich | 02-05-2002 | |
| E-Shell 450 photopolymer in | EnvisionTec | RES-01-4022 | |
| Fetal Bovine Serum | Gemini-Bio Products | 900-208 | |
| GlutaMAX | Gibco | 3505-061 | |
| gelatin from bovine skin | Hyclone | 1003372809 | |
| Hank’s Balanced Salt Solution | Sigma -Aldrich | SH30588.02 | |
| indomethacin | Sigma -Aldrich | I7378-56 | |
| Insulin-Transferrin-Selenium-Ethanolamine (ITS) | Gibco | 51500-056 | |
| interleukin 1β | Peprotech | 200-01B | |
| Leur-loc connectors | Cole-Parmer Instruments | 45508-50 | |
| L-proline | Sigma -Aldrich | 115388-93-7 | |
| β-glycerophosphate | Sigma -Aldrich | 1003129352 | |
| Medium bags | KiYATEC | FC045 | |
| Methacrylic Anhydride | Sigma -Aldrich | 102378580 | |
| Phosphate buffered Saline | Corning | 21-040-CM | |
| Pointed forceps | Fisher Brand | 12000122 | |
| Silicon mold | McMaster-Carr | RC00114P | |
| Silicon o-rings | McMaster-Carr | ZMCCs1X5 | 1mm x 5mm |
| SolidWorks | Dassault Systèmes SE, Vélizy-Villacoublay, France | ||
| Surgical Blades | Integra Miltex | 4-122 | |
| Syringe pump | Lagato210P, KD Scientific | Z569631 | 10 syringe racks |
| T-182 tissue culture flasks | Fisher Brand | FB012939 | |
| Tissue Culture Dish 150 mm | Fisher Brand | FB012925 | |
| Transforming Growth Factor Beta (TGF-β3) | Peprotech | 100-36E | |
| Trypsin | Gibco | 25200-056 | |
| UV Flashlight | KBS | KB70109 | 395 nm |
| Vida Desktop 3D Printer | EnvisionTec | ||
| Vitamin D3 | Sigma -Aldrich | 32222-06-3 | 1,25-dihydroxyvitamin D3 |
Referencias
- Safiri, S., et al. Global, regional and national burden of osteoarthritis 1990-2017: A systematic analysis of the Global Burden of Disease Study 2017. Annals of the Rheumatic Diseases. 79 (6), 819-828 (2020).
- Lawrence, R. C., et al. Estimates of the prevalence of arthritis and other rheumatic conditions in the United States: Part II. Arthritis and Rheumatism. 58 (1), 26-35 (2008).
- Makarczyk, M. J., et al. Current models for development of disease-modifying osteoarthritis drugs. Tissue Engineering. Part C, Methods. 27 (2), 124-138 (2021).
- He, Y., et al. Pathogenesis of osteoarthritis: risk factors, regulatory pathways in chondrocytes, and experimental models. Biology. 9 (8), 194(2020).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Lin, H., Sohn, J., Shen, H., Langhans, M. T., Tuan, R. S. Bone marrow mesenchymal stem cells: aging and tissue engineering applications to enhance bone healing. Biomaterials. 203, 96-110 (2019).
- Li, Z., et al. Human mesenchymal stem cell-derived miniature joint system for disease modeling and drug testing. Advanced Science. 9 (21), 2105909(2022).
- Lin, H., Cheng, A. W., Alexander, P. G., Beck, A. M., Tuan, R. S. Cartilage tissue engineering application of injectable gelatin hydrogel with in situ visible-light-activated gelation capability in both air and aqueous solution. Tissue Engineering. Part A. 20 (17-18), 2402-2411 (2014).
- Fairbanks, B. D., Schwartz, M. P., Bowman, C. N., Anseth, K. S. Photoinitiated polymerization of PEG-diacrylate with lithium phenyl-2,4,6-trimethylbenzoylphosphinate: polymerization rate and cytocompatibility. Biomaterials. 30 (35), 6702-6707 (2009).
- Lin, H., Lozito, T. P., Alexander, P. G., Gottardi, R., Tuan, R. S. Stem cell-based microphysiological osteochondral system to model tissue response to interleukin-1β. Molecular Pharmaceutics. 11 (7), 2203-2212 (2014).
- Yin, B., et al. Hybrid macro-porous titanium ornamented by degradable 3D gel/nHA micro-scaffolds for bone tissue regeneration. International Journal of Molecular Sciences. 17 (4), 575(2016).
- Lin, Z., et al. Osteochondral tissue chip derived from iPSCs: Modeling OA pathologies and testing drugs. Frontiers in Bioengineering and Biotechnology. 7, 411(2019).
- Atukorala, I., et al. Synovitis in knee osteoarthritis: A precursor of disease. Annals of the Rheumatic Diseases. 75 (2), 390-395 (2016).
- Occhetta, P., et al. Hyperphysiological compression of articular cartilage induces an osteoarthritic phenotype in a cartilage-on-a-chip model. Nature Biomedical Engineering. 3 (7), 545-557 (2019).
- He, C., et al. Modeling early changes associated with cartilage trauma using human-cell-laden hydrogel cartilage models. Stem Cell Research and Therapy. 13 (1), 400(2022).
- Elsissy, J. G., et al. Bacterial septic arthritis of the adult native knee joint: A review. JBJS Reviews. 8 (1), 0059(2020).
- Romero-Lopez, M., et al. Macrophage effects on mesenchymal stem cell osteogenesis in a three-dimensional in vitro bone model. Tissue Engineering. Part A. 26 (19-20), 1099-1111 (2020).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados