Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Eklem hastalıklarını modellemek ve ilaçları test etmek için çip üzerinde diz eklemi oluşturulması
Bu Makalede
Özet
İnsan diz eklemindeki kıkırdak, kemik, yağ yastığı ve sinovyumu özetlemek için kullanılan insan mezenkimal kök hücrelerinden dört tip doku üretmek için ayrıntılı yöntemler sunuyoruz. Bu dört doku özelleştirilmiş bir biyoreaktöre entegre edilir ve mikroakışkanlar yoluyla bağlanır, böylece çip üzerinde bir diz eklemi oluşturur.
Özet
Osteoartrit (OA) gibi zayıflatıcı eklem hastalıklarının yüksek prevalansı yüksek sosyoekonomik yük oluşturmaktadır. Günümüzde eklem bozukluklarını hedef alan mevcut ilaçlar çoğunlukla palyatiftir. Etkili hastalık modifiye edici OA ilaçlarına (DMOAD'ler) yönelik karşılanmamış ihtiyaç, öncelikle hastalık mekanizmalarını incelemek ve potansiyel DMOAD'leri test etmek için uygun modellerin bulunmamasından kaynaklanmaktadır. Burada, insan mezenkimal kök hücrelerinden (MSC'ler) türetilen adipoz, fibröz ve osteokondral doku bileşenlerinden oluşan minyatür bir sinovyal eklem taklit eden mikrofizyolojik sistemin (miniJoint) kurulmasını tarif ediyoruz. Üç boyutlu (3D) mikrodokuları elde etmek için, MSC'ler farklılaşmadan önce veya sonra fotoçapraz bağlanabilir metakrillenmiş jelatin içinde kapsüllendi. Hücre yüklü doku yapıları daha sonra miniJoint'i oluşturan 3D baskılı bir biyoreaktöre entegre edildi. İlgili doku fenotiplerini korumak için ayrı osteojenik, fibrojenik ve adipojenik ortam akışları tanıtıldı. Yaygın olarak paylaşılan bir akış, doku çapraz karışmasını sağlamak için kıkırdak, sinovyal ve yağ dokuları boyunca perfüze edildi. Bu akış paterni, mekanik çalışmalar için bir veya daha fazla doku bileşeninde pertürbasyonların indüksiyonuna izin verir. Ayrıca, potansiyel DMOAD'ler, tüm ortam akışları boyunca "sistemik uygulama" veya ilaçları yalnızca paylaşılan "sinovyal sıvı" simüle eden akışa ekleyerek "eklem içi uygulama" yoluyla test edilebilir. Böylece, miniJoint, hastalık mekanizmalarını verimli bir şekilde incelemek ve kişiselleştirilmiş tıpta ilaçları test etmek için çok yönlü bir in vitro platform olarak hizmet edebilir.
Giriş
Osteoartrit (OA) gibi eklem hastalıkları oldukça yaygın ve zayıflatıcıdır ve dünya çapında önde gelen bir sakatlık nedenini temsil etmektedir1. Sadece ABD'de OA'nın 27 milyon hastayı etkilediği ve 60 yaş ve üstü yetişkinlerin% 12.1'inde ortaya çıktığıtahmin edilmektedir. Ne yazık ki, şu anda eklem hastalıklarını yönetmek için kullanılan ilaçların çoğu palyatiftir ve etkili bir hastalık modifiye edici OA ilacı (DMOAD) mevcut değildir3. Bu karşılanmamış tıbbi ihtiyaç, öncelikle hastalık mekanizmalarını incelemek ve potansiyel DMOAD'leri geliştirmek için etkili bir modelin bulunmamasından kaynaklanmaktadır. Geleneksel iki boyutlu (2B) hücre kültürü, eklem dokularının 3B doğasını yansıtmaz ve doku eksplantlarının kültürü genellikle önemli hücre ölümü tarafından engellenir ve genellikle dinamik doku ara bağlantılarını çoğaltmada başarısız olur4. Ek olarak, genetik ve anatomik farklılıklar hayvan modellerinin fizyolojik alaka düzeyini önemli ölçüde azaltır4.
Çip üzerindeki organlar (OoC'ler) veya mikrofizyolojik sistemler, mühendislik, biyoloji ve tıp arayüzünde umut verici bir araştırma alanıdır. Bu in vitro platformlar, in vivo muadillerinin tanımlanmış sağlıklı veya patolojik özelliklerini kopyalayan minimal fonksiyonel birimlerdir5. Ayrıca, bu minyatür sistemler çeşitli hücrelere ve matrislere ev sahipliği yapabilir ve farklı dokular arasındaki biyofiziksel ve biyokimyasal etkileşimleri simüle edebilir. Bu nedenle, doğal sinovyal eklemi sadık bir şekilde özetleyebilen mikrofizyolojik bir sistem, eklem hastalıklarını modellemek ve potansiyel DMOAD'leri geliştirmek için etkili bir platform sunmayı vaat ediyor.
İnsan mezenkimal kök hücreleri (MSC'ler) vücuttaki birçok dokudan izole edilebilir ve osteojenik, kondrojenik ve adipojenik soylara ayrılabilir6. MSC'ler kemik, kıkırdak ve yağ dokusu6 dahil olmak üzere çeşitli dokuların mühendisliğini yapmak için başarıyla kullanılmıştır, bu nedenle diz ekleminin doku bileşenlerinin mühendisliği için umut verici bir hücre kaynağını temsil ettikleri anlamına gelir. Yakın zamanda, MSC kaynaklı kemik, kıkırdak, fibröz ve yağ dokularından oluşan miniJoint adlı minyatür eklem taklit eden mikrofizyolojik bir sistem geliştirdik7. Özellikle, yeni tasarım, mikroakışkan akış veya geçirgenlik yoluyla doku çapraz karışmasını sağlar (Şekil 1). Burada, çip bileşenlerinin imalatı, doku bileşenlerinin mühendisliği, çipteki mühendislik dokularının kültürü ve aşağı akış analizleri için dokuların toplanması için protokolleri sunuyoruz.
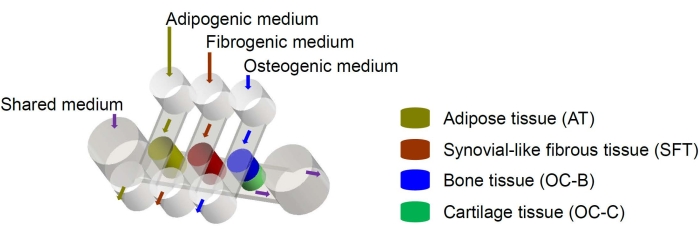
Şekil 1: Farklı doku bileşenlerinin ve ortam akışlarının düzenini gösteren miniJoint çipinin şeması. OC = osteokondral doku. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Access restricted. Please log in or start a trial to view this content.
Protokol
Aşağıdaki protokol, Pittsburgh Üniversitesi'nin ve Pittsburgh Üniversitesi'nin insan araştırmaları etik komitesinin etik kurallarını izlemektedir. Bu çalışmada kullanılan malzemelerle ilgili bilgiler Malzeme Tablosunda listelenmiştir.
1. 3D baskılı biyoreaktörlerin üretimi
- Odacıklar, ekler ve kapaklar içeren osteokondral (Şekil 2A) ve miniJoint biyoreaktörlerini (Şekil 2B) tasarlamak için bir bilgisayar yazılımı kullanın. Her parçanın boyut bilgileri Şekil S1'de gösterilmiştir.
- Tasarımı bir 3D yazıcıya aktarın ve fotopolimer mürekkeple yazdırın.
- 3D yazdırılmış parçaları (Şekil 2C-F) 15 mL% 95 etanol ile üç kez durulayın. Ardından, basılı parçaları bir el feneri polimerizasyon cihazında 200 s boyunca tamamen çapraz bağlayın.
- Kesici uçlara ve kapaklara O-halkalar ekleyin (Şekil 2C, D) ve parçaların sığıp sığmadığını test edin (Şekil 2G, H).

Şekil 2: MiniJoint biyoreaktörünü yapmak için farklı bileşenlerin imalatı. (A,B), (A) osteokondral ve (B) miniJoint çipleri oluşturmak için biyoreaktörlerin 3D modelleri. (C,D) 3D baskılı (C) kapaklar ve O-ring takılı (D) ekler. (E, F) (E) osteokondral ve (F) miniJoint doku kültürü için 3D baskılı odalar. (G,H) (G) osteokondral ve (H) miniJoint çiplerinin montajı. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
2. Doku bileşenlerinin mühendisliği
NOT: Lityum fenil-2,4,6-trimetilbenzoilfosfinat (LAP) ve metakrillenmiş jelatin (GelMA) üretimi için proseslerönceki çalışmalarda açıklanmıştır 8,9.
- GelMA'yı oluşturmak için aşağıdaki adımları izleyin.
- 500 mL damıtılmış suya 17 g jelatin Tip B ekleyin ve ardından 37 ° C'de 30 dakika boyunca bir çalkalayıcıda karıştırın.
- Ardından, 13 mL metakrilik anhidrit ekleyin, 37 ° C çalkalayıcıya geri yerleştirin ve gece boyunca çalkalanmaya bırakın.
- Ertesi gün, GelMA'yı her torbada ~ 60 mL olacak şekilde ayrı diyaliz torbalarına alın.
- Tüm diyaliz torbalarını bir karıştırma çubuğu ile damıtılmış suya koyun ve 7 gün diyaliz bekletin. Suyu günde birkaç kez değiştirin ve torbaları gece boyunca 4 ° C'de bırakın.
- 7. günde, GelMA'yı -80 ° C'de dondurun. Tamamen dondurulduktan sonra, liyofilizasyona devam edin.
- GelMA'yı bir liyofilizatörün vakum odasındaki bir kaba yerleştirin ve dondurarak kurumaya bırakın. Liyofilizatörden çıkarmadan önce GelMA'nın tamamen kuruduğundan emin olun.
- GelMA'yı Hank'in dengeli tuz çözeltisinde (Ca 2+ ve Mg2+ ile HBSS) %15'te (w/v) çözün. PH'ın 7.4'te olmasını sağlamak için, pH 7.4'e ulaşana kadar küçük miktarlarda NaOH ekleyin. Çözeltiyi, elde edilen hacme bağlı olarak 1x antibiyotik-antimikotik ve% 0.15 (w / v) LAP ile destekleyin. %15 GelMA çözeltisini kullanana kadar -20 °C'de saklayın ve ışıktan koruyun.
- 3D baskılı çift akışlı biyoreaktör odalarını, kapaklarını ve eklerini otoklav torbalarına yerleştirin ve otoklavı 121 ° C'de buharla 20 dakika ve ardından kuru ısıyla 20 dakika boyunca yerleştirin.
- Biyolojik güvenlik kabininin içinde, biyoreaktör odalarını, kapaklarını ve uçlarını gece boyunca 15 mL steril fosfat tamponlu salin içine batırın, ardından kurumaya bırakın.
- İnsan kemik iliği kaynaklı MSC'leri IRB onayı ile toplam eklem artroplastisi cerrahi atıklarından izole edin (Pittsburgh Üniversitesi ve Washington Üniversitesi).
- Spesifik olarak, kemik iliğini femur boynunun ve başının trabeküler kemiğinden temizleyin ve Dulbecco'nun Modifiye Kartal Ortamında (DMEM) yeniden askıya alın.
- Süspansiyonu 40 μm'lik bir süzgeçten geçirin ve akışı 300 x g'de 5 dakika boyunca santrifüj edin.
- Süpernatanı çıkarın, büyüme ortamı [DMEM,% 10 fetal sığır serumu (FBS) ve 1x antibiyotik-antimikotik] kullanarak peletleri yeniden askıya alın ve ardından doku kültürü şişelerine yerleştirin.
- Kültür ortamını her 3 günde bir 4 güne değiştirin. Daha fazla ilerlemeden önce% 70 ila% 80'lik bir birleşmeye ulaşıldığından emin olun.
- Tripsin-EDTA ile 2-3 dakika inkübe ederek hücreleri ayırın ve T150 şişesi başına 1 milyon hücre oranında geçiş yapın.
- Hücreleri P5'e genişletin. Tripsinizasyondan sonra, hücreleri askıya alın, sayın ve ardından 5 dakika boyunca 300x g'de santrifüj yaparak pelet yapın.
- 1.000 μL pipet ile hücreleri %15 GelMA çözeltisi içinde 20 x 106 hücre/mL'de yeniden askıya alın.
NOT: Biyolojik güvenlik kabininin ışığını kapatın. - Steril eldivenler kullanarak, steril, kuru bir silikon kalıbı Petri kabına bastırın. Ardından, silikon kalıbın her bir deliğine forsepsli bir uç yerleştirin, kesici ucun delik tarafı aşağı bakacak şekilde yerleştirin.
- 200 μL'lik bir pipet kullanarak, kesici ucu doldurmak için hücre süspansiyonunu ekleyin (kesici uç başına ~50 μL).
- Jelin / kesici ucun üst kısmını 1,5 dakika boyunca çapraz bağlamak için bir UV el feneri (395 nm dalga boyuna sahip LED ışığı) kullanın. Ardından, diğer tarafı 30 saniye aydınlatın. Çapraz bağlama, LAP fotobaşlatıcı UV ışığına maruz kaldığında meydana gelir.
NOT: Hücre süspansiyonu bu süre zarfında inkübatörde tutulabilir veya ışıktan korunabilir. - Steril forsepslerle, hücrelerin bir gecede iyileşmesine izin vermek için uçları derhal doku kültürü olmayan 6 bir plakada (DMEM% 10 [v / v] FBS ve 1x antibiyotik-antimikotik ile desteklenmiş) 8 mL büyüme ortamına aktarın.
- Hücreleri dört soya doğru ayırt edin.
- Yağ dokusunu (AT) mühendislik yapmak için, kesici uçları 8 mL adipojenik ortama (; Alfa-MEM,% 10 FBS, 0.2 mM indometasin, 1x insülin-transferrin-selenyum (ITS), 0.45 mM 3-izobütil-1-metilksantin, 0.1 μM deksametazon ve 1x antibiyotik-antimikotik) farklılaşmayı başlatmak için. İdeal olarak, dört uç, 8 mL adipojenik ortam içeren doku kültürü olmayan bir kuyu plakasının tek bir kuyucuğuna yerleştirilir. Kuyu plakalarındaki hücreleri 28 gün boyunca kültürleyin, her geçen gün orta değişikliklerle.
- Osteokondral üniteleri (OC) tasarlamak için, uçları çift akışlı biyoreaktör odalarına yerleştirin, kuyucukları kapatın ve iki akışı ayrı ayrı 35 mL osteojenik ortam (OM; DMEM, %10 FBS, 1x antibiyotik-antimikotik, 0.1 μM deksametazon, 0.01 M β-gliserofosfat, 100 ng/mL kemik morfojenik protein 7 (BMP7), 50 μg/mL askorbik asit ve 10 nM D3 vitamini) ve 35 mL kondrojenik ortam (CM; DMEM, 1x antibiyotik-antimikotik, 1x ITS, 0.1 μM deksametazon, 40 μg/mL prolin, 50 μg/mL askorbik asit ve 10 ng/mL dönüştürücü büyüme faktörü β3)10. İki haftada bir ortam değişiklikleri yaparak 28 gün boyunca hücre farklılaşmasını koruyun.
- Fibroblastları türetmek için, 20 mL fibrojenik ortam (FM; ileri DMEM,% 5 FBS, 1x GlutaMAX, 1x antibiyotik-antimikotik ve 50 μg / mL askorbik asit) kullanarak T150cm2 doku kültürü şişesinde 21 gün boyunca 2D kültürdeki MSC'leri ayırt edin. Ortamı her hafta değiştirin. Hücreleri ayırmak için 4 mL tripsin kullanın ve sinovyal benzeri fibröz doku (SFT) elde etmek için yukarıda açıklanan protokolü izleyerek 3D jelleri ekler içinde kapsülleyin.
NOT: Tüm farklılaştırma ortamlarının bileşimleri Tablo 1'de bulunabilir.
3. miniJoint çipinin kurulması
- 3D miniJoint biyoreaktör odalarını, 0.062 inç iç çapa ve 0.125 inç dış çapa sahip silikon boruları ve F 1/16 Luer kilit konektörlerini otoklavlayın. Silikon boruyu bir ucundaki miniJoint biyoreaktör dikenine bağlayın ve diğer ucundaki Luer kilidini bağlayın.
- Adım 2.11'de belirtilen, OM (BMP7'yi kaldırma) ve FMCM'yi hazırlayın. Ek olarak, ortak paylaşılan ortamı (SM; fenol kırmızısız DMEM, 1x antibiyotik-antimikotik, 1x Na-piruvat, 1x ITS, 40 μg / mL prolin, 50 μg / mL askorbik asit ve 0.5 ng / mL dönüştürücü büyüme faktörü β3) miniJoint kültürü için kullanılmak üzere hazırlayın. Her ortamın 35 mL'sini orta rezervuarlara yükleyin.
- Osteokondral üniteyi çift akışlı biyoreaktörden miniJoint biyoreaktörünün sağ kuyusuna aktarmak için düz forseps kullanın. Yağ dokusu ekini ve fibröz doku ekini sırasıyla sol ve orta kuyucuklara aktarın. Tüm kuyucukları sterilize edilmiş kapaklarla kapatın.
- miniJoint çipinin girişlerini orta rezervuarlara ve çıkışları şırıngalara bağlayın (Şekil 3A-C).
- Şırıngaları bir şırınga pompasına monte edin (Şekil 3C) ve pompayı ve talaşları bir inkübatöre aktarın. Orta rezervuarlar, inkübatörün dışındaki buz üzerinde tutulur.
- Pompayı çekme modunda çalıştırın ve ortamı orta hazneden miniJoint biyoreaktör odasına çekin. Bu miniJoint kültür süreci 28 gün sürer.
- Eklem iltihabını ve kıkırdak dejenerasyonunu modellemek için, fibrojenik ortam akışına 10 ng / mL'de interlökin 1β (IL-1β) ekleyin. IL-1β tedavisinin üçüncü gününde şırıngaları değiştirin ve fibrojenik ortama taze IL-1β sağlayın. Tedavi 7 gün sürer.
- İlaç testi adımı sırasında, IL-1β tedavisinden 3 günlük bir süreden sonra, ilacı ya paylaşılan ortamda, ilaç diz ekleminde lokal olarak kullanıldığında bir "eklem içi uygulamayı" (Şekil 3D) simüle ederek ya da tüm orta tiplerde, ilaç dolaşım yoluyla diz eklemine etki ettiğinde "sistemik bir uygulamayı" (Şekil 3E) simüle ederek uygulayın.
- Örneklerin önceki 4 gün boyunca ilaç tedavisi görüp görmediğine bakılmaksızın, 7 günlük IL-1β tedavisinden sonra analiz için tek tek dokuları toplayın.
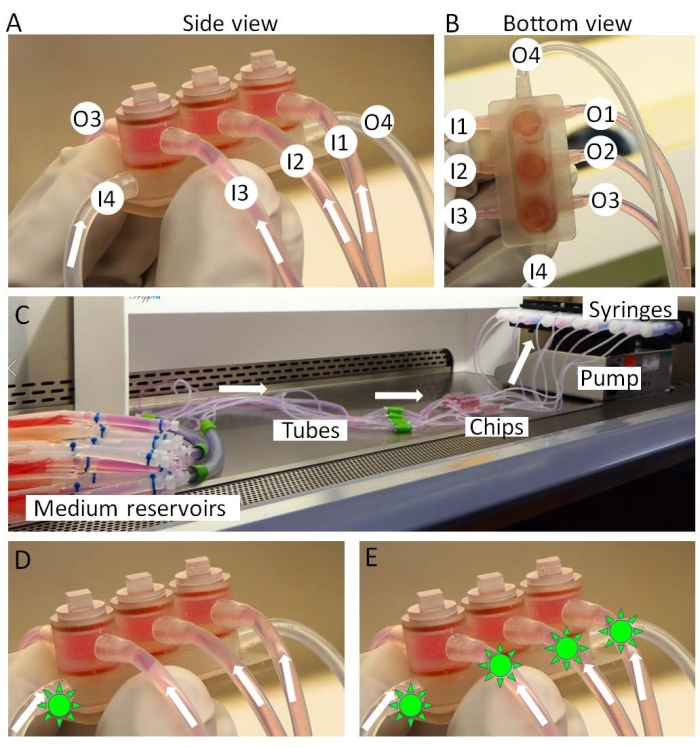
Şekil 3: MiniJoint'in montajı. (A,B) Dokuya özgü ortamlar 1-3 (I1-3) girişlerinden sokulur ve 1-3 (O1-3) çıkışlarından çıkarılır. Paylaşılan ortam I4'ten O4'e kadar perfüze edilir. (C) miniJoint kültürünün tam kurulumu. İlaçlar (yeşil güneş benzeri şekiller) ya (D) sadece paylaşılan ortama ya da (E) sırasıyla "eklem içi uygulama" ya da "sistemik uygulama" yı simüle etmek için tüm ortamlara sokulabilir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
4. Bireysel doku toplama
- Kesici uçları çıkarmak için steril kavisli forseps kullanın.
- Jeli çıkarmak için kesici ucun ortasından bir biyopsi zımbasını itin ve jeli PBS'ye yerleştirin.
- Gen ekspresyonunu değerlendirirken osteokondral jelleri ikiye bölün.
NOT: Osteokondral jel iki doku tipinden oluştuğundan, osteojenik ve kondrojenik hücreleri ayırmak önemlidir. - Çeşitli deneyler için şartlandırılmış ortam ve dokuları toplayın.
- Her ortam kaynağından yaklaşık 1,5 mL toplayın.
- Şartlandırılmış ortamı 10 dakika boyunca 14.000 x g'de santrifüj yaptıktan ve tortuyu attıktan sonra sıvı azot içinde flaş dondurun.
- Histolojik boyama ve immün boyama için, önce OC ve SFT numunelerini% 10 tamponlu formalin içine sabitleyin, artan konsantrasyonlardaki etanolde dehidre edin, ksilen içinde temizleyin, parafine gömün ve son olarak 6 μm kalınlığında kesinleştirin.
- AT mikrodokuları için, numuneleri% 10 tamponlanmış formalin içine sabitleyin ve doğrudan Yağ Kırmızısı O çözeltisi veya BODIPY ile boyayın.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
miniJoint'in tüm dokuları, miniJoint'te 28 günlük kültürü takiben fenotiplerini analiz etmek için toplandı (Şekil 4A). Bu, önceki yayınımız7'de detaylandırılmıştır.
RT-qPCR, immün boyama ve histolojik boyama kullanılarak, dokuya özgü fenotiplerin bireysel mikrodokular için iyi korunduğu doğrulanmıştır (Şekil 4). Örneğin, OC mikrodokularının (OC-O) kemikli bileşeni, ancak diğe...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bu makalede, kemik, kıkırdak, yağ dokusu ve sinovyum benzeri dokuların MSC'lerden oluşturulduğu ve özelleştirilmiş bir biyoreaktör içinde birlikte kültürlendiği bir çip üzerinde diz eklemi sistemi oluşturmak için bir protokol sunuyoruz. Tak ve çalıştır özelliklerine sahip bu çok bileşenli, insan hücresinden türetilmiş sistem, eklem hastalıklarının patogenezini incelemek ve ilaç geliştirmek için yeni bir aracı temsil etmektedir.
Farklı dokuların belirli kü...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar birbiriyle çelişen çıkarlar olmadığını beyan ederler.
Teşekkürler
Bu araştırma öncelikle Ulusal Sağlık Enstitüleri (UG3 / UH3TR002136, UG3 / UH3TR003090) tarafından finanse edilmiştir. Buna ek olarak, insan dokusu örneklerini sağladığı için Dr. Paul Manner'a (Washington Üniversitesi) ve MSC'leri izole etme ve hücre havuzu oluşturma konusundaki yardımları için Dr. Jian Tan'a teşekkür ederiz.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 3-isobutyl-1-methylxanthine | Sigma -Aldrich | I17018-1G | |
| 6 well non-tissue culture plate | Corning Falcon® Plates | 351146 | |
| 24 well non-tissue culture plate | Corning Falcon® Plates | 351147 | |
| 30 mL syringes | BD Syringe Luer Lock Cascade Health | 302832 | |
| Alcian blue stain | EK Industries | 1198 | 1% w/v, pH 1.0 |
| Advanced DMEM | Gibco | 12491-015 | |
| αMEM | Gibco | 12571-063 | |
| Antibiotic-antimycotic | Gibco | 15240-062 | |
| Biopsy punch | Integra Miltex | 12-460-407 | |
| BODIPY® fluorophore | Molecular Probes | ||
| Bone morphogenic protein 7 (BMP7) | Peprotech | ||
| Curved forceps | Fisher Brand | 16100110 | |
| DMEM | Gibco | 11995-065 | Dulbecco’s Modified Eagle Medium |
| Dexmethasome | Sigma -Aldrich | 02-05-2002 | |
| E-Shell 450 photopolymer in | EnvisionTec | RES-01-4022 | |
| Fetal Bovine Serum | Gemini-Bio Products | 900-208 | |
| GlutaMAX | Gibco | 3505-061 | |
| gelatin from bovine skin | Hyclone | 1003372809 | |
| Hank’s Balanced Salt Solution | Sigma -Aldrich | SH30588.02 | |
| indomethacin | Sigma -Aldrich | I7378-56 | |
| Insulin-Transferrin-Selenium-Ethanolamine (ITS) | Gibco | 51500-056 | |
| interleukin 1β | Peprotech | 200-01B | |
| Leur-loc connectors | Cole-Parmer Instruments | 45508-50 | |
| L-proline | Sigma -Aldrich | 115388-93-7 | |
| β-glycerophosphate | Sigma -Aldrich | 1003129352 | |
| Medium bags | KiYATEC | FC045 | |
| Methacrylic Anhydride | Sigma -Aldrich | 102378580 | |
| Phosphate buffered Saline | Corning | 21-040-CM | |
| Pointed forceps | Fisher Brand | 12000122 | |
| Silicon mold | McMaster-Carr | RC00114P | |
| Silicon o-rings | McMaster-Carr | ZMCCs1X5 | 1mm x 5mm |
| SolidWorks | Dassault Systèmes SE, Vélizy-Villacoublay, France | ||
| Surgical Blades | Integra Miltex | 4-122 | |
| Syringe pump | Lagato210P, KD Scientific | Z569631 | 10 syringe racks |
| T-182 tissue culture flasks | Fisher Brand | FB012939 | |
| Tissue Culture Dish 150 mm | Fisher Brand | FB012925 | |
| Transforming Growth Factor Beta (TGF-β3) | Peprotech | 100-36E | |
| Trypsin | Gibco | 25200-056 | |
| UV Flashlight | KBS | KB70109 | 395 nm |
| Vida Desktop 3D Printer | EnvisionTec | ||
| Vitamin D3 | Sigma -Aldrich | 32222-06-3 | 1,25-dihydroxyvitamin D3 |
Referanslar
- Safiri, S., et al. Global, regional and national burden of osteoarthritis 1990-2017: A systematic analysis of the Global Burden of Disease Study 2017. Annals of the Rheumatic Diseases. 79 (6), 819-828 (2020).
- Lawrence, R. C., et al. Estimates of the prevalence of arthritis and other rheumatic conditions in the United States: Part II. Arthritis and Rheumatism. 58 (1), 26-35 (2008).
- Makarczyk, M. J., et al. Current models for development of disease-modifying osteoarthritis drugs. Tissue Engineering. Part C, Methods. 27 (2), 124-138 (2021).
- He, Y., et al. Pathogenesis of osteoarthritis: risk factors, regulatory pathways in chondrocytes, and experimental models. Biology. 9 (8), 194(2020).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Lin, H., Sohn, J., Shen, H., Langhans, M. T., Tuan, R. S. Bone marrow mesenchymal stem cells: aging and tissue engineering applications to enhance bone healing. Biomaterials. 203, 96-110 (2019).
- Li, Z., et al. Human mesenchymal stem cell-derived miniature joint system for disease modeling and drug testing. Advanced Science. 9 (21), 2105909(2022).
- Lin, H., Cheng, A. W., Alexander, P. G., Beck, A. M., Tuan, R. S. Cartilage tissue engineering application of injectable gelatin hydrogel with in situ visible-light-activated gelation capability in both air and aqueous solution. Tissue Engineering. Part A. 20 (17-18), 2402-2411 (2014).
- Fairbanks, B. D., Schwartz, M. P., Bowman, C. N., Anseth, K. S. Photoinitiated polymerization of PEG-diacrylate with lithium phenyl-2,4,6-trimethylbenzoylphosphinate: polymerization rate and cytocompatibility. Biomaterials. 30 (35), 6702-6707 (2009).
- Lin, H., Lozito, T. P., Alexander, P. G., Gottardi, R., Tuan, R. S. Stem cell-based microphysiological osteochondral system to model tissue response to interleukin-1β. Molecular Pharmaceutics. 11 (7), 2203-2212 (2014).
- Yin, B., et al. Hybrid macro-porous titanium ornamented by degradable 3D gel/nHA micro-scaffolds for bone tissue regeneration. International Journal of Molecular Sciences. 17 (4), 575(2016).
- Lin, Z., et al. Osteochondral tissue chip derived from iPSCs: Modeling OA pathologies and testing drugs. Frontiers in Bioengineering and Biotechnology. 7, 411(2019).
- Atukorala, I., et al. Synovitis in knee osteoarthritis: A precursor of disease. Annals of the Rheumatic Diseases. 75 (2), 390-395 (2016).
- Occhetta, P., et al. Hyperphysiological compression of articular cartilage induces an osteoarthritic phenotype in a cartilage-on-a-chip model. Nature Biomedical Engineering. 3 (7), 545-557 (2019).
- He, C., et al. Modeling early changes associated with cartilage trauma using human-cell-laden hydrogel cartilage models. Stem Cell Research and Therapy. 13 (1), 400(2022).
- Elsissy, J. G., et al. Bacterial septic arthritis of the adult native knee joint: A review. JBJS Reviews. 8 (1), 0059(2020).
- Romero-Lopez, M., et al. Macrophage effects on mesenchymal stem cell osteogenesis in a three-dimensional in vitro bone model. Tissue Engineering. Part A. 26 (19-20), 1099-1111 (2020).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır