Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Создание коленного сустава-на-чипе для моделирования заболеваний суставов и тестирования лекарств
В этой статье
Резюме
Мы предлагаем подробные методы создания четырех типов тканей из мезенхимальных стволовых клеток человека, которые используются для рекапитуляции хряща, кости, жирового пакета и синовиальной оболочки коленного сустава человека. Эти четыре ткани интегрированы в индивидуальный биореактор и соединены с помощью микрофлюидики, создавая таким образом коленный сустав на чипе.
Аннотация
Высокая распространенность изнурительных заболеваний суставов, таких как остеоартрит (ОА), представляет собой высокое социально-экономическое бремя. В настоящее время доступные препараты, нацеленные на заболевания суставов, в основном паллиативны. Неудовлетворенная потребность в эффективных препаратах ОА, модифицирующих болезнь (ДМОАД), была вызвана главным образом отсутствием соответствующих моделей для изучения механизмов заболевания и тестирования потенциальных ДМОАД. Здесь описано создание миниатюрной микрофизиологической системы, имитирующей синовиальный сустав (miniJoint), включающей компоненты жировой, фиброзной и остеохондральной ткани, полученные из мезенхимальных стволовых клеток (МСК) человека. Для получения трехмерных (3D) микротканей МСК инкапсулировали в фотосшиваемый метакрилированный желатин до или после дифференцировки. Затем тканевые конструкции, нагруженные клетками, были интегрированы в биореактор, напечатанный на 3D-принтере, образуя мини-соединение. Были введены отдельные потоки остеогенной, фиброгенной и адипогенной сред для поддержания соответствующих тканевых фенотипов. Общий поток перфузировался через хрящевую, синовиальную и жировую ткани, чтобы обеспечить перекрестные помехи тканей. Эта картина потока позволяет индукция возмущений в одном или нескольких тканевых компонентах для механистических исследований. Кроме того, потенциальные ДМОАД могут быть протестированы либо путем «системного введения» через все потоки среды, либо путем «внутрисуставного введения» путем добавления лекарств только к общему потоку, имитирующему «синовиальную жидкость». Таким образом, miniJoint может служить универсальной платформой in vitro для эффективного изучения механизмов заболевания и тестирования лекарств в персонализированной медицине.
Введение
Заболевания суставов, такие как остеоартрит (ОА), широко распространены и изнурительны и представляют собой ведущую причину инвалидности во всем мире1. По оценкам, только в США ОА поражает 27 миллионов пациентов и встречается у 12,1% взрослых в возрасте 60 лет и старше2 лет. К сожалению, большинство препаратов, используемых в настоящее время для лечения заболеваний суставов, являются паллиативными, и нет эффективных препаратов, модифицирующих болезнь ОА (DMOAD)3. Эта неудовлетворенная медицинская потребность в первую очередь связана с отсутствием эффективной модели для изучения механизмов заболевания и разработки потенциальных DMOAD. Традиционная двумерная (2D) культура клеток не отражает 3D-природу тканей суставов, а культивированию тканевых эксплантатов часто препятствует значительная гибель клеток и обычно не удается воспроизвести динамические тканевые взаимосвязи4. Кроме того, генетические и анатомические различия значительно снижают физиологическую значимость животных моделей4.
Органы-на-чипах (OoC), или микрофизиологические системы, являются перспективной областью исследований на стыке инженерии, биологии и медицины. Эти платформы in vitro представляют собой минимальные функциональные единицы, которые воспроизводят определенные здоровые или патологические особенности их аналогов in vivo 5. Кроме того, эти миниатюрные системы могут содержать различные клетки и матрицы и имитировать биофизические и биохимические взаимодействия между различными тканями. Таким образом, микрофизиологическая система, которая может точно повторять нативный синовиальный сустав, обещает предложить эффективную платформу для моделирования заболеваний суставов и разработки потенциальных DMOAD.
Мезенхимальные стволовые клетки человека (МСК) могут быть выделены из многих тканей по всему телу и дифференцированы на остеогенные, хондрогенные и адипогенные линии6. МСК успешно используются для создания различных тканей, включая костную, хрящевую и жировую ткань6, что означает, что они представляют собой многообещающий источник клеток для инженерии тканевых компонентов коленного сустава. Недавно мы разработали миниатюрную микрофизиологическую систему, имитирующую суставы, под названием miniJoint, которая включает в себя костную, хрящевую, фиброзную и жировую ткани, полученные из МСК7. В частности, новая конструкция обеспечивает перекрестные помехи тканей за счет микрофлюидного потока или проникновения (рис. 1). Здесь мы представляем протоколы изготовления компонентов чипа, проектирования компонентов ткани, культивирования инженерных тканей в чипе и сбора тканей для последующего анализа.
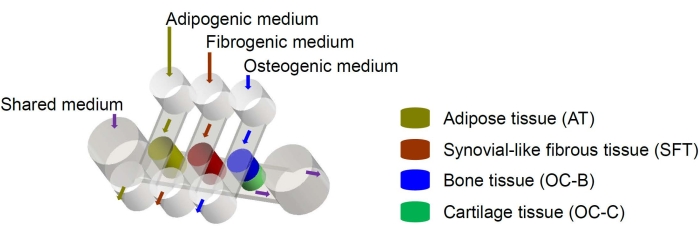
Рисунок 1: Схема чипа miniJoint, показывающая расположение различных компонентов ткани и потоков среды. ОК = остеохондральная ткань. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Access restricted. Please log in or start a trial to view this content.
протокол
Следующий протокол следует этическим принципам Университета Питтсбурга и комитета по этике исследований на людях Университета Питтсбурга. Информация о материалах, использованных в данном исследовании, приведена в Таблице материалов.
1. Производство биореакторов, напечатанных на 3D-принтере
- Используйте компьютерное программное обеспечение для проектирования остеохондральных (рис. 2A) и мини-биореакторов (рис. 2B), которые включают камеры, вставки и крышки. Информация о размерах каждой детали показана на рисунке S1.
- Перенесите дизайн на 3D-принтер и распечатайте фотополимерными чернилами.
- Промойте детали, напечатанные на 3D-принтере (рис. 2C-F), 15 мл 95% этанола три раза. Затем полностью сшивайте напечатанные детали в течение 200 с в устройстве полимеризации фонарика.
- Добавьте уплотнительные кольца к вкладышам и крышкам (рис. 2C, D) и проверьте, подходят ли детали (рис. 2G, H).

Рисунок 2: Изготовление различных компонентов для изготовления биореактора miniJoint. (A,B), 3D-модели биореакторов для создания (A) остеохондральных и (B) miniJoint чипов. (C, D) напечатанные на 3D-принтере крышки (C) и вкладыши (D) с установленным уплотнительным кольцом. (E, F) 3D-печатные камеры для (E) остеохондральной и (F) мини-суставной культуры тканей. (Г,Г) Сборка (G) остеохондральных и (H) мини-шарнирных чипов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Проектирование тканевых компонентов
ПРИМЕЧАНИЕ: Процессы изготовления фенил-2,4,6-триметилбензоилфосфината лития (LAP) и метакрилированного желатина (GelMA) описаны в предыдущих исследованиях 8,9.
- Чтобы создать GelMA, выполните следующие действия.
- Добавьте 17 г желатина типа B в 500 мл дистиллированной воды, а затем перемешивайте на шейкере в течение 30 мин при 37 °C.
- Затем добавьте 13 мл метакрилового ангидрида, поместите обратно на шейкер с температурой 37 ° C и дайте встряхнуть в течение ночи.
- На следующий день аликвотируйте GelMA в отдельные диализные мешки, по ~ 60 мл в каждом пакетике.
- Поместите все пакеты для диализа в дистиллированную воду с помощью мешалки и оставьте на 7 дней диализа. Меняйте воду несколько раз в день и оставляйте пакеты при температуре 4 ° C на ночь.
- На 7-й день заморозьте GelMA при -80 °C. После полного застывания приступают к лиофилизации.
- Поместите GelMA в посуду в вакуумную камеру лиофилизатора и дайте ему высушиться. Убедитесь, что GelMA полностью высох, прежде чем удалять его из лиофилизатора.
- Растворите GelMA в сбалансированном солевом растворе Хэнка (HBSS с Ca 2+ и Mg2+) при 15% (мас./об.). Чтобы обеспечить рН на уровне 7,4, добавляйте NaOH в небольших количествах, пока рН не достигнет 7,4. Дополните раствор 1x антибиотиком-антимикотическим и 0,15% (мас./об.) LAP в зависимости от приобретенного объема. Храните 15% раствор GelMA при температуре -20 °C до использования и защищайте его от света.
- Поместите напечатанные на 3D-принтере двухпоточные биореакторные камеры, крышки и вкладыши в автоклавы и автоклавы при 121 °C на 20 минут с паром, а затем на 20 минут с сухим теплом.
- Внутри шкафа биологической безопасности замочите камеры, крышки и вкладыши биореактора в 15 мл стерильного фосфатно-буферного физиологического раствора на ночь, после чего дайте им высохнуть.
- Изолировать МСК, полученные из костного мозга человека, из хирургических отходов тотального эндопротезирования суставов с одобрения IRB (Университет Питтсбурга и Вашингтонский университет).
- В частности, вымывают костный мозг из трабекулярной кости шейки и головки бедренной кости и ресуспендируют его в модифицированной орлиной среде Дульбекко (DMEM).
- Отфильтруйте суспензию через сетчатый фильтр 40 мкм и центрифугируйте проточный поток при 300 x g в течение 5 мин.
- Удалите надосадочную жидкость, ресуспендируйте гранулы, используя питательную среду [DMEM, 10% фетальная бычья сыворотка (FBS) и 1x антибиотик-антимикотик], а затем поместите в колбы для культивирования тканей.
- Меняйте питательную среду каждые 3 дня до 4 дней. Прежде чем продолжить, убедитесь, что достигнуто слияние от 70% до 80%.
- Отделяют клетки путем инкубации с трипсином-ЭДТА в течение 2-3 мин и пассажа в соотношении 1 миллион клеток на колбу Т150.
- Разверните ячейки до P5. После трипсинизации суспендировать клетки, пересчитать их, а затем гранулировать центрифугированием при 300х г в течение 5 мин.
- С помощью пипетки объемом 1,000 мкл ресуспендируют клетки в дозе 20 x 106 клеток/мл в 15% растворе GelMA.
ПРИМЕЧАНИЕ: Выключите свет шкафа биологической безопасности. - Используя стерильные перчатки, прижмите стерильную сухую силиконовую форму к чашке Петри. Затем вставьте по одной вставке в каждое отверстие силиконовой формы щипцами стороной отверстия вставки вниз.
- Используя пипетку объемом 200 мкл, добавьте клеточную суспензию, чтобы заполнить вставку (~ 50 мкл на вкладыш).
- Используйте УФ-фонарик (светодиодный свет с длиной волны 395 нм), чтобы сшить верхнюю часть геля/вставки в течение 1,5 мин. Затем осветите другую сторону в течение 30 секунд. Сшивание происходит, когда фотоинициатор LAP подвергается воздействию ультрафиолетового света.
ПРИМЕЧАНИЕ: Клеточную суспензию можно хранить в инкубаторе в течение этого периода или защищать от света. - С помощью стерильных щипцов немедленно перенесите вкладыши в 8 мл питательной среды в 6-луночную пластину для нетканевой культуры (DMEM с добавлением 10% [v/v] FBS и 1x антибиотика-антимикотика), чтобы позволить клеткам восстановиться в течение ночи.
- Дифференцируйте клетки по четырем линиям.
- Чтобы сконструировать жировую ткань (АТ), перенесите вкладыши на 8 мл адипогенной среды (AM; Альфа-МЭМ, 10% FBS, 0,2 мМ индометацина, 1x инсулин-трансферрин-селен (ITS), 0,45 мМ 3-изобутил-1-метилксантин, 0,1 мкМ дексаметазона и 1x антибиотик-антимикотик) для инициации дифференцировки. В идеале четыре вкладыша помещают в одну лунку лунки для нетканевой культуры с 8 мл адипогенной среды. Культивируют клетки в лунке в течение 28 дней, при этом среда меняется через день.
- Чтобы спроектировать остеохондральные установки (ОС), поместите вставки в двухпоточные камеры биореактора, закройте скважины и вливайте два потока отдельно со скоростью потока 5 мкл / мин с 35 мл остеогенной среды (OM; DMEM, 10% FBS, 1x антибиотик-антимикотик, 0,1 мкМ дексаметазон, 0,01 М β-глицерофосфат, 100 нг/мл костного морфогенного белка 7 (BMP7), 50 мкг/мл аскорбиновой кислоты и 10 нМ витамина D3) и 35 мл хондрогенной среды (CM; DMEM, 1x антибиотик-антимикотик, 1x ITS, 0,1 мкМ дексаметазон, 40 мкг/мл пролина, 50 мкг/мл аскорбиновой кислоты и 10 нг/мл, трансформирующий фактор роста β3)10. Поддерживайте дифференцировку клеток в течение 28 дней, выполняя двухнедельную смену среды.
- Чтобы получить фибробласты, дифференцируйте МСК в 2D-культуре в течение 21 дня в колбе для культуры тканей T150 см2 , используя 20 мл фиброгенной среды (FM; расширенный DMEM, 5% FBS, 1x GlutaMAX, 1x антибиотик-антимикотик и 50 мкг / мл аскорбиновой кислоты). Меняйте носитель каждую неделю. Используйте 4 мл трипсина, чтобы отделить клетки и инкапсулировать 3D-гели во вставки, следуя протоколу, описанному выше, для получения синовиальной фиброзной ткани (SFT).
ПРИМЕЧАНИЕ: Составы всех дифференцирующих сред можно найти в таблице 1.
3. Установка чипа miniJoint
- Автоклав камеры биореактора 3D miniJoint, силиконовые трубки с внутренним диаметром 0,062 дюйма и внешним диаметром 0,125 дюйма, а также разъемы F 1/16 Luer-lock. Подсоедините силиконовую трубку к зазубрине биореактора miniJoint с одного конца и подсоедините замок Luer с другого конца.
- Подготовьте AM, OM (удаление BMP7) и FMCM, упомянутые на шаге 2.11. Кроме того, подготовьте общую общую среду (SM; ДМЭМ без фенола, 1x антибиотик-антимикотик, 1x Na-пируват, 1x ITS, 40 мкг/мл пролина, 50 мкг/мл аскорбиновой кислоты и 0,5 нг/мл трансформирующего фактора роста β3) для использования для мини-посева. Загрузите 35 мл каждой среды в резервуары для среды.
- Используйте прямые щипцы для переноса остеохондрального блока из двухпоточного биореактора в правую лунку биореактора miniJoint. Перенесите вставку жировой ткани и вставку фиброзной ткани в левую и среднюю лунки соответственно. Закройте все лунки стерилизованными крышками.
- Подсоедините входные отверстия микросхемы miniJoint к резервуарам для среды, а выпускные отверстия — к шприцам (рис. 3A-C).
- Установите шприцы на шприцевой насос (рис. 3C) и перенесите насос и стружку в инкубатор. Средние резервуары держат на льду вне инкубатора.
- Работайте с насосом в режиме отвода, втягивая среду из резервуара среды в камеру биореактора miniJoint. Этот процесс культивирования мини-суставов длится 28 дней.
- Чтобы смоделировать воспаление суставов и дегенерацию хряща, добавьте интерлейкин 1β (IL-1β) в поток фиброгенной среды в дозе 10 нг / мл. Замените шприцы на третий день лечения IL-1β и введите свежий IL-1β в фиброгенную среду. Лечение длится 7 дней.
- На этапе тестирования лекарственного средства, после 3 дней лечения IL-1β, вводите препарат либо в общую среду, имитируя «внутрисуставное введение» (рис. 3D), когда лекарство используется локально в коленном суставе, либо во всех типах среды, имитируя «системное введение» (рис. 3E), когда лекарство действует на коленный сустав через кровообращение.
- Соберите отдельные ткани для анализа после 7 дней лечения IL-1β, независимо от того, подвергались ли образцы медикаментозной обработке в течение предыдущих 4 дней.
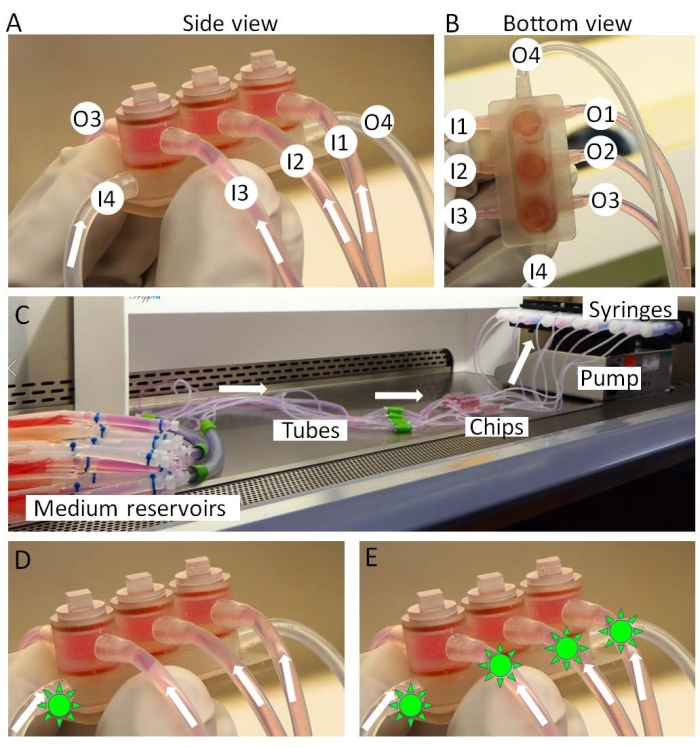
Рисунок 3: Сборка мини-шарнира. (А, Б) Тканеспецифические среды вводятся из входных отверстий 1-3 (I1-3) и выводятся из выходов 1-3 (O1-3). Общая среда перфузируется от I4 до O4. (C) Полная настройка культуры miniJoint. Лекарственные средства (формы, похожие на зеленое солнце) могут быть введены либо в (D) только общую среду, либо (E) во все среды, чтобы соответственно имитировать «внутрисуставное введение» или «системное введение». Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Индивидуальный забор тканей
- Используйте стерильные изогнутые щипцы для удаления вкладышей.
- Протолкните перфоратор для биопсии через центр вкладыша, чтобы удалить гель, и поместите гель в PBS.
- Разрежьте остеохондральные гели пополам при оценке экспрессии генов.
ПРИМЕЧАНИЕ: Поскольку остеохондральный гель состоит из двух типов тканей, важно разделить остеогенные и хондрогенные клетки. - Собирайте кондиционированные среды и ткани для различных экспериментов.
- Соберите около 1,5 мл из каждого среднего источника.
- Заморозьте кондиционированную среду в жидком азоте после центрифугирования при 14 000 x g в течение 10 мин и удаления осадка.
- Для гистологического окрашивания и иммуноокрашивания сначала зафиксируйте образцы OC и SFT в 10% буферном формалине, обезвоживайте их в этаноле возрастающих концентраций, очистите их в ксилоле, вставьте в парафин и, наконец, разделите их на толщину 6 мкм.
- Для микротканей АТ зафиксируйте образцы в 10% буферном формалине и непосредственно окрашивайте их раствором Oil Red O или BODIPY.
Access restricted. Please log in or start a trial to view this content.
Результаты
Все ткани мини-сустава были собраны для анализа их фенотипов после 28 дней культивирования в мини-суставе (рис. 4А). Это было подробно описано в нашей предыдущей публикации7.
С помощью ОТ-кПЦР, иммуноокрашивания и гистологического окрашивания б?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
В этой статье мы представляем протокол создания системы коленного сустава на чипе, в которой кости, хрящи, жировая ткань и синовиально-подобные ткани формируются из МСК и совместно культивируются в индивидуальном биореакторе. Эта многокомпонентная система на основе клеток человека с ?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Это исследование было в основном поддержано финансированием Национальных институтов здравоохранения (UG3 / UH3TR002136, UG3 / UH3TR003090). Кроме того, мы благодарим доктора Пола Маннера (Вашингтонский университет) за предоставление образцов тканей человека и доктора Цзянь Тана за помощь в изоляции МСК и создании пула клеток.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 3-isobutyl-1-methylxanthine | Sigma -Aldrich | I17018-1G | |
| 6 well non-tissue culture plate | Corning Falcon® Plates | 351146 | |
| 24 well non-tissue culture plate | Corning Falcon® Plates | 351147 | |
| 30 mL syringes | BD Syringe Luer Lock Cascade Health | 302832 | |
| Alcian blue stain | EK Industries | 1198 | 1% w/v, pH 1.0 |
| Advanced DMEM | Gibco | 12491-015 | |
| αMEM | Gibco | 12571-063 | |
| Antibiotic-antimycotic | Gibco | 15240-062 | |
| Biopsy punch | Integra Miltex | 12-460-407 | |
| BODIPY® fluorophore | Molecular Probes | ||
| Bone morphogenic protein 7 (BMP7) | Peprotech | ||
| Curved forceps | Fisher Brand | 16100110 | |
| DMEM | Gibco | 11995-065 | Dulbecco’s Modified Eagle Medium |
| Dexmethasome | Sigma -Aldrich | 02-05-2002 | |
| E-Shell 450 photopolymer in | EnvisionTec | RES-01-4022 | |
| Fetal Bovine Serum | Gemini-Bio Products | 900-208 | |
| GlutaMAX | Gibco | 3505-061 | |
| gelatin from bovine skin | Hyclone | 1003372809 | |
| Hank’s Balanced Salt Solution | Sigma -Aldrich | SH30588.02 | |
| indomethacin | Sigma -Aldrich | I7378-56 | |
| Insulin-Transferrin-Selenium-Ethanolamine (ITS) | Gibco | 51500-056 | |
| interleukin 1β | Peprotech | 200-01B | |
| Leur-loc connectors | Cole-Parmer Instruments | 45508-50 | |
| L-proline | Sigma -Aldrich | 115388-93-7 | |
| β-glycerophosphate | Sigma -Aldrich | 1003129352 | |
| Medium bags | KiYATEC | FC045 | |
| Methacrylic Anhydride | Sigma -Aldrich | 102378580 | |
| Phosphate buffered Saline | Corning | 21-040-CM | |
| Pointed forceps | Fisher Brand | 12000122 | |
| Silicon mold | McMaster-Carr | RC00114P | |
| Silicon o-rings | McMaster-Carr | ZMCCs1X5 | 1mm x 5mm |
| SolidWorks | Dassault Systèmes SE, Vélizy-Villacoublay, France | ||
| Surgical Blades | Integra Miltex | 4-122 | |
| Syringe pump | Lagato210P, KD Scientific | Z569631 | 10 syringe racks |
| T-182 tissue culture flasks | Fisher Brand | FB012939 | |
| Tissue Culture Dish 150 mm | Fisher Brand | FB012925 | |
| Transforming Growth Factor Beta (TGF-β3) | Peprotech | 100-36E | |
| Trypsin | Gibco | 25200-056 | |
| UV Flashlight | KBS | KB70109 | 395 nm |
| Vida Desktop 3D Printer | EnvisionTec | ||
| Vitamin D3 | Sigma -Aldrich | 32222-06-3 | 1,25-dihydroxyvitamin D3 |
Ссылки
- Safiri, S., et al. Global, regional and national burden of osteoarthritis 1990-2017: A systematic analysis of the Global Burden of Disease Study 2017. Annals of the Rheumatic Diseases. 79 (6), 819-828 (2020).
- Lawrence, R. C., et al. Estimates of the prevalence of arthritis and other rheumatic conditions in the United States: Part II. Arthritis and Rheumatism. 58 (1), 26-35 (2008).
- Makarczyk, M. J., et al. Current models for development of disease-modifying osteoarthritis drugs. Tissue Engineering. Part C, Methods. 27 (2), 124-138 (2021).
- He, Y., et al. Pathogenesis of osteoarthritis: risk factors, regulatory pathways in chondrocytes, and experimental models. Biology. 9 (8), 194(2020).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Lin, H., Sohn, J., Shen, H., Langhans, M. T., Tuan, R. S. Bone marrow mesenchymal stem cells: aging and tissue engineering applications to enhance bone healing. Biomaterials. 203, 96-110 (2019).
- Li, Z., et al. Human mesenchymal stem cell-derived miniature joint system for disease modeling and drug testing. Advanced Science. 9 (21), 2105909(2022).
- Lin, H., Cheng, A. W., Alexander, P. G., Beck, A. M., Tuan, R. S. Cartilage tissue engineering application of injectable gelatin hydrogel with in situ visible-light-activated gelation capability in both air and aqueous solution. Tissue Engineering. Part A. 20 (17-18), 2402-2411 (2014).
- Fairbanks, B. D., Schwartz, M. P., Bowman, C. N., Anseth, K. S. Photoinitiated polymerization of PEG-diacrylate with lithium phenyl-2,4,6-trimethylbenzoylphosphinate: polymerization rate and cytocompatibility. Biomaterials. 30 (35), 6702-6707 (2009).
- Lin, H., Lozito, T. P., Alexander, P. G., Gottardi, R., Tuan, R. S. Stem cell-based microphysiological osteochondral system to model tissue response to interleukin-1β. Molecular Pharmaceutics. 11 (7), 2203-2212 (2014).
- Yin, B., et al. Hybrid macro-porous titanium ornamented by degradable 3D gel/nHA micro-scaffolds for bone tissue regeneration. International Journal of Molecular Sciences. 17 (4), 575(2016).
- Lin, Z., et al. Osteochondral tissue chip derived from iPSCs: Modeling OA pathologies and testing drugs. Frontiers in Bioengineering and Biotechnology. 7, 411(2019).
- Atukorala, I., et al. Synovitis in knee osteoarthritis: A precursor of disease. Annals of the Rheumatic Diseases. 75 (2), 390-395 (2016).
- Occhetta, P., et al. Hyperphysiological compression of articular cartilage induces an osteoarthritic phenotype in a cartilage-on-a-chip model. Nature Biomedical Engineering. 3 (7), 545-557 (2019).
- He, C., et al. Modeling early changes associated with cartilage trauma using human-cell-laden hydrogel cartilage models. Stem Cell Research and Therapy. 13 (1), 400(2022).
- Elsissy, J. G., et al. Bacterial septic arthritis of the adult native knee joint: A review. JBJS Reviews. 8 (1), 0059(2020).
- Romero-Lopez, M., et al. Macrophage effects on mesenchymal stem cell osteogenesis in a three-dimensional in vitro bone model. Tissue Engineering. Part A. 26 (19-20), 1099-1111 (2020).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены