このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
関節疾患のモデリングと薬剤検査のための膝関節チップの作成
要約
ヒト間葉系幹細胞から4種類の組織を作製し、ヒト膝関節の軟骨、骨、脂肪パッド、滑膜を再現するための詳細な方法を提供します。これらの4つの組織は、カスタマイズされたバイオリアクターに統合され、マイクロ流体工学を介して接続されるため、膝関節オンチップが生成されます。
要約
変形性関節症(OA)のような衰弱性関節疾患の高い有病率は、高い社会経済的負担をもたらします。現在、関節障害を標的とする利用可能な薬はほとんどが緩和的です。効果的な疾患修飾OA薬(DMOAD)の満たされていないニーズは、主に疾患メカニズムを研究し、潜在的なDMOADをテストするための適切なモデルがないことによって引き起こされてきました。ここでは、ヒト間葉系幹細胞(MSC)に由来する脂肪、線維、および骨軟骨組織成分を含むミニチュア滑膜関節模倣微生物生理学的システム(miniJoint)の確立について説明します。三次元(3D)微小組織を得るために、MSCを、分化前または分化後に光架橋可能なメタクリレートゼラチンに封入した。次に、細胞を含む組織構築物を3Dプリントされたバイオリアクターに統合し、miniJointを形成しました。骨形成性、線維形成性、および脂肪生成性媒体の別々の流れを導入して、それぞれの組織表現型を維持した。一般的に共有される流れは、軟骨、滑膜、および脂肪組織を介して灌流され、組織のクロストークを可能にしました。このフローパターンにより、機構研究のための1つまたは複数の組織成分における摂動の誘導が可能になります。さらに、潜在的なDMOADは、すべての媒体ストリームを介した「全身投与」、または共有された「滑液」シミュレーションフローのみに薬物を添加することによる「関節内投与」のいずれか を介して テストできます。したがって、miniJointは、個別化医療における疾患メカニズムを効率的に研究し、薬物をテストするための汎用性の高い in vitro プラットフォームとして機能します。
概要
変形性関節症(OA)のような関節疾患は非常に蔓延しており、衰弱させ、世界中の障害の主な原因となっています1。米国だけでも、OAは2,700万人の患者に影響を及ぼし、60歳以上の成人の12.1%に発生していると推定されています2。残念ながら、現在関節疾患の管理に使用されているほとんどの薬は緩和薬であり、効果的な疾患修飾OA薬(DMOAD)は入手できません3。この満たされていない医療ニーズは、主に、疾患メカニズムを研究し、潜在的なDMOADを開発するための効果的なモデルがないことに起因しています。従来の2次元(2D)細胞培養は、関節組織の3D特性を反映しておらず、組織外植片の培養は、著しい細胞死によって妨げられることが多く、通常、動的な組織相互接続を再現できません4。さらに、遺伝的および解剖学的差異は、動物モデルの生理学的関連性を有意に低下させる4。
臓器チップ(OoC)、または微小生理学的システムは、工学、生物学、および医学のインターフェースにおける有望な研究分野です。これらのインビトロプラットフォームは、それらのインビボ対応物の定義された健康的または病理学的特徴を複製する最小の機能単位である5。さらに、これらの小型化されたシステムは、多様な細胞およびマトリックスをホストし、異なる組織間の生物物理学的および生化学的相互作用をシミュレートすることができる。したがって、天然の滑膜関節を忠実に再現できる微生物生理学的システムは、関節疾患をモデル化し、潜在的なDMOADを開発するための効果的なプラットフォームを提供することを約束します。
ヒト間葉系幹細胞(MSC)は、全身の多くの組織から単離され、骨形成性、軟骨形成性、および脂肪生成性系統に分化することができます6。MSCは、骨、軟骨、脂肪組織を含むさまざまな組織のエンジニアリングに成功しており6、膝関節の組織コンポーネントを設計するための有望な細胞源であることを意味します。私たちは最近、MSC由来の骨、軟骨、線維、脂肪組織で構成されるminiJointという名前のミニチュア関節模倣微生物生理学的システムを開発しました7。特に、この斬新な設計により、マイクロ流体の流れや透過による組織クロストークが可能になります(図1)。ここでは、チップコンポーネントの製造、組織コンポーネントのエンジニアリング、チップ内の操作された組織の培養、および下流の分析のための組織の収集のためのプロトコルを示します。
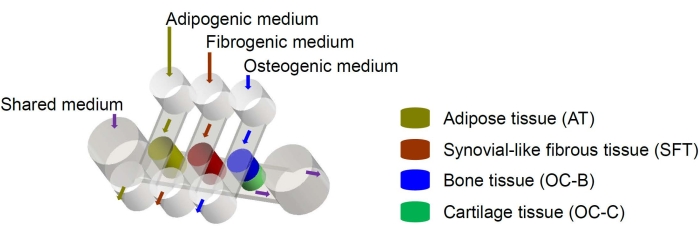
図1:さまざまな組織コンポーネントと媒体の流れの配置を示すminiJointチップの概略図。OC =骨軟骨組織。この図の拡大版を表示するには、ここをクリックしてください。
プロトコル
以下のプロトコルは、ピッツバーグ大学およびピッツバーグ大学の人間研究倫理委員会の倫理ガイドラインに従います。この研究で使用された材料に関する情報は、 材料表に記載されています。
1. 3Dプリントされたバイオリアクターの製造
- コンピュータソフトウェアを使用して、チャンバー、インサート、および蓋を含む骨軟骨(図2A)およびminiJointバイオリアクター(図2B)を設計します。各部品の寸法情報を 図 S1 に示します。
- デザインを3Dプリンターに転写し、フォトポリマーインクで印刷します。
- 3Dプリントされた部品(図2C-F)を15 mLの95%エタノールで3回すすぎます。次に、印刷片を懐中電灯重合装置で200秒間完全に架橋します。
- インサートと蓋にOリングを追加し(図2C、D)、部品がはまるかどうかをテストします(図2G、H)。

図2:ミニジョイントバイオリアクターを作るためのさまざまなコンポーネントの製造。 (A、B)、(A)骨軟骨および(B)ミニジョイントチップを作成するためのバイオリアクターの3Dモデル。(C、D)3Dプリントされた(C)蓋と(D)Oリングが取り付けられたインサート。(E、F)(E)骨軟骨および(F)ミニジョイント組織培養用の3Dプリントチャンバー。(G,H)(G)骨軟骨および(H)ミニジョイントチップの組み立て。この図の拡大版を表示するには、ここをクリックしてください。
2.組織コンポーネントのエンジニアリング
注:フェニル-2,4,6-トリメチルベンゾイルホスフィン酸リチウム(LAP)およびメタクリレート化ゼラチン(GelMA)の製造プロセスは、以前の研究8,9に記載されています。
- GelMAを作成するには、以下の手順に従ってください。
- ゼラチンB型17 gを蒸留水500 mLに加え、シェーカーで37°Cで30分間混合します。
- その後、無水メタクリル酸13mLを加え、37°Cの振とう機に戻し、一晩振とうする。
- 翌日、GelMAを個々の透析バッグに分注し、各バッグに~60 mLを入れます。
- すべての透析バッグを攪拌子付きの蒸留水に入れ、7日間の透析を可能にします。1日に複数回水を交換し、バッグを4°Cで一晩放置します。
- 7日目に、GelMAを-80°Cで凍結します。 完全に凍結したら、凍結乾燥に進みます。
- GelMAを凍結乾燥機の真空チャンバー内の皿に入れ、凍結乾燥させます。凍結乾燥機から取り出す前に、GelMAが完全に乾燥していることを確認してください。
- GelMAをハンクの平衡塩溶液(Ca2+およびMg2+を含むHBSS)に15%(w / v)で溶解します。pHが7.4であることを確認するには、pHが7.4に達するまでNaOHを少量加えます。取得した量に基づいて、1x抗生物質抗真菌薬と0.15%(w / v)LAPで溶液を補います。.15%GelMA溶液は、使用するまで-20°Cで保存し、光から保護してください。
- 3Dプリントされたデュアルフローバイオリアクターチャンバー、蓋、インサートをオートクレーブバッグに入れ、オートクレーブを121°Cで蒸気で20分間、次に乾熱で20分間オートクレーブします。
- 生物学的安全キャビネット内で、バイオリアクターチャンバー、蓋、およびインサートを15 mLの滅菌リン酸緩衝生理食塩水に一晩浸した後、乾燥させます。
- IRBの承認を得て、関節形成術の全手術廃棄物からヒト骨髄由来のMSCを分離します(ピッツバーグ大学およびワシントン大学)。
- 具体的には、大腿骨頸部と頭部の骨梁から骨髄を洗い流し、ダルベッコの改変イーグル培地(DMEM)に再懸濁します。
- 懸濁液を40 μmのストレーナーでろ過し、フロースルーを300 x g で5分間遠心分離します。
- 上清を除去し、増殖培地[DMEM、10%ウシ胎児血清(FBS)、および1x抗生物質抗真菌剤]を使用してペレットを再懸濁し、組織培養フラスコに入れます。
- 3日から4日ごとに培地を交換してください。先に進む前に、70%から80%の合流点に達していることを確認してください。
- トリプシン-EDTAと2〜3分間インキュベートして細胞を剥離し、T150フラスコあたり100万細胞の割合で継代した。
- セルを P5 まで展開します。トリプシン処理後、細胞を懸濁し、カウントし、300x g で5分間遠心分離してペレット化します。
- 1,000 μLピペットで、細胞を15%GelMA溶液に20 x 106 細胞/mLで再懸濁します。
注意: 生物学的安全キャビネットのライトをオフにします。 - 滅菌手袋を使用して、滅菌済みの乾燥したシリコン型をペトリ皿に押し付けます。次に、インサートの穴側を下に向けて、鉗子でシリコンモールドの各穴に1つのインサートを入れます。
- 200 μLのピペットを使用して、細胞懸濁液を添加してインサートを満たします(インサートあたり~50 μL)。
- UV懐中電灯(波長395nmのLEDライト)を使用して、ゲル/インサートの上部を1.5分間架橋します。次に、反対側を30秒間照らします。架橋は、LAP光開始剤がUV光にさらされると発生します。
注:細胞懸濁液は、この期間中インキュベーターに保管するか、光から保護することができます。 - 滅菌鉗子を使用して、インサートを非組織培養6ウェルプレート(DMEMに10%[v/v] FBSおよび1x抗生物質抗真菌薬を添加した)の8 mLの成長培地に直ちに移し、細胞を一晩回復させます。
- 細胞を4つの系統に分化させます。
- 脂肪組織(AT)を設計するには、インサートを8 mLの脂肪生成培地(AM;α-MEM、10%FBS、0.2 mMインドメタシン、1xインスリン-トランスフェリン-セレン(ITS)、0.45 mM 3-イソブチル-1-メチルキサンチン、0.1 μMデキサメタゾン、および1x抗生物質抗真菌薬)を分化を開始します。理想的には、4つのインサートを、8mLの脂肪生成培地と共に非組織培養ウェルプレートの1つのウェルに入れる。ウェルプレート内の細胞を28日間培養し、培地を1日おきに交換します。
- 骨軟骨ユニット(OC)を設計するには、インサートをデュアルフローバイオリアクターチャンバーに配置し、ウェルに蓋をし、35 mLの骨形成培地(OM;DMEM、10%FBS、1x抗生物質抗真菌剤、0.1 μMデキサメタゾン、0.01 M β-グリセロリン酸、100 ng / mL骨形成タンパク質7(BMP7)、50 μg/mLアスコルビン酸、および10 nMビタミンD3)および35 mLの軟骨形成培地(CM;DMEM、1x 抗生物質抗真菌剤、1x ITS、0.1 μMデキサメタゾン、40 μg/mL プロリン、50 μg/mL アスコルビン酸、および10 ng/mL形質転換成長因子β3)10。隔週の培地交換を行うことにより、細胞分化を28日間維持します。
- 線維芽細胞を誘導するには、20 mLの線維形成培地(FM;アドバンスドDMEM、5%FBS、1x GlutaMAX、1x抗生物質抗真菌剤、および50 μg/mLアスコルビン酸)を使用して、T150 cm2 組織培養フラスコで21日間にわたって2D培養でMSCを分化させます。毎週培地を交換してください。4 mLのトリプシンを使用して細胞を剥離し、上記のプロトコルに従って3Dゲルをインサート内にカプセル化して、滑膜様線維組織(SFT)を取得します。
注:すべての分化培地の組成を 表1に示します。
3. ミニジョイントチップの確立
- 3D miniJointバイオリアクターチャンバー、内径0.062インチ、外径0.125インチのシリコンチューブ、F 1/16ルアーロックコネクタをオートクレーブします。シリコンチューブを一方の端でminiJointバイオリアクターバーブに接続し、もう一方の端でルアーロックを接続します。
- 手順 2.11 で説明した AM、OM(BMP7 の削除)、および FMCM を準備します。さらに、ミニジョイント培養に使用する共通の共有培地(SM;フェノールレッドフリーDMEM、1x抗生物質抗真菌剤、1xNa-ピルビン酸、1x ITS、40 μg/mLプロリン、50 μg/mLアスコルビン酸、および0.5 ng/mL形質転換成長因子β3)を準備します。各培地35 mLを培地リザーバーに投入します。
- ストレート鉗子を使用して、骨軟骨ユニットをデュアルフローバイオリアクターからminiJointバイオリアクターの右側のウェルに移します。脂肪組織インサートと線維性組織インサートをそれぞれ左と中央のウェルに移します。滅菌した蓋ですべてのウェルに蓋をします。
- miniJointeチップの入口を培地リザーバーに接続し、出口をシリンジに接続します(図3A-C)。
- シリンジをシリンジポンプに取り付け(図3C)、ポンプとチップをインキュベーターに移します。培地リザーバーはインキュベーターの外側の氷の上に保たれます。
- ポンプを引き出しモードで操作し、培地リザーバーからミニジョイントバイオリアクターチャンバーに培地を引き込みます。このミニジョイント培養プロセスは28日間続きます。
- 関節の炎症と軟骨変性をモデル化するには、インターロイキン1β(IL-1β)を線維形成性培地流に10 ng/mLで加えます。IL-1β治療の3日目にシリンジを交換し、線維形成培地に新鮮なIL-1βを供給します。治療は7日間続きます。
- 薬物試験ステップの間、IL−1β治療の3日後、薬物が膝関節において局所的に使用される場合の「関節内投与」(図3D)をシミュレートする共有培地中のいずれかで薬物を投与するか、またはすべての培地タイプにおいて、薬物が循環を介して膝関節に作用する場合の「全身投与」(図3E)をシミュレートする。
- サンプルが過去4日間薬物治療を受けたかどうかにかかわらず、IL-1β治療の7日後に分析のために個々の組織を収集します。
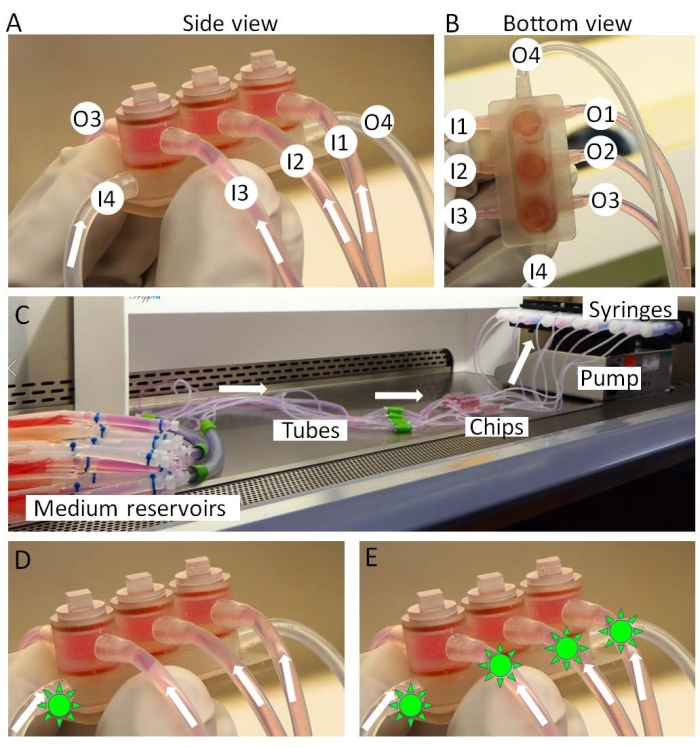
図3:ミニジョイントの組み立て 。 (A、B)組織特異的培地は、入口1〜3(I1-3)から導入され、出口1〜3(O1-3)から移動されます。共有メディアは I4 から O4 に灌流されます。(C)ミニジョイント文化の完全なセットアップ。薬物(緑色の太陽様形状)は、(D)共有培地のみまたは(E)「関節内投与」または「全身投与」をそれぞれシミュレートするために全ての培地に導入することができる。 この図の拡大版を表示するには、ここをクリックしてください。
4.個々の組織収集
- 滅菌した湾曲した鉗子を使用してインサートを取り外します。
- 生検パンチをインサートの中央に押し込んでゲルを取り除き、ゲルをPBSに入れます。
- 遺伝子発現を評価する際には、骨軟骨ゲルを半分にカットします。
注:骨軟骨ゲルは2つの組織タイプで構成されているため、骨形成細胞と軟骨形成細胞を分離することが重要です。 - さまざまな実験のために調整された培地と組織を収集します。
- 各培地源から約1.5 mLを収集します。
- 14,000 x g で10分間遠心分離し、沈殿物を廃棄した後、液体窒素中で調整された培地を瞬間凍結します。
- 組織学的染色および免疫染色では、まずOCおよびSFTサンプルを10%緩衝ホルマリンで固定し、昇順濃度のエタノールで脱水し、キシレンで透明化し、パラフィンに包埋し、最後に厚さ6μmで切片化します。
- AT微小組織の場合は、サンプルを10%緩衝ホルマリンで固定し、オイルレッドO溶液またはBODIPYで直接染色します。
結果
ミニジョイントのすべての組織を収集し、ミニジョイントで28日間の培養後に表現型を分析しました(図4A)。これについては、以前の出版物7で詳しく説明されています。
RT-qPCR、免疫染色、組織学的染色により、個々の微小組織について組織特異的な表現型が良好に維持されていることが確認されました(図4)。...
ディスカッション
本稿では、骨、軟骨、脂肪組織、滑膜様組織を間葉系幹細胞から形成し、カスタマイズされたバイオリアクター内で共培養する膝関節オンチップシステムを作成するためのプロトコルを紹介します。プラグアンドプレイ機能を備えたこの多成分ヒト細胞由来システムは、関節疾患の病因を研究し、医薬品を開発するための新しいツールです。
異なる組織が特定の培地を?...
開示事項
著者は、競合する利益を宣言しません。
謝辞
この研究は主に国立衛生研究所(UG3/UH3TR002136、UG3/UH3TR003090)からの資金提供を受けて行われた。さらに、ヒト組織サンプルを提供してくれたPaul Manner博士(ワシントン大学)と、MSCの単離と細胞プールの作成に協力してくれたJian Tan博士に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 3-isobutyl-1-methylxanthine | Sigma -Aldrich | I17018-1G | |
| 6 well non-tissue culture plate | Corning Falcon® Plates | 351146 | |
| 24 well non-tissue culture plate | Corning Falcon® Plates | 351147 | |
| 30 mL syringes | BD Syringe Luer Lock Cascade Health | 302832 | |
| Alcian blue stain | EK Industries | 1198 | 1% w/v, pH 1.0 |
| Advanced DMEM | Gibco | 12491-015 | |
| αMEM | Gibco | 12571-063 | |
| Antibiotic-antimycotic | Gibco | 15240-062 | |
| Biopsy punch | Integra Miltex | 12-460-407 | |
| BODIPY® fluorophore | Molecular Probes | ||
| Bone morphogenic protein 7 (BMP7) | Peprotech | ||
| Curved forceps | Fisher Brand | 16100110 | |
| DMEM | Gibco | 11995-065 | Dulbecco’s Modified Eagle Medium |
| Dexmethasome | Sigma -Aldrich | 02-05-2002 | |
| E-Shell 450 photopolymer in | EnvisionTec | RES-01-4022 | |
| Fetal Bovine Serum | Gemini-Bio Products | 900-208 | |
| GlutaMAX | Gibco | 3505-061 | |
| gelatin from bovine skin | Hyclone | 1003372809 | |
| Hank’s Balanced Salt Solution | Sigma -Aldrich | SH30588.02 | |
| indomethacin | Sigma -Aldrich | I7378-56 | |
| Insulin-Transferrin-Selenium-Ethanolamine (ITS) | Gibco | 51500-056 | |
| interleukin 1β | Peprotech | 200-01B | |
| Leur-loc connectors | Cole-Parmer Instruments | 45508-50 | |
| L-proline | Sigma -Aldrich | 115388-93-7 | |
| β-glycerophosphate | Sigma -Aldrich | 1003129352 | |
| Medium bags | KiYATEC | FC045 | |
| Methacrylic Anhydride | Sigma -Aldrich | 102378580 | |
| Phosphate buffered Saline | Corning | 21-040-CM | |
| Pointed forceps | Fisher Brand | 12000122 | |
| Silicon mold | McMaster-Carr | RC00114P | |
| Silicon o-rings | McMaster-Carr | ZMCCs1X5 | 1mm x 5mm |
| SolidWorks | Dassault Systèmes SE, Vélizy-Villacoublay, France | ||
| Surgical Blades | Integra Miltex | 4-122 | |
| Syringe pump | Lagato210P, KD Scientific | Z569631 | 10 syringe racks |
| T-182 tissue culture flasks | Fisher Brand | FB012939 | |
| Tissue Culture Dish 150 mm | Fisher Brand | FB012925 | |
| Transforming Growth Factor Beta (TGF-β3) | Peprotech | 100-36E | |
| Trypsin | Gibco | 25200-056 | |
| UV Flashlight | KBS | KB70109 | 395 nm |
| Vida Desktop 3D Printer | EnvisionTec | ||
| Vitamin D3 | Sigma -Aldrich | 32222-06-3 | 1,25-dihydroxyvitamin D3 |
参考文献
- Safiri, S., et al. Global, regional and national burden of osteoarthritis 1990-2017: A systematic analysis of the Global Burden of Disease Study 2017. Annals of the Rheumatic Diseases. 79 (6), 819-828 (2020).
- Lawrence, R. C., et al. Estimates of the prevalence of arthritis and other rheumatic conditions in the United States: Part II. Arthritis and Rheumatism. 58 (1), 26-35 (2008).
- Makarczyk, M. J., et al. Current models for development of disease-modifying osteoarthritis drugs. Tissue Engineering. Part C, Methods. 27 (2), 124-138 (2021).
- He, Y., et al. Pathogenesis of osteoarthritis: risk factors, regulatory pathways in chondrocytes, and experimental models. Biology. 9 (8), 194 (2020).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Lin, H., Sohn, J., Shen, H., Langhans, M. T., Tuan, R. S. Bone marrow mesenchymal stem cells: aging and tissue engineering applications to enhance bone healing. Biomaterials. 203, 96-110 (2019).
- Li, Z., et al. Human mesenchymal stem cell-derived miniature joint system for disease modeling and drug testing. Advanced Science. 9 (21), 2105909 (2022).
- Lin, H., Cheng, A. W., Alexander, P. G., Beck, A. M., Tuan, R. S. Cartilage tissue engineering application of injectable gelatin hydrogel with in situ visible-light-activated gelation capability in both air and aqueous solution. Tissue Engineering. Part A. 20 (17-18), 2402-2411 (2014).
- Fairbanks, B. D., Schwartz, M. P., Bowman, C. N., Anseth, K. S. Photoinitiated polymerization of PEG-diacrylate with lithium phenyl-2,4,6-trimethylbenzoylphosphinate: polymerization rate and cytocompatibility. Biomaterials. 30 (35), 6702-6707 (2009).
- Lin, H., Lozito, T. P., Alexander, P. G., Gottardi, R., Tuan, R. S. Stem cell-based microphysiological osteochondral system to model tissue response to interleukin-1β. Molecular Pharmaceutics. 11 (7), 2203-2212 (2014).
- Yin, B., et al. Hybrid macro-porous titanium ornamented by degradable 3D gel/nHA micro-scaffolds for bone tissue regeneration. International Journal of Molecular Sciences. 17 (4), 575 (2016).
- Lin, Z., et al. Osteochondral tissue chip derived from iPSCs: Modeling OA pathologies and testing drugs. Frontiers in Bioengineering and Biotechnology. 7, 411 (2019).
- Atukorala, I., et al. Synovitis in knee osteoarthritis: A precursor of disease. Annals of the Rheumatic Diseases. 75 (2), 390-395 (2016).
- Occhetta, P., et al. Hyperphysiological compression of articular cartilage induces an osteoarthritic phenotype in a cartilage-on-a-chip model. Nature Biomedical Engineering. 3 (7), 545-557 (2019).
- He, C., et al. Modeling early changes associated with cartilage trauma using human-cell-laden hydrogel cartilage models. Stem Cell Research and Therapy. 13 (1), 400 (2022).
- Elsissy, J. G., et al. Bacterial septic arthritis of the adult native knee joint: A review. JBJS Reviews. 8 (1), 0059 (2020).
- Romero-Lopez, M., et al. Macrophage effects on mesenchymal stem cell osteogenesis in a three-dimensional in vitro bone model. Tissue Engineering. Part A. 26 (19-20), 1099-1111 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved