É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Criação de uma articulação do joelho em um chip para modelagem de doenças articulares e testes de medicamentos
Neste Artigo
Resumo
Fornecemos métodos detalhados para gerar quatro tipos de tecidos a partir de células-tronco mesenquimais humanas, que são usadas para recapitular a cartilagem, osso, coxim gorduroso e sinóvia na articulação do joelho humano. Esses quatro tecidos são integrados em um biorreator personalizado e conectados através de microfluídica, gerando assim uma articulação do joelho em um chip.
Resumo
A alta prevalência de doenças articulares debilitantes como a osteoartrite (OA) representa um alto ônus socioeconômico. Atualmente, as drogas disponíveis que têm como alvo as desordens articulares são, em sua maioria, paliativas. A necessidade não atendida de drogas modificadoras de doença (DMOADs) eficazes tem sido causada principalmente pela ausência de modelos apropriados para estudar os mecanismos da doença e testar potenciais DMOADs. Neste trabalho, descrevemos o estabelecimento de um sistema microfisiológico mini-sinovial que mimetiza a articulação sinovial (miniJoint) composto por componentes do tecido adiposo, fibroso e osteocondral derivados de células-tronco mesenquimais humanas (CTMs). Para a obtenção dos microtecidos tridimensionais (3D), as CTMs foram encapsuladas em gelatina metacrilada fotoreticulável antes ou após a diferenciação. As construções de tecido carregadas de células foram então integradas em um biorreator impresso em 3D, formando a miniJoint. Fluxos separados de meios osteogênicos, fibrogênicos e adipogênicos foram introduzidos para manter os respectivos fenótipos teciduais. Um fluxo comumente compartilhado foi perfundido através da cartilagem, sinovial e tecido adiposo para permitir o crosstalk tecidual. Este padrão de fluxo permite a indução de perturbações em um ou mais dos componentes teciduais para estudos mecanísticos. Além disso, potenciais DMOADs podem ser testados através de "administração sistêmica" através de todos os fluxos de meio ou "administração intra-articular" adicionando os medicamentos apenas ao fluxo compartilhado de simulador de "líquido sinovial". Assim, o miniJoint pode servir como uma plataforma in vitro versátil para estudar eficientemente os mecanismos de doenças e testar drogas em medicina personalizada.
Introdução
Doenças articulares como a osteoartrite (OA) são altamente prevalentes e debilitantes e representam uma das principais causas de incapacidade em todo omundo1. Estima-se que, somente nos EUA, a OA afete 27 milhões de pacientes e ocorra em 12,1% dos adultos com 60 anos oumais2. Infelizmente, a maioria dos medicamentos atualmente utilizados para o manejo de doenças articulares é paliativa, e não há drogas modificadoras de doença (DMOADs) eficazes3. Essa necessidade médica não atendida decorre principalmente da ausência de um modelo eficaz para estudar os mecanismos da doença e desenvolver potenciais DMOADs. A cultura celular bidimensional (2D) convencional não reflete a natureza 3D dos tecidos articulares, e a cultura de explantes teciduais é frequentemente dificultada por morte celular significativa e geralmente falha em replicar as interconexões teciduais dinâmicas4. Além disso, diferenças genéticas e anatômicas reduzem significativamente a relevância fisiológica de modelos animais4.
Organs-on-chips (OoCs), ou sistemas microfisiológicos, são um campo de pesquisa promissor na interface da engenharia, biologia e medicina. Essas plataformas in vitro são unidades funcionais mínimas que replicam características saudáveis ou patológicas definidas de suas contrapartes in vivo 5. Além disso, esses sistemas miniaturizados podem hospedar diversas células e matrizes e simular as interações biofísicas e bioquímicas entre diferentes tecidos. Portanto, um sistema microfisiológico que possa recapitular fielmente a articulação sinovial nativa promete oferecer uma plataforma eficaz para modelar doenças articulares e desenvolver potenciais DMOADs.
As células-tronco mesenquimais humanas (CTMs) podem ser isoladas de vários tecidos do corpo e diferenciadas em linhagens osteogênicas, condrogênicas e adipogênicas6. As CTMs têm sido usadas com sucesso para a engenharia de vários tecidos, incluindo osso, cartilagem e tecido adiposo6, o que significa que representam uma fonte celular promissora para a engenharia dos componentes teciduais da articulação do joelho. Recentemente, desenvolvemos um sistema microfisiológico que mimetiza uma articulação em miniatura, denominado miniJoint, que compreende os tecidos ósseo, cartilaginoso, fibroso e adiposo derivados dasCTMs7. Em particular, o novo design permite crosstalk tecidual por fluxo microfluídico ou permeação (Figura 1). Aqui, apresentamos os protocolos para a fabricação dos componentes do chip, a engenharia dos componentes do tecido, a cultura dos tecidos projetados no chip e a coleta de tecidos para análises a jusante.
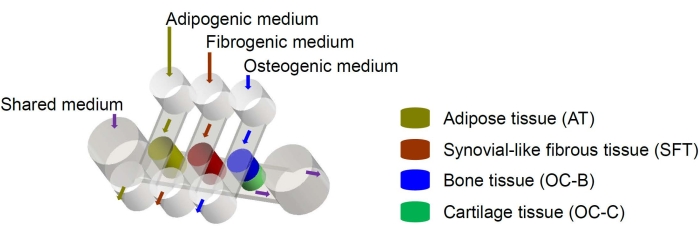
Figura 1: Esquema do chip miniJoint mostrando a disposição dos diferentes componentes do tecido e fluxos médios. CO = tecido osteocondral. Clique aqui para ver uma versão maior desta figura.
Protocolo
O protocolo a seguir segue as diretrizes éticas da Universidade de Pittsburgh e do comitê de ética em pesquisa humana da Universidade de Pittsburgh. As informações sobre os materiais utilizados neste estudo estão listadas na Tabela de Materiais.
1. Fabricação de biorreatores impressos em 3D
- Use um programa de computador para projetar biorreatores osteocondrais (Figura 2A) e miniJoint (Figura 2B) que incluem câmaras, insertos e tampas. As informações de dimensão de cada peça são mostradas na Figura S1.
- Transfira o design para uma impressora 3D e imprima com uma tinta de fotopolímero.
- Enxaguar as peças impressas em 3D (Figura 2C-F) com 15 mL de etanol 95% três vezes. Em seguida, reticule totalmente as peças impressas por 200 s em um dispositivo de polimerização de lanterna.
- Adicione O-rings aos insertos e tampas (Figura 2C, D) e teste se as peças se encaixam (Figura 2G, H).

Figura 2: Fabricação dos diferentes componentes para fazer o biorreator miniJoint (A,B), modelos 3D de biorreatores para criação de (A) chips osteocondrais e (B) miniJoint chips. (C,D) tampas (C) impressas em 3D e insertos (D) com o O-ring instalado. (E,F) câmaras impressas em 3D para (E) cultura de tecidos osteocondrais e (F) miniJoint tissue. (G,H) Montagem de (G) chips osteocondrais e (H) miniJoint chips. Clique aqui para ver uma versão maior desta figura.
2. Engenharia dos componentes teciduais
OBS: Os processos de fabricação de fenil-2,4,6-trimetilbenzoilfosfinato de lítio (LAP) e gelatina metacrilada (GelMA) são descritos em estudos anteriores 8,9.
- Para criar o GelMA, siga as etapas abaixo.
- Adicionar 17 g de gelatina Tipo B a 500 ml de água destilada e, em seguida, misturar num agitador durante 30 minutos a 37 °C.
- Em seguida, adicione 13 mL de anidrido metacrílico, coloque novamente no agitador a 37 °C e deixe agitar durante a noite.
- No dia seguinte, aliquotar o GelMA em bolsas de diálise individuais, com ~60 mL em cada bolsa.
- Coloque todos os sacos de diálise em água destilada com uma barra de agitação e aguarde 7 dias de diálise. Troque a água várias vezes ao dia e deixe os sacos a 4 °C durante a noite.
- No dia 7, congele o GelMA a -80 °C. Uma vez completamente congelado, proceda à liofilização.
- Coloque o GelMA num prato na câmara de vácuo de um liofilizador e deixe a liofilização. Certifique-se de que o GelMA está completamente seco antes da remoção do liofilizador.
- Dissolver o GelMA em solução salina balanceada de Hank (HBSS com Ca 2+ e Mg2+) a 15% (p/v). Para garantir que o pH esteja em 7,4, adicione NaOH em pequenas quantidades até que o pH atinja 7,4. Completar a solução com 1x antibiótico-antimicótico e 0,15% (p/v) de LAP com base no volume adquirido. Conservar a solução de GelMA a 15% a -20 °C até à utilização e protegê-la da luz.
- Coloque câmaras, tampas e inserções de biorreator de fluxo duplo impressas em 3D em sacos de autoclave e autoclave a 121 °C por 20 min com vapor e depois por 20 min com calor seco.
- Dentro do gabinete de segurança biológica, mergulhe as câmaras do biorreator, tampas e inserções em 15 mL de solução salina estéril tamponada com fosfato durante a noite, após o que deixá-los secar.
- Isolar CTMs derivadas da medula óssea humana de resíduos cirúrgicos de artroplastia total articular com aprovação do IRB (Universidade de Pittsburgh e Universidade de Washington).
- Especificamente, elimine a medula óssea do osso trabecular do colo femoral e da cabeça, e ressuspenda-a no Dulbecco's Modified Eagle's Medium (DMEM).
- Filtrar a suspensão através de um filtro de 40 μm e centrifugar o fluxo a 300 x g durante 5 minutos.
- Retirar o sobrenadante, ressuspender os pellets com meio de cultura [DMEM, soro fetal bovino (SFB) a 10% e antibiótico-antimicótico 1x e, em seguida, colocar em frascos de cultura de tecidos.
- Troque o meio de cultura a cada 3 dias a 4 dias. Certifique-se de que uma confluência de 70% a 80% seja alcançada antes de prosseguir.
- Separar as células incubando-se com tripsina-EDTA por 2-3 min e passar na proporção de 1 milhão de células por frasco T150.
- Expanda as células para P5. Após a tripsinização, suspender as células, contá-las e, em seguida, pellet centrifugando a 300x g por 5 min.
- Com uma pipeta de 1.000 μL, ressuspenda as células a 20 x 106 células/mL em solução de GelMA a 15%.
NOTA: Desligue a luz do armário de segurança biológica. - Usando luvas estéreis, pressione um molde de silicone estéril e seco contra uma placa de Petri. Em seguida, coloque uma pastilha em cada orifício do molde de silicone com pinças, com o lado do furo da pastilha virado para baixo.
- Usando uma pipeta de 200 μL, adicione a suspensão da célula para encher a pastilha (~50 μL por inserção).
- Use uma lanterna UV (luz LED com comprimento de onda de 395 nm) para fazer a ligação cruzada da parte superior do gel/inserção por 1,5 min. Em seguida, ilumine o outro lado por 30 s. A reticulação ocorre quando o fotoiniciador LAP é exposto à luz UV.
NOTA: A suspensão celular pode ser mantida na incubadora durante este período ou protegida da luz. - Com pinças estéreis, transfira imediatamente as pastilhas para 8 mL de meio de crescimento em uma placa de 6 poços sem cultura tecidual (DMEM suplementado com 10% [v/v] FBS e 1x antibiótico-antimicótico) para permitir que as células se recuperem durante a noite.
- Diferenciar as células em direção a quatro linhagens.
- Para engenharia de tecido adiposo (TA), transferir as pastilhas para 8 mL de meio adipogênico (MA; Alfa-MEM, 10% FBS, 0,2 mM indometacina, 1x insulina-transferrina-selênio (ITS), 0,45 mM 3-isobutil-1-metilxantina, 0,1 μM dexametasona e 1x antibiótico-antimicótico) para iniciar a diferenciação. Idealmente, quatro insertos são colocados em um único poço de uma placa de poço não tecidual com 8 mL de meio adipogênico. Cultivar as células nas placas do poço por 28 dias, com trocas de meio a cada dois dias.
- Para projetar as unidades osteocondrais (CO), coloque as pastilhas em câmaras de biorreator de duplo fluxo, tampe os poços e infunda as duas correntes separadamente a uma taxa de fluxo de 5 μL/min com 35 mL de meio osteogênico (MO; DMEM, SFB a 10%, 1x antibiótico-antimicótico, 0,1 μM de dexametasona, 0,01 M de β-glicerofosfato, 100 ng/mL de proteína morfogênica óssea 7 (BMP7), 50 μg/mL de ácido ascórbico e 10 nM de vitamina D3) e 35 mL de meio condrogênico (CM; DMEM, 1x antibiótico-antimicótico, 1x ITS, 0,1 μM de dexametasona, 40 μg/mL de prolina, 50 μg/mL de ácido ascórbico e 10 ng/mL de fator transformador de crescimento β3)10. Manter a diferenciação celular por 28 dias, realizando trocas quinzenais do meio.
- Para derivar os fibroblastos, diferenciar as CTMs em cultura 2D durante 21 dias em frasco de cultura de tecido T150cm2 utilizando 20 mL de meio fibrogênico (FM; DMEM avançado, SFB a 5%, 1x GlutaMAX, 1x antibiótico-antimicótico e 50 μg/mL de ácido ascórbico). Mude o meio toda semana. Utilizar 4 mL de tripsina para desprendimento das células e encapsular os géis 3D dentro das pastilhas, seguindo o protocolo descrito acima, para obtenção de tecido fibroso sinovial semelhante (TFS).
NOTA: As composições de todos os meios de diferenciação encontram-se na Tabela 1.
3. Estabelecimento do chip miniJoint
- Autoclave as câmaras de biorreator 3D miniJoint, tubos de silicone com diâmetro interno de 0,062 polegada e diâmetro externo de 0,125 polegada, e conectores F 1/16 Luer-lock. Conecte a tubulação de silicone à farpa do biorreator miniJoint em uma extremidade e conecte a trava Luer na outra extremidade.
- Prepare o AM, OM (removendo BMP7) e FMCM mencionados na etapa 2.11. Adicionalmente, preparar o meio comum compartilhado (SM; DMEM livre de vermelho fenol, 1x antibiótico-antimicótico, 1x Na-piruvato, 1x ITS, 40 μg/mL prolina, 50 μg/mL de ácido ascórbico e 0,5 ng/mL de fator transformador de crescimento β3) para ser usado para a cultura miniJoint. Carregar 35 mL de cada meio nos reservatórios médios.
- Use pinças retas para transferir a unidade osteocondral do biorreator de fluxo duplo para o poço direito do biorreator miniJoint. Transferir a inserção de tecido adiposo e tecido fibroso para os poços esquerdo e médio, respectivamente. Tampe todos os poços com tampas esterilizadas.
- Conecte as entradas do chip miniJoint aos reservatórios médios e as saídas às seringas (Figura 3A-C).
- Monte as seringas em uma bomba de seringa (Figura 3C) e transfira a bomba e os cavacos para uma incubadora. Os reservatórios médios são mantidos em gelo fora da incubadora.
- Opere a bomba no modo de retirada, puxando o meio do reservatório médio para a câmara do biorreator miniJoint. Esse processo de minicultura dura 28 dias.
- Para modelar a inflamação articular e a degeneração da cartilagem, adicionar interleucina 1β (IL-1β) à corrente do meio fibrogênico a 10 ng/mL. Substitua as seringas no terceiro dia de tratamento com IL-1β e forneça IL-1β fresca ao meio fibrogênico. O tratamento tem duração de 7 dias.
- Durante a etapa de teste da droga, após 3 dias de tratamento com IL-1β, administrá-la no meio compartilhado, simulando uma "administração intra-articular" (Figura 3D), quando a droga é usada localmente na articulação do joelho, ou em todos os tipos de meio, simulando uma "administração sistêmica" (Figura 3E), quando a droga age na articulação do joelho através da circulação.
- Coletar tecidos individuais para análise após 7 dias de tratamento com IL-1β, independentemente de as amostras terem sido ou não submetidas a tratamento medicamentoso nos últimos 4 dias.
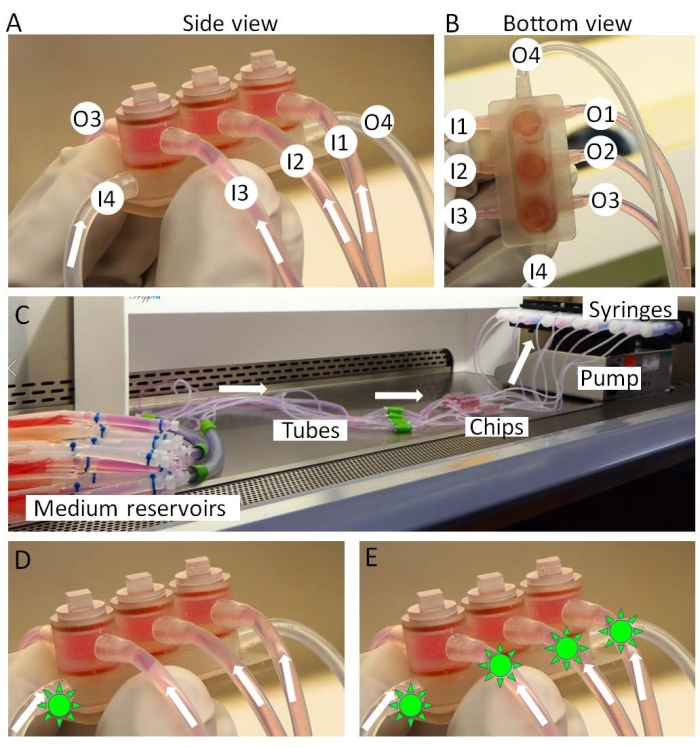
Figura 3: Montagem da miniJoint. (A,B) Os meios tecido-específicos são introduzidos a partir das entradas 1-3 (I1-3) e removidos das saídas 1-3 (O1-3). O meio compartilhado é perfundido de I4 a O4. (C) A configuração completa da minicultura. As drogas (formas verdes semelhantes ao sol) podem ser introduzidas em (D) apenas no meio compartilhado ou (E) em todos os meios para, respectivamente, simular "administração intra-articular" ou "administração sistêmica". Clique aqui para ver uma versão maior desta figura.
4. Coleta individual de tecidos
- Use pinças curvas estéreis para remover as pastilhas.
- Empurre um punch de biópsia através do centro da inserção para remover o gel e coloque o gel em PBS.
- Cortar os géis osteocondrais ao meio ao avaliar a expressão gênica.
NOTA: Como o gel osteocondral é composto por dois tipos de tecido, é importante separar as células osteogênicas e condrogênicas. - Coletar os meios e tecidos condicionados para vários experimentos.
- Coletar cerca de 1,5 mL de cada fonte de meio.
- Congelar o meio condicionado em nitrogênio líquido após centrifugação a 14.000 x g por 10 min e descarte do sedimento.
- Para coloração histológica e imunomarcação, primeiramente fixar as amostras de OC e SFT em formalina tamponada a 10%, desidratá-las em etanol de concentrações ascendentes, limpá-las em xileno, embuti-las em parafina e, finalmente, seccioná-las a uma espessura de 6 μm.
- Para os microtecidos TA, fixar as amostras em formalina tamponada a 10% e corá-las diretamente com solução de Oil Red O ou BODIPY.
Resultados
Todos os tecidos da miniJoint foram coletados para análise de seus fenótipos após 28 dias de cultura na miniJoint (Figura 4A). Isso foi detalhado em nossa publicação anterior7.
Através do uso de RT-qPCR, imunomarcação e coloração histológica, confirmou-se que os fenótipos tecido-específicos estavam bem mantidos para os microtecidos individuais (Figura 4). Por exemplo, o componente ósseo dos microt...
Discussão
Neste artigo, apresentamos um protocolo para a criação de um sistema de articulação do joelho em um chip, no qual osso, cartilagem, tecido adiposo e tecidos semelhantes à sinóvia são formados a partir de CTMs e co-cultivados dentro de um biorreator personalizado. Este sistema multicomponente, derivado de células humanas com características plug-and-play, representa uma nova ferramenta para estudar a patogênese de doenças articulares e desenvolver drogas.
Como diferentes tecidos fav...
Divulgações
Os autores declaram não haver interesses concorrentes.
Agradecimentos
Esta pesquisa foi apoiada principalmente por financiamento do National Institutes of Health (UG3/UH3TR002136, UG3/UH3TR003090). Além disso, agradecemos ao Dr. Paul Manner (Universidade de Washington) por fornecer as amostras de tecido humano e ao Dr. Jian Tan por sua ajuda no isolamento das CTMs e na criação do pool de células.
Materiais
| Name | Company | Catalog Number | Comments |
| 3-isobutyl-1-methylxanthine | Sigma -Aldrich | I17018-1G | |
| 6 well non-tissue culture plate | Corning Falcon® Plates | 351146 | |
| 24 well non-tissue culture plate | Corning Falcon® Plates | 351147 | |
| 30 mL syringes | BD Syringe Luer Lock Cascade Health | 302832 | |
| Alcian blue stain | EK Industries | 1198 | 1% w/v, pH 1.0 |
| Advanced DMEM | Gibco | 12491-015 | |
| αMEM | Gibco | 12571-063 | |
| Antibiotic-antimycotic | Gibco | 15240-062 | |
| Biopsy punch | Integra Miltex | 12-460-407 | |
| BODIPY® fluorophore | Molecular Probes | ||
| Bone morphogenic protein 7 (BMP7) | Peprotech | ||
| Curved forceps | Fisher Brand | 16100110 | |
| DMEM | Gibco | 11995-065 | Dulbecco’s Modified Eagle Medium |
| Dexmethasome | Sigma -Aldrich | 02-05-2002 | |
| E-Shell 450 photopolymer in | EnvisionTec | RES-01-4022 | |
| Fetal Bovine Serum | Gemini-Bio Products | 900-208 | |
| GlutaMAX | Gibco | 3505-061 | |
| gelatin from bovine skin | Hyclone | 1003372809 | |
| Hank’s Balanced Salt Solution | Sigma -Aldrich | SH30588.02 | |
| indomethacin | Sigma -Aldrich | I7378-56 | |
| Insulin-Transferrin-Selenium-Ethanolamine (ITS) | Gibco | 51500-056 | |
| interleukin 1β | Peprotech | 200-01B | |
| Leur-loc connectors | Cole-Parmer Instruments | 45508-50 | |
| L-proline | Sigma -Aldrich | 115388-93-7 | |
| β-glycerophosphate | Sigma -Aldrich | 1003129352 | |
| Medium bags | KiYATEC | FC045 | |
| Methacrylic Anhydride | Sigma -Aldrich | 102378580 | |
| Phosphate buffered Saline | Corning | 21-040-CM | |
| Pointed forceps | Fisher Brand | 12000122 | |
| Silicon mold | McMaster-Carr | RC00114P | |
| Silicon o-rings | McMaster-Carr | ZMCCs1X5 | 1mm x 5mm |
| SolidWorks | Dassault Systèmes SE, Vélizy-Villacoublay, France | ||
| Surgical Blades | Integra Miltex | 4-122 | |
| Syringe pump | Lagato210P, KD Scientific | Z569631 | 10 syringe racks |
| T-182 tissue culture flasks | Fisher Brand | FB012939 | |
| Tissue Culture Dish 150 mm | Fisher Brand | FB012925 | |
| Transforming Growth Factor Beta (TGF-β3) | Peprotech | 100-36E | |
| Trypsin | Gibco | 25200-056 | |
| UV Flashlight | KBS | KB70109 | 395 nm |
| Vida Desktop 3D Printer | EnvisionTec | ||
| Vitamin D3 | Sigma -Aldrich | 32222-06-3 | 1,25-dihydroxyvitamin D3 |
Referências
- Safiri, S., et al. Global, regional and national burden of osteoarthritis 1990-2017: A systematic analysis of the Global Burden of Disease Study 2017. Annals of the Rheumatic Diseases. 79 (6), 819-828 (2020).
- Lawrence, R. C., et al. Estimates of the prevalence of arthritis and other rheumatic conditions in the United States: Part II. Arthritis and Rheumatism. 58 (1), 26-35 (2008).
- Makarczyk, M. J., et al. Current models for development of disease-modifying osteoarthritis drugs. Tissue Engineering. Part C, Methods. 27 (2), 124-138 (2021).
- He, Y., et al. Pathogenesis of osteoarthritis: risk factors, regulatory pathways in chondrocytes, and experimental models. Biology. 9 (8), 194 (2020).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Lin, H., Sohn, J., Shen, H., Langhans, M. T., Tuan, R. S. Bone marrow mesenchymal stem cells: aging and tissue engineering applications to enhance bone healing. Biomaterials. 203, 96-110 (2019).
- Li, Z., et al. Human mesenchymal stem cell-derived miniature joint system for disease modeling and drug testing. Advanced Science. 9 (21), 2105909 (2022).
- Lin, H., Cheng, A. W., Alexander, P. G., Beck, A. M., Tuan, R. S. Cartilage tissue engineering application of injectable gelatin hydrogel with in situ visible-light-activated gelation capability in both air and aqueous solution. Tissue Engineering. Part A. 20 (17-18), 2402-2411 (2014).
- Fairbanks, B. D., Schwartz, M. P., Bowman, C. N., Anseth, K. S. Photoinitiated polymerization of PEG-diacrylate with lithium phenyl-2,4,6-trimethylbenzoylphosphinate: polymerization rate and cytocompatibility. Biomaterials. 30 (35), 6702-6707 (2009).
- Lin, H., Lozito, T. P., Alexander, P. G., Gottardi, R., Tuan, R. S. Stem cell-based microphysiological osteochondral system to model tissue response to interleukin-1β. Molecular Pharmaceutics. 11 (7), 2203-2212 (2014).
- Yin, B., et al. Hybrid macro-porous titanium ornamented by degradable 3D gel/nHA micro-scaffolds for bone tissue regeneration. International Journal of Molecular Sciences. 17 (4), 575 (2016).
- Lin, Z., et al. Osteochondral tissue chip derived from iPSCs: Modeling OA pathologies and testing drugs. Frontiers in Bioengineering and Biotechnology. 7, 411 (2019).
- Atukorala, I., et al. Synovitis in knee osteoarthritis: A precursor of disease. Annals of the Rheumatic Diseases. 75 (2), 390-395 (2016).
- Occhetta, P., et al. Hyperphysiological compression of articular cartilage induces an osteoarthritic phenotype in a cartilage-on-a-chip model. Nature Biomedical Engineering. 3 (7), 545-557 (2019).
- He, C., et al. Modeling early changes associated with cartilage trauma using human-cell-laden hydrogel cartilage models. Stem Cell Research and Therapy. 13 (1), 400 (2022).
- Elsissy, J. G., et al. Bacterial septic arthritis of the adult native knee joint: A review. JBJS Reviews. 8 (1), 0059 (2020).
- Romero-Lopez, M., et al. Macrophage effects on mesenchymal stem cell osteogenesis in a three-dimensional in vitro bone model. Tissue Engineering. Part A. 26 (19-20), 1099-1111 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados