需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
创建膝关节芯片,用于关节疾病建模和药物测试
摘要
我们提供了从人间充质干细胞生成四种类型的组织的详细方法,这些组织用于概括人膝关节中的软骨、骨骼、脂肪垫和滑膜。这四个组织被集成到一个定制的生物反应器中,并通过微流体连接,从而产生一个膝关节芯片。
摘要
骨关节炎(OA)等使人衰弱的关节疾病的高患病率构成了很高的社会经济负担。目前,针对关节疾病的可用药物大多是姑息性的。对有效的疾病修饰OA药物(DMOADs)的需求未得到满足,主要是由于缺乏适当的模型来研究疾病机制和测试潜在的DMOADs。在这里,我们描述了一个微型滑膜关节模拟微生理系统(miniJoint)的建立,该系统包括来自人间充质干细胞(MSCs)的脂肪,纤维和骨软骨组织成分。为了获得三维(3D)微组织,在分化之前或之后将MSCs包封在可光交联的甲基丙烯酸化明胶中。然后将充满细胞的组织结构整合到3D打印的生物反应器中,形成miniJoint。引入单独的成骨、纤维化和成脂培养基流以维持各自的组织表型。通过软骨、滑膜和脂肪组织灌注常见的共享流,以实现组织串扰。这种流动模式允许在一个或多个组织成分中诱导扰动以进行机理研究。此外,可以通过所有培养基流的"全身给药"或通过仅将药物添加到共享的"滑液"模拟流中的"关节内给药" 来 测试潜在的DMOAD。因此,miniJoint可以作为一个多功能 的体外 平台,用于有效研究疾病机制和测试个性化医疗中的药物。
引言
骨关节炎 (OA) 等关节疾病非常普遍且使人衰弱,是全球残疾的主要原因1。据估计,仅在美国,OA就影响了2700万患者,12.1%的60岁及以上成年人2。不幸的是,目前用于治疗关节疾病的大多数药物都是姑息性的,并且没有有效的疾病改善OA药物(DMOADs)可用3。这种未满足的医疗需求主要源于缺乏研究疾病机制和开发潜在DMOAD的有效模型。传统的二维(2D)细胞培养不能反映关节组织的3D性质,并且组织外植体的培养经常受到显着细胞死亡的阻碍,并且通常无法复制动态组织互连4。此外,遗传和解剖学差异显着降低了动物模型的生理相关性4。
器官芯片(OoCs)或微生理系统是工程,生物学和医学界面的一个有前途的研究领域。这些 体外 平台是最小的功能单位,可复制其 体内 对应物的定义健康或病理特征5。此外,这些小型化系统可以容纳不同的细胞和基质,并模拟不同组织之间的生物物理和生化相互作用。因此,能够忠实地概括天然滑膜关节的微生理系统有望为关节疾病建模和开发潜在的DMOAD提供有效的平台。
人间充质干细胞(MSCs)可以从全身的许多组织中分离出来,并分化为成骨、软骨和成脂谱系6。间充质干细胞已成功用于设计各种组织,包括骨骼,软骨和脂肪组织6,这意味着它们代表了设计膝关节组织成分的有前途的细胞来源。我们最近开发了一种微型关节模拟微生理系统,名为miniJoint,包括MSC衍生的骨骼,软骨,纤维和脂肪组织7。特别是,新颖的设计可以通过微流体流动或渗透实现组织串扰(图1)。在这里,我们提出了芯片组件的制造,组织组件的工程,芯片中工程组织的培养以及用于下游分析的组织收集的协议。
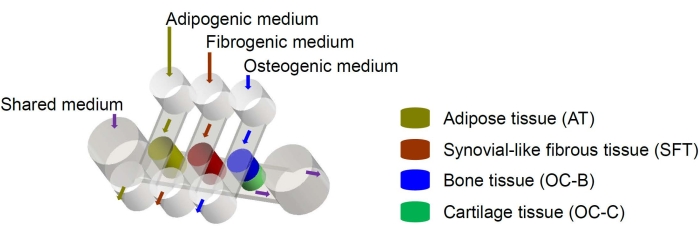
图 1:miniJoint 芯片示意图,显示了不同组织组件和介质流的排列。 OC = 骨软骨组织。 请点击此处查看此图的大图。
Access restricted. Please log in or start a trial to view this content.
研究方案
以下协议遵循匹兹堡大学和匹兹堡大学人类研究伦理委员会的伦理准则。有关本研究所用材料的信息列在 材料表中。
1. 制造3D打印生物反应器
- 使用计算机软件设计骨软骨(图2A)和微型关节生物反应器(图2B),包括腔室,插入物和盖子。每个零件的尺寸信息如图 S1所示。
- 将设计转移到3D打印机,并使用光敏聚合物墨水打印。
- 用 15 mL 的 95% 乙醇冲洗 3D 打印部件(图 2C-F)。然后,在手电筒聚合装置中将打印件完全交联200秒。
- 将O形圈添加到插件和盖子上(图2C,D),并测试零件是否合适(图2G,H)。

图2:制造miniJoint生物反应器的不同组件的制造。 (A,B),用于创建(A)骨软骨和(B)微型关节芯片的生物反应器的3D模型。(C,D)安装了O形圈的3D打印(C)盖子和(D)插件。(E,F)用于(E)骨软骨和(F)微型关节组织培养的3D打印室。(G,H)组装(G)骨软骨和(H)微型关节芯片。请点击此处查看此图的大图。
2. 组织成分工程
注意:苯基-2,4,6-三甲基苯甲酰次膦酸锂(LAP)和甲基丙烯酸化明胶(GelMA)的制造工艺在以前的研究8,9中有所描述。
- 要创建GelMA,请按照以下步骤操作。
- 将17gB型明胶加入500mL蒸馏水中,然后在37°C下在摇床上混合30分钟。
- 然后,加入13mL甲基丙烯酸酐,放回37°C摇床上,摇匀过夜。
- 第二天,将GelMA等分到单独的透析袋中,每个袋中~60毫升。
- 将所有透析袋放入带搅拌棒的蒸馏水中,并允许透析7天。每天多次换水,并将袋子在4°C下过夜。
- 在第7天,将GelMA冷冻在-80°C。 完全冷冻后,进行冻干。
- 将GelMA放入冻干机真空室的培养皿中,并冷冻干燥。确保在从冻干机中取出之前,GelMA已完全干燥。
- 将GelMA溶解在Hank的平衡盐溶液(含Ca 2+和Mg2+的HBSS)中,浓度为15%(w / v)。为确保pH值为7.4,请少量添加NaOH,直到pH值达到7.4。根据获得的体积,用1x抗生素 - 抗真菌剂和0.15%(w / v)LAP补充溶液。将15%GelMA溶液储存在-20°C直至使用,并避光。
- 将3D打印的双流生物反应器室,盖子和插入物放入高压灭菌器袋中,并在121°C下用蒸汽高压灭菌20分钟,然后用干热高压灭菌20分钟。
- 在生物安全柜内,将生物反应器室、盖子和插入物浸泡在 15 mL 无菌磷酸盐缓冲盐水中过夜,然后让它们干燥。
- 经IRB批准(匹兹堡大学和华盛顿大学),从全关节置换手术废物中分离出人骨髓来源的MSC。
- 具体来说,从股骨颈和头部的小梁骨中冲洗出骨髓,并将其重新悬浮在Dulbecco的改良鹰培养基(DMEM)中。
- 通过40μm过滤器过滤悬浮液,并以300× g 离心流出物5分钟。
- 除去上清液,使用生长培养基[DMEM,10%胎牛血清(FBS)和1x抗生素 - 抗真菌剂]重悬沉淀,然后放入组织培养瓶中。
- 每3天至4天更换培养基。在继续操作之前,请确保达到 70% 到 80% 的汇合率。
- 通过与胰蛋白酶-EDTA孵育2-3分钟来分离细胞,并以每个T150烧瓶100万个细胞的比例传代。
- 将单元格展开到 P5。胰蛋白酶消化后,悬浮细胞,计数,然后以300×g 离心5分钟沉淀。
- 用 1,000 μL 移液器将细胞以 20 x 106 个细胞/mL 重悬于 15% GelMA 溶液中。
注意:关闭生物安全柜的灯。 - 使用无菌手套,将无菌干燥的硅胶模具压在培养皿上。然后,用镊子将一个插入物放入硅胶模具的每个孔中,插件的孔侧朝下。
- 使用 200 μL 移液器,加入细胞悬液以填充插入物(每个插入物 ~50 μL)。
- 使用紫外手电筒(波长为395nm的LED灯)交联凝胶/插入物的顶部1.5分钟。然后,照亮另一侧30秒。当 LAP 光引发剂暴露在紫外线下时,会发生交联。
注意:在此期间,细胞悬液可以保存在培养箱中或避光。 - 使用无菌镊子,立即将插入物转移到非组织培养 6 孔板(DMEM 补充有 10% [v/v] FBS 和 1x 抗生素-抗真菌剂)中的 8 mL 生长培养基中,以使细胞在夜间恢复。
- 将细胞分化为四个谱系。
- 要设计脂肪组织 (AT),请将插入物转移到 8 mL 的成脂培养基 (AM;α-MEM、10% FBS、0.2 mM 吲哚美辛、1x 胰岛素-转铁蛋白-硒 (ITS)、0.45 mM 3-异丁基-1-甲基黄嘌呤、0.1 μM 地塞米松和 1x 抗生素-抗真菌药)以启动分化。理想情况下,将四个插入物放置在具有8 mL脂肪培养基的非组织培养孔板的单个孔中。将细胞在孔板中培养28天,每隔一天更换培养基。
- 为了设计骨软骨单元 (OC),将插入物放入双流生物反应器室中,盖上孔,并以 5 μL/min 的流速分别注入 35 mL 成骨培养基 (OM;DMEM、10% FBS、1x 抗生素-抗真菌药、0.1 μM 地塞米松、0.01 M β-甘油磷酸盐、100 ng/mL 骨形态发生蛋白 7 (BMP7)、50 μg/mL 抗坏血酸和 10 nM 维生素 D3)和 35 mL 成软骨培养基 (CM;DMEM、1x 抗生素-抗真菌药、1x ITS、0.1 μM 地塞米松、40 μg/mL 脯氨酸、50 μg/mL 抗坏血酸和 10 ng/mL 转化生长因子 β3)10。通过每两周更换一次培养基来维持细胞分化 28 天。
- 为了获得成纤维细胞,在 T150 cm2 组织培养瓶中使用 20 mL 纤维化培养基(FM;高级 DMEM、5% FBS、1x GlutaMAX、1x 抗生素-抗真菌剂和 50 μg/mL 抗坏血酸)在 21 天内分化 MSC。每周更换培养基。按照上述方案,使用4 mL胰蛋白酶分离细胞,并将3D凝胶封装在插入物中,以获得滑膜样纤维组织(SFT)。
注意:所有分化培养基的组成可在 表1中找到。
3. 建立微型关节芯片
- 高压灭菌3D miniJoint生物反应器室,内径为0.062英寸和外径为0.125英寸的硅胶管,以及F 1/16鲁尔锁连接器。将硅胶管一端连接到微型关节生物反应器倒钩,另一端连接鲁尔锁。
- 准备步骤 2.11 中提到的 AM、OM(删除 BMP7)和 FMCM。此外,准备用于miniJoint培养的常用共享培养基(SM;无酚红DMEM,1x抗生素 - 抗真菌剂,1x丙酮酸钠,1x ITS,40μg/ mL脯氨酸,50μg/ mL抗坏血酸和0.5ng / mL转化生长因子β3)。将每种培养基的 35 mL 加载到培养基储液槽中。
- 使用直镊子将骨软骨单元从双流生物反应器转移到miniJoint生物反应器的右孔中。将脂肪组织插入物和纤维组织插入物分别转移到左孔和中间孔中。用无菌盖盖住所有孔。
- 将miniJoint芯片的入口连接到介质储液罐,将出口连接到注射器(图3A-C)。
- 将注射器安装到注射泵上(图3C),并将泵和芯片转移到培养箱中。培养基储液槽保存在培养箱外的冰上。
- 在抽出模式下操作泵,将介质从介质储液器吸入微型生物反应器室。这种微型关节培养过程持续28天。
- 为了模拟关节炎症和软骨变性,将白介素 1β (IL-1β) 以 10 ng/mL 的浓度添加到纤维化培养基流中。在IL-1β治疗的第三天更换注射器,并向纤维化培养基提供新鲜的IL-1β。治疗持续7天。
- 在药物测试步骤中,在IL-1β治疗3天后,在共享培养基中施用药物,模拟"关节内给药"(图3D)当药物局部用于膝关节时,或在所有培养基类型中,模拟"全身给药"(图3E)当药物通过循环作用于膝关节时。
- 收集单个组织在IL-1β治疗7天后进行分析,无论样品是否在过去4天内接受了药物治疗。
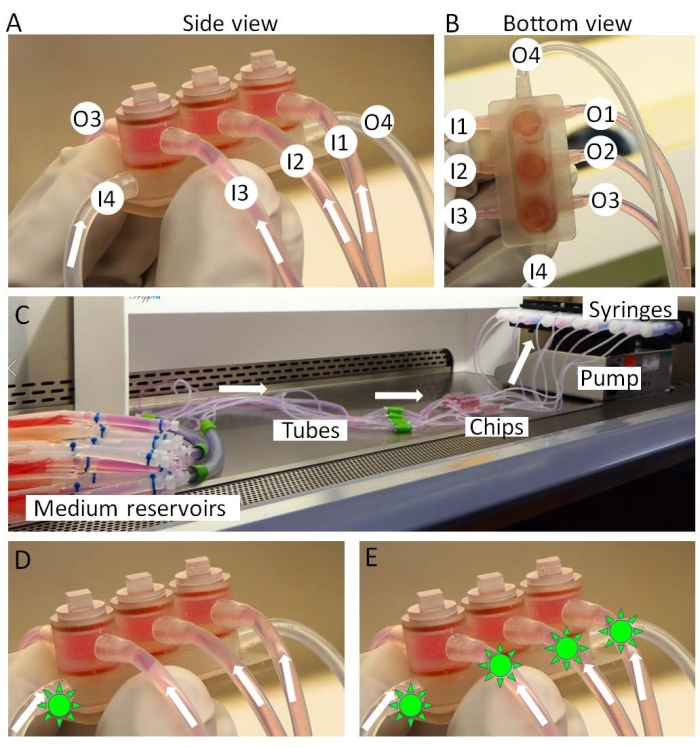
图 3:迷你接头的组装。 (A,B)组织特异性培养基从入口1-3(I1-3)引入并从出口1-3(O1-3)移出。共享培养基从 I4 灌注到 O4。(三)小联合文化的完整设置。药物(绿太阳状形状)可以仅引入(D)共享培养基或(E)所有培养基中,以分别模拟"关节内给药"或"全身给药"。请点击此处查看此图的大图。
4. 个人组织采集
- 使用无菌弯曲镊子取出插入物。
- 将活检冲头推入插入物的中心以取出凝胶,然后将凝胶放入PBS中。
- 在评估基因表达时将骨软骨凝胶切成两半。
注意:由于骨软骨凝胶由两种组织类型组成,因此分离成骨细胞和成软骨细胞很重要。 - 收集条件培养基和组织进行各种实验。
- 从每个培养基源收集约 1.5 mL。
- 以14,000× g 离心10分钟后,在液氮中快速冷冻条件培养基并丢弃沉淀物。
- 对于组织学染色和免疫染色,首先将OC和SFT样品固定在10%缓冲福尔马林中,在升序浓度的乙醇中脱水,在二甲苯中清除它们,将它们包埋在石蜡中,最后以6μm的厚度切片。
- 对于AT微组织,将样品固定在10%缓冲的福尔马林中,并直接用油红O溶液或BODIPY染色。
Access restricted. Please log in or start a trial to view this content.
结果
收集mini关节的所有组织以分析其在mini关节中培养28天后的表型(图4A)。这在我们之前的出版物7中已经详细介绍了。
通过使用RT-qPCR、免疫染色和组织学染色,证实单个微组织的组织特异性表型得到了很好的维持(图4)。例如,OC微组织的骨成分(OC-O)而不是其他组织成分表达高水平的骨钙素(OCN)。相?...
Access restricted. Please log in or start a trial to view this content.
讨论
在本文中,我们提出了一种用于创建膝关节芯片系统的协议,其中骨骼,软骨,脂肪组织和滑膜样组织由MSC形成并在定制的生物反应器中共同培养。这种具有即插即用功能的多组分人类细胞衍生系统是研究关节疾病发病机制和开发药物的新工具。
鉴于不同的组织有利于特定的培养基,因此为每个组织提供相应的培养基并防止流动之间的自由培养基交换至关重要。特别是,在?...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者声明没有竞争利益。
致谢
这项研究主要由美国国立卫生研究院(UG3 / UH3TR002136,UG3 / UH3TR003090)资助。此外,我们感谢Paul Manner博士(华盛顿大学)提供人体组织样本,感谢Jian Tan博士帮助分离MSCs和创建细胞池。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 3-isobutyl-1-methylxanthine | Sigma -Aldrich | I17018-1G | |
| 6 well non-tissue culture plate | Corning Falcon® Plates | 351146 | |
| 24 well non-tissue culture plate | Corning Falcon® Plates | 351147 | |
| 30 mL syringes | BD Syringe Luer Lock Cascade Health | 302832 | |
| Alcian blue stain | EK Industries | 1198 | 1% w/v, pH 1.0 |
| Advanced DMEM | Gibco | 12491-015 | |
| αMEM | Gibco | 12571-063 | |
| Antibiotic-antimycotic | Gibco | 15240-062 | |
| Biopsy punch | Integra Miltex | 12-460-407 | |
| BODIPY® fluorophore | Molecular Probes | ||
| Bone morphogenic protein 7 (BMP7) | Peprotech | ||
| Curved forceps | Fisher Brand | 16100110 | |
| DMEM | Gibco | 11995-065 | Dulbecco’s Modified Eagle Medium |
| Dexmethasome | Sigma -Aldrich | 02-05-2002 | |
| E-Shell 450 photopolymer in | EnvisionTec | RES-01-4022 | |
| Fetal Bovine Serum | Gemini-Bio Products | 900-208 | |
| GlutaMAX | Gibco | 3505-061 | |
| gelatin from bovine skin | Hyclone | 1003372809 | |
| Hank’s Balanced Salt Solution | Sigma -Aldrich | SH30588.02 | |
| indomethacin | Sigma -Aldrich | I7378-56 | |
| Insulin-Transferrin-Selenium-Ethanolamine (ITS) | Gibco | 51500-056 | |
| interleukin 1β | Peprotech | 200-01B | |
| Leur-loc connectors | Cole-Parmer Instruments | 45508-50 | |
| L-proline | Sigma -Aldrich | 115388-93-7 | |
| β-glycerophosphate | Sigma -Aldrich | 1003129352 | |
| Medium bags | KiYATEC | FC045 | |
| Methacrylic Anhydride | Sigma -Aldrich | 102378580 | |
| Phosphate buffered Saline | Corning | 21-040-CM | |
| Pointed forceps | Fisher Brand | 12000122 | |
| Silicon mold | McMaster-Carr | RC00114P | |
| Silicon o-rings | McMaster-Carr | ZMCCs1X5 | 1mm x 5mm |
| SolidWorks | Dassault Systèmes SE, Vélizy-Villacoublay, France | ||
| Surgical Blades | Integra Miltex | 4-122 | |
| Syringe pump | Lagato210P, KD Scientific | Z569631 | 10 syringe racks |
| T-182 tissue culture flasks | Fisher Brand | FB012939 | |
| Tissue Culture Dish 150 mm | Fisher Brand | FB012925 | |
| Transforming Growth Factor Beta (TGF-β3) | Peprotech | 100-36E | |
| Trypsin | Gibco | 25200-056 | |
| UV Flashlight | KBS | KB70109 | 395 nm |
| Vida Desktop 3D Printer | EnvisionTec | ||
| Vitamin D3 | Sigma -Aldrich | 32222-06-3 | 1,25-dihydroxyvitamin D3 |
参考文献
- Safiri, S., et al. Global, regional and national burden of osteoarthritis 1990-2017: A systematic analysis of the Global Burden of Disease Study 2017. Annals of the Rheumatic Diseases. 79 (6), 819-828 (2020).
- Lawrence, R. C., et al. Estimates of the prevalence of arthritis and other rheumatic conditions in the United States: Part II. Arthritis and Rheumatism. 58 (1), 26-35 (2008).
- Makarczyk, M. J., et al. Current models for development of disease-modifying osteoarthritis drugs. Tissue Engineering. Part C, Methods. 27 (2), 124-138 (2021).
- He, Y., et al. Pathogenesis of osteoarthritis: risk factors, regulatory pathways in chondrocytes, and experimental models. Biology. 9 (8), 194(2020).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Lin, H., Sohn, J., Shen, H., Langhans, M. T., Tuan, R. S. Bone marrow mesenchymal stem cells: aging and tissue engineering applications to enhance bone healing. Biomaterials. 203, 96-110 (2019).
- Li, Z., et al. Human mesenchymal stem cell-derived miniature joint system for disease modeling and drug testing. Advanced Science. 9 (21), 2105909(2022).
- Lin, H., Cheng, A. W., Alexander, P. G., Beck, A. M., Tuan, R. S. Cartilage tissue engineering application of injectable gelatin hydrogel with in situ visible-light-activated gelation capability in both air and aqueous solution. Tissue Engineering. Part A. 20 (17-18), 2402-2411 (2014).
- Fairbanks, B. D., Schwartz, M. P., Bowman, C. N., Anseth, K. S. Photoinitiated polymerization of PEG-diacrylate with lithium phenyl-2,4,6-trimethylbenzoylphosphinate: polymerization rate and cytocompatibility. Biomaterials. 30 (35), 6702-6707 (2009).
- Lin, H., Lozito, T. P., Alexander, P. G., Gottardi, R., Tuan, R. S. Stem cell-based microphysiological osteochondral system to model tissue response to interleukin-1β. Molecular Pharmaceutics. 11 (7), 2203-2212 (2014).
- Yin, B., et al. Hybrid macro-porous titanium ornamented by degradable 3D gel/nHA micro-scaffolds for bone tissue regeneration. International Journal of Molecular Sciences. 17 (4), 575(2016).
- Lin, Z., et al. Osteochondral tissue chip derived from iPSCs: Modeling OA pathologies and testing drugs. Frontiers in Bioengineering and Biotechnology. 7, 411(2019).
- Atukorala, I., et al. Synovitis in knee osteoarthritis: A precursor of disease. Annals of the Rheumatic Diseases. 75 (2), 390-395 (2016).
- Occhetta, P., et al. Hyperphysiological compression of articular cartilage induces an osteoarthritic phenotype in a cartilage-on-a-chip model. Nature Biomedical Engineering. 3 (7), 545-557 (2019).
- He, C., et al. Modeling early changes associated with cartilage trauma using human-cell-laden hydrogel cartilage models. Stem Cell Research and Therapy. 13 (1), 400(2022).
- Elsissy, J. G., et al. Bacterial septic arthritis of the adult native knee joint: A review. JBJS Reviews. 8 (1), 0059(2020).
- Romero-Lopez, M., et al. Macrophage effects on mesenchymal stem cell osteogenesis in a three-dimensional in vitro bone model. Tissue Engineering. Part A. 26 (19-20), 1099-1111 (2020).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。