È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Creazione di un ginocchio joint-on-a-chip per la modellazione delle malattie articolari e la sperimentazione di farmaci
In questo articolo
Riepilogo
Forniamo metodi dettagliati per generare quattro tipi di tessuti da cellule staminali mesenchimali umane, che vengono utilizzate per ricapitolare la cartilagine, l'osso, il cuscinetto adiposo e la sinovia nell'articolazione del ginocchio umano. Questi quattro tessuti sono integrati in un bioreattore personalizzato e collegati attraverso la microfluidica, generando così un'articolazione del ginocchio su un chip.
Abstract
L'elevata prevalenza di malattie articolari debilitanti come l'osteoartrite (OA) rappresenta un elevato onere socioeconomico. Attualmente, i farmaci disponibili che colpiscono i disturbi articolari sono per lo più palliativi. Il bisogno insoddisfatto di farmaci OA modificanti la malattia (DMOAD) efficaci è stato causato principalmente dall'assenza di modelli appropriati per studiare i meccanismi della malattia e testare potenziali DMOAD. Qui descriviamo la creazione di un sistema microfisiologico che imita l'articolazione sinoviale in miniatura (miniJoint) comprendente componenti del tessuto adiposo, fibroso e osteocondrale derivati da cellule staminali mesenchimali umane (MSC). Per ottenere i microtessuti tridimensionali (3D), le MSC sono state incapsulate in gelatina metacrilata fotocrosslinkabile prima o dopo la differenziazione. I costrutti tissutali carichi di cellule sono stati quindi integrati in un bioreattore stampato in 3D, formando il miniJoint. Sono stati introdotti flussi separati di mezzi osteogenici, fibrogenici e adipogeni per mantenere i rispettivi fenotipi tissutali. Un flusso comunemente condiviso è stato perfuso attraverso la cartilagine, la sinoviale e i tessuti adiposi per consentire la diafonia tissutale. Questo modello di flusso consente l'induzione di perturbazioni in uno o più componenti tissutali per studi meccanicistici. Inoltre, i potenziali DMOAD possono essere testati tramite "somministrazione sistemica" attraverso tutti i flussi di mezzo o "somministrazione intraarticolare" aggiungendo i farmaci solo al flusso di simulazione del "liquido sinoviale" condiviso. Pertanto, il miniJoint può fungere da piattaforma versatile in vitro per studiare in modo efficiente i meccanismi della malattia e testare i farmaci nella medicina personalizzata.
Introduzione
Le malattie articolari come l'osteoartrite (OA) sono altamente diffuse e debilitanti e rappresentano una delle principali cause di disabilità in tutto il mondo1. Si stima che solo negli Stati Uniti, l'OA colpisca 27 milioni di pazienti e si verifichi nel 12,1% degli adulti di età pario superiore a 60 anni. Sfortunatamente, la maggior parte dei farmaci attualmente utilizzati per gestire le malattie articolari sono palliativi e non sono disponibili farmaci OA modificanti la malattia (DMOAD) efficaci3. Questo bisogno medico insoddisfatto deriva principalmente dall'assenza di un modello efficace per studiare i meccanismi della malattia e sviluppare potenziali DMOAD. La coltura cellulare bidimensionale convenzionale (2D) non riflette la natura 3D dei tessuti articolari e la coltura degli espianti tissutali è spesso ostacolata da una significativa morte cellulare e di solito non riesce a replicare le interconnessioni tissutali dinamiche4. Inoltre, le differenze genetiche e anatomiche riducono significativamente la rilevanza fisiologica dei modelli animali4.
Gli organi su chip (OoC), o sistemi microfisiologici, sono un campo di ricerca promettente all'interfaccia tra ingegneria, biologia e medicina. Queste piattaforme in vitro sono unità funzionali minime che replicano caratteristiche sane o patologiche definite delle loro controparti in vivo 5. Inoltre, questi sistemi miniaturizzati possono ospitare diverse cellule e matrici e simulare le interazioni biofisiche e biochimiche tra diversi tessuti. Pertanto, un sistema microfisiologico in grado di ricapitolare fedelmente l'articolazione sinoviale nativa promette di offrire una piattaforma efficace per modellare le malattie articolari e sviluppare potenziali DMOAD.
Le cellule staminali mesenchimali umane (MSC) possono essere isolate da molti tessuti in tutto il corpo e differenziate in linee osteogeniche, condrogeniche e adipogeniche6. Le MSC sono state utilizzate con successo per ingegnerizzare vari tessuti, tra cui ossa, cartilagine e tessuto adiposo6, il che significa che rappresentano una fonte cellulare promettente per l'ingegneria dei componenti tissutali dell'articolazione del ginocchio. Recentemente abbiamo sviluppato un sistema microfisiologico miniaturizzato che imita le articolazioni, chiamato miniJoint, che comprende ossa, cartilagine, tessuti fibrosi e adiposi derivati da MSC7. In particolare, il nuovo design consente la diafonia tissutale mediante flusso microfluidico o permeazione (Figura 1). Qui presentiamo i protocolli per la fabbricazione dei componenti del chip, l'ingegneria dei componenti tissutali, la coltura dei tessuti ingegnerizzati nel chip e la raccolta dei tessuti per le analisi a valle.
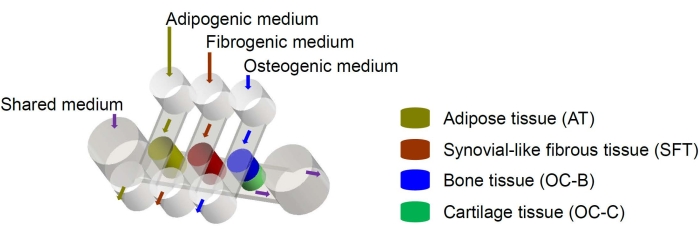
Figura 1: Schema del chip miniJoint che mostra la disposizione dei diversi componenti tissutali e dei flussi del mezzo. OC = tessuto osteocondrale. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Protocollo
Il seguente protocollo segue le linee guida etiche dell'Università di Pittsburgh e del comitato etico per la ricerca umana dell'Università di Pittsburgh. Le informazioni sui materiali utilizzati in questo studio sono elencate nella tabella dei materiali.
1. Produzione di bioreattori stampati in 3D
- Utilizzare un software per computer per progettare bioreattori osteocondrali (Figura 2A) e miniJoint (Figura 2B) che includono camere, inserti e coperchi. Le informazioni sulla quota per ciascuna parte sono mostrate nella Figura S1.
- Trasferisci il progetto su una stampante 3D e stampa con un inchiostro fotopolimerico.
- Risciacquare le parti stampate in 3D (Figura 2C-F) con 15 ml di etanolo al 95% tre volte. Quindi, reticolare completamente i pezzi stampati per 200 s in un dispositivo di polimerizzazione della torcia.
- Aggiungere O-ring agli inserti e ai coperchi (Figura 2C, D) e verificare se le parti sono adatte (Figura 2G, H).

Figura 2: Fabbricazione dei diversi componenti per realizzare il miniJoint bioreactor. (A,B), modelli 3D di bioreattori per la creazione di (A) chip osteocondrali e (B) miniJoint. (C,D) stampati in 3D (C) coperchi e (D) inserti con l'O-ring installato. (E,F) camere stampate in 3D per (E) osteocondrale e (F) minicoltura tissutale articolare. (G,H) Assemblaggio di (G) chip osteocondrali e (H) miniJoint. Fare clic qui per visualizzare una versione ingrandita di questa figura.
2. Ingegnerizzazione dei componenti tissutali
NOTA: I processi per la fabbricazione di litio fenil-2,4,6-trimetilbenzoilfosfinato (LAP) e gelatina metacrilata (GelMA) sono descritti negli studi precedenti 8,9.
- Per creare GelMA, attenersi alla seguente procedura.
- Aggiungere 17 g di gelatina di tipo B a 500 ml di acqua distillata, quindi mescolare su uno shaker per 30 minuti a 37 °C.
- Quindi, aggiungere 13 ml di anidride metacrilica, riposizionare sullo shaker a 37 °C e lasciare agitare per una notte.
- Il giorno seguente, aliquotare il GelMA in sacche di dialisi individuali, con ~ 60 ml in ogni sacchetto.
- Mettere tutte le sacche di dialisi in acqua distillata con una barra di agitazione e attendere 7 giorni di dialisi. Cambiare l'acqua più volte al giorno e lasciare i sacchetti a 4 °C durante la notte.
- Il giorno 7, congelare il GelMA a -80 °C. Una volta completamente congelato, procedere alla liofilizzazione.
- Posizionare il GelMA in un piatto nella camera a vuoto di un liofilizzatore e lasciare la liofilizzazione. Assicurarsi che il GelMA sia completamente asciutto prima della rimozione dal liofilizzatore.
- Sciogliere il GelMA nella soluzione salina bilanciata di Hank (HBSS con Ca 2+ e Mg2+) al 15% (p/v). Per garantire che il pH sia a 7,4, aggiungere NaOH in piccole quantità fino a quando il pH raggiunge 7,4. Integrare la soluzione con 1x antibiotico-antimicotico e 0,15% (p/v) LAP in base al volume acquisito. Conservare la soluzione di GelMA al 15% a -20 °C fino all'uso e proteggerla dalla luce.
- Posizionare le camere del bioreattore a doppio flusso stampate in 3D, i coperchi e gli inserti in sacchetti per autoclave e autoclavare a 121 ° C per 20 minuti con vapore e poi per 20 minuti con calore secco.
- All'interno dell'armadio di sicurezza biologica, immergere le camere del bioreattore, i coperchi e gli inserti in 15 ml di soluzione salina sterile tamponata con fosfato durante la notte, dopodiché lasciarli asciugare.
- Isolare MSC derivate dal midollo osseo umano da rifiuti chirurgici totali di artroplastica articolare con approvazione IRB (Università di Pittsburgh e Università di Washington).
- In particolare, scovare il midollo osseo dall'osso trabecolare del collo e della testa del femore e risospenderlo nel Modified Eagle's Medium (DMEM) di Dulbecco.
- Filtrare la sospensione attraverso un filtro da 40 μm e centrifugare il flusso a 300 x g per 5 minuti.
- Rimuovere il surnatante, risospendere i pellet utilizzando il terreno di coltura [DMEM, siero bovino fetale al 10% (FBS) e 1x antibiotico-antimicotico], quindi inserire in boccette di coltura tissutale.
- Cambiare il terreno di coltura ogni 3 giorni a 4 giorni. Assicurarsi che venga raggiunta una confluenza compresa tra il 70% e l'80% prima di procedere ulteriormente.
- Staccare le cellule incubando con tripsina-EDTA per 2-3 minuti e passare in un rapporto di 1 milione di cellule per pallone T150.
- Espandere le celle in P5. Dopo la tripsinizzazione, sospendere le cellule, contarle e quindi pellettare centrifugando a 300x g per 5 minuti.
- Con una pipetta da 1.000 μL, risospendere le cellule a 20 x 106 cellule/ml in soluzione di GelMA al 15%.
NOTA: Spegnere la luce dell'armadio di sicurezza biologica. - Usando guanti sterili, premere uno stampo di silicone sterile e asciutto contro una capsula di Petri. Quindi, inserire un inserto in ciascun foro dello stampo in silicone con una pinza, con il lato del foro dell'inserto rivolto verso il basso.
- Utilizzando una pipetta da 200 μL, aggiungere la sospensione cellulare per riempire l'inserto (~50 μL per inserto).
- Utilizzare una torcia UV (luce LED con una lunghezza d'onda di 395 nm) per reticolare la parte superiore del gel / inserto per 1,5 minuti. Quindi, illuminare l'altro lato per 30 secondi. La reticolazione si verifica quando il fotoiniziatore LAP è esposto alla luce UV.
NOTA: La sospensione cellulare può essere conservata nell'incubatore durante questo periodo o protetta dalla luce. - Con una pinza sterile, trasferire immediatamente gli inserti in 8 ml di terreno di crescita in una piastra a 6 pozzetti di coltura non tissutale (DMEM integrato con FBS al 10% [v / v] e 1x antibiotico-antimicotico) per consentire alle cellule di recuperare durante la notte.
- Differenzia le cellule verso quattro lignaggi.
- Per ingegnerizzare il tessuto adiposo (AT), trasferire gli inserti a 8 ml di mezzo adipogeno (AM; Alfa-MEM, 10% FBS, 0,2 mM di indometacina, 1x insulina-transferrina-selenio (ITS), 0,45 mM 3-isobutil-1-metilxantina, 0,1 μM desametasone e 1x antibiotico-antimicotico) per iniziare la differenziazione. Idealmente, quattro inserti sono collocati in un singolo pozzetto di una piastra di coltura non tissutale con 8 ml di mezzo adipogeno. Coltiva le cellule nelle piastre del pozzo per 28 giorni, con cambiamenti medi a giorni alterni.
- Per progettare le unità osteocondrali (OC), posizionare gli inserti nelle camere del bioreattore a doppio flusso, tappare i pozzetti e infondere i due flussi separatamente a una portata di 5 μL / min con 35 ml di mezzo osteogenico (OM; DMEM, 10% FBS, 1x antibiotico-antimicotico, 0,1 μM desametasone, 0,01 M β-glicerofosfato, 100 ng/mL proteina morfogenetica ossea 7 (BMP7), 50 μg/mL di acido ascorbico e 10 nM di vitamina D3) e 35 mL di terreno condrogeno (CM; DMEM, 1x antibiotico-antimicotico, 1x ITS, 0,1 μM desametasone, 40 μg/mL di prolina, 50 μg/mL di acido ascorbico e 10 ng/mL fattore di crescita trasformante β3)10. Mantenere la differenziazione cellulare per 28 giorni eseguendo cambiamenti bisettimanali del mezzo.
- Per ricavare i fibroblasti, differenziare le MSC in coltura 2D nell'arco di 21 giorni in un matraccio di coltura tissutale T150 cm2 utilizzando 20 mL di terreno fibrogenico (FM; DMEM avanzato, 5% FBS, 1x GlutaMAX, 1x antibiotico-antimicotico e 50 μg/mL di acido ascorbico). Cambia il mezzo ogni settimana. Utilizzare 4 ml di tripsina per staccare le cellule e incapsulare i gel 3D all'interno degli inserti, seguendo il protocollo sopra descritto, per ottenere tessuto simboviale simile al fibroso (SFT).
NOTA: Le composizioni di tutti i mezzi di differenziazione sono riportate nella Tabella 1.
3. Creazione del chip miniJoint
- Autoclavare le camere del bioreattore 3D miniJoint, tubi in silicone con un diametro interno di 0,062 pollici e un diametro esterno di 0,125 pollici e connettori Luer-lock F 1/16. Collegare il tubo in silicone alla barbetta del bioreattore miniJoint a un'estremità e collegare la serratura Luer all'altra estremità.
- Preparare AM, OM (rimozione BMP7) e FMCM menzionati nel passaggio 2.11. Inoltre, preparare il terreno comune condiviso (SM; DMEM privo di rosso fenolo, 1x antibiotico-antimicotico, 1x Na-piruvato, 1x ITS, 40 μg/mL di prolina, 50 μg/mL di acido ascorbico e 0,5 ng/mL di fattore di crescita trasformante β3) da utilizzare per la coltura miniJoint. Caricare 35 ml di ciascun mezzo nei serbatoi medi.
- Utilizzare una pinza dritta per trasferire l'unità osteocondrale dal bioreattore a doppio flusso al pozzetto destro del minireattore Joint. Trasferire l'inserto di tessuto adiposo e l'inserto di tessuto fibroso nei pozzetti sinistro e centrale, rispettivamente. Tappare tutti i pozzetti con coperchi sterilizzati.
- Collegare gli ingressi del chip miniJoint ai serbatoi medi e le uscite alle siringhe (Figura 3A-C).
- Montare le siringhe su una pompa a siringa (Figura 3C) e trasferire la pompa e i chip in un'incubatrice. I serbatoi medi sono tenuti sul ghiaccio all'esterno dell'incubatore.
- Azionare la pompa in modalità di prelievo, aspirando il mezzo dal serbatoio medio nella camera del miniJoint bioreactor. Questo miniprocesso di coltura congiunta dura 28 giorni.
- Per modellare l'infiammazione articolare e la degenerazione della cartilagine, aggiungere l'interleuchina 1β (IL-1β) al flusso medio fibrogenico a 10 ng / mL. Sostituire le siringhe il terzo giorno di trattamento con IL-1β e fornire IL-1β fresca al mezzo fibrogenico. Il trattamento dura 7 giorni.
- Durante la fase di test farmacologico, dopo 3 giorni di trattamento con IL-1β, somministrare il farmaco sia nel mezzo condiviso, simulando una "somministrazione intraarticolare" (Figura 3D) quando il farmaco viene utilizzato localmente nell'articolazione del ginocchio, sia in tutti i tipi di mezzo, simulando una "somministrazione sistemica" (Figura 3E) quando il farmaco agisce sull'articolazione del ginocchio attraverso la circolazione.
- Raccogliere singoli tessuti per l'analisi dopo 7 giorni di trattamento con IL-1β, indipendentemente dal fatto che i campioni siano stati sottoposti o meno a trattamento farmacologico nei 4 giorni precedenti.
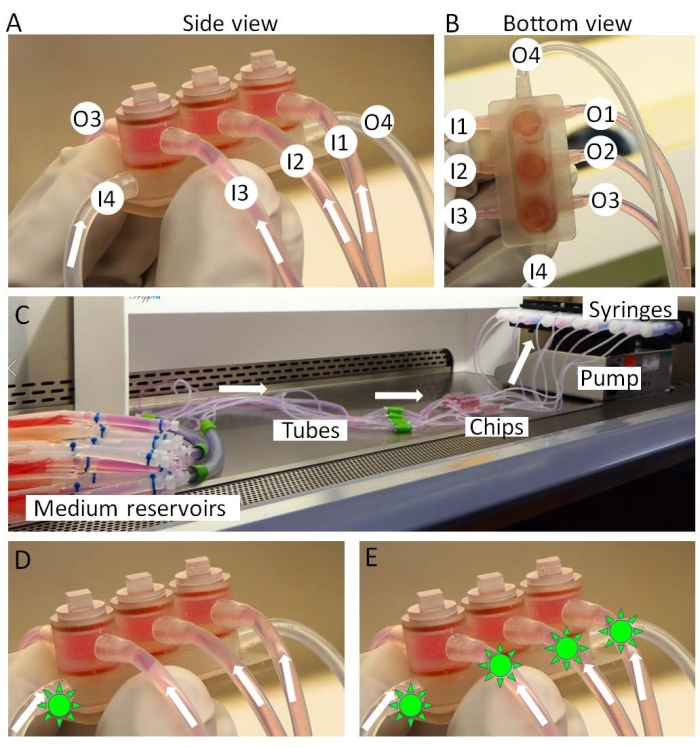
Figura 3: Assemblaggio del miniJoint. (A,B) I mezzi tessuto-specifici vengono introdotti dagli ingressi 1-3 (I1-3) e spostati dalle uscite 1-3 (O1-3). Il mezzo condiviso è perfuso da I4 a O4. (C) La configurazione completa della miniCultura congiunta. I farmaci (forme simili al sole verde) possono essere introdotti in (D) solo il mezzo condiviso o (E) tutti i mezzi per simulare rispettivamente "somministrazione intraarticolare" o "somministrazione sistemica". Fare clic qui per visualizzare una versione ingrandita di questa figura.
4. Raccolta individuale di tessuti
- Utilizzare una pinza curva sterile per rimuovere gli inserti.
- Spingere un pugno bioptico attraverso il centro dell'inserto per rimuovere il gel e posizionare il gel in PBS.
- Tagliare i gel osteocondrali a metà quando si valuta l'espressione genica.
NOTA: Poiché il gel osteocondrale è costituito da due tipi di tessuto, è importante separare le cellule osteogeniche e condrogeniche. - Raccogli i mezzi e i tessuti condizionati per vari esperimenti.
- Raccogliere circa 1,5 ml da ciascuna fonte di supporto.
- Congelare il mezzo condizionato in azoto liquido dopo aver centrifugato a 14.000 x g per 10 minuti e aver scartato il sedimento.
- Per la colorazione istologica e l'immunocolorazione, fissare prima i campioni OC e SFT in formalina tamponata al 10%, disidratarli in etanolo di concentrazioni ascendenti, eliminarli in xilene, incorporarli in paraffina e infine sezionarli ad uno spessore di 6 μm.
- Per i microtessuti AT, fissare i campioni in formalina tamponata al 10% e colorarli direttamente con la soluzione di Oil Red O o BODIPY.
Risultati
Tutti i tessuti del miniJoint sono stati raccolti per analizzare i loro fenotipi dopo 28 giorni di coltura nel miniJoint (Figura 4A). Questo è stato dettagliato nella nostra precedente pubblicazione7.
Attraverso l'uso di RT-qPCR, immunocolorazione e colorazione istologica, è stato confermato che i fenotipi tessuto-specifici erano ben mantenuti per i singoli microtessuti (Figura 4). Ad esempio, la componente o...
Discussione
In questo articolo, presentiamo un protocollo per la creazione di un sistema articolato del ginocchio su un chip, in cui ossa, cartilagine, tessuto adiposo e tessuti simil-sinoviali sono formati da MSC e co-coltivati all'interno di un bioreattore personalizzato. Questo sistema multicomponente derivato da cellule umane con funzionalità plug-and-play rappresenta un nuovo strumento per lo studio della patogenesi delle malattie articolari e lo sviluppo di farmaci.
Dato che tessuti diversi favori...
Divulgazioni
Gli autori non dichiarano interessi concorrenti.
Riconoscimenti
Questa ricerca è stata sostenuta principalmente dal finanziamento del National Institutes of Health (UG3 / UH3TR002136, UG3 / UH3TR003090). Inoltre, ringraziamo il Dr. Paul Manner (Università di Washington) per aver fornito i campioni di tessuto umano e il Dr. Jian Tan per il loro aiuto nell'isolamento delle MSC e nella creazione del pool cellulare.
Materiali
| Name | Company | Catalog Number | Comments |
| 3-isobutyl-1-methylxanthine | Sigma -Aldrich | I17018-1G | |
| 6 well non-tissue culture plate | Corning Falcon® Plates | 351146 | |
| 24 well non-tissue culture plate | Corning Falcon® Plates | 351147 | |
| 30 mL syringes | BD Syringe Luer Lock Cascade Health | 302832 | |
| Alcian blue stain | EK Industries | 1198 | 1% w/v, pH 1.0 |
| Advanced DMEM | Gibco | 12491-015 | |
| αMEM | Gibco | 12571-063 | |
| Antibiotic-antimycotic | Gibco | 15240-062 | |
| Biopsy punch | Integra Miltex | 12-460-407 | |
| BODIPY® fluorophore | Molecular Probes | ||
| Bone morphogenic protein 7 (BMP7) | Peprotech | ||
| Curved forceps | Fisher Brand | 16100110 | |
| DMEM | Gibco | 11995-065 | Dulbecco’s Modified Eagle Medium |
| Dexmethasome | Sigma -Aldrich | 02-05-2002 | |
| E-Shell 450 photopolymer in | EnvisionTec | RES-01-4022 | |
| Fetal Bovine Serum | Gemini-Bio Products | 900-208 | |
| GlutaMAX | Gibco | 3505-061 | |
| gelatin from bovine skin | Hyclone | 1003372809 | |
| Hank’s Balanced Salt Solution | Sigma -Aldrich | SH30588.02 | |
| indomethacin | Sigma -Aldrich | I7378-56 | |
| Insulin-Transferrin-Selenium-Ethanolamine (ITS) | Gibco | 51500-056 | |
| interleukin 1β | Peprotech | 200-01B | |
| Leur-loc connectors | Cole-Parmer Instruments | 45508-50 | |
| L-proline | Sigma -Aldrich | 115388-93-7 | |
| β-glycerophosphate | Sigma -Aldrich | 1003129352 | |
| Medium bags | KiYATEC | FC045 | |
| Methacrylic Anhydride | Sigma -Aldrich | 102378580 | |
| Phosphate buffered Saline | Corning | 21-040-CM | |
| Pointed forceps | Fisher Brand | 12000122 | |
| Silicon mold | McMaster-Carr | RC00114P | |
| Silicon o-rings | McMaster-Carr | ZMCCs1X5 | 1mm x 5mm |
| SolidWorks | Dassault Systèmes SE, Vélizy-Villacoublay, France | ||
| Surgical Blades | Integra Miltex | 4-122 | |
| Syringe pump | Lagato210P, KD Scientific | Z569631 | 10 syringe racks |
| T-182 tissue culture flasks | Fisher Brand | FB012939 | |
| Tissue Culture Dish 150 mm | Fisher Brand | FB012925 | |
| Transforming Growth Factor Beta (TGF-β3) | Peprotech | 100-36E | |
| Trypsin | Gibco | 25200-056 | |
| UV Flashlight | KBS | KB70109 | 395 nm |
| Vida Desktop 3D Printer | EnvisionTec | ||
| Vitamin D3 | Sigma -Aldrich | 32222-06-3 | 1,25-dihydroxyvitamin D3 |
Riferimenti
- Safiri, S., et al. Global, regional and national burden of osteoarthritis 1990-2017: A systematic analysis of the Global Burden of Disease Study 2017. Annals of the Rheumatic Diseases. 79 (6), 819-828 (2020).
- Lawrence, R. C., et al. Estimates of the prevalence of arthritis and other rheumatic conditions in the United States: Part II. Arthritis and Rheumatism. 58 (1), 26-35 (2008).
- Makarczyk, M. J., et al. Current models for development of disease-modifying osteoarthritis drugs. Tissue Engineering. Part C, Methods. 27 (2), 124-138 (2021).
- He, Y., et al. Pathogenesis of osteoarthritis: risk factors, regulatory pathways in chondrocytes, and experimental models. Biology. 9 (8), 194 (2020).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Lin, H., Sohn, J., Shen, H., Langhans, M. T., Tuan, R. S. Bone marrow mesenchymal stem cells: aging and tissue engineering applications to enhance bone healing. Biomaterials. 203, 96-110 (2019).
- Li, Z., et al. Human mesenchymal stem cell-derived miniature joint system for disease modeling and drug testing. Advanced Science. 9 (21), 2105909 (2022).
- Lin, H., Cheng, A. W., Alexander, P. G., Beck, A. M., Tuan, R. S. Cartilage tissue engineering application of injectable gelatin hydrogel with in situ visible-light-activated gelation capability in both air and aqueous solution. Tissue Engineering. Part A. 20 (17-18), 2402-2411 (2014).
- Fairbanks, B. D., Schwartz, M. P., Bowman, C. N., Anseth, K. S. Photoinitiated polymerization of PEG-diacrylate with lithium phenyl-2,4,6-trimethylbenzoylphosphinate: polymerization rate and cytocompatibility. Biomaterials. 30 (35), 6702-6707 (2009).
- Lin, H., Lozito, T. P., Alexander, P. G., Gottardi, R., Tuan, R. S. Stem cell-based microphysiological osteochondral system to model tissue response to interleukin-1β. Molecular Pharmaceutics. 11 (7), 2203-2212 (2014).
- Yin, B., et al. Hybrid macro-porous titanium ornamented by degradable 3D gel/nHA micro-scaffolds for bone tissue regeneration. International Journal of Molecular Sciences. 17 (4), 575 (2016).
- Lin, Z., et al. Osteochondral tissue chip derived from iPSCs: Modeling OA pathologies and testing drugs. Frontiers in Bioengineering and Biotechnology. 7, 411 (2019).
- Atukorala, I., et al. Synovitis in knee osteoarthritis: A precursor of disease. Annals of the Rheumatic Diseases. 75 (2), 390-395 (2016).
- Occhetta, P., et al. Hyperphysiological compression of articular cartilage induces an osteoarthritic phenotype in a cartilage-on-a-chip model. Nature Biomedical Engineering. 3 (7), 545-557 (2019).
- He, C., et al. Modeling early changes associated with cartilage trauma using human-cell-laden hydrogel cartilage models. Stem Cell Research and Therapy. 13 (1), 400 (2022).
- Elsissy, J. G., et al. Bacterial septic arthritis of the adult native knee joint: A review. JBJS Reviews. 8 (1), 0059 (2020).
- Romero-Lopez, M., et al. Macrophage effects on mesenchymal stem cell osteogenesis in a three-dimensional in vitro bone model. Tissue Engineering. Part A. 26 (19-20), 1099-1111 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon