JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
관절 질환 모델링 및 약물 테스트를 위한 무릎 관절 칩 생성
요약
우리는 인간 무릎 관절의 연골, 뼈, 지방 패드 및 활막을 재현하는 데 사용되는 인간 중간엽 줄기 세포에서 4가지 유형의 조직을 생성하는 자세한 방법을 제공합니다. 이 4 개의 조직은 맞춤형 생물 반응기에 통합되고 미세 유체를 통해 연결되어 무릎 관절 온 칩을 생성합니다.
초록
골관절염(OA)과 같은 쇠약하게 만드는 관절 질환의 높은 유병률은 높은 사회경제적 부담을 줍니다. 현재 관절 질환을 표적으로 하는 사용 가능한 약물은 대부분 완화제입니다. 효과적인 질병 수정 OA 약물(DMOAD)에 대한 충족되지 않은 요구는 주로 질병 메커니즘을 연구하고 잠재적인 DMOAD를 테스트하기 위한 적절한 모델의 부재로 인해 발생했습니다. 여기에서 우리는 인간 중간엽 줄기 세포(MSC)에서 유래된 지방, 섬유 및 골연골 조직 구성 요소를 포함하는 소형 활액 관절 모방 미세생리학적 시스템(miniJoint)의 확립을 설명합니다. 3차원(3D) 미세조직을 얻기 위해, 중간엽 줄기세포를 분화 전 또는 분화 후에 광가교결합성 메타크릴레이트화 젤라틴에 캡슐화하였다. 그런 다음 세포가 함유된 조직 구조를 3D 프린팅된 바이오리액터에 통합하여 miniJoint를 형성했습니다. 각각의 조직 표현형을 유지하기 위해 골형성, 섬유형성 및 지방형성 매체의 분리된 흐름을 도입했습니다. 일반적으로 공유되는 흐름은 연골, 활막 및 지방 조직을 통해 관류되어 조직 누화를 가능하게 했습니다. 이 흐름 패턴은 기계론적 연구를 위한 하나 이상의 조직 구성 요소에서 섭동의 유도를 허용합니다. 또한, 잠재적인 DMOAD는 모든 배지 스트림을 통한 "전신 투여" 또는 공유된 "활액" 시뮬레이션 흐름에만 약물을 추가하여 "관절 내 투여"를 통해 테스트할 수 있습니다. 따라서 miniJoint는 질병 메커니즘을 효율적으로 연구하고 개인화된 의학에서 약물을 테스트하기 위한 다목적 체외 플랫폼 역할을 할 수 있습니다.
서문
골관절염(OA)과 같은 관절 질환은 매우 만연하고 쇠약하게 하며 전 세계적으로 장애의 주요 원인입니다1. 미국에서만 OA는 2,700만 명의 환자에게 영향을 미치며 60세 이상 성인의 12.1%에서 발생하는것으로 추정됩니다. 안타깝게도 현재 관절 질환 관리에 사용되는 대부분의 약물은 완화 약물이며 효과적인 질병 수정 OA 약물(DMOAD)은 사용할 수 없습니다3. 이러한 충족되지 않은 의학적 요구는 주로 질병 메커니즘을 연구하고 잠재적인 DMOAD를 개발하기 위한 효과적인 모델의 부재에서 비롯됩니다. 종래의 2차원(2D) 세포 배양은 관절 조직의 3차원 특성을 반영하지 않으며, 조직 외식편의 배양은 종종 상당한 세포 사멸에 의해 방해를 받으며, 일반적으로 동적 조직 상호 연결을 복제하지 못한다4. 또한, 유전적 및 해부학적 차이는 동물모델의 생리학적 관련성을 현저히 감소시킨다4.
OoC(Organs-on-Chip) 또는 미세생리학적 시스템은 공학, 생물학 및 의학의 인터페이스에서 유망한 연구 분야입니다. 이러한 in vitro 플랫폼은 생체 내 대응물의 정의된 건강한 또는 병리학적 특징을 복제하는 최소 기능 단위이다5. 또한 이러한 소형화된 시스템은 다양한 세포와 매트릭스를 호스팅하고 서로 다른 조직 간의 생물물리학적 및 생화학적 상호작용을 시뮬레이션할 수 있습니다. 따라서 천연 활막 관절을 충실하게 요약할 수 있는 미세생리학적 시스템은 관절 질환을 모델링하고 잠재적인 DMOAD를 개발하기 위한 효과적인 플랫폼을 제공할 것을 약속합니다.
인간 중간엽 줄기세포(MSC)는 몸 전체의 많은 조직에서 분리되어 골형성, 연골형성, 지방형성 계통으로 분화될 수 있다6. 중간엽 줄기세포는 뼈, 연골 및 지방 조직을 포함한 다양한 조직을 조작하는 데 성공적으로 사용되어 왔다6, 따라서 무릎 관절의 조직 구성 요소를 조작하기 위한 유망한 세포 공급원을 나타낸다. 우리는 최근에 중간엽 줄기세포(MSC) 유래 뼈, 연골, 섬유, 지방조직으로 구성된 miniJoint라는 이름의 소형 관절 모방 미세생리학적 시스템을 개발했다7. 특히, 새로운 디자인은 미세유체 흐름 또는 투과에 의한 조직 누화를 가능하게 합니다(그림 1). 여기에서 우리는 칩 구성 요소의 제조, 조직 구성 요소의 엔지니어링, 칩에서 엔지니어링된 조직의 배양 및 다운스트림 분석을 위한 조직 수집을 위한 프로토콜을 제시합니다.
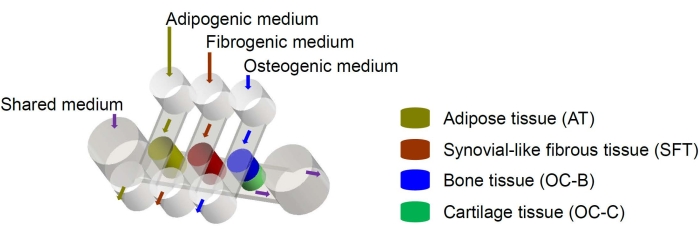
그림 1: 다양한 조직 구성 요소 및 배지 흐름의 배열을 보여주는 miniJoint 칩의 개략도. OC = 골 연골 조직. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Access restricted. Please log in or start a trial to view this content.
프로토콜
다음 프로토콜은 피츠버그 대학교와 피츠버그 대학교의 인간 연구 윤리 위원회의 윤리 지침을 따릅니다. 이 연구에 사용된 재료에 대한 정보는 재료 표에 나열되어 있습니다.
1. 3D 프린팅 바이오리액터 제조
- 컴퓨터 소프트웨어를 사용하여 챔버, 삽입물 및 뚜껑을 포함하는 osteochondral(그림 2A) 및 miniJoint 생물반응기(그림 2B)를 설계합니다. 각 부품에 대한 치수 정보는 그림 S1에 나와 있습니다.
- 디자인을 3D 프린터로 전송하고 포토폴리머 잉크로 인쇄합니다.
- 3D 프린팅 부품(그림 2C-F)을 95% 에탄올 15mL로 세 번 헹굽니다. 그런 다음 손전등 중합 장치에서 200초 동안 인쇄된 조각을 완전히 가교합니다.
- 인서트와 덮개에 O-링을 추가하고(그림 2C, D) 부품이 맞는지 테스트합니다(그림 2G, H).

그림 2: miniJoint 바이오리액터를 만들기 위한 다양한 구성 요소의 제작. (A,B), (A) osteochondral 및 (B) miniJoint 칩을 만들기 위한 생물반응기의 3D 모델. (C,D) 3D 프린팅 (C) 뚜껑 및 (D) O-링이 설치된 인서트. (E,F) (E) 골연골 및 (F) miniJoint 조직 배양을 위한 3D 프린팅 챔버. (지, H) (G) osteochondral 및 (H) miniJoint 칩의 조립. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 조직 구성 요소 엔지니어링
참고: 리튬 페닐-2,4,6-트리메틸벤조일포스피네이트(LAP) 및 메타크릴레이트 젤라틴(GelMA)의 제조 공정은 이전 연구 8,9에 설명되어 있습니다.
- GelMA를 만들려면 아래 단계를 따르십시오.
- 증류수 500mL에 젤라틴 Type B 17g을 넣은 후 37°C에서 30분간 진탕기로 섞는다.
- 그런 다음 메타크릴산 무수물 13mL를 넣고 다시 37°C 진탕기에 놓고 밤새 흔들어 줍니다.
- 다음 날, GelMA를 개별 투석 백에 분취하여 각 백에 ~60mL를 넣습니다.
- 모든 투석 백을 교반 막대가 있는 증류수에 넣고 7일 동안 투석합니다. 하루에 여러 번 물을 갈아주고 가방을 밤새 4 °C에 두십시오.
- 7일째에, GelMA를 -80°C에서 동결시킨다. 완전히 얼면 동결 건조를 진행하십시오.
- GelMA를 동결건조기의 진공 챔버에 있는 접시에 넣고 동결 건조시킵니다. 동결건조기에서 제거하기 전에 GelMA가 완전히 건조되었는지 확인하십시오.
- Hank의 균형 잡힌 소금 용액(Ca 2+ 및 Mg2+가 포함된 HBSS)에 GelMA를 15%(w/v)로 용해합니다. pH가 7.4가 되도록 하려면 pH가 7.4에 도달할 때까지 NaOH를 소량 첨가합니다. 획득한 부피에 따라 1x 항생제-항진균제 및 0.15%(w/v) LAP로 용액을 보충합니다. 사용할 때까지 15% GelMA 용액을 -20°C에서 보관하고 빛으로부터 보호하십시오.
- 3D 프린팅된 이중 흐름 바이오리액터 챔버, 뚜껑 및 삽입물을 오토클레이브 백에 넣고 121°C에서 증기로 20분 동안 오토클레이브한 다음 건열로 20분 동안 오토클레이브합니다.
- 생물학적 안전 캐비닛 내부에서 생물 반응기 챔버, 뚜껑 및 삽입물을 멸균 인산염 완충 식염수 15mL에 밤새 담근 후 건조시킵니다.
- IRB 승인을 받은 전체 관절 성형술 수술 폐기물에서 인간 골수 유래 중간엽 줄기세포를 분리합니다(피츠버그 대학교 및 워싱턴 대학교).
- 특히, 대퇴골 경부와 머리의 섬유주골에서 골수를 씻어내고 Dulbecco's Modified Eagle's Medium(DMEM)에 다시 매달아 놓습니다.
- 40μm 스트레이너를 통해 현탁액을 여과하고 300 x g 에서 5분 동안 플로우 스루를 원심분리합니다.
- 상층액을 제거하고 성장 배지[DMEM, 10% fetal bovine serum(FBS) 및 1x 항생제-항진균제]를 사용하여 펠릿을 재현탁한 다음 조직 배양 플라스크에 넣습니다.
- 배양 배지를 3일에서 4일마다 교체합니다. 계속 진행하기 전에 70%에서 80%의 합류점에 도달했는지 확인하십시오.
- 2-3분 동안 트립신-EDTA와 함께 배양하여 세포를 분리하고, T150 플라스크 당 100만 개의 세포 비율로 계대배양한다.
- 셀을 P5로 확장합니다. 트립신 처리 후, 세포를 현탁시키고, 계수한 다음, 300x g 에서 5분 동안 원심분리하여 펠렛화한다.
- 1,000 μL 피펫을 사용하여 15% GelMA 용액에서 20 x 106 cells/mL로 세포를 재현탁합니다.
알림: 생물 안전 캐비닛의 조명을 끕니다. - 멸균 장갑을 사용하여 멸균된 건조 실리콘 몰드를 페트리 접시에 대고 누릅니다. 그런 다음 집게로 실리콘 몰드의 각 구멍에 인서트를 하나씩 넣고 인서트의 구멍 면이 아래를 향하도록 합니다.
- 200 μL 피펫을 사용하여 세포 현탁액을 추가하여 삽입물을 채웁니다(삽입물당 ~50 μL).
- UV 손전등(파장 395nm의 LED 조명)을 사용하여 젤/인서트 상단을 1.5분 동안 가교합니다. 그런 다음 반대쪽을 30초 동안 비춥니다. 가교는 LAP 광개시제가 자외선에 노출될 때 발생합니다.
참고: 세포 현탁액은 이 기간 동안 인큐베이터에 보관하거나 빛으로부터 보호할 수 있습니다. - 멸균 겸자를 사용하여 세포가 밤새 회복될 수 있도록 비조직 배양 6웰 플레이트(10%[v/v] FBS 및 1x 항생제-항진균제가 보충된 DMEM)의 성장 배지 8mL에 삽입물을 즉시 옮깁니다.
- 세포를 4개의 계통으로 분화합니다.
- 지방 조직(AT)을 조작하기 위해 삽입물을 8mL의 지방 생성 배지(AM; 알파-MEM, 10% FBS, 0.2mM 인도메타신, 1x 인슐린-트랜스페린-셀레늄(ITS), 0.45mM 3-이소부틸-1-메틸크산틴, 0.1μM 덱사메타손 및 1x 항생제-항진균제)로 분화를 시작합니다. 이상적으로는, 4개의 삽입물을 8 mL의 지방생성 배지가 있는 비조직 배양 웰 플레이트의 단일 웰에 배치한다. 웰 플레이트에서 세포를 28일 동안 배양하고, 배지를 격일로 교체하였다.
- 골연골 단위(OC)를 설계하려면 삽입물을 이중 흐름 생물반응기 챔버에 넣고 웰을 덮고 35mL의 골형성 배지(OM; DMEM, 10% FBS, 1x 항생제-항진균제, 0.1μM 덱사메타손, 0.01M β-글리세로포스페이트, 100ng/mL 골형성 단백질 7(BMP7), 50μg/mL 아스코르브산 및 10nM 비타민 D3) 및 35mL의 연골 형성 배지(CM; DMEM, 항생제-항진균제 1개, ITS 1개, 덱사메타손 0.1μM, 프롤린 40μg/mL, 아스코르브산 50μg/mL 및 10ng/mL 형질전환 성장 인자 β3)10. 격주로 배지 교체를 수행하여 28일 동안 세포 분화를 유지합니다.
- 섬유아세포를 유도하기 위해 20mL의 섬유성 배지(FM; 고급 DMEM, 5% FBS, 1x GlutaMAX, 1x 항생제-항진균제 및 50μg/mL 아스코르브산)를 사용하여 T150 cm2 조직 배양 플라스크에서 21일 동안 2D 배양에서 MSC를 분화합니다. 매주 매체를 변경하십시오. 4mL의 트립신을 사용하여 세포를 분리하고 위에서 설명한 프로토콜에 따라 삽입물 내에 3D 젤을 캡슐화하여 활액막과 같은 섬유 조직(SFT)을 얻습니다.
참고: 모든 분화 배지의 조성은 표 1에서 확인할 수 있습니다.
3. miniJoint 칩 구축
- 3D miniJoint 바이오리액터 챔버, 내경 0.062인치, 외경 0.125인치의 실리콘 튜브, F 1/16 루어락 커넥터를 오토클레이브합니다. 실리콘 튜브를 한쪽 끝의 miniJoint 바이오리액터 바브에 연결하고 다른 쪽 끝의 Luer 잠금 장치를 연결합니다.
- 단계 2.11에서 언급한 AM, OM(BMP7 제거) 및 FMCM을 준비합니다. 또한, miniJoint 배양에 사용할 공통 공유 배지(SM; phenol red-free DMEM, 1x antibiotic-antimycotic, 1x Na-pyruvate, 1x ITS, 40 μg/mL proline, 50 μg/mL ascorbic acid, 0.5 ng/mL transing growth factor β3)를 준비합니다. 각 배지 35mL를 배지 저장소에 넣습니다.
- 직선 집게를 사용하여 osteochondral 장치를 이중 흐름 생물 반응기에서 miniJoint 생물 반응기의 오른쪽 웰로 옮깁니다. 지방 조직 삽입물 및 섬유 조직 삽입물을 각각 왼쪽 및 중간 웰로 옮깁니다. 멸균 된 뚜껑으로 모든 우물을 덮으십시오.
- miniJoint 칩의 입구를 중간 저장소에 연결하고 출구를 주사기에 연결합니다(그림 3A-C).
- 주사기를 주사기 펌프에 장착하고(그림 3C) 펌프와 칩을 인큐베이터로 옮깁니다. 중간 저장소는 인큐베이터 외부의 얼음 위에 보관됩니다.
- 인출 모드에서 펌프를 작동하여 매체 저장소에서 miniJoint 생물 반응기 챔버로 매체를 끌어옵니다. 이 miniJoint 배양 과정은 28 일 동안 지속됩니다.
- 관절 염증 및 연골 변성을 모델링하려면 인터루킨 1β(IL-1β)를 섬유성 배지 스트림에 10ng/mL로 추가합니다. IL-1β 처리 3일째에 주사기를 교체하고, 신선한 IL-1β를 섬유성 배지에 제공한다. 치료는 7 일간 지속됩니다.
- 약물 시험 단계 동안, IL-1β 치료 3일 후, 약물을 공유 배지에서 투여하거나, 약물이 무릎 관절에서 국소적으로 사용될 때 "관절내 투여"(도 3D)를 시뮬레이션하거나, 또는 모든 배지 유형에서 약물이 순환을 통해 무릎 관절에 작용할 때 "전신 투여"(도 3E)를 시뮬레이션한다.
- 샘플이 이전 4일 동안 약물 치료를 받았는지 여부에 관계없이 IL-1β 처리 7일 후 분석을 위해 개별 조직을 수집합니다.
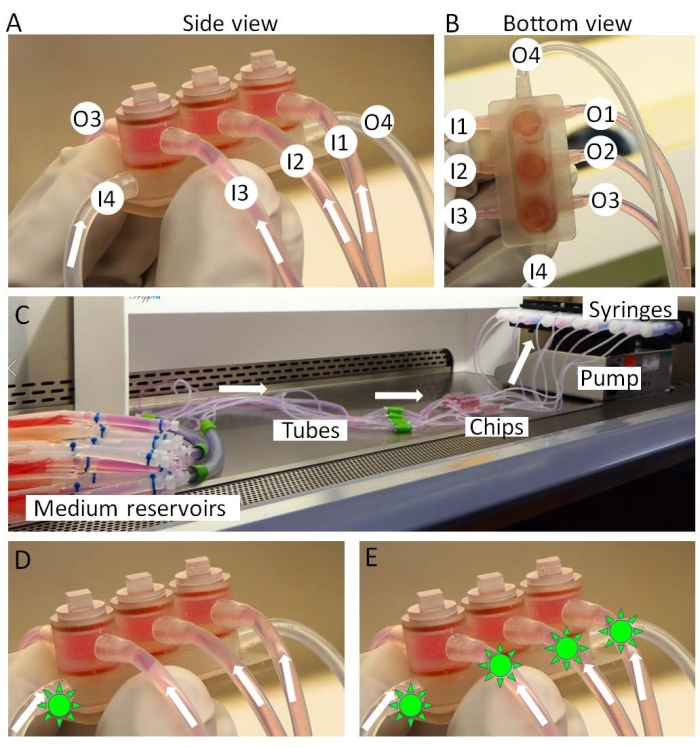
그림 3: miniJoint의 조립. (A,B) 조직 특이적 매체는 입구 1-3(I1-3)에서 유입되고 배출구 1-3(O1-3)에서 배출됩니다. 공유 매체는 I4에서 O4로 관류됩니다. (C) miniJoint 문화의 전체 설정. 약물(녹색 태양과 같은 모양)은 (D) 공유 배지에만 또는 (E) 모든 배지에 도입되어 각각 "관절내 투여" 또는 "전신 투여"를 시뮬레이션할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 개별 조직 수집
- 멸균 곡선 집게를 사용하여 삽입물을 제거합니다.
- 삽입물 중앙에 생검 펀치를 밀어 젤을 제거하고 젤을 PBS에 넣습니다.
- 유전자 발현을 평가할 때 osteochondral gels를 반으로 자릅니다.
참고: 골연골 젤은 두 가지 조직 유형으로 구성되어 있기 때문에 골형성 세포와 연골 형성 세포를 분리하는 것이 중요합니다. - 다양한 실험을 위해 컨디셔닝된 배지와 조직을 수집합니다.
- 각 배지 소스에서 약 1.5mL를 수집합니다.
- 14,000 x g 에서 10분 동안 원심분리하고 침전물을 버린 후 액체 질소에서 조절된 배지를 급속 동결합니다.
- 조직학적 염색 및 면역염색을 위해 먼저 OC 및 SFT 샘플을 10% 완충 포르말린에 고정하고 오름차순 농도의 에탄올에서 탈수하고 크실렌에서 제거하고 파라핀에 삽입한 다음 마지막으로 6μm 두께로 절단합니다.
- AT 미세 조직의 경우 샘플을 10% 완충 포르말린에 고정하고 Oil Red O 용액 또는 BODIPY로 직접 염색합니다.
Access restricted. Please log in or start a trial to view this content.
결과
miniJoint에서 28일 동안 배양한 후 표현형을 분석하기 위해 miniJoint의 모든 조직을 수집했습니다(그림 4A). 이것은 이전 간행물7에 자세히 설명되어 있습니다.
RT-qPCR의 이용, 면역염색 및 조직학적 염색을 통해 개별 미세조직에 대해 조직 특이적 표현형이 잘 유지됨을 확인하였다(도 4). 예를 들어, OC 미세조직(OC-O)의 ?...
Access restricted. Please log in or start a trial to view this content.
토론
이 기사에서는 뼈, 연골, 지방 조직 및 활막과 같은 조직이 중간엽 줄기세포에서 형성되고 맞춤형 바이오리액터 내에서 공동 배양되는 무릎 관절 칩 시스템을 만들기 위한 프로토콜을 제시합니다. 플러그 앤 플레이 기능을 갖춘 이 다중 성분 인간 세포 유래 시스템은 관절 질환의 발병기전을 연구하고 약물을 개발하기 위한 새로운 도구입니다.
서로 다른 조직이 특정 배양 배...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 경쟁 이익을 선언하지 않습니다.
감사의 말
이 연구는 주로 국립 보건원(UG3/UH3TR002136, UG3/UH3TR003090)의 자금 지원을 받았습니다. 또한 인체 조직 샘플을 제공한 Paul Manner(워싱턴 대학교) 박사와 중간엽 줄기세포를 분리하고 세포 풀을 만드는 데 도움을 준 Jian Tan 박사에게 감사드립니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 3-isobutyl-1-methylxanthine | Sigma -Aldrich | I17018-1G | |
| 6 well non-tissue culture plate | Corning Falcon® Plates | 351146 | |
| 24 well non-tissue culture plate | Corning Falcon® Plates | 351147 | |
| 30 mL syringes | BD Syringe Luer Lock Cascade Health | 302832 | |
| Alcian blue stain | EK Industries | 1198 | 1% w/v, pH 1.0 |
| Advanced DMEM | Gibco | 12491-015 | |
| αMEM | Gibco | 12571-063 | |
| Antibiotic-antimycotic | Gibco | 15240-062 | |
| Biopsy punch | Integra Miltex | 12-460-407 | |
| BODIPY® fluorophore | Molecular Probes | ||
| Bone morphogenic protein 7 (BMP7) | Peprotech | ||
| Curved forceps | Fisher Brand | 16100110 | |
| DMEM | Gibco | 11995-065 | Dulbecco’s Modified Eagle Medium |
| Dexmethasome | Sigma -Aldrich | 02-05-2002 | |
| E-Shell 450 photopolymer in | EnvisionTec | RES-01-4022 | |
| Fetal Bovine Serum | Gemini-Bio Products | 900-208 | |
| GlutaMAX | Gibco | 3505-061 | |
| gelatin from bovine skin | Hyclone | 1003372809 | |
| Hank’s Balanced Salt Solution | Sigma -Aldrich | SH30588.02 | |
| indomethacin | Sigma -Aldrich | I7378-56 | |
| Insulin-Transferrin-Selenium-Ethanolamine (ITS) | Gibco | 51500-056 | |
| interleukin 1β | Peprotech | 200-01B | |
| Leur-loc connectors | Cole-Parmer Instruments | 45508-50 | |
| L-proline | Sigma -Aldrich | 115388-93-7 | |
| β-glycerophosphate | Sigma -Aldrich | 1003129352 | |
| Medium bags | KiYATEC | FC045 | |
| Methacrylic Anhydride | Sigma -Aldrich | 102378580 | |
| Phosphate buffered Saline | Corning | 21-040-CM | |
| Pointed forceps | Fisher Brand | 12000122 | |
| Silicon mold | McMaster-Carr | RC00114P | |
| Silicon o-rings | McMaster-Carr | ZMCCs1X5 | 1mm x 5mm |
| SolidWorks | Dassault Systèmes SE, Vélizy-Villacoublay, France | ||
| Surgical Blades | Integra Miltex | 4-122 | |
| Syringe pump | Lagato210P, KD Scientific | Z569631 | 10 syringe racks |
| T-182 tissue culture flasks | Fisher Brand | FB012939 | |
| Tissue Culture Dish 150 mm | Fisher Brand | FB012925 | |
| Transforming Growth Factor Beta (TGF-β3) | Peprotech | 100-36E | |
| Trypsin | Gibco | 25200-056 | |
| UV Flashlight | KBS | KB70109 | 395 nm |
| Vida Desktop 3D Printer | EnvisionTec | ||
| Vitamin D3 | Sigma -Aldrich | 32222-06-3 | 1,25-dihydroxyvitamin D3 |
참고문헌
- Safiri, S., et al. Global, regional and national burden of osteoarthritis 1990-2017: A systematic analysis of the Global Burden of Disease Study 2017. Annals of the Rheumatic Diseases. 79 (6), 819-828 (2020).
- Lawrence, R. C., et al. Estimates of the prevalence of arthritis and other rheumatic conditions in the United States: Part II. Arthritis and Rheumatism. 58 (1), 26-35 (2008).
- Makarczyk, M. J., et al. Current models for development of disease-modifying osteoarthritis drugs. Tissue Engineering. Part C, Methods. 27 (2), 124-138 (2021).
- He, Y., et al. Pathogenesis of osteoarthritis: risk factors, regulatory pathways in chondrocytes, and experimental models. Biology. 9 (8), 194(2020).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Lin, H., Sohn, J., Shen, H., Langhans, M. T., Tuan, R. S. Bone marrow mesenchymal stem cells: aging and tissue engineering applications to enhance bone healing. Biomaterials. 203, 96-110 (2019).
- Li, Z., et al. Human mesenchymal stem cell-derived miniature joint system for disease modeling and drug testing. Advanced Science. 9 (21), 2105909(2022).
- Lin, H., Cheng, A. W., Alexander, P. G., Beck, A. M., Tuan, R. S. Cartilage tissue engineering application of injectable gelatin hydrogel with in situ visible-light-activated gelation capability in both air and aqueous solution. Tissue Engineering. Part A. 20 (17-18), 2402-2411 (2014).
- Fairbanks, B. D., Schwartz, M. P., Bowman, C. N., Anseth, K. S. Photoinitiated polymerization of PEG-diacrylate with lithium phenyl-2,4,6-trimethylbenzoylphosphinate: polymerization rate and cytocompatibility. Biomaterials. 30 (35), 6702-6707 (2009).
- Lin, H., Lozito, T. P., Alexander, P. G., Gottardi, R., Tuan, R. S. Stem cell-based microphysiological osteochondral system to model tissue response to interleukin-1β. Molecular Pharmaceutics. 11 (7), 2203-2212 (2014).
- Yin, B., et al. Hybrid macro-porous titanium ornamented by degradable 3D gel/nHA micro-scaffolds for bone tissue regeneration. International Journal of Molecular Sciences. 17 (4), 575(2016).
- Lin, Z., et al. Osteochondral tissue chip derived from iPSCs: Modeling OA pathologies and testing drugs. Frontiers in Bioengineering and Biotechnology. 7, 411(2019).
- Atukorala, I., et al. Synovitis in knee osteoarthritis: A precursor of disease. Annals of the Rheumatic Diseases. 75 (2), 390-395 (2016).
- Occhetta, P., et al. Hyperphysiological compression of articular cartilage induces an osteoarthritic phenotype in a cartilage-on-a-chip model. Nature Biomedical Engineering. 3 (7), 545-557 (2019).
- He, C., et al. Modeling early changes associated with cartilage trauma using human-cell-laden hydrogel cartilage models. Stem Cell Research and Therapy. 13 (1), 400(2022).
- Elsissy, J. G., et al. Bacterial septic arthritis of the adult native knee joint: A review. JBJS Reviews. 8 (1), 0059(2020).
- Romero-Lopez, M., et al. Macrophage effects on mesenchymal stem cell osteogenesis in a three-dimensional in vitro bone model. Tissue Engineering. Part A. 26 (19-20), 1099-1111 (2020).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유