Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Création d’une articulation du genou sur puce pour modéliser les maladies articulaires et tester des médicaments
Dans cet article
Résumé
Nous fournissons des méthodes détaillées pour générer quatre types de tissus à partir de cellules souches mésenchymateuses humaines, qui sont utilisées pour récapituler le cartilage, l’os, le coussinet adipeux et la synoviale dans l’articulation du genou humain. Ces quatre tissus sont intégrés dans un bioréacteur personnalisé et connectés par microfluidique, générant ainsi une articulation du genou sur puce.
Résumé
La forte prévalence de maladies articulaires débilitantes comme l’arthrose (OA) pose un fardeau socio-économique élevé. Actuellement, les médicaments disponibles qui ciblent les troubles articulaires sont principalement palliatifs. Le besoin non satisfait de médicaments efficaces modificateurs de la maladie pour l’arthrose (DMOAD) a été principalement causé par l’absence de modèles appropriés pour étudier les mécanismes de la maladie et tester les DMOAD potentiels. Ici, nous décrivons l’établissement d’un système microphysiologique miniature imitant l’articulation synoviale (miniJoint) comprenant des composants de tissus adipeux, fibreux et ostéochondrals dérivés de cellules souches mésenchymateuses humaines (CSM). Pour obtenir les microtissus tridimensionnels (3D), les CSM ont été encapsulées dans de la gélatine méthacrylée photoréticulable avant ou après la différenciation. Les constructions tissulaires chargées de cellules ont ensuite été intégrées dans un bioréacteur imprimé en 3D, formant le miniJoint. Des flux séparés de milieux ostéogène, fibrogéniques et adipogènes ont été introduits pour maintenir les phénotypes tissulaires respectifs. Un flux commun a été perfusé à travers les tissus cartilagineux, synovial et adipeux pour permettre la diaphonie tissulaire. Ce schéma d’écoulement permet l’induction de perturbations dans un ou plusieurs composants tissulaires pour les études mécanistiques. En outre, les DMOAD potentiels peuvent être testés soit par « administration systémique » à travers tous les flux intermédiaires, soit par « administration intraarticulaire » en ajoutant les médicaments uniquement au flux de simulation de « liquide synovial » partagé. Ainsi, le miniJoint peut servir de plateforme in vitro polyvalente pour étudier efficacement les mécanismes de la maladie et tester des médicaments en médecine personnalisée.
Introduction
Les maladies articulaires comme l’arthrose (OA) sont très répandues et débilitantes et représentent l’une des principales causes d’invalidité dans le monde1. On estime qu’aux États-Unis seulement, l’arthrose touche 27 millions de patients et survient chez 12,1% des adultes âgés de 60 ans et plus2. Malheureusement, la plupart des médicaments actuellement utilisés pour gérer les maladies articulaires sont palliatifs, et aucun médicament modificateur de la maladie (DMOAD) efficace n’est disponible3. Ce besoin médical non satisfait découle principalement de l’absence d’un modèle efficace pour étudier les mécanismes de la maladie et développer des DMOAD potentiels. La culture cellulaire bidimensionnelle conventionnelle (2D) ne reflète pas la nature 3D des tissus articulaires, et la culture d’explants tissulaires est souvent entravée par une mort cellulaire importante et ne parvient généralement pas à reproduire les interconnexions tissulaires dynamiques4. De plus, les différences génétiques et anatomiques réduisent significativement la pertinence physiologique des modèles animaux4.
Les organes sur puce (OoC), ou systèmes microphysiologiques, sont un domaine de recherche prometteur à l’interface de l’ingénierie, de la biologie et de la médecine. Ces plateformes in vitro sont des unités fonctionnelles minimales qui reproduisent des caractéristiques saines ou pathologiques définies de leurs homologues in vivo 5. De plus, ces systèmes miniaturisés peuvent héberger diverses cellules et matrices et simuler les interactions biophysiques et biochimiques entre différents tissus. Par conséquent, un système microphysiologique capable de récapituler fidèlement l’articulation synoviale native promet d’offrir une plate-forme efficace pour la modélisation des maladies articulaires et le développement de DMOAD potentiels.
Les cellules souches mésenchymateuses humaines (CSM) peuvent être isolées de nombreux tissus dans tout le corps et différenciées en lignées ostéogène, chondrogéniques et adipogènes6. Les CSM ont été utilisées avec succès pour concevoir divers tissus, y compris les os, le cartilage et le tissu adipeux6, ce qui signifie qu’ils représentent une source cellulaire prometteuse pour l’ingénierie des composants tissulaires de l’articulation du genou. Nous avons récemment mis au point un système microphysiologique miniature imitant les articulations, appelé miniJoint, qui comprend des tissus osseux, cartilagineux, fibreux et adipeux dérivésdu MSC 7. En particulier, la nouvelle conception permet la diaphonie tissulaire par écoulement microfluidique ou perméation (Figure 1). Nous présentons ici les protocoles pour la fabrication des composants de la puce, l’ingénierie des composants tissulaires, la culture des tissus modifiés dans la puce et la collecte des tissus pour les analyses en aval.
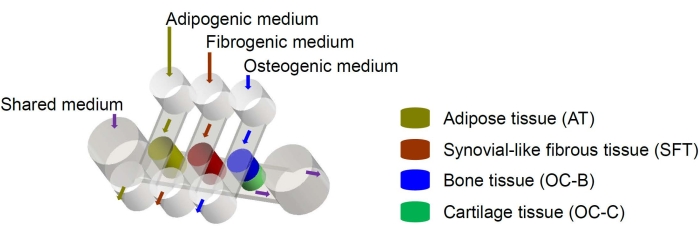
Figure 1 : Schéma de la puce miniJoint montrant la disposition des différents composants tissulaires et des écoulements du milieu. OC = tissu ostéochondral. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Access restricted. Please log in or start a trial to view this content.
Protocole
Le protocole suivant suit les directives éthiques de l’Université de Pittsburgh et du comité d’éthique de la recherche humaine de l’Université de Pittsburgh. L’information sur les matériaux utilisés dans cette étude est présentée dans le tableau des matériaux.
1. Fabrication de bioréacteurs imprimés en 3D
- Utiliser un logiciel informatique pour concevoir des bioréacteurs ostéochondrals (Figure 2A) et miniJoint (Figure 2B) comprenant des chambres, des inserts et des couvercles. Les informations de dimension pour chaque pièce sont présentées à la figure S1.
- Transférez le dessin sur une imprimante 3D et imprimez avec une encre photopolymère.
- Rincer trois fois les pièces imprimées en 3D (figure 2C-F) avec 15 ml d’éthanol à 95 %. Ensuite, réticulez complètement les pièces imprimées pendant 200 s dans un dispositif de polymérisation à la lampe de poche.
- Ajouter des joints toriques aux inserts et aux couvercles (Figure 2C, D) et vérifier si les pièces sont ajustées (Figure 2G, H).

Figure 2 : Fabrication des différents composants pour fabriquer le bioréacteur miniJoint (A,B), modèles 3D de bioréacteurs pour la création (A) de puces ostéochondrales et (B) de puces miniJoint. Couvercles (C, D) imprimés en 3D (C) et inserts (D) avec le joint torique installé. (E,F) chambres imprimées en 3D pour (E) culture ostéochondrale et (F) mini-culture tissulaire articulaire. (G,H) Assemblage de puces (G) ostéochondrales et (H) mini-articulaires. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Ingénierie des composants tissulaires
NOTE: Les procédés de fabrication du phényl-2,4,6-triméthylbenzoylphosphinate de lithium (LAP) et de la gélatine méthacrylée (GelMA) sont décrits dans des études antérieures 8,9.
- Pour créer GelMA, suivez les étapes ci-dessous.
- Ajouter 17 g de gélatine de type B à 500 mL d’eau distillée, puis mélanger sur un agitateur pendant 30 min à 37 °C.
- Ensuite, ajouter 13 mL d’anhydride méthacrylique, remettre sur le shaker à 37 °C et laisser agiter toute la nuit.
- Le lendemain, aliquote le GelMA dans des sacs de dialyse individuels, avec ~60 ml dans chaque sac.
- Placez tous les sacs de dialyse dans de l’eau distillée à l’aide d’une barre d’agitation et prévoyez 7 jours de dialyse. Changez l’eau plusieurs fois par jour et laissez les sacs à 4 °C pendant la nuit.
- Le jour 7, congeler le GelMA à −80 °C. Une fois complètement congelé, procéder à la lyophilisation.
- Placez le GelMA dans un plat dans la chambre à vide d’un lyophilisateur et laissez sécher par lyophilisation. Assurez-vous que le GelMA est complètement séché avant de le retirer du lyophiliseur.
- Dissoudre le GelMA dans la solution saline équilibrée de Hank (HBSS avec Ca 2+ et Mg2+) à 15% (p / v). Pour vous assurer que le pH est à 7,4, ajoutez du NaOH en petites quantités jusqu’à ce que le pH atteigne 7,4. Complétez la solution avec 1x antibiotique-antimycotique et 0,15% (p/v) LAP en fonction du volume acquis. Conservez la solution de GelMA à 15 % à −20 °C jusqu’à utilisation et à l’abri de la lumière.
- Placez les chambres de bioréacteur à double flux, les couvercles et les inserts imprimés en 3D dans des sacs d’autoclave, et autoclavez à 121 °C pendant 20 min avec de la vapeur, puis pendant 20 min avec de la chaleur sèche.
- À l’intérieur de l’enceinte de sécurité biologique, faites tremper les chambres du bioréacteur, les couvercles et les inserts dans 15 ml de solution saline tamponnée au phosphate stérile pendant la nuit, après quoi laissez-les sécher.
- Isoler les CSM dérivées de la moelle osseuse humaine des déchets chirurgicaux totaux d’arthroplastie articulaire avec l’approbation de l’IRB (Université de Pittsburgh et Université de Washington).
- Plus précisément, rincer la moelle osseuse de l’os trabéculaire du col et de la tête du fémur et la remettre en suspension dans le milieu d’aigle modifié de Dulbecco (DMEM).
- Filtrer la suspension à travers une crépine de 40 μm et centrifuger le débit à 300 x g pendant 5 min.
- Retirer le surnageant, remettre les granulés en suspension à l’aide d’un milieu de croissance [DMEM, sérum fœtal bovin à 10 % et 1x antibiotique-antimycotique], puis placer dans des flacons de culture tissulaire.
- Changez le milieu de culture tous les 3 jours à 4 jours. Assurez-vous qu’une confluence de 70 % à 80 % est atteinte avant d’aller plus loin.
- Détacher les cellules en incubant avec de la trypsine-EDTA pendant 2-3 min, et passage à un rapport de 1 million de cellules par fiole T150.
- Développez les cellules à P5. Après trypsinisation, suspendre les cellules, les compter, puis granuler par centrifugation à 300x g pendant 5 min.
- À l’aide d’une pipette de 1 000 μL, remettre les cellules en suspension à 20 x 106 cellules/ml dans une solution de GelMA à 15 %.
REMARQUE : Éteignez la lumière de l’enceinte de sécurité biologique. - À l’aide de gants stériles, pressez un moule en silicone stérile et sec contre une boîte de Pétri. Ensuite, placez un insert dans chaque trou du moule en silicone avec une pince, avec le côté trou de l’insert tourné vers le bas.
- À l’aide d’une pipette de 200 μL, ajouter la suspension cellulaire pour remplir l’insert (~50 μL par insert).
- Utilisez une lampe de poche UV (lumière LED avec une longueur d’onde de 395 nm) pour réticuler le haut du gel/insert pendant 1,5 min. Ensuite, illuminez l’autre côté pendant 30 s. La réticulation se produit lorsque le photoinitiateur LAP est exposé à la lumière UV.
REMARQUE: La suspension cellulaire peut être conservée dans l’incubateur pendant cette période ou protégée de la lumière. - À l’aide d’une pince stérile, transférer immédiatement les inserts dans 8 mL de milieu de croissance dans une plaque de culture non tissulaire à 6 puits (DMEM supplémenté avec 10 % [v/v] FBS et 1x antibiotique-antimycotique) pour permettre aux cellules de récupérer pendant la nuit.
- Différencier les cellules en quatre lignées.
- Pour concevoir le tissu adipeux (AT), transférer les inserts dans 8 mL de milieu adipogène (AM; Alpha-MEM, FBS à 10 %, indométacine 0,2 mM, 1 insuline-transférrine-sélénium (ITS), 0,45 mM 3-isobutyl-1-méthylxanthine, 0,1 μM de dexaméthasone et 1 x antibiotique-antimycotique) pour initier la différenciation. Idéalement, quatre inserts sont placés dans un seul puits d’une plaque de puits de culture non tissulaire avec 8 mL de milieu adipogénique. Culture des cellules dans les plaques de puits pendant 28 jours, avec des changements de milieu tous les deux jours.
- Pour concevoir les unités ostéochondrales (OC), placer les inserts dans des chambres de bioréacteur à double flux, boucher les puits et infuser les deux flux séparément à un débit de 5 μL/min avec 35 mL de milieu ostéogénique (OM; DMEM, FBS à 10 %, 1x antibiotique-antimycotique, 0,1 μM de dexaméthasone, 0,01 M β-glycérophosphate, 100 ng/mL de protéine morphogénique osseuse 7 (BMP7), 50 μg/mL d’acide ascorbique et 10 nM de vitamine D3) et 35 mL de milieu chondrogène (CM; DMEM, 1x antibiotique-antimycotique, 1x ITS, 0,1 μM de dexaméthasone, 40 μg/mL de proline, 50 μg/mL d’acide ascorbique et 10 ng/mL de facteur de croissance transformant β3)10. Maintenir la différenciation cellulaire pendant 28 jours en effectuant des changements de milieu toutes les deux semaines.
- Pour dériver les fibroblastes, différencier les CSM en culture 2D sur 21 jours dans un flacon de culture tissulaire T150 cm2 en utilisant 20 mL de milieu fibrogène (FM; DMEM avancé, 5% FBS, 1x GlutaMAX, 1x antibiotique-antimycotique et 50 μg / mL d’acide ascorbique). Changez le support chaque semaine. Utilisez 4 mL de trypsine pour détacher les cellules et encapsulez les gels 3D dans les inserts, en suivant le protocole décrit ci-dessus, pour obtenir du tissu synovial semblable à fibreux (SFT).
NOTE: Les compositions de tous les milieux de différenciation se trouvent dans le tableau 1.
3. Mise en place de la puce miniJoint
- Autoclave les chambres de bioréacteur 3D miniJoint, les tubes en silicone d’un diamètre intérieur de 0,062 pouce et d’un diamètre extérieur de 0,125 pouce, et les connecteurs Luer-lock F 1/16. Connectez le tube en silicone à la barbe du bioréacteur miniJoint à une extrémité et connectez le verrou Luer à l’autre extrémité.
- Préparez le AM, l’OM (en supprimant BMP7) et le FMCM mentionnés à l’étape 2.11. De plus, préparer le milieu commun partagé (SM; DMEM sans phénol rouge, 1x antibiotique-antimycotique, 1x Na-pyruvate, 1x ITS, 40 μg/mL de proline, 50 μg/mL d’acide ascorbique et 0,5 ng/mL de facteur de croissance transformant β3) à utiliser pour la culture miniJoint Charger 35 mL de chaque milieu dans les réservoirs du milieu.
- Utilisez une pince droite pour transférer l’unité ostéochondrale du bioréacteur à double flux vers le puits droit du bioréacteur mini-joint. Transférer l’insert de tissu adipeux et l’insert de tissu fibreux dans les puits gauche et moyen, respectivement. Boucher tous les puits avec des couvercles stérilisés.
- Connectez les entrées de la puce miniJoint aux réservoirs du milieu et les sorties aux seringues (Figure 3A-C).
- Montez les seringues sur une pompe à seringue (Figure 3C) et transférez la pompe et les copeaux dans un incubateur. Les réservoirs moyens sont maintenus sur de la glace à l’extérieur de l’incubateur.
- Faites fonctionner la pompe en mode retrait, en aspirant le fluide du réservoir moyen dans la chambre du bioréacteur mini-joint. Ce processus de culture miniJoint dure 28 jours.
- Pour modéliser l’inflammation articulaire et la dégénérescence du cartilage, ajouter de l’interleukine 1β (IL-1β) au flux de milieu fibrogène à 10 ng / mL. Remplacez les seringues le troisième jour du traitement par IL-1β et apportez de l’IL-1β fraîche au milieu fibrogénique. Le traitement dure 7 jours.
- Au cours de l’étape de test médicamenteux, après 3 jours de traitement par IL-1β, administrer le médicament soit dans le milieu partagé, simulant une « administration intra-articulaire » (Figure 3D) lorsque le médicament est utilisé localement dans l’articulation du genou, soit dans tous les types de milieux, simulant une « administration systémique » (Figure 3E) lorsque le médicament agit sur l’articulation du genou à travers la circulation.
- Prélever des tissus individuels pour analyse après 7 jours de traitement IL-1β, que les échantillons aient ou non subi un traitement médicamenteux au cours des 4 jours précédents.
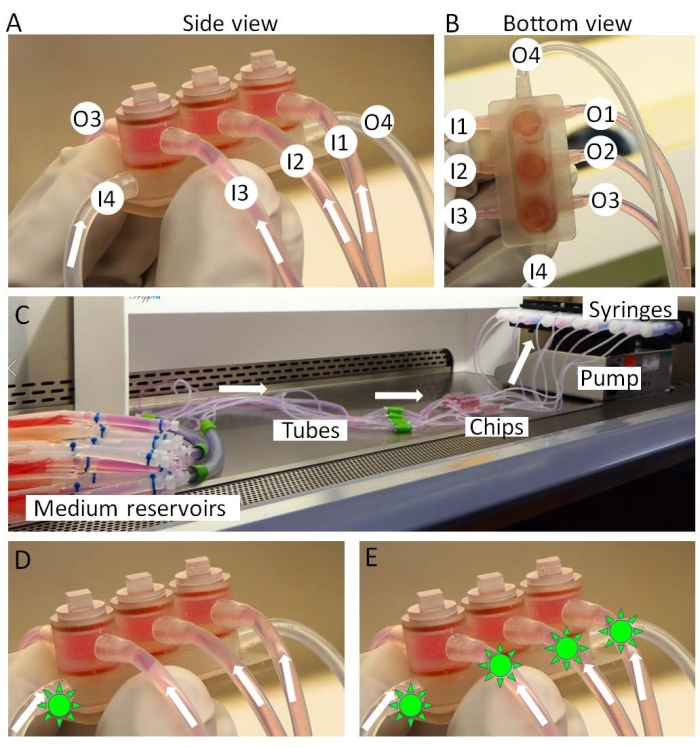
Figure 3 : Assemblage de la miniJoint (A,B) Les milieux spécifiques aux tissus sont introduits à partir des entrées 1 à 3 (I1-3) et sortis des prises 1 à 3 (O1-3). Le milieu partagé est perfusé de I4 à O4. (C) La mise en place complète de la culture mini-joint. Les médicaments (formes de soleil vert) peuvent être introduits dans (D) le milieu partagé uniquement ou (E) tous les milieux pour simuler respectivement « l’administration intra-articulaire » ou « l’administration systémique ». Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Prélèvement individuel de tissus
- Utilisez des pinces incurvées stériles pour retirer les inserts.
- Poussez un poinçon de biopsie à travers le centre de l’insert pour retirer le gel, et placez le gel dans PBS.
- Couper les gels ostéochondrals en deux lors de l’évaluation de l’expression des gènes.
REMARQUE: Puisque le gel ostéochondral se compose de deux types de tissus, il est important de séparer les cellules ostéogéniques et chondrogènes. - Recueillir les milieux et les tissus conditionnés pour diverses expériences.
- Prélever environ 1,5 mL de chaque source moyenne.
- Congeler le milieu conditionné dans de l’azote liquide après avoir centrifugé à 14 000 x g pendant 10 min et éliminé les sédiments.
- Pour la coloration histologique et l’immunomarquage, fixez d’abord les échantillons OC et SFT dans du formol tamponné à 10%, déshydratez-les dans de l’éthanol de concentrations croissantes, éliminez-les dans du xylène, incorporez-les dans de la paraffine et enfin sectionnez-les sur une épaisseur de 6 μm.
- Pour les microtissus AT, fixez les échantillons dans du formol tamponné à 10% et colorez-les directement avec une solution Oil Red O ou BODIPY.
Access restricted. Please log in or start a trial to view this content.
Résultats
Tous les tissus de la miniJoint ont été prélevés pour analyser leurs phénotypes après 28 jours de culture dans la miniJoint (Figure 4A). Cela a été détaillé dans notre publication précédente7.
Grâce à l’utilisation de la RT-qPCR, de l’immunomarquage et de la coloration histologique, il a été confirmé que les phénotypes spécifiques aux tissus étaient bien maintenus pour les microtissus individuels (
Access restricted. Please log in or start a trial to view this content.
Discussion
Dans cet article, nous présentons un protocole pour créer un système d’articulation du genou sur puce, dans lequel l’os, le cartilage, le tissu adipeux et les tissus de type synoviale sont formés à partir de CSM et co-cultivés dans un bioréacteur personnalisé. Ce système multi-composants, dérivé de cellules humaines avec des fonctionnalités plug-and-play, représente un nouvel outil pour étudier la pathogenèse des maladies articulaires et développer des médicaments.
Étant...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt concurrent.
Remerciements
Cette recherche a été principalement financée par les National Institutes of Health (UG3/UH3TR002136, UG3/UH3TR003090). De plus, nous remercions le Dr Paul Manner (Université de Washington) d’avoir fourni les échantillons de tissus humains et le Dr Jian Tan de son aide dans l’isolement des CSM et la création du pool cellulaire.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 3-isobutyl-1-methylxanthine | Sigma -Aldrich | I17018-1G | |
| 6 well non-tissue culture plate | Corning Falcon® Plates | 351146 | |
| 24 well non-tissue culture plate | Corning Falcon® Plates | 351147 | |
| 30 mL syringes | BD Syringe Luer Lock Cascade Health | 302832 | |
| Alcian blue stain | EK Industries | 1198 | 1% w/v, pH 1.0 |
| Advanced DMEM | Gibco | 12491-015 | |
| αMEM | Gibco | 12571-063 | |
| Antibiotic-antimycotic | Gibco | 15240-062 | |
| Biopsy punch | Integra Miltex | 12-460-407 | |
| BODIPY® fluorophore | Molecular Probes | ||
| Bone morphogenic protein 7 (BMP7) | Peprotech | ||
| Curved forceps | Fisher Brand | 16100110 | |
| DMEM | Gibco | 11995-065 | Dulbecco’s Modified Eagle Medium |
| Dexmethasome | Sigma -Aldrich | 02-05-2002 | |
| E-Shell 450 photopolymer in | EnvisionTec | RES-01-4022 | |
| Fetal Bovine Serum | Gemini-Bio Products | 900-208 | |
| GlutaMAX | Gibco | 3505-061 | |
| gelatin from bovine skin | Hyclone | 1003372809 | |
| Hank’s Balanced Salt Solution | Sigma -Aldrich | SH30588.02 | |
| indomethacin | Sigma -Aldrich | I7378-56 | |
| Insulin-Transferrin-Selenium-Ethanolamine (ITS) | Gibco | 51500-056 | |
| interleukin 1β | Peprotech | 200-01B | |
| Leur-loc connectors | Cole-Parmer Instruments | 45508-50 | |
| L-proline | Sigma -Aldrich | 115388-93-7 | |
| β-glycerophosphate | Sigma -Aldrich | 1003129352 | |
| Medium bags | KiYATEC | FC045 | |
| Methacrylic Anhydride | Sigma -Aldrich | 102378580 | |
| Phosphate buffered Saline | Corning | 21-040-CM | |
| Pointed forceps | Fisher Brand | 12000122 | |
| Silicon mold | McMaster-Carr | RC00114P | |
| Silicon o-rings | McMaster-Carr | ZMCCs1X5 | 1mm x 5mm |
| SolidWorks | Dassault Systèmes SE, Vélizy-Villacoublay, France | ||
| Surgical Blades | Integra Miltex | 4-122 | |
| Syringe pump | Lagato210P, KD Scientific | Z569631 | 10 syringe racks |
| T-182 tissue culture flasks | Fisher Brand | FB012939 | |
| Tissue Culture Dish 150 mm | Fisher Brand | FB012925 | |
| Transforming Growth Factor Beta (TGF-β3) | Peprotech | 100-36E | |
| Trypsin | Gibco | 25200-056 | |
| UV Flashlight | KBS | KB70109 | 395 nm |
| Vida Desktop 3D Printer | EnvisionTec | ||
| Vitamin D3 | Sigma -Aldrich | 32222-06-3 | 1,25-dihydroxyvitamin D3 |
Références
- Safiri, S., et al. Global, regional and national burden of osteoarthritis 1990-2017: A systematic analysis of the Global Burden of Disease Study 2017. Annals of the Rheumatic Diseases. 79 (6), 819-828 (2020).
- Lawrence, R. C., et al. Estimates of the prevalence of arthritis and other rheumatic conditions in the United States: Part II. Arthritis and Rheumatism. 58 (1), 26-35 (2008).
- Makarczyk, M. J., et al. Current models for development of disease-modifying osteoarthritis drugs. Tissue Engineering. Part C, Methods. 27 (2), 124-138 (2021).
- He, Y., et al. Pathogenesis of osteoarthritis: risk factors, regulatory pathways in chondrocytes, and experimental models. Biology. 9 (8), 194(2020).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Lin, H., Sohn, J., Shen, H., Langhans, M. T., Tuan, R. S. Bone marrow mesenchymal stem cells: aging and tissue engineering applications to enhance bone healing. Biomaterials. 203, 96-110 (2019).
- Li, Z., et al. Human mesenchymal stem cell-derived miniature joint system for disease modeling and drug testing. Advanced Science. 9 (21), 2105909(2022).
- Lin, H., Cheng, A. W., Alexander, P. G., Beck, A. M., Tuan, R. S. Cartilage tissue engineering application of injectable gelatin hydrogel with in situ visible-light-activated gelation capability in both air and aqueous solution. Tissue Engineering. Part A. 20 (17-18), 2402-2411 (2014).
- Fairbanks, B. D., Schwartz, M. P., Bowman, C. N., Anseth, K. S. Photoinitiated polymerization of PEG-diacrylate with lithium phenyl-2,4,6-trimethylbenzoylphosphinate: polymerization rate and cytocompatibility. Biomaterials. 30 (35), 6702-6707 (2009).
- Lin, H., Lozito, T. P., Alexander, P. G., Gottardi, R., Tuan, R. S. Stem cell-based microphysiological osteochondral system to model tissue response to interleukin-1β. Molecular Pharmaceutics. 11 (7), 2203-2212 (2014).
- Yin, B., et al. Hybrid macro-porous titanium ornamented by degradable 3D gel/nHA micro-scaffolds for bone tissue regeneration. International Journal of Molecular Sciences. 17 (4), 575(2016).
- Lin, Z., et al. Osteochondral tissue chip derived from iPSCs: Modeling OA pathologies and testing drugs. Frontiers in Bioengineering and Biotechnology. 7, 411(2019).
- Atukorala, I., et al. Synovitis in knee osteoarthritis: A precursor of disease. Annals of the Rheumatic Diseases. 75 (2), 390-395 (2016).
- Occhetta, P., et al. Hyperphysiological compression of articular cartilage induces an osteoarthritic phenotype in a cartilage-on-a-chip model. Nature Biomedical Engineering. 3 (7), 545-557 (2019).
- He, C., et al. Modeling early changes associated with cartilage trauma using human-cell-laden hydrogel cartilage models. Stem Cell Research and Therapy. 13 (1), 400(2022).
- Elsissy, J. G., et al. Bacterial septic arthritis of the adult native knee joint: A review. JBJS Reviews. 8 (1), 0059(2020).
- Romero-Lopez, M., et al. Macrophage effects on mesenchymal stem cell osteogenesis in a three-dimensional in vitro bone model. Tissue Engineering. Part A. 26 (19-20), 1099-1111 (2020).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon