A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
יצירת מפרק ברך על שבב למידול מחלות מפרקים ובדיקת תרופות
In This Article
Summary
אנו מספקים שיטות מפורטות ליצירת ארבעה סוגים של רקמות מתאי גזע מזנכימליים אנושיים, המשמשים לשחזור הסחוס, העצם, כרית השומן והסינוביום במפרק הברך האנושי. ארבע רקמות אלה משולבות בביוריאקטור מותאם אישית ומחוברות באמצעות מיקרופלואידיקה, ובכך יוצרות מפרק ברך על שבב.
Abstract
השכיחות הגבוהה של מחלות מפרקים מתישות כמו דלקת מפרקים ניוונית (OA) מהווה נטל סוציו-אקונומי גבוה. נכון לעכשיו, התרופות הזמינות המכוונות להפרעות מפרקים הן בעיקר פליאטיביות. הצורך הבלתי מסופק בתרופות OA יעילות משנות מחלה (DMOADs) נגרם בעיקר על ידי היעדר מודלים מתאימים לחקר מנגנוני המחלה ובדיקת DMOADs פוטנציאליים. במאמר זה נתאר את הקמתה של מערכת מיקרופיזיולוגית סינוביאלית זעירה המחקה מפרקים (miniJoint) הכוללת רכיבי רקמה שומניים, סיביים ואוסטאוכונדרליים שמקורם בתאי גזע מזנכימליים אנושיים (MSCs). כדי להשיג את המיקרו-רקמות התלת-ממדיות (3D), MSCs היו עטופים בג'לטין מתקרילט הניתן להצלבה לפני או אחרי התמיינות זו. מבני הרקמה עמוסי התאים שולבו אז בביוריאקטור שהודפס בתלת-ממד, ויצרו את המיני-ג'וינט. זרמים נפרדים של מדיה אוסטאוגנית, פיברוגנית ואדיפוגנית הוכנסו כדי לשמור על פנוטיפים של רקמות בהתאמה. זרם משותף נפוץ חודר דרך רקמות הסחוס, הסינוביאליות והשומן כדי לאפשר הצלבת רקמות. דפוס זרימה זה מאפשר השראת הפרעות באחד או יותר ממרכיבי הרקמה למחקרים מכניסטיים. יתר על כן, ניתן לבדוק DMOAD פוטנציאלי באמצעות "מתן מערכתי" דרך כל הזרמים הבינוניים או "מתן תוך מפרקי" על ידי הוספת התרופות רק לזרימה המדמה "נוזל סינוביאלי" משותף. לפיכך, המיני-ג'וינט יכול לשמש כפלטפורמה רב-תכליתית במבחנה ללימוד יעיל של מנגנוני מחלה ובדיקת תרופות ברפואה מותאמת אישית.
Introduction
מחלות מפרקים כמו דלקת מפרקים ניוונית (OA) שכיחות מאוד ומתישות ומייצגות גורם מוביל לנכות ברחבי העולם1. ההערכה היא כי בארה"ב לבדה, OA משפיע על 27 מיליון חולים ומופיע אצל 12.1% מהמבוגרים בגילאי 60 ומעלהשנתיים. למרבה הצער, רוב התרופות המשמשות כיום לניהול מחלות מפרקים הן פליאטיביות, ואין תרופות OA יעילות משנות מחלה (DMOADs) זמינות3. צורך רפואי זה נובע בעיקר מהיעדר מודל יעיל לחקר מנגנוני המחלה ופיתוח DMOADs פוטנציאליים. תרבית התאים הדו-ממדית (2D) הקונבנציונלית אינה משקפת את האופי התלת-ממדי של רקמות המפרקים, ותרבית צמחי הרקמה מעוכבת לעתים קרובות על ידי מוות תאי משמעותי ובדרך כלל אינה מצליחה לשכפל את חיבורי הרקמה הדינמיים4. בנוסף, הבדלים גנטיים ואנטומיים מפחיתים באופן משמעותי את הרלוונטיות הפיזיולוגית של מודלים של בעלי חיים4.
איברים על שבבים (OoCs), או מערכות מיקרופיזיולוגיות, הם תחום מחקר מבטיח בממשק של הנדסה, ביולוגיה ורפואה. פלטפורמות in vitro אלה הן יחידות פונקציונליות מינימליות המשכפלות תכונות בריאותיות או פתולוגיות מוגדרות של עמיתיהן in vivo 5. יתר על כן, מערכות ממוזערות אלה יכולות לארח תאים ומטריצות מגוונות ולדמות את האינטראקציות הביופיזיקליות והביוכימיות בין רקמות שונות. לכן, מערכת מיקרופיזיולוגית שיכולה לשחזר נאמנה את המפרק הסינוביאלי המקומי מבטיחה להציע פלטפורמה יעילה למידול מחלות מפרקים ופיתוח DMOADs פוטנציאליים.
תאי גזע מזנכימליים אנושיים (MSCs) יכולים להיות מבודדים מרקמות רבות בכל הגוף ולהתמיין לשושלות אוסטאוגניות, כונדרוגניות ואדיפוגניות6. MSCs שימשו בהצלחה להנדסה של רקמות שונות, כולל עצם, סחוס ורקמת שומן6, ולכן הם מייצגים מקור תאים מבטיח להנדסת רכיבי הרקמה של מפרק הברך. לאחרונה פיתחנו מערכת מיקרופיזיולוגית מיניאטורית המחקה מפרקים, בשם miniJoint, הכוללת רקמות עצם, סחוס, סיבי ושומןשמקורן ב-MSC 7. בפרט, העיצוב החדשני מאפשר הצלבת רקמות באמצעות זרימה או חלחול מיקרופלואידים (איור 1). כאן אנו מציגים את הפרוטוקולים לייצור רכיבי השבב, הנדסת רכיבי הרקמה, תרבית הרקמות המהונדסות בשבב ואיסוף הרקמות לאנליזות במורד הזרם.
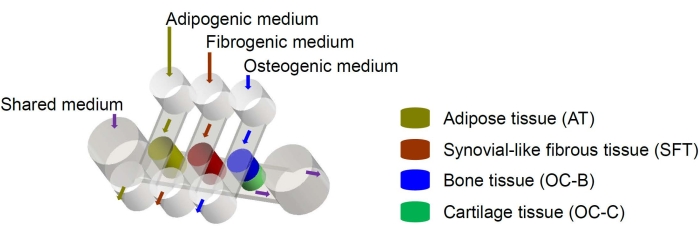
איור 1: סכמה של שבב miniJoint המראה את הסידור של רכיבי הרקמה השונים והזרימות הבינוניות. OC = רקמה אוסטאוכונדרלית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Protocol
הפרוטוקול הבא עוקב אחר ההנחיות האתיות של אוניברסיטת פיטסבורג וועדת האתיקה של המחקר האנושי של אוניברסיטת פיטסבורג. מידע על החומרים ששימשו במחקר זה מופיע בטבלת החומרים.
1. ייצור ביוריאקטורים מודפסים בתלת-ממד
- השתמשו בתוכנת מחשב כדי לתכנן ביוריאקטורים של אוסטאוכונדרלים (איור 2A) ומיני-מפרקים (איור 2B) שכוללים תאים, תוספות ומכסים. מידע הממדים עבור כל חלק מוצג באיור S1.
- העבר את העיצוב למדפסת תלת-ממד והדפס באמצעות דיו פוטופולימרי.
- שטפו את החלקים המודפסים בתלת-ממד (איור 2C-F) ב-15 מ"ל של 95% אתנול שלוש פעמים. לאחר מכן, הצליבו באופן מלא את החלקים המודפסים במשך 200 שניות במכשיר פילמור פנס.
- הוסיפו אורינגים לתוספות ולמכסים (איור 2C, D), ובדקו אם החלקים מתאימים (איור 2G, H).

איור 2: ייצור של הרכיבים השונים ליצירת המיני-ריאקטור הביולוגי. (A,B), מודלים תלת-ממדיים של ביוריאקטורים ליצירת (A) שבבי אוסטאוכונדרל ו-(B) miniJoint שבבים. (C,D) מכסים מודפסים בתלת-ממד (C) ותוספות (D) עם טבעת O מותקנת. (E,F) תאים מודפסים תלת-ממדיים עבור (E) אוסטאוכונדרלי ו-(F) תרבית רקמה מיני-מפרקית. (ז,ח) הרכבה של (G) שבבי osteochondral ו (H) miniJoint chips. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
2. הנדסת מרכיבי הרקמה
הערה: התהליכים לייצור ליתיום פניל-2,4,6-טרימתילבנזואילפוספינאט (LAP) וג'לטין מתקרילט (GelMA) מתוארים במחקרים קודמים 8,9.
- כדי ליצור GelMA, בצע את השלבים הבאים.
- מוסיפים 17 גרם של ג'לטין מסוג B ל 500 מ"ל של מים מזוקקים, ולאחר מכן מערבבים על שייקר במשך 30 דקות ב 37 ° C.
- לאחר מכן, להוסיף 13 מ"ל של אנהידריד methacrylic, להניח בחזרה על שייקר 37 °C, ולאפשר לנער לילה.
- למחרת, aliquot את GelMA לתוך שקיות דיאליזה בודדות, עם ~ 60 מ"ל בכל שקית.
- מניחים את כל שקיות הדיאליזה במים מזוקקים עם מוט ערבוב, ומאפשרים 7 ימי דיאליזה. החליפו את המים מספר פעמים ביום, והשאירו את השקיות על 4 מעלות צלזיוס למשך הלילה.
- ביום 7, להקפיא את GelMA ב -80 מעלות צלזיוס. לאחר קפוא לחלוטין, להמשיך lyophilization.
- מניחים את הג'ל בצלחת בתא ואקום של ליופיליזר, ומאפשרים ייבוש בהקפאה. יש לוודא שה-GelMA מיובש לחלוטין לפני ההסרה מהליופיליזר.
- ממיסים את הג'ל בתמיסת המלח המאוזנת של האנק (HBSS עם Ca2 + ו-Mg2+) ב-15% (w/v). כדי להבטיח שה-pH יהיה 7.4, הוסיפו NaOH בכמויות קטנות עד שה-pH יגיע ל-7.4. השלם את התמיסה עם 1x אנטיביוטיקה-antimycotic ו 0.15% (w/v) LAP בהתבסס על נפח שנרכש. אחסנו את תמיסת 15% GelMA בטמפרטורה של -20°C עד לשימוש, והגנו עליה מפני אור.
- הניחו תאי ביוריאקטור בזרימה כפולה, מכסים ותוספות בהדפסה תלת-ממדית לתוך שקיות אוטוקלאב, ו-autoclave בטמפרטורה של 121°C למשך 20 דקות עם אדים ולאחר מכן למשך 20 דקות עם חום יבש.
- בתוך ארון הבטיחות הביולוגי, השרו את תאי הביוריאקטורים, המכסים והתוספות ב-15 מ"ל של מלח סטרילי חוצץ פוספט למשך הלילה, ולאחר מכן אפשרו להם להתייבש.
- בודד MSCs שמקורם במח עצם אנושי מפסולת כירורגית ארתרופלסטית כוללת במפרקים באישור IRB (אוניברסיטת פיטסבורג ואוניברסיטת וושינגטון).
- באופן ספציפי, לשטוף את מח העצם מן העצם trabecular של צוואר הירך ואת הראש, ולהשעות אותו מחדש ב Modified Eagle's Medium של Dulbecco (DMEM).
- מסננים את המתלה דרך מסננת של 40 מיקרומטר, וצנטריפוגו את הזרימה במהירות של 300 x גרם למשך 5 דקות.
- הסר את הסופרנטנט, השהה מחדש את הכדוריות באמצעות מדיום גידול [DMEM, 10% נסיוב בקר עוברי (FBS), ו 1x אנטיביוטיקה antimycotic], ולאחר מכן לשים לתוך צלוחיות תרבית רקמה.
- שנה את מדיום התרבות כל 3 ימים עד 4 ימים. ודא כי מפגש של 70% עד 80% הושג לפני שתמשיך הלאה.
- נתקו את התאים על ידי דגירה עם טריפסין-EDTA למשך 2-3 דקות, ועברו ביחס של 1 מיליון תאים לכל צלוחיות T150.
- הרחב את התאים ל- P5. לאחר טריפסיניזציה, להשעות את התאים, לספור אותם, ולאחר מכן גלולה על ידי צנטריפוגה ב 300x גרם במשך 5 דקות.
- עם פיפטה של 1,000 μL, השהה מחדש את התאים ב 20 x 106 תאים / מ"ל בתמיסת 15% GelMA.
הערה: כבו את האור של ארון הבטיחות הביולוגי. - בעזרת כפפות סטריליות לוחצים תבנית סיליקון סטרילית ויבשה על צלחת פטרי. לאחר מכן, הכניסו תוספת אחת לכל חור של תבנית הסיליקון עם מלקחיים, כאשר צד החור של האינסרט פונה כלפי מטה.
- באמצעות פיפטה של 200 μL, הוסף את מתלה התא כדי למלא את התוספת (~ 50 μL לכל הוספה).
- השתמש בפנס UV (נורית LED באורך גל של 395 ננומטר) כדי להצליב את החלק העליון של הג'ל / הכנס למשך 1.5 דקות. לאחר מכן, להאיר את הצד השני במשך 30 שניות. Crosslinking מתרחשת כאשר photoinitiator LAP נחשף לאור UV.
הערה: תרחיף התא עשוי להישמר באינקובטור במהלך תקופה זו או להיות מוגן מפני אור. - בעזרת מלקחיים סטריליים, העבירו מיד את התוספות ל-8 מ"ל של מדיום גידול בצלחת 6 בארות ללא רקמה (DMEM בתוספת 10% [v/v] FBS ו-1x אנטיביוטיקה-אנטי-מיקוטית) כדי לאפשר לתאים להתאושש בן לילה.
- התמיינות התאים לארבע שושלות.
- כדי להנדס רקמת שומן (AT), להעביר את התוספות ל 8 מ"ל של תווך אדיפוגני (AM; אלפא-MEM, 10% FBS, 0.2 mM אינדומתצין, 1x אינסולין-טרנספרין-סלניום (ITS), 0.45 mM 3-isobutyl-1-methylxanthine, 0.1 μM dexamethasone, ו 1x אנטיביוטיקה-antimycotic) כדי ליזום התמיינות. באופן אידיאלי, ארבע תוספות ממוקמות בבאר אחת של צלחת באר לא רקמה תרבית עם 8 מ"ל של מדיום אדיפוגני. תרבית את התאים בצלחות הבאר במשך 28 ימים, עם שינויים בינוניים כל יומיים.
- כדי להנדס את היחידות האוסטאוכונדרליות (OC), מקמו את התוספות בתאי ביוריאקטור בעלי זרימה כפולה, סגרו את הבארות והזרימו את שני הזרמים בנפרד בקצב זרימה של 5 מיקרוליטר/דקה עם 35 מ"ל של תווך אוסטאוגני (OM; DMEM, 10% FBS, 1x אנטיביוטיקה-אנטי-מיקוטית, 0.1 מיקרומטר dexamethasone, 0.01 M β-glycerophosphate, 100 ng/mL חלבון מורפוגני עצם 7 (BMP7), 50 מיקרוגרם / מ"ל חומצה אסקורבית, ו 10 ננומטר ויטמין D3) ו 35 מ"ל של מדיום כונדרוגני (CM; DMEM, 1x אנטיביוטיקה-אנטי-מיקוטית, 1x ITS, 0.1 מיקרומטר dexamethasone, 40 מיקרוגרם / מ"ל פרולין, 50 מיקרוגרם / מ"ל חומצה אסקורבית, ו 10 ng / mL גורם גדילה טרנספורמציה β3)10. שמור על התמיינות תאים במשך 28 ימים על ידי ביצוע שינויים בינוניים דו-שבועיים.
- כדי להפיק את הפיברובלסטים, יש להבדיל בין MSCs בתרבית דו-ממדית במשך 21 יום בבקבוק תרביתרקמה T150 ס"מ 2 באמצעות 20 מ"ל של תווך פיברוגני (FM; DMEM מתקדם, 5% FBS, 1x GlutaMAX, 1x אנטיביוטיקה-אנטי-מיקוטית, ו-50 מיקרוגרם/מ"ל חומצה אסקורבית). שנה את המדיום כל שבוע. השתמש 4 מ"ל של טריפסין כדי לנתק את התאים, ולעטוף את הג'ל התלת-ממדי בתוך התוספות, בהתאם לפרוטוקול שתואר לעיל, כדי לקבל רקמה סיבית סינוביאלית (SFT).
הערה: ניתן למצוא את ההרכבים של כל מדיות הבידול בטבלה 1.
3. הקמת שבב miniJoint
- Autoclave תאי bioreactor miniJoint 3D, צינורות סיליקון עם קוטר פנימי 0.062 אינץ 'וקוטר חיצוני 0.125 אינץ ', ומחברי F 1/16 Luer-lock. חברו את צינור הסיליקון למוט הביוריאקטור miniJoint בקצה אחד, וחברו את מנעול Luer בקצה השני.
- הכן את AM, OM (הסרת BMP7) ו- FMCM המוזכרים בשלב 2.11. בנוסף, הכינו את המדיום המשותף המשותף (SM; DMEM ללא פנול אדום, 1x אנטיביוטיקה-אנטי-מיקוטית, 1x Na-פירובט, 1x ITS, 40 מיקרוגרם/מ"ל פרולין, 50 מיקרוגרם/מ"ל חומצה אסקורבית, ו-0.5 נ"ג/מ"ל גורם גדילה טרנספורמטיבי β3) לשימוש בתרבית המיני-ג'וינט. עומס של 35 מ"ל מכל מדיום לתוך המאגרים הבינוניים.
- השתמש במלקחיים ישרים כדי להעביר את היחידה האוסטאוכונדרלית מהביוריאקטור בעל הזרימה הכפולה לבאר הימנית של הביוריאקטור המיני-מפרק. מעבירים את החדרת רקמת השומן ואת החדרת הרקמה הסיבית לבאר השמאלית והאמצעית, בהתאמה. מכסים את כל הבארות במכסים מעוקרים.
- חברו את פתחי השבב miniJoint למאגרים הבינוניים ואת השקעים למזרקים (איור 3A-C).
- הרכיבו את המזרקים על משאבת מזרקים (איור 3C), והעבירו את המשאבה והשבבים לאינקובטור. המאגרים הבינוניים נשמרים על קרח מחוץ לאינקובטור.
- הפעל את המשאבה במצב נסיגה, תוך משיכת התווך מהמאגר הבינוני לתוך תא הביוריאקטור miniJoint . תהליך תרבית מיני ג'וינט זה נמשך 28 ימים.
- כדי למדל דלקת מפרקים וניוון סחוס, יש להוסיף אינטרלוקין 1β (IL-1β) לזרם התווך הפיברוגני ב-10 ננוגרם/מ"ל. החלף את המזרקים ביום השלישי של הטיפול IL-1β, וספק IL-1β טרי למדיום הפיברוגני . הטיפול נמשך 7 ימים.
- במהלך שלב בדיקת התרופה, לאחר 3 ימים של טיפול IL-1β, יש לתת את התרופה בתווך המשותף, המדמה "מתן תוך מפרקי" (איור 3D) כאשר התרופה נמצאת בשימוש מקומי במפרק הברך, או בכל סוגי הברך, המדמה "מתן מערכתי" (איור 3E) כאשר התרופה פועלת על מפרק הברך דרך מחזור הדם.
- לאסוף רקמות בודדות לניתוח לאחר 7 ימים של טיפול IL-1β אם הדגימות עברו טיפול תרופתי במשך 4 הימים הקודמים או לא.
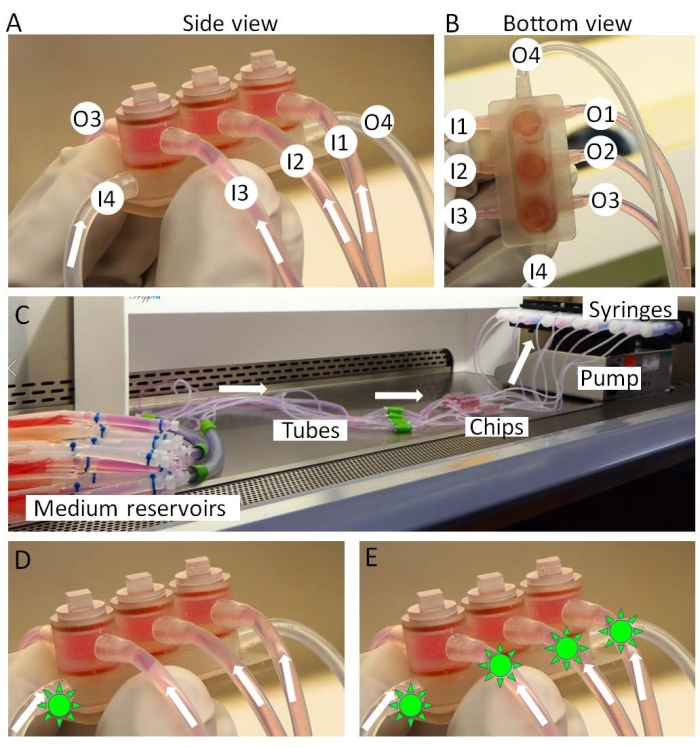
איור 3: הרכבה של המיני-ג'וינט. (A,B) מדיה ספציפית לרקמות מוחדרת מכניסות 1-3 (I1-3) ומועברת החוצה משקעים 1-3 (O1-3). המדיום המשותף מחורר מ-I4 ל-O4. (ג) המערך המלא של תרבות המיני-ג'וינט. תרופות (צורות כמו שמש ירוקה) יכולות להיות מוחדרות לתוך (D) המדיום המשותף בלבד או (E) כל המדיומים כדי לדמות בהתאמה "מתן תוך מפרקי" או "מתן מערכתי". אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
4. איסוף רקמות בודד
- השתמש במלקחיים מעוקלים סטריליים כדי להסיר את התוספות.
- דחפו ניקוב ביופסיה דרך מרכז האינסרט כדי להסיר את הג'ל, והניחו את הג'ל ב-PBS.
- לחתוך את הג'ל osteochondral לשניים בעת הערכת ביטוי הגן.
הערה: מאחר שהג'ל האוסטאוכונדרלי מורכב משני סוגי רקמות, חשוב להפריד בין התאים האוסטאוגניים והכונדרוגנים. - לאסוף את המדיה המותנית ואת הרקמות עבור ניסויים שונים.
- יש לאסוף כ-1.5 מ"ל מכל מקור בינוני.
- הקפיאו במהירות הבזק את המדיה המותנית בחנקן נוזלי לאחר צנטריפוגה של 14,000 x גרם למשך 10 דקות והשליכו את המשקעים.
- עבור צביעה היסטולוגית ו immunostaining, תחילה לתקן את דגימות OC ו SFT ב 10% פורמלין חוצץ, לייבש אותם אתנול של ריכוזים עולים, לנקות אותם xylene, להטביע אותם פרפין, ולבסוף לחתוך אותם בעובי של 6 מיקרומטר.
- עבור מיקרו-רקמות AT, תקן את הדגימות ב-10% פורמלין חוצץ, והכתים אותן ישירות בתמיסת שמן אדום O או BODIPY.
תוצאות
כל הרקמות של המיני-ג'וינט נאספו כדי לנתח את הפנוטיפים שלהן לאחר 28 ימי תרבית במיני-ג'וינט (איור 4A). כך פורט בפרסום הקודם שלנו7.
באמצעות שימוש ב-RT-qPCR, צביעה חיסונית וצביעה היסטולוגית, אושר שהפנוטיפים הספציפיים לרקמות נשמרו היטב עבור המיקרו-רקמות הבו?...
Discussion
במאמר זה אנו מציגים פרוטוקול ליצירת מערכת מפרק על שבב של מפרק הברך, שבה עצמות, סחוס, רקמת שומן ורקמות דמויות סינוביום נוצרים מתאי MSC ומתורבתים יחד בתוך ביוריאקטור מותאם אישית. מערכת מרובת רכיבים זו, שמקורה בתאים אנושיים עם תכונות plug-and-play מייצגת כלי חדש לחקר הפתוגנזה של מחלות מפרקים ופיתוח ת...
Disclosures
המחברים מצהירים כי אין אינטרסים מתחרים.
Acknowledgements
מחקר זה נתמך בעיקר על ידי מימון מהמכונים הלאומיים לבריאות (UG3/UH3TR002136, UG3/UH3TR003090). בנוסף, אנו מודים לד"ר פול מנר (אוניברסיטת וושינגטון) על מתן דגימות הרקמה האנושית ולד"ר ג'יאן טאן על עזרתם בבידוד MSCs ויצירת מאגר התאים.
Materials
| Name | Company | Catalog Number | Comments |
| 3-isobutyl-1-methylxanthine | Sigma -Aldrich | I17018-1G | |
| 6 well non-tissue culture plate | Corning Falcon® Plates | 351146 | |
| 24 well non-tissue culture plate | Corning Falcon® Plates | 351147 | |
| 30 mL syringes | BD Syringe Luer Lock Cascade Health | 302832 | |
| Alcian blue stain | EK Industries | 1198 | 1% w/v, pH 1.0 |
| Advanced DMEM | Gibco | 12491-015 | |
| αMEM | Gibco | 12571-063 | |
| Antibiotic-antimycotic | Gibco | 15240-062 | |
| Biopsy punch | Integra Miltex | 12-460-407 | |
| BODIPY® fluorophore | Molecular Probes | ||
| Bone morphogenic protein 7 (BMP7) | Peprotech | ||
| Curved forceps | Fisher Brand | 16100110 | |
| DMEM | Gibco | 11995-065 | Dulbecco’s Modified Eagle Medium |
| Dexmethasome | Sigma -Aldrich | 02-05-2002 | |
| E-Shell 450 photopolymer in | EnvisionTec | RES-01-4022 | |
| Fetal Bovine Serum | Gemini-Bio Products | 900-208 | |
| GlutaMAX | Gibco | 3505-061 | |
| gelatin from bovine skin | Hyclone | 1003372809 | |
| Hank’s Balanced Salt Solution | Sigma -Aldrich | SH30588.02 | |
| indomethacin | Sigma -Aldrich | I7378-56 | |
| Insulin-Transferrin-Selenium-Ethanolamine (ITS) | Gibco | 51500-056 | |
| interleukin 1β | Peprotech | 200-01B | |
| Leur-loc connectors | Cole-Parmer Instruments | 45508-50 | |
| L-proline | Sigma -Aldrich | 115388-93-7 | |
| β-glycerophosphate | Sigma -Aldrich | 1003129352 | |
| Medium bags | KiYATEC | FC045 | |
| Methacrylic Anhydride | Sigma -Aldrich | 102378580 | |
| Phosphate buffered Saline | Corning | 21-040-CM | |
| Pointed forceps | Fisher Brand | 12000122 | |
| Silicon mold | McMaster-Carr | RC00114P | |
| Silicon o-rings | McMaster-Carr | ZMCCs1X5 | 1mm x 5mm |
| SolidWorks | Dassault Systèmes SE, Vélizy-Villacoublay, France | ||
| Surgical Blades | Integra Miltex | 4-122 | |
| Syringe pump | Lagato210P, KD Scientific | Z569631 | 10 syringe racks |
| T-182 tissue culture flasks | Fisher Brand | FB012939 | |
| Tissue Culture Dish 150 mm | Fisher Brand | FB012925 | |
| Transforming Growth Factor Beta (TGF-β3) | Peprotech | 100-36E | |
| Trypsin | Gibco | 25200-056 | |
| UV Flashlight | KBS | KB70109 | 395 nm |
| Vida Desktop 3D Printer | EnvisionTec | ||
| Vitamin D3 | Sigma -Aldrich | 32222-06-3 | 1,25-dihydroxyvitamin D3 |
References
- Safiri, S., et al. Global, regional and national burden of osteoarthritis 1990-2017: A systematic analysis of the Global Burden of Disease Study 2017. Annals of the Rheumatic Diseases. 79 (6), 819-828 (2020).
- Lawrence, R. C., et al. Estimates of the prevalence of arthritis and other rheumatic conditions in the United States: Part II. Arthritis and Rheumatism. 58 (1), 26-35 (2008).
- Makarczyk, M. J., et al. Current models for development of disease-modifying osteoarthritis drugs. Tissue Engineering. Part C, Methods. 27 (2), 124-138 (2021).
- He, Y., et al. Pathogenesis of osteoarthritis: risk factors, regulatory pathways in chondrocytes, and experimental models. Biology. 9 (8), 194 (2020).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Lin, H., Sohn, J., Shen, H., Langhans, M. T., Tuan, R. S. Bone marrow mesenchymal stem cells: aging and tissue engineering applications to enhance bone healing. Biomaterials. 203, 96-110 (2019).
- Li, Z., et al. Human mesenchymal stem cell-derived miniature joint system for disease modeling and drug testing. Advanced Science. 9 (21), 2105909 (2022).
- Lin, H., Cheng, A. W., Alexander, P. G., Beck, A. M., Tuan, R. S. Cartilage tissue engineering application of injectable gelatin hydrogel with in situ visible-light-activated gelation capability in both air and aqueous solution. Tissue Engineering. Part A. 20 (17-18), 2402-2411 (2014).
- Fairbanks, B. D., Schwartz, M. P., Bowman, C. N., Anseth, K. S. Photoinitiated polymerization of PEG-diacrylate with lithium phenyl-2,4,6-trimethylbenzoylphosphinate: polymerization rate and cytocompatibility. Biomaterials. 30 (35), 6702-6707 (2009).
- Lin, H., Lozito, T. P., Alexander, P. G., Gottardi, R., Tuan, R. S. Stem cell-based microphysiological osteochondral system to model tissue response to interleukin-1β. Molecular Pharmaceutics. 11 (7), 2203-2212 (2014).
- Yin, B., et al. Hybrid macro-porous titanium ornamented by degradable 3D gel/nHA micro-scaffolds for bone tissue regeneration. International Journal of Molecular Sciences. 17 (4), 575 (2016).
- Lin, Z., et al. Osteochondral tissue chip derived from iPSCs: Modeling OA pathologies and testing drugs. Frontiers in Bioengineering and Biotechnology. 7, 411 (2019).
- Atukorala, I., et al. Synovitis in knee osteoarthritis: A precursor of disease. Annals of the Rheumatic Diseases. 75 (2), 390-395 (2016).
- Occhetta, P., et al. Hyperphysiological compression of articular cartilage induces an osteoarthritic phenotype in a cartilage-on-a-chip model. Nature Biomedical Engineering. 3 (7), 545-557 (2019).
- He, C., et al. Modeling early changes associated with cartilage trauma using human-cell-laden hydrogel cartilage models. Stem Cell Research and Therapy. 13 (1), 400 (2022).
- Elsissy, J. G., et al. Bacterial septic arthritis of the adult native knee joint: A review. JBJS Reviews. 8 (1), 0059 (2020).
- Romero-Lopez, M., et al. Macrophage effects on mesenchymal stem cell osteogenesis in a three-dimensional in vitro bone model. Tissue Engineering. Part A. 26 (19-20), 1099-1111 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved