A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تقييم النقل الخلوي المعوي لعزل تجرثم الدم الإشريكية القولونية الوليدي
In This Article
Summary
تسبب الإشريكية القولونية الإنتان لدى حديثي الولادة الذين يتناولون البكتيريا في وقت قريب من الولادة. العملية التي تنطوي عليها قدرة الإشريكية القولونية على الانتقال من القناة المعوية إلى مجرى الدم غير مفهومة بشكل جيد. يقيم هذا النموذج في المختبر قدرة سلالات الإشريكية القولونية على السفر عبر الخلايا الظهارية المعوية.
Abstract
يبتلع الأطفال حديثو الولادة سلالات الإشريكية القولونية الأمومية التي تستعمر الأمعاء في وقت الولادة تقريبا. تغزو سلالات الإشريكية القولونية ذات القدرة على الانتقال عبر القناة الهضمية مجرى دم المولود الجديد ، مسببة تجرثم الدم الذي يهدد الحياة. تستخدم المنهجية المقدمة هنا الخلايا الظهارية المعوية المستقطبة التي تزرع على إدخالات شبه منفذة لتقييم انتقال الخلايا من عزلات تجرثم الدم الإشريكية القولونية الوليدية في المختبر. تستخدم هذه الطريقة خط الخلايا المعوية T84 الثابت الذي لديه القدرة على النمو حتى التقاء وتشكيل تقاطعات ضيقة و desmosomes. بعد الوصول إلى نقطة التقاء ، تطور الطبقات أحادية T84 الناضجة مقاومة عبر الظهارة (TEER) ، والتي يمكن قياسها باستخدام الفولتميتر. ترتبط قيم TEER عكسيا بنفاذية الخلايا للمكونات خارج الخلية ، بما في ذلك البكتيريا ، عبر الطبقة الأحادية المعوية. من ناحية أخرى ، فإن مرور البكتيريا عبر الخلايا (transcytosis) ، لا يغير بالضرورة قياسات TEER. في هذا النموذج ، يتم تحديد الممر البكتيري عبر الطبقة الأحادية المعوية لمدة تصل إلى 6 ساعات بعد الإصابة ، ويتم إجراء قياسات متكررة ل TEER لمراقبة نفاذية الخلايا شبه الخلوية. بالإضافة إلى ذلك ، تسهل هذه الطريقة استخدام تقنيات مثل التلوين المناعي لدراسة التغيرات الهيكلية في الوصلات الضيقة وغيرها من بروتينات الالتصاق من خلية إلى أخرى أثناء النقل الخلوي البكتيري عبر الظهارة المستقطبة. يساهم استخدام هذا النموذج في توصيف الآليات التي يتم من خلالها نقل الخلايا القولونية الوليدية عبر ظهارة الأمعاء لإنتاج تجرثم الدم.
Introduction
الإشريكية القولونية هي السبب الأكثر شيوعا للإنتان المبكر عند الأطفال حديثي الولادة1،2،3. يمكن أن يصل معدل وفيات تجرثم الدم الإشريكية القولونية الوليدي إلى 40٪ ، والتهاب السحايا هو أحد المضاعفات المحتملة المرتبطة بإعاقات النمو العصبي الشديدة2. يمكن أن يؤدي ابتلاع سلالات الإشريكية القولونية الأمومية من قبل حديثي الولادة إلى تجرثم الدم الوليدي. تم تكرار هذه العملية في النماذج الحيوانية 2,4. بمجرد تناولها ، تنتقل البكتيريا المسببة للأمراض من تجويف الأمعاء الوليدي عبر الحاجز المعوي وتدخل مجرى الدم ، مسببة تسمم الدم. تختلف سلالات الإشريكية القولونية الغازية الوليدية التي تنتج تجرثم الدم في قدرتها على غزو الخلايا الظهارية المعوية 1,5. ومع ذلك ، فإن قدرتها على نقل الخلايا ظهارة الأمعاء بعد الغزو لم يتم توصيفها بالكامل.
يعد نموذج نقل الخلايا المعوية هذا طريقة مفيدة في المختبر لمحاكاة الممر البكتيري عبر ظهارة الأمعاء. الهدف العام من الطرق المقدمة في هذه المخطوطة هو مقارنة قدرة عزلات الإشريكية القولونية الوليدية على نقل الخلايا في ظهارة الأمعاء. يستخدم النموذج الموصوف هنا خلايا T84 ، وهي خلايا غدية معوية بشرية خلدة 6,7. تزرع خلايا T84 لتلتقي على غشاء شبه نافذ مع مقصورتين منفصلتين. الأساس المنطقي لاستخدام هذه التقنية هو أنه ، كما يحدث في الجسم الحي ، تستقطب هذه الخلايا المعوية وتطور تقاطعات ضيقة ناضجة 6,8. يصبح الجانب الملامس للغشاء هو الجانب القاعدي. يصبح الجانب الآخر من الخلايا هو الجانب القمي ، الذي يشبه تجويف الأمعاء حيث تلتصق مسببات الأمراض المبتلعة وتغزو. غشاء transwell قابل للنفاذ للبكتيريا ، لكن الخلايا المعوية المستقطبة تشكل تقاطعات ضيقة ، مما يضعف الحركة البكتيرية شبه الخلوية9. وبالتالي ، توفر هذه الطريقة ميزة البيئة المختبرية الخاضعة للرقابة باستخدام خط خلية بشرية لدراسة عملية نقل الخلايا البكتيرية ، بما في ذلك الطريق عبر الخلايا. في حين توجد طرق أخرى للتحقيق في انتقال الخلايا للبكتيريا عبر ظهارة الأمعاء ، فإن طريقة transwell المعروضة هنا توفر سهولة أكبر وإمكانية الوصول. تتوفر تقنيات بديلة ، مثل تلك التي تستخدم عينات خارج الجسم الحي تم إعدادها في أنظمة غرفة Using. ومع ذلك ، فإنهم يستخدمون عينات الأنسجة التي قد لا يمكن الوصول إليها بسهولة ، خاصة إذا كان البحث يهدف إلى دراسة علم وظائف الأعضاء البشرية10. تمثل الكائنات العضوية المعوية مثالا آخر على بديل في المختبر لدراسة تفاعلات البكتيريا المضيفة11. بينما يمكن أيضا استخدام أحاديات الطبقات العضوية في نظام transwell لدراسة النقل الخلوي البكتيري ، فإنها تتطلب عزل ونمو الخلايا الجذعية واستخدام عوامل نمو محددة للحث على التمايز12. وبالتالي ، فإن استخدامها يستغرق وقتا أطول ويرتبط بتكاليف أكبر مقارنة بطريقة transwell الموضحة في هذه المخطوطة.
تم إجراء تقييم الممر البكتيري عبر ظهارة الأمعاء باستخدام نظام transwell في المختبر بنجاح لمختلف مسببات الأمراض. وقد أظهرت هذه الدراسات فائدة نظام transwell باستخدام خلايا T84 لتوصيف نقل الخلايا من البكتيريا عبر ظهارة الأمعاء المستقطبة13،14،15. ومع ذلك ، لم يتم وصف تطبيق طريقة transwell هذه لمقارنة قدرة نقل الخلايا لسلالات E. coli الوليدية المنتجة لتجرثم الدم بالتفصيل. توفر هذه المخطوطة للباحثين الآخرين بروتوكولا قياسيا للترانسويل موثوقا به وسهل الاستخدام ولا يتطلب موارد باهظة الثمن.
لمقارنة قدرة سلالات الإشريكية القولونية الغازية لحديثي الولادة على نقل الخلايا في ظهارة الأمعاء ، يمكن أن يصاب الجانب القمي من الطبقة الأحادية الظهارية المعوية بعدد معروف من الخلايا البكتيرية. بعد الحضانة ، يمكن جمع الوسط الموجود على الجانب القاعدي من الظهارة وتحديد كمية البكتيريا لتحديد كمية النقل الخلوي البكتيري بمرور الوقت. في هذه المخطوطة ، يتم استخدام الطرق المقدمة لدراسة قدرة نقل الخلايا للسلالات السريرية الوليدية E. coli المستعادة من الأطفال حديثي الولادة الذين تم إدخالهم إلى المستشفى بسبب تجرثم الدم. تم نشر معايير الإدراج لاختيار هذه العزلات السريرية لحديثي الولادة لدراسات نقل الخلايا سابقا1،2،16. عندما يتم تنفيذ هذه الطريقة باستخدام سلالات مختلفة من الإشريكية القولونية ، يمكن مقارنة قدراتها على نقل الخلايا. من خلال هذه العملية ، يوفر نموذج نقل الخلايا المعوية بيانات قيمة لتوصيف عوامل ضراوة الإشريكية القولونية التي تساهم في العملية متعددة الخطوات التي تتوج بتطور تجرثم الدم الوليدي.
Protocol
ملاحظة: قم بإجراء جميع عمليات التلاعب بخلايا T84 والبكتيريا والألواح والكواشف في خزانة أمان من المستوى 2 للسلامة الحيوية (BSL-2) لتجنب التلوث. استخدم مناطق وحاضنات منفصلة لجميع الأعمال التي تنطوي على خلايا T84 المعقمة وخلايا T84 المصابة والإشريكية القولونية. تم الحصول على عزلات الإشريكية القولونية السريرية التي تم اختبارها بالطرق الموضحة هنا باتباع إرشادات مجلس المراجعة المؤسسية في مؤسستنا1،16.
1. إعداد إدراج transcytosis مع خلايا T84 (حوالي 1-2 أسابيع قبل التجربة)
- تنمو خلايا T84 من مجموعة الثقافة الأمريكية (ATCC) في وسط زراعة الأنسجة (TCM + المضادات الحيوية) التي تتكون من وسط النسر المعدل من Dulbecco: خليط المغذيات F-12 من لحم الخنزير (1: 1 ، التركيز النهائي: 50٪ لكل منهما) ، 5٪ مصل بقري جنيني ، و 1٪ (100 وحدة / مل) خليط مضاد حيوي مزدوج من البنسلين / الستربتومايسين. احتضان الخلايا عند 37 درجة مئوية مع 5٪ CO2.
ملاحظة: يتم استخدام شكل مختلف من هذه التركيبة المتوسطة بدون البنسلين / الستربتومايسين (TCM بدون مضادات حيوية) للخطوات اللاحقة (القسم 2 وما بعده) في الإجراء. تأكد من استخدام الصيغة الصحيحة لكل خطوة. - من خلال العمل داخل خزانة السلامة الحيوية (BSC) ، قم بزرع خلايا T84 في إدخالات ترانسويل لثقافة غشاء البولي إيثيلين تيريفثاليت مع مسام 3 ميكرومتر مصنوعة لألواح 24 بئرا. قم بتضمين نسخ متماثلة لإدراج transwell لكل حالة تجريبية مرغوبة بالإضافة إلى عناصر تحكم غير مصابة لمراقبة التلوث المحتمل.
- في لوحة مكونة من 24 بئرا مصممة لحمل إدخالات transwell ، املأ العدد المطلوب من آبار التجميع ب 1 مل من TCM + المضادات الحيوية.
- في كل بئر ، ضع ملحقا واحدا للترانسويل.
- بذرة هذه الإدخالات مع 1 × 105 T84 الخلايا المعلقة في 500 ميكرولتر من TCM + المضادات الحيوية. حدد عدد الخلايا باستخدام مقياس الدم مع صبغة زرقاء تريبان أو عداد خلايا آلي17.
- احتضان لوحات transwell التي تحتوي على إدراج البذور في نفس الظروف التي نمت فيها الخلايا.
- تحقق باستخدام المجهر الضوئي من أن الطبقات الأحادية قد بدأت في أن تصبح متقاربة بعد بذر الإدراج ، بعد حوالي 48 ساعة من البذر.
- كل 2 أيام بعد البذر ، قم بقياس وتسجيل المقاومة الكهربائية عبر الظهارة (TEER) باستخدام مقياس فولت / أوم ظهاري (EVOM) لتقييم نضج الطبقة الأحادية. بمجرد أن تصل الإدخالات إلى TEER لا يقل عن 1000 Ω سم2 ، فإنها تعتبر جاهزة للفحص18.
ملاحظة: تستغرق الإدخالات عادة من 7 إلى 10 أيام للوصول إلى هذا TEER بعد البذر. ستظهر خلايا T84 التقاء بنسبة 100٪ تحت المجهر الضوئي بمجرد الوصول إلى هذه المقاومة.- قم بتخزين مسبار EVOM مع الأقطاب الكهربائية المغمورة في 0.15 M KCl عندما لا تكون قيد الاستخدام.
- قبل قياس TEER ، قم بتطهير مسبار القطب عن طريق غمره في 5 مل من الإيثانول بنسبة 70٪ في أنبوب مخروطي سعة 50 مل لمدة 10-15 دقيقة. قم بإزالة المسبار ، وتخلص من الإيثانول الزائد ، واتركه يجف في الهواء داخل BSC لمدة 10 دقائق. احتفظ بأنبوب الإيثانول.
- اختبر EVOM والمسبار عن طريق وضع المسبار الجاف المطهر في بئر معقم يحتوي على 1 مل من TCM + المضادات الحيوية مع ملحق معقم بداخله يحتوي على 500 ميكرولتر من TCM + المضادات الحيوية. تأكد من أن قراءة EVOM هي <200 Ω. سجل هذه القيمة الفارغة لاستخدامها في حسابات المقاومة اللاحقة الموضحة في الخطوة 1.3.6.
- إزالة التحقيق من أنبوب TCM + المضادات الحيوية. احتفظ بهذا الأنبوب لتخزين المسبار طوال التجربة.
- اخفض المسبار برفق في الإدخال الأول باستخدام القطب الطويل في بئر التجميع والقطب القصير داخل الإدخال. اسمح للقطب الطويل بلمس قاع بئر التجميع ، لكن لا تضغط لأسفل لأن هذا قد يعطل الطبقة الأحادية الظهارية.
- كرر هذه العملية لقياس وتسجيل المقاومة بالأوم (Ω) لكل إدخال. عند الانتهاء ، قم بتطهير المسبار في الإيثانول عن طريق غمره لمدة 10-15 دقيقة أخرى. بعد ذلك ، انقل المسبار الذي تم تطهيره مرة أخرى إلى محلول KCl للتخزين. اطرح المقاومة الفارغة التي تم الحصول عليها في الخطوة 1.3.3 من كل قيمة تم الحصول عليها من كل إدراج يحتوي على خلايا T84. اضرب المقاومة الناتجة (Ω) لكل ملحق في مساحة الجزء السفلي من كل ملحق (سم 2) للحصول على قياس TEER النهائي (Ω سم2).
- بمجرد وصول TEER إلى 1000 Ω سم2 على الأقل ، تكون الطبقة الأحادية الظهارية ناضجة وجاهزة لفحوصات العدوى.
- مع نضوج TEER ، قم بتزويد الخلايا بوسط جديد كل 1-2 أيام.
- في لوحة جديدة مكونة من 24 بئرا ، أضف 1 مل من TCM + المضادات الحيوية إلى بئر واحد لكل ملحق مصنف يتم تحضيره.
- باستخدام ملقط معقم ، انقل الإدخالات بعناية إلى الآبار التي تم تجديدها حديثا.
- استبدل الوسائط في الإدخالات.
- قم بإزالة الوسائط القديمة من الحشوات عن طريق إمالة اللوحة واستخدام شفاط فراغ داخلي لإزالة الوسائط برفق باستخدام طرف ماصة على طول جانب الملحق. يسمح الشافطة بتنظيم الشفط منخفض المستوى لمنع تعطيل الخلايا. لا تسمح لطرف الماصة بلمس الجزء السفلي من الملحق ، لأن هذا سيعطل الطبقة الأحادية الظهارية النامية.
- أضف 500 ميكرولتر من TCM + المضادات الحيوية إلى الإدراجات. تصور الطبقة الأحادية باستخدام المجهر الضوئي للتحقق من بقائها سليمة.
- كل 1-2 يوم، قم بقياس TEER عبر كل إدراج كما هو موضح أعلاه في الخطوات 1.3.2-1.3.6.
2. تحضير خلايا T84 قبل يوم واحد من التجربة باستخدام الطب الصيني التقليدي بدون مضادات حيوية
- قم بقياس وتسجيل TEER في اليوم السابق للتجربة.
- استبدل الطب الصيني التقليدي بنفس الطريقة كما هو الحال أثناء إعداد الخلية السابقة وصيانتها. ومع ذلك ، يتم استخدام الطب الصيني التقليدي بدون مضادات حيوية بدلا من ذلك استعدادا للعدوى (1 مل في بئر اللوحة و 500 ميكرولتر في الملحق).
3. ثقافات الإشريكية القولونية (بدأت قبل يوم واحد من التجربة)
تنبيه: استخدم احتياطات السلامة البيولوجية من المستوى 2 (BSL-2) عند العمل مع سلالات الإشريكية القولونية السريرية المسببة للأمراض.
- خذ أنبوبا مخروطيا مكتوبا عليه 15 مل مع 5 مل من مرق الليزوجيني المعقم (LB) ، واستخدم حلقة معقمة لتلقيح المرق بمستعمرة واحدة من سلالة بكتيرية واحدة (E. coli). كرر هذه العملية ، وقم بإنشاء أنبوب مزرعة ليلي واحد لكل سلالة ليتم اختبارها.
- احتضان الثقافة الليلية ، مع تخفيف أغطية الأنابيب ، في شاكر حاضنة (250 دورة في الدقيقة ، 37 درجة مئوية).
4. تحضير لقاح الإشريكية القولونية والخلايا الظهارية والمواد (في صباح التجربة)
ملاحظة: استخدم الطب الصيني التقليدي بدون مضادات حيوية دافئة حتى 37 درجة مئوية من هذه النقطة فصاعدا.
- أضف 250 ميكرولتر من كل مزرعة رطل بين عشية وضحاها إلى 25 مل من الطب الصيني التقليدي بدون مضادات حيوية في أنبوب مخروطي سعة 50 مل (واحد لكل سلالة فردية). حافظ على أغطية الأنابيب مرفوخة. ضع أنابيب الاستزراع الجديدة هذه في شاكر في نفس الإعدادات (250 دورة في الدقيقة ، 37 درجة مئوية) لمدة 2 ساعة بالضبط. قم بتنفيذ الخطوات الفرعية المتبقية أثناء الانتظار.
- قم بقياس TEER عبر كل إدراج، كما هو موضح في الخطوات 1.3.2-1.3.6. سجل هذه على أنها TEERs في الوقت (t) = 0 h.
- انقل الإدخالات إلى الآبار في لوحة جديدة ، وقم بتغيير الوسائط باستخدام التقنية الموضحة في الخطوة 1.4.3. ومع ذلك ، هذه المرة ، املأ آبار التجميع الجديدة ب 500 ميكرولتر من الطب الصيني التقليدي بدون مضادات حيوية ، واملأ الإدخالات ب 400 ميكرولتر من الطب الصيني التقليدي بدون مضادات حيوية. الحفاظ على إدراج داخل حاضنة زراعة الأنسجة حتى وقت الإصابة.
- ضع عددا كافيا من ألواح أجار LB المربعة للتدفئة إلى درجة حرارة الغرفة (RT) للطلاء لاحقا والقياس الكمي للبكتيريا.
5. تلقيح الخلايا (بداية التجربة)
- بعد 2 ساعة بالضبط ، قم بإزالة المزارع البكتيرية الصباحية من شاكر ، وطرد مركزي لمدة 10 دقائق (1900 × جم ، 4 درجات مئوية).
ملاحظة: لجميع الخطوات التالية ، احتفظ بجميع المعلقات البكتيرية على الجليد لتقليل النمو. - أعد تعليق حبيبات البكتيريا في الطب الصيني التقليدي بدون مضادات حيوية. استخدم مقياس الطيف الضوئي لضبط الكثافة البصرية (OD) إلى 0.7-0.9 ، وقم بتخفيفه باستخدام TCM بدون مضادات حيوية إلى تركيز 1 × 106 وحدات تشكيل مستعمرة (CFU) / مل (حوالي 1: 100 تخفيف). استخدم هذا المعلق البكتيري لإصابة كل ملحق ب 1 × 105 CFU لكل حجم 100 ميكرولتر.
- قم بتسمية لوحة transwell ، وقم بإصابة كل ملحق ب 100 ميكرولتر من اللقاح المعدل OD (إجمالي 1 × 105 CFU لكل إدخال). وقد بدأ الفحص الآن. لاحظ الوقت ، وقم بتسجيله ك t = 0 h.
- قم بلوحة التعليق البكتيري للقاحي لتحديد كمية CFU / mL باستخدام طريقة تخفيف الجنزير ، وطلاء 10 ميكرولتر على ألواح أجار LB مربعة19.
6. تحديد كمية نقل الخلايا
- كل 30 دقيقة بعد التلقيح ، املأ آبارا جديدة ب 500 ميكرولتر من الطب الصيني التقليدي بدون مضادات حيوية. نقل الحشوات إلى هذه الآبار الجديدة باستخدام مجموعة مختلفة من الملقط المعقم لكل سلالة بكتيرية مختلفة.
- اجمع الوسائط من بئر التجميع المستخدم لكل ملحق في أنابيب منفصلة ملصقة. ضع هذه الأنابيب على الثلج. أعد لوحات transwell إلى الحاضنة بين النقاط الزمنية.
- لكل إدراج ، اجمع الوسائط المجمعة من t = 0.5 h و t = 1 h و t = 1.5 h و t = 2 h و vortex لفترة وجيزة. قم بلوحة الوسائط التي تم جمعها على ألواح أجار LB باستخدام طريقة تخفيف المسار لتحديد كمية البكتيريا المنقولة في أول 2 ساعة من التجربة.
ملاحظة: يضمن استرجاع البكتيريا كل 30 دقيقة وإبقائها على الجليد تقليل نمو البكتيريا في آبار التجميع إلى الحد الأدنى وإجراء القياسات على البكتيريا المنقولة في الغالب. - ضع ألواح أجار LB لتخفيف الجنزير المسمى في الحاضنة البكتيرية عند 37 درجة مئوية بدون ثاني أكسيد الكربونالإضافي 2 ، وأعد لوحة T84 transwell إلى حاضنة زراعة الأنسجة.
- عند t = 4 h ، كرر الخطوة 6.3 عن طريق الجمع بين الوسائط المجمعة من t = 2.5 h و t = 3 h و t = 3.5 h و t = 4 h.
- عند t = 6 h ، كرر الخطوة 6.3 عن طريق الجمع بين الوسائط المجمعة من t = 4.5 h و t = 5 h و t = 5.5 h و t = 6 h. بالإضافة إلى ذلك ، عند t = 6 h ، قم بلوحة الوسائط من آبار التحكم.
7. نهاية التجربة
- قياس وتسجيل TEER في نهاية التجربة ، ر = 6 ساعات. استخدم الإجراء الموضح في الخطوات 1.3.2-1.3.6.
- قم بتطهير المسبار عن طريق غمره في 70٪ من الإيثانول لمدة 10-15 دقيقة. تخلص من الحشوات ، أو احفظها / قم بمعالجتها لتطبيقات إضافية ، إذا رغبت في ذلك. اسمح لألواح أجار LB بالحضانة طوال الليل ، وتطهير و / أو التخلص بأمان من جميع المواد المستخدمة الأخرى.
- بعد الحضانة بين عشية وضحاها ، عد المستعمرات البكتيرية يدويا على لوحات LB لتخفيف المسار لتحديد كمية اللقاح وكمية E. coli transcytosis. تأكد من أن لوحات التحكم لا تظهر أي نمو بكتيري.
النتائج
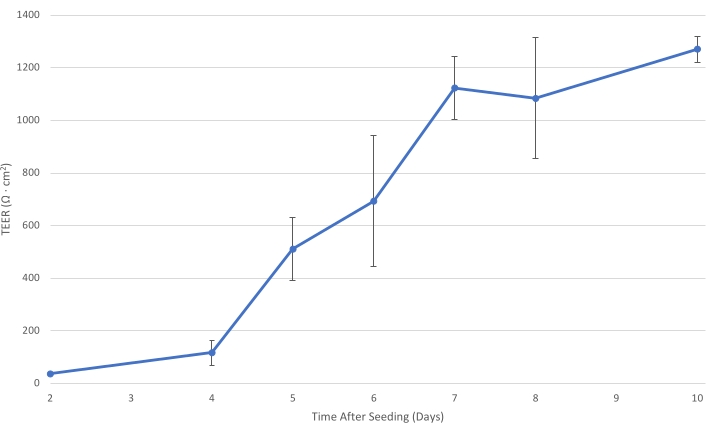
الشكل 1: T84 TEER بمرور الوقت. مع نضوج طبقة الخلية T84 على الإدخال ، تزداد المقاومة الكهربائية للطبقة الأحادية. عند TEER لا يقل عن 1000 Ω سم2 ، يتم تطوير طبقة الخلية بشكل كاف لتقليل النقل البكتيري شبه...
Discussion
هذه الطريقة مشتقة من التقنيات المستخدمة في أمراض الجهاز الهضمي والأمراض المعدية20. تم استخدام نماذج في المختبر للحاجز الظهاري المعوي لتوضيح الآليات التي تتفاعل بها المحتويات اللمعية مع هذا المكون ذي الصلة من المناعة الفطرية 6,8. كما تم تمي?...
Disclosures
اي.
Acknowledgements
تم دعم هذا العمل من خلال منحة سارة موريسون الطلابية الصادرة عن كلية الطب بجامعة ميسوري-كانساس سيتي إلى الذكاء الاصطناعي.
Materials
| Name | Company | Catalog Number | Comments |
| 10,000 U/ mL Penicillin/Streptomycin Mixture | Fisher Scientific | 15-140-122 | |
| 15 mL sterile conical tubes | MidSci | C15B | |
| 2 mL microcentrifuge tubes | Avant | AVSS2000 | |
| 50 mL sterile polypropylene conical tubes | Falcon | 352070 | |
| Aspirator | Corning | 4930 | |
| Biosafety Cabinets | Labconco | 30441010028343 | Three of these are used in the method: one for sterile tissue work, one for infected tissue work, and one for bacterial work. |
| Centrifuge | Sorvall | Legend RT | |
| Disposable inoculation loops | Fisherbrand | 22363605 | |
| Dulbecco's Modified Eagle Medium (DMEM) | Gibco | 11965-084 | |
| Epithelial Volt/Ohm Meter | World Precision Instruments | EVOM2 | |
| Fetal Bovine Serum | Fisher Scientific | 10437028 | |
| Ham's F-12 Nutrient Mixture | Gibco | 11765-047 | |
| Hemacytometer | Sigma Aldrich, Bright Line | Z359629 | |
| Incubator shaker | New Brunswick | Innova 4080 | |
| Incubators | Thermo Scientific | 51030284 | Three of these are used in the method: one for sterile tissue culturing, one for infected tissue culturing, and one for bacterial incubation. |
| Lysogeny broth | Difco | 244610 | |
| Lysogeny broth agar | IBI Scientific | IB49101 | |
| Nikon Eclipse TS2R Microscope | Nikon | ||
| Spectrophotometer | Unico | 1100RS | |
| T84 Intestinal Cells | American Tissue Culture Collection | CCL248 | |
| Tissue culture inserts, with polyethylene trephthalate membrane, 3 µm pores, 24 well format | Falcon | 353096 | |
| Tissue culture plate, 24 wells | Falcon | 353504 | |
| Trypan blue stain | Fisher Scientific | T10282 |
References
- Shakir, S. M., Goldbeck, J. M., Robison, D., Eckerd, A. M., Chavez-Bueno, S. Genotypic and phenotypic characterization of invasive neonatal Escherichia coli clinical isolates. American Journal of Perinatology. 31 (11), 975-982 (2014).
- Cole, B. K., et al. Route of infection alters virulence of neonatal septicemia Escherichia coli clinical isolates. PloS One. 12 (12), 0189032 (2017).
- Stoll, B. J., et al. Early-onset neonatal sepsis 2015 to 2017, the rise of Escherichia coli, and the need for novel prevention strategies. Journal of the American Medical Association Pediatrics. 174 (7), 200593 (2020).
- Dalgakiran, F., Witcomb, L. A., McCarthy, A. J., Birchenough, G. M., Taylor, P. W. Non-invasive model of neuropathogenic Escherichia coli infection in the neonatal rat. Journal of Visualized Experiments. (92), e52018 (2014).
- Williams, M., et al. Whole-genome sequencing-based phylogeny, antibiotic resistance, and invasive phenotype of Escherichia coli strains colonizing the cervix of women in preterm labor. BMC Microbiology. 21 (1), 330 (2021).
- Schoultz, I., Keita, &. #. 1. 9. 7. ;. The intestinal barrier and current techniques for the assessment of gut permeability. Cells. 9 (8), 1909 (2020).
- Devriese, S., et al. T84 monolayers are superior to Caco-2 as a model system of colonocytes. Histochemistry and Cell Biology. 148 (1), 85-93 (2017).
- Buckley, A., Turner, J. R. Cell biology of tight junction barrier regulation and mucosal disease. Cold Spring Harbor Perspectives in Biology. 10 (1), 029314 (2018).
- Awad, W. A., Hess, C., Hess, M. Enteric pathogens and their toxin-induced disruption of the intestinal barrier through alteration of tight junctions in chickens. Toxins. 9 (2), 60 (2017).
- Vancamelbeke, M., Vermeire, S. The intestinal barrier: A fundamental role in health and disease. Expert Review of Gastroenterology & Hepatology. 11 (9), 821-834 (2017).
- Aguilar, C., et al. Organoids as host models for infection biology - A review of methods. Experimental and Molecular Medicine. 53 (10), 1471-1482 (2021).
- Nickerson, K. P., et al. A versatile human intestinal organoid-derived epithelial monolayer model for the study of enteric pathogens. Microbiology Spectrum. 9 (1), 0000321 (2021).
- Gavin, H. E., Beubier, N. T., Satchell, K. J. The effector domain region of the Vibrio vulnificus MARTX toxin confers biphasic epithelial barrier disruption and is essential for systemic spread from the intestine. PLoS Pathogens. 13 (1), 1006119 (2017).
- Kobayashi, H., et al. Aeromonas sobria serine protease decreases epithelial barrier function in T84 cells and accelerates bacterial translocation across the T84 monolayer in vitro. PloS One. 14 (8), 0221344 (2019).
- Kalischuk, L. D., Inglis, G. D., Buret, A. G. Campylobacter jejuni induces transcellular translocation of commensal bacteria via lipid rafts. Gut Pathogens. 1 (1), 2 (2009).
- Cole, B. K., Ilikj, M., McCloskey, C. B., Chavez-Bueno, S. Antibiotic resistance and molecular characterization of bacteremia Escherichia coli isolates from newborns in the United States. PloS One. 14 (7), 0219352 (2019).
- Cadena-Herrera, D., et al. Validation of three viable-cell counting methods: Manual, semi-automated, and automated. Biotechnology Reports. 7, 9-16 (2015).
- den Hartog, G., et al. Apurinic/apyrimidinic endonuclease 1 restricts the internalization of bacteria into human intestinal epithelial cells through the inhibition of Rac1. Frontiers in Immunology. 11, 553994 (2020).
- Jett, B. D., Hatter, K. L., Huycke, M. M., Gilmore, M. S. Simplified agar plate method for quantifying viable bacteria. Biotechniques. 23 (4), 648-650 (1997).
- Lievin-Le Moal, V., Servin, A. L. Pathogenesis of human enterovirulent bacteria: Lessons from cultured, fully differentiated human colon cancer cell lines. Microbiology and Molecular Biology Reviews. 77 (3), 380-439 (2013).
- Kaczmarek, A., Budzynska, A., Gospodarek, E. Detection of K1 antigen of Escherichia coli rods isolated from pregnant women and neonates. Folia Microbiologica. 59 (5), 419-422 (2014).
- Kalita, A., Hu, J., Torres, A. G. Recent advances in adherence and invasion of pathogenic Escherichia coli. Current Opinion in Infectious Diseases. 27 (5), 459-464 (2014).
- McCool, D. J., Marcon, M. A., Forstner, J. F., Forstner, G. G. The T84 human colonic adenocarcinoma cell line produces mucin in culture and releases it in response to various secretagogues. Biochemical Journal. 267 (2), 491-500 (1990).
- Resta-Lenert, S., Barrett, K. E. Enteroinvasive bacteria alter barrier and transport properties of human intestinal epithelium: Role of iNOS and COX-2. Gastroenterology. 122 (4), 1070-1087 (2002).
- Elatrech, I., et al. Escherichia coli LF82 differentially regulates ROS production and mucin expression in intestinal epithelial T84 cells: Implication of NOX1. Inflammatory Bowel Diseases. 21 (5), 1018-1026 (2015).
- El-Aouar Filho, R. A., et al. Heterogeneous family of cyclomodulins: Smart weapons that allow bacteria to hijack the eukaryotic cell cycle and promote infections. Frontiers in Cellular and Infection Microbiology. 7, 208 (2017).
- Hopkins, A. M., Walsh, S. V., Verkade, P., Boquet, P., Nusrat, A. Constitutive activation of Rho proteins by CNF-1 influences tight junction structure and epithelial barrier function. Journal of Cell Science. 116, 725-742 (2003).
- Shiou, S. R., et al. Erythropoietin protects intestinal epithelial barrier function and lowers the incidence of experimental neonatal necrotizing enterocolitis. Journal of Biological Chemistry. 286 (14), 12123-12132 (2011).
- Newburg, D. S., Ko, J. S., Leone, S., Nanthakumar, N. N. Human milk oligosaccharides and synthetic galactosyloligosaccharides contain 3’-, 4-, and 6'-galactosyllactose and attenuate inflammation in human T84, NCM-460, and H4 cells and intestinal tissue ex vivo. Journal of Nutrition. 146 (2), 358-367 (2016).
- Burns, J. L., Griffith, A., Barry, J. J., Jonas, M., Chi, E. Y. Transcytosis of gastrointestinal epithelial cells by Escherichia coli K1. Pediatric Research. 49 (1), 30-37 (2001).
- Raut, B., Chen, L. J., Hori, T., Kaji, H. An open-source add-on EVOM((R)) device for real-time transepithelial/endothelial electrical resistance measurements in multiple transwell samples. Micromachines. 12 (3), 282 (2021).
- McCarthy, A. J., Stabler, R. A., Taylor, P. W. Genome-wide identification by transposon insertion sequencing of Escherichia coli K1 genes essential for in vitro growth, gastrointestinal colonizing capacity, and survival in serum. Journal of Bacteriology. 200 (7), 00698 (2018).
- Sayoc-Becerra, A., et al. The JAK-inhibitor tofacitinib rescues human intestinal epithelial cells and colonoids from cytokine-induced barrier dysfunction. Inflammatory Bowel Diseases. 26 (3), 407-422 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved