A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הערכה של טרנסציטוזה מעיים של חיידקי חיידקי חיידקי Escherichia coli ילודים
In This Article
Summary
Escherichia coli גורם אלח דם בילודים אשר בולעים את החיידקים סביב זמן הלידה. התהליך הכרוך ביכולתו של E. coli לנוע מהמערכת האנטרית לזרם הדם אינו מובן היטב. מודל זה במבחנה מעריך את יכולתם של זני E. coli לנוע דרך תאי אפיתל המעי.
Abstract
תינוקות בולעים זני E. coli אימהיים המאכלסים את מערכת העיכול שלהם סביב זמן הלידה. זני E. coli בעלי יכולת טרנסלוקציה על פני המעיים פולשים לזרם הדם של היילוד, וגורמים לחיידקים מסכני חיים. המתודולוגיה המוצגת כאן משתמשת בתאי אפיתל מעיים מקוטבים הגדלים על תוספות חצי-חדירות כדי להעריך את הטרנסציטוזה של חיידק E. coli מבודד במבחנה. שיטה זו משתמשת בקו תאי המעי T84 שהוקם שיש לו את היכולת לגדול למפגש וליצור צמתים הדוקים ודמוזומים. לאחר ההגעה למפגש, מונו-שכבות T84 בוגרות מפתחות התנגדות טרנס-אפיתליאלית (TEER), אותה ניתן לכמת באמצעות מד מתח. ערכי TEER נמצאים בקורלציה הפוכה עם החדירות העל-תאית של רכיבים חוץ-תאיים, כולל חיידקים, על-פני שכבת המעיים. המעבר הטרנס-תאי של חיידקים (טרנסציטוזה), לעומת זאת, אינו משנה בהכרח את מדידות ה- TEER. במודל זה, מעבר חיידקים על פני מונולאייר המעי מכמת עד 6 שעות לאחר ההדבקה, ומדידות חוזרות ונשנות של TEER נעשות כדי לנטר את החדירות הפרה-תאית. בנוסף, שיטה זו מקלה על השימוש בטכניקות כגון immunostaining כדי לחקור את השינויים המבניים בצמתים הדוקים וחלבוני הידבקות אחרים מתא לתא במהלך טרנסציטוזה חיידקית על פני אפיתל מקוטב. השימוש במודל זה תורם לאפיון המנגנונים שבאמצעותם E. coli transcytose ילודים על פני אפיתל המעי לייצר חיידקים.
Introduction
Escherichia coli הוא הגורם השכיח ביותר של אלח דם מוקדם בתינוקות 1,2,3. שיעור התמותה של חיידק E. coli ילודים יכול להגיע ל -40%, ודלקת קרום המוח היא סיבוך אפשרי הקשור לנכויות נוירו-התפתחותיות חמורות2. בליעה של זני E. coli אימהיים על ידי התינוק יכולה לייצר חיידק ילודים; תהליך זה שוכפל במודלים של בעלי חיים 2,4. לאחר בליעתם, חיידקים פתוגניים עוברים מלומן המעי היילודים על פני מחסום המעי ונכנסים לזרם הדם, מה שגורם לספטיצמיה. זני E. coli פולשניים המייצרים חיידקים שונים ביכולתם לפלוש לתאי אפיתל במעיים 1,5. עם זאת, היכולת שלהם transcytose אפיתל המעי לאחר הפלישה לא היה מאופיין לחלוטין.
מודל זה של טרנסציטוזה במעיים הוא שיטה שימושית במבחנה לחיקוי מעבר חיידקים על פני אפיתל המעי. המטרה הכוללת של השיטות המוצגות בכתב יד זה היא להשוות את היכולת של E. coli מבודד ילודים כדי transcytose אפיתל המעי. המודל המתואר כאן משתמש בתאי T84, שהם תאי אדנוקרצינומה של המעי האנושי 6,7. תאי T84 גדלים למפגש על קרום חצי-חדיר עם שני תאים נפרדים. הרציונל לשימוש בטכניקה זו הוא, כפי שקורה in vivo, תאי מעיים אלה מקטבים ומפתחים צמתים הדוקים בוגרים 6,8. הצד במגע עם הממברנה הופך לצד הבסיסי. הצד הנגדי של התאים הופך לצד האפי, הדומה לומן המעיים שבו פתוגנים שנבלעו נדבקים ופולשים. קרום הטרנסוול חדיר לחיידקים, אך תאי המעי המקוטבים יוצרים צמתים הדוקים, הפוגעים בתנועה העל-תאית של החיידקים9. לפיכך, שיטה זו מספקת את היתרון של סביבה מבוקרת במבחנה המשתמשת בקו תאים אנושי כדי לחקור את תהליך הטרנסציטוזה החיידקית, כולל המסלול הטרנס-תאי. בעוד שקיימות שיטות אחרות לחקור את הטרנסציטוזה של חיידקים על פני אפיתל המעי, שיטת הטרנסוול המוצגת כאן מספקת קלות ונגישות רבה יותר. קיימות טכניקות חלופיות, כגון אלה המשתמשות בדגימות ex vivo המוגדרות במערכות תא של Ussing. עם זאת, הם משתמשים בדגימות רקמה שעשויות שלא להיות נגישות בקלות, במיוחד אם המחקר מתכוון לחקור את הפיזיולוגיה האנושית10. אורגנואידים במעיים מייצגים דוגמה נוספת לחלופה חוץ-גופית לחקר אינטראקציות בין חיידקים מארחים11. בעוד שמונו-שכבות אורגנואידיות יכולות לשמש גם במערכת הטרנסוול כדי לחקור טרנסציטוזה חיידקית, הן דורשות בידוד וצמיחה של תאי גזע ושימוש בגורמי גדילה ספציפיים כדי לגרום להתמיינות12. לפיכך, השימוש בהם גוזל זמן רב יותר וכרוך בעלויות גבוהות יותר בהשוואה לשיטת טרנסוול המתוארת בכתב יד זה.
ההערכה של מעבר חיידקים על פני אפיתל המעי באמצעות מערכת זו in vitro transwell בוצעה בהצלחה עבור פתוגנים שונים. מחקרים אלה הראו את התועלת של מערכת טרנסוול המשתמשת בתאי T84 כדי לאפיין את הטרנסציטוזה של חיידקים על פני אפיתל המעי המקוטב13,14,15. עם זאת, היישום של שיטת טרנסוול זו להשוואת יכולת הטרנסציטוזה של זני E. coli המייצרים חיידקים לא תואר בפירוט. כתב יד זה מספק לחוקרים אחרים פרוטוקול טרנסוול סטנדרטי שהוא אמין וקל לשימוש ואינו דורש משאבים יקרים מדי.
כדי להשוות את היכולת של זני E. coli פולשניים ילודים לבצע טרנסציטוזה של אפיתל המעי, הצד האפי של שכבת האפיתל במעיים יכול להיות נגוע במספר ידוע של תאי חיידקים. לאחר הדגירה, ניתן לאסוף את המדיום בצד הבסיסי של האפיתל ולכמת את החיידקים כדי לקבוע את כמות הטרנסציטוזה החיידקית לאורך זמן. בכתב יד זה, השיטות המוצגות משמשות לחקר יכולת הטרנסציטוזה של זנים קליניים של E. coli ילודים שהחלימו מתינוקות המאושפזים עם חיידקים. קריטריוני ההכללה לבחירת מבודדים קליניים יילודים אלה למחקרי טרנסציטוזה פורסמו בעבר 1,2,16. כאשר שיטה זו מבוצעת באמצעות זנים שונים של E. coli, ניתן להשוות את יכולות הטרנסציטוזה שלהם. באמצעות תהליך זה, מודל transcytosis המעי מספק נתונים חשובים כדי לאפיין את גורמי virulence של E. coli התורמים לתהליך multistep שמגיע לשיאו בהתפתחות של חיידק ילודים.
Access restricted. Please log in or start a trial to view this content.
Protocol
הערה: בצע את כל המניפולציות של תאי T84, חיידקים, צלחות וריאגנטים בארון בטיחות Biosafety רמה 2 (BSL-2) כדי למנוע זיהום. השתמש באזורים נפרדים ובאינקובטורים לכל העבודה הכוללת תאי T84 סטריליים, תאי T84 נגועים ו- E. coli. מבודדי E. coli הקליניים שנבדקו בשיטות המתוארות כאן התקבלו בהתאם להנחיות מועצת הביקורת המוסדית במוסד שלנו 1,16.
1. הכנת תוספות טרנסציטוזה עם תאי T84 (כשבוע-שבועיים לפני הניסוי)
- גידול אוסף תרביות מסוג אמריקאי (ATCC) תאי T84 במדיום תרבית רקמה (TCM + אנטיביוטיקה) המורכב מתערובת החומרים המזינים F-12 של דולבקו: תערובת החומרים המזינים F-12 של Ham (1:1, ריכוז סופי: 50% כל אחד), סרום בקר עוברי ו-1% (100 U/mL) תערובת אנטיביוטית כפולה של פניצילין/סטרפטומיצין. לדגור על התאים ב 37 מעלות צלזיוס עם 5% CO2.
הערה: וריאציה של נוסחה בינונית זו ללא פניצילין/סטרפטומיצין (TCM w/o אנטיביוטיקה) משמשת לשלבים המאוחרים יותר (סעיף 2 ואילך) בהליך. ודא שנעשה שימוש בניסוח הנכון עבור כל שלב. - עבודה בתוך ארון בטיחות ביולוגית (BSC), זרע את תאי T84 לתוך פוליאתילן טרפתלט תרבית תא ממברנה טרנסוול מוסיף עם נקבוביות 3 מיקרומטר שנעשו עבור צלחות 24 באר. כלול משכפלים של תוסף טרנסוול עבור כל מצב ניסוי רצוי בתוספת פקדים לא נגועים כדי לנטר זיהום אפשרי.
- בצלחת של 24 בארות שנועדה להחזיק תוספות טרנסוול, מלאו את המספר הרצוי של בארות איסוף ב-1 מ"ל של TCM + אנטיביוטיקה.
- בכל באר, מניחים תוספת טרנסוול אחת.
- זרע תוספות אלה עם 1 x 105 T84 תאים תלויים ב 500 μL של TCM + אנטיביוטיקה. כמת את מספר התאים באמצעות המוציטומטר עם כתם כחול טריפאן או מונה תאים אוטומטי17.
- לדגור על צלחות טרנסוול המכילות תוספות זרעים באותם תנאים שבהם גדלו התאים.
- ודא במיקרוסקופיה קלה שהמונולרים החלו להתמזג לאחר זריעת התוספת, כ-48 שעות לאחר הזריעה.
- כל יומיים לאחר הזריעה, מדוד ורשום את ההתנגדות החשמלית הטרנס-אפיתליאלית (TEER) באמצעות מד וולט/אוהם אפיתל (EVOM) כדי להעריך את הבשלות של המונולייר. ברגע שהתוספות מגיעות ל-TEER של לפחות 1,000 Ω·ס"מ2, הן נחשבות מוכנות לבדיקה18.
הערה: לתוספות לוקח בדרך כלל 7-10 ימים להגיע ל- TEER זה לאחר הזריעה. תאי T84 יראו 100% מפגש תחת מיקרוסקופיית אור ברגע שתגיע להתנגדות זו.- אחסן את הגשושית EVOM כשהאלקטרודות שקועות ב-0.15 M KCl כאשר אינן בשימוש.
- לפני מדידת ה- TEER, נטרל את בדיקת האלקטרודה על ידי טבילתה ב- 5 מ"ל של 70% אתנול בצינור חרוטי של 50 מ"ל למשך 10-15 דקות. מסירים את הבדיקה, מנערים את עודפי האתנול ומניחים לה להתייבש באוויר בתוך ה-BSC למשך 10 דקות. שמור על צינור של אתנול.
- בדוק את EVOM ובדיקה על ידי הצבת הבדיקה היבשה המפורקת בבאר סטרילית המכילה 1 מ"ל של TCM + אנטיביוטיקה עם הכנסה סטרילית בפנים המכילה 500 μL של TCM + אנטיביוטיקה. ודא שקריאת EVOM היא <200 Ω. הקלט ערך ריק זה כדי להשתמש בו בחישובי ההתנגדות המאוחרים יותר המתוארים בשלב 1.3.6.
- הסר את הבדיקה מן הצינור של TCM + אנטיביוטיקה. שמור צינור זה לאחסון הגשושית לאורך כל הניסוי.
- הורידו בעדינות את הבדיקה לתוך התוספת הראשונה עם האלקטרודה הארוכה בבאר האיסוף והאלקטרודה הקצרה בתוך התוספת. אפשרו לאלקטרודה הארוכה לגעת היטב בתחתית האיסוף, אך אל תדחפו כלפי מטה מכיוון שהדבר עלול לשבש את מונולייר האפיתל.
- חזור על תהליך זה כדי למדוד ולהקליט את ההתנגדות ב- Ohms (Ω) עבור כל הוספה. בסיום, יש לפרק את הבדיקה באתנול על ידי טבילתה למשך 10-15 דקות נוספות. לאחר מכן, העבר את הבדיקה המפורקת בחזרה לפתרון KCl לאחסון. הפחת את ההתנגדות הריקה המתקבלת בשלב 1.3.3 מכל ערך המתקבל מכל הוספה המכילה תאי T84. הכפל את ההתנגדות המתקבלת (Ω) עבור כל תוספת באזור התחתון של כל תוספת (ס"מ 2) כדי לקבל את מדידת ה- TEER הסופית (Ω·cm2).
- ברגע שה-TEER מגיע לפחות ל-1,000 Ω·ס"מ2, המונו-שכבה האפיתליאלית בשלה ומוכנה למבחני זיהום.
- כאשר ה- TEER מתבגר, ספק לתאים מדיום טרי כל 1-2 ימים.
- בצלחת חדשה של 24 בארות, יש להוסיף 1 מ"ל של TCM + אנטיביוטיקה לבאר אחת עבור כל תוסף זרעים שמוכן.
- באמצעות מלקחיים סטריליים, בזהירות להעביר את התוספות לבארות שהתחדשו לאחרונה.
- החלף את המדיה בתוספות.
- הסר את המדיה הישנה מהתוספות על ידי הטיית הצלחת ושימוש בשואב אבק פנימי כדי להסיר בעדינות את המדיה עם קצה פיפטה לאורך צד התוספת. השואף מאפשר ויסות של יניקה ברמה נמוכה כדי למנוע את ההפרעה של התאים. אין לאפשר לקצה הפיפטה לגעת בתחתית התוספת, מכיוון שהדבר ישבש את המונולייר האפיתל המתפתח.
- הוסף 500 μL של TCM + אנטיביוטיקה לתוספות. דמיינו את המונולייר עם מיקרוסקופיית אור כדי לוודא שהוא נשאר שלם.
- כל 1-2 ימים, מדוד את ה- TEER בכל הוספה כמתואר לעיל בשלבים 1.3.2-1.3.6.
2. הכנת תאי T84 יום אחד לפני הניסוי באמצעות TCM עם אנטיביוטיקה
- מדוד ותעד את ה- TEER יום לפני הניסוי.
- החלף את ה- TCM באותו אופן כמו במהלך ההכנה והתחזוקה הקודמת של התא. עם זאת, TCM w / o אנטיביוטיקה משמש במקום זאת כהכנה לזיהום (1 מ"ל בצלחת היטב ו 500 μL להוסיף).
3. תרביות E. coli (התחיל יום אחד לפני הניסוי)
התראה: השתמש באמצעי זהירות ברמה 2 (BSL-2) בעת עבודה עם זני E. coli קליניים פתוגניים.
- קח צינור חרוטי מסומן של 15 מ"ל עם 5 מ"ל של ציר ליזוגני סטרילי (LB), והשתמש בלולאה סטרילית כדי לחסן את המרק במושבה אחת מזן חיידקים אחד (E. coli). חזור על תהליך זה, יצירת צינור תרבית אחד בן לילה עבור כל זן להיבדק.
- לדגום את תרבות הלילה, עם כובעי הצינורות משוחררים, בשייקר אינקובטור (250 סל"ד, 37 מעלות צלזיוס).
4. הכנת E. coli inoculum, תאי אפיתל וחומרים (בבוקר הניסוי)
הערה: יש להשתמש ב-TCM עם אנטיביוטיקה שחוממה עד 37 מעלות צלזיוס מנקודה זו ואילך.
- יש להוסיף 250 מיקרו-ליטר מכל תרבית LB למשך הלילה ל-25 מ"ל של TCM עם אנטיביוטיקה בצינור חרוטי של 50 מ"ל (אחד לכל זן בודד). שמור על הכובעים של הצינורות משוחררים. הניחו את צינורות התרבית החדשים האלה בשייקר באותן הגדרות (250 סל"ד, 37 מעלות צלזיוס) למשך שעתיים בדיוק. בצע את שלבי המשנה הנותרים בזמן ההמתנה.
- מדוד את ה- TEER בכל הוספה, כמתואר בשלבים 1.3.2-1.3.6. רשום אותם כ- TEERs בזמן (t) = 0 שעות.
- הזז את התוספות לבארות בלוח חדש, ושנה את המדיה באמצעות הטכניקה המתוארת בשלב 1.4.3. עם זאת, הפעם, למלא את בארות האיסוף החדש עם 500 μL של TCM w / o אנטיביוטיקה, ולמלא את התוספות עם 400 μL של TCM w / o אנטיביוטיקה. שמור את התוספות בתוך אינקובטור תרבית רקמה עד לזמן ההדבקה.
- קבעו מספר מספיק של לוחות אגר LB מרובעים כדי להתחמם לטמפרטורת החדר (RT) לציפוי מאוחר יותר ולכימות חיידקים.
5. חיסון התאים (תחילת הניסוי)
- לאחר שעתיים בדיוק, הסר את תרביות החיידקים של הבוקר מהשייקר, וצנטריפוגה אותן למשך 10 דקות (1,900 x גרם, 4 מעלות צלזיוס).
הערה: עבור כל השלבים הבאים, שמור את כל תרחיף החיידקים על הקרח כדי למזער את הצמיחה. - יש להשעות את גלולת החיידק ב-TCM באמצעות אנטיביוטיקה. השתמש בספקטרופוטומטר כדי להתאים את הצפיפות האופטית (OD) ל- 0.7-0.9, ולדלל עוד יותר עם TCM עם אנטיביוטיקה לריכוז של 1 x 106 יחידות יוצרות מושבה (CFU)/mL (בערך 1:100 דילול). השתמש בתרחיף חיידקי זה כדי להדביק כל תוסף עם 1 x 105 CFU לכל נפח של 100 μL.
- תייג את צלחת הטרנסוול, והדביק כל תוסף ב- 100 μL של ה- inoculum המותאם ל- OD (סה"כ 1 x 105 CFU לכל הוספה). כעת החלה הבדיקה. שים לב לשעה ורשום אותה כ- t = 0 שעות.
- צלחת את תרחיף חיידקי inoculum כדי לכמת את CFU / mL באמצעות שיטת דילול המסלול, ציפוי 10 μL aliquots על לוחות אגר LB מרובע19.
6. כימות טרנסציטוזה
- כל 30 דקות לאחר החיסון, מלאו בארות חדשות ב-500 μL של TCM עם אנטיביוטיקה. מעבירים את התוספות לבארות החדשות האלה באמצעות קבוצה שונה של מלקחיים סטריליים לכל זן חיידקים שונה.
- אסוף את המדיה מבאר האיסוף המשומשת עבור כל הכנסה לצינורות מסומנים נפרדים. הניחו את הצינורות האלה על קרח. החזירו את לוחות הטרנסוול לחממה בין נקודות זמן.
- עבור כל הוספה, שלב את המדיה שנאספה מ- t = 0.5 h, t = 1 h, t = 1.5 h, ו- t = 2 h, ומערבל לזמן קצר. צלחת את המדיה שנאספה על לוחות אגר LB באמצעות שיטת דילול המסלול כדי לכמת את כמות החיידקים שעברו טרנסציטוזה בשעתיים הראשונות של הניסוי.
הערה: אחזור החיידקים כל 30 דקות ושמירתם על הקרח מבטיחים שצמיחת החיידקים בבארות האיסוף תמוזער ותיעשה מדידות על חיידקים שעברו בעיקר טרנסציטוזה. - הניחו את לוחות ה-LB agar של דילול המסלול באינקובטור החיידקי בטמפרטורה של 37 מעלות צלזיוס ללא תוספת CO2, והחזירו את צלחת הטרנסוול T84 לחממה של תרביות הרקמה.
- ב- t = 4 h, חזור על שלב 6.3 על ידי שילוב המדיה שנאספה מ- t = 2.5 h, t = 3 h, t = 3.5 h, ו- t = 4 h.
- ב- t = 6 h, חזור על שלב 6.3 על ידי שילוב המדיה שנאספה מ- t= 4.5 h, t = 5 h, t = 5.5 h, ו- t = 6 h. בנוסף, ב t = 6 שעות, צלחת את המדיה מבארות הבקרה.
7. סוף הניסוי
- מדוד ורשום את ה- TEER בסוף הניסוי, t = 6 שעות. השתמש בהליך המתואר בשלבים 1.3.2-1.3.6.
- נטרל את הבדיקה על ידי טבילתה ב-70% אתנול למשך 10-15 דקות. בטל את התוספות, או שמור/עבד אותן עבור יישומים נוספים, אם תרצה בכך. אפשרו ללוחות האגר של LB לדגור למשך הלילה, ולחטא ו/או להשליך בבטחה את כל החומרים האחרים שנעשה בהם שימוש.
- לאחר דגירה של לילה, ספרו את מושבות החיידקים באופן ידני על לוחות LB של דילול המסלול כדי לקבוע את כמות האינוקולום ואת כמות E. coli transcytosis. ודא כי לוחות הבקרה אינם מראים כל צמיחה חיידקית.
Access restricted. Please log in or start a trial to view this content.
תוצאות
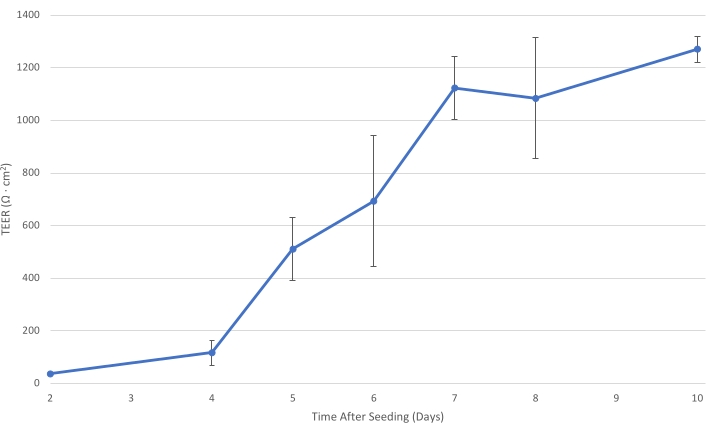
איור 1: T84 TEER לאורך זמן. ככל ששכבת התא T84 מתבגרת על התוספת, ההתנגדות החשמלית של המונולאייר גדלה. ב-TEER של לפחות 1,000 Ω·ס"מ2, שכבת התא מפותחת מספיק כדי להקטין את הובלת החיידקים העל-תאיים ולאפשר מד?...
Access restricted. Please log in or start a trial to view this content.
Discussion
שיטה זו נגזרת מטכניקות המשמשות בגסטרואנטרולוגיה ומחלות זיהומיות20. מודלים במבחנה של מחסום אפיתל המעי שימשו כדי להבהיר את המנגנונים שבאמצעותם התוכן הזוהר אינטראקציה עם מרכיב רלוונטי זה של חסינות מולדת 6,8. האינטראקציות בין המארח לפתוגן של <...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ללא.
Acknowledgements
עבודה זו נתמכה על ידי מענק סטודנטים של שרה מוריסון שהונפק על ידי בית הספר לרפואה של אוניברסיטת מיזורי-קנזס סיטי ל- A.I.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 10,000 U/ mL Penicillin/Streptomycin Mixture | Fisher Scientific | 15-140-122 | |
| 15 mL sterile conical tubes | MidSci | C15B | |
| 2 mL microcentrifuge tubes | Avant | AVSS2000 | |
| 50 mL sterile polypropylene conical tubes | Falcon | 352070 | |
| Aspirator | Corning | 4930 | |
| Biosafety Cabinets | Labconco | 30441010028343 | Three of these are used in the method: one for sterile tissue work, one for infected tissue work, and one for bacterial work. |
| Centrifuge | Sorvall | Legend RT | |
| Disposable inoculation loops | Fisherbrand | 22363605 | |
| Dulbecco's Modified Eagle Medium (DMEM) | Gibco | 11965-084 | |
| Epithelial Volt/Ohm Meter | World Precision Instruments | EVOM2 | |
| Fetal Bovine Serum | Fisher Scientific | 10437028 | |
| Ham's F-12 Nutrient Mixture | Gibco | 11765-047 | |
| Hemacytometer | Sigma Aldrich, Bright Line | Z359629 | |
| Incubator shaker | New Brunswick | Innova 4080 | |
| Incubators | Thermo Scientific | 51030284 | Three of these are used in the method: one for sterile tissue culturing, one for infected tissue culturing, and one for bacterial incubation. |
| Lysogeny broth | Difco | 244610 | |
| Lysogeny broth agar | IBI Scientific | IB49101 | |
| Nikon Eclipse TS2R Microscope | Nikon | ||
| Spectrophotometer | Unico | 1100RS | |
| T84 Intestinal Cells | American Tissue Culture Collection | CCL248 | |
| Tissue culture inserts, with polyethylene trephthalate membrane, 3 µm pores, 24 well format | Falcon | 353096 | |
| Tissue culture plate, 24 wells | Falcon | 353504 | |
| Trypan blue stain | Fisher Scientific | T10282 |
References
- Shakir, S. M., Goldbeck, J. M., Robison, D., Eckerd, A. M., Chavez-Bueno, S. Genotypic and phenotypic characterization of invasive neonatal Escherichia coli clinical isolates. American Journal of Perinatology. 31 (11), 975-982 (2014).
- Cole, B. K., et al. Route of infection alters virulence of neonatal septicemia Escherichia coli clinical isolates. PloS One. 12 (12), 0189032(2017).
- Stoll, B. J., et al. Early-onset neonatal sepsis 2015 to 2017, the rise of Escherichia coli, and the need for novel prevention strategies. Journal of the American Medical Association Pediatrics. 174 (7), 200593(2020).
- Dalgakiran, F., Witcomb, L. A., McCarthy, A. J., Birchenough, G. M., Taylor, P. W. Non-invasive model of neuropathogenic Escherichia coli infection in the neonatal rat. Journal of Visualized Experiments. (92), e52018(2014).
- Williams, M., et al. Whole-genome sequencing-based phylogeny, antibiotic resistance, and invasive phenotype of Escherichia coli strains colonizing the cervix of women in preterm labor. BMC Microbiology. 21 (1), 330(2021).
- Schoultz, I., Keita, Å The intestinal barrier and current techniques for the assessment of gut permeability. Cells. 9 (8), 1909(2020).
- Devriese, S., et al. T84 monolayers are superior to Caco-2 as a model system of colonocytes. Histochemistry and Cell Biology. 148 (1), 85-93 (2017).
- Buckley, A., Turner, J. R. Cell biology of tight junction barrier regulation and mucosal disease. Cold Spring Harbor Perspectives in Biology. 10 (1), 029314(2018).
- Awad, W. A., Hess, C., Hess, M. Enteric pathogens and their toxin-induced disruption of the intestinal barrier through alteration of tight junctions in chickens. Toxins. 9 (2), 60(2017).
- Vancamelbeke, M., Vermeire, S. The intestinal barrier: A fundamental role in health and disease. Expert Review of Gastroenterology & Hepatology. 11 (9), 821-834 (2017).
- Aguilar, C., et al. Organoids as host models for infection biology - A review of methods. Experimental and Molecular Medicine. 53 (10), 1471-1482 (2021).
- Nickerson, K. P., et al. A versatile human intestinal organoid-derived epithelial monolayer model for the study of enteric pathogens. Microbiology Spectrum. 9 (1), 0000321(2021).
- Gavin, H. E., Beubier, N. T., Satchell, K. J. The effector domain region of the Vibrio vulnificus MARTX toxin confers biphasic epithelial barrier disruption and is essential for systemic spread from the intestine. PLoS Pathogens. 13 (1), 1006119(2017).
- Kobayashi, H., et al. Aeromonas sobria serine protease decreases epithelial barrier function in T84 cells and accelerates bacterial translocation across the T84 monolayer in vitro. PloS One. 14 (8), 0221344(2019).
- Kalischuk, L. D., Inglis, G. D., Buret, A. G. Campylobacter jejuni induces transcellular translocation of commensal bacteria via lipid rafts. Gut Pathogens. 1 (1), 2(2009).
- Cole, B. K., Ilikj, M., McCloskey, C. B., Chavez-Bueno, S. Antibiotic resistance and molecular characterization of bacteremia Escherichia coli isolates from newborns in the United States. PloS One. 14 (7), 0219352(2019).
- Cadena-Herrera, D., et al. Validation of three viable-cell counting methods: Manual, semi-automated, and automated. Biotechnology Reports. 7, 9-16 (2015).
- den Hartog, G., et al. Apurinic/apyrimidinic endonuclease 1 restricts the internalization of bacteria into human intestinal epithelial cells through the inhibition of Rac1. Frontiers in Immunology. 11, 553994(2020).
- Jett, B. D., Hatter, K. L., Huycke, M. M., Gilmore, M. S. Simplified agar plate method for quantifying viable bacteria. Biotechniques. 23 (4), 648-650 (1997).
- Lievin-Le Moal, V., Servin, A. L. Pathogenesis of human enterovirulent bacteria: Lessons from cultured, fully differentiated human colon cancer cell lines. Microbiology and Molecular Biology Reviews. 77 (3), 380-439 (2013).
- Kaczmarek, A., Budzynska, A., Gospodarek, E. Detection of K1 antigen of Escherichia coli rods isolated from pregnant women and neonates. Folia Microbiologica. 59 (5), 419-422 (2014).
- Kalita, A., Hu, J., Torres, A. G. Recent advances in adherence and invasion of pathogenic Escherichia coli. Current Opinion in Infectious Diseases. 27 (5), 459-464 (2014).
- McCool, D. J., Marcon, M. A., Forstner, J. F., Forstner, G. G. The T84 human colonic adenocarcinoma cell line produces mucin in culture and releases it in response to various secretagogues. Biochemical Journal. 267 (2), 491-500 (1990).
- Resta-Lenert, S., Barrett, K. E. Enteroinvasive bacteria alter barrier and transport properties of human intestinal epithelium: Role of iNOS and COX-2. Gastroenterology. 122 (4), 1070-1087 (2002).
- Elatrech, I., et al. Escherichia coli LF82 differentially regulates ROS production and mucin expression in intestinal epithelial T84 cells: Implication of NOX1. Inflammatory Bowel Diseases. 21 (5), 1018-1026 (2015).
- El-Aouar Filho, R. A., et al. Heterogeneous family of cyclomodulins: Smart weapons that allow bacteria to hijack the eukaryotic cell cycle and promote infections. Frontiers in Cellular and Infection Microbiology. 7, 208(2017).
- Hopkins, A. M., Walsh, S. V., Verkade, P., Boquet, P., Nusrat, A. Constitutive activation of Rho proteins by CNF-1 influences tight junction structure and epithelial barrier function. Journal of Cell Science. 116, 725-742 (2003).
- Shiou, S. R., et al. Erythropoietin protects intestinal epithelial barrier function and lowers the incidence of experimental neonatal necrotizing enterocolitis. Journal of Biological Chemistry. 286 (14), 12123-12132 (2011).
- Newburg, D. S., Ko, J. S., Leone, S., Nanthakumar, N. N. Human milk oligosaccharides and synthetic galactosyloligosaccharides contain 3’-, 4-, and 6'-galactosyllactose and attenuate inflammation in human T84, NCM-460, and H4 cells and intestinal tissue ex vivo. Journal of Nutrition. 146 (2), 358-367 (2016).
- Burns, J. L., Griffith, A., Barry, J. J., Jonas, M., Chi, E. Y. Transcytosis of gastrointestinal epithelial cells by Escherichia coli K1. Pediatric Research. 49 (1), 30-37 (2001).
- Raut, B., Chen, L. J., Hori, T., Kaji, H. An open-source add-on EVOM((R)) device for real-time transepithelial/endothelial electrical resistance measurements in multiple transwell samples. Micromachines. 12 (3), 282(2021).
- McCarthy, A. J., Stabler, R. A., Taylor, P. W. Genome-wide identification by transposon insertion sequencing of Escherichia coli K1 genes essential for in vitro growth, gastrointestinal colonizing capacity, and survival in serum. Journal of Bacteriology. 200 (7), 00698(2018).
- Sayoc-Becerra, A., et al. The JAK-inhibitor tofacitinib rescues human intestinal epithelial cells and colonoids from cytokine-induced barrier dysfunction. Inflammatory Bowel Diseases. 26 (3), 407-422 (2020).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved