需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
新生儿 大肠杆菌 分离菌血症肠道转吞作用的评估
摘要
大肠杆菌在新生儿中引起败血症,这些新生儿在出生时摄入细菌。大肠杆菌从肠道到血流的能力所涉及的过程知之甚少。该体外模型评估了大肠杆菌菌株通过肠上皮细胞的能力。
摘要
新生儿摄入母体大肠杆菌菌株,这些菌株在分娩时定植在肠道中。具有跨肠道易位能力的大肠杆菌菌株侵入新生儿的血液,导致危及生命的菌血症。这里介绍的方法利用在半透性插入物上生长的极化肠上皮细胞来评估体外新生儿大肠杆菌菌血症分离株的转吞作用。该方法使用已建立的T84肠细胞系,该细胞系具有生长到汇合并形成紧密连接和桥粒的能力。达到汇合后,成熟的T84单层产生跨上皮电阻(TEER),可以使用电压表进行量化。TEER值与细胞外成分(包括细菌)在肠道单层中的细胞旁通透性呈负相关。另一方面,细菌的跨细胞传代(转胞作用)不一定会改变TEER测量。在该模型中,感染后长达6小时量化穿过肠道单层的细菌通道,并重复测量TEER以监测细胞旁通透性。此外,该方法有助于使用免疫染色等技术来研究极化上皮上皮细菌转吞过程中紧密连接和其他细胞间粘附蛋白的结构变化。该模型的使用有助于表征新生儿大肠杆菌转胞酶穿过肠上皮产生菌血症的机制。
引言
大肠杆菌是新生儿早发性败血症的最常见原因1,2,3。新生儿大肠杆菌菌血症的死亡率可达40%,脑膜炎是一种与严重神经发育障碍相关的可能并发症2。新生儿摄入母体大肠杆菌菌株可引起新生儿菌血症;这个过程已经在动物模型2,4中得到复制。一旦摄入,致病菌就会从新生儿肠腔穿过肠道屏障进入血液,引起败血症。产生菌血症的新生儿侵袭性大肠杆菌菌株侵入肠上皮细胞的能力各不相同1,5。然而,它们在侵袭后转胞上皮的能力尚未完全表征。
这种肠道转吞模型是一种有用的 体外 方法,可以模拟细菌通过肠上皮。本手稿中介绍的方法的总体目标是比较新生儿 大肠杆菌 分离株转胞肠上皮的能力。这里描述的模型利用T84细胞,它们是永生化的人肠腺癌细胞6,7。T84细胞生长到具有两个独立隔室的半透膜上汇合。使用这种技术的基本原理是,就像 在体内发生的那样,这些肠细胞极化并发展出成熟的紧密连接6,8。与膜接触的一侧成为基底侧。细胞的另一侧成为顶端侧,类似于摄入的病原体粘附和侵入的肠腔。跨孔膜对细菌具有渗透性,但极化的肠细胞形成紧密的连接,这会损害细菌的细胞旁运动9。因此,该方法提供了利用人细胞系研究细菌转吞作用过程(包括跨细胞途径)的受控 体外 环境的优点。虽然存在其他方法可以研究细菌在肠上皮的转吞作用,但此处介绍的跨孔方法提供了更大的便利性和可及性。可以使用替代技术,例如利用在Ussing室系统中设置的 离体 样品的技术。然而,他们利用可能不容易获得的组织标本,特别是如果研究打算研究人体生理学10。肠道类器官代表了研究宿主-细菌相互作用的 体外 替代方案的另一个例子11。虽然类器官单层也可用于跨孔系统以研究细菌转吞作用,但它们需要干细胞的分离和生长以及使用特定的生长因子来诱导分化12。因此,与本手稿中描述的Transwell方法相比,它们的使用更耗时,并且成本更高。
使用这种体外跨孔系统对细菌通过肠上皮的评估已成功针对各种病原体进行。这些研究表明,使用T84细胞的Transwell系统在极化肠上皮13,14,15上表征细菌的转吞作用的效用。然而,该转孔法在比较产菌血症新生儿大肠杆菌菌株的转吞能力中的应用尚未详细描述。这份手稿为其他研究人员提供了一个标准的Transwell方案,该方案可靠且易于使用,不需要过于昂贵的资源。
为了比较新生儿侵袭性大肠杆菌菌株转胞肠上皮的能力,肠上皮单层的顶端侧可以被已知数量的细菌细胞感染。孵育后,可以收集上皮基底侧的培养基并定量细菌以确定随时间推移的细菌转吞量。在本手稿中,所介绍的方法用于研究从因菌血症住院的新生儿中恢复的新生儿大肠杆菌临床菌株的转胞作用能力。选择这些新生儿临床分离株进行转胞作用研究的纳入标准已于先前发表1,2,16。当使用不同的大肠杆菌菌株进行该方法时,可以比较它们的转吞能力。通过这一过程,肠道转吞模型为表征大肠杆菌的毒力因子提供了有价值的数据,这些因子有助于导致新生儿菌血症发展的多步骤过程。
Access restricted. Please log in or start a trial to view this content.
研究方案
注意:在生物安全2级(BSL-2)安全柜中对T84细胞,细菌,平板和试剂进行所有操作,以避免污染。使用单独的区域和培养箱进行涉及无菌 T84 细胞、感染 T84 细胞和 大肠杆菌的所有工作。使用此处描述的方法测试的临床 大肠杆菌 分离株是根据我们机构1,16 的机构审查委员会的指南获得的。
1.用T84细胞制备转吞插入物(实验前约1-2周)
- 在由Dulbecco的改良鹰培养基:Ham的F-12营养混合物(1:1,最终浓度:每个50%),5%胎牛血清和1%(100 U / mL)青霉素/链霉素双重抗生素混合物组成的组织培养基(TCM +抗生素)中培养美国型培养物收藏(ATCC)T84细胞。将细胞在37°C与5%CO2孵育。
注意:不含青霉素/链霉素(不含抗生素的TCM)的这种培养基配方的变体用于该程序的后续步骤(第2节及以后)。确保每个步骤都使用正确的配方。 - 在生物安全柜(BSC)内工作,将T84细胞接种到聚对苯二甲酸乙二醇酯膜细胞培养物中,该插入物具有3μm孔,用于24孔板。包括每个所需实验条件的跨孔插入重复以及未感染的对照,以监测可能的污染。
- 在设计用于容纳Transwell插入物的24孔板中,用1 mL中药+抗生素填充所需数量的收集孔。
- 在每个孔中,放置一个跨孔插入物。
- 用悬浮在 500 μL TCM + 抗生素中的 1 x 105 T84 细胞接种这些插入物。使用台盼蓝染色的血细胞计数器或自动细胞计数器17量化细胞数量。
- 在与细胞生长相同的条件下孵育含有种子插入物的跨孔板。
- 用光学显微镜验证单层在接种插入物后约48小时开始汇合。
- 接种后每 2 天,使用上皮伏特/欧姆表 (EVOM) 测量并记录跨上皮电阻 (TEER) 以评估单层的成熟度。一旦插入物达到至少 1,000 Ω·cm2 的 TEER,它们就被认为已准备好进行测定18。
注意:播种后,插入物通常需要 7-10 天才能到达此 TEER。一旦达到该电阻,T84细胞将在光学显微镜下显示100%汇合。- 不使用时,将电极浸没在0.15 M KCl中的EVOM探头存放。
- 在测量TEER之前,通过将电极探针浸入50mL锥形管中的5mL 70%乙醇中10-15分钟来净化电极探针。取出探针,甩掉多余的乙醇,让它在平衡计分卡内风干10分钟。保留乙醇管。
- 通过将干燥的去污探针放入含有 1 mL 中药 + 抗生素的无菌孔中,并在内部装有 500 μL TCM + 抗生素的无菌插入物中来测试 EVOM 和探针。确保 EVOM 读数为 <200 Ω。记录此空白值,以便在步骤1.3.6中描述的后续电阻计算中使用它。
- 从中医+抗生素的管中取出探针。保留该管以在整个实验过程中储存探针。
- 轻轻地将探头放入第一个插入物中,长电极在收集孔中,短电极在插入物内。让长电极接触收集孔的底部,但不要向下推,因为这可能会破坏上皮单层。
- 重复此过程以测量并记录每个刀片的电阻(以欧姆 (Ω) 为单位)。完成后,通过将探针浸没在乙醇中再浸入10-15分钟来净化。然后,将去污的探头移回KCl溶液进行储存。从每个含有T84细胞的插入片段获得的每个值中减去步骤1.3.3中获得的空白电阻。将每个刀片的电阻 (Ω) 乘以每个刀片底部的面积 (cm 2),得到最终的 TEER 测量值 (Ω·cm2)。
- 一旦TEER达到至少1,000 Ω·cm2,上皮单层成熟并准备好进行感染测定。
- 随着TEER的成熟,每1-2天为细胞提供新鲜培养基。
- 在新的 24 孔板中,为制备的每个种子插入物向一个孔中加入 1 mL 中药 + 抗生素。
- 使用无菌镊子,小心地将插入物转移到新补充的孔中。
- 更换插入件中的介质。
- 通过倾斜板并使用内部真空吸气器沿着插入物侧面用移液器尖端轻轻取出介质,从插入物中取出旧介质。吸气器允许调节低水平吸力以防止细胞破裂。不要让移液器吸头接触插入物的底部,因为这会破坏发育中的上皮单层。
- 在插入物中加入 500 μL 中药 + 抗生素。用光学显微镜观察单层以验证其是否完好无损。
- 每 1-2 天,按照上述步骤 1.3.2-1.3.6 中所述测量每个插入物的 TEER。
2.在实验前1天使用不含抗生素的中药制备T84细胞
- 在实验前一天测量并记录TEER。
- 以与先前细胞制备和维护期间相同的方式更换TCM。然而,不使用抗生素的中药代替用于准备感染(板孔中 1 mL,插入物中 500 μL)。
3. 大肠杆菌 培养(实验前1天开始)
注意:使用致病性临床 大肠杆菌 菌株时,请使用生物安全2级(BSL-2)预防措施。
- 取带有 5 mL 无菌溶原肉汤 (LB) 的标记 15 mL 锥形管,并使用无菌环用一种细菌菌株 (大肠杆菌) 的一个菌落接种肉汤。重复此过程,为每种要测试的菌株创建一个过夜培养管。
- 在培养箱振荡器(250rpm,37°C)中孵育过夜培养物,使管盖松开。
4.准备 大肠杆菌 接种物,上皮细胞和材料(实验当天上午)
注意:使用不含抗生素的中药,从此时起升温至37°C。
- 将每个过夜LB培养物中的250 μL加入50 mL锥形管中的25 mL不含抗生素的中药中(每个菌株一个)。保持管子的盖子松开。将这些新的培养管以相同的设置(250rpm,37°C)放入振荡器中整整2小时。在等待时执行其余子步骤。
- 测量每个插件的TEER,如步骤1.3.2-1.3.6中所述。将这些记录为时间 (t) = 0 小时的 TEER。
- 将插入物移动到新板中的孔中,并使用步骤1.4.3中描述的技术更换培养基。然而,这一次,用 500 μL 不含抗生素的中药填充新的收集孔,并用 400 μL 不含抗生素的中药填充插入物。将插入物保持在组织培养箱内,直到感染。
- 放置足够数量的方形LB琼脂平板,加热至室温(RT),以便以后进行铺板和细菌定量。
5.接种细胞(实验开始)
- 正好2小时后,从摇床中取出早晨的细菌培养物,并离心10分钟(1,900× g,4°C)。
注意:对于以下所有步骤,请将所有细菌悬浮液保持在冰上以尽量减少生长。 - 将细菌沉淀重悬于不含抗生素的中药中。使用分光光度计将光密度(OD)调节至0.7-0.9,并用不含抗生素的TCM进一步稀释至1 x 106 菌落形成单位(CFU)/mL的浓度(约1:100稀释)。使用该细菌悬浮液每 100 μL 体积用 1 x 105 CFU 感染每个插入物。
- 标记Transwell板,并用100μLOD调节接种物感染每个插入物(每个插入物总共1 x 105 CFU)。该测定现已开始。记下时间,并将其记录为 t = 0 h。
- 使用跟踪稀释法接种细菌悬浮液以定量 CFU/mL,将 10 μL 等分试样接种在方形 LB 琼脂平板19 上。
6. 量化转吞作用
- 接种后每 30 分钟,用 500 μL 不含抗生素的中药填充新孔。使用一组不同的无菌镊子将插入物转移到这些新孔中,用于每种不同的细菌菌株。
- 将每个插入物的用过的收集孔中的培养基收集到单独的标记管中。将这些管子放在冰上。在时间点之间将Transwell板返回培养箱。
- 对于每个插入片段,合并收集的培养基从t = 0.5小时,t = 1小时,t = 1.5小时和t = 2小时,并短暂涡旋。使用跟踪稀释方法将收集的培养基接种在LB琼脂平板上,以量化实验前2小时内转核的细菌量。
注意:每30分钟取回细菌并将其保存在冰上可确保收集孔中的细菌生长最小化,并对主要转胞细菌进行测量。 - 将标记的跟踪稀释LB琼脂平板置于37°C的细菌培养箱中,无需补充CO2,并将T84跨孔板返回组织培养箱。
- 在t = 4小时时,通过合并t = 2.5小时,t = 3小时,t = 3.5小时和t = 4小时的收集培养基来重复步骤6.3。
- 在t = 6小时时,通过合并t = 4.5小时,t = 5小时,t = 5.5小时和t = 6小时的收集培养基来重复步骤6.3。此外,在t = 6小时时,从对照孔中铺板培养基。
7. 实验结束
- 在实验结束时测量并记录TEER,t = 6小时。使用步骤 1.3.2-1.3.6 中所述的过程。
- 通过将探针浸入70%乙醇中10-15分钟来净化探针。如果需要,丢弃刀片,或保存/处理它们以用于其他应用。让LB琼脂平板孵育过夜,并对所有其他使用过的材料进行消毒和/或安全处理。
- 孵育过夜后,在跟踪稀释LB平板上手动计数细菌菌落,以确定接种量和 大肠杆菌 转吞量。确保对照板没有显示任何细菌生长。
Access restricted. Please log in or start a trial to view this content.
结果
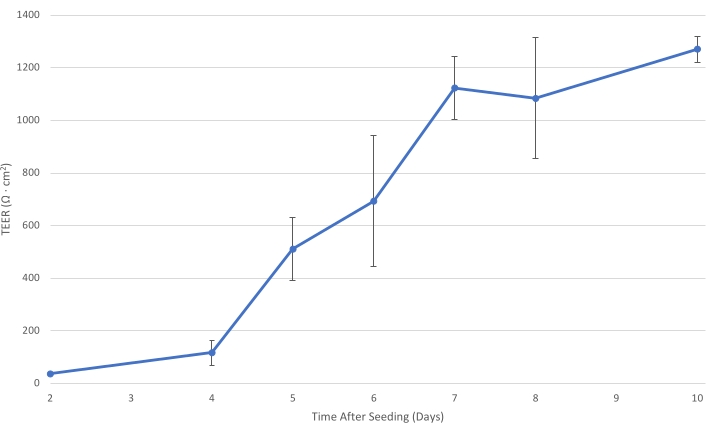
图 1:T84 TEER 随时间的变化。 随着插入物上的T84细胞层成熟,单层的电阻增加。在TEER至少为1,000 Ω·cm2时,细胞层充分发育以减少细胞旁细菌运输并允许测量主要跨细胞细菌运输。误差线表示标准偏差。
Access restricted. Please log in or start a trial to view this content.
讨论
该方法源自胃肠病学和传染病中使用的技术20。肠上皮屏障的体外模型已被用于阐明管腔内容物与先天免疫的这一相关成分相互作用的机制6,8。侵袭性新生儿大肠杆菌的宿主-病原体相互作用也通过遗传分析、抗菌素耐药性和免疫技术进行了单独表征1,5,16
Access restricted. Please log in or start a trial to view this content.
披露声明
没有。
致谢
这项工作得到了密苏里大学堪萨斯城医学院向人工智能发放的莎拉·莫里森学生补助金的支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 10,000 U/ mL Penicillin/Streptomycin Mixture | Fisher Scientific | 15-140-122 | |
| 15 mL sterile conical tubes | MidSci | C15B | |
| 2 mL microcentrifuge tubes | Avant | AVSS2000 | |
| 50 mL sterile polypropylene conical tubes | Falcon | 352070 | |
| Aspirator | Corning | 4930 | |
| Biosafety Cabinets | Labconco | 30441010028343 | Three of these are used in the method: one for sterile tissue work, one for infected tissue work, and one for bacterial work. |
| Centrifuge | Sorvall | Legend RT | |
| Disposable inoculation loops | Fisherbrand | 22363605 | |
| Dulbecco's Modified Eagle Medium (DMEM) | Gibco | 11965-084 | |
| Epithelial Volt/Ohm Meter | World Precision Instruments | EVOM2 | |
| Fetal Bovine Serum | Fisher Scientific | 10437028 | |
| Ham's F-12 Nutrient Mixture | Gibco | 11765-047 | |
| Hemacytometer | Sigma Aldrich, Bright Line | Z359629 | |
| Incubator shaker | New Brunswick | Innova 4080 | |
| Incubators | Thermo Scientific | 51030284 | Three of these are used in the method: one for sterile tissue culturing, one for infected tissue culturing, and one for bacterial incubation. |
| Lysogeny broth | Difco | 244610 | |
| Lysogeny broth agar | IBI Scientific | IB49101 | |
| Nikon Eclipse TS2R Microscope | Nikon | ||
| Spectrophotometer | Unico | 1100RS | |
| T84 Intestinal Cells | American Tissue Culture Collection | CCL248 | |
| Tissue culture inserts, with polyethylene trephthalate membrane, 3 µm pores, 24 well format | Falcon | 353096 | |
| Tissue culture plate, 24 wells | Falcon | 353504 | |
| Trypan blue stain | Fisher Scientific | T10282 |
参考文献
- Shakir, S. M., Goldbeck, J. M., Robison, D., Eckerd, A. M., Chavez-Bueno, S. Genotypic and phenotypic characterization of invasive neonatal Escherichia coli clinical isolates. American Journal of Perinatology. 31 (11), 975-982 (2014).
- Cole, B. K., et al. Route of infection alters virulence of neonatal septicemia Escherichia coli clinical isolates. PloS One. 12 (12), 0189032(2017).
- Stoll, B. J., et al. Early-onset neonatal sepsis 2015 to 2017, the rise of Escherichia coli, and the need for novel prevention strategies. Journal of the American Medical Association Pediatrics. 174 (7), 200593(2020).
- Dalgakiran, F., Witcomb, L. A., McCarthy, A. J., Birchenough, G. M., Taylor, P. W. Non-invasive model of neuropathogenic Escherichia coli infection in the neonatal rat. Journal of Visualized Experiments. (92), e52018(2014).
- Williams, M., et al. Whole-genome sequencing-based phylogeny, antibiotic resistance, and invasive phenotype of Escherichia coli strains colonizing the cervix of women in preterm labor. BMC Microbiology. 21 (1), 330(2021).
- Schoultz, I., Keita, Å The intestinal barrier and current techniques for the assessment of gut permeability. Cells. 9 (8), 1909(2020).
- Devriese, S., et al. T84 monolayers are superior to Caco-2 as a model system of colonocytes. Histochemistry and Cell Biology. 148 (1), 85-93 (2017).
- Buckley, A., Turner, J. R. Cell biology of tight junction barrier regulation and mucosal disease. Cold Spring Harbor Perspectives in Biology. 10 (1), 029314(2018).
- Awad, W. A., Hess, C., Hess, M. Enteric pathogens and their toxin-induced disruption of the intestinal barrier through alteration of tight junctions in chickens. Toxins. 9 (2), 60(2017).
- Vancamelbeke, M., Vermeire, S. The intestinal barrier: A fundamental role in health and disease. Expert Review of Gastroenterology & Hepatology. 11 (9), 821-834 (2017).
- Aguilar, C., et al. Organoids as host models for infection biology - A review of methods. Experimental and Molecular Medicine. 53 (10), 1471-1482 (2021).
- Nickerson, K. P., et al. A versatile human intestinal organoid-derived epithelial monolayer model for the study of enteric pathogens. Microbiology Spectrum. 9 (1), 0000321(2021).
- Gavin, H. E., Beubier, N. T., Satchell, K. J. The effector domain region of the Vibrio vulnificus MARTX toxin confers biphasic epithelial barrier disruption and is essential for systemic spread from the intestine. PLoS Pathogens. 13 (1), 1006119(2017).
- Kobayashi, H., et al. Aeromonas sobria serine protease decreases epithelial barrier function in T84 cells and accelerates bacterial translocation across the T84 monolayer in vitro. PloS One. 14 (8), 0221344(2019).
- Kalischuk, L. D., Inglis, G. D., Buret, A. G. Campylobacter jejuni induces transcellular translocation of commensal bacteria via lipid rafts. Gut Pathogens. 1 (1), 2(2009).
- Cole, B. K., Ilikj, M., McCloskey, C. B., Chavez-Bueno, S. Antibiotic resistance and molecular characterization of bacteremia Escherichia coli isolates from newborns in the United States. PloS One. 14 (7), 0219352(2019).
- Cadena-Herrera, D., et al. Validation of three viable-cell counting methods: Manual, semi-automated, and automated. Biotechnology Reports. 7, 9-16 (2015).
- den Hartog, G., et al. Apurinic/apyrimidinic endonuclease 1 restricts the internalization of bacteria into human intestinal epithelial cells through the inhibition of Rac1. Frontiers in Immunology. 11, 553994(2020).
- Jett, B. D., Hatter, K. L., Huycke, M. M., Gilmore, M. S. Simplified agar plate method for quantifying viable bacteria. Biotechniques. 23 (4), 648-650 (1997).
- Lievin-Le Moal, V., Servin, A. L. Pathogenesis of human enterovirulent bacteria: Lessons from cultured, fully differentiated human colon cancer cell lines. Microbiology and Molecular Biology Reviews. 77 (3), 380-439 (2013).
- Kaczmarek, A., Budzynska, A., Gospodarek, E. Detection of K1 antigen of Escherichia coli rods isolated from pregnant women and neonates. Folia Microbiologica. 59 (5), 419-422 (2014).
- Kalita, A., Hu, J., Torres, A. G. Recent advances in adherence and invasion of pathogenic Escherichia coli. Current Opinion in Infectious Diseases. 27 (5), 459-464 (2014).
- McCool, D. J., Marcon, M. A., Forstner, J. F., Forstner, G. G. The T84 human colonic adenocarcinoma cell line produces mucin in culture and releases it in response to various secretagogues. Biochemical Journal. 267 (2), 491-500 (1990).
- Resta-Lenert, S., Barrett, K. E. Enteroinvasive bacteria alter barrier and transport properties of human intestinal epithelium: Role of iNOS and COX-2. Gastroenterology. 122 (4), 1070-1087 (2002).
- Elatrech, I., et al. Escherichia coli LF82 differentially regulates ROS production and mucin expression in intestinal epithelial T84 cells: Implication of NOX1. Inflammatory Bowel Diseases. 21 (5), 1018-1026 (2015).
- El-Aouar Filho, R. A., et al. Heterogeneous family of cyclomodulins: Smart weapons that allow bacteria to hijack the eukaryotic cell cycle and promote infections. Frontiers in Cellular and Infection Microbiology. 7, 208(2017).
- Hopkins, A. M., Walsh, S. V., Verkade, P., Boquet, P., Nusrat, A. Constitutive activation of Rho proteins by CNF-1 influences tight junction structure and epithelial barrier function. Journal of Cell Science. 116, 725-742 (2003).
- Shiou, S. R., et al. Erythropoietin protects intestinal epithelial barrier function and lowers the incidence of experimental neonatal necrotizing enterocolitis. Journal of Biological Chemistry. 286 (14), 12123-12132 (2011).
- Newburg, D. S., Ko, J. S., Leone, S., Nanthakumar, N. N. Human milk oligosaccharides and synthetic galactosyloligosaccharides contain 3’-, 4-, and 6'-galactosyllactose and attenuate inflammation in human T84, NCM-460, and H4 cells and intestinal tissue ex vivo. Journal of Nutrition. 146 (2), 358-367 (2016).
- Burns, J. L., Griffith, A., Barry, J. J., Jonas, M., Chi, E. Y. Transcytosis of gastrointestinal epithelial cells by Escherichia coli K1. Pediatric Research. 49 (1), 30-37 (2001).
- Raut, B., Chen, L. J., Hori, T., Kaji, H. An open-source add-on EVOM((R)) device for real-time transepithelial/endothelial electrical resistance measurements in multiple transwell samples. Micromachines. 12 (3), 282(2021).
- McCarthy, A. J., Stabler, R. A., Taylor, P. W. Genome-wide identification by transposon insertion sequencing of Escherichia coli K1 genes essential for in vitro growth, gastrointestinal colonizing capacity, and survival in serum. Journal of Bacteriology. 200 (7), 00698(2018).
- Sayoc-Becerra, A., et al. The JAK-inhibitor tofacitinib rescues human intestinal epithelial cells and colonoids from cytokine-induced barrier dysfunction. Inflammatory Bowel Diseases. 26 (3), 407-422 (2020).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。